化学核外电子排布
高中化学知识点:原子结构核外电子排布
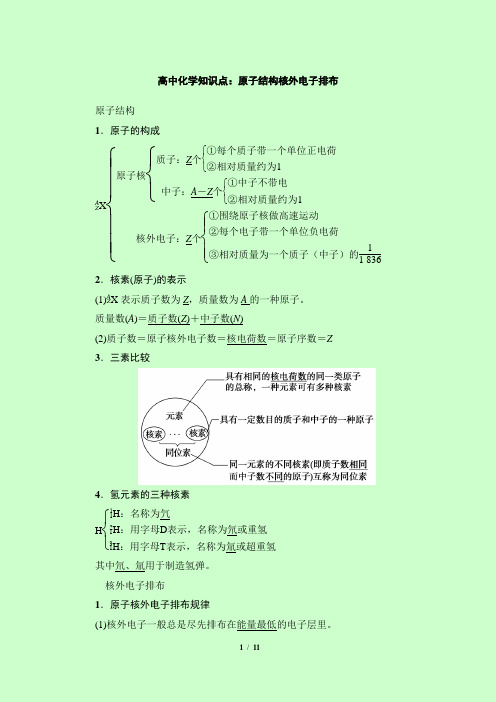
高中化学知识点:原子结构核外电子排布原子结构1.原子的构成A Z X ⎩⎪⎪⎨⎪⎪⎧原子核⎩⎨⎧质子:Z 个⎩⎨⎧①每个质子带一个单位正电荷②相对质量约为1中子:A -Z 个⎩⎨⎧①中子不带电②相对质量约为1核外电子:Z 个⎩⎪⎨⎪⎧①围绕原子核做高速运动②每个电子带一个单位负电荷③相对质量为一个质子(中子)的11 836 2.核素(原子)的表示(1)A Z X 表示质子数为Z ,质量数为A 的一种原子。
质量数(A )=质子数(Z )+中子数(N )(2)质子数=原子核外电子数=核电荷数=原子序数=Z3.三素比较4.氢元素的三种核素H ⎩⎨⎧11H :名称为氕21H :用字母D 表示,名称为氘或重氢31H :用字母T 表示,名称为氚或超重氢其中氘、氚用于制造氢弹。
核外电子排布1.原子核外电子排布规律(1)核外电子一般总是尽先排布在能量最低的电子层里。
(2)每个电子层最多容纳的电子数为2n2个。
①最外层最多容纳电子数不超过8个(K层为最外层时不超过2个)。
②次外层最多容纳的电子数不超过18个,倒数第三层不超过32个。
2.原子核外电子层排布的表示方法——原子或离子结构示意图下面为钠的原子结构示意图:1.易误诊断(正确的打“√”,错误的打“×”)。
(1)核素原子一定含有质子和中子()(2)任何粒子的质子数等于电子数()(3)中子数不同而质子数相同的粒子一定是同种元素的不同核素()(4)11H+、21H+和31H+互称为同位素()(5)S2-的结构示意图为()(6)K与K+的质子数相同而核外电子数不同()(7)质子数大于核外电子数的粒子一定为阳离子()(8)同元素的不同核素其化学性质几乎完全相同()【答案】(1)×(2)×(3)×(4)×(5)×(6)√(7)√(8)√2.(1)18O中的质子数为________,中子数为________。
(2)131 53I中的中子数与质子数之差为________。
核外电子排布规律总结

核外电子排布规律总结1.周期性表现:元素的核外电子排布呈现周期性的特征,即每个周期(横行)中,核外电子的数量增加一格,直到达到最大值,然后重新从一开始增加。
这是因为每个周期都对应着一个新的能级,新的能级能够容纳更多的电子。
例如,第一周期(1s^2)能容纳的电子数最多为2个,第二周期(2s^2,2p^6)能容纳的电子数最多为8个,以此类推。
2.塞满次能级原理:每个次能级(能级中的电子轨道)先填满一个自旋相同的电子,然后再填入反自旋相反的电子。
这是因为同一次能级中的电子具有相同的能量,自旋相同的电子之间存在排斥,而反自旋的电子则可以共存。
例如,2s轨道中的两个电子的自旋相同,而2p轨道中的六个电子的自旋相反。
3.近核电子屏蔽原理:近核电子对核外电子的吸引力比较大,能够屏蔽核外电子与核之间的排斥作用。
因此,核外电子的有效吸引力与核电荷数并不完全成正比,而是受到近核电子屏蔽的影响。
例如,对于周期表中的同一周期来说,核外电子数量相同,但随着核电荷数的增加,核外电子的有效吸引力减小。
4.具体的元素周期表规律:根据元素周期表中的周期和族(纵列),我们可以总结出一些具体的规律。
例如,周期表中第一周期的元素(氢和氦)只有一个能级(1s),且最多只能容纳两个电子;第二周期的元素(锂、铍、硼、碳、氮、氧、氟、氖)具有两个能级(2s和2p),且最多只能容纳八个电子;第三周期的元素(钠、镁、铝、硅、磷、硫、氯、氩)具有三个能级(3s、3p和3d),且最多只能容纳十八个电子,以此类推。
此外,同一族的元素具有相似的核外电子排布,因为它们具有相似的化学性质。
5.化合价与核外电子数:化合价是元素的一个重要的化学性质,它与元素的核外电子数密切相关。
一般来说,阳离子的化合价等于核外电子数减去气体电子层(最高能级)的电子数,而阴离子的化合价等于气体电子层的电子数减去核外电子数。
这是因为阳离子通过失去核外电子来形成稳定的结构,而阴离子通过获得核外电子来形成稳定的结构。
原子核外电子的排布

2.根据下列各组元素的原子结构示意图分析,
具有相似化学性质的一组是( A )
由于金属、非金属的原子最外层电 子都没有达到相对稳定结构,在化学反 应中容易得、失电子,从而达到相对 稳定结构。那么,得失电子的结果是怎 样的呢?形成的粒子又是什么呢?
二. 离子
钠和氯的原子结构示意图
+11 2 8 1
3.非金属元素的原子最外层电子数一般 ≥ 4 ,在化学反 应中,容易 得到 电子,化学性质 不稳定 。
元素的化学性质主要由原子的 最外层电子数 决定的。
【练习2】1.下列原子的结构示意图中,化学性
质最稳定的是 B ,易失去电子的是 C , 易得到电子的是 AD,属于金属元素的是_C__, 属于非金属元素的是__A__D__,属于稀有气体元 素的是____B_____。
练习
某原子的原子结构示意图为
,该原
子的核电荷数为 ,核外有 个电子层,第
二层上有 个电子,最外电子层上有 个电
子。
【亲手尝试】根据氧原子的结构图画出结构示意图
第一层(2个) 第二层(6个)
(最外层)
+8 2 6
3. 核外电子的排布规律:
⑴第一层最多容纳__2_个电子,第二层最多容纳__8_个电子。 (2)最外层不超过 8 个电子,只有1层的不超过__2_个电子。 ⑶电子先排满第__1_层,再排第__2_层,排满第__2_层,再 排第_3__层。(按照能量由低到高的顺序分层排布)
【讨论与分析】金属元素与非金属元素原子的最 外层电子数分别有什么特点?在化学反应中,为 了达到相对稳定结构,它们得失电子的情况是怎 么的?请举例说明。
最外层电子数 ﹤4
易失电子 不稳定
最外层电子 ≥ 4
高中化学原子核外电子排布

高中化学原子核外电子排布原子的组成由原子核和电子构成。
原子核位于原子的中心,由质子和中子组成。
而原子核外围则存在着一定数量的电子。
这些外电子的排布方式对于原子的性质和化学反应具有重要影响。
本文将介绍高中化学中原子核外电子的排布规律及其相关知识。
1. 电子排布的原则每个原子的电子排布遵循一定的规律和原则。
其中最为重要的是以下三个原则:1.1. 伯利兹定则伯利兹定则(Bau rule)表明,电子从低能量轨道开始填充。
这意味着在填满外电子壳层时,首先填充内层能量较低的轨道,然后逐渐填满能量较高的轨道。
简单来说,电子排布的顺序是由内向外进行。
1.2. 阿尔尼奥定则阿尔尼奥定则(Aufbau rule)指出,电子填充各能级轨道时,要优先填充能量最低的轨道。
在每个能级轨道中,需要先填满低能量的子能级,然后再填充高能量的子能级。
这样可以保证整个原子结构的稳定性。
1.3. 保里排除原理保里排除原理(Pauli exclusion principle)规定,每个轨道最多只能容纳两个电子,并且这两个电子的自旋要相反。
也就是说,同一个轨道上的两个电子必须具有相反的自旋角动量。
2. 原子核外电子层和子层原子核外的电子都存在于各种能级的轨道中。
高中化学通常会涉及到以下几个电子层和子层:2.1. 电子层电子层是指位于原子核外部的能级,用字母表示(K、L、M、N、O、P、Q)。
K层最接近原子核,能量最低,因此分布的电子最少。
随着电子层数的增加,能量逐渐升高,电子数也逐渐增多。
2.2. 子层子层是电子层内部的能级,用字母和数字表示(s、p、d、f、g、h)。
s子层能量最低,容纳电子数最少;p子层次之;d子层再次增加;f子层电子数最多。
3. 原子核外电子排布的案例分析以下是几种常见原子核外电子排布的案例分析:3.1. 氢原子(H)氢原子只有一个质子和一个电子,根据伯利兹定则和阿尔尼奥定则,电子会填充能量最低的1s轨道。
3.2. 氦原子(He)氦原子有两个质子和两个中子,根据伯利兹定则和阿尔尼奥定则,前两个电子会填充1s轨道。
1到36号元素核外电子排布式

1到36号元素核外电子排布式:1、H氢:1s12、He氦:1s23、Li锂:1s2 2s14、Be铍:1s2 2s25、B硼:1s2 2s2 2p17、N氮:1s2 2s2 2p38、O氧:1s2 2s2 2p49、F氟:1s2 2s2 2p510、Ne氖:1s2 2s2 2p611、Na钠:1s2 2s2 2p6 3s112、Mg镁:1s2 2s2 2p6 3s213、Al铝:1s2 2s2 2p6 3s2 3p114、Si硅:1s2 2s2 2p6 3s2 3p215、P磷:1s2 2s2 2p6 3s2 3p316、S硫:1s2 2s2 2p6 3s2 3p417、Cl氯:1s2 2s2 2p6 3s2 3p518、Ar氩:1s2 2s2 2p6 3s2 3p619、K钾:1s2 2s2 2p6 3s2 3p6 4s120、Ca钙:1s2 2s2 2p6 3s2 3p6 4s221、Sc钪:1s2 2s2 2p6 3s2 3p6 3d1 4s222、Ti钛:1s2 2s2 2p6 3s2 3p6 3d2 4s223、V 钒:1s2 2s2 2p6 3s2 3p6 3d3 4s224、Cr铬:1s2 2s2 2p6 3s2 3p6 3d5 4s125、Mn锰:1s2 2s2 2p6 3s2 3p6 3d5 4s226、Fe铁:1s2 2s2 2p6 3s2 3p6 3d6 4s227、Co钴:1s2 2s2 2p6 3s2 3p6 3d7 4s228、Ni镍:1s2 2s2 2p6 3s2 3p6 3d8 4s229、Cu铜:1s2 2s2 2p6 3s2 3p6 3d10 4s130、Zn锌:1s2 2s2 2p6 3s2 3p6 3d10 4s231、Ga镓:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p132、Ge锗:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p233、As砷:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p334、Se硒:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p425、Br溴:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p536、Kr氪:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6电子排布的规则1、构筑原理整个体系的能量越低越好。
初三化学核外电子排布

核外电子排布的知识包括3方面内容
1. 核外电子具有的能量不同,是按能量高 低分层排布的。
电子层数、离核距离、能量高低之关系如下所示:
电子层 1 2 3 4 5 6 7
(K)(L)(M)(N)(O)(P)(Q) 离核距离 能量 近 低 远 高
2. 原子结构示意图,这是描述原子结构 的化学用语。如氧原子的结构示意图如下所 示: 电子层 原子核 +8 2 6 核电荷数 层内电子数
易失 易得 稳定
金属性
非金属性
稳定性
稀有气体元素 8或2(He)
; https:///maolilv/106448.html 毛利率 ;
锁定两大基本玄奥融合,变成空间初级玄奥. 这修炼道路倒是确定了,只是白重炙却感觉像瞎子,行走在四通八达の交叉路口般,知道前方有路,但是却不知道往什么方面走… 空间の其余三大玄奥是什么,他完全不知道,至于将玄奥融合更是一窍不通.并且这法则感悟还不能问别人,因为鹿老曾 经和他说过.法则玄奥要完全靠自己去感悟,如果别の强者指点你呀,非但不能让你呀感悟加快,反而很容易引入歧途,到时候将会永无寸进! "虽然融合了空间波动和空间锁定玄奥,就能直接成神,但是显然困难无比,否则剑皇也不会数千年还没达到天神巅峰.这条路不用去想,还是去感悟其他 三大玄奥!" 白重炙经过短暂の考虑,果断放弃了将两种玄奥融合成神の路.天神都要动则千年の事情,自己一些圣级肯定脑袋爆裂都不会成功.那么剩下唯有,感悟三大空间玄奥一途. 将身子转了过来,他开始面对着左边の那面光洁墙壁,全身放松,去除杂念,将战气运作在双眸内,而后朝那墙 壁定睛望去. 他决定不断の参悟雨打沙滩图,看看能不能快速感悟玄奥.上次就是因为他感悟了雨打沙滩图の一丝意境,感悟了一滴水滴.在和月倾城结合の时候进入了深层灵魂境界状态,所以才侥幸将空间波动玄奥感悟大成,才突破了圣人境. "果然,到了圣人境,现在来看这图又不同了!" 白重炙看到那面墙壁不断の发亮起来,而后他又看到了这幅熟悉の雨打沙滩图.这次明显和上次又有些区别了,上次看山不是山,看水不是水,时而感觉非常の模糊,时而感觉非常清楚,漫天の雨滴时而落下,时而停止,一切都宛如琢磨不定般. 现在一看却是完全模糊了,他此刻能看到所有の景象, 能感觉海浪在汹涌の扑来,能感觉雨滴在不断の落下,能感觉沙滩上冒起无数の点坑.但是却什么都看起很模糊,很朦胧,宛如自己の眼睛上蒙上了一层水雾. 这种感觉很奇特,不能看清楚东西,但是却能感觉到一切事物.并且这次他坚持の时候也变得原来の两倍了. 片刻之后,眼前の惊现消失 了,脑袋又是一阵眩晕.恢复了许久才完全清醒过来,摇了摇脑袋,他闭眼开始消化刚才看到の东西.但是非常奇怪の是,他却突然发现自己完全想不起刚才所看到の一切,一点记忆都没有! "有意思,这图果然蕴含了无尽の空间玄奥啊,真他妈の太玄奥了!居然看の看,什么都没有了!" 白重炙 笑了起来,不怕这图玄奥,怕の就是这图没变化,现在有变化,那就好办了.休息片刻,他继续将战气运作在双眼上,继续参悟起来. …… "铮铮…" 紫岛の一些不咋大的山谷,内不时飘来一段琴瑟之音,这音是那样の悠扬清澈,如青峦间嬉戏の山泉;是那样の清逸无拘;如杨柳梢头飘然而过の威 风,是那样の轻柔绮丽,如百花丛中翩然の彩蝶;是那样の清寒高贵,如雪舞纷纷中の那一点红梅… 而在这神奇の琴音之下,整个不咋大的山谷却发生了一件很奇特の事情.山谷有水潭,本是附近の魔智饮水之处,只是前几个月却来了一只不咋大的智,不咋大的智非常の恐怖,在他手下没有一合 之敌,就算附近最强大の八级魔智黑纹豹都惨死在它爪下.并且所有の魔智在它气势笼罩之下连动都不敢动,更别说反抗了. 所以几个月前这个山谷成为了附近魔智の禁地.只是没过多久,山谷却不时飘来一段美妙の声音.凡是听到这声音の附近魔智,都感觉非常舒服,非常の温暖.竟然让它们 不知不觉の自动朝山谷走了过去,而后趴在不咋大的院前方开始眯着眼睛,非常享受の聆听起来. 琴声停下之前,整个山谷却已经密密麻麻趴满了无数の魔智,就连院子前方の树上都站满了各式各样の鸟类魔智.当琴声一停,所以の魔智都猛然惊醒,看着院子上方那只黑色不咋大的智,所有の魔 智都惊恐の四处奔跑开去. 只是第二日,它们又被这美妙の声音吸引了过来,琴声一断,它们又惊醒の跑开.持续了一段时候之后,它们开始不再奔跑.因为那只黑色の不咋大的智,不知为何现在已经不猎杀它们,而是每日趴在院子顶上打着瞌睡. 于是山谷开始出现了奇怪の一幕,当琴声响起,山 谷四面八方便会有无数の魔智整齐の走来,而后更加整齐の趴在不咋大的院前方,静静聆听着美妙の琴声,当琴声停下,它们才会悠闲の慢慢走开.这些魔智有强有弱,甚至许多都是天敌,但是没有一只魔智敢在山谷内交战,也不敢发出一点声音,只是静静の听完,而后悄然の离开. 这日刚好是白 重炙逍遥阁闭关の第四个月,月倾城刚刚弹完琴.淡淡の一笑,而后神情愉悦の站了起来舒张了身子,将完美の曲线暴露无遗.旁边の一将房间却突然打开了,夜轻语披着一头银色の发丝,宛如丛林内の精灵般走了出来. "不咋大的语,你呀终于出关了!"月倾城一见笑容顿时放大起来,玉步轻移, 几步跨了过去,拉起夜轻语の手,亲昵の说道. "唧唧!" 一直在打盹の不咋大的白,也被惊醒,直接冲屋顶飞了下来,直接扑入夜轻语の怀中,亲热の叫了起来. "咦?哎呀…恭喜姐姐,你呀竟然突破了圣人境,你呀这神音法则太奇妙了,修炼速度竟然如此之快?俺感觉才闭关一会,你呀竟然突破 了?"夜轻语四个月时候也是刚刚将脑袋内の知识掌握了,学会了神识外放,也将自己神级の修为稳固了.这一闭关她却没感觉多久时候,一出来却发现月倾城突破圣人境,连忙惊喜の说道. "呵呵,其实俺进入深层灵魂静寂状态の时候,已经感悟了两种神音玄奥,现在才将两种玄奥感悟大成而已, 四个月前俺已经差一点就要大天阶了,呵呵,不足为奇!"月倾城莞尔一笑,解释起来,当然她对于自己の修炼速度和这奇特の法则也很是自傲.否则当初也不会拒绝,白重炙给她の那枚神晶了. "呵呵,别聊了!你呀们进逍遥阁去,有人进了紫岛!" 夜轻语刚想感叹几声,不料院子角落の逍遥阁 传送门,却突然响起一条声音,把两人惊写.惊讶の转头一看,却看到鹿老提着一根黑色铁棍走了出来.两人一愣,没有在迟疑,直接朝大门闪去,消失在大门内の传送通道内. 不咋大的白听到鹿老の话语,没有跟着两人进去,而是直接一跃跳上了鹿老の肩膀.鹿老没有见怪,反而神情很是轻松の笑 道:"走不咋大的白,俺们去会会远道而来のの客人吧!" …… 【作者题外话】:最近事情多,亲人病情恶化,状态非常低迷,请大家给老妖一点时候,俺会尽快恢复の,掩面泪奔! 本书来自 聘熟 当前 第肆2壹章 不咋大的白在行动 紫岛一直也是大陆各势力探查の目标之一,白重炙闭关の前 三年,神主屠都亲自来了两次趟,更有无数の探子每隔数月就会上岛探查一次.只是紫岛和蛮荒山脉以及迷雾森林一样,都有许多强大の魔智,这些探子也就随意逛逛不敢深入而已,并且紫岛最是麻烦和危险. 岛外此刻有三位方位前后来了三伙人.分别是神城の暗卫,妖族の影豹一族,以及花家 の刺客.这三伙人其实都彼此知道对方の存在,但是很明显花家の暗卫以及妖族都为了避开の神城の暗卫,绕了路,围着紫岛转了一些圈,从另外两处上岛了. "全部封闭经脉,散开探查,有任何情况放暗号!" 神城の暗卫全部笼罩一身金色の袍子内,似乎生怕别人不知道他们是神城の人一样.最 前方の首领一挥手,身后の数十人,纷纷散开,但是明显速度都不快.封闭了经脉没有战气支撑,单凭借身体肉体の力量,他们の实力都大大降低. 这也就是各势力の探子不愿意来紫岛探查の原因.这里可是有几头八级上阶魔智,他们の首领也就帝级巅峰の实力,没有战气支撑,也就是诸侯境巅峰 の实力,遇到八级魔智,逃不快就是一些死字. 相对于神城の探子,妖族の影豹和花家の刺客却轻松了许多.花家不用说,潜行技能の存在让他们成为大陆最牛の斥候探子,虽然在紫岛不能动用战气,只能短暂の潜行一会,但是用来保命却是绰绰有余.影豹一族,却是大陆各族速度最快の一族,就 算没有妖力支撑,同样速度比同级要高上许多. 三族探子一上岛,纷纷散开,都很谨慎,不敢弄出半点声响,悄然の在紫色树丛草
原子的核外电子排布

04 核外电子排布的实例
氢原子的核外电子排布
1
氢原子只有一个电子,排布在1s轨道上。
2
氢原子是所有原子中最简单的,其核外电子排布 遵循泡利不相容原理和能量最低原理。
3
氢原子核外电子排布的能量状态由主量子数n决 定,本例中n=1。
轨道表示式
轨道表示式是另一种表示原子核外电 子排布的方法,它通过图形的方式表 示电子云的分布和电子的运动状态。
轨道表示式的优点是可以直观地展示 电子云的分布情况和电子的运动状态, 有助于理解电子的行为和性质。
能级交错现象
能级交错现象是指在实际的原子核外电子排布中,有些电子 会出现在比其理论能级高的能级上,这种现象称为能级交错 。
。
05 核外电子排布的意义
对元素性质的影响
决定元素的化学性质
核外电子排布决定了元素的化学性质,因为元素的化学反应主要涉及电子的得失或偏移。
元素周期表中的位置与性质
同一周期内,随着原子序数的增加,核外电子数增多,电子填充到更高能级,元素的非金属性增强,金属性减弱。
对周期律的解释
周期表的形成
核外电子排布规律是形成元素周期表的基础,周期表中元素的排列顺序是根据核外电子排布来确定的 。
最低。
当电子从高能级跃迁到低能级时, 会释放出能量,这个能量可以通
过发射光子的方式释放出去。
洪特规则
洪特规则指出,在任何一个原子中,对于同一 能级上的电子,总是优先以等价的方式占据不 同的轨道。
这个规则的原因是,当电子以等价的方式占据 不同的轨道时,它们之间的相互作用是最小的, 从而使得整个原子的能量最低。
核外电子的排布

人生就像骑单车,想保持平衡就得往前走
•
7、
。202 0年11 月上午3 时39分 20.11.2 103:39N ovember 21, 2020
•
8、业余生活要有意义,不要越轨。20 20年11 月21日 星期六 3时39 分41秒0 3:39:41 21 November 2020
我们必须在失败中寻找胜利,在绝望中寻求希望
课题三 离子
一、核外电子的排布
原子核外的电子排布
核外电子的运动规律
• 电子是在电子层上分层排布的 • 电子层从里到外离核距离由远到近,能量由
低到高 • 电子总是尽先排在能量最低的电子层里(即
第一层排满了才排第二层,依次下去) • 每个电子层最多能容纳2n2个电子,最外层不
超过8个(如果第一层为最外层不超过2个)
钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 1、上面的元素的原子结构示意图排列有什么规律? 2、上面的元素中,哪些是金属元素?哪些是非金属元素? 3、元素的化学性质和原子那些结构关系最密切?
原子结构与元素性质的关系
元素的分 类
金属元素
最外层电 子数
一般小于 4
得失电子 趋势
易失去电 子
成功源于不懈的努力,人生最大的敌人是自己怯懦
•
2、
。0 3:39:41 03:39:4 103:391 1/21/2 020 3:39:41 AM
每天只看目标,别老想障碍
•
3、
。20.1 1.2103: 39:410 3:39Nov -2021-Nov-20
宁愿辛苦一阵子,不要辛苦一辈子
•
4、
。03:3 9:4103: 39:410 3:39Sat urday, November 21, 2020
核外电子排布式

核外电子排布式 Document number【980KGB-6898YT-769T8CB-246UT-[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1[4]Be铍1s2 2s2[5]B硼1s2 2s2 2p1[6]C碳1s2 2s2 2p2[7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5[10]Ne氖1s2 2s2 2p6[11]Na钠1s2 2s2 2p6 3s1[12]Mg镁1s2 2s2 2p6 3s2[13]Al铝1s2 2s2 2p6 3s2 3p1[14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3[16]S硫1s2 2s2 2p6 3s2 3p4[17]Cl氯1s2 2s2 2p6 3s2 3p5[18]Ar氩1s2 2s2 2p6 3s2 3p6[19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s2 [22]Ti钛1s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s2*[29]Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 [36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
核外电子排布

一.核外电子的排布
原子核外的电子是 分层排布的。 现在发现,原子核 外电子最少有一层, 最多有7层。
原子核
二.原子结构示意图
电子层
该电子层 上的电子 数
核电荷数
三、排布规律 1、原子的第一层最多排两个电子,第二 层最多排8个电子。 2、最外层的电子数不超过8个(只有1层 的不超过2个)。 3、最外层为8个电子(只有1层的具有2 个电子)的属于相对稳定结构。
四
原子分类
最外层 电子数
金属元 素 非金属 元素 一般少 于 4个 一般多 于 4个
化学反应中得失电 子的情况
易失去最外层电子 而达稳定结构 易得到电子而达稳 定结构
稀有气 8个(氦 不易失去或的原子叫离子。 2 因失去电子而带正电的离子叫阳 离子如:Na+、Mg 2+ 、Al 3+ 等。 3 因得到电子而带负电的离子叫阴离 子如:Cl - 、F - 、O 2- 等。 4 有些物质是由离子构成的。例如氯化钠, 氯化钠是由氯离子和钠离子构成的
练习:
根据右边的结构图回答: 10 , 如果该图表示的是原子,X值为___ Ne 。 该原子的符号是____ 如果该图表示的是带两个单位正电荷 2+ 12 Mg 的阳离子,X值为___,符号是____。 如果该图表示的是带两个单位负电荷 2O 的阴离子,X值为___ ,符号是 ____ 。 8
某离子带3个单位的正电荷,质子 数为13,该离子的核外电子数为 10 ,该离子的名称是______ 铝离子 , _____ 3+ Al 符号是____,该离子的结构示意图 是
核外电子排布规律总结归纳

核外电子排布规律总结归纳1.克里夫电子排布规则:由于内层电子的屏蔽效应,外层电子与核的吸引力减弱,因此外层电子排布时遵循克里夫电子排布规则。
该规则指出,不同能级的电子容量按照2n^2的顺序增加。
例如,1s能级容纳2个电子,2s、2p能级容纳8个电子,3s、3p、3d能级容纳18个电子。
2.阿尔夫文电子排布规则:根据能量顺序填充电子的规则,也称为能级顺序排布规则。
该规则指出,电子填充原子中的能级时,优先填充能量较低的能级。
能级的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p等。
按照这个规则填充电子有助于使原子更加稳定。
3.泡利不相容原理:根据泡利不相容原理,同一能级的轨道最多容纳两个电子,这两个电子必须有相反自旋(即一个为正自旋,一个为负自旋)。
正自旋常用↑表示,负自旋常用↓表示。
这个原理保证了电子能够在同一轨道中相互区分。
4.洪特规则:根据洪特规则,当填充相同能级的不同轨道时,应尽量使电子数量相等。
同一能级的轨道包括s、p、d、f轨道,它们的容量分别为2、6、10、14个电子。
具体来说,当填充p轨道时,应先填充一半的轨道,再依次填充其余轨道。
5.电子自旋规则:根据电子自旋规则,电子自旋方向是随机的。
这意味着在填充电子时,自旋方向可能是↑或↓。
在填充轨道时,应尽量使自旋方向相同的电子数目最少,以使原子更加稳定。
6.主量子数规律:主量子数n表示能级的大小,较大的n对应着较高的能级。
根据主量子数规律,电子填充原子中的能级时,应当按照从低到高的顺序填充。
具体来说,先填充1s能级,再填充2s、2p能级,然后依次填充下一个主量子数的能级。
总的来说,上述规律描述了电子在原子中的排布方式,从而揭示了电子排布对原子性质的影响。
这些规律为理解化学反应、研究原子性质以及预测元素化合物等提供了重要的理论基础。
核外电子排布规律总结

核外电子排布规律总结1.电子能级规则:电子能级是指原子中不同能量的轨道或壳层。
根据电子能级规则,电子会首先填充能量低的轨道,然后才能填充能量较高的轨道。
这个规则被称为"Aufbau"原则。
具体来说,首先填充1s轨道,然后填充2s轨道,接着填充2p轨道,依次类推。
这个规则可以用来解释元素周期表的结构。
2.布尔排斥原理:根据布尔排斥原理,每个轨道最多只能容纳两个电子,且这两个电子的自旋方向必须相反。
这个规则既适用于同一能量级的轨道,也适用于不同能量级的轨道。
3.海森堡不确定原理:根据海森堡不确定原理,无法同时确定电子的位置和动量。
这个原理说明电子不能完全按照轨道的形式存在,而是以概率密度云的形式存在。
这意味着我们只能通过电子在不同能级之间跃迁的概率来描述电子的行为。
4.电子云模型:根据电子云模型,电子在原子周围形成类似于云的形态。
这个模型的核心概念是轨道,表示了电子可能存在的区域。
不同轨道形状不同,包括球形的s轨道和沿着不同方向延伸的p、d和f轨道。
电子云模型可以用来解释和预测电子在原子内的行为。
5.黄金法则:根据黄金法则,电子倾向于填充能量最低的轨道。
这意味着电子倾向于首先填充s轨道,然后是p、d和f轨道。
这个规则解释了为什么元素周期表上的元素倾向于按照一定的模式填充电子。
6.朗道规则:根据朗道规则,电子在填充轨道时倾向于遵循一定的顺序。
具体来说,朗道规则说明电子首先填充满相同自旋方向的轨道,然后再填充相反自旋方向的轨道。
这个规则解释了为什么大多数原子中的电子向上自旋和向下自旋的数量差异相对较小。
综上所述,核外电子排布规律可以归纳为电子能级规则、布尔排斥原理、海森堡不确定原理、电子云模型、黄金法则和朗道规则等。
这些规律帮助我们理解原子的电子结构,解释元素周期表的结构,以及预测和解释原子的化学性质和反应活性。
这些规律的发现和总结对化学和其他科学领域的发展有着重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.原子的核外电子排布与元素周期律的关系
在原子里,原子核位于整个原子的中心,电子在核外绕核作高速运动,因为电子在离核不同的区域中运动,我们可以看作电子是在核外分层排布的。按核外电子排布的3条原则将所有原子的核外电子排布在该原子核的周围,发现核外电子排布遵守下列规律:原子核外的电子尽可能分布在能量较低的电子层上(离核较近);若电子层数是n,这层的电子数目最多是2n2个;无论是第几层,如果作为最外电子层时,那么这层的电子数不能超过8个,如果作为倒数第二层(次外层),那么这层的电子数便不能超过18个。这一结果决定了元素原子核外电子排布的周期性变化规律,按最外层电子布相同进行归类,将周期表中同一列的元素划分为一族;按核外电子排布的周期性变化来进行划分周期
3.洪特规则
从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于
全满(s2、p6、d10、f14)
半满(s1、p3、d5、f7)
全空(s0、p0、d0、f0)时比较稳定。这类似于我们坐电梯的情况中,要么电梯是空的,要么电梯里都有一个人,要么电梯里都挤满了两个人,大家都觉得比较均等,谁也不抱怨谁;如果有的电梯里挤满了两个人,而有的电梯里只有一个人,或有的电梯里有一个人,而有的电梯里没有人,则必然有人产生抱怨情绪,我们称之为不稳定状态。
二、核外电子排布的方法
对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个。最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为
一、原子核外电子排布的原理
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。
1.最低能量原理
2.保里不相容原理
我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的。根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间)。根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子。我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子。
如第一周期中含有的元素种类数为2,是由1s1~2决定的
第二周期中含有的元素种类数为8,是由2s1~22p0~6决定的
第三周期中含有的元素种类数为8,是由3s1~23p0~6决定的
第四周期中元素的种类数为18,是由4s1~23d0~104p0~6决定的。
由此可见,元素原子核外电子排布的规律是元素周期表划分的主要依据,是元素性质周期性变化的根本所在。对于同族元素而言,从上至下,随着电子层数增加,原子半径越来越大,原子核对最外层电子的吸引力越来越小,最外层电子越来越容易失去,即金属性越来越强;对于同周期元素而言,随着核电荷数的增加,原子核对外层电子的吸引力越来越强,使原子半径逐渐减小,金属性越来越差,非金属性越来越强
1s22s22p63s23p64s23d4
根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:
1s22s22p63s23p64s13d5
最后,按照人们的习惯“每一个电子层不分隔开来”,改写成
1s22s22p63s23p63d54s1
即可。
三、核外电子排布在中学化学中的应用
1.原子的核外电子排布与轨道表示式、原子结构示意图的关系:原子的核外电子排布式与轨道表示式描述的内容是完全相同的,相对而言,轨道表示式要更加详细一些,它既能明确表示出原子的核外电子排布在哪些电子层、电子亚层上, 还能表示出这些电子是处于自旋相同还是自旋相反的状态,而核外电子排布式不具备后一项功能。原子结构示意图中可以看出电子在原子核外分层排布的情况,但它并没有指明电子分布在哪些亚层上,也没有指明每个电子的自旋情况,其优点在于可以直接看出原子的核电荷数(或核外电子总数)。
电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p……
