最新高考化学二轮复习+检测三:元素化合物氮族元素和碳族(可编辑)优秀名师资料
新高考化学二轮复习氮及其化合物 (讲义及答案)及答案

新高考化学二轮复习氮及其化合物 (讲义及答案)及答案一、选择题1.下列实验方法正确的是A.用洁净的铂丝蘸取某溶液在酒精灯外焰上灼烧,火焰呈黄色,则该溶液中不含K+SO B.向无色溶液中加入盐酸酸化的 BaCl2溶液有白色沉淀出现,则该溶液中一定含有2-4 C.向某无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则该溶液中一定含有2-CO3D.向待测液中加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,待测液NH中一定有+4【答案】D【详解】A.做焰色反应实验时,火焰呈黄色,则该溶液中含有Na+,不能确定是否含K+,A不正确;SO或Ag+ B.溶液中加入盐酸酸化的 BaCl2溶液,有白色沉淀出现,则该溶液中可能含有2-4等,B不正确;CO C.无色溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体,则该溶液中可能含有2-3 HCO 等,C不正确;或3D.向待测液中加入烧碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则该气NH,D正确;体为NH3,从而证明待测液中一定有+4故选D。
2.四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。
其中原试管充满NO2的是A.B.C.D.【答案】B【详解】NO不溶于水,对应D图像,SO2在水中的溶解度为1体积水溶解40体积SO2,对应图像A,根据化学方程式3NO2+H2O=2HNO3+NO,剩余气体是反应前的1/3,对于图像B,Cl2+H2O =HCl+HClO,HClO2HCl+O2↑,对应图像C,所以其中原试管充满NO2的是B,答案选B。
3.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是()A.在空气中敞口久置的浓硫酸,溶液质量增大难挥发性B.在加热条件下铜与浓硫酸反应强氧化性、酸性C.蔗糖与浓硫酸反应中有海绵状的炭生成吸水性D.浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色脱水性【答案】B【详解】A.浓硫酸具有吸水性,则在空气中敞口久置的浓硫酸,会吸收空气中的水分而使溶液的质量增大,表现的是浓硫酸的吸水性,故A错误;B.在加热条件下铜与浓硫酸反应生成硫酸铜和二氧化硫和水,硫元素化合价部分变化,体现浓硫酸的强的氧化性和酸性,故B正确;C.蔗糖与浓硫酸反应中有海绵状的炭生成,体现浓硫酸的脱水性,故C错误;D.硫酸与少量胆矾晶体混合,晶体由蓝色变成白色,体现浓硫酸的吸水性,故D错误。
高三化学非金属及其化合物(二)——氮族元素和碳族元素知识精讲
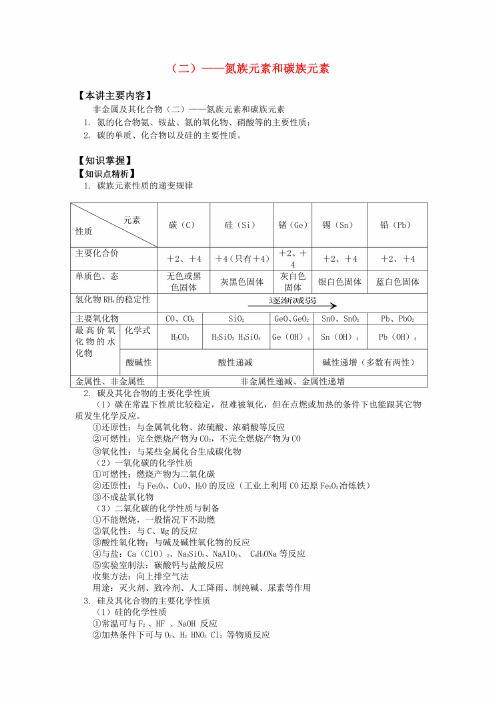
(二)氮族元素和碳族元素【本讲主要内容】非金属及其化合物(二)----氮族元素和碳族元素1. 氮的化合物氨、铉盐、氮的氧化物、硝酸等的主要性质;2. 碳的单质、化合物以及硅的主要性质。
【知识掌握】【知识点精析】1.碳族元素性质的递变规律2.碳及其化合物的主要化学性质(1)碳在常温下性质比较稳定,很难被氧化,但在点燃或加热的条件下也能跟其它物\ -素兀素性质碳(C)硅(Si)错(Ge)锡(Sn)铅(Pb)主要化合价+ 2、+4+ 4(只有+4)+ 2、+4+ 2、+4+ 2、+4单质色、态无色或黑 色固体灰黑色固体灰白色 固体银白色固体蓝白色固体氢化物rh 4的稳定性逐渐减弱 ,主要氧化物CO 、CO2SiO 2GeO> GeO2SnO> S11O2Pb 、 PbO 2最高价氧 化物的水 化物化学式H2CO3H2SM3 H4S1O4Ge (OH) 4Sn (OH) 4Pb (OH) 4酸碱性酸性递减碱性递增(多数有两性)金属性、非金属性非金属性递减、金属性递增质发生化学反应。
① 还原性:与金属氧化物、浓硫酸、浓硝酸等反应② 可燃性:完全燃烧产物为CO?,不完全燃烧产物为CO③ 氧化性:与某些金属化合生成碳化物(2) 一氧化碳的化学性质① 可燃性:燃烧产物为二氧化碳② 还原性:与Fe 304> CuO 、压0的反应(工业上利用CO 还原Fe2()3冶炼铁)③ 不成盐氧化物(3) 二氧化碳的化学性质与制备① 不能燃烧,一般情况下不助燃② 氧化性:与C 、Mg 的反应③ 酸性氧化物:与碱及碱性氧化物的反应④ 与盐:Ca (CIO ) 2、Na 2SiO 3> NaAlO?、C 6H 50Na 等反应⑤ 实验室制法:碳酸钙与盐酸反应收集方法:向上排空气法用途:灭火剂、致冷剂、人工降雨、制纯碱、尿素等作用3.硅及其化合物的主要化学性质(1)硅的化学性质① 常温可与Fz 、HF 、NaOH 反应② 加热条件下可与。
2024年高考化学一轮总复习氮及其重要化合物作业含解析新人教版
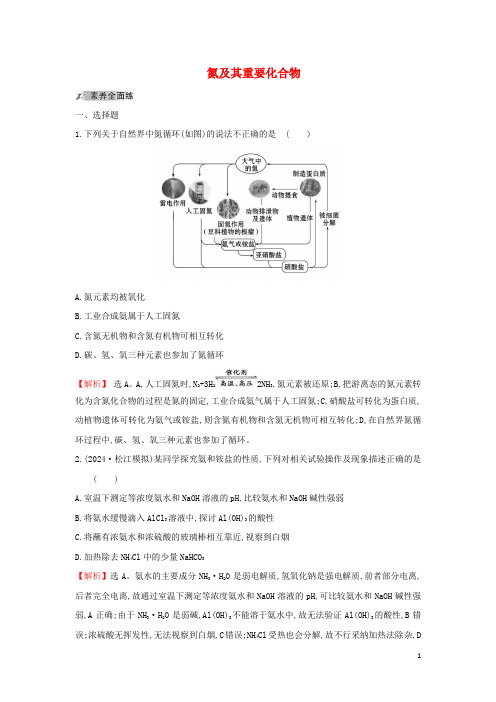
氮及其重要化合物一、选择题1.下列关于自然界中氮循环(如图)的说法不正确的是( )A.氮元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物和含氮有机物可相互转化D.碳、氢、氧三种元素也参加了氮循环【解析】选A。
A,人工固氮时,N2+3H22NH3,氮元素被还原;B,把游离态的氮元素转化为含氮化合物的过程是氮的固定,工业合成氨气属于人工固氮;C,硝酸盐可转化为蛋白质,动植物遗体可转化为氨气或铵盐,则含氮有机物和含氮无机物可相互转化;D,在自然界氮循环过程中,碳、氢、氧三种元素也参加了循环。
2.(2024·松江模拟)某同学探究氨和铵盐的性质,下列对相关试验操作及现象描述正确的是( )A.室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱B.将氨水缓慢滴入AlCl3溶液中,探讨Al(OH)3的酸性C.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,视察到白烟D.加热除去NH4Cl中的少量NaHCO3【解析】选A。
氨水的主要成分NH3·H2O是弱电解质,氢氧化钠是强电解质,前者部分电离,后者完全电离,故通过室温下测定等浓度氨水和NaOH溶液的pH,可比较氨水和NaOH碱性强弱,A正确;由于NH3·H2O是弱碱,Al(OH)3不能溶于氨水中,故无法验证Al(OH)3的酸性,B错误;浓硫酸无挥发性,无法视察到白烟,C错误;NH4Cl受热也会分解,故不行采纳加热法除杂,D错误。
3.某试验过程如图所示,则图中③试管的现象是( )A.无明显现象,因稀硫酸不与铜反应B.铜片溶解,产生无色气体,该气体遇到空气不变色C.铜片溶解,放出红棕色有刺激性气味的气体D.铜片溶解,产生无色气体,该气体在试管口变为红棕色【解析】选D。
生成的Cu(NO3)2在H2SO4的酸性条件下相当于又有了HNO3,铜片会接着溶解生成NO。
4.(2024·黄冈模拟)向盛有100 mL HNO3溶液的烧杯中加入肯定量的Cu、Al合金(还原产物为NO),充分反应后向溶液中加入1 mol·L-1的NaOH溶液,产生沉淀的质量与所加溶液的体积的关系如图所示。
高三高考复习氮族元素全章复习课件

本奉学习可标1、以元素周期律为指导,理解氮族元素的性质递变规律。
2、以氮元素为代表,了解氮族元素的单质及其重要化合物的性质及用途。
3、掌握硝酸的制备、性质和用途。
4、了解磷及其化合物的性质。
高考考点分析:本节重要的考点有:①利用元素的相似性和递变性推测不常见的如As、Sb、Bi等律和元素周期表的知识解决上述问题;②N?分子的稳定性;③白磷分子的结构;④磷的氧化物(P2O5)、含氧酸(H3PO4)的性质;⑤氮的氧化物对大气的污染及防止大气污染。
练习1、A s为第| 期第V A族元素,贝!J As不可能具有的性质是(CD )A.神单质通常条件下为固体;B.神可以有一3、+3、+5等多种化合价C・AS2O5对应水化物的酸性比H3PO4强D.神的还原性比磷弱练习2、下列过程属于人工固氮的是(A)A、用N2和H2合成NH3B、闪电时大气中氮的氧化物的生成C、由氨制尿素D、从空气中分离出氮气—■氮族元素:(在周期表中位置:第VA族)7NIIIIII相似性II递变性IIIIII1V最外层都有5个电子,化合价主要有-3、+3 和+5IIIIII原子结构单质物性化学性质IIIIIIIIIIIIII5iSb j 2、气态氢化物的通式:RH3IIIIII I I 3、最高价氧化物对!应的水化物通式为HHRO3或H3RO4IIII原子半径增大ng核电荷数增大、电子层增多单质密度增大□□一i沸点先升氢化物的稳定性减弱最高价氧化物对应水化物的酸性减弱B-HHV单质氧化性减弱III I苗电作局人工固氮质有机物氮及其化合物知识主线:-3 0 +2N N =^>N 匚I I I (NH4+)二、氮气(嗖)1、氮的原子结构结构:N@ 2^+4 +5 >N NI IC^IO2=^>HNO3(N2O4)(NO3)N2的电子式:2、化学性质:氮气(此)的分子结构为:N 三N,结构 非常稳定。
所以化学性质很稳定。
4、制法:分离空气 5、用途 1、物理性殴:标况下, P = 284-22.4 = 1.25 (g/L) 3、 N2+3H2 Nz+3Mg 催化剂 点燃 放电 2NH3 (氧化性) Mg3N 2 (氧化性) 2NO (还原性)一偿 氮的固定:&——费蔓亶 •化合态氮 固变L 固氮 N2+O 2N2O NO N2O3NO2(N2O4)N2O5、是一种无色的有毒的难溶于水的气体;极易与氧气反应生成二氧化氮。
第八章《氮族元素》高三化学复习教案

《氮族元素》复习教案(一)【教学内容】氮族元素、氮气【教学目标】1、能运用原子核外电子排布规律,熟练地写出氮、磷两种元素原子结构示意图。
2、认识氮族元素性质的相似性和递度规律,以及引起氮族元素性质异同的原因。
3、记住氮族元素的一些重要性质。
4、认识氮分子结构、性质及其重要用途。
5、熟悉氮在六种不同氧化物中的化合价;掌握一氧化氮和二氧化氮的重要性质。
6、了解氮的固定的重要性。
【知识讲解】一、氮族元素的结构特点氮族元素包括 N、 P、A S、 S b、 B i五种元素,在周期表中位于第 VA 族。
它们的最外层电子数均为 5 个,它们的原子半径随着核电荷数的增大而逐渐增大。
它们在原子结构上的异同处决定了性质的相似性和递变性。
单质的物理性质递变规律有:从氮到铋、单质的密度逐渐增大;固态氮和红磷、白磷均属分子晶体,熔沸点逐渐升高;锑和铋的金属性已较显著,熔、沸点的递变规律与碱金属单质相仿,逐渐降低。
砷较特殊,灰砷已呈现一定金属性,但常压下,它在613C0时能升华,加压下测得的熔点是氮族元素的单质中最高的。
二、氮族元素的相似性和递变性相似性递变性1、最外层上均为 5 个电子,均能1、氮、磷、砷、锑、铋的单质从非金获得 3 个电子而达到稳定结构。
属过渡到金属。
2、在最高价氧化物中化合价都是2、氮、磷与氧气反应的条件不同+5 价,化学式为 R2 O5放电2NO (难化合)N 2+O23、在气态氢化物中,都显- 3 价化点燃2P2O5(易化合)4P+5O 2学式为 RH3点燃2P2O5P4+5O 24、最高价氧化物的水化物的化学式所以还原性 N<P为: H 3RO4或 HRO 33、氮、磷与 H 2反应的条件不同高温、高压N 2+3H 2催化剂2NH 3而磷与 H 2很难直接化合成PH3所以氧化性: N>P4、气态氢化物的稳定性NH 3、 PH3、 A S H3、 S b H3稳定性逐渐减弱5、最高价氧化物的水化物的酸性HNO 3、 H3PO4、 H3A S O4、 H3S b O4酸性逐渐减弱说明:①氮族元素原子的价电子数是 5,但主要为 +3 、+5 价。
高三化学总复习氮族元素综合测试题

高三化学总复习氮族元素综合测试题一、选择题1.各取0.1mol Cu分别投入足量的以下四种酸溶液中(必要时能够加热):①浓硫酸②浓硝酸③稀硝酸④稀硫酸,充分反响后得到的气体体积(一样条件下)由大到小的顺序是()A.①②③④ B.②①③④ C.②④①③ D.③④①②2.磷和氧气反响,可分别按如下方式进展,4P+3O2=2P2O3(方式一),4P+5O2=2P2O5(方式二),假设在两个容器中都分别放入2 molP和 2 molO2,且操纵不同条件使反响分别按方式一和方式二进展,经充分反响生成P2O3和P2O5。
物质的量之比为()A.5∶4 B.1∶1 C.5∶3 D.4∶33.在一样情况下,将以下四组混合气体:①体积比为3∶1的NH3和N2②体积比为1∶1的NO和NO2③体积比为1∶1的NO2和O2④体积比为4∶1的NO2和O2分别置于完全一样的试管里,倒置于水槽中,反响后,液面上升高度分别为h1、H2、H3、H4,以下关系正确的选项()A.h1>H2>H3>H4 B.H4>h1>H3>H2C.H4>H3>h1>H2 D.H2>H3>h1>H44.以下各组物质在不同条件下反响时,均能得到不同的产物,其中主要是由温度不同引起的是()①P、Cl2②Cu、HNO3③NaCl、浓H2SO4④H2S、O2⑤CO2、NaOH⑥P2O5、H2O⑦C、O2A.①② B.③⑦ C.③⑥ D.②⑤5.NH4ClO4在强热条件下分解的产物为N2、O2、HCl和H2O。
则反响中生成的氧化产物与复原产物的物质的量之比为()A.2∶4 B.5∶4 C.4∶7 D.7∶46.碘化磷(PH4I)是一种白色晶体。
依照你所学的知识,推断以下关于碘化磷的描绘错误的选项是()A.它是离子晶体,稳定,高温也不分解 B.它的水溶液使淀粉变蓝C.能跟强碱反响放出PH3 D.该物质中含有共价键、配位键和离子键7.有A、B两种物质,A和B化合生成C,C溶于水生成D,D和红热木炭反响又生成C,则A和B分别是()A.O2和SO2 B.N2和O2 C.NO和O2 D.H2和Cl28.有反响B2+2C-=2B-+C2,C2+2D-=2C-+D2,以下推断正确的选项()A.B-能被D2置换成B2 B.D-不能被B2氧化C.单质氧化性:B2>D2 D.阴离子复原性:B->D-9.含硫酸铵和硝酸铵的混合溶液V升,参加a mol NaOH,刚好使中硝酸铵的物质的量浓度是()10.能推断出非金属性M比N强的有()A.跟氢气反响生成气态氢化物时,M比N容易B.各自最高价氧化物的水化物酸性M比N强C.各自气态氢化物的水溶液酸性M比N强D.跟氧气反响生成氧化物时,M比N容易11.以下说法中错误的选项是()A.硝酸的浓度越大,溶液的密度越大;而氨水的浓度越大,溶液的密度越小B.H2、O2、HCl和H2S四种气体均可用五氧化二磷枯燥C.在6Na+2H3PO4=2Na3PO4+3H2↑反响中,磷酸把Na氧化到Na+,因此H3PO4也是氧化性酸D.在Zn和稀H2SO4的反响中,氢元素被复原;而在Cu与热浓H2SO4的反响中,硫元素被复原12.以下离子方程式书写正确的选项()A.实验室用氯化铵和熟石灰共热制氨气B.碳酸氢钙溶液中参加足量的烧碱溶液C.硫酸铵与氢氧化钡浓溶液混合D.铜和稀HNO3反响13.一种盐 X和NaOH反响,生成有刺激性气味的气体Y,Y经一系列氧化再溶于水可得酸Z,Y和Z反响又可生成X。
高考化学氮族元素必备专题复习.doc

高考化学 氮族元素必备专题复习【考纲解读】1. 了解氮的单质及其氧化物、氢化物的性质。
2. 了解氮的氧化物对大气的污染及其防治;初步了解含磷洗涤剂对环境及人类健康的影响。
3. 掌握氨、铵盐的性质、掌握NH 4+的检验。
4. 掌握 NH 3 的实验室制法。
5. 掌握 HNO 3的性质。
【高考预测】1. 氮族元素性质的相似性、递变性及其应用。
2. 有关氮的氧 化物和氧气的混合气体与水反应的计算。
3.NO x 、含磷洗涤剂对环境及人类健康的危害与防治。
4.NH 3 的结构特点; NH 3、铵盐的化学性质及其应用。
5.NH 的实验室制法、工业制法的反应原理、仪器、原理、收集及检验;+的检验。
NH346.HNO 3 的强氧化性;运用电子守恒进行 HNO 3的相关计算。
一、氮气的化学性质1. 氮的固定使空气中 __________的氮转化为 __________ 的过程。
2. 氮气的性质①物理性质纯净的N 2 是一种无色无味的气体,难溶于水,在空气中约占总体积的______。
②化学性质氮气的化学性质:常温稳定、高温活泼(与N ≡ N 叁键键能有关)⑴还原性: N 2 + O 2 放电注: NO 与 O 2 进一步化合 2NO + O 2 = 2NO 2(红棕色)2NO⑵氧化性: N + 3H高温高压。
3Mg+N点燃22NH3MgN2232压催化剂例 1、( 2013·上海化学· 18)汽车剧烈碰撞时,安全气囊中发生反应 10NaN 3+2KNO 3→K 2O+5Na 2O+16N 2↑。
若氧化物比还原物多1.75mol ,则下列判断正确的是A. 生成 40.0LN 2(标准状况)B.有 0.250molKNO 3 被氧化C. 转移电子的物质的量为1.25mol D. 被氧化的 N 原子的物质的量为 3.75mol【答案】 CD二、氮的氧化物1.在氮族元素中氮和其它元素比较,有很大的特殊性,它的主要化合价有-3、+1、+2、+3、+4、+5,氮元素能以不同的价态与氧结合,可以形成多种氧化物:N 2O 、 NO 、 N 2O 3、 N 2O 4、 NO 2、 N 2O 5。
《3年高考2年模拟》2022课标版高中化学一轮复习 第4讲 氮及其化合物(1)

第4讲 氮及其化合物考试要点核心素养1.了解氮单质及其重要化合物的制备方法。
2.掌握氮单质及其重要化合物的主要性质及其应用。
3.了解氮单质及其重要化合物对环境的影响。
1.宏观辨识与微观探析:能从不同层次认识氮及其化合物的主要性质及应用;从氮的化合价变化角度认识氮及其化合物之间的反应原理及转化条件。
2.科学探究与创新意识:从不同的角度探究氨气、氮的氧化物、硝酸的主要性质和制备方案,并进行实验验证。
3.科学精神与社会责任:关注NO 、NO 2的污染,保护环境。
一、氮及其氧化物的性质及应用1.氮元素在自然界中的存在形态及氮的固定2.氮气 (1)结构 分子式:N 2;电子式:② ∶N︙︙N∶ ;结构式:③。
(2)性质:写出有关化学方程式:ⅰ.④3Mg+N2Mg3N2,N2表现⑤氧化性。
ⅱ.⑥N2+3H22NH3,N2表现⑦氧化性。
ⅲ.⑧N2+O22NO ,N2表现⑨还原性。
3.氮的氧化物(1)氮有多种氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等,其中属于酸性氧化物的是N2O3、N2O5。
(2)NO和NO2的比较NO NO2物理性质颜色⑩无色红棕色毒性有毒有毒溶解性不溶于水易溶于水与O2或H2O反应2NO+O22NO23NO2+H2O2HNO3+NO 制备Cu与稀硝酸反应Cu与浓硝酸反应收集方法排水法向上排空气法与人体、环境的关系a.与血红蛋白结合,使人中毒b.转化生成NO2,形成酸雨、光化学烟雾等形成酸雨、光化学烟雾、破坏臭氧层等二、硝酸的重要性质及应用1.物理性质硝酸是无色易挥发的液体,有刺激性气味。
2.化学性质(1)不稳定性反应的化学方程式: 4HNO 32H 2O+4NO 2↑+O 2↑ 。
(2)强氧化性浓硝酸和稀硝酸都有强氧化性,而且浓度越大氧化性越强。
a.与金属反应稀硝酸与铜反应的化学方程式: 3Cu+8HNO 3(稀)3Cu(NO 3)2+2NO ↑+4H 2O 。
浓硝酸与铜反应的化学方程式: Cu+4HNO 3(浓)Cu(NO 3)2+2NO 2↑+2H 2O 。
元素及其化合物氮族元素 人教版

元素及其化合物(三)氮族元素一. 选择题(每小题有1~2个选项符合题意)1. 同主族元素形成的同一类物质,往往结构和性质相似。
化合物I PH 4是一种无色晶体,下列对它的叙述,正确的是( ) A. 它是一种共价化合物B. 加热可产生有色蒸气C. 它不能跟NaOH 溶液反应D. 它可以由3PH 和HI 化合而成2. 某共价化合物含碳、氢、氮三种元素,分子内有四个氮原子,且四个氮原子排列成空心的四面体(如白磷)结构,每两个氮原子间都有一个碳原子。
已知分子内无C —C 单键和C=C 双键,则该化合物的化学式为( ) A. CH 8N 4 B. C 6H 12N 4 C. C 6H 10N 4 D. C 4H 8N 43. 某气体可能含有2N 、HCl 和CO 。
把混合气体依次通过足量的3NaHCO溶液和灼热的CuO ,气体体积均没有变化;再通过足量的22O Na 固体,气体体积减小;最后通过灼热的铜网,经充分反应后,气体体积又减小,但还有剩余气体。
以下对混合气体组成的判断中,正确的是( )A. 一定有2N ,CO 和HCl 中至少有一种B. 一定有2N ,没有CO 和HClC. 一定无2N ,CO 和HCl 中至少有一种D. 一定有2N 、HCl 、CO4. 在一种强酸性溶液中,可能存在-3NO 、-I 、-Cl 、+3Fe 中的一种或几种,向该溶液中加入溴水,单质溴被还原。
由此可推断该溶液中( )A. 含有-I ,不能确定是否含-ClB. 含有-3NO C. 含有+3Fe D. 含有-I 、-Cl、-3NO5. 根据下列叙述,回答本题及后面的6、7两题。
在3PCl 中加入蒸馏水,微热,3PCl 完全水解,产物之一是亚磷酸(33PO H ),它的结构为:HOHOPOH已知:.a 33PO H 与NaOH 反应只能生成32HPO Na 和32PO NaH两种盐;b. 33PO H 与碘水反应,碘水棕黄色褪去,再加3AgNO 有黄色沉淀;c. 盛33PO H 的试管中加3AgNO 溶液,产生黑色Ag 沉淀,试管口处有棕红色气体出现。
高考化学总复习课件氮及其重要化合物

成了蛋白质的基本骨架。
氮在蛋白质中的存在形式
02
蛋白质中的氮主要以酰胺键(-CONH-)的形式存在,连接氨
基酸形成多肽链。
蛋白质中氮的含量与蛋白质的质量关系
03
蛋白质中氮的含量是评价蛋白质质量的重要指标之一,高质量
的蛋白质通常含有较高的氮。
生物固氮与氮肥的生产和使用
生物固氮的概念
生物固氮是指某些微生物能够将大气中的氮气转化为氨或其他含氮 化合物的过程。
05
氮及其化合物的实验探究
氨的实验室制法
1 2
反应原理
利用氮气和氢气在高温高压下催化合成氨气。
实验装置
包括合成塔、热交换器、冷凝器、分离器等。
3
实验步骤
将氮气和氢气按一定比例混合,通过合成塔中的 催化剂层,在高温高压下反应生成氨气,经过冷 凝器冷却后得到液态氨。
铵盐的性质实验
铵盐的溶解性
铵盐易溶于水,且溶解度随温度升高而增大。
解题速度和准确性。
模拟试题与答案解析
模拟试题一
以氮的氧化物和氨的合成为背景,考查化学反应原理和化学计算。通过解析该题,可以检 验学生对相关知识点的掌握情况。
模拟试题二
涉及氮的固定、转化和铵盐的性质等知识点,考查学生综合运用知识解决问题的能力。答 案解析详细分析了解题思路和方法。
模拟试题三
以氮及其化合物的应用为背景,考查学生实验探究能力和创新思维。答案解析提供了多种 可能的实验方案和设计思路。
备考策略与建议
01
02
03
04
系统复习氮及其重要化合物的 性质、转化关系等基础知识,
形成完整的知识网络。
重视实验探究,掌握氮及其化 合物的实验方法和操作技能, 培养实验设计和分析能力。
高考化学二轮复习氮及其化合物 (讲义及答案)及答案

答案选A。
5.浅绿色的Fe(NO3)2溶液中逐渐加入少量稀盐酸时,溶液的颜色变化应该是
A.颜色变浅B.变为红色C.没有改变D.变为黄色
【答案】D
【详解】
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,三价铁离子为棕黄色;
【答案】B
【详解】
C与浓硫酸共热反应生成CO2、SO2和H2O,产生的气体X中含CO2、SO2;Cu与浓HNO3反应生成Cu(NO3)2、NO2和H2O,气体Y中含NO2;将X、Y同时通入足量BaCl2溶液中,发生的反应有3NO2+H2O=2HNO3+NO、3SO2+2HNO3+2H2O=3H2SO4+2NO、H2SO4+BaCl2=BaSO4↓+2HCl。
高考化学二轮复习氮及其化合物 (讲义及答案)及答案
一、选择题
1.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是()
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
故答案选D。
9.许多装有化学物质的瓶子上贴有危险警告标志,下面是一些危险警告标志,其中标志贴错的是( )
选项
A
B
C
D
物质
浓硝酸
汽油
纯碱
氯酸钾
危险警告标志
新高考化学二轮复习氮及其化合物 复习题及答案

新高考化学二轮复习氮及其化合物复习题及答案一、选择题1.宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。
引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是( )A.高温下N2遇空气生成NO2B.NO遇空气反应生成NO2C.CO2与NO反应生成NO2D.NO与H2O反应生成NO2【答案】B【详解】A.氮气为空气的主要组成气体,性质稳定,高温下N2遇空气不会直接生成NO2,故A错误;B.一氧化氮极易被氧气氧化,NO在常温下能与氧气反应2NO+O2=2NO2,生成红棕色的NO2,所以B选项正确;C.高温条件下一氧化碳在空气中不可能为反应产物,必然被氧气氧化成二氧化碳,所以,CO2与NO在空气中高温条件下不反应,故C错误;D.一氧化氮和水之间不会发生反应,故D错误故选B。
2.X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有( )①C、O2②Na、O2③Fe、HNO3④S、O2 ⑤N2、O2 ⑥H2S、O2 ⑦NH3、O2A.四项B.五项C.六项D.七项【答案】A【详解】①氧气不足时,碳燃烧生成一氧化碳,一氧化碳能在氧气中燃烧生成二氧化碳,碳在足量氧气中燃烧生成二氧化碳,①符合;②常温下,钠与氧气反应生成氧化钠,加热时氧化钠可与氧气反应生成过氧化钠,钠在氧气中燃烧生成过氧化钠,②符合;③过量的铁与稀硝酸反应生成硝酸亚铁,硝酸亚铁与稀硝酸反应转化为硝酸铁,铁与足量的稀硝酸反应生成硝酸铁,③符合;④硫在氧气中燃烧生成二氧化硫,在催化剂和高温条件下二氧化硫与氧气反应生成三氧化硫,硫与氧气不能直接反应生成三氧化硫,④不符合;⑤氮气与氧气在放电或高温条件下反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,氮气与氧气不能直接生成二氧化氮,⑤不符合;⑥氧气不足时,硫化氢燃烧生成硫,硫在氧气中燃烧生成二氧化硫,硫化氢在足量氧气中燃烧生成二氧化硫,⑥符合;⑦在催化剂和加热条件氨气与氧气反应生成一氧化氮,一氧化氮与氧气化合生成二氧化氮,氨气与氧气不能直接生成二氧化氮,⑦不符合;所以,符合图示转化关系的有:①②③⑥,故答案为:A。
2024年人教版高中化学同步精品讲义(必修二)第04讲 5.4氮气和氮氧化物(含答案解析)

第1课时 氮气和氮氧化物1.了解氮的固定和自然界中氮的循环。
2.了解氮气的主要化学性质。
3.认识氮氧化物的性质与转化。
一、氮气与氮的固定 1.氮元素的原子结构和性质(1)氮元素的原子结构氮元素位于元素周期表的第二周期第ⅤA 族,氮原子最外层有5个电子,既不容易得到3个电子,也不容易失去5个电子。
氮原子一般通过共用电子对与其他原子相互结合构成物质。
(2)氮元素在自然界中的存在①游离态:主要以氮气分子的形式存在于空气中,约占78%(体积分数)。
②化合态:存在于动植物体内的蛋白质中,土壤、海洋的硝酸盐和铵盐中。
2.氮气的性质(1)物理性质通常情况下,氮气是无色、无味的气体,密度比空气的稍小,难溶于水。
(2)化学性质氮分子内两个氮原子间以共价三键(N ≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下很难与其他物质发生化学反应,但在高温、放电等条件下,氮气也可以与镁、氧气、氢气等物质发生化合反应。
写出氮气与下列物质反应的化学方程式。
①金属镁:N 2+3Mg=====点燃Mg 3N 2,氮气表现氧化性; ②氢气:N 2+3H 2高温、高压催化剂2NH 3,氮气表现氧化性;③氧气:N 2+O 2=======放电或高温2NO ,氮气表现还原性。
(3)用途①氮气常用作保护气,如焊接金属、填充灯泡、保存食品等。
②氮气是合成氨、制硝酸的重要原料。
③液氮可用作制冷剂,应用于医学、科技等领域。
3.氮的固定(1)含义:将大气中游离态的氮转化为氮的化合物的过程。
(2)分类:①自然固氮:大自然通过闪电释放能量将氮气转化为含氮的化合物(高能固氮),或者通过豆科植物的根瘤菌将氮气转化为氨(生物固氮)。
②人工固氮:工业合成氨。
二、一氧化氮和二氧化氮1.一氧化氮、二氧化氮的物理性质氧化物颜色状态气味水溶性NO无色气态无味难溶NO2红棕色气态刺激性气味与水反应2.一氧化氮、二氧化氮的相互转化操作一:在一支50 mL的注射器里充入20 mL NO,观察颜色,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器。
高考化学二轮复习教案第18讲碳族元素

第18讲碳族元素(建议2课时完成)[考试目标]1.了解碳的三种重要的同素异形体及导致它们物理性质有较大差别的原因。
了解碳的多样性。
2.了解碳、硅单质及其重要化合物(氧化物、碳酸钠、碳酸氢钠、硅酸钠等)的主要性质及应用。
3.了解水泥、玻璃和陶瓷等硅酸盐产品的主要化学成分、生产原料及其用途。
4.了解常见的无机非金属材料、金属材料与复合材料。
5.了解碳的氧化物对大气的污染。
[要点精析]复习策略:本单元主要采用对比的方法复习碳硅及化合物的主要性质,同时注意碳硅及化合物的某些特殊性.一、碳族元素1.碳族元素:包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb),为第IV A族元素;最外层均有四个电子,决定了碳族元素性质具有相似性,容易形成共价化合物(特别是碳和硅),其化合价主要有+4和+2;但电子层数不同,又导致了性质具有递变性:从碳→铅,非金属2.碳的同素异形体的比较:(表18—2)碳元素不仅可以形成多种同素异形体,而且还可以形成多种无机化合物和有机化合物,是形成化合物种类最多的元素。
例题1:(1)质量相等的石墨与足球烯(C 60)所含质子数( ) A .前者多 B. 相等 C. 后者多 D. 无法确定 (2)设计一个实验证明金刚石、石墨和C 60都是由碳元素组成的。
答案:(1)B (2)分别将三种物质在氧气充足的条件下燃烧,若三者产生的都是无色无味的气体且将所得气体通入澄清石灰水中,若气体都使澄清的石灰水变浑浊,则说明它们都是由碳元素组成的。
解析:(1)等质量的石墨与足球烯含有相同物质的量碳原子,所含质子数也相等 二、碳、硅元素的单质及重要化合物的主要性质、制法及应用的比较1.碳单质:(1)物理性质:碳元素形成的同素异形体由于碳原子的排列方式不同,导致物理性质有较大的差别。
(见表18—2)(2)化学性质:①C + O 2 = CO 2 ②2C + O 2 = 2CO ③C+4HNO 3(浓)=CO 2↑+ 4NO 2↑+ 2H 2O ④ C + 2CuO = 2Cu + CO 2↑⑤ C + CO 2 = 2CO ⑥ 2C + SiO 2 = Si + 2CO ↑点燃 点燃 △高温高温 △例题2:除去下列物质中的杂质(括号内为杂质)。
高考化学二轮复习作业卷氮及其重要化合物含解析

氮及其重要化合物可能用到的相对原子质量:H~1 O~16 S~32 N~14 Cl~35.5 C~12 Na~23 Al~27 K~39 He~4 P~31 Cu~64 Ba~137 Ca~40 Cu~64 Mg~24、选择题〔本大题共15小题。
在每题给出的四个选项中,只有一个选项是符合题目要求的〕1.以下关于自然界中氮循环〔如右图〕的:说法不正确的选项是.......A.但元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物与含氮有机物可相互转化D.碳、氢、氧三种元素也参及了氮循环2.一定量的Fe与Fe2O3混合物投入2mol/L250mL的HNO3溶液中,反响完全后,无固体剩余,生成气体(标况),再向反响后溶液中参加1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )A.450mLB.500mLC.400mLD.无法确定3.俗话说“雷雨发庄稼〞.在雷雨天,空气中有O3〔由O2生成〕与NO产生,以下说法正确的选项是〔〕A.O3与O2两种气体都是氧元素形成的单质,化学性质一样B.生成O3与NO的反响都是氧化复原反响C.NO在空气中不能稳定存在,会继续反响D.NO的产生是形成酸雨的主要原因4.〔2021•福建〕以下物质及水作用形成的溶液能及NH4Cl反响生成NH3的是〔〕A.二氧化氮B.钠C.硫酸镁D.二氧化硅5.物质氧化性、复原性的强弱,不仅及物质的构造有关,还及物质的浓度与反响温度有关.以下各组物质:①Cu及HNO3溶液②Cu 及FeCl3溶液③Zn及H2SO4溶液④Fe及HCl溶液由于浓度不同而能发生不同氧化复原反响的是〔〕6.化学反响中,有时存在“一种物质过量,另一种物质仍不能完全反响〞的特殊情况。
以下反响中,属干这种情况的是①过量锌及18 mol/L的硫酸反响;②过量氢气及少量氮气在催化剂存在下充分反响;③浓盐酸及过量的MnO2反响;④过量铜及浓硫酸反响;⑤过量稀硝酸及银反响;⑥过量稀硫酸及大块状石灰石反响。
高三化学总复习氮族元素(含答案)

高三化学总复习氮族元素可能用到的相对原子质量:H: 1 O: 16 N: 14 Cl: 35.5 S:32 Ca: 40 Cu:64 Na:23I卷一、选择题(每小题有1-2个答案,共50分)1.汽车尾气在光照下分解时,即开始光化学烟雾的循环,它的形成过程可用下列方程式表示:NO2NO+O;2NO+O2== 2NO2;O+O2==O3下列有关叙述不正确的是A.在此过程中,NO2是催化剂B.在此过程中,NO是反应的中间产物C.此过程的总反应方程式为:2O3==3O2D.光化学烟雾能引起人的外呼吸功能严重障碍2.锗酸铋(BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗元素处于最高价态,又知铋元素是VA族元素,它的价态与铋跟氯形成某种共价氯化物所呈现的价态相同,此时该氯化物中铋有8电子的稳定结构,则BGO 的化学式为A.Bi2Ge3O15 B. Bi4Ge3O12C. Bi4Ge3O16D. Bi2Ge3O123.在浅绿色的硝酸亚铁溶液中主要存在的平衡是Fe2++2H 2O Fe(OH)2+2H+,现向该溶液中加入少量的稀盐酸,溶液颜色的变化应该是A.绿色变浅B.绿色加深C.溶液变黄D.几乎不变化4.下列各组比较中,正确的是A.原子半径:N<P<S B.稳定性:NH3< H2O < HFC.碱性:Sb(OH)3>Bi(OH)3D.酸性:H3AsO4> H2SeO4> HBrO4 5.含3.7gCa(OH)2的石灰水中滴加150ml0.5mol/L的H3PO4溶液,待完全反应后,下列叙述正确的是A.只生成CaHPO4B.有Ca3(PO4)2和CaHPO4生成C.只生成Ca(H2PO4)2D.有CaHPO4和Ca(H2PO4)26.蘸有浓氨水的玻棒靠近下列各浓酸时,均有白烟产生的一组是A.HCl、H2SO4、HNO3B.HCl、HBr、HNO3C.HCl、H3PO4、HNO3D.HCl、H3PO4、H2SO47.亚硝酸钠有咸味,有毒,外观类似于食盐,故应严防把它误当作食盐用。
高考化学试题汇编氮族元素

高考化学试题汇编氮族元素在一定条件下,NO跟NH3能够发生反应生成N2和H2O。
现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试运算原反应混合物中NO与NH3的物质的量可能各是多少。
(1)(2)0.3 mol NO和0.7 mol NH3或0.2 mol NH3和 0.8 mol NO下列现象的产生与人为排放大气污染物氮氧化物无关的是A .闪电B .光化学烟雾C .酸雨D .臭氧层空泛(2000春季10)已知元素砷(As)的原子序数为33,下列叙述正确的是A.砷元素的最高化合价为+3 B.砷元素是第四周期的主族元素C.砷原子的第3电子层含有18个电子D.砷的氧化物的水溶液呈弱碱性已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:今有某固体可能由上述三种硝酸盐中的一种或几种组成,取适量该固体充分加热,得到一定量气体。
若该气体经水充分吸取后,剩余气体的体积在同温同压下为吸取前的1/6,通过运算(忽略氧在水中的溶解)回答:(1)该固体是否可能只是由一种盐组成的?若可能,指出是哪种盐。
(2)若固体是混合物,指出它的可能组成(物质的量之比)。
(1)可能,是纯AgNO3 (2)是KNO3与Cu(NO3)2按1:1混合或三种盐KNO3与Cu(NO3)2物质的量1:1,而AgNO3物质的量可任意变动铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为A.9.02g B.8.51g C.8.26g D.7.04g关于氮族元素(用R代表)的下列叙述正确的是A.最高化合价是+5 B.氢化物的通式为RH5 C.非金属性由上到下递增D.其含氧酸均为一元强酸有一种磷的结构式是,有关它的下列叙述不正确...的是A.它完全燃烧时的产物是P2O5 B.它不溶于水C.它在常温下呈固态D.它与白磷互为同分异构体金属加工后的废切削液中含2~5%的NaNO2,它是一种环境污染物。
2024届高三化学二轮复习——卤族与碳族及其应用(含解析)

2024届高三化学二轮复习——卤族与碳族及其应用一、单选题1.氨气可以做喷泉实验,这是利用氨气下列性质中的( )A .易液化B .比空气轻C .极易溶于水D .有刺激性气味2.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )A .汽车尾气中NO ,主要来源于汽油、柴油的燃烧B .二氧化硫不仅可以漂白纸浆,还能杀菌消毒C .植物直接吸收利用空气中的NO 和NO 2作为肥料,实现氮的固定D .工业废气中的SO 2和CO 2均可采用石灰法进行脱除3.“蓝天、碧水、净土”三大环保保卫战正加快生态环境治理和现代化建设。
下列说法错误的是( )A .废旧电池必须回收处理,可以防止重金属污染B .尽量少用或不用含磷洗涤剂,以防止水体富营养化C .农田使用铵态氮肥要深施覆土,以防止氮肥被氧化D .在燃油车上安装三元催化转化器,以降低污染气体的排放4.化学与生产、生活密切相关。
下列做法或说法错误的是( )A .将煤气中毒患者移至空气流通处进行救治B .医用药品常在低温、干燥的环境中密封保存C .农业生产中草木灰和铵态氮肥混合使用以增加肥效D .4NH Cl 和2ZnCl 溶液可作为焊接除锈剂5.下列实验操作不能达到实验目的的是( )A .AB .BC .CD .D6.化学与生产、生活密切相关,下列物质的性质、用途都正确且有相关性的是()A.A B.B C.C D.D7.下列实验“操作和现象”与“结论”对应关系正确的是()A.A B.B C.C D.D8.某元素常见物质的“价类”二维图,其中d为红棕色气体,f和g均为正盐且焰色反应(试验)火焰为黄色。
下列说法错误的是()A.常温下,e的浓溶液可以用铝槽车运输B.气体a、c均可用浓硫酸干燥C.1 mol d与足量水反应转移2mol3电子D.d可与NaOH溶液反应生成f和g9.下列物质的保存方法正确的是()A.氯水保存在无色细口瓶中B.氢氧化钠保存在带玻璃塞的试剂瓶中C.漂白粉长期放置在烧杯中D.金属钠保存在煤油中10.下列有关实验室制取Cl2的装置正确的是()A.制备Cl2B.净化Cl2C.收集Cl2D.尾气处理11.有关氯及其化合物的说法,正确的是()A.以氯气和石灰乳为原料制取漂白粉B.氯碱工业中,阳极得到烧碱C.可在“84”消毒液中加入洁厕灵(主要成为HCl)以增强漂白性D.Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性12.下列关于含氮化合物的说法错误的是()A.工业上可使用液氮做制冷剂B.NO2能导致“光化学烟雾"的形成C.浓硝酸可用铝槽车运输D.硫酸铁又称肥田粉,属于硝态氮肥13.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是()A.A B.B C.C D.D14.2019年12月以来,我国部分地区突发的新冠病毒肺炎威胁着人们的身体健康。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2011年高考化学二轮复习检测三:元素化合物氮族元素和碳族(可编辑)《元素化合物氮族元素和碳族》检测题一1氯气可用来消灭田鼠为此将氯气通过软管灌入洞中这是利用了Cl2下列性质中的?黄绿色 ?密度比空气大 ?有毒 ?较易液化 ?溶解于水A???B??C??D???2已知HIO既能和酸又能和碱发生中和反应则它与盐酸反应的产物是AIO-BH2OCHI DICl3为了防止Cl2中毒可用浸透某种物质溶液的毛巾捂住口鼻该物质在下列物质中的最佳选择是ANH3BSO2CKI DNa2CO34氯的原子序数为1735Cl是氯的一种同位素下列说法正确的是A35Cl原子所含质子数为18 Bmol的1H35Cl分子所含中子数约为602×1023 C35 g的35Cl2气体的体积为224 LD35Cl2气体的摩尔质量为70 gmol-1 5下列反应都是用盐酸制Cl2为制得等量Cl2消耗盐酸最少的是AMnO24HClMnCl2Cl2?2H2O B2KMnO416HCl2KCl2MnCl25Cl2?8H2OCKClO36HClKCl3Cl2?3H2O D4HClO22H2O2Cl2?6今有甲乙丙三瓶等体积的新制氯水浓度均为01 molL-1如果在甲瓶中加入少量的NaHCO3晶体m mol在乙瓶中加入少量的NaHSO3晶体m mol丙瓶不变片刻后甲乙丙三瓶溶液中HClO的物质的量浓度大小关系是溶液体积变化忽略不计A甲乙丙 B甲丙乙C丙甲乙 D乙丙甲7将015 mol的MnO2与过量的12 molL-1的浓盐酸反应和50 mL 12 molL-1的浓盐酸与足量的MnO2反应两者产生的Cl2相比其他反应条件相同A一样多B前者较后者多 C后者较前者多D无法比较8F2是氧化性最强的非金属单质在加热条件下等物质的量的F2与烧碱完全反应生成NaFH2O和另一种气体该气体可能是AH2BHFCO2 DOF29我国政府规定国内销售的食盐必须加碘关于加碘盐的下列叙述中不正确的是A食用加碘盐以确保人体对碘的摄入量B加碘盐中加入的是碘酸钾C加碘盐中不能同时加入碘酸钾和碘化钾D加碘盐中加入的是单质碘10氯化溴BrCl和Br2Cl2具有相似的性质下列有关氯化溴性质的判断中错误的是A在CCl4中的溶解性BrClBr2BBrCl氧化性比Br2强比Cl2弱C沸点BrClBr2 D常温下BrCl可与NaOH溶液反应生成NaCl和NaBrO11有ABC三种物质它们是Cl2HClHBrABC不知分别是哪一种已知AB混合不反应则下列结论中正确的是AC绝不是HClBAB能确定 CC可能是HClDC不是Cl2就是HBr12氟是最活泼的非金属能体现这一结论的是A氢氟酸是一元弱酸B氢氟酸能腐蚀玻璃CNaF是一种农药D氟能与Xe发生化合反应14在含有FeBr2和FeI2的混合溶液中通入足量的氯气然后把溶液蒸干并将残渣灼烧得到的残渣是AFeCl2Br2I2BFeCl3I2 CFeOH3I2DFe2O315碘是原子半径较大的卤族元素可能呈现金属性下列事实能说明这个结论的是A已制得了IBrICl等卤素互化物 B已经制得I2O5等碘的氧化物C已经制得INO33IClO432H2O等含I3的化合物 DI2易溶于KI等碘化物溶液形成I16已知氯化碘ICl性质类似于卤素有很强的化学活性ICl跟ZnH2O分别发生如下反应2ICl2ZnZnCl2ZnI2IClH2OHClHIO下列叙述正确的是A在Zn跟ICl的反应中ZnI2既是氧化产物又是还原产物B在Zn跟ICl的反应中ZnCl2既不是氧化产物又不是还原产物C在H2O跟ICl的反应中ICl既是氧化剂又是还原剂D在H2O和ICl的反应中ICl既不是氧化剂也不是还原剂17氰气的分子式为CN2它的性质和卤素相似称为拟卤素对其性质和有关化合物性质的叙述正确的是A NaCN和AgCN都易溶于水 B HCl和HCN都易形成白雾CCN2易溶于水也易溶于NaOH溶液DCN2和NaOH溶液反应生成NaCNNaCNO和H2O18酸根RO所含电子数比硝酸根NO的电子数多10则下列说法正确的是AR原子的电子层数比N的电子层数多1BRO中R的化合价与NO中N的化合价相等CRO和NO只能被还原不能被氧化 DR与N为同族元素19上海高考题过氧化氢的沸点比水高但受热容易分解某试剂厂先制得78的过氧化氢溶液再浓缩成30溶液时可采用的适宜方法是A常压蒸馏 B减压蒸馏C加生石灰常压蒸馏D加压蒸馏20下列叙述不正确的是A硒可以与钠组成化合物Na2Se B硒化氢水溶液的酸性比氢硫酸弱C硒酸的酸性比硫酸的酸性弱 D硒化氢在空气中完全燃烧时生成二氧化硒和水21碲元素及其化合物不可能具有的性质是A碲的化合价有-2价4价6价B碲的氧化物有TeO2和TeO3C碲能与氢气直接化合且H2Te比H2Se稳定D单质碲呈银白色还原性比硒强22含有硒的保健品已开始进入市场已知硒元素与钾元素同周期则下列关于硒的叙述不正确的是A原子序数为24B气态氢化物为H2SeC非金属性比溴弱D最高价含氧酸为H2SeO423下列有关硫化氢性质的说法正确的是A给盛硫化氢的容器加热会产生黄色物质 B由于硫化氢不稳定所以久置的氢硫酸会变浑浊C硫化氢具有强还原性故氢硫酸在反应中只能作还原剂D氢硫酸是弱酸无法通过复分解反应制取强酸24下列物质中既能与H2S反应又能与溴水反应的是AFeSO4溶液BNa2S溶液CCuSO4溶液D氯水25同温同压下燃烧20 mL H2S用去O2 16 mL则充分燃烧的H2S与不充分燃烧的H2S的质量之比为 A 1?2B2?3 C7?3 D3?726关于O3的说法中错误的是?O3具有刺激性臭味因此被称为臭氧?O2与O3是氧元素的同素异形体?O3比O2密度大也比O2易溶于水 ?O3比O2稳定高温下不易分解?臭氧有漂白和消毒作用?空气中微量O3可以刺激中枢神经加快血液循环因此空气中O3含量越高越好?空气中高压放电高压电机和复印机工作都会有O3生成A???B??? C?? D??27下列能说明元素R一定为氧族元素的是AR为非金属元素其氧化物对应水化物分子式为H2RO3BR的单质与H2化合成H2RCR的单质与铝化合成Al2R3 DR的氢化物的水溶液呈酸性28若要从CO2气体中除去少量SO2最好使混合气体通过A盛NaOH溶液的洗气瓶B盛KMnO4酸性溶液的洗气瓶C盛品红溶液的洗气瓶D盛饱和NaHCO3溶液的洗气瓶30SO2是常见的大气污染物之一我国规定空气中SO2含量不得超过002 mgL-1下列措施中不能够减少SO2排放量的是A用天然气代替煤炭做民用燃料 B开发新型燃器提高热能利用率C硫酸厂采取措施提高尾气的吸收率 D燃煤中加入生石灰后使用31SO2和Cl2都具有漂白性若将等物质的量的这两种气体同时作用于潮湿的有色物质可观察到有色物质 A立刻褪色B慢慢褪色C先褪色后复原 D颜色不褪32向FeCl3和BaCl2的酸性混合液中通入SO2气体有白色沉淀生成此沉淀是ABaSO4 BFeS CBaSO3 DS33在常温下将a L SO2和b L H2S混合当反应后气体体积为反应前气体体积的14时则a与b之比为 A1?1B1?2C1?3 D2?134下列关于SO2的叙述不正确的是ASO2既可以是含硫物质的氧化产物又可以是含硫物质的还原产物BSO2是亚硫酸的酸酐C大气中SO2的主要来源是含硫物质的燃烧 DSO2具有氧化性因而可以使品红溶液褪色35下列反应发生后溶液中H浓度显著增大的是A将SO2通入溴水中B将SO2通入品红溶液中C将H2S通入CuSO4溶液中D将Cl2通入KI溶液36为了除去混入CO2中的SO2和O2下列试剂的使用顺序正确的是?饱和Na2SO4溶液?饱和NaHCO3?浓硫酸?灼热的铜网?碱石灰A??? B??? C??? D???37一定物质的量的SO2与NaOH溶液反应所得产物中含Na2SO3和NaHSO3物质的量之比为3?5则参加反应的SO2与NaOH物质的量之比为A1?2B3?5 C8?11 D18?838下列四种溶液中一定存在SO的是A向甲溶液中加入BaCl2溶液产生白色沉淀B向乙溶液中加入BaCl2溶液有白色沉淀再加入盐酸沉淀不溶解C向丙溶液中加入盐酸使之酸化再加入BaCl2溶液有白色沉淀产生D向丁溶液中加入硝酸酸化再加入硝酸钡溶液有白色沉淀产生39已知98的浓H2SO4的浓度为184 molL则49的硫酸溶液的浓度为A92 molLB大于92 molLC小于92 molL D不能确定40向50 mL 18 molL硫酸中加入足量的铜片并加热被还原的硫酸的物质的量n 为An09 molB045 moln09 molCn045 molDn045 mol41在200 mL 05 molL-1 NaOH溶液中加入一定量SO3在一定条件下蒸发所得溶液析出的固体物质只有50 g该固体物质的成分可能是固体物质均不含结晶水ANa2SO4BNaHSO4 CNaOH和Na2SO4DNa2SO4和NaHSO442利用废铜屑制取CuSO4溶液最好的方法是A铜屑和浓硫酸混合加热 B铜屑在空气中燃烧后再溶于稀H2SO4C铜屑与稀硫酸混合加热 D铜屑在空气中灼烧后再溶于浓H2SO443各取pH2的H2SO4和H2SO3溶液350 mL分别稀释5倍后再分别加入01 g Zn在相同条件下让它们充分反应则A两者放出H2体积一样 BH2SO4放出的H2比H2SO3放出的H2体积小CH2SO4放出的H2比H2SO3放出的H2体积大DH2SO4的反应速率比H2SO3的反应速率快44在硫酸的工业生产中下列生产操作及对生产操作主要原因的说明二者都正确的是A从沸腾炉出来的炉气需净化因为炉气中SO2会与杂质反应B硫铁矿燃烧前需要粉碎因为大块的不能燃烧CSO3用983的浓H2SO4吸收目的是防止形成酸雾以使SO3吸收完全DSO2氧化为SO3时需使用催化剂这样可以提高SO2的转化率45下列各组气体中在实验室可用硫酸制取又能用浓H2SO4干燥的一组是AHClHBrH2BH2SCO2H2 CH2SO2HClDNH3HFH246下列气体中最易液化的是 AN2 BO2CNH3 DH2 47既能用浓硫酸又能用碱石灰干燥的气体是ACl2 BSO2 CNO DNH348下列物质中既能与稀硫酸反应又能与烧碱溶液反应的是ANH4ClBNH4HSCNaHCO3DFeS49下列各组物质的空间构型完全不同的是 ANH3和H3OBNH4和CH4 CCO2和SiO2D金刚石和晶体硅50下列各组气体在通常条件下能稳定共存的是ANH3O2HClBN2H2HClCCO2NOO2DH2SO2SO2 51某混合气体可能有COCO2NH3HClH2和水蒸气中的一种或几种当依次通过澄清石灰水无浑浊现象氢氧化钡溶液有浑浊现象浓H2SO4灼热的氧化铜变红和无水硫酸铜变蓝时则可断定该混合气体中一定有AHClCO2H2 BCOH2H2O CCOH2NH3 DHClCOH2O 52氨水中含氮的微粒最多的是ANH3BNH3H2O CNH4 DOH-53下列混合物可用加热方法分离的是A碘和氯化铵 B硫酸钾和氯酸钾C氯化铵和硫酸钡 D碳酸氢钠和碳酸氢铵54限用一种试剂经过一次性实验就能鉴别Na2CO3NH42SO4NH4ClKNO3溶液应选用AAgNO3溶液 BNaOH溶液 CBaOH2溶液 D盐酸55下列各组离子在水溶液中能大量共存的是ACO32-HHCO3-Ca2BNH4OH-Ba2NO3-CI-ClO-NO3-H DSO32-SO42-NaOH-56下列有关硝酸化学性质的叙述中正确的是A浓稀硝酸都能使蓝色石蕊试剂变红B硝酸过量能与Na2SO3反应但不生成SO2 C稀硝酸可与Na2S反应制得H2S D在碘化钾淀粉溶液中滴加稀硝酸溶液呈蓝色57污染环境的有害气体中主要由于跟血红蛋白作用而引起中毒的有毒气体是ASO2 BCO2CNO DCO58某二价金属跟硝酸反应时金属与硝酸所消耗的物质的量之比为25则反应中唯一的还原产物可能是ANH3 BN2O CNO DNO259可不用棕色瓶存放但必须用玻璃塞试剂瓶存放的药品是A氯水 B硝酸银溶液 C液溴 D烧碱60Cu粉放A稀H2SO4中加热后也无现象当加入一种盐后Cu粉质量减少而溶液变蓝同时有气体生成此盐是A氯化物 B硫酸盐C硝酸盐 D磷酸盐61下列酸的酸酐难以由单质间直接化合生成的有AH2CO3 BHNO3CH2SO3 DH2SO462下列反应中既能表现出硝酸的酸性又能表现出其氧化性的是AFe2O3HNO3 BAl OH3HNO3CCHNO3浓 DCuHNO363当三份Cu粉分别与过量的稀硝酸浓硝酸热的浓硫酸反应后收集到的气体在相同状况下体积相等时三份Cu粉的质量比为不考虑NO2转化成N2O4和反应生成气体的溶解A312 B322 C112D26364下列关于浓硝酸和浓硫酸的叙述正确的是A常温下都能用铝容器贮存B常温下都能与铜较快反应C露置在空气中容器内酸液的质量都减少 D露置在空气中容器内酸液的浓度均降低65按右图进行实验试管内装有12mLNO然后间歇而缓慢地通入8mLO2下面有关实验最终状态的描述正确的是A试管内气体呈棕红色B试管内气体为无色是NOC试管内气体为无色是O2D试管内液面高度上升66 46g金属钠在空气中充分燃烧得到淡黄色粉末该粉末与足量的水反应放出气体的体积是标准状况下A448L B112LC224L D56L67氢化钠NaH是一种白色的离子晶体其中钠是1价NaH与水作用放出氢气下列叙述中正确的是 ANaH在水中显酸性 BNaH中氢离子的电子层排布与氦原子相同CNaH中氢离子半径比锂离子半径大DNaH中氢离子可被还原成氢气68下列物质的溶液既能与H反应又能与OH-反应的是AMgSO4 BNa2CO3CNaHCO3 DNH42SO469将一小块金属钾投入下列物质的溶液中既能放出气体又有沉淀析出的是AMgCl2 BBaCl2 CCuCl2 DNaHCO370下列关于碱金属的叙述中正确的是A碱金属都可以保存在煤油中 B碱金属与水反应均漂浮在水面上C碱金属在空气中加热均可生成多种氧化物D碱金属的硬度小密度小熔点低71下列关于纯碱晶体Na2CO310H2O的叙述中错误的是A将晶体放置在空气中质量会减轻 B加热晶体则生成NaHCO3CNa2CO3可作为干燥剂使用 D晶体溶于水后呈碱性72相同质量的NaMgAl分别与过量的盐酸反应在相同条件下置换出H2的体积比是A36?69?92 B23?12?9 C1?2?3 D9?12?2373有关镁的下列叙述中错误的是A能与NH4Cl溶液作用放出氢气 B与冷水剧烈反应生成MgOH2沉淀并放出氢气C在CO2中能继续燃烧所以金属镁着火不能用CO2去灭火D在通常情况下其表面有一层致密的氧化膜所以抗腐蚀能力很强74有无色溶液加入Na2O2时有无色无味气体放出并有白色沉淀生成加入Na2O2的量与生成白色沉淀的量如图3-18所示该无色溶液中含有的物质是ACaCl2和MgCl2BAl2SO43CAl2SO43和MgSO4DNa2SO4和MgSO475相同质量的镁条分别在下列气体中充分燃烧所得固体物质的质量最大的是AO2 BN2 CCO2 D空气76用纯净的铂丝蘸取某无色溶液在无色火焰上灼烧火焰呈黄色说明该溶液中金属离子A只有NaB可能有Na也可能有KC一定有KD一定有Na也可能有K77电子工业制造光电管时需要一种经强光照射就失电子而接通电路的材料制造这种材料的物质应属于A放射性元素 B?A族元素C卤化银 D?A族元素78某温度下w g某物质在足量氧气中充分燃烧其燃烧产物立即与过量的Na2O2反应固体质量增加w g在?H2?CO ?CO和H2的混合气 ?HCHO ?CH3COOH ?HOCH2CH2OH中符合题意的是A均不符合B只有???C只有?? D全部符合79已知锂及其化合物的许多性质与碱金属差异较大却与镁相似下面有关锂及其化合物性质的叙述不正确的是A锂在过量氧气中燃烧主要产物是氧化锂而不是过氧化锂B碳酸锂受强热很难分解C碳酸锂的溶解度比碳酸氢锂的大D锂可以与氮气化合生成氮化锂Li3N80已知钡的活泼性介于钠和钾之间下列说法中正确的是A钡可以从氯化钠溶液中置换出钠 B钡可以从氯化铜溶液中置换出铜C钡可以从冷水中置换出氢而得到氢气D在水溶液中钡离子可以氧化金属钠81Na3N与NaH均为离子化合物都能与水反应放出气体下列有关叙述正确的是A二者中Na半径都比阴离子大B与水反应时水都作氧化剂C与水反应所产生的气体都能使湿润的红色石蕊试纸变蓝D二者与盐酸反应前者可产生两种盐后者只有一种盐生成82将23 g钠与另一种金属元素组成的合金放入足量盐酸中完全反应时收集到113 L H2标准状况则另一种金属可能是?K ?Mg ?Al ?Li ?Rb ?Fe A??? B??C???D????83钾与氧组成的某种离子晶体含钾的质量分数是其阴离子只有过氧离子O和超氧离子O两种则此晶体中O与O的物质的量之比为A2?1B1?1C1?2D1?3842001年春季高考题将一定质量的MgZnAl混合物与足量稀H2SO4反应生成H2 28 L标准状况原混合物中的质量可能是A2 gB14 gC8 gD10 g85将某物质的量的镁和铝相混合取等质量的该混合物四份分别加到足量的下列溶液中充分反应后放出氢气最多的是A3 molL-1 HClB4 molL-1的HNO3C8 molL-1 NaOHD18 molL-1H2SO486人的纯净的胃液是一种强酸性液体pH在0915左右氢氧化铝是一种治疗胃液过多的胃药的主要成分目前这种胃药已不常用原因主要是A长期摄入铝元素不利于人体健康B它不能中和胃液C它不易溶于胃液 D它的疗效太差87下列气体逐渐通入NaAlO2溶液中开始时产生沉淀继续通入气体时沉淀又溶解该气体是ANO2BNOCCO2 DH2S88在硝酸铝和硝酸镁的混合溶液中逐滴加入稀氢氧化钠溶液直至过量下列表示氢氧化钠加入量x与溶液中沉淀物的量y的关系示意图中正确的是89在氯化镁和硫酸镁的混合液中若Mg2与Cl-的物质的量浓度之比为4?3时下列判断正确的是A溶液中Mg2与SO的物质的量浓度相等B溶液中Mg2与SO物质的量浓度之比为5?8C溶液中Mg2与SO物质的量浓度之比为8?5D溶液中氯化镁和硫酸镁物质的量相等90将AlCl3溶液和NaOH溶液等体积混合得到的沉淀物和溶液中所含铝元素的质量相等则原AlCl3溶液和NaOH溶液物质的量浓度之比可能是A2?3B1?3C1?4D2?791m g钠铝混合物放入n g水中反应停止后仍有不溶物a g则溶液中溶质为ANaOHBNaAlO2CNaOH和NaAlO2D无法确定92将铝粉放入烧碱溶液中若反应过程中有15 mol电子发生转移则参加反应的水为A9 g B18 gC05 mol D mol932002年全国高考题铁屑溶于过量的稀硫酸过滤后向滤液中加入适量硝酸再加入过量的氨水有红褐色沉淀生成过滤加热沉淀物至质量不再发生变化得到红棕色的残渣上述沉淀和残渣分别为 AFeOH3Fe2O3 BFeOH2FeOCFeOH2FeOH3Fe3O4 DFe2O3FeOH394要证明某溶液中不含Fe3而可能含有Fe2进行如下实验操作时最佳顺序为?加入足量氯水 ?加入足量KMnO4溶液 ?加入少量NH4SCN溶液A?? B??C?? D???95在氯化铁氯化铜和盐酸混合液中加入铁粉待反应结束所剩余的固体滤出后能被磁铁吸引则反应后溶液中存在较多的阳离子是ACu2BFe3CFe2DH 96在FeCl3CuCl2FeCl2的混合溶液中Fe3Cu2和Fe2的物质的量之比为3?2?1现加入适量铁粉使溶液中三种离子物质的量浓度之比变化为1?2?4则参加反应的铁粉与原溶液Fe3的物质的量之比为A2?1 B1?2C1?3D1?497在浓度均为3 molL-1的盐酸和硫酸各100 mL中分别加入等质量的铁粉反应完毕后生成气体的质量比为3?4则加入铁粉的质量为A56 gB84 gC112 g D18 g98把a g铁铝合金粉末溶于足量盐酸中加入过量NaOH溶液过滤出沉淀经洗涤干燥灼烧得到的红色粉末的质量仍为a g则原合金中铁的质量分数为A70B524C476 D3099制印刷电路时常用氯化铁溶液作为腐蚀液发生的反应为2FeCl3Cu2FeCl2CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉反应结束后下列结果不可能出现的是A烧杯中有铜无铁B烧杯中有铁无铜C烧杯中铁铜都有 D烧杯中铁铜都无100某强酸性溶液中可能存在NOCl-I-Fe3中的一种或几种向该溶液中加入溴水单质溴被还原由此推断溶液中A不含NO也不含Fe3B含有NOI-Cl-C含I-但不能确定是否含Cl-D含有Fe3 《元素化合物氮族元素和碳族》检测题一一单项选择1下列各组物质中使有色物质褪色的反应机理相同的是 A二氧化硫和过氧化钠B过氧化氢和次氯酸 C二氧化硫和漂白粉 D活性炭和二氧化硫2实验室保存下列物质的方法中不正确的是A少量金属钠保存在煤油里B澄清石灰水盛装在用玻璃塞塞紧的试剂瓶中CFeSO4溶液存放在加有少量铁粉的试剂瓶中 D新制氯水通常保存在棕色试剂瓶中3 下列实验现象的描述错误的是 A新制氯水使碘化钾试纸呈蓝色 B向NaHCO3固体加入新制氯水有无色气体产生 C向FeCl2溶液中滴加新制氯水再滴加KSCN溶液呈血红色 D在新制氯水中滴加AgNO3溶液有白色沉淀生成4已知常温下氯酸钾与浓盐酸反应能放出氯气现按右下图进行卤素的性质实验玻璃管内分别装有滴有少量不同溶液的白色棉球反应一段时间后对图中指定部位颜色描述正确的是? ? ? ?A 黄绿色橙色蓝色红色B 黄绿色橙色蓝色白色C 黄绿色无色紫色红色D 无色橙色紫色白色5进行化学实验观测实验现象通过分析推理得出正确的结论是化学学习的方法之一下列对有关实验事实的解释正确的是 ASO2气体使高锰酸钾溶液褪色表现了SO2的漂白性B在含有CuNO32MgNO32和AgNO3的溶液中加入适量锌粉首先置换出的是Cu C浓硝酸在光照条件下变黄说明浓硝酸易分解生成有色产物且溶于浓硝酸D 常温下将铝片放入浓硫酸中无明显现象说明铝不与冷的浓硫酸发应6在AlCl3和MgCl2的混合溶液中逐滴加入NaOH溶液直至过量经测定加入NaOH的体积和所得沉淀的物质的量的关系如下图所示b处NaOH的体积为1L则下列判断不正确的是ANaOH的浓度为06 molLB在a点处溶液中的溶质为NaClC图中线段oa ab5 1D在b点处溶液中的溶质只有NaAlO2二多项选择7在能与铝反应产生氢气的溶液中一定不能大量共存的离子组是 A NH4Cu2Cl-NO3- B KNaSO32-S2- C KNaAlO2-SO42- D Ba2NaCl-Br--8下列离子方程式书写正确的是A碳酸氢钡溶液中加入足量的NaOH 溶液Ba2 2HCO3- 2OH-BaCO3? CO32- 2H2O B硫酸铜溶液与氢氧化钡溶液反应Ba2 SO42- BaSO4?C氨水和硫酸铝溶液反应3OH- Al3 AlOH3?D二氧化硅与氢氧化钠溶液反应SiO22OH-SiO32-H2O9在生活生产及化学研究中人们经常需要根据不同原子分子或离子的某些特征反应对物质进行区别检验等下列说法正确的是A 用KOH溶液可以将MgCl2 NH4BrCuSO4AlCl3区别开BMnO2CuOFe三种物质的粉末都是黑色的用稀盐酸不能将它们区别开C 某溶液中加入稀盐酸有无色气体产生该气体能使澄清石灰水变浑浊则此溶液中一定含有CO32ˉD可以用BaCl2溶液和稀盐酸检验Na2SO3 是否变质10 在保持平衡的天平的左右两盘中各放一只大小和质量均相同的烧杯两烧杯中都盛有1 molL的稀硫酸100 mL然后分别向两烧杯中加入一定质量的金属充分反应后天平仍保持平衡则金属的质量分别是A46 g Na48 g MgB5 g Na5 g AlC23 g Na2 4 g Mg D18 g Al24 g Mg11粗盐水过滤后仍含有可溶性的CaCl3MgCl2Na2SO4等杂质通过如下几个实验步骤可以除去这些杂质 ?加入稍过量的Na2CO3溶液?加入稍过量的NaOH溶液?加入稍过量的BaCl2溶液?滴入稀盐酸至无气泡产生?过滤正确的操作顺序是A????? B????? C????? D?????12下列实验中能利用相同装置作部分实验装置的是A除去碳酸氢钠固体中的碳酸钠B铜与浓硝酸反应制取二氧化碳气体C加热铵盐和碱的化合物制取氨气D鉴别碳酸钠和碳酸氢钠13一般地同一主族的元素最外层电子数相同其单质及其对应的化合物具有相似的性质下列关于同主族元素所形成物质的性质的推理中正确的是ANa与C12反应能形成离子键故K与C12反应也能形成离子键BC12能置换出NaBr溶液中的溴故Br2能置换出NaI溶液中的碘CLi在氧气中燃烧生成Li2O故Na在氧气中燃烧生成Na2ODC在自然界有稳定的单质存在故Si在自然界也有稳定的单质存在三填空14写出下列反应的化学方程式或离子方程式1漂白粉溶液中通入过量的二氧化碳的化学方程式 ________ ___________________2足量的氯气通入到溴化亚铁溶液中的离子方程式___________________________3铝与氢氧化钠溶液反应的离子方程式_____________________________ _______4二氧化硫使溴水褪色的化学方程式并标出该反应中电子转移的方向和数目_____________________________________________________________________________15下列是几种不同类型的漏斗用途有差异1粗盐提纯用到的是_________填序号下同2用CCl4从溴水中提取溴用到的是____________________________3实验室用二氧化锰和浓盐酸加热制氯气用到的是_________________________________4实验室制氢气常用到______________________________________________16某溶液中可能含有NaKClO-SO42-CO32-等离子中的全部或其中的几种为确定其成分现进行以下的连续操作?用洁净的铂丝蘸取溶液在无色火焰上灼烧火焰呈黄色?取少量溶液加入稀硫酸酸化无气体放出再滴入数滴品红溶液振荡后品红褪色?向?反应后的溶液中加入BaNO32溶液产生白色沉淀试填写下列空白1 原混合液中一定存在的离子是一定不存在的离子是2 上述??的操作中是错误的应改为加试剂以便确定离子是否存在3 为确定离子是否存在应补充的操作是17 某研究性学习小组认为SiO2SO2和CO2都是酸性氧化物化学性质应具有一定的相似性他们以课本知识Mg在点燃的条件下可与CO2反应为基础设计了如右图所示装置进行Mg和SO2反应的实验据此请回答1若用下列物质中的两种相互混合反应制取SO2则这两种物质最好是_______填代号 ? 10的H2SO4溶液 ? 50的H2SO4溶液 ?Na2SO3固体 ? CaSO3固体2写出装置B中发生的主要反应的化学方程式________________________________装置C中NaOH溶液的作用是________________________________________3你认为该装置是否有不足之处如果有请说明之答______________ ___________________________________________________。
