浙江省仙居中学高三一轮复习-含硅物质
高考化学一轮复习 专题三 第三单元 含硅物质及其应用课件 苏教版

第七页,编辑于星期五:七点 四十四分。
【例1】(2021·重庆理综,26)工业上电解饱和食盐 水能制取多种化工原料,其中局部原料可用于 制备多晶硅。 (1)右图是离子交换膜法电解饱和食盐水示意 图,电解槽阳极产生的气体是________;
第八页,编辑于星期五:七点 四十四分。
NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母); 枯燥塔中应使用的液体是________。
第二十一页,编辑于星期五:七点 四十四分。
【例2】(2021·四川理综,6)开发新材料是现代科技开展的方向之一。以下有关材料的 说法正确的选项是( ) A.氮化硅陶瓷是新型无机非金属材料 B.C60属于原子晶体,用于制造纳米材料 C.纤维素乙酸酯属于天然高分子材料 D.单晶硅常用于制造光导纤维 解析:B项,C60属于分子晶体;C项,纤维素乙酸酯不是天然高分子材料;D项,二氧化硅常
第六页,编辑于星期五:七点 四十四分。
【议一议】
能否依据Na2CO3+SiO2 强?
Na2SiO3+CO2↑说明H2SiO3的酸性比H2CO3
答:不能。因为酸盐互化关系:强酸+弱酸盐===强酸盐+弱酸,仅适用于常温下 水溶液中进行的反响,而该反响是在高温且干态下进行,只能从化学平衡移动 角度 去解释反响发生的原因,因CO2为气体,及时离开反响体系,使化学反响得 以向右 进行。
Si+2NaOH+H2O===Na2SiO3+2H2↑
。
在加热条件下硅可以和氧气、氯等反响。
第二页,编辑于星期五:七点 四十四分。
3.工业上用SiO中,是 沙子、 石英 的主要成分,纯洁的二氧化硅晶
很高
很大
不
体无色、熔点
,硬度
浙江专用高考化学一轮复习专题非金属及其化合物第二单元含硅矿物与信息材料课件

解析:加热时氯化铵分解生成 HCl 和 NH3,HCl 与 Ca3SiO5 反应得到硅酸 钙、氯化钙和水,A 项正确;水泥吸水会变硬,需密封保存,B 项正确; Ca3SiO5 能与二氧化硫反应得到亚硫酸钙,C 项正确;由上述分析可知, Ca3SiO5 与足量盐酸反应得不到二氧化硅,D 项错误。
纯 SiHCl3
解析:步骤①的生成物为 Si(粗)和 CO,A 项错误;步骤①②③中,硅元素 的化合价从正价→0 价→正价→0 价,所以硅元素分别被还原、被氧化、被 还原,B 项错误;二氧化硅能与氢氟酸反应,但生成的不是盐和水,所以 不属于两性氧化物,C 项错误;SiHCl3 与 SiCl4 的沸点不同且相差较大, 可通过蒸馏提纯 SiHCl3,D 项正确。
专题4 非金属及其化合物
第二单元 含硅矿物与信息材料
化学
[考点分布]
考点一 硅单质及其重要化合物的性质
1.硅单质的存在形态、物理性质及用途 (1) 硅 元 素 因 有 亲 氧 性 , 所 以 仅 有 ___化__合______ 态 。 硅 单 质 主 要 有 ___晶__体__硅_____和__无__定__形__硅____两大类。
考点三 硅及其化合物的转化关系与应用 硅及其化合物的转化关系
题组化工生产中的硅及其化合物的转化 1.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发 现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2―高①―温C→Si(粗)―②30―H0 ℃C→lSiHCl31 00③0―~过―1量→1H002 ℃Si(纯)
题组二 无机非金属材料成分的辨别与性质 2.(2020·宁波质检)硅是构成无机非金属材料的一种主要元素,下列有关硅 的化合物的叙述错误的是( ) A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为 Si3N4 B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承 C.光导纤维是一种新型无机非金属材料,其主要成分为 SiO2
(浙江选考)高考化学大一轮复习 第17讲 含硅矿物与信息材料课时作业-人教版高三全册化学试题

课后作业17 含硅矿物与信息材料(时间:45分钟满分:100分)一、选择题(本题包括14小题,每小题5分,共70分,每小题只有一个选项符合题目要求)1.下列有关硅的化合物的叙述错误的是( )A.氮化硅陶瓷的化学式为Si3N4B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承C.光导纤维是光缆通讯的重要材料,其主要成分为SiO2D.2MgO·SiO2中的酸根阴离子为Si O42-答案D解析D中酸根阴离子应为Si O44-,故D错误。
2.下列五个转化,其中不可能通过一步反应实现的是( )①SiO2→Na2SiO3②CuSO4→CuCl2③SiO2→H2SiO3④CuO→Cu(OH)2⑤Na2O2→NaOHA.①②B.③④C.②③④D.②③④⑤答案B解析①SiO2+2NaOH Na2SiO3+H2O;②CuSO4+BaCl2BaSO4↓+CuCl2;⑤2Na2O2+2H2O4NaOH+O2↑,SiO2和CuO均不溶于水,因此SiO2、CuO不可能通过一步反应分别生成H2SiO3、Cu(OH)2。
3.下列说法正确的是( )A.制取水泥和玻璃的原料中均有纯碱B.普通玻璃是电的绝缘体,这种透明的固体物质是混合物,无固定的熔点C.普通玻璃俗称水玻璃D.硅酸盐工业使用的每一种原料都含有硅答案B解析制取玻璃的原料中有纯碱,而制取水泥的原料中没有纯碱,A错误;玻璃属于混合物,没有固定的熔、沸点,B正确;普通玻璃和水玻璃的成分不同,水玻璃不是普通玻璃的俗名,C错误;制取水泥和玻璃的原料中均有石灰石,石灰石中不含有硅,D错误。
4.下列有关硅酸盐的叙述,正确的是( )A.大部分硅酸盐都易溶于水,Na2SiO3是常见的可溶性硅酸盐,其水溶液俗称水玻璃,可用作建筑黏合剂B.石英砂可与烧碱反应制水玻璃:SiO2+2OH-Si O32-+H2OC.硅酸具有酸的通性,能使石蕊溶液变红D.石棉Mg3Ca(SiO3)4可表示为氧化物形式3MgO·CaO·4SiO2答案B解析硅酸盐大部分难溶于水,常见硅酸盐中只有Na2SiO3、K2SiO3等可溶,Na2SiO3的水溶液具有黏性,可作建筑黏合剂,A错误;石英砂成分为SiO2,SiO2+2NaOH Na2SiO3+H2O,NaOH、Na2SiO3为强电解质可拆成离子形式,B正确;硅酸具有酸的通性,例如能与碱反应,但其难溶于水,不能使石蕊溶液变色,C错误;硅酸盐改写成氧化物形式时要按“较活泼金属氧化物→较不活泼金属氧化物→二氧化硅→水”的顺序排列,由于Ca活泼性强于Mg,所以其氧化物形式为CaO·3MgO·4SiO2,D错误。
高三化学综合复习第一轮:非金属元素—硅人教实验版

高三化学综合复习第一轮:非金属元素—硅人教实验版【本讲教育信息】一. 教学内容:综合复习第一轮:非金属元素—硅二. 重点、难点1. 解硅单质的性质、用途2. 认识二氧化硅的结构、了解二氧化硅的用途。
3. 掌握二氧化硅、硅酸盐的性质三. 具体内容硅的原子结构示意图:硅元素存在形式(一)硅1. 单质物理性质晶体硅是灰黑色、有光泽、而脆的固体,熔点2. 单质化学性质常温下,化学性质活泼;加热条件下,能与非金属如O2、Cl2等反应3. 硅的主要用途:4. 粗硅的制取:用焦炭和石英砂高温下制取,请写出反应的化学方程式(二)二氧化硅1. 物理性质:熔点,硬度。
2. 化学性质:(1)酸性氧化物的通性:(2)特性:3. 主要用途:(三)硅酸1. 制取:2. 硅胶的用途:(四)硅酸盐1. 硅酸钠的水溶液俗称;2. 性质硅酸钠的水溶液暴露在空气中已变质,请写出有关反应的化学方程式解释:为什么盛放氢氧化钠溶液的试剂瓶的瓶塞不能用玻璃塞?3. 用途硅酸钠是制备和的原料【典型例题】[例1] 不用任何试剂就可以将①Na2SiO3②Na2SO4③CuCl2④KCl ⑤Ba(NO3)2五种溶液鉴别出来的顺序是()A. ③④⑤①②B. ③①⑤②④C. ①③④②⑤D. ③②①④⑤答案:B解析:考查多种物质的鉴别和各物质的性质。
[例2] 氧化钙中含有二氧化硅,为得到纯净的氧化钙,可先将它放入足量的盐酸中,充分反应后过滤,再向滤液中通入常见的两种气体,可产生沉淀,将沉淀滤出高温加热。
通入的气体是什么?通入的正确顺序是什么?写出通入气体有关反应的化学方程式。
答案:先通入氨气,后通入CO2;H2O+2NH3+CO2=CaCO3↓+2NH4Cl。
解析:考查混合物提纯的方法。
[例3]答案:(1)盐酸(2)灼烧;(3)加水;(4)灼烧。
(操作略)解析:考查混合物的除杂。
[例4] 现有下列五个转化,其中不能通过一步反应实现的是()①SiO2→Na2SiO3②CuSO4→CuCl2③SiO2→H2SiO3 ④CuO→Cu(OH)2⑤Na2O2→Na2SO4A. ①和②B. ③和④C. ②③④D. ②③④⑤答案:B解析:考查硅元素相关物质的性质。
浙江版高考化学大一轮复习专题4非金属及其化合物第二单元硅硫及其化合物学案
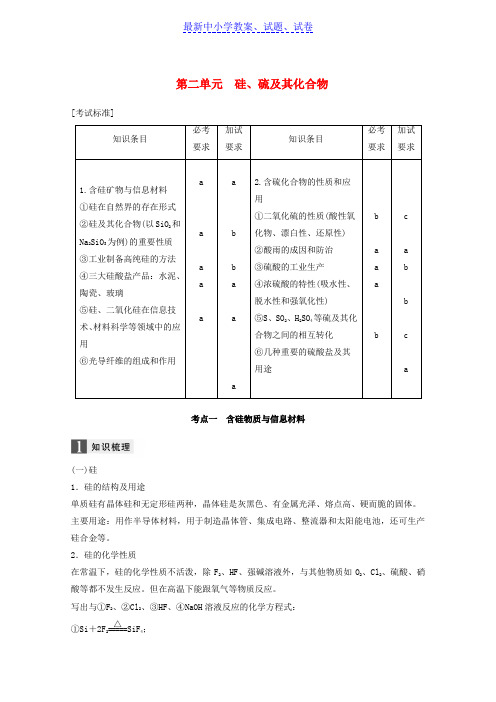
第二单元硅、硫及其化合物[考试标准]考点一含硅物质与信息材料(一)硅1.硅的结构及用途单质硅有晶体硅和无定形硅两种,晶体硅是灰黑色、有金属光泽、熔点高、硬而脆的固体。
主要用途:用作半导体材料,用于制造晶体管、集成电路、整流器和太阳能电池,还可生产硅合金等。
2.硅的化学性质在常温下,硅的化学性质不活泼,除F2、HF、强碱溶液外,与其他物质如O2、Cl2、硫酸、硝酸等都不发生反应。
但在高温下能跟氧气等物质反应。
写出与①F2、②Cl2、③HF、④NaOH溶液反应的化学方程式:①Si+2F2=====△SiF4;②Si+2Cl 2=====△SiCl 4; ③Si+4HF===SiF 4↑+2H 2↑; ④Si+2NaOH +H 2O===Na 2SiO 3+2H 2↑。
3.高纯硅的制法 (1)工艺流程石英砂――→①焦炭高温粗硅――→②Cl 2加热SiCl 4――→③H 2高温高纯硅 (2)反应原理①SiO 2+2C=====高温电炉Si +2CO↑ (石英砂)(焦炭) (粗硅) ②Si(粗)+2Cl 2=====△SiCl 4, ③SiCl 4+2H 2=====高温Si(纯)+4HCl 。
(二)二氧化硅二氧化硅晶体是硅原子和氧原子以共价键结合形成的立体网状的原子晶体。
1.物理性质SiO 2晶体的硬度大,熔、沸点高,不导电,不溶于水。
2.化学性质Si —O 键的键能很大,因而化学性质十分稳定。
(1)与碱性氧化物、强碱等反应: SiO 2+CaO=====高温CaSiO 3 SiO 2+2NaOH===Na 2SiO 3+H 2O盛放碱溶液的试剂瓶常用橡皮塞,不能用玻璃塞。
(2)与弱酸HF 的反应:SiO 2+4HF===SiF 4↑+2H 2O(氢氟酸腐蚀玻璃) (3)氧化性:SiO 2+2C=====高温Si +2CO↑ 3.用途制造光导纤维、光学仪器、玻璃原料和建筑材料等。
(三)硅酸、硅酸盐 1.硅酸(1)性质:不溶于水,酸性比碳酸弱,不能使指示剂变色,是一种白色粉末状固体。
浙江专版高考化学一轮复习含硅矿物与信息材料学案

课时3含硅矿物与信息材料[考纲导航]考点一硅、二氧化硅与信息材料[主干精讲]1.硅的存在与性质(1)硅的存在:硅在自然界中全部以化合态的形式存在,主要存在于硅酸盐及岩石中。
(2)物理性质:硅晶体的熔点高,硬度大。
(3)化学性质①常温下,性质稳定,与O2、Cl2、HNO3、H2SO4都很难反应。
但常温下,Si可以与F2、氢氟酸、NaOH溶液反应;加热或高温下能与O2、Cl2等反应。
②与氢氟酸反应:Si +4HF===SiF 4↑+2H 2↑;③与NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑; ④与O 2反应:Si +O2=====高温SiO 2。
2.硅的工业制法3.二氧化硅与二氧化碳的比较O4.硅、二氧化硅的应用 (1)硅的用途①作为半导体材料;②生产硅合金;③制造太阳能电池。
(2)二氧化硅的用途①信息高速公路的骨架——光导纤维 ②制造石英坩埚、石英玻璃、石英钟表等; ③制造电子工业的重要部件、光学仪器; ④用作工艺饰品如水晶、玛瑙等。
5.硅酸(1)物理性质:硅酸不溶于水。
(2)化学性质①弱酸性(比碳酸还弱)与NaOH 溶液反应的化学方程式:H 2SiO 3+2NaOH===Na 2SiO 3+2H 2O 。
向Na 2SiO 3溶液中通入少量CO 2的化学方程式:Na 2SiO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3。
②不稳定性硅酸受热分解的化学方程式:H 2SiO 3=====△SiO 2+H 2O 。
(3)用途硅胶可用作干燥剂,也可以作催化剂的载体等。
[典例剖析]【例1】 (2016·温州第二外国语学校高三模拟)关于硅的说法不正确的是( ) A .晶体硅的导电性介于金属和绝缘体之间,是良好的半导体 B .加热到一定温度时,硅能与氯气、氧气等非金属反应 C .利用二氧化硅与C 反应能制得粗硅D .二氧化硅性质较稳定,常温下不与任何物质反应解析 A 项,硅的导电性能介于金属和绝缘体之间,是良好的半导体材料,故A 正确;B 项,硅与氯气反应生成四氯化硅,与氧气加热生成二氧化硅,所以加热到一定温度时硅能与氯气、氧气等非金属反应,故B 正确;C 项,工业上,在电炉中用炭粉还原二氧化硅制得硅,故C 正确;D 项,硅常温下与氢氟酸、氢氧化钠反应,故D 错误。
2021高考浙江(学考)化学一轮复习讲义: 专题3 第2单元 含硅矿物与信息材料

第二单元 含硅矿物与信息材料1.硅的存在形态、物理性质(1)硅在自然界只有化合态,含量占第2位。
(2)硅是灰黑色固体,有金属光泽,熔点高,硬度大,有脆性。
2.硅的化学性质(写出化学方程式)(1)与非金属单质⎩⎨⎧O 2:Si +O 2=====△SiO 2F 2:Si +2F 2===SiF4Cl 2:Si +2Cl 2=====△SiCl4(2)与氢氟酸反响:Si +4HF===SiF 4↑+2H 2↑(特性);(3)与NaOH 溶液反响:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑(特性)。
3.工业上提纯粗硅的方法为(写出化学方程式) Si +2Cl 2=====△SiCl 4,SiCl 4+2H 2=====△Si +4HCl 。
4.二氧化硅的性质 (1)物理性质常温下为固体,不溶于水,硬度大,熔沸点高。
(2)化学性质考点2| 硅酸及其盐无机非金属材料1.硅酸——难溶性酸(1)化学性质(2)硅酸的制备及硅胶的形成①制备原理:可溶性硅酸盐(如Na2SiO3)与其他酸(如盐酸)反响:Na2SiO3+2HCl===H2SiO3(胶体)+2NaCl。
②硅胶:硅酸在水中易聚合形成硅酸凝胶,经枯燥脱水后即得硅胶。
硅胶多孔,吸附水分能力强,常用作枯燥剂和催化剂载体。
2.硅酸盐(1)Na2SiO3水溶液俗称水玻璃,常用于制作黏合剂、防腐剂和耐火材料。
(2)硅酸钠溶液在空气中易变质,反响的化学方程式为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3。
(3)硅酸盐组成的表示:通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成;如硅酸钠(Na2SiO3)可表示为Na2O·SiO2,石棉(CaMg3Si4O12)可表示为CaO·3MgO·4SiO2。
3.无机非金属材料(1)传统无机非金属材料水泥玻璃陶瓷瓷等。
(3)特殊功能的含硅物质①碳化硅具有金刚石构造,可用作磨料。
2024高考化学一轮复习核心素养测评十二含硅矿物与信息材料含解析苏教版

含硅矿物与信息材料一、选择题(本题包括4小题,每题6分,共24分)1.文物是珍贵的历史文化遗产。
下表中对文物用料和成分分析错误的是( )选项 A B C D文物用料成分分析瓷器青釉褐彩诗文执壶的用料为硅酸盐千里江山图运用的颜料铜绿的主要成分为碱式碳酸铜衍圣公朝服用料丝绸的主要成分为纤维素青铜器四羊方尊的主要成分为铜锡合金【解析】选C。
瓷器属于硅酸盐制品,主要成分是硅酸盐,A项正确;碱式碳酸铜是颜料铜绿的主要成分,B项正确;丝绸的主要成分为蛋白质,C项错误;青铜是最早运用的合金,成分为铜锡合金,D项正确。
2.(2024·海口模拟)下列叙述正确的是( )A.CO2和SiO2都是酸性氧化物,所以两者物理性质相像B.因为CaCO3+SiO2CaSiO3+CO2↑,所以硅酸的酸性比碳酸强C.CO2和SiO2都能与碳反应,且都作氧化剂D.SiO2既能和NaOH反应,又能和HF反应,所以二氧化硅属于两性氧化物【解析】选C。
CO2和SiO2都是酸性氧化物,和其物理性质无因果关系,CO2的熔、沸点低,硬度小,微溶于水,SiO2的熔、沸点高,硬度大,不溶于水,CO2和SiO2的物理性质相差较大,A项不正确;CaCO3+SiO2CaSiO3+CO2↑,反应进行的缘由是SiO2沸点高,CO2沸点低,而“较强酸制较弱酸”是溶液中复分解反应规律,B项不正确;CO2和SiO2都与碳反应,碳作还原剂,CO2和SiO2作氧化剂,C项正确;SiO2与HF反应是HF的特性,SiO2不与其他酸反应,故SiO2不属于两性氧化物,D 项不正确。
3.(2024·商洛模拟)2019年9月19日,我国在酒泉卫星放射中心实行“一箭五星”的方式胜利将“珠海一号”03组卫星放射升空。
有一种新型“连续纤维增韧”航空材料,其主要成分是碳化硅、陶瓷和碳纤维。
下列有关该新型材料的叙述正确的是( )A.耐高温但不耐腐蚀B.比钢铁轻,但质地较脆C.有固定的熔点D.是一种新型无机非金属材料【解析】选D。
1高考浙江化学一轮复习教材研读:专题三 第二单元 含硅矿物与信息材料 含解析

第二单元含硅矿物与信息材料考点考试内容考试要求含硅矿物与信息材料(1)硅在自然界的存在形式 a(2)硅及其化合物(以SiO2和Na2SiO3为例)的重要性质b(3)工业制备高纯硅的方法 b(4)三大硅酸盐产品:水泥、陶瓷、玻璃 a(5)硅、二氧化硅在信息技术、材料科学等领域中的应用a (6)光导纤维的组成和作用 a考点一碳、硅单质及其重要化合物1.判断正误,正确的画“√”,错误的画“✕”。
(1)金刚石和石墨由相同的元素组成,因此它们具有相同的性质( )(2)一氧化碳易与血液中的血红蛋白结合( )(3)向CaCl2溶液中通入CO2,无明显现象,若先通入NH3再通入CO2,溶液会变浑浊( )(4)向饱和Na2CO3溶液中通入过量的CO2气体,有晶体析出( )(5)向NaAlO2溶液中通入CO2气体,一开始有白色沉淀生成,CO2过量,沉淀溶解( )(6)向氨化的饱和食盐水中通入过量CO2气体,有晶体析出( )1.答案(1)✕(2)√(3)√(4)√(5)✕(6)√2.用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质),将所选答案的编号填入下表相应的空格内(如果不需要外加试剂,则对应答案栏不需填)。
1 / 20可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳可选用的操作:①水洗②加热③高温灼烧④过滤⑤结晶粉末状混合物选择的试剂选用的操作ⅠCaCO3(SiO2)ⅡNaCl(SiO2)ⅢSiO2(Fe2O3)ⅣSiO2(CaCO3)ⅤSiO2(NH4Cl)2.答案Ⅰ.B ④Ⅱ.D ④⑤Ⅲ.A ④Ⅳ.A ④Ⅴ./ ②或D ④1.碳、硅单质的结构、物理性质及用途碳硅在元素周期表中的位置第①二周期②ⅣA族第③三周期④ⅣA族元素在自然界中的存在形式既有游离态又有化合态只有⑤化合态单质的结构金刚石:⑥空间网状结构,石墨:层状结构晶体硅:与金刚石类似的⑦空间网状结构单质的物理性质金刚石熔点高、硬度大,石墨熔点高、质⑧软,有滑腻感,能导电晶体硅为灰黑色固体,有金属光泽、硬度大、熔点⑨高2 / 20单质的用途金刚石用作切割刀具,⑩石墨用作电极、铅笔芯晶体硅用作半导体材料、硅芯片和硅太阳能电池2.碳、硅的化学性质碳、硅在参与化学反应时,一般表现还原性。
高考化学一轮复习 专题3第3单元 含硅矿物与信息材料课件 苏教版

①与强碱溶液(如NaOH溶液)反应,化
学方程式为: SiO2+2NaOH===Na2SiO3+H2O。 ______________________________ ___
②与碱性氧化物 (如 CaO)反应,化学方程式为:
CaO+SiO2=====CaSiO3。 ____________________________________
______________________________
__。
(3)写出①、③和④反应的化学反应方程式(若
是离子反应的写离子方程式):
①______________________________; ③______________________________; ④______________________________。
应我们虽然没有学过,但是可以从二氧
化硅与氧化钙的反应迁移得来。
答案:(1)SiO2 MgO MgSiO3 (2)抑制氯化镁水解 - 2- (3)①SiO2+2OH ===SiO3 +H2O + 2+ ③MgSiO3+2H ===H2SiO3+Mg ④SiO2+Na2CO3=====Na2SiO3+CO2↑
(3)用途:黏合剂(矿物胶),耐火阻燃材料。 3.传统无机非金属材料
原料
纯碱 、 _______ 石灰石 、 __________ 石英 ____________
原理 Na2CO3+SiO2===== Na2SiO3 +CO2↑ CaCO3+SiO2===== CaSiO3+CO2↑
高温 高温
生产设备
普通 玻璃
玻璃熔炉
原料
石灰 普通 石、 硅酸 黏土 盐水 和石 泥 膏
原理
生产设备
2021高考浙江版化学一轮复习教材研读:专题三 第二单元 含硅矿物与信息材料 Word版含解析

第二单元含硅矿物与信息材料考点考试内容考试要求含硅矿物与信息材料(1)硅在自然界的存在形式 a(2)硅及其化合物(以SiO2和Na2SiO3为例)的重要性质b(3)工业制备高纯硅的方法 b(4)三大硅酸盐产品:水泥、陶瓷、玻璃 a(5)硅、二氧化硅在信息技术、材料科学等领域中的应用a (6)光导纤维的组成和作用 a考点一碳、硅单质及其重要化合物1.判断正误,正确的画“√”,错误的画“✕”。
(1)金刚石和石墨由相同的元素组成,因此它们具有相同的性质( )(2)一氧化碳易与血液中的血红蛋白结合( )(3)向CaCl2溶液中通入CO2,无明显现象,若先通入NH3再通入CO2,溶液会变浑浊( )(4)向饱和Na2CO3溶液中通入过量的CO2气体,有晶体析出( )(5)向NaAlO2溶液中通入CO2气体,一开始有白色沉淀生成,CO2过量,沉淀溶解( )(6)向氨化的饱和食盐水中通入过量CO2气体,有晶体析出( )1.答案(1)✕(2)√(3)√(4)√(5)✕(6)√2.用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质),将所选答案的编号填入下表相应的空格内(如果不需要外加试剂,则对应答案栏不需填)。
可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳可选用的操作:①水洗②加热③高温灼烧④过滤⑤结晶粉末状混合物选择的试剂选用的操作ⅠCaCO3(SiO2)ⅡNaCl(SiO2)ⅢSiO2(Fe2O3)ⅣSiO2(CaCO3)ⅤSiO2(NH4Cl)2.答案Ⅰ.B ④Ⅱ.D ④⑤Ⅲ.A ④Ⅳ.A ④Ⅴ./ ②或D ④1.碳、硅单质的结构、物理性质及用途碳硅在元素周期表中的位置第①二周期②ⅣA族第③三周期④ⅣA族元素在自然界中的存在形式既有游离态又有化合态只有⑤化合态单质的结构金刚石:⑥空间网状结构,石墨:层状结构晶体硅:与金刚石类似的⑦空间网状结构单质的物理性质金刚石熔点高、硬度大,石墨熔点高、质⑧软,有滑腻感,能导电晶体硅为灰黑色固体,有金属光泽、硬度大、熔点⑨高单质的用途金刚石用作切割刀具,⑩石墨用作电极、铅笔芯晶体硅用作半导体材料、硅芯片和硅太阳能电池2.碳、硅的化学性质碳、硅在参与化学反应时,一般表现还原性。
高三一轮复习导学案15硅及其化合物

5、随着现代科学技术的发展,一些具有特殊结构、特殊功能的新型无机非金属材料如__________________、_____________、_____________等被相继研制出来。
【重难点突破措施】
【教学流程】
【二次备课】
【板书设计】
【课堂针对训练】A确的是()
A、二氧化硅是由二氧化硅分子组成的,它的熔点高,硬度大
B、二氧化硅用于制造晶体管、集成电路
C、二氧化硅可用于制造石英钟的压电材料和光导纤维
D、二氧化硅是硅酸的酸酐,它不溶于任何酸
2、硅酸盐材料是传统的无机非金属材料,其制品性质_____,熔点_____,大都____溶于水。
3、生产玻璃的主要原料为_____________________,发生的主要的化学反应有:____________________________,___________________________。普通玻璃的主要成分为_________________________________。盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生____________________反应(用化学方程式表示),而使瓶塞与瓶口粘在一起。
向硅酸钠的水溶液中通入足量CO2离子方程式_______________________________。
【思考】①Na2SiO3+CO2+2H2O=H4SiO4↓+ Na2CO3与
②Na2CO3+SiO2 Na2SiO3+CO2↑这两个反应矛盾吗?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
十分稳定 2、化学性质:
(1)酸性氧化物:但是不溶于水,也不与水反应。 (2)常温只与氢氟酸、强碱反应 4HF+SiO2==SiF4↑+2H2O 2NaOH+SiO2==Na2SiO3+H2O (3)高温时:高温 SiO2+2C===Si+2CO↑ SiO2+CaO===CaSiO3 Na2CO3+SiO2===Na2SiO3+CO2↑ CaCO3+SiO2====CaSiO3+CO2↑
高温
573 K以上
SiHCl3(纯)
H2 1 357 K
高纯硅
①写出由纯SiHCl3制备高纯硅的化学反应方程式 1 357 K SiHCl3+H2 Si+3HCl ②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应 生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程 H2SiO3↓+3HCl↑+H2↑ 式 SiHCl3+3H2O ; H2还原SiHCl3过程中若混入O2,可能引起的后果是 氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3
已知 SiHCl3 能与 H2O 剧烈反应,在空气中易自燃.
考题再现 (3)用SiHCl3与过量H2反应制备纯硅的装置如下图所示(热源及夹持 装置略去):
①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是 . ②反应一段时间后,装置D中观察到的现象是 ;装置D不能采用 普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 . ③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气 密性,控制好反应温度以及______________. ④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取 上层清液后需再加入的试剂是________(填写字母代号). A.碘水 B.氯水 C.Na2SO3溶液 D.KSCN溶液
考题再现
[答案] (2)
(1)ACD -3 Si3N4
(3)Si3N4+12HF===3SiF4↑+4NH3↑ 强热 (4)3SiCl4+2N2+6H2=====Si3N4+12HCl
硅元素及其化合物的转化
Mg、
全局性掌控
1.SiO2是酸性氧化物,能与NaOH溶液反应(2010·山东高考T13-A)
食品中的二氧化硅: 纽崔莱蛋白粉的包装上有一个简单说明 成分:大豆蛋白、乳蛋白、卵磷脂和二氧化硅。
知识归纳
Si:半导体 SiO2:光导纤维、光学仪器、电子部件 H2SiO3:硅酸在水中聚合形成胶体, 经处理脱水用作干燥剂 Na2SiO3:黏合剂(矿物胶),耐火阻燃材料. 硅酸盐:传统无机非金属材料---水泥、玻璃、陶瓷 新型无机非金属材料--- Si、SiO2 、氮化硅陶瓷、氧化铝陶瓷
2.二氧化硅是生产光纤制品的基本原料(2010·江苏高考T4-A)
3.水玻璃可用于生产黏合剂和防火剂(2010·江苏高考T4-B) 4.用纯碱制玻璃不产生温室气体(2010·重庆高考T6-A) 5.下列物质可以满足一步转化关系:(2010·福建高考T9-D)
6.硅是构成一些岩石和矿物的基本元素
7.水泥、玻璃、水晶饰物都是硅酸盐制品
高温 高温
高温
应用于玻璃的生产 三大传统无机非金属材料
知识归纳
二氧化硅
1、物理性质:坚硬难熔的固体 (原子晶体)
熔点高,沸点高,硬度大,无色透明的固体,不导电,晶体 二氧化硅叫石英、水晶,天然二氧化硅叫硅石、石英砂。
十分稳定 2、化学性质:
(1)酸性氧化物:但是不溶于水,也不与水反应。 (2)常温只与氢氟酸、强碱反应 4HF+SiO2==SiF4↑+2H2O 2NaOH+SiO2==Na2SiO3+H2O (3)高温时:高温 SiO2+2C===Si+2CO↑ 应用于硅的生产 SiO2+CaO===CaSiO3 Na2CO3+SiO2===Na2SiO3+CO2↑ CaCO3+SiO2====CaSiO3+CO2↑
例 5 、材料科学是近年来与化学有关的科学研究的热点。某 新型无机非金属材料K由两种非金属元素组成,它的一种超硬 物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性。它是 以中学化学中的常见物质为原料来生产的。下图所示为其生产 过程,其中虚线框内转化是为探究C的组成而设, C与 H2O反 应生成E和F。G、F、H均难溶于水且为白色粉末,E的水溶 液可使紫色石蕊试液变红色;图中除M、K(均含A元素)外 均为中学化学常见物质,且3molM参加反应可以生成8molNH3。
高温 高温
高温
硅的制备 工业上: SiO2
高温
+C
高温
粗硅
+Cl2 高温
SiCl4
精馏+H2 高温
Si
SiO2+2C == 2CO+Si(含杂质的粗硅) Si+2Cl2 == SiCl4 生成的液态SiCl4经精馏、除硼、砷等,再用H2还原 SiCl4+2H2==4HCl+Si(高纯硅
高温 高温
考题再现 (2009· 台州模拟)硅单质及其化合物应用范围很广。请回答 (1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷 (SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示 焦炭 HCl 精馏 意图如下: 粗硅 石英砂 SiHCl3(粗)
全局性掌控 本节主要考点有Si、SiO2、Na2SiO3、H2SiO3的性质和
用途及SiO2的结构.
主要考查知识集中在三个方面,一是硅、二氧化硅、硅酸 盐的用途, 二是硅及其化合物的性质, 三是硅及其化合物的制备.
由于许多高科技领域的新型无机非金属材料都与硅有关,
考查形式会以硅及其化合物知识为载体与基本理论,和其 他元素及化合物相联系综合考查.
K+NH3
G
G
⑥过量CO2
△
H
⑤NaOH溶液
I
F
请回答下列问题: (1)写出化学式:单质B Si, ,化合物F H4SiO4 (2)写出下列反应的离子反应方程式:反应③
;
Ag++Cl—=AgCl
; ;
-+SiO =SiO 2-+H O 2OH 2 3 2 反应⑤
(3)写出反应④的化学反应方程式: 3Si(NH2)4 = Si3N4+。 8NH3
考题再现 (2)下列有关硅材料的说法正确的是 ABC(填字母)。 A. B. C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 D. E. (3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中, 逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解 释 。
解释:Na2SiO3和NH4Cl均能够水解,二者相互促 进,Na2SiO3水解生成H2SiO3,NH4Cl水解产生NH3
二氧化硅(SiO2)是国际食品行业允许使用的食品抗结块剂。 二氧化硅主要应用于奶粉、可可粉、糖粉、植脂末粉末、速溶 咖啡、粉状汤料及粉末香精等。
用量为0.25~2%。
磷酸三钙
实验设计 如何设计实验证明蛋白质粉中含有二氧化硅?磷酸三钙 ?
知识归纳
二氧化硅
1、物理性质:坚硬难熔的固体 (原子晶体)
熔点高,沸点高,硬度大,无色透明的固体,不导电,晶体 二氧化硅叫石英、水晶,天然二氧化硅叫硅石、石英砂。
知识归纳 新型无机非金属材料的种类和用途 材料类别 主要特性 示例 用途 汽轮机叶片、 氮化硅陶瓷 轴承、永久性 模具等 光导纤维 光缆通讯、医
高温结构 能承受高温,
陶瓷
强度高Βιβλιοθήκη 光学材料 具有光学特性疗、照明等
人造骨、人造
生物陶瓷 具有生物功能
氧化铝陶瓷
关节、接骨螺 钉
考题再现 氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳 定,工业上曾普遍采用高纯硅与氮气在1300℃反应制得. (1)根据性质推测氮化硅陶瓷的用途是______(选填代号). A.制汽轮机叶片 B.制有色玻璃 C.制永久性模具 D.制造柴油机 (2)画出N的原子结构示意图:________,试判断氮元素的最低负 价为________,请从原子结构和化合价两个角度分析推断氮化 硅的化学式:________. (3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,不与其他无机酸反 应.请写出陶瓷与氢氟酸发生复分解反应的化学方程式: ______________. (4)用四氯化硅和氮气在氢气气氛保护下,加强热使四氯化硅和 氮气发生反应,可得较高纯度的氮化硅,则反应的化学方程式 为________________________.
考题再现
高温 答案:(1)SiO2+2C=====Si+2CO↑ (2)分馏(或蒸馏) (3)①浓硫酸 使滴入烧瓶中的 SiHCl3 汽化 在此反应温度下,普通玻璃会软化
②有固体物质生成
高温 SiHCl3+H2=====Si+3HCl ③排尽装置中的空气 ④B、D
知识归纳
Si:半导体 SiO2:光导纤维、光学仪器、电子部件 H2SiO3:硅酸在水中聚合形成胶体,经处理脱水用作干燥剂 Na2SiO3:黏合剂(矿物胶),耐火阻燃材料. 硅酸盐:传统无机非金属材料---水泥、玻璃、陶瓷 新型无机非金属材料--- Si、SiO2 、氮化硅陶瓷、氧化铝陶瓷
高温 高温
高温
实验设计 如何设计实验证明蛋白质粉中含有二氧化硅?磷酸三钙 ?
一般的检验程序:
灼烧灰化---浸泡---过滤---提取---检验 《实验化学》 海带中碘元素的检验 《实验化学》 牙膏中摩擦剂的检验:二氧化硅?氢氧化铝?碳酸钙?
知识归纳
二氧化硅
1、物理性质:坚硬难熔的固体 (原子晶体)
考题再现
5.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: ①高温下用碳还原二氧化硅制得粗硅. ②粗硅与干燥的 HCl 气体反应制得 SiHCl3: 300℃ Si+3HCl=====SiHCl3+H2. ③SiHCl3 与过量 H2 在 1 000~1 100℃反应制得纯硅.
