自我总结的Westen Blot步骤
WesternBlot(步骤简略,但注意事项经验总结基本原理很全面)

Western Blot(步骤简略,但注意事项、经验总结、基本原理很全面)1、丙烯酰胺和N,N’-亚甲双丙烯酰胺,应以温热(以利于溶解双丙稀酰胺)的去离子水配制含有29%(w/v)丙稀酰胺和1%(w/v)N,N’-亚甲双丙烯酰胺储存液丙稀酰胺29g,N,N-亚甲叉双丙稀酰胺1g,加H2O至100ml。
)储于棕色瓶,4℃避光保存。
严格核实PH不得超过7.0,因可以发生脱氨基反应是光催化或碱催化的。
使用期不得超过两个月,隔几个月须重新配制。
如有沉淀,可以过滤。
2、十二烷基硫酸钠SDS溶液:10%(w/v)0.1gSDS,1mlH2O去离子水配制,室温保存。
3、分离胶缓冲液:1.5mmol/LTris-HCL(pH8.8):18.15gTris和48ml1mol/LHCL混合,加水稀释到100ml终体积。
过滤后4°C保存。
4、浓缩胶缓冲液:0.5mmol/LTris-HCL(pH6.8):6.05gTris溶于40mlH2O中,用约48ml 1mol/L HCL 调至pH6.8加水稀释到100ml终体积。
过滤后4°C保存。
这两种缓冲液必须使用Tris碱制备,再用HCL调节PH值,而不用T ris.CL。
5、TEMED原溶液四甲基乙二胺催化过硫酸铵形成自由基而加速两种丙稀酰胺的聚合。
PH 太低时,聚合反应受到抑制。
AP提供两种丙稀酰胺聚合所必须的自由基。
去离子水配制数ml,临用前配制.6. 10%过硫酸铵溶液:称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,冻存。
7、SDS-PAGE加样缓冲液:在沸水终煮3min混匀后再上样,一般为20-25ul,总蛋白量100μg。
8、Tris-甘氨酸电泳缓冲液:30.3gTris,188g甘氨酸,10gSDS,用蒸馏水溶解至1000ml,临用前稀释10倍。
PH8.39、转移缓冲液:2.9g甘氨酸、5.8gT ris碱、0.37g SDS(可不加),200ml甲醇(临用前加),加水至总量1L。
western blot实验流程(自己整理)
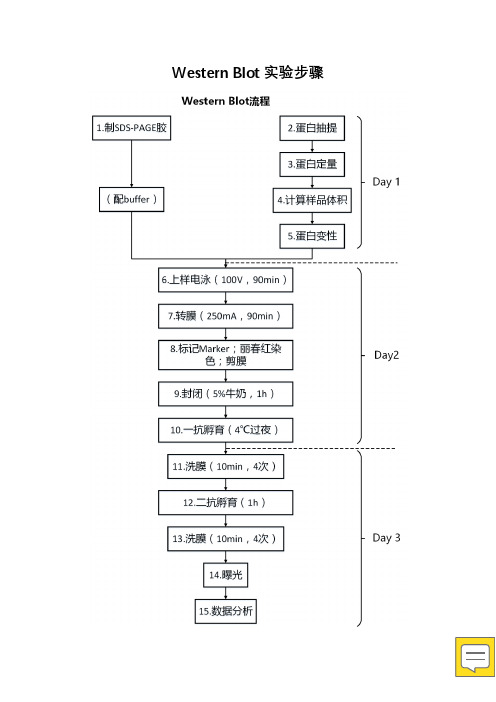
Western Blot实验步骤1.制胶2.细胞蛋白抽提步骤1.提前预冷离心机,溶解lysis buffer;2.将细胞沉淀置于冰上;1ml PBS重悬,4℃离心5min,(除去样中微量血清);3.每107cells加裂解工作液100ul,轻轻重悬细胞沉淀;4.置冰上10min,其间振荡2-3次;5.13000rpm离心10min,4℃;6.将上清转到小离心管中;7.取出1ul,用于Bradford测定蛋白浓度(ug/ul)=(样本OD值的平均值-对照OD值平均值)*斜率100℃,5min;提前预热。
中间打开盖子1~2次。
6.上样电泳(100V,90min)向电泳槽中加入电泳缓冲液,使两块玻璃内侧电泳液高于上样孔,外侧电泳槽内电泳液浸没凝胶底部。
玻璃板内侧液面高于外侧。
然后开始上样,保证每孔总蛋白量在30-50ug,总上样量小于30ul,注意上样时间尽量短,避免样品扩散。
上样完毕,盖好电泳槽的盖子,注意正负极,并选择适当的电压进行电泳。
通常在不连续的系统中,上层浓缩胶的电泳电压(建议70-80V)要低于分离胶电泳电压(建议90-110V),以达到更好的浓缩效果,使样品进入分离胶时被压缩在同一水平线上。
电泳直至溴酚蓝染料前沿下至凝胶末端处停止电泳,电泳时间约2-3 小时。
电泳时间根据具体情况定。
7.转膜(250mA,1h 30min)转膜顺序:阴极碳板+海绵+三滤+胶+膜+三滤+海绵+阳极碳板湿式电转膜1. 电泳结束后取出凝胶,在转膜缓冲液中漂洗数秒。
按“三明治”模式,打开电转印夹,每侧垫上一块专用的用转膜液浸泡透的海绵垫,再各放一块转膜液浸透的快速高效蛋白转移垫(定性滤纸),将凝胶平放在阴极侧滤纸上,最后将转膜液浸透博士德硝酸纤维素NC 膜平放在凝胶上,去除气泡,夹好电转印夹,注意NC 膜与胶,NC 膜与滤纸,滤纸与胶之间不可有气泡。
2. 转印槽加满转膜缓冲液,插入电转印夹,将转印槽放入冰箱内(-20℃),确保NC 膜最靠近正极,带负电的氨基酸和蛋白质向正极迁移。
westernblot电泳原理及步骤

westernblot电泳原理及步骤一、概述西方印迹(w es te rnb l ot)是一种重要的蛋白质分析技术,广泛应用于分子生物学和生物化学研究中。
它通过将待检蛋白质进行SD S-P AG E电泳分离,再转移到聚合物膜上,利用特异性抗原与抗体结合的原理,检测目标蛋白质的存在与表达水平。
二、原理1.SD S-PA GE电泳分离-准备样品:将待检蛋白质样品加入去离子水、蛋白质缓冲液和还原剂混合,使蛋白质变性和解聚。
-加载样品:将样品加入聚丙烯酰胺凝胶(p ol ya cr yl am id eg e l)孔上。
-电泳分离:将准备好的凝胶置于电泳槽中,通电使蛋白质在凝胶中由负极向正极运动分离。
2.转膜-准备转膜装置:将P V DF或N C膜与吸水性纸张浸泡后,叠放在转膜装置中,并按压缩成一整体。
-预处理转膜:将转膜装置放入转渍缓冲液中浸泡,使其湿润。
-转移:将电泳完的凝胶与转膜装置层叠,加上固定层叠板,施加压力进行转膜。
3.免疫检测-封闭:将转膜后的膜置于封闭液中,阻断非特异性结合位点,减少背景信号。
-孵育:将膜与目标蛋白对应的一抗抗体孵育,使其与目标蛋白特异性结合。
-洗涤:用洗涤缓冲液洗去非特异性结合的抗体。
-二抗检测:将膜与与一抗相应的辣根过氧化物酶标记的二抗孵育,二抗与一抗结合形成复合物。
-显示:加入发色底物,与酶催化反应,生成可视化的蛋白质带谱。
三、操作步骤1.准备样品-将待检蛋白质样品加入适量去离子水、蛋白质缓冲液和还原剂混合。
-完全溶解样品,可加热至95°C处理。
2.SD S-PA GE电泳分离-准备分离凝胶:根据目标蛋白质的分子量选择合适浓度的凝胶。
-加载样品:用自动吸管或微量注射器将样品均匀地加载到聚丙烯酰胺凝胶孔上。
-启动电泳:将准备好的凝胶放入电泳槽中,加入电泳缓冲液,通电进行电泳。
3.转膜-准备转膜装置:按照转膜装置的说明书操作,准备好转膜膜和膜瓶。
-预处理转膜:将PVD F或N C膜与吸水性纸张浸泡,并放入转膜缓冲液中浸泡片刻。
自己整理的western blot步骤
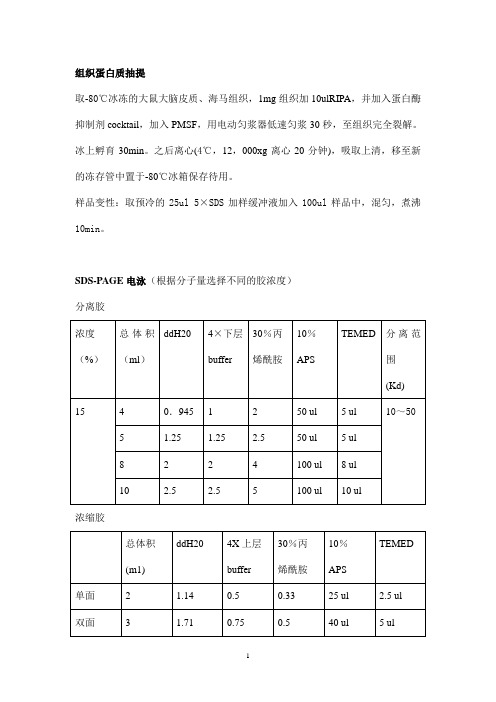
组织蛋白质抽提取-80℃冰冻的大鼠大脑皮质、海马组织,1mg组织加10ulRIPA,并加入蛋白酶抑制剂cocktail,加入PMSF,用电动匀浆器低速匀浆30秒,至组织完全裂解。
冰上孵育30min。
之后离心(4℃,12,000xg离心20分钟),吸取上清,移至新的冻存管中置于-80℃冰箱保存待用。
样品变性:取预冷的25ul 5×SDS加样缓冲液加入100ul样品中,混匀,煮沸10min。
SDS-PAGE电泳(根据分子量选择不同的胶浓度)分离胶浓缩胶灌胶、上样:取一套干净的玻璃板(0.75mm),擦拭干净,按次序放置,用固定夹夹好,固定在制胶架上。
将分离胶5 ml(or 10 m1)灌入约2/3,加水或无水乙醇或异丙醇或SDS(0.1%)或正丁醇压实,待凝后(20--30min),倒出水,滤纸吸干;将配好的2ml积层胶灌入,将梳子插入,待凝后拔出梳子。
装入电泳槽内,梳子面朝里,加入Tris-甘氨酸电泳缓冲液,内液面略高于外液面,拔出梳子,按预定顺序加样,每样品加20ul。
设预染Marker孔。
将电泳装置与电源相接,红对红,黑对黑。
凝胶上所加电压80V,当染料前沿进入分离胶后(30min),把电压提高到120V,继续电泳直至溴酚蓝刚跑出来,关闭电源。
转膜:6张滤纸l张硝酸纤维素膜把凝胶转移到一盘转移缓冲液中略为漂洗,滤纸、垫片、夹子、膜也浸入其中转膜叠放顺序:白色板-三层海绵-3层滤纸-硝酸纤维素膜-凝胶-3层滤纸-三层海绵-黑色板黑对黑,白对红,连接电源,0.33A(0.8~3.0mA/cm2),90min。
转膜槽放在冰中。
转膜完毕断开电源从上到下拆卸转移装置,用镊子(防手上蛋白污染膜)逐一掀去各层丽春红检测:用丽春红检测有无条带,用TBST冲洗直至红色条带消失封闭:封闭液(含10%脱脂奶粉的TBST)封闭2h,室温,一般20~24℃TBST稍微洗一下或不洗即可进行抗体孵育一抗孵育:适宜稀释倍数一抗(一般用TBST稀释,含2%的BSA(牛血清白蛋白,为终浓度))孵育置于湿盒中,4℃冰箱孵育过夜(12h以上),或室温孵育3h,均在摇床上TBST洗膜10mi n×3次二抗孵育:适当稀释倍数HRP标记的二级抗体,置于湿盒中,室温孵育2hTBST洗膜10mi n×3次抗体孵育及TBST漂洗过程都在摇床上进行。
WesternBlot操作流程

WesternBlot操作流程Western Blot操作流程本⼈将⾃⼰做WB实验时的具体操作流程,做了详细的记录并整理。
因为每个实验室的条件不⼀样,所以本流程仅供参考,具体适合⾃⼰的实验操作需要⼤家摸索。
由于知识量有限,有些描述⽤词并不专业,请⼤家谅解。
⼀、流程图制胶→→电泳跑胶(1.5-2.5h)→→转膜(3h)→→(可使⽤⽴春红检测是否蛋⽩是否成功转移)TBST清洗(10min)→→封闭(2h)→→TBST清洗(10min)→→附Ⅰ抗(内参:⼩⿏抗β-Actin,先摇床轻摇30min,再放冰箱4度过夜)→→TBST 清洗三次(10min/次)→→附Ⅱ抗(内参:⼭⽺抗⼩⿏,轻摇1.5h)→→TBST清洗三次(10min/次)→→显影⼆、物料及配制1、电泳液:⼀包电泳粉+1000ml双蒸⽔(可回收使⽤)2、10%过硫酸铵:1g过硫酸铵+10ml双蒸⽔3、转膜液:⼀包转膜粉+800ml双蒸⽔+200ml甲醇(可回收使⽤)4、TBST溶液:50ml 20*TBS+950ml双蒸⽔+1ml吐温20。
(⽆需回收)5、封闭液:购买6、Ⅰ抗(内参):将⼩⿏抗β-Actin:Ⅰ稀释液按1:500稀释待⽤,4度保存。
Ⅰ抗(⽬的蛋⽩58kDa):将smad2:Ⅰ稀释液按1:1000稀释待⽤,4度保存。
7、Ⅱ抗(内参):将⼭⽺抗⼩⿏:Ⅱ抗稀释液按1:5000稀释代⽤,4度保存。
Ⅱ抗(⽬的蛋⽩58kDa):将⼭⽺抗兔:Ⅱ抗稀释液按1:5000稀释待⽤,4度保存。
7、显影液:按说明书配制,避光可长期回收使⽤8、定影液:按说明书配制,可长期回收使⽤9、发光液:超敏发光液A液:B液=1:1三、步骤(⼀)制胶1、Tris-⽢氨酸SDS-PAGE聚丙烯酰胺凝胶电泳分离胶溶液的配制2、Tris-⽢氨酸SDS-PAGE聚丙烯酰胺凝胶电泳5%积层胶所⽤溶液3、1)将规格1.0mm或其它规格的玻璃板固定好。
2)依次将所需试剂加⼊烧杯中,加⼊TEMED之后,混匀,⽤1000ml的移液枪沿玻璃板缝左右两边的⾓交替加⼊分离胶溶液,也可从左到右连续加⼊(⽬的:两种⽅法都可以使液⾯快速达到⽔平状态)。
--Western blot 详细步骤(中文版)

Western blot 步骤一、蛋白样品制备1.细胞样品:弃去培养基→预冷PBS洗涤3次→弃去PBS,加入细胞裂解液和蛋白酶抑制剂,冰上轻摇裂解30min→将裂解液及细胞碎片移至离心管→4℃下12000rpm离心5min→取少量上清,BCA法测定蛋白浓度→其余上清加入蛋白上样缓冲液,煮沸变性,-80℃保存。
2.组织样品:直径5mm组织放入1.5ml EP管→加入RIPA和蛋白酶抑制剂→冰上剪碎→电动匀浆器间歇匀浆1min→间断超声破碎2min→4℃下12000rpm离心5min→取少量上清,BCA法测定蛋白浓度→其余上清加入蛋白上样缓冲液,煮沸变性,-80℃保存二、电泳、转膜1.组装制胶版,按目的蛋白分子量配制7ml对应浓度的分离胶液,摇匀后迅速灌胶至胶板2/3高度。
2.以ddH2O封闭胶液,室温下静置30分钟。
倾去覆盖水层,以滤纸小心吸去剩余的水。
3.配制5%积层胶3ml,迅速混匀,加到分离胶上至胶版上缘,小心插入梳子,室温下聚合时间1h。
4.将聚合好的两块胶安装至电泳槽中,倒入1×电泳缓冲液5.将取等质量蛋白样品及蛋白Ladder,每孔上样10-20μL。
6.接通电源,积层胶电压为60V。
7.待溴酚兰电泳至积层胶与分离胶分界处,将电压调为100V继续电泳,待溴酚兰电泳至底部时终止电泳,小心取胶,放置于转膜缓冲液中。
8.剪下同样大小的PVDF膜,甲醇浸泡30秒后转膜缓冲液轻漂洗。
9.组装“三明治”,以恒定电流350mA转膜2小时10.转膜完毕后,取出PDDF膜,蛋白面向上,5%脱脂奶粉室温下轻摇封闭2小时。
11.取出PVDF膜,吸去表面奶液后放入杂交袋,蛋白面向上,一抗TBS稀释后加入杂交袋,4℃孵育过夜。
12.取出PVDF膜,1×TBS摇床漂洗10分钟,漂洗3次后放入杂交袋。
13.二抗TBST稀释后加入杂交袋,室温孵育2小时。
14.以1×TBST洗膜三次,每次10分钟。
westernblot法

Western blot,也称为蛋白质印迹或免疫印迹,是一种常用的生物化学技术,用于分析样品中特定蛋白质的存在、细胞中特异蛋白质的半定量分析以及蛋白质分子的相互作用研究等。
下面是Western blot的基本步骤和注意事项:一、实验步骤蛋白样品制备:从细胞或组织中提取蛋白质样品,常用的方法有细胞裂解、组织匀浆等。
蛋白定量:使用BCA蛋白浓度测定法等对蛋白质样品进行定量,以便后续的Western blot分析。
凝胶电泳:将蛋白质样品在聚丙烯酰胺凝胶中电泳分离,根据蛋白质的大小和电荷进行分离。
转膜:将电泳分离后的蛋白质样品转移到硝酸纤维素膜上,以便进行后续的免疫检测。
免疫检测:使用特异性抗体对转移后的蛋白质样品进行免疫检测,抗体与目标蛋白质结合后,通过显色反应呈现阳性结果。
数据分析:对免疫检测结果进行定量和定性分析,如条带大小、灰度值等。
二、注意事项实验前要充分了解实验原理和操作流程,确保实验的正确性和可行性。
蛋白样品制备过程中要保证细胞或组织充分裂解和匀浆,以获得更纯的蛋白质样品。
在进行Western blot分析前,要对蛋白质样品进行定量,以保证实验结果的准确性。
在转膜过程中,要选择合适的转移缓冲液和转移时间,以保证蛋白质样品的完整转移。
在免疫检测过程中,要选择合适的抗体和显色试剂,以保证免疫检测结果的特异性。
在数据分析过程中,要选择合适的分析方法和软件,以保证数据分析的准确性和可靠性。
总之,Western blot是一种常用的生物化学技术,在蛋白质分析领域具有广泛的应用价值。
在进行Western blot实验时,要严格遵守实验步骤和注意事项,以保证实验结果的准确性和可靠性。
Western blot实验技术全攻略!附详细操作步骤

随着生物学领域的不断发展,Western blot(蛋白质印迹)实验技术已成为研究蛋白质表达和相互作用的重要手段。
本文将为大家提供一份Western blot实验技术全攻略,附详细操作步骤,希望对大家的科研工作有所帮助。
Western blot实验技术全攻略第一步:制备样品Western blot实验需要使用蛋白质样品,因此首先需要制备样品。
一般来说,可以从细胞、组织或生物液中提取蛋白质。
提取蛋白质的方法有很多种,例如细胞裂解、超声波破碎、切片法等。
提取后的样品需要通过蛋白质定量方法确定蛋白质的浓度。
第二步:电泳分离蛋白质将制备好的样品经过蛋白质电泳分离,将蛋白质分离成不同的带状条带。
电泳分离可以采用SDS-PAGE或非变性PAGE方法。
SDS-PAGE适用于大多数蛋白质,这种方法可以将蛋白质分离成不同的分子量带状条带。
非变性PAGE则适用于大分子蛋白质和蛋白质复合物的分离。
第三步:转移蛋白质将分离好的蛋白质转移到聚丙烯酰胺凝胶膜(PVDF)或硝酸纤维素膜(NC)上。
转移蛋白质可以采用湿式电转移或半干式电转移方法。
湿式电转移适用于小分子蛋白质的转移,而半干式电转移则适用于大分子蛋白质的转移。
第四步:阻断和孵育将转移膜放入含有牛血清白蛋白(BSA)或非脂类干奶粉的TBST中,进行阻断。
然后将膜孵育于含有一定浓度的一抗体的TBST中,以便与目标蛋白结合。
第五步:检测和成像将膜孵育于含有适量的二抗体的TBST中,以便与一抗体结合。
二抗体通常被标记为辣根过氧化物酶(HRP)或碱性磷酸酶(AP)。
在使用HRP的情况下,将膜浸泡在ECL底物中,然后用射线或荧光成像系统观察蛋白质的信号。
在使用AP的情况下,将膜浸泡在BCIP 和NBT底物中,然后用射线或荧光成像系统观察蛋白质的信号。
下面是Western blot实验的详细操作步骤:1. 蛋白质提取:将待测样品(如细胞、组织等)进行裂解,以获得蛋白质样品。
2. SDS-PAGE电泳:将蛋白质样品进行电泳分离,以分离不同大小的蛋白质。
westernblot原理及过程

westernblot原理及过程
1、Western Blot的原理是:蛋白质是带电的,在聚丙烯酰胺凝胶中通过SDS-PAGE分离蛋白质后,蛋白质被固定在凝胶中。
当凝胶被转移到支持物(例如NC膜或PVDF膜)上时,蛋白质在膜上保留其电荷。
通过针对特定氨基酸序列的特异性抗体作为探针检测蛋白质的位置。
这种技术的作用是对细胞或组织提取的蛋白混合物中的某一特异蛋白进行鉴别和半定量分析。
2、Western Blot的过程大致分为以下几步:
蛋白提取:从细胞或组织中提取总蛋白质混合物。
蛋白定量:确定凝胶中蛋白质的浓度。
SDS-PAGE电泳:通过SDS-PAGE分离蛋白质混合物。
电转印:将分离的蛋白质从凝胶转移到支持物(例如NC膜或PVDF 膜)上。
封闭:用含有去污剂和牛血清白蛋白的溶液处理膜,以封闭膜上的任何未结合位点。
抗原-抗体免疫反应:使用特异性抗体检测目标蛋白质的位置。
蛋白检测:使用化学发光剂检测膜上的目标蛋白质。
Western blot(蛋白印迹法)详细步骤

Western blot(蛋白印迹法)详细步骤一、组织的研磨准备:研钵、研磨棒、EP管、药匙、液氮、液氮匙、自封袋、一次性手套、棉手套步骤:①用研磨棒将装有冻存组织的EP管敲碎,取出组织,在研钵中盛满液氮,用力敲碎组织,研磨。
②研磨过程中一旦液氮干了,立即加入液氮,保持研磨在液氮中进行,直至组织呈干粉状。
③用在液氮中浸泡过的药匙将研磨好的粉末盛入新的EP管中。
④装有组织粉末的EP管现在液氮中保存,待所有组织都研磨结束后装入自封袋,于-80℃保存。
注意:1.研钵使用前要用锡纸包口、研磨棒用锡纸包头,在烘箱中烘烤180℃至少3h 以上。
2.组织研磨成粉末后待液氮全部挥发后再将组织粉末装管。
3.每种样品都最好留有副管,备用。
二、裂解提蛋白准备:裂解液配制比例RIPA:PMSF=1000:10=100:1若需要加入蛋白酶抑制剂,则比例一般为1:1000(即1ml裂解液加1μl蛋白酶抑制剂)步骤:①将RIPA和PMSF按比例混匀,加入到装有组织粉末的EP管中,一般加入300~500μl左右(浓度尽量高点)。
②盖好盖子,在冰上裂解30~40min.③到时间后于4℃,12000rpm离心10min,取上清液转移到新的离心管中,于-20℃保存。
注意:1.裂解液加入后用手指弹一下混匀,当加入量很少时,成粘稠状,有必要时应用枪头混匀。
三、BCA法测定蛋白浓度(BCA试剂盒)准备:BCA试剂盒(BCA试剂A、BCA试剂B、蛋白标准液)、酶标板、酶标仪、摇床步骤:①按1:15或1:30稀释待测样品,即取1μl样品+14μl水。
③按50体积BCA试剂A加1体积BCA试剂B(50:1)根据样品数量配制BCA工作液。
④每个标准品孔加入200μl BCA工作液,样品孔加入待测样品10μl和200μlBCA工作液,充分混匀,在摇床上震荡30s,37℃放置30min,于492nm下测定OD值。
⑤标准曲线以蛋白含量(μg)为横坐标,吸光度为纵坐标,根据样品的吸光度可以在标准曲线上查得相应的蛋白含量。
WB操作步骤-自己整理

Western Blot 相关实验方法与试剂(湿转法)人工肝实验室学习姚瑶(一)目的蛋白提取:(1)单层贴壁细胞总蛋白的提取:1、倒掉细胞培养液,加入Hanks液洗涤一次后倒掉,根据所用细胞决定是否用胰酶消化,加入适量(约5ml)新鲜细胞培养液后,将贴壁细胞吹起,并转移至4支离心管内,配平后,1500转离心10min。
2、倒掉上清,用4度预冷PBS溶液洗涤沉淀,1500转离心10min。
共洗三次,每次十分钟。
3、倒掉上清,吸净,每管加入50ul 细胞裂解液RIPA,吹散,加入后由于DNA的释放可迅速变粘稠,故应尽快转移至1.5ml EP 管内,-20℃裂解30min。
4、超声波细胞裂解仪上将各管裂解15s。
(可不做)5、4℃,12000转离心10min。
6、将上清转移至0.5ml EP管中,每管100ul,冰浴待用。
(2)组织中总蛋白的提取:1、取约100mg肝组织于研磨器内,加入500ul 细胞裂解液RIPA,研磨后吸出于1.5ml EP管内,再加入500ul RIPA,研磨后吸出于上EP管内。
冰上裂解30min。
2、配平后,4℃,14000转离心10min。
3、将上清分装于0.5ml EP管内,每管100ul,冰浴待用(二)蛋白含量的测定:1、稀释标准品:10ul标准品C液+90ul PBS溶液,混匀。
2、按0、1、2、4、8、12、16、20ul将稀释后的标准品加入于96孔板内,并用PBS将各孔补足20ul。
3、将第2、3排96孔板分别加入样品1ul、0.5ul,(可采用倍比稀释法),并用PBS将各孔补足20ul。
4、配制工作液:按A液:B液=50:1配制适量工作液,每孔加入200ul。
5、37℃水浴30min。
6、酶标仪测定各孔OD值(A570,Mode1)。
7、绘制标准曲线,计算样品蛋白浓度。
(三)SDS-PAGE电泳:(1)清洗玻璃板(2)灌胶与上样:1、配胶:根据目的蛋白的大小,决定分离胶的浓度。
Western Blot 实验步骤(自己总结)

Western Blot步骤北京协和医学院 阜外心血管病医院 心外科 心血管病国家重点实验室吴益和一.心肌总蛋白提取(一)——TRIzol® Reagent蛋白质的提取1. 准备试剂:异丙醇;含0.3M盐酸胍的95%乙醇;无水乙醇; 1%SDS。
1. 含0.3M盐酸胍的95%乙醇:盐酸胍(分子量95.53):95%乙醇=14.3295g:500ml2.1%SDS:SDS:H2O=0.5g:50ml2. 操作步骤:1. 取沉淀DNA后剩余的上清,用异丙醇沉淀蛋白质。
每使用1ml TRIzol加1.5ml异丙醇,室温放置10分钟,2~8℃12000×g离心10分钟弃上清;2. 准备0.3M盐酸胍(guanidine hydrochloride)的95%乙醇洗涤液;3. 用含0.3M盐酸胍(guanidine hydrochloride)的95%乙醇洗涤蛋白质沉淀。
每使用1ml TRIzol加2ml洗涤液,室温放置20分钟(Note: .蛋白质沉淀可保存在含0.3M盐酸胍的95%乙醇中2~8℃一个月以上或-20℃一年以上);4. 2~8℃7500×g离心5分钟,弃上清;5. 重复3-4两次以上;6. 在三次洗涤后加2ml无水乙醇到蛋白质沉淀中,涡旋混匀15秒(Note: .蛋白质沉淀可保存在无水乙醇中2~8℃一个月以上或-20℃一年以上);;7. 室温下孵化20分钟;8. 2~8℃7500×g离心5分钟,弃上清;9. 风干蛋白质沉淀5-10分钟(可以延长时间直到满意为止),不要干燥过度;10.蛋白质重悬浮:1)用1% SDS(十二烷基硫酸钠)溶解蛋白质(200 μL),反复吸打,50℃温浴使其完全溶解;2)2~8℃10000×g离心10分钟除去不溶物;3)将包含蛋白质的上清转移到新的EP管中(此时分离得到的蛋白质样品可直接用于Western Blot(之前先测浓度)或-20℃保存备用);4)因为不同溶剂中某些蛋白质的溶解性不同,SDS溶液中蛋白质的可溶性差,如果蛋白质沉淀在SDS溶液中不可溶,那么可以选择下面的溶剂(Hummon et. al., 2007)来溶解蛋白质沉淀:1% SDS and 62.5 mM sarkosyl(肌氨酰:裂解病毒颗粒或感染细胞的一种去污剂)at pH 8.0–8.8; 9.5 M urea and 2% CHAPS, pH 9.1; 250mM glycerol(甘油), 10mM TEA, and 4% CHAPS; 2% diethylamine(二乙胺); 10M Urea(尿素)。
western blot 超详细步骤

一、蛋白质的样品制备:一、溶液:裂解液及蛋白酶抑制剂(每毫升裂解液加20ulcocktail)二、操作步骤:1、6孔板置于冰上,细胞经预冷的PBS漂洗3次,每孔加入100μl裂解液,5min 后用细胞刮刀刮取细胞,用枪头转移至1.5mlEP管中,编号置于冰上。
2、以上所得的样品用超声细胞破碎仪超声处理,超声时间为3S,间歇时间为10S,重复三次。
3、于4℃离心机(预冷)12000r离心15min,取上清,收集于0.5mlEP管中。
二、蛋白浓度的测定(BCA法测定蛋白浓度)1.取标准蛋白(2mg/ml)备用。
2.于标准蛋白稀释为2mg/ml 1mg/ml 0.5 mg/ml 0.25 mg/ml 0.125mg/ml 0mg/ml,96孔板中每孔加入10ul,设3个复孔,待测蛋白稀释8倍,每孔加入10ul,设3个复孔,每孔加入BCA工作液(A液:B液=50:1混匀)90ul,37℃温浴30min,酶标仪测出各吸光度值,EXCEL输入数据,绘制标准曲线。
测出待测蛋白浓度。
测完蛋白含量后,计算含30、50μl蛋白的溶液体积即为上样量。
按上样量取出样品至0.5ml的EP管中,加入5×SDS 上样缓冲液至终浓度为1×。
后蛋白于95℃煮5min(干湿温箱预热)。
样品于-80℃保存。
三、电泳1.制胶分离胶:电泳凝胶浓度试剂 10%H2O(ml) 4.030%丙烯酰胺 3.31.5mol/lTris.cl(PH8.8) (ml)2.510%SDS(ml) 0.110%AP(ml) 0.1TEMED(μl) 5总体积(ml) 10浓缩胶试剂浓度(5%)H2O(ml) 230%丙烯酰胺(T: 30%,C: 3%(ml) 0.51.0mol/lTris.cl(PH8.8) (ml) 0.510%SDS(μl) 4010%AP(μl) 30TEMED(μl) 4总体积(ml) 31、玻璃板对齐后放入夹中卡紧。
western blot 全过程 详细步骤

一:提蛋白:1.PBS洗2遍,加RIPA 80-100ul(含10xcooktail)。
2.在冰上刮到离心管中,在冰上裂解20-30min。
3.4度离心,13000rpm、10-15min(准备新的离心管、配BCA 200ul/每孔(A:B=50:1)、96孔板加PBS(2个对照组20ul,实验组18ul))。
4.取上清转移到新离心管中,记住转移的体积。
5.96孔板中每孔加2ul蛋白液。
6.每孔加200ulA/B混合液。
7.37度半小时。
8.测浓度以及标化用一起在libo文件夹找模板,最后得到每组需要加的RIPA以及loding buffer,还有标化后的浓度。
562波长0.046斜率(实验组值-对照组值)/斜率=浓度浓度最好在4-8ug/ul最好,跑胶时就可以只加10ul蛋白液(蛋白含量40-80ug)9.加好对应的RIPA以及loding buffer后,煮蛋白5-15min,-20度保存。
二:跑胶1. 1.0玻板,洗干净2.配制10%或者12%分离胶一块胶需要5ml3.灌分离胶,在分离胶上层灌无水乙醇4.配制5%浓缩胶2块胶需要4ml5.待分离胶干后,灌浓缩胶,插梳子6.待胶干后,将胶及玻板一起放入电泳槽,拔梳子,倒入1*running buffer(上腔灌满,下腔过电线丝)7.预电泳,100v,10-15min8.加样(蛋白样品及marker)10ul,marker 5ul9.60v 10-20min,之后100-110v三:转膜1.配transfer buffer ,用10*transfer buffer 稀释10倍,并加20%甲醇2.transfer buffer浸泡海绵、滤纸3.pvdf膜,甲醇泡1分钟,清水洗2次,泡在transfer buffer里20min4.胶取出,在transfer buffer里泡10min5.黑胶白膜(一层海绵,2层滤纸)6.转膜100v,1—1.5h(黑对黑,冰板,在冰里跑)四:封闭、一抗、二抗1.5%脱脂奶粉(pbst溶)1h 37度2.一抗4度12h3.pbst洗膜,3次,每次10min4.二抗(1:5000)1h 37度5. pbst洗膜,3次,每次10min6.显影剂A和B各300ulPBST:1000ml’PBS+1mltween5%脱脂奶粉:100mlPBST+5g脱脂奶粉10*running buffer:tris 30.3g 甘氨酸144.1g sds 10g 加水至1000ml10*transfer buffer:tris 30.3g 甘氨酸144.1g 加水至1000ml1* transfer buffer:100ml10*transfer buffer 200ml甲醇加水至1000ml。
Western blot步骤与经验总结

Western bloting经验总结1.试剂准备详细参考试剂配方2.制胶2.1 准备好制胶器,玻璃板务必要干净,否则容易产生气泡或使胶不平;玻璃板需卡紧,先用1ml H2O试探,以防漏胶。
将水倒去后用滤纸把残留在玻璃板上的水吸去(轻轻的,不要使卡紧的玻璃板松动)。
2.2 配胶:按需要配制适当浓度的胶,如上表及SDS-PAGE分离胶配方表。
充分混匀,尽量不要弄出气泡(可以轻轻快速旋转配胶用的烧杯30 s到1min,切莫太快以免液体溅出,如图所示[不是自转];若用枪反复吹打,不要太快以免产生大量气泡)2.3 将胶慢慢加入到玻璃空隙中。
枪头可残留部分液体,以免把气泡打进玻璃板间,胶约7 ml(1.5mm厚,六一24D型)。
2.4 压胶:用无水乙醇或水轻轻地沿板加入,每块胶上加600 ul-1000 ul。
放于室温或37℃,务必放平,不平则胶歪,导致显出的蛋白条带歪曲。
2.4 20 min后倒去无水乙醇或水,用滤纸吸干。
(若胶不凝,可放30 min,再不凝的话就要考虑,10%AP溶液是否过期(有效一周)或浓度是否配错,是否忘记加促凝剂TEMED)。
2.5 配制浓缩胶(5%)并混匀,插好梳子,轻轻从梳子两端缝隙加入浓缩胶,直到胶快溢出梳子(溢出也无妨),检查是否有气泡,若有,将梳子轻轻拔出,重新插好。
放于室温或37℃,30分钟(浓缩胶较稀,时间要长些)3.冲洗加样孔:小心拔出梳子,若加样孔扭曲变形,可用针头将其扶正(勿将针头插到胶中),先加部分1×SDS-PAGE 电泳缓冲液到内槽,用枪头吸电泳液轻轻冲洗加样孔,以排除气泡。
4.排除槽底的气泡:将内置电泳槽放在外槽中,加入1×SDS-PAGE 电泳缓冲液(外槽液,可以是内槽回收液)溢过底部胶(液面离底部3-4cm即可),倾斜整个电泳槽,反复提起放下内电泳槽,直至完全排除内槽底的气泡。
5.上样:蛋白样本与一定比例的上样buffer(5×)4:1混匀,沸煮3-5分钟。
Westernblot实验步骤及注意事项

Westernblot实验步骤及注意事项Westernblot 实验步骤1. 组织块称重2. 利用液氮、研钵粉碎组织块3. 加入RIPA缓冲液(每克组织3 ml RIPA),PMSF(每克组织30μl,10 mg/ml PMSF),利用Polytron进一步匀浆(15,000转/分*1分钟)维持4℃4. 加入PMSF(每克组织30μl,10 mg/ml PMSF),冰上孵育30分钟5. 移入离心管4℃约20,000 g(约15,000转)15分钟6. 上清液为细胞裂解液可分装-20℃保存7. 进行Bradford比色法测定蛋白质浓度8. 取相同质量的细胞裂解液(体积*蛋白质浓度),并加等体积的2×电泳加样缓冲液9. 沸水浴中3分钟10. 上样11. 电泳(浓缩胶20mA,分离胶35mA)12. 电转膜仪转膜(100mA 40分钟)13. 膜用丽春红染色,胶用考马斯亮蓝染色14. Westernblot 试剂盒显色15. 分析比较记录western blot的实验步骤及注意事项的资料1. 把聚丙烯酰胺凝胶中的蛋白质电泳转移到硝酸纤维膜上。
1)转移缓冲液洗涤凝胶和硝酸纤维素膜,将硝酸纤维素膜铺在凝胶上,用5ml 移液管在凝胶上来回滚动去除所有的气泡。
2)在凝胶/滤膜外再包一张3mm滤纸(预先用转移缓冲液浸湿),将凝胶夹在中间,保持湿润和没有气泡。
3)将此滤纸/凝胶/薄膜滤纸按照厂家建议方法放入电泳装置中,凝胶面向阴极。
4)将上述装置放入缓冲液槽中,并灌满转移缓冲液以淹没凝胶。
5)按照厂家所示接通电源开始电泳转移。
6)转移结束后,取出薄膜和凝胶,弃去凝胶。
2. 将薄膜漂在氨基黑中快速染色,直至分子量标准显现时取出,记录下标准位置。
3. 用100ml水洗涤纤维素膜,必要时可用脱色缓冲液。
4. 膜置印迹缓冲液中于37℃保温1小时。
5. 室温下,用PBS-Tween缓冲液洗涤薄膜。
6. 用封口机将薄膜封入塑料袋中,尽可能不留空气。
Western-Blot 操作流程及个人心得体会

Western-Blot 操作流程及个人心得体会(二)作者:未知时间:2010-5-25 10:26:33Western操作步骤(一)蛋白样品制备(1)单层贴壁细胞总蛋白的提取:1. 倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
2. 每瓶细胞加3ml 4℃预冷的PBS(0.01M pH7.2~7.3)。
平放轻轻摇动1min 洗涤细胞,然后弃去洗液。
重复以上操作两次,共洗细胞三次以洗去培养液。
将PBS 弃净后把培养瓶置于冰上。
3. 按1ml 裂解液加10 μl PMSF(100mM),摇匀置于冰上。
(PMSF要摇匀至无结晶时才可与裂解液混合)4. 每瓶细胞加400 μl 含PMSF的裂解液,于冰上裂解30min,为使细胞充分裂解培养瓶要经常来回摇动。
5. 裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至1.5ml 离心管中。
(整个操作尽量在冰上进行)6. 于4℃下12000rpm 离心5min。
(提前开离心机预冷)7. 将离心后的上清分装转移倒0.5min 的离心管中放于-20℃保存。
(个人感觉上述方法可操作性有待加强,细胞中蛋白本来就很少,一瓶50ml的细胞有时按照实验要求只能加100~200μl 的裂解液,按照上述操作,直接用200μl 裂解液进行裂解,根本就不够瓶壁上沾的。
本人是先用预冷的PBS(一般数毫升)加入后,用细胞刮刮下细胞,转移至试管中,如果数瓶细胞是收集同一蛋白的,可以放在同一试管,离心后再将蛋白转移到EP管中,这样可操作性就比较强)(2)组织中总蛋白的提取:1. 将少量组织块置于1~2ml 匀浆器中球状部位,用干净的剪刀将组织块尽量剪碎。
2. 加400 μl 单去污剂裂解液裂(含PMSF)于匀浆器中进行匀浆。
然后置于冰上。
3. 几分钟后再碾一会儿再置于冰上,要重复碾几次使组织尽量碾碎。
westernblot原理及步骤

westernblot原理及步骤Western blot原理及步骤。
Western blot,又称免疫印迹法,是一种用于检测特定蛋白质的方法。
它能够通过识别蛋白质在膜上的位置来确定其分子量,并且可以检测蛋白质的表达水平。
本文将介绍Western blot的原理及步骤,希望能够帮助读者更好地理解和应用这一技术。
1. 原理。
Western blot的原理基于蛋白质的电泳分离和免疫检测。
首先,待检测的蛋白样品经过SDS-PAGE凝胶电泳分离,然后将分离后的蛋白转移到膜上。
接着,膜上的蛋白与特异性抗体结合,再经过化学发光或染色等方法来检测目标蛋白的存在和表达水平。
2. 步骤。
(1)蛋白样品制备,将待检测的蛋白样品加入SDS-PAGE凝胶电泳缓冲液,使其蛋白质变性并带有负电荷,然后进行蛋白定量。
(2)SDS-PAGE凝胶电泳,将蛋白样品加载到聚丙烯酰胺凝胶中,然后进行电泳分离,使蛋白质按照大小分子量在凝胶中迁移。
(3)蛋白转膜,将分离后的蛋白转移到膜上,通常使用的是聚偏氟乙烯(PVDF)或硝酸纤维素膜。
转膜的方法有湿式转膜和半干式转膜两种。
(4)膜上抗体结合,将蛋白转膜后的膜进行封闭,然后与特异性的一抗抗体结合,再与辅助抗体结合。
(5)信号检测,通过化学发光或染色等方法来检测膜上蛋白的存在和表达水平,如辣根过氧化物酶(HRP)发光、碱性磷酸酶(AP)发光、共价结合荧光素等。
3. 注意事项。
(1)蛋白样品制备要避免蛋白降解和失活,通常在样品中加入蛋白酶抑制剂和磷酸酯酶抑制剂。
(2)SDS-PAGE凝胶电泳要注意电泳条件的选择,如电压、时间和电流密度等。
(3)蛋白转膜后的膜要保持湿润,避免膜的干燥和破裂。
(4)抗体结合和信号检测要根据实验需要选择合适的抗体和检测方法,以确保结果的准确性和可靠性。
4. 应用。
Western blot广泛应用于生物医学研究中,如检测蛋白质的表达水平、鉴定蛋白质、研究蛋白质相互作用等。
我的western-blot实验经验总结

我的western-blot实验经验总结
Western-blot实验是一种常用的免疫学分析方法,用于检测蛋白质的存在、定量和分子量。
在进行这项实验时,需要经过以下几个步骤:
1. 样品制备:首先需要从细胞或组织中提取蛋白质,并将其分离成不同的组分。
这可以通过各种方法来完成,例如细胞裂解、电泳分离等。
2. 凝胶制备:将分离的蛋白质样品加载到聚丙烯酰胺凝胶中,通过电泳分离蛋白质,使其根据分子大小以不同的速度移动。
3. 转移:将凝胶中分离的蛋白质转移到聚丙烯酰胺或聚偏氟乙烯膜上,以便进行进一步的免疫学分析。
4. 免疫学反应:使用特定的抗体识别目标蛋白质,并进行免疫学检测。
这包括将蛋白质与一种或多种特定抗体反应,再使用荧光标记或酶标记的二抗进行检测。
5. 成像和数据分析:使用特定的成像方法,例如荧光显微镜或化学发光成像,来可视化免疫学反应结果。
然后进行数据分析,例如测量蛋白质的强度、定量分析等。
在进行Western-blot实验时,需要注意一些常见问题,例如蛋白质分离不完全、
抗体不充分、背景噪音等。
为了获得准确和可重复的结果,需要仔细控制实验条件、进行质量控制和标准化操作。
蛋白质印迹(Western blotting)实验操作步骤

蛋白质印迹/Western blotting实验操作步骤一、总蛋白的提取单层贴壁细胞总蛋白的提取:1)吸除培养液2)每皿细胞加4℃预冷的 PBS。
平放轻轻摇动 1min 洗涤细胞,然后弃去洗液。
重复上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
(PBS会降低细胞裂解液的效价和总蛋白的浓度)3)加裂解液于冰上裂解 30 min,为使细胞充分裂解,培养瓶要经常来回摇动(可放置在4℃摇床裂解)。
4)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至 1.5mL 离心管中。
(整个操作尽量在冰上进行)5)在EP管中将细胞震碎(10s/次,3次)6)于4℃下 12000rpm 离心 20-30 min。
(离心机提前预冷至4℃)7)将离心后的上清分装转移倒 1.5mL 的离心管中放于-20℃保存。
二、BCA法测蛋白浓度1)将BCA protein assay每孔 A液200μL,B液4μL混合,96孔板每孔加入22.5μLdd水,2.5μL蛋白提取液,200μLA+B混合液2)在烘箱中37℃,90r,孵育30min3)使用酶标仪测出吸光度后,使用公式y=0.9154x-0.118计算出蛋白浓度(浓度需要×10)4)将蛋白配成等浓度等体积(使用配置好的裂解液配),按照4:1加入5X loading buffer然后煮5min(100℃),放入-20℃保存三、SDS-PAGE电泳板子1.5mm,梳子1.5mm1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲洗2)验漏:玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上,加满水验漏3)灌胶:验漏结束后用纸吸干水分,按方法配制下层胶(4mL+4mL+80μLAP),灌胶时,可用 1mL 枪吸取胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
然后胶上加1 mL水,液封后的胶凝的更快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自我总结的Westen Blot步骤,简单实用!
蛋白质的提取
(整个过程冰上进行)
一.组织膜蛋白
裂解液bufferA+1%蛋白酶抑制剂
蛋白保存液40%SDS+60%RIPA+1%蛋白酶抑制剂
1.-80°C冰箱中取出组织放入研磨管中(研磨管和配套的研磨棒事先用去离子水冲洗,用纸吸干水)按600-700μl/100mg组织加裂解液研磨(研磨后研磨管和研磨棒用去离子水冲洗,用纸吸干水)
2.用1000枪转入1.5ml离心管中4°C离心,1500转15min
3.用1000枪将上清转入差速离心专用离心管中(离心管事先用去离子水冲洗)用裂解液配平
4.差速离心33000-35000转(45000g)30min
5.弃上清,沉淀加入150μl左右蛋白保存液(根据沉淀的量调整)用枪来回吹打使沉淀溶解,枪头在液面下,尽量不要出沫
6.将上述液体分装到0.5ml离心管中,每管20-25μl,留一管-20°C保存测浓度,其余放入-80°C保存
二.组织总蛋白
裂解液40%SDS+60%RIPA+1%蛋白酶抑制剂
1.-80°C冰箱中取出组织放入研磨管中(研磨管和配套的研磨棒事先要用去离子水冲洗,用干净的纸擦干)按600-700μl/100mg组织加裂解液研磨(研磨后研磨管和研磨棒用去离子水冲洗,用纸吸干水)
2.用1000枪转入1.5ml离心管中4°C离心,13500转30min
3.取上清分装到0.5ml离心管中,每管20-25μl,留一管-20°C保存测浓度,其余放入-80°C保存
三.细胞总蛋白
裂解液RIPA+1%蛋白酶抑制剂
1.将培养瓶中培养液倒掉,加入PBS冲洗5-6遍,倒掉PBS,用枪吸出倒不尽的PBS
2.每瓶加100-150μl裂解液,用细胞刮刀尽量将细胞刮下来(刮刀用前去离子水冲洗,用纸吸干水,用完一样处理)用200枪转入1.5ml离心管中
3.超声破碎细胞,频率80-100间,超声探头(用前用纸擦,用后用纸擦并盖上盖)插入液面下,超声3-5s停3-5s,总共20s左右,停止5min左右
4.重复上步4-6次
5.4°C离心13500转15min
6.取上清分装到0.5ml离心管中,每管40μl,留一管-20°C保存测浓度,其余放入-80°C保存。
蛋白质浓度的测定
工作液(BCA试剂B液:BCA试剂A液=1:50)
1.用100枪将19μl PBS加入96孔板(两边不加,测浓度不准)
2.用2.5枪加入1μl待测样品(加样时枪头在液面下,提抢时贴壁,尽量不产生气泡)
3.用200枪加入200μl工作液,混匀(枪头在液面下,不产生气泡)
4.放入37°C孵箱30min
5.用酶标仪测浓度,记录数据
凝胶的配置
一.分离胶的配置:
1. 将胶板用自来水冲洗干净(否则配出的胶会不均匀),用去离子水冲洗。
将胶板固定在架子上,加入去离子水至矮板高度,等待3~4分钟,测试是否漏水。
期间可以准备配胶时所需要的溶液:
去离子水:室温放置
30%丙烯酰胺:4℃放置,神经毒性
TRIS—HCL(ph8.8):4℃放置
TRIS—HCL(ph6.8):4℃放置
10%SDS(自配):室温放置
10%AP(现配现用):避光
TEMED:室温放置,神经毒性
2. 根据所需蛋白质的分子量确定所要配制多大浓度的胶。
本实验采用的胶为10%的分离胶,2块胶版配置25ml即可。
按照如下的量进行配制分离胶:
去离子水:9.9ml
30%丙烯酰胺:8.3ml
TRIS—HCL(ph8.8):6.3ml
10%SDS(自配):0.25ml
10%AP(现配现用):0.25ml
TEMED:0.01ml
配置时要将液体混匀,加入最后两种物质的速度要快,因为丙烯酰胺是促凝剂,凝聚的物质为APH和TEMED。
将配好的分离胶倒入胶板中(倒入量为胶板高度的3/4)加入去离子水封住,防止空气进入,排除气泡。
加去离子水时要轻,防止将上层的分离胶稀释。
通常分离胶需要30~35分钟即可,凝固后可以看到用一条直线。
3. 在配好的分离胶上层加入TRIS—HCL(ph6.8)作为一种缓冲,因为积层胶用的是TRIS—HCL(ph6.8)。
然后配制积层胶:
去离子水:5.5ml
30%丙烯酰胺:3.5ml
TRIS—HCL(ph6.8):1.5ml
10%SDS(自配):0.08ml
10%AP(现配现用):0.08ml
TEMED:0.008ml
配好后将TRIS—HCL倒出,倒入积层胶,插入梳子(梳子要用去离子水冲洗干净,并将去离子水甩掉,否则会在胶板上留下不能用的孔道),插梳子的时候要排除气泡,从一端向另一端推。
20分钟即可凝固,拔出梳子。
将配好的胶板放入装有去离子水的饭盒中,防止胶中的水分蒸发,发生缩胶现象。
电泳液和转膜液的配制
1. 电泳液:Gly15.0g,Tris-base3.02g,SDS1g,1000ml 去离子水,室温保存
2. 转膜液:Gly14.4g,Tris-base
3.00g,甲醇100ml,900ml去离子水,4℃保存
蛋白质样本的处理
1. 从-80℃冰箱中取出提好的蛋白质,按照算好的蛋白,ripa,loading将蛋白稀释到同一个体积。
(此操作过程在冰域中进行)
蛋白质的体积X= 40μg/[(1.3484*O D值-0.0799)*20]
Ripa的体积Y=体积最大的蛋白质补整-X
Loading的体积Z=1/4(X+Y)
2. 煮样:100℃,5min。
(将管外的水擦干净)
电泳过程
1. 将电泳槽准备好,胶板的矮面朝里,加入电泳液,先在里面和外面个加入一半的电泳液,排净气泡后加满。
2. 上样,上样量为8μl。
上样时要慢,如果担心样的中央处有凹陷,那就在边处让样流下。
3. 按照“红对红,黑对黑”的原则安装电极。
开始跑电泳。
先恒压70v使蛋白质跑到同一条起跑线上,待跑至分离胶上时,改为100v,使溴酚蓝全部跑出时停止。
电压越小跑的越好。
转膜过程
1.剪好滤纸和NC膜,滤纸要比膜小1~2cm,在转膜液中浸泡。
2.准备白色的矮一些的盒子,里面装好转膜液,将膜取下,取得过程中要注意不要将膜弄破。
3.制作“三明治”,夹板黑色的一面朝向桌子,第一层为海绵,第二层为滤纸,第三层为胶,第四层为滤纸,这时不要急于将最后一层海绵盖上,先将前面三层中的气泡赶走,然后再加入第五层海绵。
夹紧,不要让夹板扭动。
4.放入“三明治”时要按照“黑对黑”的原则放入。
在倒满转膜液之前不要忘记将一个冰盒放在转膜槽内。
将转膜槽放在装满冰的盆里,开始转膜。
我们需要的分子量范围是:>250kd~31kd,我们转膜的条件为恒压70v,2h。
封闭
1. 封闭液的配制(5%):将10g脱脂奶粉加入到200mlPBS中,在漏斗中过滤。
2. 将膜取出,放在去离子水中冲洗一下,放入封闭液中。
3. 放在摇床上封闭2h。
一抗的孵育
1. 将膜从封闭液中取出,用PBS冲洗3次,每次10min。
按照分子量将膜剪开。
2. 一抗有两种孵育方法:一、室温孵育:在桌面上铺一张纸,将剪好的膜放在纸上,加上相应的一抗。
二、过夜孵育:准备夹链袋,将膜用镊子放入,但是不能碰到膜的表面,将抗体加入,不能有气泡。
在室温下摇动1h(可以将枪按到一档)4℃过夜。
3. APP(1:200),Navβ2(1:200),Nav1.2(1:200),NR1(1:200),BACE1(1:1000),GA PDH(1:1000)
二抗的孵育
1. 将膜从夹链袋中取出,一抗回收放在PBST中冲洗3次,10min一次。
2. 二抗在暗室中进行,GAPDH二抗用800鼠(1:4000),其他用700兔(1:4000)。
3. 二抗孵育1h。
4. 洗膜:PBST冲洗3次,每次10min。
最后再用PBS冲洗一次。
扫膜。
