第二节 铁的冶炼 合金
铁的冶炼合金教案

第五章第二节铁的冶炼合金一.学习目标1.认知性学习目标:(1)了解从铁矿石中将铁还原出来的方法。
(2)知道生铁、钢等重要的合金。
认识加入其他元素可以改善金属特性的重要作用。
2.技能性学习目标:能利用化学方程式进行不纯物质的相关计算。
3.体验性学习目标:感受合金的广泛用途、特殊的性质。
二.教学重点:(1)了解从铁矿石中将铁还原出来的方法。
(2)知道生铁、钢等重要的合金。
认识加入其他元素可以改善金属特性的重要作用。
三.教学难点:能利用化学方程式进行不纯物质的相关计算。
四.教学过程第一课时铁的冶炼【创设情景】大自然中有很多铁矿,其中的铁是不是金属铁?【介绍】金属的冶炼、我国的大型铁矿。
【提问】如何才能将氧化铁转化为铁呢?【讨论】你能想出那些方法?【观察思考】看实验录象。
【交流实验】1、反应的化学方程式2、处理尾气的其他方法。
【创设情景】工业上如何实现这一反应呢?【观察思考】看实验录象。
【提问】你还知道其他的冶炼方法吗?【介绍】电解法。
【讲解】氧化、还原。
【交流讨论】书121页计算题。
【提高要求】现有800吨含氧化铁80%的赤铁矿石,可炼出含杂质3%的生铁多少吨?【小结】不纯物质参加化学反应的计算方法【总结】第二课时二、生铁和钢三、合金【情景引入】炼铁高炉中出来的产品是生铁,应用范围不广,人们是怎么将生铁转变为钢的?【阅读】120页内容。
【讨论交流】生铁炼钢的原理【介绍】我国钢产量的变化。
【学生讨论】121页图。
【情景引入】我们身边的金属制品都是纯金属吗?【讨论】下列场合需要什么样的金属?灯丝、飞机的外壳、刀具、钢笔尖、铜钟?【阅读讨论】合金的形成。
【活动探究】合金的硬度与熔点和组成金属的关系。
【师生整理】【交流讨论】一些常见合金的特性和用途。
【教师介绍】几种合金。
【学生练习】练习与实践。
【课堂小结】观看幻灯片。
《铁的冶炼合金》课件

高强度低合金钢具有较高的强度和良 好的韧性,主要用于制造桥梁、船舶 、建筑等结构件。
弹簧钢具有良好的弹性和耐疲劳性能 ,主要用于制造各种弹簧。
05
铁的冶炼与环境保护
铁的冶炼过程中的环境问题
空气污染
铁矿石在高温下燃烧会产生大量 的烟尘和有害气体,如二氧化硫 、氮氧化物等,对空气造成严重
杂质去除
在冶炼过程中,通过加入熔剂 去除铁水中的杂质,如硫、磷 等。
铁水处理
经过脱硫、脱磷处理后,铁水 被送入转炉中进一步处理,以 生产不同品种和规格的钢材。
02
铁的冶炼过程
采矿与选矿
采矿
从地下或地表开采出铁矿石,通常采用露天开采或地下开采 方式。
选矿
通过物理或化学方法将铁矿石进行破碎、磨细和分选,以获 得品位较高的铁精矿。
造成各种铸件。
铸铁的抗压和耐磨性能较好,主 要用于制造承受较大压力和摩擦 力的部件,如发动机缸体、齿轮
等。
随着技术的发展,铸铁的应用范 围也在不断扩大,如在汽车轻量
化方面有所应用。
其他铁合金的生产与应用
其他铁合金包括高强度低合金钢、工 具钢、弹簧钢等,其生产过程和特性 与钢铁、不锈钢和铸铁有所不同。
铁合金的性能特点与应用
高强度与硬度
良好的耐磨性
铁合金通常具有较高的强度和硬度,能够 满足各种工程应用的需求。
铁合金具有较好的耐磨性,常用于制造需 要承受较大摩擦和磨损的零件。
良好的耐腐蚀性
应用领域
某些铁合金具有较好的耐腐蚀性,可用于 制造需要长期耐腐蚀的零件。
铁合金广泛应用于汽车、机械、建筑、航 空航天、石油化工等领域,作为结构材料 和功能材料发挥着重要作用。
铁的冶炼合金ppt 沪教版优质课件

2002年,我国的钢产 量为18224.89万吨,连 续多年保持世界第一
为纪念199ห้องสมุดไป่ตู้年中国钢产量突破1亿吨而发行
(iron)在自然界中分布很广,在地壳 中含量居所有金属元素的第二位,仅 次于铝,约占地壳总质量的4.75%。我 国辽宁鞍山、湖北大冶、四川攀枝花 等地都有大型铁矿
上海教育出版社九年级化学上册 教材
第五章 金属与金属矿物
第二节 铁的冶炼 合金
铁的用途
建筑 桥梁 器械 车辆、飞机、舰艇 生活用具 其它
钢铁是非常重要的金属材料。钢铁的生产和使用是人类文明 和社会进步的一个重要标志
在春秋战国时期,我国就开始生产和使用铁器。
新中国成立以后,我国的钢铁工业得到了 飞跃的发展。
通电
2Al2O3====4Al + 3O2↑
通电
2NaCl====2Na + Cl2↑ 在金属中,K、Na、CA、Al等活泼金属不能用一般 的方法和还原剂使其从化合物中还原出来,只能用 通电分解其熔融盐或氧化物的方法来冶炼。
通过这节课的学习我明白 了……
4 、不要把成功想得太遥远,有时候,它离我们很近,只是由于我们的疏忽而与它失之交臂。 19 、很多人找女朋友或者男朋友,把学历当作指标之一,既希望对方能够给他/她伴侣的温暖与浪漫,又希望他/她知识丰富、学历相当或更高,在事业上能蒸蒸日上;我想说,你找的是伴侣,不是 合作伙伴,更不是同事,生活就是生活,这个人适合你,即使你是博士他/她斗大字不识一个,那也无所谓,适合就会和谐融洽,人比文凭更重要 20 、创造机遇有时并不难,只要懂得把泥土从不需要的地方移到需要的地方,但移动之前,要先能够把心中“理所当然”的冰块移走,把想像春天般铺开。 10 、很多事情别人通知你了,要说谢谢,没有通知你,不要责怪,因为那些事你其实应该自己弄清楚。 2 、赢家总有一个计划,输家总有一个借口。 19 、自我反省,做自己的老师。 20 、想停下来深情地沉湎一番,怎奈行驶的船却没有铁锚;想回过头去重温旧梦,怎奈身后早已没有了归途。因为时间的钟摆一刻也不曾停顿过,所以生命便赋予我们将在汹涌的大潮之中不停地 颠簸。
第二节铁的冶炼合金

第二节铁的冶炼合金学习目标1.从铁矿石中将铁还原出来的方法工业炼铁的主要设备是高炉。
把铁矿石跟焦炭、石灰石一起加入高炉,从下方通入热风,焦炭在炉内反应生成的一氧化碳跟氧化铁在高温下反应生成铁。
发生反应的化学方程式为:Fe2O3+3CO=2Fe+3CO22.生铁和钢等重要的合金生铁是含碳量为2%~4.3%的铁合金,其中还含有硫、磷、硅等杂质。
钢是含碳量为0.03%~2%的铁合金,钢是由生铁在炼钢炉中进一步冶炼除去过多的碳、硅、硫、磷而得到的。
钢的性能比生铁优越。
合金是由一种金属跟其他金属(或非金属)熔合形成的具有金属特性的物质。
合金具有许多良好的物理、化学或机械性能。
3.认识金属材料在生产、生活和社会发展中的重要作用。
4.含杂质物质的质量计算方法:纯净物质量=不纯物质量某物质质量分数。
学习要点重点、难点和疑点1.重点:⑴铁的冶炼。
⑵合金的特点及应用。
2.难点:(1)铁的冶炼。
(2)用所学知识解释和解决生活中有关金属和合金的问题。
3.疑点:(1)冶炼生铁时为什么要用焦炭而不用煤?(2)炼铁时为什么生成的是生铁而不是纯铁?教材解读内容要点解析金属的冶炼:使金属矿物变成金属的过程。
铁在不同化合物中表现出不同的化合价。
一般,铁在置换反应的生成物中表现为+2价;铁在氯气等物质化合时生成+3价的铁离子;另外铁在氧气中燃烧生成Fe3O4,可将Fe3O4表示成FeO·Fe2O3,即Fe3O4中铁即表现出+2价,又表现出+3价。
炼铁的原理:高温Fe2O3+3CO====2Fe+3CO2设备为高炉,原料为石灰石、铁矿石、焦炭、空气,产品为生铁。
生铁是含碳量为2%---4.3%的铁合金,其中还含有硫、磷等杂质。
钢是含碳量为0.03%----2%的铁的合金,钢是由生铁在炼钢炉中进一步冶炼除去过多的碳、硅、硫、磷而得到的。
钢的性能比生铁优越。
焦炭有着多孔性,它含硫量少,并有发热量高的优点。
而煤中含有大量的硫、磷等杂质,如不经过洗涤干馏,把它们除去变成焦炭,则会使生铁中除含有碳外,还含有大量的硫、磷,从而大大影响生铁的性能。
第二节 铁的冶炼 合金

第二节 铁的冶炼 合金教学目标: 知识与技能:1.了解从铁矿石中将铁还原出来的方法;2.知道生铁和钢等重要的合金,认识加入其他元素可以改善金属特性的重要性; 3.认识金属材料在生产、生活和社会发展中的重要作用。
过程与方法:1.学习从日常生活事物中发现和提出问题;2.指导学生通过各种媒体和资料收集、整理和加工信息。
情感态度价值观:了解我国钢铁工业的发展;认识金属冶炼的重要性。
内容要点:1、 在炼铁高炉里用一氧化碳把铁矿石中的氧化铁(或其他铁的氧化物)在高温下反应能生成生铁。
(写出化学方程式)2、生铁和钢是重要的铁合金。
3、合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。
如青铜是由铜、锡等元素形成的合金。
世界上最常见、应用很广的钢是由铁、碳等元素形成的合金。
通常所说的“金属材料”,既包括各种纯金属,也包括各种合金。
教学重点与难点教学重点:生铁的冶炼;铁的两种合金;含杂质物质的化学方程式的计算。
教学难点:1.含杂质物质的化学方程式的计算;2.“一氧化碳与氧化铁反应”的演示实验。
探究学习:1.一氧化碳与氧化铁反应的注意事项 2.生铁和钢的比较 知识整理:一.生铁的冶炼1.炼铁的原料:铁矿石、焦炭、石灰石和空气铁矿石:主要有赤铁矿Fe 2O 3、磁铁矿Fe 3O 4、菱铁矿FeCO 3、黄铁矿FeS 2 焦炭:主要作用是提供热量和产生还原剂CO ;石灰石:主要作用是造渣,除去铁矿石中SiO 2等杂质。
2.炼铁的设备:高炉3.炼铁的原理:在高温条件下,利用还原剂一氧化碳从铁的氧化物中将铁还原出来。
4.炼铁的过程及反应(以赤铁矿为例): (1)焦炭燃烧产生热量并生成还原剂C+O 2点燃===CO 2;CO 2+C 高温===2CO (2)氧化铁被CO 还原成铁Fe 2O 3+3CO 高温===2Fe+3CO 2(3)SiO 2与CaCO 3分解产生的CaO 反应生成硅酸钙CaCO 3高温===CaO+CO 2↑;CaO+SiO 2==CaSiO 3 ;炉渣主要成分5.炼铁产物:生铁有关问题:常见的铁矿石主要有:吃铁矿(主要成分是Fe 2O 3)、磁铁矿(主要成份Fe 3O 4)、菱铁矿(主要成分为FeCO 3)、黄铁矿(主要成分是FeS 2)。
铁的冶炼、合金

如:利用赤铜矿(Cu2O)提取铜Cu2O+C===2Cu+CO;古代湿 法炼铜:Fe+CuSO4==FeSO4+Cu (2)电解法:活泼金属很难从其矿石中还原出来,需要用电解 法。 如:电解熔融氧化铝制铝:2Al2O3===4Al+3O2↑,电解熔融氯 化钠制钠:2NaCl===2Na+Cl2↑ (3)分解法:有些金属的氧化物受热容易分解,可以用简单加 热的方法得到。 如:氧化汞制水银:2HgO===2Hg+O2↑
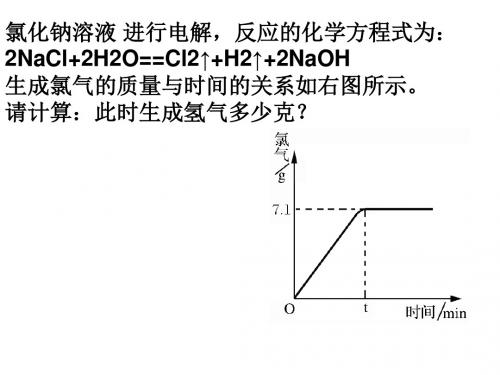
例2、计算多少吨生铁中含铁的质量分数
为96%,含铁560t? 生铁的质量: 560t÷96%=583.3t
不纯物质的质量=
纯物质的质量÷物质的质量分数
例3:用1000t含氧化铁80%的赤铁矿石, 理论上可以炼出含铁96%的生铁多少吨?
赤铁矿石—氧化铁—铁—生铁
注意: 带入化学方程式计算的数据应是 纯净物的质量
高温 通电 通电
上海宝山钢铁公司炼铁高炉
生熟炼铁炉二
生熟炼铁炉一
为纪念1996年中国钢产量突破1亿吨 而1000t含杂质20%的赤铁矿石中含 氧化铁的质量是多少?
氧化铁的质量: 1000t× ( 1- 20% )=800t 纯物质的质量=
不纯物质的质量×物质的质量分数
注意事项:
1、加热之前先通入CO一会儿, 排出试管内的空气, 防止CO不纯加热而发生爆炸。 2、加热至红棕色固体变黑时停止加热。 3、停止加热后,要继续通入CO至试管冷却, 防止生成的铁再次与空气中的氧气反应又变回 氧化铁。
.金属冶炼的方法: (1)还原法:把金属矿物与焦炭、氢气、一氧化碳等还原性物 质一起加热反应。
第二节 铁的冶炼 合金
(第一课时)
化学-九年级上册-第五章 课题2 铁的冶炼 合金

3、主要设备:高炉
高炉示意图
高炉工作示意图
4、主要反应过程
问题1:原料中
((12))焦二炭氧与化过碳量又空与气焦高炭的焦温在作反高炭用应温和是下石什反灰应么石生?成一氧
化碳
(3)一氧化碳与赤铁矿石高答温:反焦应炭的作 试写出各步反应的化学方用程式是:作燃料和 (((213)))CCFeO+22OO+32+点= C燃高=3C温CO2OC2=高O温2生F是石e成+灰除一3石去C氧的炉O化2作渣碳用。。
二 生铁与钢的比较
铁的合 金
C%
其它杂 质
机械性 能
用途
生铁 2%-4.3%
钢 0.03%-2%
Si、Mn、S、P Si、Mn、S、P
(较多) 质硬而脆、无韧性
(较少) 坚硬、韧性大、
可塑性好。
制铁锅、暖气
制造机械、
机床底座等
交通工具等
小结:
1、炼铁的原理 2、主要原料及设备 3、主要反应 4、产物 5 生铁和钢的主要区别
第二节
铁的冶炼合金
艾 菲 尔 铁 塔
艾 菲 尔 铁 塔
铁矿石
一 、铁的冶炼
1、铁的存在及分布
地壳中的铁都以化合态存在,游 离态的铁只能从陨石中得到。
2、一氧化碳与氧化铁的反应 现象: _固_体__由_红__变__黑_,_石_灰__水_变__浑_浊__。
高温
方程式:_F_e2_O_3+__3_C_O_=_2_F_e_+_3_C_O_2
5、产物
(1)生铁
问题1:高炉煤气能 否直接排放?怎么
处理?
问题2:生铁中的主 要成分是什么?
(2)高炉煤气:CO、CO2、N2、大量灰尘 等。
铁的冶炼、合金PPT课件1

实验现象: 红棕色的氧化铁粉末逐渐变成黑色,同时澄清的石灰 水逐渐变浑浊 注意问题: 1、一氧化碳还原氧化铁是在封闭的硬质玻管中进行的, 先通一氧化碳,可以把管内的空气排出,防止一氧化碳 与空气混合受热爆炸 2、实验完毕先停止加热,还要继续通入一氧化碳直到 玻璃管冷却为止。(防止灼热的铁与氧气反应)
轻松课后
2.P121 某钢铁公司用490万吨含氧化 铁60%的赤铁矿石炼铁,所得 到的生铁最多含铁多少万吨? (作业) 3.思考课本P124第6题
再见
• • • • • • • • • • • • • • • • • • • • • • • • •
1、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。 ——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。 ——谢觉哉 4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。—— 贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。 ——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。—— 列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。—— 华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。 ——苏霍姆林斯基 11、学会学习的人,是非常幸福的人。 ——米南德 12、你们要学习思考,然后再来写作。 ——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。 ——华罗庚 14、许多年轻人在学习音乐时学会了爱。—— 莱杰 15、学习是劳动,是充满思想的劳动。 ——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。 ——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。 ——毛泽东 18、只要愿意学习,就一定能够学会。 ——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。—— 列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。—— 赞科夫 21、游手好闲地学习,并不比学习游手好闲好。—— 约翰 · 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。 ——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。 ——别林斯基
九年级化学 铁的冶炼 合金 ppt课件

back
一. 铁的冶炼
2. 工业上炼铁的设备、及原料
铁的冶炼 其主要反应原理: Fe2O3+3CO====2Fe+3CO2 设备:炼铁高炉 原料:铁矿石、焦炭、石灰石
高温
二. 生铁与钢
二. 生铁与钢 1.生铁是指含碳量在2%-4.3%的铁合金;
2. 钢是指含碳量在0.03%-2%的铁合金。
生铁与钢的含碳量不同,所以两者的机械性能不同
金属的存在形式
自 然 界 以 单 质 形 式 存 在 的 金
自 然 界 以 单 质 形 式 存 在 的 银
金属的存在形式
常见的铁矿石
赤 铁 矿
黄 铁 矿
金属的存在形式
常见的铁矿石
的冶炼
早在春秋战国时期,我国就开始生产 和使用铁器,从公元1世纪起,铁便成了一
三.合金
1. 合金的概念 2.合金的物理特性: 合金的硬度一般比各成分金属大,多数合金的熔点低于 组成它的成分金属。
基础知识巩固
1.铁是一种应用广泛的金属。下列有关铁的叙述正确的是………( B ) A. 从历史上看,人类利用最早的金属是铁器 B. 用铁锅炒菜可使食物增加微量铁元素 C. 铁与盐酸反应可生成氯化铁和氢气 D. 用于炼铁的铁矿石中含有大量的单质铁 2.已知4FeS2 + 11O2 == 2Fe2O3 + 8SO2 ,从环境保护方面考虑,下 列铁矿石中不适宜用来冶铁生铁的是……………………………( D ) A. 菱铁矿(FeCO3) B.磁铁矿(Fe3O4) C. 赤铁矿(Fe2O3) D.黄铁矿 (FeS2) 3. 生铁和钢的主要区别在于…………………………………………( A ) A. 生铁和钢的主要成分都是铁,其含碳量不同,性能也不同 B. 生铁是铁,钢是铁的氧化物 C. 生铁硬而有韧性,既可铸又可锻 D. 钢是用铁矿石和焦炭作原料炼制而成
沪教版九年级上册化学第二节铁的冶炼合金.pptx

通常把金属(如铁)跟氧结合生成金属氧化物(如 氧化铁)的过程称为金属的氧化。金属氧化物跟焦炭、 氢气、一氧化碳等物质反应,失去氧转化为金属的过 程,称为金属氧化物的还原。
(即物质跟氧结合的反应称为氧化。物质失去氧的 过程称为还原。同理:物质跟氧结合的反应叫氧化反 应,这种物质叫还原剂。物质失去氧的反应叫还原反 应,这种物质叫氧化剂。)
放在火上灼烧——真金不怕火炼; 放入硫酸铜溶液中—使溶液褪色的是假金。
1、钢铁冶炼的定义、原理、结构; 2、钢铁的种类和用途; 3、几种常见的合金。
空白演示
在此输入您的封面副标题
①燃烧放热; ②生成还原气CO。
工业炼铁的主要设备: 高炉
主要反应: Fe2O3+3CO 高=温2Fe+3CO2 _1 Fe3O4 +_4 CO 高=温_F3e+_C4O2
造渣除杂
炼铁高炉的结构
生 产 流 程 动 画
炼铁工业设备图
思考题:
炼铁选用的铁矿石通常不仅要求含铁量高,而且要“有害
元素”少,下列铁矿石你认为不适宜炼铁的是:
碳等杂质变为气体或炉渣而除去的过程。
目的: 降碳、调硅锰、除硫磷。
合金是混合物, 不是纯净物哟!
定 义:合金是由一种金属跟其他金属(或非金属)
熔合形成的有金属特性的物质。
有金属光泽、硬度、 延展性…
人类历史上使用最早的青铜是由铜、锡等元素形 成的合金。世界上最常见、应用很广的钢是由铁、碳 等元素形成的合金。
生铁和钢的比较
碳的质量分数
生铁
2%~4.3%
其他元素
较多硅、锰, 少量硫、磷
机械性能
硬而脆
第二节铁的冶炼合金

和武器
生铁中的含碳量2% ~ 4.3% 钢中的含碳量0.03% ~ 2%
生铁和钢的区别在于含碳量不同。 那么炼钢就是降低生铁中的含碳量
“百炼成钢”?
设备:转炉
原料:生铁、氧气
原理: 高温下, 把生铁中过量的碳 除去
为纪念1996年中国钢产量突破1亿吨而发行的邮票
如:做飞机机翼的金属材料, 需要坚硬而质轻;
你的依据? 这两种铁矿石含铁量都较高,不含“有害元素”
例题:某炼铁厂每天消耗含氧化铁70%的赤铁矿640t。
理论上每天能生产含铁96%的生铁多少吨? 解:设理论上每天能生产含铁96%的生铁的质量为x,
其中纯铁的质量为:96%x。
640t 赤铁矿中氧化铁质量为:640t×70%=448t
高温
3 CO + Fe2O3 ==== 3 CO2 + 2 Fe
160
112
448t
96%x
160 : 112 = 448t : 96%x x = 326.7t
答:理论上每天能生产含铁96%的生铁326.7t
• 1、你家都有哪些铁制品?你是如何防锈的? • 2、调查你家或附近都有哪些合金制品?它们
有什么优良性能? • 3、实验室有Cu—Zn合金与Cu—Ag
各一份,你能鉴别它们吗?
均含有Fe元素,不同之处在于Fe少了O元素,怎么才 能使Fe2O3失去O转变成Fe呢?
可在 一定条件下,可加入某类物质,让其与 Fe2O3中的O元素结合, 主动夺取Fe2O3中的“O”元 素,使Fe2O3转变成金属Fe。
设备:高炉
原料:铁矿石、焦炭、 石灰石、空 气
主要反应:
点燃
C+O2===CO2
高温 工业炼钢:C+O2===CO2
第二节_铁的冶炼_合金综述
①百炼成钢:
C+O2==CO2
②将生铁加入足量的稀盐酸中, C 经过反应得到的残渣主要是 。
点燃
三、合金:金属+金属 (或金属+非金属)
的具有金属的特性的物质
一起熔合而成
例如:钢和生铁都是铁的合金
1、合金是混合物
2、合金中一定有金属, 可能有非金属 3、合金硬度增大, 熔点降低!
P123
生铁铸造的铁锅、下水井盖
一、铁的冶炼P120 氧化 缓慢 +O 2 3
剧烈
Fe O Fe3O4
Fe
-O 还原
(一)金属的氧化与氧化物的还原
1.金属的氧化:金属与氧气结合生产金属氧 化物的过程,称为金属的氧化 2.金属的还原:金属氧化物跟焦炭、氢气、 一氧化碳等物质的反应,失去氧转化为金 属的过程,称为金属氧化物的还原。
• 二、生铁和钢P120
铁
生铁
钢
Fe ,C ,S, Fe , C P 物质类型 纯净物 混合物 混合物 碳元素 0 2%~4.3% 0.03%~2% 质量分数 Fe 机械性能 机械加工
用途
组成
硬而脆,无韧 性 可铸、不可 锻 铁锅 机床底 座
坚硬、韧性大、 塑性好 可铸、可锻、 可压延 制造机器 交通 工具 武器
3、下列物质不属于合金的是( ) D A、不锈钢 B、黄铜 C、18K黄金 D、氧化铁 4、在日常生活中的金属炊具和医 院中的金属医疗器械的主要成份是 ( ) C A、白铜合金 B、武德合金 C、 不锈钢 D、青铜
5.封阳台的“铝合金”建材是一种比较理想 的装潢材料,它属于( ) A纯净物 B化合物 C单质 D混合物 6.血红蛋白的相对分子质量为8000,其中含铁 元素2.1%,则每个血红蛋白中含铁原子的个数为 ( ) A .1 B .2 C .3 D .4 7.当把一块硬币投入稀盐酸中,过一点时间观 察到溶液变成浅绿色,说明硬币中一定含有( ) A.铝 B.镁 C.铁 D.银
铁的冶炼 合金 (2)

课题:铁的冶炼合金(2)主备人:钱兴勇审核:教学目标1、知道生铁和钢等重要的合金,认识加入其他元素可以改善金属特性的重要作用;2、认识金属材料在生产生活和社会发展中的重要作用。
教学重难点合金及合金的物理特性教学过程集体备课补充栏一、课前预习检测在炼铁高炉里用一氧化碳与铁矿石中的氧化铁(或其他铁的氧化物)在高温下反应能生成生铁,写出相应的化学方程式:二、创设情境,揭示课题生铁和钢均为铁的合金。
它们在生产生活中有着广泛的用途。
钢铁的生产和使用是人类文明和社会进步的一个重要标志。
三、师生互动,导学达标阅读P120-121归纳:生铁:含碳量在2﹪—4.3﹪之间的铁的合金钢:含碳量在0.03﹪—2﹪之间的铁的合金从生铁炼成钢的实质为:降碳、除硫磷、调硅锰用途:阅读:P122 有关文字。
归纳:合金是一种金属跟其他金属(或非金属)熔合形成的具有金属特性的物质。
人类历史上使用最早的合金是青铜;世界上最常见、应用最广的合金是钢。
引导学生阅读P122 活动与探究:某种保险丝是用武德合金制成的。
比较武德合金和其组成金属的熔点差异,归纳出合金的优良特性。
归纳:合金具有许多良好的物理、化学或机械性能;合金的硬度一般比各成分金属大;多数合金的熔点低于组成它的成分金属。
生铁和钢是重要的铁合金。
通常所说的“金属材料”,既包括各种纯金属,也包括各种合金。
阅读:P123 拓展视野几种合金四、当堂训练某钢铁公司用490万吨含氧化铁60%的赤铁矿石炼铁,所得到的生铁中最多含铁多少吨?五、学习体会,课堂小结合金的性质和用途六、作业布置练习与实践:1----5七、教学后记。
九年级化学铁的冶炼合金2

1、1.先进入位于南岛加鲁卡(481,92)或(426,93)附近的塔姆塔姆村,进村后,从(44,55)进入塔姆塔姆的民家,找村庄小姑娘对话,了解到她需要玩家帮助她去哈罗山顶找医生拿药草给她爸爸治病用.2、2.从塔姆塔姆村东口(34,78)出来后,往南边走,从(452,162)处进入到森林洞窟1楼.石器时代,一起玩石器2.5最好玩一起玩石器 《原始in石器时代》游戏保留了原作独特的Q版卡通风格,采用先进的画面渲染技术,每一处设计都力争还原最真实的石器世界,从场景、音乐、任务到广大玩家耳熟能详的经典宠物全部一比一还原到游戏中,极大提升视觉享受!可谓是原版石器
1、在很 久很久很久以前的年代,是大家印象中野蛮的石器时代。其实也并不尽是如此,在那个世界上有很多肉眼看不到的精灵们,栖息在道具、武器和防具之中,好让人们更容易使用各项器具,并给予人们莫大的勇气,治疗人们的疾病,赋予人们力量。另外还有很多前所未见的变型动物以及大家十分感 3、“萨伊纳斯”岛位于尼斯大陆的东侧出海口附近,气候温和宜人,适合居住。岛上的“玛丽娜斯村”和“萨姆吉尔村”是玩家可选择的两个出生地,“萨姆吉尔村”以英雄萨姆基鲁为名,村中有座巨大的英雄雕像,游戏内统称萨姆吉尔;“玛丽娜斯村”则是以海产著名的村落,村民相当温和 石器时代之疯狂原始人手游电脑版游戏详解教程《石器时代之疯狂原始人》是一款致敬经典的手游,游戏再现了经典石器情怀,独创回合制竞技场PK玩法。游戏中玩家能够随心所欲的调整装备属性搭配,驾驭战宠骑乘进行5V5实时竞技对抗。 回归原始生活,石器时代原始人冒险者背景,回味经典时代情怀,收集百变萌宠化身,打造属于自己的冒险篇章。同系列的宠物,不一样的外观特点,随机属性,任意抓捕!更有猜蛋游戏,收集极品宠物不再是难题。100个空闲宠物仓库,随行20只宝宝,让你成为百变宠物收藏大师。 经典易懂的手游回合制玩法,策略套路在其中,玩起来容易,想要玩好它可要好好花一番心思。突破性公平竞技玩法,15种别样特性武器装备任意搭配,百种宠物技能自由组合,潜力加点随心操控,只要你想玩,懂玩,套路深,平民也能当大神。 PC电脑1台安卓模拟器1个 1、游戏采用Q版画风,角色及宠物形象萌动可爱,整体界面清新自然,3D模型十分细腻,加上粒子渲染,整体视觉效果相当惊艳。野外场景各具特色,不论是草原的幽谧寂静还是洞穴的阴暗湿冷都充分的表现出来,加上魔性欢快的背景音乐,带给玩家出色的视听享受。2、游戏采用Q版画风,角色 塔姆塔姆村草药爱雪石器炎龙器私服石器时代话说在原始的“塔姆塔姆村”有一个名叫“小泽”的男孩,有一天,他喜欢上一个“爱吃苹果的女孩”,但由于种种原因而一直没有表白,这时候就需要有一位强不强悍都无所谓的勇士来给他们做月老。《石器时代》“小泽爱情故事”任务也正由此而
第二节铁的冶炼合金

定义:
使金属矿物变成金属的过程, 叫做金属冶炼。
一、铁的冶炼 二、生铁和钢 三、合金
探究实验
进行课本119页的实验,实验过程 中注意安全(一氧化碳有毒),注意 观察实验现象并记录。
炼铁的原理:
Fe2O3 + 3CO 高 温 2Fe + 3CO2
炼 铁 高 炉 的 结 构
化物是
()
A、FeO C、Fe3O4
B、Fe2O3
生铁和刚的比较
生铁:含碳量为2%~4.3%, 含有较多碳、硫、磷、硅等元素。
钢:含碳量为0.03%~2%, 碳、硫、磷、硅等元素含量较少, 较硬,有韧性良好的延展性和弹性, 机械性能好,可锻、轧和铸造。
定 义:
合金是一种金属跟其他金 属(或非金属)熔合形成的 有金属特性的物质。
炼铁工业设备图
炼铁工业设备图
金属的冶炼方法
Fe2O3 + 3H2 = 2Fe + 3H20
2Al2O3
通电
4Al + 3O2
随堂练习1:
工业上以赤铁矿(Fe2O3) 为原料冶炼铁。某钢铁厂冶炼 896Kg铁,需要含Fe2O364% 的赤铁矿多少千克?
随堂练习2:
2、8gCO在高温下跟5.8g某种 铁的氧化物完全反应,这种氧
肽
铜
合
合
金
金合Βιβλιοθήκη 铂金铱钢
合
金
不
记 忆
锈 钢
合
金
高
温
合
金
随堂练习:
判断下列说法是否正确? ①合金也是金属材料。 ②合金没有金属光泽。 ③合金不能导电、传热。 ④合金没有延展性。 ⑤合金的各种物理性质、化学性质
沪教版化学-九年级上册-5.2 铁的冶炼 合金——第2课

还原法:主要是将金属矿物与焦炭、氢气、 一氧化碳等还原性物质一起反应。
电解法:活泼金属很难从其矿石中还原出来,
需要用电解法。
如:2Al2O3
通电
==== 4Al + 3O2↑
分解法等
如:2HgO
高温
====
2Hg
+
O2↑
生铁与钢
生铁(Pig iron) 钢(Steel)
含碳量 机械性能 机械加工
2%~4.3% 硬而脆 可铸不可煅
0.03%~2% 硬而韧
可铸又可煅
应用
铁锅、暖气片、 机械、交通工 机床底垫等 具、武器等
钢铁是怎样炼成的?
原料: 生铁、氧气、废钢铁
原理:在高温条件下,用氧气等把生铁中 所含有的过量的碳和其他杂质转变 为气体或炉渣而除去。
化学方程式:
主要反应为:C
+
O2
高温 ====
第2节 铁的冶炼 合金
第2课时
铁的冶炼原理
在高温条件下,利用还原剂CO从铁的氧化物 中将Fe还原出来。(以赤铁矿为例)
氧化剂,反应中失氧,本身被还原,发生还原反应
高温
Fe2O3 + 3CO ==== 2Fe + 3CO2
还原剂,反应中得氧,本身被氧化,发生氧化反应
————还原法冶炼金属
金属冶炼的方法
黑色粉末变为亮红色粉末; 试管口有小液滴产生。
化学方程式:CuO
+
H2
△ ===
Cu
+
H2O
返回
CO2
合金
定义:合金是一种金属跟其他金属(或பைடு நூலகம் 金属)相互熔合形成的具有金属特性的物 质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节铁的冶炼合金1.从铁矿石中将铁还原出来的方法工业炼铁的主要设备是高炉。
把铁矿石跟焦炭、石灰石一起加入高炉,从下方通入热风,焦炭在炉内反应生成的一氧化碳跟氧化铁在高温下反应生成铁。
发生反应的化学方程式为:Fe2O3+3CO=2Fe+3CO22.生铁和钢等重要的合金生铁是含碳量为2%~4.3%的铁合金,其中还含有硫、磷、硅等杂质。
钢是含碳量为0.03%~2%的铁合金,钢是由生铁在炼钢炉中进一步冶炼除去过多的碳、硅、硫、磷而得到的。
钢的性能比生铁优越。
合金是由一种金属跟其他金属(或非金属)熔合形成的具有金属特性的物质。
合金具有许多良好的物理、化学或机械性能。
3.认识金属材料在生产、生活和社会发展中的重要作用。
4.含杂质物质的质量计算方法:纯净物质量=不纯物质量×物质质量分数。
1.重点:⑴铁的冶炼。
⑵合金的特点及应用。
2.难点:(1)铁的冶炼。
(2)用所学知识解释和解决生活中有关金属和合金的问题。
3.疑点:(1)冶炼生铁时为什么要用焦炭而不用煤?(2)炼铁时为什么生成的是生铁而不是纯铁?1、锌、铜与癌症人体是由多种元素组成的。
现代科学证明:人体要维持正常的新陈代谢所必需元素有27种。
其中14种为微量元素,虽然他们含量极微却对人体的健康起着重要的作用。
癌症和微量元素铜和锌在人体里的含量有着很密切的关系。
我国广东顺德、江苏启东等癌病高发区的土壤、水、农作物中铜都高于非癌高发区,而锌低于非癌高发区;对肝癌、胃肠道癌等多种恶性肿瘤患者的血清分析都得出一致的结论:恶性肿瘤患者的血清锌与铜的比值明显低于正常人,而进行手术摘除恶性组织或药物治疗后,患者血清中锌与铜比值回升,可见铜、锌与癌病的关系最为显著。
锌、铜与癌症关系的机理可能在于:锌控制着生物膜的稳定性,可增强膜抵抗自由基攻击和脂质过氧化物损伤的功能;另外,锌对提高生物体的免疫功能有一定的作用。
铜进入肝细胞后与蛋白质、氨基酸或一些化学致癌物质形成致癌作用较强的金属大分子络合物;过量的铜离子作用于DNA,导致恶性细胞的分裂、生长。
总之,象铜、锌等人体内微量元素主要是通过和有机物形成生物大分子来影响人体生理机能的。
2、具有多种用途的铂金除了强度和密度之外,铂金还拥有另外一项出色品质:柔韧性。
铂金十分柔韧,只需1克铂金,就可以拉成超过1英里(近2公里)长的细丝。
这种品质,加上铂金的强度,令珠宝商们能够创造出极其柔韧的网状铂金首饰,而其他贵重金属绝对无法做到这一点。
铂金在其他领域也十分必需:它可以用于工业领域,最著名的就是用在催化反应器中。
铂金在医疗领域中也扮演着重要的角色,它不受血液氧化作用的影响,具有出色的传导性,且能与活组织相容。
由于上述这些特性,铂金被应用于心脏起博器中。
目前,超过五万人依靠心脏起博器健康地生活着。
对他们而言,铂金是一种能够拯救生命的金属。
3、老年痴呆症的罪魁祸首金属铝在现代工业中大显身手的同时,也渗入到了我们的家庭。
为此有人开始研究铝对人体健康的影响。
长期以来,人们一直认为铝是一种对人体无害的金属元素,治疗胃酸过多的药——胃舒平的主要成分就是氢氧化铝。
然而,近代科技的发展,对“铝无害论”提出了异议。
l975年,美国佛蒙特医院雷弗教授等用电子显微镜和X射线衍射光谱测定法分析了多名老年痴呆症患者的神经元,结果发现这些人的神经元中,铝的含量比正常人多了2~4倍。
后来,美国科学家达伦用原子吸收光谱分析了老年痴呆症人的大脑,发现他们脑中铝的含量竟是正常人的5倍。
美国的一个医疗小组到世界上饮水含铝量最高的关岛调查,最后发现那里患老年痴呆症的人数比正常地区多了3~5倍。
这些都证实铝是老年痴呆症的罪魁祸首。
那么,铝为什么会导致老年痴呆症呢?这个问题还在争论中。
一般的观点认为由于三价铝离子有空的电子轨道,易与碱基对中含未成对电子的原子结合,并进入神经元细胞中,使神经细胞释放的传递物质如乙酚胆碱等不能顺利通过,从而导致神经传递系统受阻,引起铝的过量摄入往往是由于不正确使用铝制品引起的。
大家知道,铝在空气中会形成一层致密的氧化铝,可保护它免受进一步的腐蚀,但这层保护膜并非坚不可摧,在酸性或碱性溶液中易被破坏。
因此我们平时应养成科学使用铝制品的习惯,如不用铝制品存放酸、碱食物,尽量缩短食物在铝制品中的存放时间,尽量不用铝锅炒菜,让比铝硬的金属制品(如铁勺)与铝制品接触,不用硬质抹布如百洁布擦洗铝制品,等等。
当然,平时加强体育锻炼,增强身体活力,也是防止铝元素在体内存积的好办法。
4、在金属活动性顺序里为什么包括氢1865年,贝开托夫在实验的基础上,根据金属和金属离子间互相置换能力的大小,以及金属跟酸、跟水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里就已包括了氢。
因为氢可以被位于它前面的金属从稀酸里置换出来,而氢也可以把位于它后面的金属,从它们的盐溶液里置换出来,而氢后面的金属不能从酸中置换出氢。
这就是说,贝开托夫当时区分金属的活泼与不活泼,是以氢作为标准的。
当然,早期的化学家把金属跟酸、跟水等反应的剧烈程度作为衡量金属活动性大小的标志是不严格的。
准确的方法是以金属的标准电极电势来比较金属的活动性大小,而标准电极电势也是以氢电极定为零作为标准来测定的。
标准电极电势为负值的金属比氢活泼;标准电极电势为正值的金属活动性小于氢。
另外,氢的原子结构决定它在化学反应中表现出与碱金属具有相似的化学性质。
例如,氢具有还原性,能和大多数非金属反应显示+1价;等等。
由于以上几个方面的原因,因此把氢排进了金属活动性顺序里。
/web/maintain/driver/1.htm/200406/ca424033.htm/teacher/details.asp?TopicAbb=design&SubjectAbb=hx&FileN ame=C30hxs246t01.htm&FileID=3980&Title=%B5%DA%C1%F9%BD%DA%A1%A1%BB%AF%BA%CF%BC%DB /hyfw/mrgd0.asp?newsid=9例1、下列说法错误的是()A.地壳中的铁都以化合物形式存在B.生铁和钢都不能完全溶解在盐酸中C.锯条上的烤蓝是一层致密的氧化膜钢是由生铁炼制而成的,因而钢不会生锈D.是铁,差别是含碳量不同,也就是它们除含铁外还含碳,碳不能溶于酸。
烤蓝是通过化学处理的方法在钢铁表面形成防锈层——致密氧化膜。
生铁是含碳量为2%---4.3%的铁合金,其中还含有硫、磷等杂质。
的铁的合金.不论是生铁还是钢中的主要成分铁的化学性质不变。
钢是含碳量为0.03%----2%变式题1.下列说法中正确的是()A.生铁和钢都是铁的单质B.生铁和钢都是化合物C.生铁和钢都是铁的合金D.生铁和钢硬度比纯铁小例2、(2004 江苏南京)下列两个成语与我们所学的化学知识有关。
请你任选一个,简述其中的化学原理。
A.百炼成钢(将反复烧红的生铁在空气中不断锤打,转化为钢)B.釜底抽薪(釜:指古代炊具,相当于现在的锅;薪:指柴火)你选择的成语是。
其中的化学原理:。
“百炼成钢”有两个要点:①生铁与钢的区别;②生铁转化为钢时发生的化学反应。
“釜底抽薪”也包含两个要点:①可燃物是燃烧的必备条件之一;②移走可燃物可以灭火。
;锤打烧红的生铁时,生铁中的碳与氧气等反应生成了二氧化碳,使含碳量降低,转变为钢。
B;燃烧需要可燃物,减少可燃物不利于燃烧。
(其他合理答案均可).。
变式题2.在古代,人们把在高温下烧红的生铁反复锤打,最终使生铁转化为钢,这也是成语“百炼成钢”的来历。
请你写出在上述转变中最关键的一步反应的化学方程式:。
=CO22例3、(2003 湖南长沙)生铁和足量的稀盐酸充分反应后会留下黑色残渣,该残渣的主要成分是,铁与稀盐酸反应的化学方程式为。
气,而碳不能与稀盐酸反应,故剩余的黑色残渣的主要成分是碳。
Fe+2HCl=FeCl2+H2↑变式题3.将铁放入下列溶液中,溶液的质量会减少的是()。
(A)(B)(C)(D)例4、依据反应:X+C=2Y 和Fe2O3+3Y=2Fe+3X,推断X和Y各表示()A.CO 和CO2 B.H2O 和CO C.CO2和CO D.CO2和H2联想炼铁反应:Fe2O3+3CO=2Fe+3 CO2知,X为CO2,Y为CO,代入反应:X+C=2Y 验证,CO2 +C=2CO,符合题意。
C变式题4在Fe2(SO4)3和FeSO4的混合物中,如果硫元素的质量分数为a%,则铁元素的质量分数为()A.1.31a% B.2.25a% C.(100-4a)% D.(100-3a)%D例5、现有:①磁铁矿(主要成分:Fe3O4);②黄铁矿(主要成分:FeS2);③赤铁矿(主要成分:Fe2O3)。
请从多角度分析这三种矿石中哪种不适合用来炼铁?原因是。
通过对三种物质的化学式,可知含铁元素质量分数由大到小的顺序是:Fe3O4>Fe2O3>FeS2 ,从各物质组成中可知,使用FeS2炼铁可能产生对空气有污染的SO2。
综合以上分析得出结论是黄铁矿最不适合用来炼铁。
黄铁矿;黄铁矿中含铁的质量分数最低,冶炼过程中还可能产生有害气体SO2。
审视此题,应注意“多角度”三个字。
通过对三个化学式的分析和比较,理清本题思路如下:既要从各物质中的含铁量来考虑,又要从对空气是否有污染的角度来考虑。
提醒同学们在平时学习中要注意从多方面、不同角度思考问题,得出结论。
变式题5山东省烟台市2003年常见的铁矿石有:磁铁矿(主要成分是F e O34)、赤铁矿(主要成分是F e O23)、褐铁矿(主要成分是F e O H O2323 )、菱铁矿(主要成分是F e C O3)、黄铁矿(主要成分是F e S2)。
其中理论上最适宜炼铁的两种矿石为__________,理由是_______________。
解答:磁铁矿、赤铁矿铁的百分含量高,有害元素少。
例6、(2003年湖南长沙)下列化合物中,铁元素质量分数最小的是()A.FeOB. Fe2O3C. Fe3O4D.FeSFeO为标准,将Fe的原子个数定为1,则把各式变形为:FeO Fe2O3 Fe3O4 FeSFeO FeO 2观察转化后各项,另一元素(或部分)的相对原子(或部分)质量越大,则铁元素的质量分数越小。
解题的方法是变式同异法。
即运用转化的方法把化学式变形为易于分析的形式,一般不看转化后相同的部分,而分析比较差异的部分。
变式题6.下列物质中,铁元素含量最高的是()A.Fe(OH)2B.Fe(OH)3C.Fe2O3D.Fe3O42334例7、实验室准备选用铁、氧化铜、稀硫酸三种物质制取铜。
下面是两位同学的实验设计方案,哪种方法好,理由是什么?Fe ————→H 2 —————→ CuH 2SO 4 FeCuO ————→CuSO 4————→ Cu本题要求我们通过分析、比较两种实验方案的异同,判断出哪一种实验方案更优越。
