建立人肾小管上皮细胞蛋白质组双向电泳的分离体系
蛋白质组双向电泳原理及实验步骤ppt课件.ppt

中国历史上吸烟的历史和现状、所采 取的措 施以及 由此带 来的痛 苦和灾 难,可 以进一 步了解 吸烟对 人民健 康的危 害,提 高师生 的控烟 意识
• 最高电压10,000 V • 10–25C 温度控制 • 7, 11, 17, 18, 和 24 cm的聚
焦盘,可以各放12根胶条 • 可以储存10个程序,每个程序有
中国历史上吸烟的历史和现状、所采 取的措 施以及 由此带 来的痛 苦和灾 难,可 以进一 步了解 吸烟对 人民健 康的危 害,提 高师生 的控烟 意识
实验操 作
Method
原理
Theory
应用
Application
中国历史上吸烟的历史和现状、所采 取的措 施以及 由此带 来的痛 苦和灾 难,可 以进一 步了解 吸烟对 人民健 康的危 害,提 高师生 的控烟 意识
中国历史上吸烟的历史和现状、所采 取的措 施以及 由此带 来的痛 苦和灾 难,可 以进一 步了解 吸烟对 人民健 康的危 害,提 高师生 的控烟 意识
二维SDS-PAGE
• 同普通SDS-PAGE类似。
• 但一般在垂直电泳系统中无需浓缩胶,因 为在IPG胶条中蛋白质区域已得到浓缩, 可以认为非限制性IEF胶(低浓度丙烯酰胺 胶)充当了浓缩胶。
l 设置等电聚焦时的温度。(17℃)
中国历史上吸烟的历史和现状、所采 取的措 施以及 由此带 来的痛 苦和灾 难,可 以进一 步了解 吸烟对 人民健 康的危 害,提 高师生 的控烟 意识
配制SDS-PAGE凝胶
配制12%的丙烯酰胺凝胶,直接用双向电 泳专用梳子;或在上部留0.5cm的空间, 用MilliQ水、乙醇或水饱和正丁醇封胶。 聚合30分钟。
第
一
向
双向电泳详细操作过程
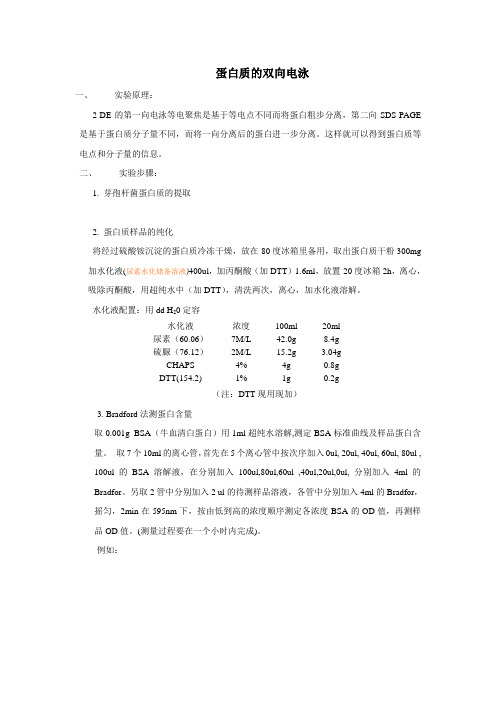
蛋白质的双向电泳一、实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE 是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二、实验步骤:1. 芽孢杆菌蛋白质的提取2. 蛋白质样品的纯化将经过硫酸铵沉淀的蛋白质冷冻干燥,放在-80度冰箱里备用,取出蛋白质干粉300mg 加水化液(尿素水化储备溶液)400ul,加丙酮酸(加DTT)1.6ml,放置-20度冰箱2h,离心,吸除丙酮酸,用超纯水中(加DTT),清洗两次,离心,加水化液溶解。
水化液配置:用dd H20定容水化液浓度100ml 20ml尿素(60.06)7M/L 42.0g 8.4g硫脲(76.12)2M/L 15.2g 3.04gCHAPS 4% 4g 0.8gDTT(154.2) 1% 1g 0.2g(注:DTT现用现加)3. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 20ul, 40ul, 60ul, 80ul , 100ul的BSA溶解液,在分别加入100ul,80ul,60ul ,40ul,20ul,0ul, 分别加入4ml的Bradfor。
另取2管中分别加入2 ul的待测样品溶液,各管中分别加入4ml的Bradfor,摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
例如:标准曲线方程式:Y= aX+b.其中Y为OD值,X为蛋白含量。
a、b通过作图输入数据可知G250的配置:称取G250 固体0.1g加水定容至1L。
使用前滤纸过滤。
比色皿用70%的乙醇保存,待用时用双蒸水冲洗,再用无水乙醇冲洗,双蒸水冲洗,再加入待测样品溶液润洗,然后,加入样品,测定OD值。
蛋白质双向电泳简介

IPG 胶的水合及上样
2-DE 样品
水合溶液
IPG 胶条支架
水合溶液:
8M
尿素
2%
NP-40 或 CHAPS
2%
IPG缓冲液 (两亲性电解液)
0.28% DTT
微量 溴酚蓝
IPG 胶条 定位
水合目的:使样品能完全以可溶形式进入IPG胶条内
蛋白载样量
IPG胶条对蛋白载样量的影响因素:
待分析的蛋白点的量应满足随后的质谱分析待研究蛋白的丰度 样品的复杂度
IPG 胶条的平衡
平衡液 6 M 尿素和30% 甘油 减少电内渗
SDS-PAGE均一胶各成分用量
双向电泳(2DE)示意图
等电聚焦,实现蛋白质按等电点进行分离
提取的总蛋 白溶液
大 分子量
SDS-PAGE 分离,使得 蛋白质按分 子量大小排 序
小
通过双向电泳使得不同等电点和分子量的 蛋白质根据其自身特性分布到凝胶的不同
位置从而实现蛋白质的双向分离
步骤
样品制备 胶条水合 等电聚焦 聚焦后胶条平衡 第二相SDS-PAGE 分离蛋白质的检测与匹配分析
通过细胞破碎方法从原材料中提取粗蛋白质, 然后用含变性剂(或离液剂)、去污剂和还原剂 的裂解液溶解蛋白并使其变性。提取的蛋白可 用裂解液稀释。裂解液也可结合IPG胶条上基 质以维持IEF期间的蛋白质的稳定性。变性剂 尿素和硫脲与IEF兼容。用高浓度的变性剂以 打断蛋白质样品中的氢键结构。使用非离子型 或两性去污剂以破坏疏水交互作用。
在蛋白样品裂解时,应以溶解尽可能多的蛋白 质和保持在整个双向电泳过程中蛋白质的溶解 性为主要目标。根据目前的实践经验,蛋白质 变性成为多肽链便于多肽序列能够与其相应基
因序列匹配。二次样品制备的目的是去除干扰 双向电泳的非蛋白物质(如盐、酚类物质、脂 类、多糖和核酸等)和阻止在双向电泳谱中导 致假点的多肽或蛋白修饰。此外,用于样品制 备的药剂必须与等电聚焦兼容。
人胆汁蛋白质组双向荧光差异凝胶电泳图谱的建立与差异分析

1.样本纯化效果:经脱盐、脱脂、去除核酸等处理 后,胆汁粘滞度明显降低,色泽由棕黄变为淡黄,透光 度由毛玻璃样变为透明。置换缓冲液后,其pH值为 8.5,符合荧光标记的最佳pH值范围。在对处理后的 胆汁样本荧光标记实验中,各电泳条带均分界清楚,背 景清晰,无核酸及脂质残留所造成的条带模糊、拖尾与 背景干扰;hnel(12斗g)、L丑ne2(6峭)、Lane3(3¨g) 三个泳道中样本的荧光强度值分别为119 648 601.64、 78 517 575.9l、35 629 602.36;荧光强度与蛋白量呈线 性关系(图1)。
cnlde弛p∞“on.coⅡImerci8l k“s Cle明舶ei钯and microcon were adopted to remove the abund舳t Hpid肌d
salt.舢kr qu如t的by BCA Kit,concentrated and pudfied samples were labeled“tIl three di&rent CyDyes
图1经Cy2标记的不同浓样本的荧光 强度与蛋白浓度呈线性关系
2.胆汁2D.DIGE电泳图谱的建立:实验组、对照 组及内标组样本经纯化处理并标记不同的荧光染料 后,同一凝胶内分别获得3幅凝胶电泳图谱用于匹配 蛋白质点表达量的胶内差异分析(DIA)。6块凝胶中 的12例样本共获得了18幅双向电泳图谱(实验组,对 照组及内标组各6幅),其中5块凝胶中的15幅图谱 蛋白质点分离清晰,可用于生物学变异分析(BVA)。 A、B、C、D分别显示了同一凝胶中不同组别样本标记 cy2、Cy5、cy3荧光染料后所获取的双向电泳图谱,其
基金项目:国家高新技术研究发展计划(863)项目(2002AA241061) 作者单位:430030武汉,华中科技大学同济医学院附属同济医院普 外科(陈波、汪昕、邹声泉);烟台毓璜顶医院肝胆外科(刘小方);华中 科技大学同济医学院蛋白质组学研究中心(鲁艳军) 通讯作者料:本组12胆汁样本(肝门部胆管癌及 胆总管结石各6例)均取自于2006年3月至2006年 lO月在同济医院普通外科行手术治疗的患者。所有 病例均经病理活检和/或术中探查证实。荧光染料 (Cy2、cy3、Cy5)、二硫苏糖醇(DrI-I')、尿素、十二烷基 磺酸钠(SDs)、过硫酸铵、低熔点琼脂糖、溴酚蓝、 CHAPs、丙烯酰胺、甲叉双丙烯酰胺、TEMED、碘乙酰 胺、PHAMLYTE、mG缓冲液(pH4~7)及lPG胶条(pH 范围4—7,18 cm)均购于Amersham Pha删acia公司。 非离子型脱脂剂(Cleanascite’M HC 100)由美国Biotech 公司惠赠。微量超滤管(MICROCONo YM-3,截醑相 对分子质量为3×103)购于Miuipore公司。BCA蛋白 定量试剂盒为Pierce公司产品。其余试剂均为国产分 析纯。E仕an IPG phorⅡ等电聚焦仪、垂直电泳仪、De.
肺癌组织中蛋白质组双向电泳图谱分析方法的建立

Journal of Zhengzhou University (M edical Sciences) M ay. 2005 Vol. 40 No. 3
·417·
ZHAN G Hu izhen1) , FAN Q ing tang1) , WU Y im ing2) 1 ) D epa rtm en t of Environm en ta l Hea lth, College of Public Hea lth, Z hengzhou U n iversity, Z hengzhou 450052 2 ) D epa rtm en t of O ccupa tiona l Hea lth and Tox icology, College of Public Hea lth, Z hengzhou U n iversity, Z hengzhou 450052
1 材料与方法
1. 1 标本的收集和蛋白质的提取 实验采用的肺 癌组织和配对的癌旁组织标本均取自郑州大学第一 附属 医 院 , 经 病 理 学 鉴 定 。提 取 组 织 总 蛋 白 [ 3 ] , B radford方法检测蛋白浓度 [ 4 ] , - 80 ℃保存备用 。 1. 2 固相 pH梯度 2SD S双向凝胶电泳 使用 B IO 2 RAD 公司的双向电泳仪 。第一相等电聚焦使用的 预制胶条 pH 3~10。样品 100 μg中加入上样缓冲 液 ,总的 v·h为 80 000。第二相 SDS2PAGE电泳使 用 120 g /L 凝胶 。考马斯亮蓝染色 。 1. 3 图像采集与分析软件 使用 GS2800获取图像 后 ,用 PDQuest 7. 1 软件对图像进行剪切 、编辑 、点 检测 、点匹配 。
5 Van Heek2Romanow ski R , Putter S, Trarbach T, et al. Etopo2 side toxicity on human neuroblastoma cells in vitro is en2 hanced by p receeding hypertherm ia. M ed Pediatr Oncol, 2001, 36 (1) : 197
双向电泳

双向电泳的应用及研究进展摘要:双向电泳是蛋白质组学研究中最常用的技术,具有简便、快速、高分辨率和重复性等优点。
本文重点介绍了双向电泳的基本原理及其应用。
同时对当前双向电泳技术面临的挑战和发展前景进行了讨论。
关键词: 双向电泳,应用,前景1.1双向电泳技术概述双向电泳(two-dimensional gel electrophoresis, 2-DE)是蛋白分离的黄金标准,由此可以分析生物样品的显著差别,产生的结果用于诊断疾病、发现新的药物靶标和分析潜在的环境和药物的毒性。
双向电泳分离技术利用复杂蛋白混合物中单个组分的电泳迁移,第一向通过电荷的不同分离,另一向通过质量的不同分离。
双向电泳协同质谱技术是正在出现的蛋白组学领域的中心技术。
双向电泳是一种分析从细胞、组织或其他生物样本中提取的蛋白质混合物的有力手段,是目前唯一能将数千种蛋白质同时分离与展示的分离技术,其高分辨率、高重复性和兼具微量制备的性能是其他分离方法所无与伦比的。
双向电泳技术、计算机图像分析与大规模数据处理技术以及质谱技术被称为蛋白质组研究的三大基本支撑技术。
可见双向电泳在蛋白质组学研究中的重要性。
就像Fey和Larsen在他们的综述中提到:“尽管人们都想有新技术取代它,可是如果希望对细胞活动有全面的认识,其他技术无法在分辨率和灵敏度上与双向电泳相媲美”。
1.2双向电泳基本原理1975年,意大利生化学家O’Farrell发明了双向电泳技术[1],双向电泳是指利用蛋白质的带电性和分子量大小的差异,通过两次凝胶电泳达到分离蛋白质群的技术。
双向电泳技术依据两个不同的物理化学原理分离蛋白质。
第一向电泳依据蛋白质的等电点不同,通过等电聚焦将带不同净电荷的蛋白质进行分离。
在此基础上进行第二向的SDS聚丙烯酰胺凝胶电泳,它依据蛋白质分子量的不同将之分离。
双向电泳所得结果的斑点序列都对应着样品中的单一蛋白。
因此,上千种蛋白质均能被分离开来,并且各种蛋白质的等电点,分子量和含量的信息都能得到。
适于人表皮组织蛋白质组分析的双向电泳技术

第29卷第3期2008年5月中山大学学报(医学科学版)JOURNALOFSUNYAT-SENUNIVERSITY(MEDICALSCIENCES)Vol.29No.3May2008・技术研究・适于人表皮组织蛋白质组分析的双向电泳技术聂燕芳1,曾耀英1,吴晓萍1,刘钧澄2,黄秀艳1(1.暨南大学组织移植与免疫中心,广东广州510632;2.中山大学附属第一医院小儿外科,广东广州510080)摘要:【目的】建立适于人表皮组织的双向电泳技术,并应用质谱技术对人表皮组织蛋白质组进行初步分析。
【方法】利用组织匀浆法制备人表皮组织总蛋白、固相pH梯度胶条进行双向电泳、PDQuest7.4软件比较和分析电泳图谱,利用质谱技术鉴定部分蛋白斑点。
【结果】成功建立了适用于人表皮组织蛋白质组分析的双向电泳技术,获得和比较了人表皮组织双向电泳四种染色图谱。
人表皮组织的蛋白质在pH5~8范围内分布均匀,分子量集中在15~100ku之间。
银染图谱获得的蛋白斑点数为586±14;对质谱兼容的几种染色方法进行比较分析,结果表明Neuhoff胶体考染更适合于人表皮组织蛋白质的双向电泳分析,其在上样量为350μg时蛋白斑点数达394±9,匹配率为85.53%。
利用基质辅助激光解析电离飞行时间质谱技术成功获得了Neuhoff胶体考染的两个蛋白斑点的肽质量指纹图谱,并鉴定为Caspase14前体和27ku热激蛋白1。
【结论】建立的表皮组织双向电泳技术及其图谱可为皮肤蛋白质组学研究提供参考,为人皮肤蛋白质组学平台的构建奠定良好基础。
关键词:人表皮组织;双向电泳;蛋白质组;肽质量指纹图谱中图分类号:Q51文献标识码:A文章编号:1672-3554(2008)03-0337-05Two-dimensionalElectrophoresisforProteomicsAnalysisofHumanEpidermisNIEYan-fang1,ZENGYao-ying1,WUXiao-ping1,LIUJun-cheng2,HUANGXiu-yan1(1.InstituteofTissueTransplantationandImmunology,JinanUniversity,Guangzhou510632,China;2.DepartmentofPediatricSurgery,TheFirstAffiliatedHospital,SUNYat-senUniversity,Guangzhou510080,China)Abstract:【Objective】Toestablishtwo-dimensionalelectrophoresis(2-DE)technologyforhumanepidermis,andanalyzetheproteomeofhumanepidermisbymassspectrometry.【Methods】Totalproteinsofepidermiswereextractedbyhomogenizationandseparatedby2-DEusingimmobilizedpHgradient(IPG)strips.The2-DEmapswerematchedandanalyzedusingimageanalysissoftwarePDQuest7.4,andsomeoftheproteinspotswereidentifiedbymassspectrometry.【Results】The2-DEmethodsforproteomicsanalysisofhumanepidermiswassuccessfullyestablished,andfourdifferentstaining2-DEprofileswereobtainedandcompared.ProteinsspotswerewelldistributedinpH5~8andmolecularweightrangeof15ku~100ku.586±14proteinspotsweredetectedinthesilverstainingmaps.Withinthethreestainingmethodscompatiblewithmassspectrometry,Neuhoff'scolloidalstainingwasmostsuitablefortheproteomicsanalysisofhumanepidermis.With350μgproteinloaded,394±9proteinspotsweredetectedwithamatchrateof85.53%.Finallythepeptidemassfingerprinting(PMF)oftwooftheproteinswereobtainedusingmatrix-assistedlaserdesorption/ionization-time-of-flightmassspectrometry,andthenidentifiedasCaspase14precursorandHeatshock27kuprotein1.【Conclusion】Theestablished2-DEmethodsandmapsofepidermisprovidereferencedataforskinproteomicstudies,andhelptoconstructtheplatformforhumanskinproteomics.Keywords:epidermis;two-dimensionalelectrophoresisprofiles;proteome;PMF[JSUNYat-senUniv(MedSci),2008,29(3):337-341]收稿日期:2007-11-21基金项目:国家重点基础研究规划项目973计划项目(2004CB720100);国家重点基础研究发展计划973项目(2006CB504201)作者简介:聂燕芳(1979-),女,广东博罗人,在读博士研究生,E-mail:snyanf@jnu.edu.cn;曾耀英,通讯作者,研究员,博士生导师,E-mail:tzengyy@jnu.edu.cn中山大学学报(医学科学版)第29卷目前,蛋白质组学技术在人皮肤研究领域的应用仍处于初步发展阶段,而表皮蛋白质组双向电泳图谱大多建立在人角质形成细胞系[1-4]或者原代培养的角质形成细胞[5]的基础上,关于人表皮组织蛋白质组的报道并不多见,在国内更尚未见报道。
双向电泳泳实验方案

双向电泳实验方案1.双向电泳总蛋白(培养细胞)提取方法:方案一细胞培养在10cm的培养皿中,待培养至80%左右密度时,细胞用预冷的PBS漂洗3次,加450μl裂解液,细胞刮刀收集,用移液器转移至1.5ml离心管中,反复吹打。
(折合在六孔板中,每孔加裂解液50μl)之后将样品用超声波细胞破碎仪超声处理超声时间为5s,间歇时间为10s,功率为100-120W,超声处理至溶液清澈无粘稠物为止,处理过程在冰浴中进行,超声处理后,4℃、25000g离心1h。
取上清进行蛋白质浓度测量,按实验所需的量分装后-80℃冰箱中保存。
(裂解液成分:8mol/L脲,65mmol/L DDT,4%CHAPS,40mmol/L Tris)方案二1.1试剂(1)抽提缓冲液9mol/L脲 5.4g4%CHAPS 0.4g0.5%IPG缓冲液(PH 3-10)(AP Biotech) 50.0μl50mmol/L DDT 0.077gH2O 加至10ml(2)IPG缓冲液(PH 3-10)(AP Biotech)(3) 磷酸盐缓冲液(PBS),冰冻1.2仪器(1) 细胞刮刀(2)离心机(低温,低速)(3)滤纸(4)冰浴装置(5)超速离心机(低温)(6)漩涡混合器1.3细胞培养的GC-1 spg细胞1.4方法1.从培养皿中转移细胞:用细胞刮刀从培养皿中刮下细胞,用5ml移液器将培养基和细胞转移至15ml离心管中。
2.480g、4℃离心沉淀细胞5min。
3.弃去上清,勿搅动沉淀要点:操作一下步骤时,所有细胞需保持冰冻状态;不离心或震荡时保持细胞在冰上。
4.离心管中加入10ml冰冻PBS,来回吹打重悬细胞。
5.480g、4℃再次离心细胞5min。
6.弃去上清,勿搅动沉淀。
7.重复步骤4-6两次。
8.在最后一次洗涤后,把离心管完全空干,用滤纸将沉淀上残留的PBS吸干。
9.用移液器将抽提缓冲液加到离心管中。
依赖所研究的细胞系来确定抽提缓冲液的体积。
蛋白质组学研究介绍结合双向电泳

蛋白质组学研究的主要内容和方法
蛋白质表达分析
研究不同生理或病理条件下蛋白质的表 达水平变化,揭示蛋白质的表达模式和
规律。
蛋白质相互作用研究
利用酵母双杂交、免疫共沉淀等技术 手段,研究蛋白质之的相互作用和
复合物的形成。
蛋白质功能研究
通过基因敲除、基因敲减、定点突变 等技术手段,研究蛋白质的功能和作 用机制。
智能化
结合人工智能和机器学习技术,实现双向电 泳的智能化分析,自动识别和鉴定蛋白质, 提高数据分析的准确性和可靠性。
拓展双向电泳技术的应用领域
临床诊断
01
将双向电泳技术应用于临床诊断,通过对生物标志物的检测和
分析,辅助医生进行疾病诊断和治疗方案的制定。
药物研发
02
利用双向电泳技术筛选和鉴定药物作用靶点,为新药研发提供
蛋白质芯片技术
高通量、快速、简便,但灵敏度和分辨率相对较低,且覆盖的蛋白质数量有限。
双向电泳与蛋白质免疫印迹技术的比较
双向电泳
可以对全蛋白质组进行分离和定性,分 辨率高。
VS
蛋白质免疫印迹技术
可以对特定蛋白质进行检测和定量,灵敏 度高,但只能针对已知的蛋白质进行检测 。
05
双向电泳技术的发展前景 和展望
蛋白质的纯化
通过双向电泳,可以去除样品中的杂 质,提高蛋白质的纯度,从而获得更 准确的鉴定结果。
蛋白质的表达和鉴定
蛋白质表达分析
通过比较不同生理状态或不同组织中 蛋白质的表达模式,可以研究蛋白质 的表达水平,进而了解其在生命活动 中的作用。
蛋白质鉴定
通过与已知蛋白质的数据库进行比对, 可以鉴定出双向电泳图谱中的蛋白质, 为后续的功能研究提供依据。
双向电泳原理及实验步骤

银染(Silver Stain Plus™ stain)
荧光染色(SYPRO® Ruby protein gel stain)
适用于质谱的染色方法
考马斯亮蓝染色
银染的检测灵敏度很高,可达到200pg,但其线性很差。普通的银染过程中因醛类的特异反应,而与下游质谱不兼容。
快速银染法,可与下游质谱兼容,但其检测灵敏度较低,并伴有很深的背景干扰。
聚焦时间的优化
IEF的基本条件
Stemp 1
Stemp 2
Stemp 3
total
voltage
Time
Volt-Hours
Ramp
250
20min
---
Linear
4000
4000
2hr
---
---
10,000V-hr
Linear
Rapid
5 hr
14,000V-hr
7 cm
Stemp 1
Stemp 2
双向电泳样品的溶解
是成功进行双向电泳的最关键因素之一 溶解的目标: 样品中非共价结合的蛋白质复合物和聚积体完全破坏,从而形成各个多肽的溶解液; 必须允许可能干扰2-DE分离的盐、脂类、多糖和核酸等物质的去除; 保证样品在电泳过程中保持溶解状态。
离液剂:通过改变溶液中的氢键结构使蛋白质充分伸展,将其疏水中心完全暴露,降低接近疏水残基的能量域。典型代表是尿素和硫尿。
02
样品上样缓冲液
标准溶液:
Reagent
Amount
8M urea
47ml of 8.5 stock or 24g urea in 25ml H2O
50mM DTT or 2mM TBP
385mg or 500ul of 200mM TBP stock
蛋白质组学研究中双向电泳的样品制备

医学分子生物学杂志,2008,5(5):4622465 J Med Mol B i ol,2008,5(5):4622465DO I 11013870/j 1issn 1167228009120081051019通讯作者:陈智(电话:0571287236579,E 2mail:chenzhi@zju 1edu 1cn )Corres ponding author:CHEN Zhi (Tel:862571287236579,E 2mail:chenzhi@zju 1edu 1cn )蛋白质组学研究中双向电泳的样品制备谈旭翡,陈智浙江大学医学院附属第一医院传染病诊治国家重点实验室 杭州市,310003【摘要】 蛋白质组学是目前生命科学研究中的一个热点,而双向电泳技术是现阶段大多数蛋白质组学研究中分离蛋白质混合物时所采用的主要技术。
在双向电泳技术中,样品制备是整个分离过程中的关键一步,对实验结果将起到决定性作用。
文章介绍了双向电泳技术的样品来源,并重点对样品制备过程一般包括的步骤,如样品匀质化、蛋白质溶解、干扰物去除和蛋白质富集等进行了详细说明。
随着样品制备技术的发展,双向电泳技术将在蛋白质组学的研究中发挥更为显著的作用。
【关键词】 蛋白质组学;双向电泳;样品制备【中图分类号】 R349184Research Progress on Sam ple Prepara ti on of Two D i m en si ona l Elec 2trophoresis i n Proteo m i csT AN Xufei,CHEN ZhiS tate Key L aboratory forD iagnosis and Treat m en t of Infectious D iseases,The F irst A ffiliated Hospital,College of M edicine,Zhejiang U niversity,Hangzhou,310003,China【Abstract 】 Pr oteom ics is currently a hots pot in the field of life science,while T wo D i m ensi onal Electr ophoresis is the most commonly used technol ogy in the separati on of p r oteins 1Sa mp le p repara 2ti on is a key step in separati on p r ocess,which deter m ines experi m ental results 1This article intr o 2duces sa mp le s ources and mainly exp lains the p r ocess of sa mp le p reparati on,including homogeniza 2ti on,s olubilizati on,re moval of interferential fact ors and p r otein enrich ment 1W ith the devel opment of sa mp le p reparati on technique,T wo D i m ensi onal Electr ophoresis will be increasingly i m portant in the study of p r oteom ics 1【Key words 】 p r oteom ics;t w o di m ensi onal electr ophoresis;sa mp le p reparati on 自1975年O ’Farrel 等[1]建立双向电泳技术以来,由于其具有高分辨率和高灵敏度的特性,已成为蛋白质组学研究的重要方法。
建立人肾小管上皮细胞蛋白质组双向电泳的分离体系

建立人肾小管上皮细胞蛋白质组双向电泳的分离体系张春燕;刘友平;杨烨;龚舒;李洪【摘要】背景:双向电泳分离技术是蛋白质组学研究的核心技术之一,但蛋白质样品的分离效果受各种实验条件的影响较大.因此,针对不同来源的蛋白样品进行实验条件的优化可获得具有较高分辨率的双向电泳图谱.目的:拟建立优化的人肾小管上皮细胞株蛋白质组双向电泳分离体系.方法:常规培养人肾小管上皮细胞株HK-2细胞并裂解提取全蛋白,按标准条件对蛋白质进行双向电泳分离,并对各个关键因素进行优化.等电聚焦采用缓慢升压模式,电泳参数根据Bio-Rad公司的预设方案进行调整.改良硝酸银法进行蛋白质斑点染色.采集电泳图谱并分析双向电泳图谱中蛋白斑点的数量、图像分辨率及背景条纹的变化.结果与结论:通过对实验条件的筛选和优化,成功建立了具有较高的分辨率和重复性的人肾小管上皮细胞蛋白质组双向电泳分离体系.其中,优化后的裂解液配方成分为1%TBP,4%CHAPS,0.2%Bio-Lyte,40mmol/L Tris,8mol/L尿素,2 mol/L硫脲:采用pH 4~7的IPG胶条;上样方式选择被动的水化上样.等电聚焦过程中使用预设的缓慢升压模式,充分聚焦后选用合适的电压模式进行SDS-PAGE电泳,然后采用改良硝酸银法进行染色,最终获得了满意的蛋白质组双向电泳图谱.【期刊名称】《中国组织工程研究》【年(卷),期】2010(014)024【总页数】5页(P4416-4420)【关键词】双向电泳;蛋白质组;人肾小管上皮细胞;优化;分离体系【作者】张春燕;刘友平;杨烨;龚舒;李洪【作者单位】泸州医学院生物化学教研室,四川省泸州市,646000;泸州医学院生物化学教研室,四川省泸州市,646000;泸州医学院生物化学教研室,四川省泸州市,646000;人类疾病细胞信号与调控四川省高校点实验室,四川省泸州市,646000;泸州医学院生物化学教研室,四川省泸州市,646000;人类疾病细胞信号与调控四川省高校点实验室,四川省泸州市,646000【正文语种】中文【中图分类】R3180 引言双向电泳作为蛋白质组研究的三大核心技术之一,是目前分离复杂蛋白质组分最常用的工具[1]。
蛋白质双向电泳

模块五蛋白质双向电泳1. 实验目的掌握双向电泳能根据等电点和分子量分离蛋白质的原理,第一向等电聚焦电泳(IEF)和第二向聚丙烯酰胺凝胶电泳(SDS-PAGE)操作步骤,掌握凝胶染色方法,掌握凝胶分析软件的使用,了解对分离出的特异蛋白质的进一步分析方法,了解利用电泳技术分析生物大分子的方法。
2. 实验原理从广义上讲,双向电泳是将样品电泳后为了不同的目的在垂直方向再进行一次电泳的方法。
目前蛋白质双向电泳常用的组合第一向为等电聚焦(载体两性电解质pH梯度或固相pH梯度),根据蛋白质等电点进行分离,第二向为SDS-PAGE,根据相对分子质量分离蛋白质。
这样经过两次分离后,在凝胶上显示出的蛋白点可以获得蛋白质等电点和相对分子质量信息。
双向电泳技术作为分离蛋白质的经典方法,目前得到了相当广泛的应用。
在植物研究中,成功建立了拟南芥、水稻、玉米等植物种类的双向电泳图谱数据库,对推动植物蛋白质组研究起到重要作用。
第一向等电聚焦:等电聚焦(isoelectrofocusing,IEF)是在凝胶柱中加入一种称为两性电解质载体(ampholyte)的物质,从而使凝胶柱在电场中形成稳定、连续和线性pH梯度。
以电泳观点看,蛋白质最主要的特点是它的带电行为,它们在不同的pH值环境中带不同数量的正电荷或负电荷,只有在某一pH时,蛋白质的净电荷为零,此pH即为该蛋白质的等电点(isoeletric point,PI)。
在电场中,蛋白质分子在大于其等电点的pH环境中以阴离子形式向正极移动,在小于其等电点的pH 环境中以阳离子形式向负极移动。
如果在pH梯度环境中将含有各种不同等电点的蛋白质混合样品进行电泳,不管混合蛋白质分子的原始分布如何,都将按照它们各自的等电点大小在pH梯度某一位置进行聚集,聚焦部位的蛋白质质点的净电荷为零,测定聚焦部位的pH即可知道该蛋白质的等电点。
第二向SDS聚丙烯酰胺凝胶电泳:SDS是一种阴离子表面活性剂,当向蛋白质溶液中加入足够量的SDS时,形成了蛋白质-SDS复合物,这使得蛋白质从电荷和构象上都发生了改变。
双向电泳实验蛋白质样品制备要点

双向电泳实验蛋白质样品制备要点双向电泳是一种分析从细胞、组织或其他生物样本中提取的蛋白质混合物的有力手段,是蛋白质组学研究中的一种常用技术。
这项技术利用蛋白质的两种特性,即等电点与相对分子量,通过等电聚焦(IEF)与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)这两项技术,将上千种不同的蛋白质分离,同时得到每种蛋白质的等电点、相对分子量和含量等信息。
这里将蛋白质样本分为两种,一种是血清样本,另一种是组织和细胞样本,分别介绍样本的制备方法。
一、血清样本的制备血清和其他生物液体中的蛋白质存在有大量的白蛋白和IgG而很难用双向电泳分离,因为这些蛋白质会掩盖凝胶上的其他蛋白,从而难以分辨血清蛋白量。
而且这些蛋白质的等电点和分子量分布范围广,会掩盖一些低分度的蛋白质,因此需要使用白蛋白和IgG清除试剂盒(使用IgG结合树脂作为清除试剂),具体步骤如下:①用移液管移取15μL人血清,放入带盖样本管中(为保证良好的树脂与样本的混合,推荐采用一次性15mL离心管)。
②在含有样本的管中加入750μL悬浮匀浆,取液前必须保证树脂匀浆为均匀的悬浮液。
③室温下在振荡混合器上混合匀浆/样本混合液3分钟,混合转速应确保混合液处于悬浮液状态。
④将微离心柱的底端折去,置于试剂盒中所配的离心管中。
⑤孵育完成时,确保树脂处于悬浮状态,然后小心地将树脂/样本混合物移入微离心柱的上层槽中。
⑥以大约6500×g离心5分钟。
⑦将含有树脂凝胶的上层槽弃去,收集滤出液。
⑧样品即可用于下一步的处理和储存备用。
二、组织和细胞样本的制备裂解不同种类的蛋白质样本应采取不同的处理和条件,裂解的效果取决于细胞破碎的方法、蛋白质浓缩和裂解的方法,去污剂的选择以及样本溶液的组成等。
1. 破碎细胞的方法细胞破碎过程中蛋白酶可能被释放出来,并引起蛋白质的分解,使双向电泳的最后结果复杂化。
因此,应直接将样本在强变性液裂解(8mol/L尿素、10%TCA或2%SDS)来抑制蛋白酶,并且在低温下制备样品。
双向电泳法在家蚕蛋白质分离中的应用

双向电泳法在家蚕蛋白质分离中的
应用
双向电泳法在家蚕蛋白质分离中的应用
双向电泳(Bis-Tris Electrophoresis)是一种高效、可重复性强的蛋白质分离技术,它在生物学研究中有着广泛的应用。
在家蚕蛋白质分离中,双向电泳也可以被用来进行有效的分离。
双向电泳法的原理是利用两种不同的电泳缓冲溶液,分别为酸性和碱性,将家蚕蛋白质溶解在其中,然后通过在两种缓冲溶液之间施加电压,让家蚕蛋白质随着电流移动,当家蚕蛋白质移动到两种缓冲溶液中间时,会因为环境pH变化而凝固,从而将它们分离出来。
双向电泳对家蚕蛋白质分离具有很多优势,首先,它是一种高效、快速的分离方法,能够在较短的时间内获得高精度的结果。
此外,它非常适合家蚕蛋白质分析,因为它能够将小分子量的蛋白质与大分子量的蛋白质进行有效的分离,这对于家蚕蛋白质组学研究非常有益。
此外,它还可以分离出复杂的家蚕蛋白质混合物,使得蛋白质的分析更加容易。
为了有效地利用双向电泳法,在进行家蚕蛋白质分离之前,应该先进行细胞裂解和蛋白质抽提,以获得家蚕蛋白质溶液。
其次,将抽提出来的蛋白质溶液添加到酸性和碱性缓冲溶液中,并且要确保每种缓冲溶液的pH值都足够适宜,以保证蛋白质的最佳分离效果。
最后,将两种缓冲溶液中的混合蛋白质放入电泳仪中,施加电压,让蛋白质随着电流移动,完成分离。
总之,双向电泳法在家蚕蛋白质分离中可以发挥其独特的优势,如高效性、可重复性等,使得家蚕蛋白质组学研究得以顺利进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国组织工程研究与临床康复第 14 卷 第 24 期 2010–06–11 出版Vol.14, No.24Journal of Clinical Rehabilitative Tissue Engineering Research June 11, 2010建立人肾小管上皮细胞蛋白质组双向电泳的分离体系★◆张春燕1,刘友平1,杨 烨1,龚 舒2,李 洪1,2Establishment of two-dimensional electrophoresis separation system for proteomes of human kidney tubular epithelial cellsZhang Chun-yan1, Liu You-ping1, Yang Ye1, Gong Shu2, Li Hong1, 2Abstract1Department of Biochemistry, 2Key Laboratory of Sichuan Higher Education Institute for Human Disease Cell Signal and Regulation, Luzhou Medical College, Luzhou 646000, Sichuan Province, China Zhang Chun-yan★, Master, Teaching assistant, Department of Biochemistry, Luzhou Medical College, Luzhou 646000, Sichuan Province, China zcy_2004_116@tom. com. Correspondence to: Li Hong, Professor, Master’s supervisor, Department of Biochemistry, Key Laboratory of Sichuan Higher Education Institute for Human Disease Cell Signal and Regulation, Luzhou Medical College, Luzhou 646000, Sichuan Province, China lihong7188@ Received: 2010-01-12 Accepted: 2010-02-21BACKGROUND: Two-dimensional electrophoresis (2-DE) separation technology is one of core technologies for proteomics studies. However, the resolution of 2-DE map is highly altered due to different experimental conditions. Therefore, a 2-DE map with high resolution can be obtained via the optimization of key experimental conditions for a definite proteome sample. OBJECTIVE: To establish an effective separation system of 2-DE for the proteome of HK-2 human renal tubular epithelial cells. METHODS: HK-2 human renal tubular epithelial cells were cultured routinely. The proteins were extracted from HK-2 cells after lysing, and separated by 2-DE on the standard experimental condition with an optimization for each important experimental parameter. Electrophoresis parameters recommended by Bio-Rad Corporation were adjusted adequately. In the process of silver staining, a sufficient washing operation ensured a weak background of 2-DE maps. The gray densities and numbers of protein spots, resolution and contaminating strands in 2-DE maps were determined. RESULTS AND CONCLUSION: A 2-DE separation system for proteome of human renal tubular epithelial cells was successfully established. The optimized experimental conditions were selected finally as follows: The lysis buffer containing 1% TBP, 4% CHAPS, 0.2% Bio-Lyte, 40 mmol/L Tris, 8 mol/L urea, 2 mol/L thiourea was applied to extract proteins from cells, and the passive rehydration proposal of samples was used to help the separation of large molecular weight proteins on the pH 4-7 IPG gels. Electrophoresis parameters recommended by Bio-Rad Corporation were adjusted adequately. In the process of silver staining, a sufficient washing operation ensured a weak background of 2-DE maps. Under the optimized conditions, 2-DE maps with high resolution have been reproducibly obtained. Zhang CY, Liu YP, Yang Y, Gong S, Li H. Establishment of two-dimensional electrophoresis separation system for proteomes of human kidney tubular epithelial cells.Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu. 2010;14(24): 4416-4420. [ ]摘要背景:双向电泳分离技术是蛋白质组学研究的核心技术之一,但蛋白质样品的分离效果受各种实验条件的影响较大。
因此, 针对不同来源的蛋白样品进行实验条件的优化可获得具有较高分辨率的双向电泳图谱。
目的:拟建立优化的人肾小管上皮细胞株蛋白质组双向电泳分离体系。
方法:常规培养人肾小管上皮细胞株 HK-2 细胞并裂解提取全蛋白,按标准条件对蛋白质进行双向电泳分离,并对各个关键 因素进行优化。
等电聚焦采用缓慢升压模式,电泳参数根据 Bio-Rad 公司的预设方案进行调整。
改良硝酸银法进行蛋白质斑 点染色。
采集电泳图谱并分析双向电泳图谱中蛋白斑点的数量、图像分辨率及背景条纹的变化。
结果与结论:通过对实验条件的筛选和优化,成功建立了具有较高的分辨率和重复性的人肾小管上皮细胞蛋白质组双向电泳 分离体系。
其中,优化后的裂解液配方成分为 1% TBP,4%CHAPS,0.2% Bio-Lyte,40 mmol/L Tris,8 mol/L 尿素,2 mol/L 硫脲;采用 pH 4~7 的 IPG 胶条;上样方式选择被动的水化上样。
等电聚焦过程中使用预设的缓慢升压模式,充分聚焦后选 用合适的电压模式进行 SDS-PAGE 电泳,然后采用改良硝酸银法进行染色,最终获得了满意的蛋白质组双向电泳图谱。
关键词:双向电泳;蛋白质组;人肾小管上皮细胞;优化;分离体系 doi:10.3969/j.issn.1673-8225.2010.24.011 张春燕,刘友平,杨烨,龚舒,李洪. 建立人肾小管上皮细胞蛋白质组双向电泳的分离体系[J].中国组织工程研究与临床康复, 2010,14(24):4416-4420. [ ]4416P.O. Box 1200, Shenyang110004张春燕,等. 建立人肾小管上皮细胞蛋白质组双向电泳的分离体系1 泸州医学院生物 化学教研室, 四川 省泸州市 2 646000; 人类疾 病细胞信号与调 控四川省高校重 点实验室, 四川省 泸州市 646000实验方法: 0 引言 双向电泳作为蛋白质组研究的三大核心 技术之一,是目前分离复杂蛋白质组分最常用 的工具 。
双向电泳/质谱(2-DE/MS)蛋白质组 解决方案能够在整体水平上,大规模、快速地 鉴定复杂蛋白样品。
该方案先通过双向电泳图 谱寻找差异蛋白质,再用质谱确认差异蛋白质 的精细分子量。
双向电泳实验周期长、 步骤多、 操作性强,如样品处理、上样方式、等电聚焦 和染色等各个环节均影响双向电泳的分离效 果[2-4] [1]样品制备:人肾小管上皮细胞株(HK-2)传代后, 采用含体积分数10%胎牛血清的高糖DMEM 培养液,于体积分数5%CO2培养箱,37 ℃常规 培养。
生长两三天至80%左右密度,弃去培养 液,生理盐水洗涤3次,3个培养瓶中分别加入 细胞裂解液A(40 mmol/L DTT,4%CHAPS, 0.2%Bio-Lyte, mmol/L Tris, mol/L尿素)、 40 8 细胞裂解液B(40 mmol/L DTT,4%CHAPS, 0.2%Bio-Lyte,40 mmol/L Tris,8 mol/L尿素, 2 mol/L硫脲)、细胞裂解液C (1%TBP,4% CHAPS, 0.2%Bio-Lyte, mmol/L Tris, mol/L 40 8 尿素, mol/L硫脲), ℃振荡30 min。
