2009届高三一轮复习:《化学键》课件(新人教版)(原创)[1]
合集下载
化学课件《化学键复习课》优秀ppt 人教课标版

层电子数,只要在元素符号右上角标出“n+”
电荷字样。 K+ Ca 2 +
(3)阴离子的电子式:不但要画出最外层电子
数 右上,而角且标还出应“用n-于”电括荷号字“样[。[:]B··”·r·括:]起- 来,并在
二、离子键
1、定义: 使阴、阳离子结合成化合物 的静电作用,叫做离子键。
成键微粒:阴、阳离子 相互作用:静电作用 成键过程:阴、阳离子接近到某一定距离
《化学键》复习课
复习目标:
1、 理解离子键和离子化合物的涵义;理解共价 键和共价化合物涵义以及化学反应的本质。
2、学会用电子式表示原子、离子、离子化合物 以及离子化合物的形成过程。
3、学会用电子式表示共价分子以及共价分子的 形成过程。
重点: 离子键和离子化合物、共价键和共价化合 物。
难点:用电子式表示离子化合物以和共价化合物 的形成过程。
化学键
电子式 离子键 共价键 课堂小结
化学键
定义:相邻的两个或多个原子(或离子)
之间强烈的相互作用叫做化学键。
离子键
化学键
共价键
极性键 非极性键
金属键(高三内容)
一、电子式:
H
氢
CNOF 碳氮氧氟
Na Mg Al 钠镁铝
S Cl 硫氯
K Ca
Br
钾钙
溴
一、电子式:
在元素符号周围用“ · ”或“×”来表示原 子最外层电子的式子。
①电子式
C N O S Cl)
HCl的电子式
H
××
Cl
××
×× ×× ××
Cl2的电子式
②、结构式:
×× ××
Cl Cl
×× ××
电荷字样。 K+ Ca 2 +
(3)阴离子的电子式:不但要画出最外层电子
数 右上,而角且标还出应“用n-于”电括荷号字“样[。[:]B··”·r·括:]起- 来,并在
二、离子键
1、定义: 使阴、阳离子结合成化合物 的静电作用,叫做离子键。
成键微粒:阴、阳离子 相互作用:静电作用 成键过程:阴、阳离子接近到某一定距离
《化学键》复习课
复习目标:
1、 理解离子键和离子化合物的涵义;理解共价 键和共价化合物涵义以及化学反应的本质。
2、学会用电子式表示原子、离子、离子化合物 以及离子化合物的形成过程。
3、学会用电子式表示共价分子以及共价分子的 形成过程。
重点: 离子键和离子化合物、共价键和共价化合 物。
难点:用电子式表示离子化合物以和共价化合物 的形成过程。
化学键
电子式 离子键 共价键 课堂小结
化学键
定义:相邻的两个或多个原子(或离子)
之间强烈的相互作用叫做化学键。
离子键
化学键
共价键
极性键 非极性键
金属键(高三内容)
一、电子式:
H
氢
CNOF 碳氮氧氟
Na Mg Al 钠镁铝
S Cl 硫氯
K Ca
Br
钾钙
溴
一、电子式:
在元素符号周围用“ · ”或“×”来表示原 子最外层电子的式子。
①电子式
C N O S Cl)
HCl的电子式
H
××
Cl
××
×× ×× ××
Cl2的电子式
②、结构式:
×× ××
Cl Cl
×× ××
人教版新教材《化学键》ppt课件1

有相对分子质量相同的分子,故构成的过氧化氢分子的相对
分子质量种数小于 36 种,故 A 错误;H2、D2、T2 均为氢气 单质,属于一种物质,故 B 错误;H2、D2、T2 在相同条件下 的密度比等于气体相对分子质量之比为 2∶4∶6=1∶2∶3,
故 C 正确;氕、氘发生核聚变生成其他元素,属于核反应,
[对点练]
1.有以下六种原子:36Li、73Li、2113Na、2142Mg、146C、147N,下列
相关说法不正确的是
()
A.63Li 和 73Li 在元素周期表中所处的位置相同 B.146C 和 147N 质量数相等,二者互为同位素
C.2113Na 和 2142Mg 的中子数相同但不属于同种元素
异形体是指同一元素的不同“单质”间的关系。
(5)同位素之间可形成不同的同位素单质。如氢分子有六 种:H2、D2、T2、HD、HT、DT。同位素之间可形成不同的 同位素化合物。如水分子有:H2O(普通的水)、D2O(重水)、 T2O(超重水)等。H、D、T与16O、17O、18O可形成3×6=18 种水分子,相对分子质量不同。它们的物理性质(如密度)有 所不同,但化学性质几乎完全相同。
[对点练]
2.(2019·盐城中学月考)下列说法正确的是
()
A.由 H、D、T 与 16O、17O、18O 构成的过氧化氢分子的相
对分子质量有 36 种
B.H2、D2、T2 互为同素异形体 C.H2、D2、T2 在相同条件下的密度比为 1∶2∶3 D.氕、氘发生核聚变生成其他元素,属于化学变化
解析:H、D、T 组合 H2、D2、T2、HD、HT、DT 共 6 种; 16O、17O、18O 组合 16O2、17O2、18O2、16O17O、16O18O、17O18O 共 6 种,所以构成的过氧化氢分子共有 6×6=36 种,但其中
【新教材】人教版《化学键》PPT精品课件1

有相对分子质量相同的分子,故构成的过氧化氢分子的相对
分子质量种数小于 36 种,故 A 错误;H2、D2、T2 均为氢气 单质,属于一种物质,故 B 错误;H2、D2、T2 在相同条件下 的密度比等于气体相对分子质量之比为 2∶4∶6=1∶2∶3,
故 C 正确;氕、氘发生核聚变生成其他元素,属于核反应,
答案:D
题点二 各种粒子之间的子质量数为 A,含 N 个中子,它
答案:B
提能点(二) 元素、核素、同位素、同素异形体的易错点 (1)一种元素可以有多种核素,也可能只有一种核素,有多
少种核素就有多少种原子。 (2)同位素的化学性质几乎完全相同,原因是核外电子排布
相同。 (3)同位素之间的转化,既不是物理变化也不是化学变化,
是核反应。同素异形体之间的转化是化学变化。 (4)同位素是指同一元素的不同“原子”间的关系,同素
异形体是指同一元素的不同“单质”间的关系。
(5)同位素之间可形成不同的同位素单质。如氢分子有六 种:H2、D2、T2、HD、HT、DT。同位素之间可形成不同的 同位素化合物。如水分子有:H2O(普通的水)、D2O(重水)、 T2O(超重水)等。H、D、T与16O、17O、18O可形成3×6=18 种水分子,相对分子质量不同。它们的物理性质(如密度)有 所不同,但化学性质几乎完全相同。
⑤每种元素都有两种或两种以上的核素
A.①②④⑤
B.③④⑤
C.②③⑤
D.①⑤
解析:对于元素而言,大部分元素都有同位素原子,但是也有 元素没有同位素,如 Na 和 F,故⑤错误;质子数相同的粒子 不一定属于同种元素,如 OH-和 F-的质子数都为 9,但很明 显不属于同种元素,故①错误。 答案:D
2.中国科学技术名词审定委员会已确定第 116 号元素 Lv 的名
人教版高中化学《化学键》优质课件1

课前篇素养初探
-11-
课前篇素养初探
知识铺垫
必备知识
正误判断
4.结构式 (1)定义:用一根短线“—”表示一对共用电子,这种图示叫做结构 式。
(2)常见以共价键形成的分子的结构式及空间构型:
分子 H2 HCl CO2
H2O
CH4
结构式 H—H H—Cl O C O
空间 构型 — —
直线形 V 形
正四面体形
4.3 化学键 课件【新教材】人教版(2019)高中化 学必修 一(共4 1张PPT )
-19-
4.3 化学键 课件【新教材】人教版(2019)高中化 学必修 一(共4 1张PPT )
课堂篇素养提升
探究一
探究二
素养脉络
随堂检测
2.离子化合物和共价化合物
类型
离子化合物
共价化合物
定义
阴、阳离子之间以离子键 原子间以共用电子对形成
4.3 化学键 课件【新教材】人教版(2019)高中化 学必修 一(共4 1张PPT )
-21-
4.3 化学键 课件【新教材】人教版(2019)高中化 学必修 一(共4 1张PPT )
探究一
探究二
素养脉络
随堂检测
课堂篇素养提升
素能应用
典例1(2020河南林州一中高一调研)在NaF、NaOH、CaO、Cl2、
2Na+Cl2 2NaCl,H2+Cl2
2HCl。
2.H、Na、Cl的原子结构示意图分别为
、
、
。 钠元素具有较强的金属性,反应中钠原子易失去电子,反应中氯元 素具有较强的非金属性,氯原子易得到电子。
-3-
知识铺垫
必备知识
正误判断
(新)人教版《化学键》优秀课件PPT1
化学键 课后训练
7、有以下9种物质:
①Ne ②HCl ③P ④H O ⑤Na S ⑥NaOH
⑦Na O ⑧NH C4 l ⑨A2lC2l
2
已知同2 种2非金属4原子之间形3成非极性共价键,不同种非金属原子之间形成极性共价
键。请用上述物质的序号填空:
(1)不存在化学键的是___________。
(2)只存在极性共价键的是___________。
【解析】
非金属氢化物:HCl、 H S 等 7.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
(3)含有金属元素 2 (1)3He是高效核能原料,其原子核内质子数为2、中子数为1。
2.下列说法错误的是( )
的化合物 酸:H SO 、 HNO 等 【解析】
2 4 3 B
NaCl溶液(MgCl2)
化学键
离子化合物
一般由金属元素和非金属元素组成的化合 物为离子化合物。特例:铵盐、AlCl3等。
概念:含由离子键的构化成合的物化合物
强碱:如NaOH、Ba(OH)2等
常见 类型
大多数盐:如KCl、MgCl2、ZnSO4等
活泼金属氧化物:如Na2O、BaO等
注意:
①离子化合物并不一定含金属元素,例如NH4Cl等铵盐。 ②既有金属元素又有非金属元素的化合物并不一定使离
化学键
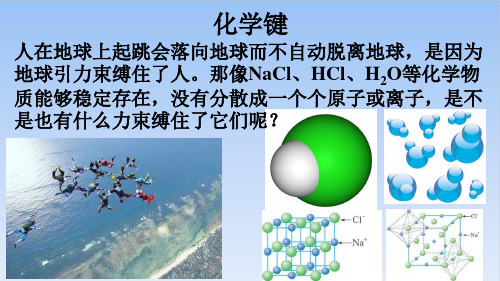
人在地球上起跳会落向地球而不自动脱离地球,是因为 地球引力束缚住了人。那像NaCl、HCl、H2O等化学物 质能够稳定存在,没有分散成一个个原子或离子,是不 是也有什么力束缚住了它们呢?
化学键
1、了解离子键和共价键的概念及形成过程,并能区别 它们。 2、掌握离子化合物和共价化合物的概念,并能识别常 见的离子化合物和共价化合物。
人教版化学《化学键》PPT课件

实验步骤
制备晶体样品,进行X射线 衍射实验,收集衍射数据 ,解析晶体结构,确定化 学键类型。
应用范围
适用于研究离子键、共价 键等多种类型的化学键, 特别适用于研究晶体结构 。
红外光谱法研究化学键
红外光谱原理
利用物质吸收红外光后产生的振 动和转动能级跃迁,分析物质的
结构和化学键类型。
实验步骤
制备样品,进行红外光谱实验,收 集光谱数据,解析光谱信息,确定 化学键类型。
利用金属键的性质可以合成具有特殊 功能的材料,如超导材料、储氢材料 等。
金属键的应用广泛,如制造导线、电 极、催化剂等。
05
化学键与物质性质的关系
化学键对物质物理性质的影响
01
02
03
熔点、沸点
离子键和共价键的强度影 响物质的熔点和沸点。离 子键越强,熔点越高;共 价键越强,沸点越高。
硬度
化学键的强度决定了物质 的硬度。离子键和共价键 越强,物质越硬。
化学性质多样性
不同类型的化学键导致物质具有 不同的化学性质。例如,离子键 形成的物质易溶于水,而共价键 形成的物质可能具有不同的溶解
性、酸碱性等。
化学键在材料科学中的应用
纳米材料
利用化学键的特性,可以合成出 具有特定形状和功能的纳米材料 。
生物医用材料
利用化学键的特性,可以设计出 与生物体相容性良好的医用材料 ,如生物降解材料、生物活性材 料等。
化学键的形成与性质
形成
原子或离子之间通过电子的转移或共 享形成化学键。
性质
不同类型的化学键具有不同的性质, 如离子键具有较强的极性和较高的熔 点,共价键具有方向性和饱和性,金 属键具有导电性和延展性等。
化学键在化学反应中的作用
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5)氢键作用:使物质有较高的熔沸点(H2O、 HF 、NH3) 使物质易溶于水(C2H5OH, CH3COOH) 解释一些反常现象 结果1:氢键的形成会使含有氢键的物质的熔、 沸点大大升高。如:水的沸点高、氨易液化等。 这是因为固体熔化或液体汽化时,必须破坏分 子间作用力和氢键 结果2:氢键的形成对物质的溶解性也有影响, 如:NH3极易溶于水。
[归纳整理]
二、共价键
1、定义: 原子之间通过共用电子对所形成的相互作用, 叫做共价键。
2、成键微粒: 3、相互作用:
原子
共用电子对
思考 哪些粒子能形成共价键?
4、形成共价键条件: 同种或不同种非金属元素原子结合; 部分金属元素原子与非金属元素原子,如 AlCl3 ,FeCl3; 5、存在:存在于非金属单质和共价化合物中, 也存在于某些离子化合物和原子团中
用电子式表示溴化钙的形成过程
· · · · · · · : +· : · ]-Ca2+ [: : Br ] Br · Ca· : · [ Br: Br → · · · · · · · ·
· ·
注意点 1. 离子须注明电荷数; 2.相同的原子可以合并写,
相同的离子要单个写; 3.阴离子要用方括号括起;
4.化学反应的本质:
一个化学反应的的过程,本质上就是 旧化学键断裂和新化学键形成的过程。
[归纳与整理]
一、离子键
定义: 使阴阳离子结合成化合物的静电作用, 叫做离子键。
1、成键微粒:阴阳离子
2、相互作用:静电作用(静电引力和斥力)
3、成键过程:阴阳离子接近到某一定距离时, 吸引和排斥达到平衡,就形成了离子键。
H2 HCl NaOH NH4Cl Na2O2 SO42- NO3 6、共价化合物:以共用电子对 形成分子的 化合物。
判断:
• 含有共价键的化合物一定是共价化合物
错,如:NaOH Na2SO4
• 全部由非金属元素组成的化合物一定是 共价化合物
错,如 NH4Cl 等铵盐
• 在气态单质分子里一定有共价键
思考
哪些粒子能形成离子键?
[归纳与整理]
4、形成离子键的条件:
1、活泼的金属元素(IA,IIA)和活泼的非金属 元素(VIA,VIIA)之间的化合物。 2、 活泼的金属元素和酸根离子形成的盐
酸根离子:SO42-、NO3-、Cl-等
3、铵盐子和酸根离子(或活泼非金属元素) 形成的盐。
把NH4+看作是活泼的金属阳离子
﹕ ﹕ ﹕
· ·
﹕ ﹕
﹕
﹕
﹕
【知识拓展】
金属键:金属晶体中,金属阳离子与自由电子之间的强烈 静电作用。 配位键:电子对由一个原子单方面提供而跟另一个原子共用而 形成的共价键。 1、孤对电子:原子最外层存在没有跟其它原子共用的电子对。 例如: N
H 2、虽然配位键和其它键的形成不同,但一旦形成后则与其它 共价键无任何区别。例如:
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会
反常呢?
课堂练习
试用化学键的观点来解释以下问题:
1、NaCl与KCl中,熔点NaCl > KCl;
前者离子键强于后者。
2、Al2O3与MgO均为高熔点物质,常用做耐火材 料,原因是: 与NaCl相比,它们均由半径小、高电 电荷(Al3+、Mg2+、O2+)的离子构成,离子键很强。 3、通常状况下氮气的性质为什么很不活泼? N=N
三、表示方法
在元素符号周围 用小黑点(或小叉) 表示最外层电子 的式子叫电子式
[ 练习] 写出下列微粒的电子式: 硫原子、 溴原子、 硫离子、溴离子、铝离子
· · ·· S· ·
· · Br · · ·
· : ·]2[ S: · ·
: :[ Br ]
· · · ·
· ·
Al3+
用电子式可以直观地 表示出原子之间是怎样结合的 看到原子结构特点与键之间的关系。
四卤化碳的熔沸点与 相对原子质量的关系
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子X,(N、O、F)与H原子形成强极性共 价键,与另一个分子中的半径较小,非金属性 很强的原子Y (N、O、F),在分子间H与Y 产生较强的静电吸引,形成氢键 2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。 3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
H H N H H +
H
H
H
O
H
H H N H H
+
H H O H
+ H
H O H
+
[科学视野]
了解分子间作用力和氢键
四、分子间作用力和氢键
1.分子间作用力 定义: 把分子聚集在一起的作用力叫做
分子间作用力(也叫范德华力)。 (1)分子间作用力比化学键弱得多,是一种 微弱的相互作用,它主要影响物质的熔、沸点等 物理性质,而化学键主要影响物质的化学性质。 (2)分子间作用力主要存在于由分子构成的 物质中,如:多数非金属单质、稀有气体、非 金属氧化物、酸、氢化物、有机物等。 (3)分子间作用力的范围很小,只有分子间的 距离很小时才有。
F2 F2
卤素单质的熔、沸点与 相对分子质量的关系
应用:对于四氟化碳、四氯化碳、四溴化
碳、四碘化碳,其熔沸点如何变化?
温度/℃ 250 200 150 CBr4
沸点
× ×
熔点
CI4
100
50
CCl4×
×
CBr4
-50 -100
-150 -200 -250
0
100 200 300 400 500 × CCl4 相对分子质量 × CF4 × CF4
(4)一般来说,对于组成和结构相似的物质, 相对分子质量越大,分子间作用力越大,物质的 熔、沸点越高。如卤素单质:
温度/℃ 250 200 150 100 50
沸点
I2 100 150 Br2 I2
熔点
-50 -100 -150 -200
-250
0
50
Cl2 Cl2
Br2 200 250 相对分子质量
[归纳与整理]:化学键
直接相邻的两个或多个原子或离子之间强烈 的相互作用叫做化学键。
1、定义:
离子键
配位键 极性键
2 分 类
.
共价键 金属键
非极性键
3.化学键的存在:
(1)稀有气体单质中不存在; (2)多原子单质分子中存在共价键; (3)非金属化合物分子中存在共价键(包括酸); (4)离子化合物中一定存在离子键,可能有共 价键的存在(Na2O2、NaOH、NH4Cl),共价 化合物中不存在离子键; (5)离子化合物可由非金属构成, 如:NH4NO3、NH4Cl 。
3、离子化合物的电子式:由阴、阳离子的 电子式组成,但对相同离子不能合并 AB型 A2B型 AB2型
2-
[课堂练习] KBr
NaCl
CaCl2
K 2O
4、用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程
· · · · + [ : :Na ·+ Cl · → Na Cl ] · · · ·
错,He、Ne等稀有气体
非极性键和极性键
非极性键
极性键
同种原子
不同种原子
【比较整理】
H2 特 组成
原子吸引电子对能力 同种原子 相同
HCl
不同种原子 不相同
共用电子对位置 征 成键原子电性 结 论
不偏向任何 偏向吸引电子能 一个原子 力强的原子一方 不显电性 非极性键 A-A 显电性 极性键 A-B
· ·
K+
注 意
箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。
用电子式表示下列共价分子的形成过程
· · · · ·:· ·· 碘 :I ·+ · : → :I I: I · · · · · · · · · · 水 2 H ·+ · ·→ H ﹕O﹕ H O · · H · ﹕ + N → H ﹕N 氨 3H· · · H · · · ﹕ ﹕ C + 二氧化碳 · · 2 · · O → O﹕ C ﹕ O · · ·
5、离子化合物:含有离子键的化合物。
H
元素周期表
Be N O F
Li
Na
Mg
P
S
Cl
K
Ca ……
As
Se
Br
Rb
Sr
Sb
Te
I
Cs
Ba
Bi
ቤተ መጻሕፍቲ ባይዱ
Po
At
Fr
Rb
离子键的强弱比较
影响因素:离子半径(反比)、电荷数(正比) 比较离子键强弱:KCl与KBr、 Na2O与MgO 决定:稳定性及某些物理性质,如熔点等。
4.不能把 “→”写成 “ ==”
5.用箭头表明电子转移方向(也可不标)
[ 练习] ⑴ 用电子式表示氧化镁的形成过程
· · · 2+[:· ]2· · · · → Mg Mg + O O: · · · · · · S 2K. + ··· → ·
⑵ 用电子式表示硫化钾的形成过程
K+
· :· ]2[ S:
