溴乙烷
溴乙烷的结构与性质

溴乙烷的结构与性质1. 溴乙烷的结构溴乙烷,也称为1-溴乙烷,分子式为C2H5Br。
它是一种有机卤素化合物,由一个乙基基团和一个溴原子组成,化学结构式为CH3-CH2-Br。
其分子量为108.97 g/mol,密度为1.46 g/mL(20°C),沸点为38.4°C,熔点为-119°C。
2. 溴乙烷的性质2.1 物理性质(1)状态:溴乙烷为无色液体,在室温下为液态,但在非常低温下可以冷却成固态。
它通常具有刺激性气味,具有较高的揮發性。
(2)密度:溴乙烷可以混合水,是不易挥发的液体。
一般情况下,它的密度比水大约两倍左右,也就是说,它会在水面上浮起来。
(3)溶解性和溶解度: 溴乙烷是有机溶剂,能够溶于乙醇、乙醚、苯等有机溶剂,但不易溶于水,其水溶度为3.5g/L(20°C)。
2.2 化学性质(1)溴乙烷是一种亲电性化合物,它能与亲核试剂反应,实现亲电取代反应。
(2)与强碱反应,可以实现消除反应,生成ethylene。
(3)会遭受较强的自由基自身作用,例如被光解或作用于生物体,导致加成、裂解或取代反应等。
(4)溴乙烷可以经过一系列反应变为其他的有机卤素化合物,例如溴化,以及存在于化学反应过程中的其它氯、溴和碘。
3. 应用溴乙烷是一种常用的化学试剂,广泛用于有机合成、医学和农业工业。
在银镜反应中,它是用来证明存在还原酮或葡萄糖的卤素试剂。
同时,它也可以用作疗法学,治疗肝炎、肾炎、硬皮症以及甲状腺功能亢进症的药物成分。
此外,它们还可以被用来作为杀菌剂,或作为农业上用来保护植物和动物的药物成分。
总之,溴乙烷是一种重要的有机卤素化合物,具有广泛应用的领域,包括有机合成、医学和农业工业等领域。
虽然溴乙烷具有一些有害的性质,但是在正确使用的情况下,它还是一种非常有价值的化学试剂。
溴乙烷

溴乙烷溴乙烷,又称1-溴乙烷,化学式为C2H5Br,是一种无色液体。
下面将从溴乙烷的性质、制备方法、应用领域以及安全注意事项等方面展开阐述。
首先,我们来了解一下溴乙烷的性质。
溴乙烷是一种易燃的有机溴化合物,具有特殊的臭味。
它的沸点为38℃,密度为1.46g/cm³。
在室温下,溴乙烷可溶于乙醇和醚,不溶于水。
它具有惰性,不与强碱和氧化剂发生反应。
溴乙烷可以通过多种方法制备。
最常用的方法是通过将乙烯与溴反应制得。
乙烯与溴反应会生成溴乙烷,反应条件通常为加热条件下,反应物为液态。
另外,溴化氢和乙烷反应也可以制备溴乙烷。
这种方法相较于前一种方法更为简单,但收率相对较低。
溴乙烷的应用领域广泛。
首先,在有机合成中,溴乙烷可以用作溴化试剂,用于化学反应中。
其次,溴乙烷还是生产丙烯酸、丙烯酯等化学物质的重要原料。
此外,溴乙烷还用于制备表面活性剂、杀菌剂和某些医药中间体等。
在工业上,它广泛应用于有机合成以及农药、医药等领域。
然而,正如任何化学物质一样,使用溴乙烷时需要注意安全问题。
首先,由于其易燃性,应避免与明火和高温物体接触。
其次,溴乙烷有一定的毒性,应远离儿童,并注意避免吸入和接触皮肤。
在使用过程中,要佩戴防护手套、护目镜和防护服等个人防护装备,确保自身安全。
当遇到泄漏情况时,应迅速撤离现场,采取相应的应急处理措施。
综上所述,溴乙烷是一种常见的有机化合物,具有一定的化学特性和应用价值。
在使用时,我们应了解其性质、制备方法以及安全注意事项,合理使用并遵循相关的操作规程,确保自身安全并有效进行化学实验和应用。
溴乙烷的结构

②消去反应:
连有卤素原子的相邻的碳原子上必需有氢原子。
[课堂练习]:试写出1-氯丙烷2-氯丙烷和 1,1-二氯丙烷、1,2-二氯丙烷分别发生消去反 应的化学方程式。
(7)卤代烃的获取方法
①不饱和烃与卤素单质、卤化氢等的加成反应。
②取代反应
深度思考
1.实验室现有失去标签的溴乙烷、戊 烷各一瓶,如何鉴别? 答案:利用戊烷密度小于水,溴乙烷密 度大于水的性质鉴别。 2.卤代烃遇AgNO3溶液会产生卤化银 沉淀吗? 答案:不会,卤代烃分子中卤素原子与 碳原子以共价键相结合,属于非电解质,不 能电离出卤素离子。
(4)命名: 把卤原子作取代基,在烃的前 面标上卤原子的位置、数目和名称。 (5)物理性质: 难溶于水,易溶于有机溶剂, 熔沸点、密度均大于相应的烃;且 密度随碳原子的增加而减小;沸点 随碳原子数的增加而升高。
(6)化学性质:与溴乙烷相似
①取代反应(水解反应):
[ 课堂练习 ] :试写出 1- 氯丙烷、 2氯丙烷和 1,1- 二氯丙烷分别发生水解反 应的化学方程式。
(2)分类:
①根据醇分子里羟基的数目,醇分为: 一元醇: CH3OH CH3CH2OH 二元醇: 乙二醇 多元醇: 丙三醇 ②根据醇分子里烃基是否饱和,醇分为: 饱和醇: CH3OH CH3CH2OH 不饱和醇:CH3CH= CHCH2OH
③根据醇分子里是否含有苯环,醇 可分为:脂肪醇和芳香醇。 芳香醇: (3)醇的通式 通式: R—OH ;饱和一元 脂肪 醇的 通式:CnH2n+1OH 或CnH2n+2O 说明: ①碳原子相同的饱和一元醇与饱和一 元醚互为同分异构体。 ②饱和脂肪醇的通式为:CnH2n+2Ox 。
b、乙醇的催化氧化反应:
溴乙烷知识点总结

溴乙烷知识点总结物理性质1. 外观:溴乙烷为无色液体,具有特有的刺激性气味。
2. 熔点和沸点:溴乙烷的熔点为-119°C,沸点为38.3°C。
3. 密度:溴乙烷的密度为1.47 g/cm³。
4. 溶解性:溴乙烷可溶于乙醇、乙醚等有机溶剂,但不溶于水。
化学性质1. 稳定性:在一般条件下,溴乙烷是稳定的,但会与强氧化剂发生剧烈反应。
2. 燃烧性:溴乙烷易燃,能与空气形成爆炸性混合物,在高温、火花或明火的作用下易发生燃烧。
3. 毒性:溴乙烷具有一定的毒性,吸入高浓度的溴乙烷蒸气可能引起头晕、恶心、中毒甚至窒息。
制备方法溴乙烷通常是通过乙醇和溴在催化剂的作用下反应制得的。
具体反应方程式如下:C2H5OH + HBr → C2H5Br + H2O用途1. 作为有机溶剂:溴乙烷可用作有机合成中的溶剂,如用于萃取和结晶分离。
2. 化学中间体:溴乙烷是许多有机合成反应的中间体,如用于用于合成其他溴代烷烃以及有机合成中的取代反应。
3. 杀虫剂和消毒剂:溴乙烷曾经被广泛应用于杀虫剂和消毒剂中,但由于其毒性和环境污染问题,目前已经不再常用。
安全注意事项1. 毒性:溴乙烷具有一定的毒性,接触时应避免吸入气体或接触皮肤和眼睛。
2. 易燃性:溴乙烷易燃,避免高温、火花或明火的接触。
3. 通风良好:使用或储存溴乙烷时,应保证有良好的通风条件,以避免蒸气的积聚。
环境影响1. 生物积累:溴乙烷在生物体内会积累,并对生物体产生毒性影响。
2. 水污染:溴乙烷不易溶于水,但可能对水体产生污染,影响水生生物。
溴乙烷是一种重要的有机化合物,具有广泛的应用价值。
在使用过程中,需要注意其毒性和易燃性,并尽量减少对环境的影响。
溴乙烷

中文名溴乙烷英文名Bromoethane别名乙基溴溴代乙烷英文别名Ethyl bromideCAS 74-96-4EINECS 200-825-8化学式C2H5Br分子量108.97inchi InChI=1/C2H5Br/c1-2-3/h2H2,1H3密度 1.46熔点-119℃沸点37-40℃闪点-23℃水溶性0.91 g/100 mL (20℃)折射率1.4225物化性质性状无色透明易燃、易挥发性液体。
具有醚臭和辛辣味。
在空气中和遇光明时变成淡黄色。
熔点-119.3℃沸点38.4℃相对密度1.4612折射率1.4244溶解性与乙醇、乙醚、氯仿及其他有机溶剂混溶,微溶于水。
产品用途用于医药、农药、染料工业,是有机合成中的乙基化剂,也用作致冷剂和有机溶剂风险术语R11 - 高度易燃。
R20/22 - 吸入及吞食有害。
R40 - 少数报道有致癌后果。
安全术语S36/37 - 穿戴适当的防护服和手套。
危险品运输编号UN 1891上游原料硫酸硫酸氢溴酸氢溴酸溴素乙醇下游产品3-(N,N-二乙基)氨基乙酰苯胺乙基丙二酸二甲酯α-乙基去氧苯偶姻N-乙基咔唑分散蓝SE-2R 永固紫RL 哌拉西林诺氟沙星盐酸洛美沙星盐酸地芬尼多硫柳汞溴乙烷- 制法1.氢溴酸法乙醇和氢溴酸(或溴化钠)在硫酸存在下,加热到回流温度,进行置换反应,粗产品用硫酸洗涤,碳酸钾中和得成品。
2.乙醇溴化法在溴中加入无水乙醇和硫黄,使溴慢慢与乙醇作用,反应温度60~90℃,反应产物经冷却,去酸即得溴乙烷。
溴乙烷- 用途在有机合成中用作乙基化剂,也是合成农药、医药、染料、香料的原料。
还可用作制冷剂、溶剂和熏蒸剂等。
溴乙烷、卤代烃

第一节溴乙烷卤代烃官能团:有机化合物中决定其主要化学性质,影响其物理性质的原子或原子团。
由于官能团的作用体现于这一章的始终,成为这一章知识的主题或者说是串联起这一章知识的一条潜在的主线,在学习烃的衍生物时应重视官能团的作用。
烷一.知识梳理1.溴乙烷的结构:由乙基和溴原子两部分构成;溴原子是溴乙烷的官能团。
2.溴乙烷的物理性质:无色液体,沸点38.4°C,密度比水大.溴乙烷的化学性质(1)强碱的水溶液下的取代反应(2)强碱的醇溶液下的消去反应3.卤代烃概述(1)卤代烃—卤素取代了烃分子中的一个或几个氢原子后的产物。
(2)存在—自然界中无天然品,全部为合成品。
(3)应用—溶剂、助剂、消毒剂、麻醉剂、致(制)冷剂,阻燃剂。
有机合成的重要中间体。
(有机的合成中间转运站)4.卤带烃分类和命名(1)分类1°2°3°CH j ClR2CHClR3CCl饱和*一卤代烃二卤代烃三卤代烃如代烃氯代烃溴代烃碘代烃氯氟代烃脂肪族乙烯式烯丙式CH2=CHX CH2=CHCH2Cl不饱和芳香族XCH2X(2)命名1.选择含卤素的最长碳链为主链;2.从靠近取代基的一端为主链编号;3.以相应的烃为母体,将卤素作为取代基放在母体名称之前;4.不同卤素按F、Cl、Br、I的顺序排列(位序小的排在前面)。
例题:Cl CH34-甲基-2-氯己烷CH3CHCH2CHCH2CH3CH J Cl2-甲基-4-氯己烷5.卤带烃的物理性质(1)多为无色、有味、多数有毒,一氟代烷的毒性最大;不溶于水,易溶于有机溶剂。
(2)小分子为气体或液体。
如氟甲烷、氯甲烷、溴甲烷和氟乙烷、氯乙烷为气体,其余的卤代烷为液体。
15个碳以上的为固体。
(3)液体气化时吸热量大,可作制冷剂。
如氟利昂(Freon)即为含氟制冷剂。
但由于它对大气中臭氧层的破坏作用,目前已被国际禁用。
(4)密度:一氟、一氯代烷的密度小于1,一溴、一碘代烷的密度大于1。
溴乙烷

CH3CH2 CH2CH2 Cl CH3
CH3CH2 CH2 Cl CH2 CH3 CH3CH CH2 Cl CH3
CH3
CH3C HCH2CH3 CH2 Cl
CH3CH CH2CH2 Cl CH3
CH3C ClCH2CH3 CH3
CH3 CH3 C CH2Cl
CH3
5、卤代烃的物理性质
所有卤代烃都不溶于水,可溶于大多 数有机溶剂。通常情况下,大部分卤代 烃是液体。 CH3Cl CH3CH2Cl
不用
一、溴乙烷
3、溴乙烷的化学性质
(2)C2H5Br的消去反应
CH2—CH2+NaOH
乙醇 △
CH2=CH2↑+NaBr + H2O
H Br
消去反应
有机化合物在一定条件下,从一个分子中
脱去一个小分子(如H2O、HBr等)而生成 不饱和(含双键或叁键)化合物的反应。
--
CH3Br
CH3 CH3-C- CH2Br
CH3
×
(4) CH3Cl
×
溴乙烷的化学性质比较
反应物 反应条件
取代反应
CH3CH2Br
NaOH水溶液, 加热
消去反应
CH3CH2Br
NaOH醇溶 液,加热
生成物 结论
CH3CH2OH NaBr
CH2=CH2 NaBr H2O
溴乙烷与在不同条件下发生
不同类型的反应
练习1 试考虑如何以乙烯制取乙二醇
CH3 D、CH2=C-CH2
Cl
不能发生 消去反应
【练习题4】
下列卤代烃能发生消去反应且有机产
物可能有两种的是 ( )
c
A、CH3Cl
B、CH3-CH-CH3
溴乙烷
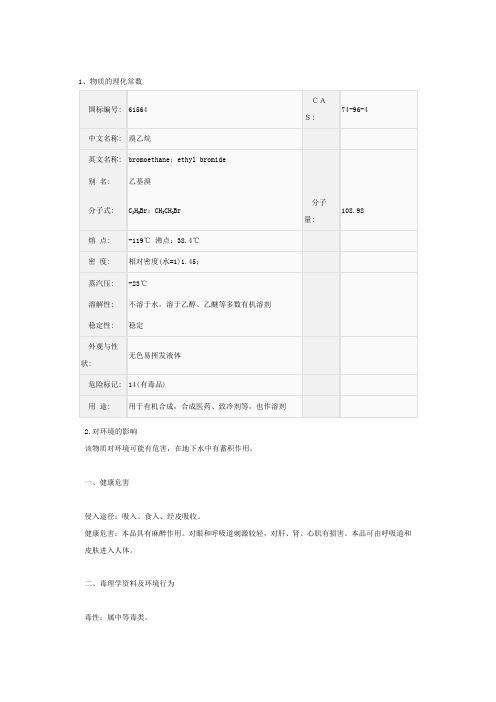
1、物质的理化常数2.对环境的影响该物质对环境可能有危害,在地下水中有蓄积作用。
一、健康危害侵入途径:吸入、食入、经皮吸收。
健康危害:本品具有麻醉作用。
对眼和呼吸道刺激较轻,对肝、肾、心肌有损害。
本品可由呼吸道和皮肤进入人体。
二、毒理学资料及环境行为毒性:属中等毒类。
急性毒性:LD501350mg/kg(大鼠经口);LC5072386mg/m3,1小时(小鼠吸入);兔吸入80~115mg/L×25~30分钟,立即死亡;狗吸入80~200mg/m3×1小时,致死。
亚急性和慢性毒性:大鼠吸入540ppm×4小时/日×6月,肝功能异常,肝脏损害。
特殊毒性:Ames试验鼠伤寒沙门氏菌TA1535、TA100 +S9或-S9阳性。
危险特性:其蒸气与空气可形成爆炸性混合物。
遇明火、高热能引起燃烧爆炸。
受高热分解产生有毒的溴化物气体。
受光照或火焰下易分解生成溴化氢和碳酰溴。
与强氧化剂接触可发生化学反应。
燃烧(分解)产物:一氧化碳、二氧化碳、溴化氢。
3.现场应急监测方法4.实验室监测方法色谱-质谱法《环境监测资料,1986(1-2)》中国环境监测总站空气中样品的测定:样品用活性炭吸附后,用异丙醇洗脱,再用气相色谱法测定(NISOH法)5.环境标准前苏联车间空气中有害物质的最高容许浓度 5mg/m36.应急处理处置方法一、泄漏应急处理迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
不要直接接触泄漏物。
尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄漏:用活性碳或其它惰性材料吸收。
大量泄漏:构筑围堤或挖坑收容。
用泡沫覆盖,降低蒸气灾害。
用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
废弃物处置方法:用控制焚烧法,焚烧系统要按装洗涤器和灰分处理装置。
二、防护措施呼吸系统防护:空气中浓度超标时,应选择佩带自吸过滤式防毒面具(半面罩)。
溴乙烷

CH3CHBrCH3
(CH3)3CCl
CH r CH 2B 2Br
CHCl2CHBr2
CH2Br H
规律:所有的卤代烃都能发生水解反应, 但卤代烃中与连接卤原子的碳原子相邻的碳 原子上有氢能发生消去反应。
思考:如何鉴别氯乙烷与溴乙烷?
取少量样 品于试管 中
①NaOH ②过量 水溶液 HNO3
③AgNO3 溶液 有沉淀产生
白色↓
AgCl 氯乙烷
淡黄色↓
AgBr
溴乙烷
二、卤代烃的用途 致冷剂 溶剂 灭火剂
麻醉剂 医用 卤代烃
农药
R-X的主要性质
反应 条件 实质 键的变化 对卤代烃的 要求 主要 产物
水 解 NaOH -X被 反 水溶液 -OH 应 加热 取代
C-X断 裂形成 C-OH键
菏泽一中
赵桂芳
体育比赛中,当运动员肌肉挫伤或扭伤 时,队医随即对准伤员的受伤部位喷射某种 气雾剂,进行局部冷冻麻醉应急处理 ,稍 后运动员又可上场了。你知道这种气雾剂的 主要成份是什么吗? 药理作用:氯乙烷沸点低,易汽化, 且汽化时吸收大量热,使受伤部位温 度急剧下降,局部暂时失去知觉,达 到麻醉的效果。
氯乙烷
一、溴乙烷 1.结构特型
纯净的溴乙烷是无色液体,难溶于水, 可 溶于有机溶剂,密度比水大,沸点38.4℃。 3.化学性质
【实验探究】——溴乙烷的水解反应
实验操作 实验现象结论或解释 向试管中加入15滴溴乙烷,再 分层 反应缓慢 加入约1ml5%的NaOH溶液, 充分振荡,水浴加热2分钟。 将混合液转移至另一支小试管 中,静置,取试管中的上层清 有浅 -生成 有 Br 液少许于另一支试管中,向试 黄色 管中滴加稀硝酸至溶液显酸性, 沉淀 再向溶液中滴加5滴2%的 AgNO3溶液,充分振荡。 向试管中加入15滴溴乙烷, 分层, 无Br再滴加5滴2%的AgNO3溶液, 无沉淀 充分振荡。
溴乙烷知识概述

溴乙烷知识概述
简介
溴乙烷,化学式为C2H5Br,又称溴化乙烷。
是一种有机物,属于溴代烷类。
溴乙烷是一种无色液体,常温下呈微黄色,具有特殊的气味。
物理性质
1.外观:无色液体,常温下呈微黄色;
2.熔点:-119°C;
3.沸点:38.8°C;
4.密度:1.471 g/mL at 25°C;
5.溶解度:与水混溶,能与苯、乙醇、乙醚、氯仿、二氯甲烷等多种有
机溶剂混溶。
化学性质
1.氧化反应:容易被强氧化剂氯或臭氧氧化为丙酮和溴化氢;
2.氢化反应:和铁微粉以及氢气在镍催化下反应生成乙烷;
3.取代反应:溴化乙烷能够与另一种有机物发生取代反应,如与氢氧化
钠反应生成醇类。
吸入溴乙烷的危害
吸入高浓度的溴乙烷蒸汽或接触散发出的气体会引起中枢神经系统受损,表现为头晕、昏迷和谵妄等症状。
较低浓度的溴乙烷蒸汽,长期吸入也有害,容易引起呼吸系统、视力和皮肤等方面的损伤。
而且,溴乙烷还属于一定程度的致癌物质,长期接触可能会导致慢性中毒现象。
使用注意事项
1.避免高温火源和明火,不要与氧化剂和还原剂接触;
2.禁止直接吸入或接触皮肤;
3.使用时必须佩戴防护装备,如手套和防毒面具等;
4.避免仓储于易燃易爆物品附近及保持通风良好的环境。
结语
综上所述,作为一种害性较大,但又广泛应用于科研和工业等领域的化学品,我们在使用和储存过程中,必须做好防范措施,以免对个人和环境造成伤害。
溴乙烷的化学性质H
② 氟氯烃(氟里昂)(CF2Cl2 等) 性质:无色无味气体,化学性质稳定,无毒,易挥 发,易液化,不燃烧。
用途:制冷剂,雾化剂,发泡剂,溶剂,灭火剂。
危害:CF2Cl2
紫外光 CF2Cl ·+ Cl ·
Cl ·+ O3
CH3CH2OH
CH2=CH2
结论
溴乙烷和NaOH在不同条件下 发生不同类型的反应
练习:写出下列反应的化学方程式,说明反应类型 2-溴丙烷 与 NaOH水溶液共热 2-溴丙烷 与 NaOH乙醇溶液共热
三、化学性质
‥H ‥H ‥ H︰C‥︰‥C︰B‥r︰
HH
由于溴原子吸引电子能力强,C-Br 键容易断裂,使 溴原子易被取代。由于“-Br”的作用,溴乙烷的化 学性质比乙烷活泼,能发生许多化学反应。
不饱和链状卤代烃的命名:
含连接 –X 的C原子在内的最长不饱和碳链为主链,从 离双键或三键最近的一端编号,其他命名同饱和链状 卤代烃
命名下列卤代烃 CH2=CHCH2CH2Br 4-溴-1-丁烯
CH2=CHCHCH2Br CH3
4-溴-3-甲基-1-丁烯
四、卤代烃的物理通性 ① 两个碳以下的一氯代烷以及溴甲烷是气体,一般卤 代烃均为液体,高级的卤代烃为固体。
溴乙烷与 NaOH乙醇混 合液
现象:溴水褪色
溴水
2、溴乙烷的消去反应 反应发生的条件:与强碱的醇溶液共热
H Br
醇
H2C CH2 + NaOH △
CH2= CH2↑ + NaBr + H2O
有机化合物在一定条件下,从一个分子中脱去一个小
溴乙烷

溴乙烷、卤代烃重点讲解:卤代烃的官能团是卤原子,掌握其化学性质应紧紧围绕官能团——卤原子。
一、水解反应溴乙烷与NaOH水溶液共热,可发生反应:CH3CH2—Br + H—OH CH3—CH2—OH + HBr注意:(1)此反应属于取代反应。
溴乙烷分子中的溴原子被水分子中的羟基(—OH)取代,取代下来的溴原子与氢原子结合生成溴化氢;(2)溴乙烷的水解反应是可逆反应,为了使正反应进行的比较完全,水解一定要在碱性条件下进行;(3)溴乙烷分子不能电离出Br-,所以它不与AgNO3反应。
但在碱性条件下水解之后,由于溶液中存在Br-,所以再加酸化的AgNO3溶液可以产生浅黄色的AgBr沉淀。
二、消去反应1、概念:有机化合物在一定条件下,从一个分子内脱去一个小分子(如水、卤化氢等分子),而生成不饱和(含双键或叁键)化合物的反应,叫做消去反应。
说明:掌握消去反应概念尤其要注意两个关键点:(1)分子内脱去小分子;(2)生成不饱和(含双键或叁键)的化合物。
2、卤代烃发生消去反应的条件:与NaOH的醇溶液共热3、反应机理:从溴乙烷的消去反应机理可知断裂的键为碳溴键和与卤原子直接相连的碳原子的邻位碳上的碳氢键,所以叫“相邻消去”。
发生消去反应,是与卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。
如CH3X(X代表卤素原子),没有邻位碳原子,不能发生消去反应。
还有如:邻位碳原子上没有H原子,不能发生消去反应。
∴发生消去反应(即分子内脱去小分子)条件:①卤素原子相连的原子有邻位C(最少为2个C)②与卤素原子相连的C原子的邻位C上必须有H原子同时,根据碳的四价结构,与卤素原子直接相连的碳原子的邻位碳,可以是一种,也可能是两种,最多还可以是三种,如果这些邻位碳原子上都有氢原子,则所得到的不饱和烯烃可能是一种,也可能是两种,还可能是三种,这就要看这些邻位碳原子的环境是否等效——即对称。
如果官能团在烃基的对称位置上,则消去产物为一种。
溴乙烷的性质实验知识点总结
溴乙烷的性质实验知识点总结
实验梳理
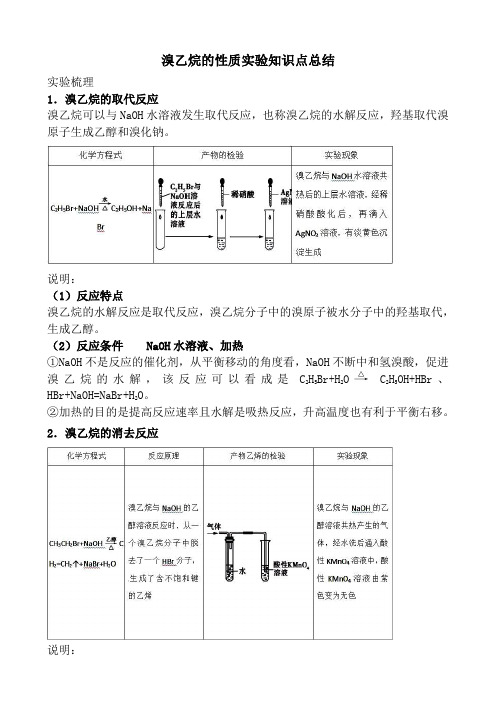
1.溴乙烷的取代反应
溴乙烷可以与NaOH水溶液发生取代反应,也称溴乙烷的水解反应,羟基取代溴原子生成乙醇和溴化钠。
说明:
(1)反应特点
溴乙烷的水解反应是取代反应,溴乙烷分子中的溴原子被水分子中的羟基取代,生成乙醇。
(2)反应条件NaOH水溶液、加热
①NaOH不是反应的催化剂,从平衡移动的角度看,NaOH不断中和氢溴酸,促进溴乙烷的水解,该反应可以看成是C2H5Br+H2O C2H5OH+HBr、HBr+NaOH=NaBr+H2O。
②加热的目的是提高反应速率且水解是吸热反应,升高温度也有利于平衡右移。
2.溴乙烷的消去反应
说明:
(1)反应特点
溴乙烷的消去反应是从分子中相邻的两个碳原子上脱去一个溴化氢分子,有机物由饱和变为不饱和。
(2)反应条件
与强碱的醇溶液共热。
消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应,叫做消去反应。
3.卤代烃的水解反应与消去反应的比较
(1)二者反应机理的区别
以溴乙烷为例,由其分子结构
可知,条件不同,其断键位置不同:
①在强碱的水溶液中,在b处断键,发生取代反应(水解)。
②在强碱的醇溶液中,在a、b处断键,发生消去反应。
(2)二者是平行的竞争反应
在碱性的水溶液中,有利于发生取代(水解)反应生成醇;在碱性的醇溶液中,因有醇的存在,抑制了醇的生成,使反应趋向于发生消去反应,也正因为如此,消去反应易发生副反应。
高中化学精讲溴乙烷__卤代烃

考点解析复习专题辅导46.溴乙烷 卤代烃1.复习重点1.溴乙烷的化学性质(水解、消去反应);2.卤代烃的物理通性、化学性质、卤原子的检验。
2.难点聚焦一、溴乙烷1.溴乙烷的分子组成和结构注解①溴乙烷是乙烷分子里的一个氢原子被溴原子取代得到的。
乙烷分子是非极性分子,溴乙烷分子是极性分子,这是因为溴乙烷分子中,溴原子的电负性大于碳,碳和溴原子之间的成键电子对偏向溴原子一边,因此,C —Br 是极性键。
②溴乙烷在水溶液中或熔化状态下均不电离,是非电解质。
③溴乙烷的官能团是—Br 。
2.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点C 4.38,不溶于水,可溶于大多数有机溶剂。
其密度大于水的密度。
3.溴乙烷的化学性质(1)溴乙烷的水解反应实验6—1 课本第146页实验现象 向试管中滴入3AgNO 溶液后有浅黄色沉淀生成。
解释 溴乙烷在NaOH 存在下可以跟水发生水解反应生成乙醇和溴化氢,溴化氢与3AgNO 溶液反应生成AgBr 浅黄色沉淀。
实验探究①检验溴乙烷水解的水溶液中的-Br 时,必须待试管中液体分层后再吸取上层液,以免吸取到未水解的溴乙烷。
②检验-Br 前,先将较多的稀3HNO 溶液滴入待检液中以中和NaOH ,避免-OH 干扰-Br 的检验。
HBr OH H C OH H Br H C NaO H +−−→−-+-5252也可写为:NaBr OH H C NaOH Br H C +→+5252点拨①溴乙烷的水解反应条件:过量的强碱(如NaOH)。
②溴乙烷的水解反应,实质是可逆反应,通常情况下,正反应方向趋势不大,当加入NaOH 溶液时可促进水解进行的程度。
③溴乙烷的水解反应可看成是溴乙烷分子里的溴原子被水分子中的羟基取代,因此溴乙烷的水解反应又属于取代反应。
④溴乙烷分子中的溴原子与3AgNO 溶液不会反应生成AgBr 。
(2)溴乙烷的消去反应①化学反应原理:溴乙烷与强碱(NaOH 或KOH)的醇溶液共热,从分子中脱去HBr ,生成乙烯。
溴乙烷中溴离子的鉴定

溴乙烷中溴离子的鉴定1.引言1.1 概述概述溴乙烷是一种常见的有机化合物,其化学式为C2H5Br。
其中,溴离子(Br-)是成分之一。
溴离子在溴乙烷中起着重要的化学作用,因此,对溴乙烷中溴离子的鉴定成为一项关键的研究内容。
溴离子是一种阴离子,带有一价负电荷。
它在化学反应中具有很高的活性,因此容易与其他物质发生反应。
溴离子的存在与否对于溴乙烷的性质和用途具有重要影响。
为了进行准确的鉴定,科学家们开发了多种检测方法。
这些方法包括物理方法和化学方法。
物理方法主要包括光谱分析、质谱分析等,通过检测溴离子的吸收或散射光谱特征来确定其存在与否。
化学方法则主要利用溴离子与特定试剂之间的反应进行检测,如溴离子与银离子反应生成白色沉淀等。
本文将对溴乙烷中溴离子的鉴定方法进行综述,并总结每种方法的优缺点。
同时,我们将对鉴定结果进行讨论和分析,以期对溴乙烷中溴离子的鉴定有更深入的了解。
最后,我们对未来可能的研究方向进行展望。
总之,溴乙烷中溴离子的鉴定对于理解该有机化合物的性质和用途至关重要。
通过本文的阐述,我们将探讨各种鉴定方法的优缺点,并为进一步的研究提供参考。
1.2 文章结构文章结构部分的内容可以根据以下模板进行编写:文章结构部分提供了关于整篇文章的组织和结构的说明,以帮助读者更好地理解文章的内容和逻辑关系。
本文的结构安排如下:第一部分是引言,主要包括概述、文章结构和目的。
概述部分对溴乙烷中溴离子的鉴定进行简要介绍,引起读者的兴趣并说明该领域的重要性。
文章结构部分说明了本文的整体组织结构,使读者能够清楚地了解该文档的内容分布。
目的部分明确了本文的研究目标和意义,指导读者理解和阅读本文的动力。
第二部分是正文,主要包括溴离子的性质和检测方法。
溴离子的性质部分描述了溴离子的化学特性、物理性质和常见的化学反应。
通过全面了解溴离子的性质,有助于为后续的鉴定方法提供基础知识。
溴离子的检测方法部分介绍了目前常用的鉴定溴离子的实验方法和仪器设备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4. 溴乙烷(Bromo ethane)
4.1标识
别名: 乙基溴,溴代乙烷,Bromic ethane,Ethyl bromide, Hydrobromic ethane, Monobromoethane
分子式:C2H5Br相对分子量:109.0
4.2危规分类及编号
按GB13690归类为第6类“有毒品”
危规分类及编号:6.1类“毒害品”,
危规号:61564,UN.No. 1891; IMDG CODE 6146页,6.1类。
4.3规格、用途
规格:工业级,含量≥98%;试剂级(HG3-980-81)分析纯,沸程38.0~40.0℃,化学纯,沸程37~40℃。
用途:制药、致冷剂、麻醉剂、溶剂、熏蒸剂、有机合成,通用试剂。
4.4物化性质
无色液体,有类似氯仿气味。
相对密度 1.451(25℃)。
熔点-118.5℃。
沸点38.4℃。
折射率1.424。
临界温度230.7℃。
临界压力6.23×106Pa。
蒸气压51.4kPa(20℃)。
难溶于水。
能与乙醇、乙醚、氯仿、四氯化碳等混溶。
4.5危险特性:
易燃。
闪点-23℃。
自然点511.1℃。
蒸气能与空气形成爆炸性混合物。
爆炸极限6.7%~11.3%。
遇高热、明火易燃烧。
受阳光或火焰下易分解生成溴化氢和碳酰溴。
后者有类似光气的剧毒作用。
与水或水蒸气接触会反应生成有毒性和腐蚀性的云雾。
有毒。
大鼠吸入的致死浓度为20000×10-6。
人中毒症状为面部潮红、脉搏频数、四肢震颤、呼吸障碍、声门痉挛、发绀、虚脱。
严重者因呼吸瘫痪而死亡。
麻醉浓度3%~10%。
4.6应急措施
消防方法:消防人员须戴氧气防毒面具和防护服。
用泡沫、二氧化碳、砂土、干粉灭火。
急救:应使吸入蒸气的患者脱离污染区,安置休息并保暖。
眼睛受刺激用水冲洗,严重者须就医诊治。
皮肤接触先用水冲洗,再用肥皂彻底洗涤。
误服立即漱口、饮水,并送医院救治。
4.7储运须知
包装标志:毒害品。
副标志:易燃液体。
包装方法:(Ⅱ)类,玻璃瓶外木箱内衬垫料或铁桶。
储运条件:储存于阴凉、干燥、通风的仓间内。
远离火种、热源。
避光保存。
避免物品受潮,与氧化剂、酸类、含水物品隔离储运。
泄漏处理:首先切断一切火源,戴好防毒面具与手套。
用砂土吸收,倒至空旷地方掩埋。
污染地面用肥皂水或洗涤剂刷洗,经稀释的污水放入废水系统。
