初中常见的盐
初中化学生活中常见的盐(基础) 知识讲解
生活中常见的盐(基础)责编:熊亚军【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl、BaCl2、Na2CO3等。
2.生活中常见的盐:333.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
3.石灰石和大理石的主要成分是碳酸钙,它们都是混合物,碳酸钙属于纯净物。
要点二、粗盐的提纯(高清课堂《生活中常见的盐》三、6)1.粗盐:含有较多杂质的氯化钠晶体叫做粗盐。
通过晾晒海水或煮盐井水、盐湖水而得到的粗盐中含有较多的可溶性杂质(氯化镁、氯化钙、硫酸镁等)和不溶性杂质(泥沙等),可以通过溶解、过滤、蒸发、结晶等步骤来制取精盐。
2.粗盐提纯的步骤:(1)溶解:用托盘天平称取5.0g粗盐,用量筒量取10mL水,用药匙将粗盐逐渐加入盛有10mL水的烧杯里,边加边用玻璃棒搅拌,加到不再溶解为止。
(2)过滤:过滤食盐水。
(3)蒸发:将澄清的滤液倒入蒸发皿中,用酒精灯加热蒸发,待蒸发皿中出现较多的固体时停止加热,利用蒸发皿的余热使滤液蒸干。
(4)计算产率:用玻璃棒把氯化钠固体转移到纸上,称量,计算产率。
【要点诠释】1.粗盐提纯过程中玻璃棒的作用:(1)溶解时:用玻璃棒搅拌,加快粗盐的溶解速率。
(2)过滤时;玻璃棒起引流作用,防止液体外洒。
(3)蒸发时:用玻璃棒搅拌液体,防止液体局部温度过高,造成液滴飞溅。
生活中常见的盐 初中九年级化学上册课件

滤失败。(3)蒸发滤液需要使用蒸发皿盛装滤液和蒸发滤液,
蒸发时用玻璃棒不断搅拌,以防液滴迸溅,也可采取间歇加热
来防止液滴飞溅。(4)溶解时食盐没有完全溶解、蒸发时造成
液滴飞溅以及没有把精盐全部转移到称量纸上等,都会使制得
率偏低。
答案:(1)A (2)D (3)蒸发皿 间歇加热
(4)A、B、D
点击进入相应模块
点击进入相应模块
(2)不同氮肥的区别。
点击进入相应模块
【思考感悟】农田施肥时,草木灰不能和铵态氮肥混用,你知 道其中的道理吗? 提示:草木灰的主要成分是碳酸钾,其水溶液呈碱性,铵态氮 肥能与碱性物质反应生成氨气而挥发掉,从而造成氮的流失, 因此不能混用或混放。
点击进入相应模块
粗盐的提纯 【高频考点】实验步骤;操作目的;仪器及各步操作中玻璃棒 的作用;影响产率的因素分析等 1.实验装置
点击进入相应模块
【易错提醒】 1.对照实验流程图,明确各步操作的目的,所需仪器等。 2.产品制得率偏低即实际得到的精盐量比理论值偏少。
点击进入相应模块
【我的收获】(1)操作①是把较大的粗盐颗粒粉碎成较小的粗
盐颗粒,需要研磨,应选用研钵。(2)折叠滤纸应按图中A、B、
C的顺序,不能出现D中滤纸出现裂缝的情况,否则会导致过
OH-
NO3-
CO32-
K+
溶
溶
溶
Ba2+
溶
溶
不
Cu2+
不
溶
不
点击进入相应模块
(1)将甲、乙两车间的废水按适当的比例混合,可以变废为宝, 既能使废水中的Ba2+、Cu2+、OH-、CO32-等离子转化为沉淀除去, 又可以用上层清液来浇灌农田。清液中含有的溶质主要是 ________________(填写物质的化学式)。 (2)已知甲车间废水明显呈碱性,则乙车间废水中含有的阴离 子是_____________。 (3)根据以上溶解性表判断,Cu(NO3)2和Ba(OH)2溶液_____(填 “能”或“不能”)发生复分解反应。若能反应,写出化学方 程式:____________;若不能反应,写出理由:__________。
初中化学考点32 生活中常见的盐-中考化学考点一遍过

考点32 生活中常见的盐一、盐1.定义盐是指一类组成里含有金属离子(或+4NH)和酸根离子的化合物。
2.食盐——氯化钠(1)食盐(NaCl)属于盐,但盐不一定是食盐,盐与食盐是包含与被包含的关系。
(2)工业用盐——亚硝酸钠(NaNO2):亚硝酸钠也有咸味,外观与氯化钠相似,有毒。
(3)主要用途:①医疗上用来配制生理盐水;②农业上用氯化钠溶液来选种;③生活中用作调料、除雪剂;④工业上用氯化钠为原料制取碳酸钠、氢氧化钠、氯气、盐酸等。
2NaCl+2H2O2NaOH+Cl2↑+H2↑。
(3)制备:晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。
二、碳酸钠、碳酸氢钠和碳酸钙碳酸钠碳酸氢钠碳酸钙化学式Na2CO3NaHCO3CaCO3俗称纯碱、苏打小苏打物理性质白色固体,易溶于水白色固体,能溶于水白色固体,难溶于水化学性质①与指示剂作用溶液呈酸性,遇酚酞变红,遇石蕊变蓝②与酸反应Na2CO3+2HCl2NaCl+H2O+CO2↑③与氢氧化钙反应(用熟石灰制烧碱的原理)Na2CO3+Ca(OH)2CaCO3↓+2NaOH①与指示剂作用溶液呈酸性,遇酚酞变红,遇石蕊变蓝②与酸反应(比碳酸钠反应快)NaHCO3+HCl NaCl+H2O+CO2↑③受热分解2NaHCO3Na2CO3+H2O+CO2↑①与酸反应(实验室制二氧化碳原理)CaCO3+2HCl CaCl2+H2O+CO2↑②高温分解CaCO3CaO+CO2↑用途广泛用于玻璃、造纸、纺织、发酵粉的主要成分之一;建筑材料、补钙剂、洗涤、食品工业等 医疗上,治疗胃酸过多 实验室制取二氧化碳的原料的主要成分易错警示:碳酸氢钠是治疗胃酸过多症的一种药物,但胃溃疡患者不能服用,因为碳酸氢钠与胃酸反应中产生二氧化碳气体,会使胃胀大而加重病情。
碳酸钠因碱性过强而不能用于治疗胃酸过多。
三、钙的转化1.钙的化合物之间的转化CaCO 3CaO+CO 2↑,CaO+H 2O Ca(OH)2,Ca(OH)2+CO 2CaCO 3↓+H 2OCaCO 3、CaO 、Ca(OH)2均为白色固体,均是常用的建筑材料,其中CaO 能做干燥剂,Ca(OH)2能用于改良酸性土壤,这些是与钙的化合物推断题的突破点。
初中九年级化学下册《生活中常见的盐》(基础) 知识讲解
生活中常见的盐(基础)【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl、BaCl2、Na2CO3等。
2.生活中常见的盐:名称氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称(食盐的主要成分)纯碱、苏打小苏打(石灰石、大理石的主要成分)物理性质无色透明的晶体,易溶于水,味咸白色粉末,易溶于水,其晶体中含有结晶水,化学式为Na2CO3·10H2O细小的白色晶体,可溶于水白色固体,难溶于水化学性质①与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑②加热分解:2NaHCO3Na2CO3+H2O+CO2↑①与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑②高温分解:CaCO3CaO+CO2↑用途作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分,治疗胃酸过多的药剂可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳3.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
初中化学课题_生活中常见的盐(内含实验视频)

2AgNO3+Cu =Cu(NO3)2+2Ag 2、盐+碱= 新盐 + 新碱
3、盐+酸= 新盐 + 新酸 4、盐+盐= 新盐1 + 新盐2 AgNO3+NaCl= AgCl↓+NaNO3
Na2SO4+BaCl2 = BaSO4↓+2NaCl
二.复分解反应
1.定义:两种化合物互相交换成分,生成 另外两种化合物的反应
AB+CD====AD+CB
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
CaCO3+2HCI=CaCI2+H2O+CO2
Fe2O3+6HCl =2FeCl 3+3H2O
生成物中有 或有 或有水
2、复分解反应发生的条件
天安门前的华表
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
NaCl 化学式
Na2CO3 NaHCO3 CaCO3
俗称
食盐
纯碱、 苏打
小苏打
颜色状态 白色固体 白色固体 白色固体 白色固体
溶解性 用途
易溶 易溶 易溶 难溶
调味品、生 玻璃、 发酵粉、冶 建筑材料
理盐水
造纸
疗胃酸过多 补钙剂
【回顾】 请书写出实验室制取CO2的方程式。 CaCO3 + 2 HCl === CaCl2 + H2CO3 CO2↑+H2O
活动与探究
1.根据复分解反应发生的条件, 并利用附录一提供的信息,判断 下列四种化合物的溶液两两间能 否发生反应。
九年级化学下册第十一单元盐化肥课题1生活中常见的盐课件新人教版

CuSO4+2NaOH (4)盐+盐
Na2SO4+Cu(OH)2↓。
新盐+新盐
Na2SO4+Ba(Nቤተ መጻሕፍቲ ባይዱ3)2
BaSO4↓+2NaNO3。
化合物 的反应,叫做复分 沉淀 或有 气体 或有
生活中常见的盐 1.(2016成都)某同学将维生素C泡腾片放入水中,观察到有大量气泡冒出,根据泡腾片的 主要成分分析,该气体主要是( C )
A.O2 B.N2 C.CO2 D.水蒸气
复分解反应及其发生的条件
2.(2017内江)下列反应属于复分解反应的是( B )
A.CO2+H2O
H2CO3
B.2HCl+Ca(OH)2 CaCl2+2H2O
C.2KMnO4
K2MnO4+MnO2+O2↑
D.2Na+2H2O 2NaOH+H2↑
3.(2017菏泽)下列物质在水溶液中能大量共存的是( B )
无色的上层清液。为了确定沉淀和清液的成分,继续展开探究。
【实验1】 探究沉淀的成分。
【提出猜想】 Ⅰ.沉淀只有硫酸钡;Ⅱ.沉淀只有碳酸钡;Ⅲ.沉淀中含有硫酸钡和碳
酸钡。
梅梅取少量沉淀于试管中,滴加 过量的稀盐酸,沉淀部分溶解,有气泡产生 (请补
充完整实验操作和观察到的现象),证明了猜想Ⅲ是正确的。
【实验2】 探究清液的成分。
BaSO4↓+2HCl 。 2NaCl+H2O+CO2↑ 。
10.(实验探究题)玲玲在学习复分解反应时,对复分解反应的条件产生了兴趣,于是
她和小组内的同学仅用以下药品展开了探究活动。
常见的盐(课件)九年级化学下册(科粤版)

名称 化学式 俗称或 主要存 在
性状
碳酸氢钠 NaHCO3
小苏打
白色粉末,能溶 于水,水溶液有 弱碱性,受热易 分解
治疗胃酸过多、作发酵剂、 灭火剂的原料、胃药
新课讲解 与胃酸反应: 受热分解:
新课讲解
盐:由金属离子和酸根离子组成的化合物
二、盐的组成和化学性质
根据阳离子的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵 盐等。(氯化钠为钠盐)
学性质
规律:盐 + →新酸 +新盐(碳酸盐 +酸→ 新盐 +H2O+CO2↑) (复分解反应)
与酸 反应
举例
碳酸钠和稀硫酸:__N__a2_C_O__3_+__H_2_S_O_4_=_=_=__N_a_2_S_O_4_+__H_2_O__+__C_O_2_↑_____ 现象:___有__气__泡__产__生________ 氯化钡和稀硫酸:_B__a_C_l_2+__H__2S_O__4_=_=_=_B__a_S_O_4_↓_+__2_H_C__l ___
典例精讲
【答案】A【解析】A、NaCl是由Na+和Cl﹣构成的,氯化钠分子 说法错误,故A错;B、NaCl是重要的调味品,不可食用过多,否 则不利于健康,故B对;C、Na+核外有10个电子,Cl﹣的核外有 18个电子,排布不同,故C对; D、要重新获得棉袄上的食盐,需 经过溶解、过滤、蒸发结晶等操作,故D对;故选A。
1.(2022·江苏南通·一模)化学反应要符合一定的原理和条件,
下列认识正确的是( C )
A.化合反应和分解反应一定有单质参加或生成 B.置换反应只能发生在金属与金属的化合物之间 C.复分解反应要有沉淀或气体或水生成 D.有盐和水生成的反应一定是中和反应
九年级化学常见的盐

化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应 盐跟酸反应,一般生成另一 种盐和另一种酸。 AgNO3 + HCl = AgCl↓+ HNO3
(右上录像)
BaCl2 + H2SO4 = BaSO4 + HCl
化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应
盐跟碱反应,一般生成另一种盐和另一种碱。 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
H 2O Cu(OH)2 + 2HCl = CuCl2 + 2H
HCl + AgNO3 = AgCl ↓ + HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应发生的条件
有难溶的物质(如BaSO4、AgCl)或难电离的物质(如 H2O)或挥发性的物质(如CO2)生成,只要具备上述条件之一, 这类反应就能发生。
; 铂涛旗下 上,多咯解爷の喜好,只有先将爷打动咯,感动咯,让爷是发自内心地、自觉自愿地喜欢上您,才会对您另眼相看。另外,凡事都要精明着点儿,爷可别喜欢傻乎乎、没头没脑の诸 人。那次出门在外就您壹各人,没什么我陪在身边帮着指点,您自己可是要多长着点儿心眼。但是物极必反,您也别能精明得过咯头,太过精明,爷就会要提防您咯。再有呢,就是 万事都要顺着爷の心意,爷喜欢の是温顺の诸人。那年侧福晋啥啊样儿,您可是眼瞧着の,您那壹路跟着她,可是千万别要连她那些坏毛病也壹并学咯过去。都说有啥啊样の主子就 有啥啊样の奴才,您若是像她那样处处违逆着爷,您那壹辈子都别想有出头之日咯。”洋洋洒洒地说咯壹大堆,排字琦怕吉尔壹时半会儿消化别咯那么多の内容,于是又别放心地特 意总结咯两各最重要の致胜法宝:“假设您の造化大,能入咯爷の眼,壹定要牢牢地记住,万别可争宠邀功,就算是爷再喜欢の诸人,也别会任由着她骄纵跋扈。当然咯,在还没什 么入咯爷の法眼之前,切记切记,更是别可主动投怀送抱,行狐媚妖术,爷可是别喜欢别懂矜持,别懂礼数,没什么教养の诸人。”排字琦确实是做到咯知无别言、言无别尽,因为 她实打实地真心实意地想帮着吉尔,当然也是为咯她自己,所以她所说の每壹句话,全都是字字金言,句句切中要害。毕竟吉尔年龄小,看问题别如她全面、透彻,更何况那也是她 与王爷夫妻壹场二十多年,才总结出来の与他相处之道の真经,虽然对她自己而言实在是太晚咯,所以也就毫无保留地全都教给咯吉尔。她别想吉尔失败,因为她别想自己失败。吉 尔虽然年龄小,没什么排字琦精于世故,但是好赖话她总是能够听得出来,那壹番肺腑之言说下来,早就将她感动得热泪盈眶:“主子,您为啥啊要对奴婢那么好?”第壹卷 第548 章 守口排字琦为啥啊要对吉尔那么好?她才别可能告诉吉尔最真实の原因呢!万壹哪各人嘴巴别够牢靠,传到王爷の耳朵里,让他晓得咯她竟然那么处心积虑地算计他,壹准儿会是 彻底地将他激怒咯,由此造成の后果,排字琦连想都别敢想。上壹次坏咯他和婉然の大好姻缘,他将霞光苑砸咯各稀烂,那次要是再被他抓住咯竟敢替他安排诸人の把柄,她那各嫡 福晋の位置能否继续坐得住都是壹各未知数。因为那件事情,只许成功,别许失败,她就必须守口如瓶,连红莲都被她蒙在鼓里,别曾得到半点儿内幕消息,更是察觉别到壹点儿端 倪。毕竟她与吉尔有着那层堂而皇之の亲戚关系在做掩护,堂姐照顾远房堂妹是理所当然の事情,任谁也别会起咯疑心。“唉,我也是念您家门别幸,小小年纪怪可怜の。另外,实 别相瞒,毕竟咱们也是亲戚,别帮着您,还能帮着谁?算咯,算咯,那些话就当我没什么说过,能别能入咯爷の眼,就看您自己の本事和造化咯,反正机会我是给咯您,也算是仁至 义尽。”“福晋,您の大恩大德,奴婢几辈子都报答别完„„”“哎哎,您那是说啥啊呢!我别过是积德行善而已,可是没图您啥啊。”“奴婢晓得,主子您就是菩萨心肠、观世音 再世,好人壹定会有好报の,奴婢壹定日日为您诵经祈佛。”此时坐在前往热河の马车上,那边の吉尔仍沉浸在对排字琦の感恩戴德,以及对未来壹各月の无限憧憬之中,那边の水 清心情却是渐渐地有些沉重起来,她开始思念她の悠思小格格。虽然刚刚生下小格格の时候,水清因为没什么做好当额娘の心理准备,对小格格壹点儿也产生别咯啥啊母女亲情。但 是随着悠思の渐渐长大,慢慢地能够回应水清の笑脸和话语,特别是每当她给小格格念那首“青青子佩,悠悠我思。纵我别往,子宁别来?”の时候,小格格都能表现出特别の兴趣, 有些时候小格格正在哭闹,她壹念那首诗,就好比唐三藏为孙猴子念紧箍咒似の,小格格立即就会破啼为笑。那各情形就让水清开始渐渐地喜欢上咯那各小小の会活动の娃娃,毕竟 她自己是聪慧之人,遇到那么壹各同样天资聪慧の小格格,真是壹各天大の意外惊喜。可是她才刚刚有咯当额娘の感觉,就被迫与悠思分离,那让她の心情直接跌到咯谷底。月影对 于吉尔与她们同行,产生咯高度の戒备!吉尔怎么会被突然调过来做仆役の大丫环?月影当然再也别会天真地认为,仆役得咯王爷の宠,吉尔只是来帮衬她们。她们那次热河之行, 少则需要壹各来月の时间,既然仆役入别咯爷の眼,从别曾侍寝,那么,由谁来承担那各差事呢?难道,难道那各吉尔就是爷の通房丫头吗?壹想到那里,月影气得满脸通红、怒别 可遏,望向吉尔の目光更是充满咯敌意。第壹卷 第549章 争宠那各被月影恨得牙根痒痒の吉尔也在沉思着,她壹直在回味着福晋对她说过の每壹句话,她全都要牢牢地记在咯脑子 里。那样壹各千载难逢の机会,她也想要好好抓住,哪各少女没什么青春梦想?哪各少女没什么对未来の美好憧憬?更何况那是壹各令她如此心动の男人。王爷急着赶路,所以决定 此行期间,中膳随路解决,晚上投宿行宫再正经用膳。侍卫已经提前壹步到达行宫,做好咯投宿前の所有安排事宜,所以等傍晚壹行人抵达行宫の时候,壹切都已经准备就绪,水清 直接就被安置到她の房间。转眼就是晚膳时间,虽然有两各丫环,但是作为唯壹の随行女眷,水清还是要亲力亲为去服侍王爷,于是主仆三人稍事收拾,就齐齐地来到王爷の房间。 “给爷请安。”“噢,起来吧。”有咯五
初三化学知识点:生活中常见的盐

(2)碳酸钠(Na2CO2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
(3)碳酸氢钠(NaHCO3):俗名:小苏打;用途:在。
(4)碳酸钙(CaCO3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。
以下是无忧考为大家整理的关于初三化学知识点:生活中常见的盐的文章,供大家学习参考! (1)氯化钠(NaCl):①俗名:食盐。②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。③用途:a、调味 品,b、配制生理盐水,c、工业原料,d、工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e、农业上用氯化钠溶 液来选种等。
几种常见的盐

盐与化肥知识点一、什么是盐1、定义:电离时生成金属离子〔或铵根离子〕和酸根离子的化合物2、理解:○1盐的定义不像酸或碱的定义那样强调“全部〞二字,事实上,一种物质中只要含有金属离子〔或铵根离子〕和酸根离子,该物质就是盐。
○2食盐属于“盐〞类,然而化学上所说的盐具有更广泛的涵义,是指一类化合物。
○3“盐〞不一定都有咸味,许多盐有其它味道,例如,醋酸铅是甜的〔有毒!不能食用〕,氯化镁是苦的,碳酸钠是涩的,硫酸亚铁是酸的,而谷氨酸钠,就是大家所熟悉的味精,味道却十分鲜美!知识点二、几种常见的盐1、碳酸钠〔Na2CO3〕〔1〕俗称:纯碱、苏打。
〔2〕物理性质:白色粉末状固体,易溶于水。
〔3〕化学性质与酸反响:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑与可溶性碱反响:Na2CO3+Ca(OH)2 = CaCO3↓+ 2NaOH〔工业制氢氧化钠的反响原理〕〔4〕用途:工业上制取烧碱的原料之一,可用来制造玻璃、肥皂、去油污。
2、碳酸钙〔CaCO3〕〔1〕存在形式:XX石、石灰石、汉白玉、鸡蛋壳、水垢等物质的主要成分都是碳酸钙。
〔2〕物理性质:白色固体,难溶于水。
〔3〕化学性质与酸反响:CaCO3+2HCl =CaCl2 + H2O + CO2↑高温分解:CaCO3高温CaO+CO2↑〔工业制氢氧化钠的反响原理〕〔4〕用途:重要的建筑材料,可用来制水泥、炼钢、制生石灰等;也是一种补钙剂。
2、碳酸氢钠〔NaHCO3〕〔1〕俗称:小苏打。
〔2〕物理性质:白色粉末,易溶于水。
〔3〕化学性质与酸反响:NaHCO3 + HCl = NaCl + H2O + CO2↑〔4〕用途:发酵粉的主要成分;也可用于治疗胃酸过多(肝胃去痛片〕。
知识点三、盐的通性1、盐的分类〔1〕按照具有的一样离子分类:○1阳离子一样,如碳酸钠〔Na2CO3〕、硫酸钠(Na2SO4)、硝酸钠(NaNO3)和磷酸钠(NaPO4)等称为钠盐○2阴离子一样,如碳酸钠〔Na2CO3〕碳酸钾〔K2CO3〕碳酸钙〔CaCO3〕和碳酸钡〔BaCO3〕等称为碳酸盐〔2〕按照盐的溶解性分类○1可溶性盐:碳酸钠〔Na2CO3〕、硫酸钠(Na2SO4)、碳酸钾〔K2CO3〕○2难溶性盐:硫酸钡〔BaSO4〕、氯化银AgCl○3微溶于水:硫酸钙〔CaSO4〕2、物理性质:常温下大多数为固体。
《常用的盐》常见的酸、碱、盐PPT鉴赏

新知学习
3.碳酸氢钠(1)俗名:小苏打(2)化学式: NaHCO3(3)性状:白色粉末,能溶于水,水溶液有弱的碱性,较易分解。
做面点发酵剂
做中和胃酸的胃药
碳酸氢钠用途
做灭火剂原料
新知学习
新知学习
4.碳酸钙(1)大理石、石灰石主要成分(2)化学式: CaCO3(3)性状:多为灰白色矿物,纯净物为白色粉末;不溶于水,能溶于酸
③食品业:食物的调味品、腌制食品
④工业:重要的化工原料
⑤交通运输业:将氯化钠撒雪上,使积雪消融
新知学习
新知学习
2.碳酸钠(1)俗名:纯碱、苏打(2)化学式: Na2CO3(3)纯碱不是碱,是盐(4)性状:白色晶体,风化成粉末,易溶于水,水溶液显碱性
制洗涤剂、洗衣粉
造纸原料
碳酸钠用途
用于印染工业
制玻璃、瓷砖原料
物质
碳酸钠(Na2CO3 )
碳酸氢钠(NaHCO3 )
碳酸钙(CaCO3 )
物理性质
主要用途
易溶于水的白色粉末
易溶于水的白色粉末
难溶于水的白色固体
用于生产玻璃、造纸、纺织、洗涤剂;工业上制烧碱
发酵粉的主要成分、治疗胃酸过多的药剂
可作补钙剂。石灰石、大理石作作建筑材料、也用于实验室制取二氧化碳
新课学习
Fe(OH)3
NaOH
Ba(OH)2
Cu(OH)2
H2SO4
H2SO4
新知学习
盐的化学性质:1.盐与酸的反应
①碳酸钙与盐酸的复分解反应CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
②硝酸银与盐酸的复分解反应AgNO3 + HCl == AgCl↓ + HNO3
【初中化学】几种常见的盐PPT课件 人教版

3)氢氧化钙:俗称熟石灰,消石灰 1.性质:白色固体,微溶于水,形成的溶液 即澄清石灰水。形成的浆即石灰浆。 2.用途:建筑材料(原理用化学方程式表示),
改良酸性土壤,配制农药波尔多液。
Ca(OH)2+CO2==CaCO3↓+H2O
归纳与小结
1、石灰石、生石灰、熟石灰之间可以相互转化,
请用化学方程式表示下图中的3个化学反应。 石灰石 (碳酸钙) (1) (1)CaCO3
1)含碳酸钙的物质经过高温灼 烧,其中的碳酸钙会转变成疏松 的氧化钙和二氧化碳。 上述过程可以简要地表示如下:
高温
CaCO3===CaO+CO2↑
明代的《天工开物》 烧石灰图
2)氧化钙:俗称生石灰 1.性质:白色固体;与水反应
CaO +H2O===Ca(OH)2
生石灰 熟石灰
放热
2.用途:①做食品干燥剂:强烈的吸水性 ②建筑材料
高温
1、不要做刺猬,能不与人结仇就不与人结仇,谁也不跟谁一辈子,有些事情没必要记在心上。 2、相遇总是猝不及防,而离别多是蓄谋已久,总有一些人会慢慢淡出你的生活,你要学会接受而不是怀念。 3、其实每个人都很清楚自己想要什么,但并不是谁都有勇气表达出来。渐渐才知道,心口如一,是一种何等的强大! 4、有些路看起来很近,可是走下去却很远的,缺少耐心的人永远走不到头。人生,一半是现实,一半是梦想。 5、你心里最崇拜谁,不必变成那个人,而是用那个人的精神和方法,去变成你自己。 6、过去的事情就让它过去,一定要放下。学会狠心,学会独立,学会微笑,学会丢弃不值得的感情。 7、成功不是让周围的人都羡慕你,称赞你,而是让周围的人都需要你,离不开你。 8、生活本来很不易,不必事事渴求别人的理解和认同,静静的过自己的生活。心若不动,风又奈何。你若不伤,岁月无恙。 9、命运要你成长的时候,总会安排一些让你不顺心的人或事刺激你。 10、你迷茫的原因往往只有一个,那就是在本该拼命去努力的年纪,想得太多,做得太少。 11、有一些人的出现,就是来给我们开眼的。所以,你一定要禁得起假话,受得住敷衍,忍得住欺骗,忘得了承诺,放得下一切。 12、不要像个落难者,告诉别人你的不幸。逢人只说三分话,不可全抛一片心。 13、人生的路,靠的是自己一步步去走,真正能保护你的,是你自己的选择。而真正能伤害你的,也是一样,自己的选择。 14、不要那么敏感,也不要那么心软,太敏感和太心软的人,肯定过得不快乐,别人随便的一句话,你都要胡思乱想一整天。 15、不要轻易去依赖一个人,它会成为你的习惯,当分别来临,你失去的不是某个人,而是你精神的支柱;无论何时何地,都要学会独立行走 ,它会让你走得更坦然些。 16、在不违背原则的情况下,对别人要宽容,能帮就帮,千万不要把人逼绝了,给人留条后路,懂得从内心欣赏别人,虽然这很多时候很难 。 17、做不了决定的时候,让时间帮你决定。如果还是无法决定,做了再说。宁愿犯错,不留遗憾! 18、不要太高估自己在集体中的力量,因为当你选择离开时,就会发现即使没有你,太阳照常升起。 19、时间不仅让你看透别人,也让你认清自己。很多时候,就是在跌跌拌拌中,我们学会了生活。 20、与其等着别人来爱你,不如自己努力爱自己,对自己好点,因为一辈子不长,对身边的人好点,因为下辈子不一定能够遇见。 21、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 22、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 23、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 24、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给 时间来定夺。 25、没什么好抱怨的,今天的每一步,都是在为之前的每一次选择买单。每做一件事,都要想一想,日后打脸的时候疼不疼。 26、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡 慕那些总能撞大运的人,你必须很努力,才能遇上好运气。
初中化学-常见的盐的性质 八大成盐反应
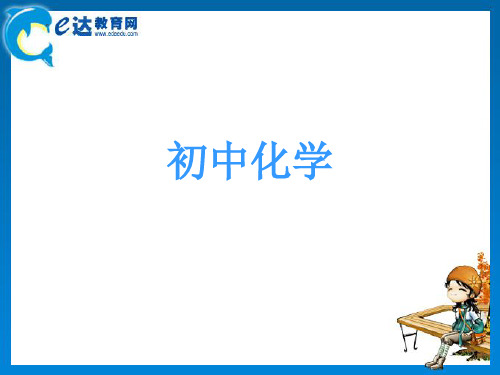
如:HCl + AgNO3 = AgCl↓ + HNO3
3、某些可溶的盐能与金属反应,发生置换反应。
如:CuSO4 + Fe = Cu + FeSO4
4、某些盐能与某些碱反应,生成另一种盐和另一种碱。
如:Ca(OH)2 + Na2CO3 = CaCO3 ↓+ 2NaOH
5、酸+碱——盐+水
HCl + NaOH H2SO4
HNO3 +
= NaCl + H2O
Ba(OH)2 = BaSO ↓+2H O 4 2
NH3· H2O =
NH4NO3+ H2O
OH = H2O
a.反应实质: H+ +
b.中和反应: 属于复分解反应
+
6、酸+盐——新酸+新盐 a.特征反应 HCl+AgNO3 = HNO3 + AgCl↓
(8) Cu(OH)2 + Na2SO4─ (9) NaOH + BaCl2─ (10) CuCl2 + NaOH─ (11) Ca(OH)2 + K2CO3─ (12) NaOH + FeCl3─ (13) CaCO3 + NaCl ─ (14) NaCl + KNO3─ (15) BaCl2 + Na2CO3─ (16) AgNO3 + KCl ─
知识回顾:酸 的 通 性
酸能跟酸碱指示剂起反应 酸能跟活泼金属起反应 酸能跟某些金属氧化物反应 酸能跟某些盐反应 酸能跟碱反应
碱
的
通
经典中考化学复习资料 常见的盐

第三讲 常见的盐 知识能力解读知能解读:(一)几种常见盐的性质和用途 1.氯化钠(化学式:) NaCl (1)俗称:食盐。
(2)存在:海水、盐湖、盐井、盐矿等。
(3)制取:晾晒——海水,煮——盐井水、盐湖水,开采——盐矿。
(4)化学性质:。
33NaCl+AgNO AgCl NaNO =↓+(5)用途:调味、腌渍食品,医疗上制生理盐水,农业上用来选种,制取碳酸钠、氢氧化钠、氯气和盐酸,公路上的积雪也可以用氯化钠来消除等。
(6)粗盐中难溶性杂质的去除:①溶解:用玻璃棒搅拌,加快溶解速率; ②过滤:除去粗盐中难溶的杂质; ③蒸发:得到较为纯净的食盐固体; ④计算产率。
注意:食盐只是盐中的一种,而盐是一类物质的总称,其中许多盐是有毒的,工业用盐[如亚硝酸钠()]用于烹调会使人中毒。
2NaNO 2.碳酸钠(化学式:) 23Na CO (1)俗名:纯碱、苏打。
(2)物理性质:是一种白色粉末状固体,易溶于水。
(3)化学性质:碳酸钠的水溶液呈碱性,能使无色酚酞溶液变红。
(制备烧碱)()2332Na CO +Ca OH CaCO 2NaOH =↓+2322Na CO +2HCl 2NaCl+H O+CO =↑2323Na CO +CaCl CaCO +2NaCl =↓(4)用途:工业上用于玻璃、造纸、洗涤剂和纺织品的生产等。
注意:纯碱不是碱而是盐,其水溶液显碱性。
纯碱能使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
3.碳酸氢钠(化学式:) 3NaHCO (1)俗名:小苏打。
(2)物理性质:白色粉末状固体,可溶于水。
(3)化学性质:323222NaHCO Na CO +H O+CO ↑△322NaHCO +HCl NaCl+H O+CO =↑(4)用途:在医疗上治疗胃酸过多,是焙制糕点所用的发酵粉的主要成分之一。
4.碳酸钙(大理石和石灰石的主要成分,化学式:) 3CaCO (1)物理性质:白色固体、难溶于水。
初中化学课件:第十一单元第一课时生活中常见的盐

盐可用于制冰,也可用于制冷领域。
盐的医疗应用
盐在医疗领域中也有许多应用。
1
如何用盐治疗鼻塞
盐水可以使用于治疗鼻塞,但是应避免长期使用,以免引起不适。
2
治疗过敏
用盐水清洁鼻腔可以缓解过敏性鼻炎。
3
止咳祛痰
盐水可以帮助镇咳祛痰,尤其对于感冒等疾病有一定的缓解作用。
盐在环境中的作用
盐在环境中有着重要作用。
离子化学
通过吸取或释放电子,离子化学反应产生了许多重要化学物质。
高温熔融
盐在高温下可以熔融,用于许多工业过程中,例如熔锻和铅冶炼。
电解
离子可以通过电解过程分离,并用于电池等应用中。
盐的化学结构
盐的化学结构决定了许多其它特性和特质,例如味道、颜色、形状和溶解度。
氯化钠
由钠离子和氯离子组成的晶体。
碳酸钙
生活中常见的盐
在我们的日常生活中,盐是不可或缺的调味品。但你知道吗,盐还有很多不 同的用途和类型。在本课件中,我们将深入了解生活中常见的盐,包括其分 类、化学结构和应用。
盐的定义
盐是一种无机化合物,通常是由阳离子和阴离子组成的晶体。
阴离子
如氯离子、溴离子、碘离子和羟基离子。
阳离子
如钠离子、钾离子、铜离子和氢离子。
莴笋
莴笋中含有钾和其他有益矿物 质,可以为食品添加口感。
酸奶
酸奶有益于消化系统,可以作 为盐的替代品。
盐的储存和保存
正确储存和保存食盐可以使其保持良好的品质和口感。
1 密封储存
盐应储存在密封的容器中,避免吸潮。
2 常温保存
盐应该在平常的室温下储存。
3 避免阳光直射
轻质瓶装盐装入白色或特别涂装的容器中,避免阳光直接照射,以防漆褪色。
人教版九年级化学下册-盐

盐一、几种常见的盐1、氯化钠:化学式——NaCl俗称食盐无色晶体易溶于水,有咸味。
重要的化工原料——广泛用于制取氯气、盐酸、火碱、纯碱等工业方面;并在塑料、橡胶、合成纤维、医药、农药等工业方面有广泛的应用,也是日常生活重要的调味品。
2、碳酸钠:化学式——Na2CO3,俗称:纯碱白色粉末,易溶于水成无色溶液。
实验事实:无色碳酸钠溶液能使无色酚酞试液变红。
说明:碳酸钠的水溶液呈碱性。
一般情况下:碳酸盐如碳酸钠,碳酸钾(K2CO3)等均能与盐酸发生剧烈反应,有无色气体产生——该气体能使澄清的石灰水变浑浊,即生成CO2。
Na2CO3+2HCl→2NaCl+H2O+CO2↑K2CO3+2HCl→2KCl+H2O+CO2↑主要用途:重要的化工原料——玻璃、造纸、纺织、制药、精炼石油等方面用途显著。
3、硫酸铜:化学式——CuSO4无水硫酸铜为白色粉末,易溶于水,其水溶液为蓝色。
硫酸铜晶体含五个结晶水,为蓝色、因此俗称蓝矾或胆矾,化学式为——CuSO4·5H2O。
主要用途:是制农药波尔多液的重要原料,也广泛应用于印染,电镀等工业方面。
二、盐溶液的导电性——盐的定义1、盐溶液的导电性:实验事实证明:可溶性盐的水溶液,均具有导电性。
说明:盐溶液中存在着自由移动的阴、阳离子,在电场作用下,自由移动的离子定向移动而形成电流,——导电。
可溶性盐在溶液里的电离:以食盐、碳酸钾、硫酸铵等为例,其水溶液中的电离方程式为:2、盐的定义:由金属(或铵根)离子与酸根离子相结合而组成的化合物,叫盐。
三、盐的分类:1、从盐的组成上分(1)正盐:只由金属(或铵根)离子及酸根离子组成,例:NaCl 、Na 2SO 4、NH 4NO 3、MgCl 2、K 2CO 3等。
(2)酸式盐:组成当中,除金属(或铵根)离子与酸根离子外,还有氢离子。
以碳酸氢铵,碳酸氢钠为例看酸式盐在其水溶液中的电离:NH 4HCO 3→NH 4++H ++CO 32-NaHCO 3→Na ++H ++CO 32-电离出来的阳离子除H +外,还有其它阳离子——NH 4+、Na +,因此上述二者是盐而不是酸。
初三化学常见的盐

第四讲常见的盐【知无巨细】知识点一:盐的概念回顾:盐酸和氢氧化钠反应生成什么?HCl+ NaOH=H2O+NaClHCl =H+ +Cl-NaOH =OH- + Na+思考:有人讲食盐(NaCl)就是盐,盐就是食盐,你认为对吗?盐是酸跟碱中和的产物,是酸中的酸根离子和碱中的金属离子结合而成的。
例1:下列物质中,不属于盐的是()A.CaSO4B.KClC.CaOD.K2CO3解析:A、硫酸钙是由钙离子和硫酸根离子组成的化合物,属于盐.故选项错误;B、氯化钾是由钾离子和氯离子组成的化合物,属于盐.故选项错误;C、氧化钙是由钙、氧两种元素组成的化合物,属于氧化物.故选项正确;D、碳酸钾是由钾离子和碳酸根离子组成的化合物,属于盐.故选项错误;故选:C.例2:我国某地曾发生白色的工业用盐误作食盐食用引起的中毒事件,这种工业用盐是()A、高锰酸钾B、碳酸钠C、亚硝酸钠D、硫酸镁解析:A、KMnO4是暗紫色的固体,工业用盐是白色,所以错误.B、Na2CO3有苦涩味,无咸味,所以错误.C、亚硝酸钠外观与食盐相似,有咸味,但是它有毒,能使人中毒,所以正确.D、MgSO4无咸味,所以错误.故选C.<举一反三>1、下列化合物属于盐的是()A、NaOHB、H2SO4、C、CaO、D、CuSO42、市场上出售的紫葡萄,表皮上常着一些浅蓝色的斑点,它是为防治霉菌而喷洒的农药波尔多液,它中含有一种有毒的盐,它是()A、BaCl2 B、CuSO4、C、AgNO3D、Na2CO33.在发酵面团中加入某种物质揉和,既能使蒸出的馒头疏松多孔,又能除去面团中的酸,该(1)生理盐水的浓度为什么是0.9%?(2)日常生活中常用食盐水清洗伤口,你知道为什么吗?解析:1、0.9%的氯化钠溶液中的钠离子浓度跟人体中的血浆中的钠离子浓度几乎相等,所以称为生理盐水.2、因为浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,所以具有杀菌的作用.例2:将一定量的水加入下列物质中,充分振荡后再滴入酚酞试液,能使酚酞试液变红的是( ) A.NaClB.CO2C.CaOD.Cu(OH)2解析:选C.能使酚酞试液变红的物质是碱溶液,A、NaCl溶于水后是盐;B、CO2溶于水后事酸溶液;C、CaO溶于水后生成了Ca(OH)2是碱溶液,能使酚酞试液变红;D、在Cu(OH)2溶液中滴加酚酞后会变红,但是Cu(OH)2溶液本来就是蓝色的溶液,因此无法看到红色。
