乙醇醇类PPT课件1 人教版55页PPT
合集下载
乙醇 醇类 PPT

烃基不同: 脂肪醇、芳香醇等
4、醇的物理性质
低级的饱和一元醇为无色中性液体,具 有特殊气味,甲醇、乙醇、丙醇与水以任意比 混溶;
含4到11个碳的醇为油状液体,可以部 分溶于水;
含12个碳以上的醇为无色无味的蜡状 固体,不溶于水;
随着分子里碳原子数的递增,醇的沸点 逐渐升高,密度逐渐增大。
5、常见的醇:(完成讲义)
酯化反应 卤代反应 取代反应
CH3CH2OH
浓H2SO4 140℃
分子间脱水
CH3CH2OH
浓H2SO4 170℃
消去反应
CH3CH2OH+O2 点燃
CH3CH2OH+O2
Cu
△
氧化反应
☆特别注意:
1、醇的催化氧化规律:羟基碳上有2个氢,被氧化为醛;
羟基碳上有1个氢,被氧化为酮,
羟基碳上没有氢,则难以被氧化。
请写出1、2、3、5、7、9、10有关反应 方程式。
(1)置换反应(活泼金属反应)
(2)取代反应(酯化、卤代、分子间脱水成醚)
(3)消去反应
(4)氧化反应 可燃性、催化氧化、使酸性KMnO4、 酸性重铬酸钾溶液变色
CH3CH2OH+Na
置换反应
CH3CH2OH+CH3COOH CH3CH2OH+HBr
沸点: 远高于式量相近的烷烃?
醇分子间形成氢键示意图:
R
R
R
O HH
O
H
H
O
H
H
O
O
O
R
R
R
甲醇,乙醇,丙醇可与水以任意比例互溶
你知道形成氢键的条件吗?
延伸:还有一些烃衍生物也可以形成氢键
4、醇的物理性质
低级的饱和一元醇为无色中性液体,具 有特殊气味,甲醇、乙醇、丙醇与水以任意比 混溶;
含4到11个碳的醇为油状液体,可以部 分溶于水;
含12个碳以上的醇为无色无味的蜡状 固体,不溶于水;
随着分子里碳原子数的递增,醇的沸点 逐渐升高,密度逐渐增大。
5、常见的醇:(完成讲义)
酯化反应 卤代反应 取代反应
CH3CH2OH
浓H2SO4 140℃
分子间脱水
CH3CH2OH
浓H2SO4 170℃
消去反应
CH3CH2OH+O2 点燃
CH3CH2OH+O2
Cu
△
氧化反应
☆特别注意:
1、醇的催化氧化规律:羟基碳上有2个氢,被氧化为醛;
羟基碳上有1个氢,被氧化为酮,
羟基碳上没有氢,则难以被氧化。
请写出1、2、3、5、7、9、10有关反应 方程式。
(1)置换反应(活泼金属反应)
(2)取代反应(酯化、卤代、分子间脱水成醚)
(3)消去反应
(4)氧化反应 可燃性、催化氧化、使酸性KMnO4、 酸性重铬酸钾溶液变色
CH3CH2OH+Na
置换反应
CH3CH2OH+CH3COOH CH3CH2OH+HBr
沸点: 远高于式量相近的烷烃?
醇分子间形成氢键示意图:
R
R
R
O HH
O
H
H
O
H
H
O
O
O
R
R
R
甲醇,乙醇,丙醇可与水以任意比例互溶
你知道形成氢键的条件吗?
延伸:还有一些烃衍生物也可以形成氢键
课件:《乙醇醇类》

CH3CH2CH2OH 有两个或两个以上H氧化成醛; CH3CHCH3 | OH CH3 | CH3—C—OH | CH3
有一个H氧化成酮; 没有H不能催化氧化。
下列醇能发生催化氧化吗?
CH3 CH3CH2-C-CH3 OH
CH3 CH3-C-CH2OH CH3
×
√
2CrO3(红色) + 3C2H5OH + 3H2SO4 Cr2(SO4)3(绿色) + 3CH3CHO + 6H2O
2)消去反应
浓硫酸
C2H5OH
170℃
CH2=CH2↑+ H2O
醇的消去规律:
与–OH 碳相邻的碳原子上有H原子的醇 才能发生消去反应。
下列醇能发生消去反应吗?
CH3 CH3CH2-C-CH3 OH
CH3 CH3-C-CH2OH CH3
√
×
3)氧化反应
①燃烧:C2H5OH + 3O2
点燃
2 CO2 + 3H2O
2—甲基—1—丙醇
CH3 CH3 CH3—CH—C—OH CH2—CH3
2,3—二甲基—3—戊醇
实验室制取乙烯
为何使液体温度迅 速升到170℃?
酒精与浓硫酸体 积比为多少?
温度计的 位置?
浓硫酸的作 用是什么?
放入几片碎 瓷片作用是 什么?
有何杂质气体? 如何除去?
混合液颜色如何 变化?为什么?
五、醇类
燃 料
消毒剂
乙 醇
化工原 料 溶 剂 饮 料
主干知识网
CO2 CH2=CH2
氧化 分解
C6H12O6
消 去
水解
加 成
氧化
《乙醇》ppt课件 人教课标版1

感谢观看,欢迎指导!
3.下列物质中,不能与乙醇发生酯化反应的是( A )
A.乙醛 B.硝酸 C.苯甲酸 D.硫酸
4.用30g乙酸和46g乙醇反应,如果实际产 率是理论产率的85%,则可得到的乙酸乙酯
的质量是( A )
A.37.4g B.44g C.74.8g D.88g
5、可以说明乙酸是弱酸的事实是( C )
A.乙酸能与水以任意比混溶 B.乙酸能与碳酸钠反应,产生二氧化碳 C.1mol/L的乙酸钠溶液的PH值约为9 D.1mol/L的乙酸水溶液能使紫色石蕊试液变红
乙酸具有酸的通性: ①能使紫色的石蕊试液变红②能跟活泼金属反应
③能跟某些金属氧化物反应
④能跟碱反应⑤能跟某些盐反应
例如: 2CH3COOH+Zn=(CH3COO)2Zn+H2↑ 2CH3COOH+CuO=(CH3COO)2Cu+H2O 2CH3COOH+Ca(OH)2=(CH3COO)2Ca+2H2O 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
6、烧鱼时,又加酒又加醋,鱼的味道就变得无腥、香
醇、特别鲜美,其原因是 (D)
A.有盐类物质生成 B.有酸类物质生成 C.有醇类物质生成 D.有酯类物质生成
1.城市发展论坛的与会专家普遍认为 :我国 城镇化 研究主 要集中 在预测 城镇化 速度和 趋势上 ,而对 城镇化 过程中 公共政 策的负 面影响 则明显 被忽视 。
饮食中重要的有机化合物
(第二课时)
传说了在酒古。代他的儿中子兴黑国塔,也即跟今杜山康西学省会运了城酿县酒有技个术叫。杜后康来的,人黑发塔明率 族扔掉移可居惜现,江就苏存省放镇起江来的,地在方缸。里在浸那泡里。,到他了们二酿十酒一后日觉的得酉酒时糟, 一诱为开惑“缸下调,,味一黑浆股塔”从尝。来了这没一种有口调闻,味过酸浆的甜叫香兼什气备么扑,名鼻味字而道呢来很?。美黑在,塔浓便把郁贮二的藏十香着一味作日 加酸这“节,酉课食”就醋字来中来研含命究有名乙3%这酸—种的5酸结%水构的叫和乙“性酸醋质,”。所。以醋乙的酸主又要叫成醋分酸就。是我乙们
乙醇醇类(课件PPT)
11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
二、醇类
1.醇的定义 2.醇的分类 3.饱和一元醇的组成及结构通式
4.常见醇的物理性质(甲醇、丙醇、 乙二醇、丙三醇)及碳原子数的递变与物 理性质的关系。
5.分析低级醇的沸点比其相对应的烷 烃要高得:无色、粘稠、甜味、液体、低凝固点 化学性质:与乙醇相似。 用途:抗冻剂、原料、发雾剂。
53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
二、醇类
1.醇的定义 2.醇的分类 3.饱和一元醇的组成及结构通式
4.常见醇的物理性质(甲醇、丙醇、 乙二醇、丙三醇)及碳原子数的递变与物 理性质的关系。
5.分析低级醇的沸点比其相对应的烷 烃要高得:无色、粘稠、甜味、液体、低凝固点 化学性质:与乙醇相似。 用途:抗冻剂、原料、发雾剂。
53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。
乙醇和醇类PPT演示文稿

为培养学生的创新精神和创新能力,根据教学大 纲和学生实际,确定本节教学目标为:
①使学生掌握乙醇的结构和主要的化学性质 ②使学生了解乙的化学性质。乙醇的化学性质是整个 醇类化学性质的“龙头”,掌握了乙醇的化学性质, 可以类推其他醇类的性质 。并为后面学习苯酚的性质, 乙醛的性质做好铺垫。 难点是化学性质与分子结构的关系。在乙醇与钠的反 应,乙醇的催化氧化及消去反应中,断裂和生成的化 学键分别是哪个,这是学生较难理解的。授课过程中 利用已有知识,利用实验产物,可推知化学键的断裂 和生成部位。利用球棍模型及多媒体课件都 可以形象直观地看出这些部位。 有利于难点的突破。
3、补充乙醇的催化氧化实验,既强化 了重点,又为今后学习乙醛做铺垫 补充实验:在试管中加入2ml乙醇, 把光亮的细铜丝绕成螺旋状,在酒精 灯的外焰上加热烧红,当表面生成一 层黑色氧化铜时,迅速插到盛有乙醇 的试管底部。观察反应现象,并请一 学生在试管口闻气味。教师明确告诉 大家,这刺激性气味是乙醛的气味, 乙醇被氧化成了乙醛,同时教师给出 乙醛的结构式,引导学生分析在上述 反应中到底是哪个键断裂。通过补充 实验,既强化了重点,又为后续学习 做准备。 多媒体演示乙醇的催化氧化
(二)讲授阶段(结合多媒体演示)
1、展示教具,掌握结构,为突出重点,突破难点做准备 展示乙醇的球棍模型和乙醇样品,用多媒体出示 以下问题: 问题设计: ①乙醇的分子式_________式量_________结构式_______结 构简式_________官能团_________ ②乙醇俗称_________无水乙醇_________色,透明而有 __________味。 让学生带着问题读课本P156乙醇的结构并总结乙醇的物理 性质。带着问题阅读教材,学生在理论上认识了乙醇的结 构,球棍模型又形象直观地体现乙醇的结构。这就使学生 不仅从理论上而且从空间结构中真真切切地感受到乙醇的 结构。结构决定性质,结构的认识为讲授化学性质,突破 本节难点做好了铺垫。
①使学生掌握乙醇的结构和主要的化学性质 ②使学生了解乙的化学性质。乙醇的化学性质是整个 醇类化学性质的“龙头”,掌握了乙醇的化学性质, 可以类推其他醇类的性质 。并为后面学习苯酚的性质, 乙醛的性质做好铺垫。 难点是化学性质与分子结构的关系。在乙醇与钠的反 应,乙醇的催化氧化及消去反应中,断裂和生成的化 学键分别是哪个,这是学生较难理解的。授课过程中 利用已有知识,利用实验产物,可推知化学键的断裂 和生成部位。利用球棍模型及多媒体课件都 可以形象直观地看出这些部位。 有利于难点的突破。
3、补充乙醇的催化氧化实验,既强化 了重点,又为今后学习乙醛做铺垫 补充实验:在试管中加入2ml乙醇, 把光亮的细铜丝绕成螺旋状,在酒精 灯的外焰上加热烧红,当表面生成一 层黑色氧化铜时,迅速插到盛有乙醇 的试管底部。观察反应现象,并请一 学生在试管口闻气味。教师明确告诉 大家,这刺激性气味是乙醛的气味, 乙醇被氧化成了乙醛,同时教师给出 乙醛的结构式,引导学生分析在上述 反应中到底是哪个键断裂。通过补充 实验,既强化了重点,又为后续学习 做准备。 多媒体演示乙醇的催化氧化
(二)讲授阶段(结合多媒体演示)
1、展示教具,掌握结构,为突出重点,突破难点做准备 展示乙醇的球棍模型和乙醇样品,用多媒体出示 以下问题: 问题设计: ①乙醇的分子式_________式量_________结构式_______结 构简式_________官能团_________ ②乙醇俗称_________无水乙醇_________色,透明而有 __________味。 让学生带着问题读课本P156乙醇的结构并总结乙醇的物理 性质。带着问题阅读教材,学生在理论上认识了乙醇的结 构,球棍模型又形象直观地体现乙醇的结构。这就使学生 不仅从理论上而且从空间结构中真真切切地感受到乙醇的 结构。结构决定性质,结构的认识为讲授化学性质,突破 本节难点做好了铺垫。
乙醇和醇类-PPT课件

H OH
分子间脱水(取代反应) • 化学方程式: • 断键位置:-O-H H-O具有羟基的结构可能脱水
17
•
(1)分子内脱水
•
HH
||
•
•
H—C — C—H
||
•
•
H OH
乙醇的脱水反应:
-------消去反应
浓硫酸
1700C
CH2=CH2↑ + H2O 乙烯
18
乙醇的脱水反应:
•
(2)分子间脱水
气
味。
15
反应机理:
2Cu O2 2CuO
• H—C—C—H + CuO
总反应式:
HH
H O—H
HH
||
H—C — C =O + Cu + H2O
|
H 乙醛
• ||
• ||
2C2 H 5OH
•
O2
•
•
催化剂
△
2CH 3CHO
2H 2O
(Cu作催化剂)
16
3.脱水反应 分子内脱水(消去反应)
• 化学方程式: • 断键位置:- C – C –
密度为p g/cm-3,充分反应后量筒内液面读数为a mL,则一个
乙醇分子中能被置换的氢原子数为 n(H)=23 a /5600 Vp 。
(用含a、V、p的式子表示)
4
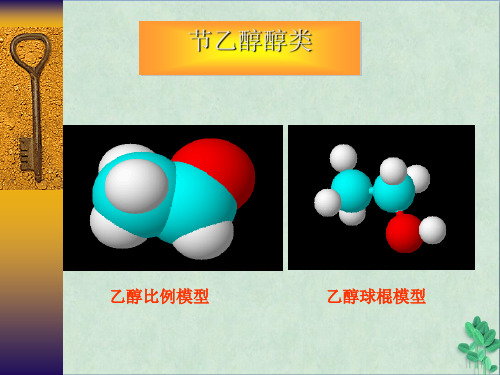
乙醇 醇类
乙醇比例模型
乙醇球棍模型
5
6
知识内容
乙醇的性质、乙醇的结构及断键方式、
乙醇的应用
能力内容 探究能力、分析问题的能力
实验内容
写出下列化学方程式: 1、 CH3CH2OH与浓盐酸的反应:
分子间脱水(取代反应) • 化学方程式: • 断键位置:-O-H H-O具有羟基的结构可能脱水
17
•
(1)分子内脱水
•
HH
||
•
•
H—C — C—H
||
•
•
H OH
乙醇的脱水反应:
-------消去反应
浓硫酸
1700C
CH2=CH2↑ + H2O 乙烯
18
乙醇的脱水反应:
•
(2)分子间脱水
气
味。
15
反应机理:
2Cu O2 2CuO
• H—C—C—H + CuO
总反应式:
HH
H O—H
HH
||
H—C — C =O + Cu + H2O
|
H 乙醛
• ||
• ||
2C2 H 5OH
•
O2
•
•
催化剂
△
2CH 3CHO
2H 2O
(Cu作催化剂)
16
3.脱水反应 分子内脱水(消去反应)
• 化学方程式: • 断键位置:- C – C –
密度为p g/cm-3,充分反应后量筒内液面读数为a mL,则一个
乙醇分子中能被置换的氢原子数为 n(H)=23 a /5600 Vp 。
(用含a、V、p的式子表示)
4
乙醇 醇类
乙醇比例模型
乙醇球棍模型
5
6
知识内容
乙醇的性质、乙醇的结构及断键方式、
乙醇的应用
能力内容 探究能力、分析问题的能力
实验内容
写出下列化学方程式: 1、 CH3CH2OH与浓盐酸的反应:
乙醇 醇类PPT教学课件

NaCl + H2SO4 C2H5OH + HCl
NaHSO4 + HCl C2 H5Cl + H2O
启迪思考题
9、当-C上氢原子数目与醇的氧化有何关系?
参考:与-OH相连的碳原子必须有H
才能被氧化。
HH
两个氢脱去与O结合成水
H C—C—H
H O—H
--C被氧化还原
①在--C碳上有2个H时
RCH O Cu RCH=O
3、气温的空间变化及原因
• (1)气温的水平分布(变化)
• 气温的水平分布规律及成因:
• ①气温从低纬向两极递减。
•
原因:太阳辐射(高度)由低纬向高续递减
• ②南半球等温线比北半球平直。
•
原因:南半球海洋较广阔性质较均一
• ③北半球冬季大陆上等温线向低纬凸出,夏季大陆 上等温线向高纬凸出;海洋与大陆相反。
乙醇分子可以看作是水分子里的一个氢原子
被乙基所取代的产物,但乙醇在水溶液里比水还
难于电离。
启迪思考:试比较乙醇和 水的酸性强弱 ?
能否通过此反应测定有机物的羟基数目?
参考答案
化学性质
与氢卤酸反应
C2H5 OH+H Br
C2H5Br+H2O
溴乙烷
HH
乙醇可与氢卤酸发生作用,
H C—C—H 反应时乙醇分子里的羟基键断
参考:能。
让钠与醇反应,通过钠与醇 的物质的量作比较则可有结果。
启迪思考题
7、乙醇与氢卤酸的反应是什么类型反应?
参考:是个取代反应。可看作是卤素
原子取代了乙醇中的羟基(-OH)。
8、 若将乙醇、食盐、浓硫酸(1:1)混合加热时, 反应中硫酸的作用是什么?有关反应是什么?
选修五 乙醇 醇类 精品PPT课件

乙醇 醇类
河南省偃师高中 王真杰
物理性质
无色、有特殊香味的液体,易挥发、沸 点低(78℃),密度0.79g/cm3,能与水 以任意比互溶,能溶解多种有机物和无 机物,是一种良好的溶剂。
开动脑筋
1.下列用途体现了乙醇的哪些物理性质? ⑴用乙醇给发烧病人擦拭身体降温。 ⑵泡制药酒,治疗疾病。
2.如何检验乙醇中是否含水? 3.如何除去工业2、3步操
作4~5次后闻试 有刺激性气味
管中液体气味
Cu→CuO
CuO→Cu
?
化学性质
乙醇的催化氧化
2Cu+O2 2CuO
CuO+CH3CH2OH
Cu+CH3CHO+H2O
乙醛
2CH3CH2OH+O2 Cu 2CH3CHO+2H2O
乙醛
乙醇的催化氧化
断键部位
与钠的反应 置换反应
(D )
A、3:2:1 B、2:6:3 C、3:1:2 D、2:1:3
乙醇的氧化反应
燃烧 C2H6O+3O2 点燃 2CO2 +3H2O
化学性质 实 验 报 告
实验步骤 实验现象 原因或结论
1.取3~4mL无水 乙醇于试管中
2.将铜丝在酒精 铜丝颜色:
灯外焰上灼烧至 红→黑
红热
3.趁热将铜丝插 入乙醇中
(1)α-松油醇的分子式____C_1_0_H_1_8_1_8O_ 。
(2)α-松油醇能发生的反应类型是_____A__C____ 。
A.加成 B.水解 C.氧化
(3)写结构简式:β-松油醇
,
γ松油醇
。
化学性质 乙醇的分子间脱水
C2H5—OH+H—O—C2H5
河南省偃师高中 王真杰
物理性质
无色、有特殊香味的液体,易挥发、沸 点低(78℃),密度0.79g/cm3,能与水 以任意比互溶,能溶解多种有机物和无 机物,是一种良好的溶剂。
开动脑筋
1.下列用途体现了乙醇的哪些物理性质? ⑴用乙醇给发烧病人擦拭身体降温。 ⑵泡制药酒,治疗疾病。
2.如何检验乙醇中是否含水? 3.如何除去工业2、3步操
作4~5次后闻试 有刺激性气味
管中液体气味
Cu→CuO
CuO→Cu
?
化学性质
乙醇的催化氧化
2Cu+O2 2CuO
CuO+CH3CH2OH
Cu+CH3CHO+H2O
乙醛
2CH3CH2OH+O2 Cu 2CH3CHO+2H2O
乙醛
乙醇的催化氧化
断键部位
与钠的反应 置换反应
(D )
A、3:2:1 B、2:6:3 C、3:1:2 D、2:1:3
乙醇的氧化反应
燃烧 C2H6O+3O2 点燃 2CO2 +3H2O
化学性质 实 验 报 告
实验步骤 实验现象 原因或结论
1.取3~4mL无水 乙醇于试管中
2.将铜丝在酒精 铜丝颜色:
灯外焰上灼烧至 红→黑
红热
3.趁热将铜丝插 入乙醇中
(1)α-松油醇的分子式____C_1_0_H_1_8_1_8O_ 。
(2)α-松油醇能发生的反应类型是_____A__C____ 。
A.加成 B.水解 C.氧化
(3)写结构简式:β-松油醇
,
γ松油醇
。
化学性质 乙醇的分子间脱水
C2H5—OH+H—O—C2H5
人教课标版 乙醇、醇类PPT

小结
醇分子中,和羟基相连的碳原子上有二个或三
个氢原子,被氧化为醛。
若有一个氢原子,被氧化为酮。
若没有氢原子,一般不被氧化。
练习:对于分子式为C8H10O的有机物A,若满足下列
转化,则符合条件的A的结构式是____________。
写出下列转化的化学方程式(注明反应类型) A→B______________________
巩固训练
2、(2009· 全国理综卷2· 29)A、B、C、D、E、F、J、H、I、J 均为有机化合物。根据以下框图,回答问题
(1)B、C均为有支链的有机化合物,B的结构简式为_________ ,C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简 式为______________。
巩固训练
2、(2009· 全国理综卷2· 29)A、B、C、D、E、F、J、H、I、J 均为有机化合物。根据以下框图,回答问题
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的
结构简式为__________。
巩固训练
2、(2009· 全国理综卷2· 29)A、B、C、D、E、F、J、H、I、J均为有机化合 物。根据以下框图,回答问题
(3)⑤的化学方程式是________________________; ⑨的化学方程式是________________________;
巩固训练
2、(2009· 全国理综卷2· 29)A、B、C、D、E、F、J、H、I、J 均为有机化合物。根据以下框图,回答问题
取代反应 ;⑦的 (4)①的反应类型是水解反应 _______;④的反应类型是________ 反应类型是________ 氧化反应 。
醇的物理性质 易 溶于水; 1、在水中的溶解性:低级脂肪醇____ 小于 水的密度; 2、密度:一元脂肪醇的密度一般________ 3、沸点: ① 直链饱和一元醇的沸点随着分子中碳原子数的递 升高 ; 增而逐渐_______ ② 醇分子间存在氢键,所以相对分子质量相近的醇 大于 烷烃。 和烷烃相比,醇的沸点远_______
乙醇和醇类的化学性质 PPT1(2份) 人教课标版

•
13、认识到我们的所见所闻都是假象,认识到此生都是虚幻,我们才能真正认识到佛法的真相。钱多了会压死你,你承受得了吗?带,带不走,放,放不下。时时刻刻发悲心,饶益众生为他人。
•
14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。
•
15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
并稳定在170 0C左右 ? 3、实验时为什么烧瓶内物质会变黑? 4、实验过程中为什么要将气体先通过氢氧化钠溶液?
选修五51页实验3—1(乙醇的消去反应)
1、实验前为什么要向圆底烧瓶中加入碎瓷片?
防止爆沸
2、实验时为什么要使反应温度迅速升高到170 0C 并稳定在170 0C左右 ?
提高乙烯产量,减少副反应的发生
•
8、有些事,不可避免地发生,阴晴圆缺皆有规律,我们只能坦然地接受;有些事,只要你愿意努力,矢志不渝地付出,就能慢慢改变它的轨迹。
•
9、与其埋怨世界,不如改变自己。管好自己的心,做好自己的事,比什么都强。人生无完美,曲折亦风景。别把失去看得过重,放弃是另一种拥有;不要经常艳羡他人,人做到了,心悟到了,相信属于你的风景就在下一个拐弯处。
醇类的化学性质
第一课时 乙醇的化学性质
文昌中学化学组 周红兵
1
教学目标: 1、通过引导分析使学生掌握乙醇化学性质。 2、通过对乙醇化学性质的学习,让学生理解有机反应中 官能团、反应条件及化学键断裂和形成的重要性 3、通过乙醇让学生学会从羟基出发去分析醇类化学性质的方法 教学重点、难点: 1、重点:掌握醇类的化学性质即学会分析学习有机物的方法。 2、难点:对醇类催化氧化、消去反应的理解。
相关主题
