药品验收记录表格模板
药品验收记录表

药品购进检验验收记录(201)采购日期通用名称制造商规范批号有效期购买数量购买单位验收结论检验结论接受方药品购进检验验收记录(2014)购买日期通用名称制造商规范批号有效期购买单价供应商外观检验测试结论接受方1月2日清开灵注射液河北神威药业有限公司10mi * 5件131108a2 2016-10 1208.75元,云南铜丰普成县1月2日5%葡萄糖注射液昆明南强250i /瓶a131111a2 2015 -10 240 1.641元云南同峰无异常可接收普增县1月20日云南白药云南白药集团4G * 6瓶zca1307 2017-02 1 63.132元,云南同峰无异常,可接收普增县2015年1月20日1.508元,云南铜丰无异常可收集普增县1月20日,吉兹喜糖浆太极集团,200mi /瓶,2016-07-516.173元,云南铜凤无异常可采集普增县1月20日,阿莫西林片,昆明远瑞药业,0.25g * 24粒,2015-09-20 3.55元云南铜凤无异常可以接受普增县1月20日四环素片昆明振华药业0.25g * 100粒2015-08-104.29元云南通丰无异常可采集普增县1月20日醋酸泼尼松片重庆科瑞药业5mg * 1000片693004 2016-08-1 22.86元云南通峰没有异常可以接受普赞庚1月20日荣盛地塞米松钠注射液1mi:2mg2015-1020 1.05元,云南同丰没有异常可以收集普赞庚1月20日葡萄糖酸钙钙昆明玉石药10mi:1g * 5丸2015-11-101.49元云南普丰没有普赞gyen 1月20日注射用青霉素钠注射剂哈尔滨医药集团400万* 50片装a131**** ****-10100.68元nnan桐丰无异常可收集普赞庚恩1月20日小柴胡颗粒四川丰春药业云南神凤科仙注射液于2015年5月10日收到硫酸庆大霉素西南药业1mi * 40000 130606 2016-06-10 1.19元云南桐丰无异常可收集普增仙1月20日甲硝唑氯化钠昆明南强250mi / 1瓶a131111a2 2015-10 240 1.641元云南通丰普abnormal县1月20日5%葡萄糖注射液昆明南强250mi /瓶a131211c2 2016-11 2001.641普P县1月20日0.9%氯化钠昆明南强250mi / 1瓶a131210a1 2016-11 200 1.55元,云南铜丰无异常收费普增县药品采购检验验收记录(2014年)采购日期通用名称生产厂家说明书批号有效期采购数量采购单价供应商外观检验结论验收人3月5日清飞化痰丸昆明传统的中药厂6G * 10袋131244 2018-11 10 10.80云南桐峰无异常采集,普增县3月5日,安林巴比妥注射液西南药业公司2mi * 10片131002 2015-09-30 1.03云南桐峰无异常可采集普赞霉素3月5头孢他啶哈尔滨医药集团注射剂1g * 10片b131030 2015-09 300 2.80云南同丰无异常可接收普赞霉素3月5日头孢噻肟钠昆明吉大1g * 1片131219 2015-12 300 1.50元,云南同丰无异常可接收普赞gy 3月5日延胡宁海口七里80mg *注射用10瓶2015-12-500.87元,云南铜丰无异常可收集普赞gy 3月5日昆明吉大注射用头孢曲松钠1g * 10瓶140113 2016-07 3001.47元云南普feng无异常可收集普zengyen 3月5日注射用青霉素钠哈尔滨医药集团400万* 50片c1312012015-12 250 0.68元3月5日清开灵注射液河北神威药业有限公司10mi * 5丸2016-11年1208.75元,云南铜凤未见异常,普增县3月5日,昆明南强5%葡萄糖注射液250mi /瓶c131211,2016-11 200云南1.641元同峰无异常收集,3月5日,昆明市南强0.9%氯化钠250mi /瓶a131233a1 2016-11 200 1.55元,云南同峰无异常可收集普增县3月6日复方小ber碱片云南明净亨利30mg * 100粒2015-05-52.60元云南云南铜丰无异常可普增县3月6日维生素C片西南太极集0.1g * 100片130906 2015-08-100.87元云南云南铜丰无异常普增县3月6日采集阿普西林片西南维生素0.1g * 100粒昆明元瑞药业0.25g * 24粒2015-10 20 3.55元,云南铜丰无异常可采集普zen菌3月6日马来酸氯苯那敏片国药集团荣盛1000片/瓶2016-09-13.25元。
药品购进验收情况记录表
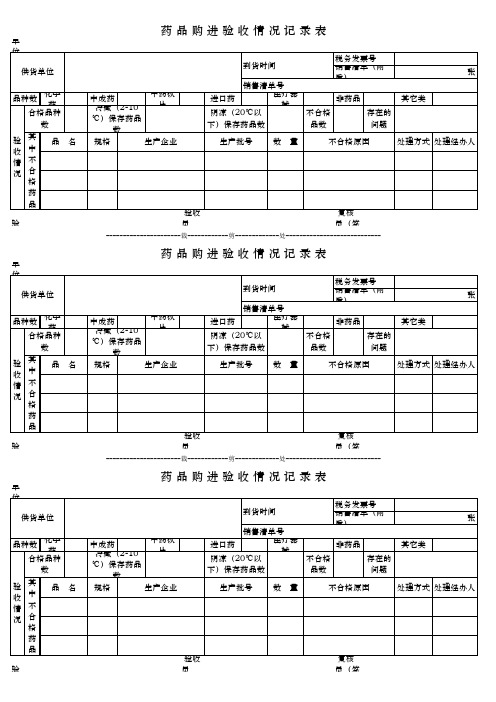
药品购进验收情况记录表
中成药 冷藏(2-10
中药饮 片
℃)保存药品
数
规格
生产企业
税务发票号
到货时间
销售清单(附 后)
张
销售清单号
进口药
医疗器 械
非药品
其它类
阴凉(20℃以
不合格
存在的
下)保存药品数
品数
问题
生产批号 数 量
不合格原因
处理方式 处理经办人
验收 员
复核 员(签
生产企业
税务发票号
到货时间
销售清单(附 后)
张
销售清单号
进口药
医疗器 械
非药品
其它类
阴凉(20℃以
不合格
存在的
下)保存药品数
品数
问题
生产批号 数 量
不合格原因
处理方式------------------裁------------剪-------------处----------------------------
药品购进验收情况记录表
中成药 冷藏(2-10
中药饮 片
℃)保存药品
数
规格
生产企业
税务发票号
到货时间
销售清单(附 后)
张
销售清单号
进口药
医疗器 械
非药品
其它类
阴凉(20℃以
不合格
存在的
下)保存药品数
品数
问题
生产批号 数 量
不合格原因
处理方式 处理经办人
验收 员
复核 员(签
----------------------裁------------剪-------------处----------------------------
药品购进验收记录

药品购进验收记录
单位名称(盖章):
说明:
1.药品购进验收记录必须真实完整。
购进验收记录必须注明药品的通用名称,剂型、规格、批号、有效期、生产厂商、购货单位、购货数量、购货价格、购货日期、验收结论、验收人员、验收日期及国务院药品监督管理部门规定的其他内容。
2.药品验收员必须对购进的药品逐批验收,作出合格或不合格的结论,并在记录上签名及验收日期。
3.药品购进验收记录应按月整理归档,保存至超过药品有效期一年,但不得少于五年。
西药库药品质量验收记录表

②外包装完整的有种药品,外包装不达要求的有种药品;
③有效期合理的有种药品,不合理的有种药品;
④冷藏药品温度达标的有种药品,不达标的有种药品;
⑤品种质量抽样检查合格的有种药品,不合格的有种药品;
⑥进口药品有种,是/不是(勾选)都有《进口药品注册证》、《进口药品检验报告书》复印件,并有印章;
西药库药品质量验收记录表
配送公司:
验收日期:20年月日
验收内容
(进货凭证、品名、规格、数量、批号、有效期、批准文号、供应单位、厂家、外包装情况检查是否合格;等)
本次配送公司送货共有种药品,已对每个品种的进行详细的质量验收,具体如下:
⑦进口血液制品有种,是/不是(勾选)都有《生物制品进口批件》复印件,并有印章;
其他:。
验收结论:验收合格种药品,退货种,包括(具体药名):
退货原因(勾选):①单据信息与实物不符;②外包装不合格;③有效期不合理;④温度不达标;⑤抽样检查质量不合格;⑥进口药品资料不全;⑦进口血液制品资料不全;⑧其他。
备注:
验收人:
药品购进验收记录
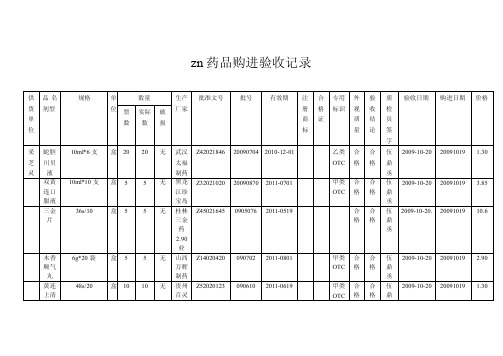
仁和
0.25g*24s/10 盒 20 20 无 长春 Z22023971 20090401 2012-0301
1
金开
药业
25mg*100s 瓶 20 20 无 大同 H14022743 090403 2011-0301 市利
群药
业
72g/10
瓶4
4 无 广州 Z44022627 NE1711 2013-0401 陈李
胶囊
制药
思密 达
3g10 袋/50 盒 2
2 无 天津 H20000690 U0239 2013-03-01 博福
益普
阿奇 0.25g*6s/10 盒 10 10 无 山西 H20093256 A090501 2011-04-01
霉素
云鹏
片
制药
龙胆 泻肝
6g*20 袋 盒 5
5 无 陕西 Z6102573 090504 2012-04-01 香菊
气务
公司
剂
氟轻 松软
10g/30
支5
5 无 马应 H42022579 090803 2011-07-01 龙药
膏
业
丞
合 合 伍 2009-10-31 2009-10-29 18.60 格格 鼎
丞 合 合 伍 2009-10-31 2009-10-29 2.10 格格 鼎
丞 合 合 伍 2009-10-31 2009-10-29 3.10 格格 鼎
200s/10
瓶5
5 无 白山 Z22020881 20090401 2012-0301 建宁
制药
35g/10
瓶 10 10 无 广州 Z44020403 090502 2011-0401 国一
药品验收记录表

药房验收药师必须掌握的技能:药品的接受、储存和保管!1、影响药品质量的因素。
环境因素。
日照。
阳光中的紫外线往往会对药物的变化起到催化作用,并能加速药物的氧化和分解。
空气。
空气中的氧气和二氧化碳会导致药物的氧化和变质。
湿度。
湿度过高,会使药品潮解、液化、变质或发霉;湿度太低,使得一些药物容易风化。
温度。
温度过高和过低都会导致药物变质,特别是当温度过高时。
时间。
有些药物在性质或效力上不稳定,即使在合适的储存条件下,也会在长时间内逐渐变质和失效。
因此,各国药典对药物的有效期都有不同的规定。
震击。
它可能改变人促红细胞生成素的二级结构,导致先前隐藏的抗原决定簇暴露或产生免疫原性结构,从而使促红细胞生成素具有抗原性。
人促红细胞生成素制剂容易刺激人体产生抗体,导致纯红细胞再生障碍性贫血(PRCA)。
应注意人促红细胞生成素:1静脉注射或皮下注射的循环、储存和使用。
2存放在阴凉的地方。
3不要振动。
人为因素。
(1)人员设置。
(2)药品质量监督管理,如规章制度的建立、实施和监督;(3)药学人员的贮存和维护技能、对药品质量的重视程度、责任心、身体状况和心理状态等。
药物因素。
水解是药物降解的主要方式,主要有酯类和酰胺类。
包括青霉素、头孢菌素等。
氧化也是药物变质最常见的反应:酚类(肾上腺素、吗啡等)、烯醇(维生素C)、芳胺类(磺胺嘧啶钠)、噻嗪(盐酸氯丙嗪)等。
2、药品质量验收。
药品的包装和说明书。
●药品内包装:清洁、无污染、干燥、密封严密、无泄漏、无破损。
●药品包装:坚固、耐压、防潮、防震。
●包装垫和缓冲材料应清洁、干燥、无虫。
●药品内部标签:应包括仿制名、适应症或适应症、规格、用法和用量、生产日期、产品批号、有效期、生产企业等。
●药品外标签:应当注明药品的通用名称、成分、性质、适应症或适应症、规格、用法和用量、不良反应、禁忌、注意事项、储存、生产日期、产品批号、有效期、批准文号、生产企业等。
●不能全部标明适应症或者适应症、用法、用量、不良反应、禁忌和注意事项的,应当标明主要内容,并注明“详见说明书”字样;●外包装还必须印有体积、重量、易碎性、小心搬运、向上、不倒置、防潮、防热、防冻等储运图形标识,危险药品包装标识。
药品经营质量管理记录表格完整打印版

药品经营质量管理记录表格完整打印版有效期生产厂商供货单位事故发生时间事故原因影响范围处理情况处理人签名备注药品零售企业的质量管理记录表格目录:一、药品采购记录表二、药品验收记录表三、药品陈列检查记录表四、药品养护记录表五、药品销售记录表六、中药饮片处方审核、调配核对记录表七、中药饮片清斗装斗记录表八、药品拆零销售记录表九、温湿度监测记录表十、药品质量投诉和质量事故处理记录表十一、药品不良反应报告记录表十二、不合格药品处理记录表十三、首营企业审核记录表十四、首营品种审核记录表药品采购记录表购货日期通用名称剂型规格生产厂商供货单位数量价格(中药)产地备注采购人主管负责人药品验收记录表到货日期通用名称剂型规格批准文号批号生产日期有效期生产厂商供货单位到货数量验收合格数量验收结果验收人主管负责人中药饮片验收记录表到货日期品名规格批号产地生产日期生产厂商供货单位到货数量批准文号验收合格数量验收结果验收人主管负责人药品陈列检查记录表检查日期通用名称剂型规格批号生产日期有效期生产厂商供货单位陈列数量检查合格数量检查结果陈列环境和药品摆放检查情况检查人主管负责人药品养护记录表养护日期通用名称剂型规格批号生产日期有效期生产厂商供货单位库存数量外观检查情况包装检查情况养护措施养护情况的总结分析养护人主管负责人药品销售记录表销售日期通用名称剂型规格批号生产日期有效期生产厂商购货单位经营地址联系方式销售数量单价金额记录人主管负责人中药饮片处方审核、调配核对记录表核对日期处方详情处方出具单位处方提供人员及联系方式处方审核情况审核药师签名调配情况调剂药师签名备注中药饮片清斗装斗记录表品名规格批号产地生产日期生产厂商供货单位斗内剩余数量清斗时间装斗数量装斗时间质量情况养护人主管负责人药品拆零销售记录表拆零日期通用名称剂型规格批号生产日期有效期生产厂商销售数量销售日期分拆情况复核人员签名温湿度监测记录表监测日期监测时间监测场所实时湿度实时温度异常情况处理监测人员签名备注药品质量投诉处理记录表投诉时间投诉单位基本信息投诉内容接收人处理签名时间情况核实处理结果处理人签名药品质量事故处理记录通用名称剂型规格批号生产日期有效期生产厂商供货单位事故发生时间事故原因影响范围处理情况处理人签名备注药品不良反应报告记录表通用名称:未填写剂型规格:未填写批号:未填写生产日期:未填写有效期:未填写生产厂商:未填写不良反应发生时间:未填写不良反应过程描述:未填写不良反应处理措施:未填写不良反应处理结果:未填写记录人:未填写签名:未填写不合格药品处理记录表通用名称:未填写剂型规格:未填写批号:未填写生产日期:未填写有效期:未填写生产厂商:未填写不合格原因:未填写发现时间:未填写处置措施:未填写处置时间:未填写处置结果:未填写记录人:未填写主管负责人:未填写日期:未填写首营企业审核记录表供货企业名称:未填写经营或生产地址:未填写统一社会信用代码:未填写药品经营或生产许可证号:未填写有效期限:未填写经营范围及方式:未填写代表品种质量状况:未填写相关印章及随货同行单的审核情况:未填写银行开户信息审核结果:未填写审核人:未填写主管负责人:未填写日期:未填写首营品种审核记录表品种通用名称:未填写剂型规格:未填写批准文号:未填写生产日期:未填写有效期:未填写批号:未填写以上记录表存在大量未填写的信息,无法提供有效的记录和参考。
药品验收记录表

药品验收记录表1、保存至超过药品有效期一年,但不得少于三年的情况总结(1)药品生产、经营企业采购药品时按规定留存的资料和销售凭证;(2)药品批发和零售连锁企业购进记录;(3)药品批发和零售连锁企业销售记录;(4)药品批发企业的验收记录;(5)药品批发企业质量跟踪记录;(6)药品批发、零售连锁企业的复核记录(7)医疗机构药品购进记录;(8)医疗机构药品验收记录必须保存至超过药品有效期1年,但不得少于3年。
2、保存至超过药品有效期一年,但不得少于二年的情况总结(1)药品零售购进票据和购进记录;(注意和批发、零售连锁区分开)(2)药品零售连锁门店所接收的送货凭证。
(2)疾病预防控制机构、接种单位购进疫苗时的证明文件:超过疫苗有效期两年(3)疫苗生产企业、疫苗批发企业的购销记录:超过疫苗有效期两年(18条)(4)疾病预防控制机构的购进、分发、供应记录:超过疫苗有效期两年(18条)3、一年事项(1)托运或自行运输麻醉、一类精神药申领的运输证明:有效期1年(2)医疗机构制剂使用过程中发现不良反应,保留的病历和有关检验、检查报告单等原始记录至少一年备查。
(3)《基本医疗保险药品目录》新药增补工作每年进行一次。
(4)《中国药典》增补本,原则上每年一版。
(5)社会保险经办机构与定点零售药店签订的协议有效期一般为1年。
4、两年事项(1)医疗机构有关配制制剂的记录和质量检验记录应完整归档,至少保存2年备查。
(2)《基本医疗保险药品目录》每两年调整一次。
(3)定点批发企业的条件:单位及工作人员2年内没有违反有关禁毒的法律、行政法规的行为(4)《药品广告审查表》原件保存2年。
5、三年事项(1)退货记录保存3年。
(2)医疗机构根据麻醉药品和精神药品处方开具情况,按品种、规格对其消耗量进行专册登记,登记内容包括发药日期、患者姓名、用药数量。
专册保存期限为3年。
(3)国家基本药物目录原则上每3年调整一次(4)医疗机构购进药品索取、留存供货单位的合法票据,保存期不得少于3年。
