溶解平衡图像
溶解平衡图像(20190417104740)

某温度时, Ag2SO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是A.含有大量 SO42-的溶液中肯定不存在 Ag+B.0.02mol/L 的 AgNO3溶液与 0.2mol/L 的 Na2SO4溶液等体积混合不会生成沉淀C.Ag2SO4的溶度积常数( Ksp)为 1×10- 3 D.a 点表示 Ag2SO4的不饱和溶液,蒸发可以使溶液由 a 点变到 b 点某温度时, Ag2SO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是A.含有大量 SO42-的溶液中肯定不存在 Ag+【Ag+是一定存在的,只是量的多少而已,排除A】B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀【假设不沉淀,则 c(Ag+)×c( Ag+)×c( SO4^(2-) )=0.01 ×0.01 ×0.1 =0.00001 】根据图像可判定 Ksp=【图像不清晰,可依据图像求出】【如果横纵坐标的数量级均为10- 2 次方,则 Ksp= 0.00002 】【然后依据 Ksp 与上面求出的浓度积比较,不出现沉淀】C.Ag2SO4的溶度积常数( Ksp)为 1×10- 3【Ksp=c(Ag+)× c( Ag+)× c( SO4^(2-) )= 0.00002 ,排除 C】D.a 点表示 Ag2SO4的不饱和溶液,蒸发可以使溶液由 a 点变到 b 点【蒸发的过程中,Ag+和硫酸根离子浓度均将增大,因而不会水平变化,排除D】【考点】沉淀溶解平衡 , 沉淀溶解平衡常数的概念 , 浓度的定义 , 图像信息的提取【分析】 A 选项考查学生对沉淀的理解是否准确 ;B 选项可以直接利用图像得出结论 ;D 选项要求学生理解浓度的概念和影响因素 , 并隐含考查了用图像表达实验结果的能力 , 可以拓展问学生如果出 a 点蒸发溶液成分变化趋势在图中如何反映出来 . 本题得分率很不理想 ,可见学生对于沉淀溶解平衡的方程式以及溶度积常数的表达式很不熟悉, 这个要求是必须要达到的 , 是化学平衡常数的直接迁移应用.C[ 相应知识点归纳 ]⑴.在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线外的点⑵.溶液在蒸发时,离子浓度的变化分两种情况:ⅰ、原溶液不饱和时,离子浓度要增大都增大;ⅱ、原溶液饱和时,离子浓度都不变。
高中化学第3章水溶液中的离子反应与平衡微专题7难溶电解质沉淀溶解平衡图像分析新人教版选择性必修1

3.如图所示,有两条T1、T2两种温度下的BaSO4在水中的沉淀溶解 平衡曲线,下列说法不正确的是( D )
A.加入Na2SO4固体可使溶液由a点变到b点 B . T1 温 度 下 , 在 T1 曲 线 上 方 区 域 ( 不 含 曲 线 ) 任 意 一 点 时 , 均 有 BaSO4沉淀生成 C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含 a、b) D.升温可使溶液由b点变为d点
A.L1线代表AgCl的沉淀溶解平衡曲线 B.a1、b两点所示溶液中c(Ag+):b>a1 C.若将上述K2CrO4溶液的浓度改为0.05 mol·L-1,则b点会移动到 c点
D.将a1与b点溶液混合,无Ag2CrO4固体析出
2.常温下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的FeCl2 和MnCl2溶液中滴加0.1 mol·L-1的K2S溶液,滴加过程中溶液-lg c(Fe2 +)和-lg c(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知: Ksp(MnS)>Ksp(FeS),lg 3≈0.5,忽略溶液混合时温度和体积的变化],下 列说法错误的是( A )
2.c(Mn+)—pH图像 Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):图中曲线为相应 金属阳离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化 物的Ksp的大小以及离子分离方法的选择。
跟|踪|训|练 1.(2024·青岛高二检测)一定温度下,AgCl(s) Ag(aq)+Cl-(aq)体系 中,c(Ag+)和 c(Cl-)的关系如图所示。下列说法不正确的是( D )
(4)相同实验条件下,沉淀相同物质的量的Cl-和Br-消耗的AgNO3 的物质的量相同,由于Ksp(AgBr)<Ksp(AgCl),当滴加相同物质的量的 Ag+时,溶液中c(Br-)<c(Cl-),故反应终点c向b方向移动。
溶解平衡图像

沉淀溶解平衡曲线沉淀溶解平衡图像题的解题策略1.沉淀溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液;2.从图像中找到数据,根据K sp公式计算得出K sp的值;3.比较溶液的Q c与K sp的大小,判断溶液中有无沉淀析出;4.涉及Q c的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积;1.在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示;又知t℃时AgCl的K sp=4×10-10,下列说法不正确的是A.在t℃时,AgBr的K sp为×10-13B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点C.图中a点对应的是AgBr的不饱和溶液D.在t℃时,AgCls+Br-aq AgBrs+Cl-aq的平衡常数K≈816答案 B解析根据图中c点的cAg+和cBr-可得该温度下AgBr的K sp为×10-13,A正确;在AgBr饱和溶液中加入NaBr固体后,cBr-增大,溶解平衡逆向移动,cAg+减小,故B错;在a点时Q c<K sp,故为AgBr的不饱和溶液,C正确;选项D 中K=cCl-/cBr-=K sp AgCl/K sp AgBr,代入数据得K≈816,D正确;2.已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入·L-1Na2SO4溶液,下列叙述正确的是A.溶液中析出CaSO4固体沉淀,最终溶液中cSO错误!比原来的大B.溶液中无沉淀析出,溶液中cCa2+、cSO错误!都变小C.溶液中析出CaSO4固体沉淀,溶液中cCa2+、cSO错误!都变小D.溶液中无沉淀析出,但最终溶液中cSO错误!比原来的大答案 D解析由图像可知K sp CaSO4=×10-6,当加入·L-1Na2SO4溶液时,此时cCa2+=错误!=6×10-4mol·L-1,cSO错误!=错误!=×10-3mol·L-1,Q c=×10-6<K sp CaSO4,所以溶液中无沉淀析出,但最终溶液中cSO错误!比原来大;3.2013·江苏,14一定温度下,三种碳酸盐MCO3M:Mg2+、Ca2+、Mn2+的沉淀溶解平衡曲线如图所示;已知:pM=-lgcM,pCO错误!=-lgcCO错误!;下列说法正确的是A.MgCO3、CaCO3、MnCO3的K sp依次增大B.a点可表示MnCO3的饱和溶液,且cMn2+=cCO错误!C.b点可表示CaCO3的饱和溶液,且cCa2+<cCO错误!D.c点可表示MgCO3的不饱和溶液,且cMg2+<cCO错误!答案BD解析结合沉淀溶解平衡曲线及溶度积常数进行分析;碳酸盐MCO3的溶度积可表示为K sp MCO3=cM2+·cCO错误!,由图像可知,MgCO3、CaCO3、MnCO3的pM为一定值时,其pCO错误!逐渐增大,由溶度积表达式可知三种物质的K sp逐渐减小,A错;a点在MnCO3的沉淀溶解平衡曲线上,为其饱和溶液,结合MnCO3图中曲线可知,cCO错误!=cMn2+,B对;b点在CaCO3的沉淀溶解平衡曲线上,为其饱和溶液,结合CaCO3图中曲线可知,cCO错误!<cCa2+,C错;c点在MgCO3的沉淀溶解平衡曲线的上方,为其不饱和溶液,溶液中cCO错误!>cMg2+,D正确;4.一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子M2+形成硫化物沉淀所需S2-最低浓度的对数值lgcS2-与lgcM2+的关系如图所示;下列有关判断不正确的是A. 该温度下,KspMnS大于×10-35B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀C. 向cFe2+=·L-1的溶液中加入CuS粉末,有FeS沉淀析出D. 该温度下,溶解度:CuS>MnS>FeS>ZnS答案D粉末后cFe2+×cS2-大于10-20,所以有FeS沉淀析出,C正确;D、依据此图可知,CuS的Ksp最小,其次是MnS、FeS 和ZnS,所以该温度下,溶解度:CuS<MnS<FeS<ZnS,D错误,答案选D;5.2014·新课标全国卷Ⅰ,11溴酸银AgBrO3溶解度随温度变化曲线如下图所示;下列说法错误的是A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速度加快C.60℃时溴酸银的K sp约等于6×10-4D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯答案 A解析A项,由题图可知,随着温度升高,溴酸银的溶解度逐渐增大,因此AgBrO3的溶解是吸热过程;B项,由图像曲线可知,温度升高斜率增大,因此AgBrO3的溶解速度加快;C项,由溶解度曲线可知,60℃时,AgBrO3的溶解度约为0.6g,则其物质的量浓度约为·L-1,AgBrO3的K sp=cAg+·cBrO错误!=×≈6×10-4;D项,若KNO3中含有少量AgBrO3,可通过蒸发浓缩得到KNO3的饱和溶液,再冷却结晶获得KNO3晶体,而AgBrO3留在母液中;6.25℃时,PbCl2固体在不同浓度盐酸中的溶解度曲线如图;在制备PbCl2的实验中,洗涤PbCl2固体最好选用A.蒸馏水B.·L-1盐酸C.·L-1盐酸D.·L-1盐酸答案 B解析观察题图知,PbCl2固体在浓度为·L-1的盐酸中溶解度最小;7.已知:pAg=-lgcAg+,K sp AgCl=1×10-12;如图是向10mLAgNO3溶液中逐渐加入·L-1的NaCl溶液时,溶液的pAg 随着加入NaCl溶液的体积变化的图像实线;根据图像所得下列结论正确的是提示:K sp AgCl>K sp AgIA.原AgNO3溶液的物质的量浓度为·L-1B.图中x点的坐标为100,6C.图中x点表示溶液中Ag+被恰好完全沉淀D.把·L-1的NaCl换成·L-1NaI则图像在终点后变为虚线部分答案 B解析A项,加入NaCl之前,pAg=0,所以cAgNO3=1mol·L-1,错误;B项,由于cAg+=10-6mol·L-1,所以Ag+沉淀完全,nNaCl=nAgNO3=0.01L×1mol·L-1=,所以VNaCl=100mL,B正确,C错误;若把NaCl换成NaI,由于K sp AgI 更小,所以cAg+更小,pAg更大,D错误;8.衡阳市2017年十校高考调研冲刺预测卷五如图是CaOH2在温度分别为T1、T2时的沉淀溶解平衡曲线图中浓度单位为mol·L-1,温度为T1时CaOH2的Ksp = 4×10-6, ≈;下列说法正确的是A. 温度: T l<T2B. 温度为T1时,P点分散系中分散质粒子直径均小于1nmC. Q点的溶液中cOH-约为D. 加水稀释时溶液碱性减弱,Z点溶液可转化为Q点溶液答案C解析A、氢氧化钙溶解度是随着温度的升高而降低,根据图像,因此T1>T2,故A错误;B、P点属于过饱和溶液,即悬浊液,因此分散质粒子直径大于100nm,故B错误;C、根据K sp=cCa2+×c2OH-,4×10-6=4a×2a2,解得a=×10-3,因此cOH-=2××10-3mol·L-1=·L-1,故C正确;D、加水稀释,cCa2+和cOH-都减小,故D错误;9.2017新课标3卷在湿法炼锌的电解循环溶液中,较高浓度的Cl 会腐蚀阳极板而增大电解能耗;可向溶液中同时加入Cu 和CuSO 4,生成CuCl 沉淀从而除去Cl -;根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 A .SP (CuCl)K 的数量级为710- B .除Cl -反应为Cu+Cu 2++2Cl -=2CuCl C .加入Cu 越多,Cu +浓度越高,除Cl -效果越好 D .2Cu +=Cu 2++Cu 平衡常数很大,反应趋于完全 答案C 解析K sp CuCl=cCu +·cCl -,在横坐标-1(Cl )lg mol L c --⋅为1时,纵坐标-1(Cu )lg mol L c +⋅大于-6,小于-5,所以K sp CuCl 的数量级是10-7,A 正确;除去Cl -反应应该是Cu+Cu 2++2Cl -=2CuCl,B 正确;溶液中存在平衡:Cu ++Cl -CuCl 、2Cu +Cu 2++Cu,加入纯固态物质Cu 对平衡无影响,故C 错误;D .在没有Cl -存在的情况下,反应2Cu +Cu 2++Cu 的平衡常数约为2 6.77.927.32(Cu )1010(Cu )(10)c c +-+-==,平衡常数 很大,反应趋于完全,D 正确;10.金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的;难溶金属的氢氧化物在不同pH 下的溶解度S/mol·L -1如下图所示;1pH =3时溶液中铜元素的主要存在形式是________写化学式;2若要除去CuCl 2溶液中的少量Fe 3+,应该控制溶液的pH 为______填字母; A .<1 B .4左右 C .>63在NiNO 32溶液中含有少量的Co 2+杂质,______填“能”或“不能”通过调节溶液pH 的方法来除去,理由是______________________________________________;4已知一些难溶物的溶度积常数如下表:物质 FeS MnS CuS PbS HgS ZnS K sp×10-18×10-13×10-36×10-28×10-53×10-24某工业废水中含有Cu 2+、2+2+;A.NaOHB.FeSC.Na2S答案1Cu2+2B 3不能Co2+和Ni2+沉淀的pH范围相差太小4B解析1由图可知,在pH=3时,溶液中不会出现CuOH2沉淀;2要除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右;3从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,操作时无法控制溶液的pH;4要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不会引入其他离子;。
第章沉淀溶解平衡-PPT精选

2020/6/1
2020/6/1
例题:求 25℃时, Ag2CrO4在 0.010 mol·L-1
K2CrO4溶液中的溶解度。
A2C g r4(Os ) 2A(gaq C ) r2 4O (aq
初浓 始/度 (mLo 1)l
0
0.010
平浓 衡/度 (mLo 1)l
2x 0.010x
(2x)2 (0.010x) Ksp 1.11012
H2O
2020/6/1
2020/6/1
2020/6/1
2020/6/1
2020/6/1
2020/6/1
例2 25oC,已知Ksp(Ag2CrO4)1.11012,求同温下
S(Ag2CrO4)/(gL1)
Ag2CrO4(s) 2Ag(aq)CrO24(aq)
平衡浓/(度 molL1)
2x
0.00100 1.325
0.00500 0.0100 1.385 1.427
盐效应:在难溶电解质溶液中,加入易溶强电 解质而使难溶电解质的溶解度增大的作用。
c(Na2SO4)/ molL-1
0 0.001 0.01 0.02 0.04 0.100 0. 200
S(PbSO4)/ mmolL-1
0.15
第六章 沉淀—溶解平衡
§ 6.1 溶解度和溶度积 § 6.2 沉淀的生成与溶解 § 6.3 两种沉淀之间的平衡
§ 6.1 溶解度和溶度积
6.1.1 溶解度 6.1.2 溶度积 6.1.3 溶解度和溶度积的关系
2020/6/1
2020/6/1
溶度积 在一定温度下,将难溶电解质晶体放 入水中时,就发生溶解和沉淀两个过程。
平衡浓 /(m 度oLl1)
专题14 沉淀溶解平衡的图像

第 1 页 共 4 页 专题 沉淀溶解平衡的图像分析与解题思路【常见图像与解题思路】1、溶解度曲线图1、溴酸银(AgBrO 3)溶解度随温度变化曲线如下图所示。
下列说法错误..的是( )A .溴酸银的溶解是放热过程B .温度升高时溴酸银溶解速度加快C .60 ℃时溴酸银的K sp 约等于6×10-4 D .若硝酸钾中含有少量溴酸银,可用重结晶方法提纯2、双曲线 (1)阳离子~阴离子单曲线图:横、纵坐标分别为阳离子或阴离子AgCl 曲线图曲线可知信息①曲线上各点的意义:曲线上任一点(c 点)都表示饱和溶液,曲线上方的任一点(b 点)均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点(a 点)均表示不饱和溶液②计算K sp :由c 点可以计算出K sp③a 点若蒸发达到曲线上,只能沿着a ―→d 斜向上的方向,因为蒸发去水,阴阳离子浓度均变大了【对点训练2】第 2 页 共 4 页1、在T ℃时,铬酸银(Ag 2CrO 4)在水溶液中的沉淀溶解平衡曲线如图所示。
下列说法中不正确的是( )A .T ℃时,在Y 点和Z 点,Ag 2CrO 4的K sp 相等B .向饱和Ag 2CrO 4溶液中加入固体K 2CrO 4不能使溶液由Y 点变为X 点C .T ℃时,Ag 2CrO 4的K sp 为1×10-8D .图中a =2×10-4(2)阴阳离子浓度~温度双曲线图:横、纵坐标分别为阳离子或阴离子,两条曲线为不同温度 BaSO 4 曲线可知信息 ①曲线上各点的意义:每条曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液T 1曲线:a 、b 点都表示饱和溶液,c 点表示过饱和溶液T 2曲线:a 、b 点都表示不饱和溶液,c 点表示不饱和溶液②计算K sp :由a 或b 点可以计算出T 1温度下的K sp③比较T 1和T 2大小:因沉淀溶解平衡大部分为吸热,可知:T 1<T 2【对点训练3】1、已知溴酸银的溶解是吸热过程,在不同温度条件下,溴酸银的溶解平衡曲线如图所示,下列说法正确的是( )A .T 1>T 2 B .加入AgNO 3固体,可从a 点变到c 点C .a 点和b 点的K sp 相等D .c 点时,在T 1、T 2两个温度条件下均有固体析出3、对数曲线①当坐标表示浓度的对数时,要注意离子浓度的换算,如lg c (X)=a ,则c (X)=10a②当坐标表示浓度的负对数(-lgX =pX)时,pX 越大,c (X)越小,c (X)=10-pX (1)正对数[lg c (M +)~lg c (R -)]曲线:横、纵坐标分别为阳离子或阴离子的正对数第 3 页 共 4 页 CuS 、ZnS 曲线可知信息①曲线上各点的意义:每条曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液ZnS 曲线:a 点表示饱和溶液,c 点表示不饱和溶液CuS 曲线:b 点都表示不饱和溶液,c 点表示过饱和溶液②计算K sp :由曲线上面给定数据可以计算CuS 、ZnS 的K sp③比较K sp 大小:K sp (ZnS)>K sp (CuS)【对点训练4】1、硫酸锶(SrSO 4)可用于烟火和陶瓷工业,该物质是矿物天青石的主要成分,可由Na 2SO 4溶液加入锶盐溶液沉淀而得。
高一化学沉淀溶解平衡(PPT)4-1

Q c称为离子积,其表达式中离子浓度是任意的,为 此瞬间溶液中的实际浓度,所以其数值不定,但对一 难溶电解质,在一定温度下,Ksp 为一定值。
②溶度积规则
(1) Q c >Ksp 时,沉淀从溶液中析出(溶液过饱和), 体系中不断析出沉淀,直至达到平衡(此时Q c =Ksp ) (2) Q c =Ksp 时,沉淀与饱和溶液的平衡 (3) Q c <Ksp 时,溶液不饱和,若体系中有沉淀, 则沉淀会溶解直至达到平衡(此时Q c =Ksp )
糖均显著降低。韩春然等用纤维素酶和蛋白酶从黑木耳中提取多糖并研究其降血糖功能,结果发现,当给药剂量在mg/kg以上时,黑木耳多糖能明显降低糖 尿病小鼠的血糖值,但对正常小鼠的血糖值没有影响,说明黑木耳多糖对糖尿病有良好的
(4)溶度积规则
①离子积
AnBm(s)
nAm+(aq) + mBn-(aq)
Q c= [Am+]n[Bn-]m
小鼠注射黑木耳多糖,一周后小鼠血清中的胆固醇含量明显降低。周国华等采用不同浓度黑木耳多糖对高脂模型小鼠进行试验,结果表明,黑木耳多糖组小 鼠的血清甘油三酯、总胆固醇和低密度脂蛋白均不同程度地低于对照组,而高密度脂蛋白却显著高于对照组,说明黑木耳多糖有降血脂作用。 [] 降血糖作用 宗灿华等对黑木耳多糖降低糖尿病小鼠的血糖作用进行了试验分析, 黑木耳 黑木耳 结果表明,与模型对照组比较,给药天后,黑木耳多糖各剂量组小鼠血
nAm+(aq) + mBn-(aq)
则Ksp, AnBm= [Am+]n . [Bn-]m
练习:BaSO4、Ag2CrO4、Mg(OH)2、Fe(OH)3的溶度积
瘤作用。将黑木耳多糖以腹腔注射给药可抑制小鼠实体瘤S8的生长,静脉注射给药对抑制Lewis肺瘤、B黑素瘤和H肝癌变有效,最适有效剂量为μg/kg。宗灿 华等试验研究发现,黑木耳多糖可增高H小鼠血清NO含量,促进肿瘤细胞凋亡。 [] 抗衰老作用 黑木耳多糖对机体损伤有保护作用,可延缓组织衰老,被认 为是较理想的抗衰老保; 作文网 / 作文网 ;吴宪瑞等报道,黑木耳多糖能显著增强果蝇的飞翔能力、小鼠游泳耐力,能使小鼠心肌 组织脂褐质含量明显下降,并提高小鼠脑和肝中SOD的活力。周慧萍等报道,黑木耳多糖能延长果蝇寿命,增加老年小鼠对有害刺激的非特异性抵抗力,降 低动物血浆中过氧化脂质含量,减少脂褐素的生成。 [] 抗辐射作用 陈志强等给小鼠腹腔注射木耳多糖mg/只,连续7天,以Coγ射线照射,总剂量达8伦琴, 结果表明,小鼠存活时间比对照组长天,存活率是其.倍,表明黑木耳多糖对放射性细胞损伤有保护作用。樊黎生等研究发现,采用中、高剂量黑木耳多糖溶 液对小鼠进行灌胃,经.GyCoγ射线照射,小鼠的骨髓微核率和精子畸变率明显降低,存活率提高,存活时间延长,表明黑木耳多糖具有较好的抗辐射作用。 [] 抗凝血作用 黑木耳多糖有抑制血小板凝集的作用,其机制主要是抑制凝血酶的活性。国内有研究表明,体外试验以μmol/L多糖液.mL与兔血.mL混合,凝 血时间可延长倍。给小鼠分组静脉注射、腹腔注射和灌胃mg/kg,凝血时间较对照组分别延长.、.和.倍。 [] 降血脂作用 有研究报道,以每天mg/kg黑木耳多 糖对高脂血症小鼠连续给药周,经测定,可明显降低小鼠血清总胆固醇含量和动脉粥样硬化指数,并提高血清和肝脏抗氧化能力。蔡小玲等每天为高脂血症2. Nhomakorabea溶度积常数
第45讲-沉淀溶解平衡图像及分析

∶
sp [Cu (OH )2 ]
2 (OH - )
=Ksp[Fe(OH)2]∶Ksp[Cu(OH)2]
=104.6∶1,C正确;X点转化为Y点时,c(Cu2+)不变,c(OH-)增大,但当加入少量
NaOH固体后,c(OH-)增大,Cu(OH)2的沉淀溶解平衡向逆反应方向移
动,c(Cu2+)减小,故X点不能转化为Y点,D错误。
图像
分析
横坐标数值越大,c(CO23 )越小
纵坐标数值越大,c(M)越小
线上方的点为相应物质的不饱和溶液
线下方的点表示有相应物质的沉淀生成
pM=-lg c(M)
线上的点为相应物质的饱和溶液
(M:Mg2+、Ca2+、Mn2+),
2pc(CO2)=-lg
c(CO
3
3 )
根据线上任意一点的坐标,可计算相应物质的 Ksp
考向2 沉淀滴定曲线及分析
例2.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4
溶液,所得的沉淀溶解平衡图像如图所示(不考
2-
虑 C2O4 的水解)。下列叙述正确的是(
)
A.Ksp(Ag2C2O4)的数量级等于10-7
B.N点表示AgCl的不饱和溶液
C.向 c(Cl-)=c(C2O24 )的混合液中滴入
AgNO3 溶液时,先生成 Ag2C2O4 沉淀
D.Ag2C2O4+2Cl-
9.04
2AgCl+C2O2的平衡常数为
10
4
答案 D
2-
解析 由图可知,当 c(C2O4 )=10-2.46 mol·L-1 时,c(Ag+)=10-4 mol·L-1,
人教化学选修4第三章 第四节 难溶电解质的溶解平衡(共24张PPT)

Cr(OH)3(s)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32, 要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至 ____5______
讨论2:(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-, 利用Ag+与CrO42- 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀 (浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为__________ mol·L2.-01,×此10时-5 溶液中 c(CrO42- )等于__________ 5m.0o×l·L1-01。-3 (已知Ag2 CrO4、AgCl的Ksp分别为2.0×10-12和 2.0×10-10)。
溶解 沉淀
溶液中的溶质
v溶解 < v沉淀,析出晶体
下列方程式①AgCl(s) Ag+(aq)+Cl-(aq)、②AgCl===Ag++Cl-、
③CH3COOH CH3COO-+H+各表示什么意义?
①表示 AgCl 的沉淀溶解平衡;②表示 AgCl 为强电解质,溶于水的
AgCl 完全电离;③表示弱电解质 CH3COOH 的电离平衡。
B.AgCl> Ag2CrO4>AgI D.Ag2CrO4>AgI>AgCl 重难点探究三
讨论2:已知25℃时,AgCl的溶解度是1.92×10-3g/L,求它的溶度积。已知AgCl 的摩尔质量为143.5g/mol。
解 :依题意可知25℃时AgCl饱和溶液中
c(Ag+)=c(Cl-)=0.00192/143.5mol/L
第八章 第8讲 沉淀溶解平衡图像-2025年高中化学高考备考
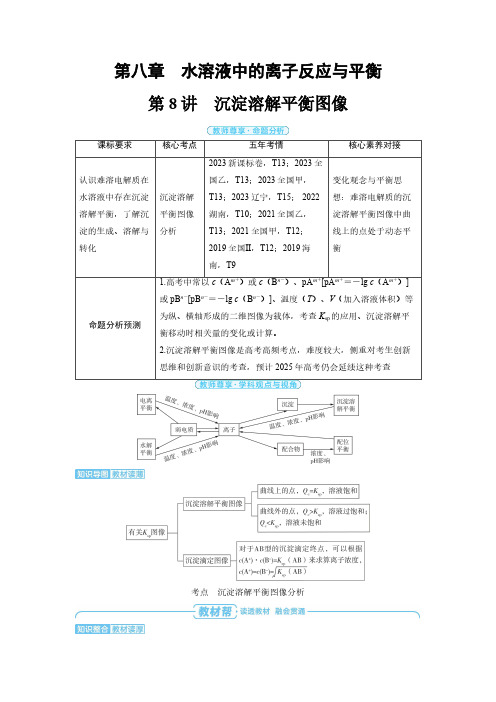
第八章水溶液中的离子反应与平衡第8讲沉淀溶解平衡图像课标要求核心考点五年考情核心素养对接认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化沉淀溶解平衡图像分析2023新课标卷,T13;2023全国乙,T13;2023全国甲,T13;2023辽宁,T15;2022湖南,T10;2021全国乙,T13;2021全国甲,T12;2019全国Ⅱ,T12;2019海南,T9变化观念与平衡思想:难溶电解质的沉淀溶解平衡图像中曲线上的点处于动态平衡命题分析预测1.高考中常以c (A m +)或c (B n -)、pA m +[pA m +=-lg c (A m +)]或pB n -[pB n -=-lg c (B n -)]、温度(T )、V (加入溶液体积)等为纵、横轴形成的二维图像为载体,考查K sp 的应用、沉淀溶解平衡移动时相关量的变化或计算。
2.沉淀溶解平衡图像是高考高频考点,难度较大,侧重对考生创新思维和创新意识的考查,预计2025年高考仍会延续这种考查考点沉淀溶解平衡图像分析1.沉淀溶解平衡浓度图像模型图像分析BaSO 4的沉淀溶解平衡图像(1)求K sp或K sp的数量级:A点,c(Ba2+)=c(S O42-)=10-5 mol·L-1,K sp(BaSO4)=[1]10-10。
(2)曲线上任意一点都达到了沉淀溶解平衡状态,Q c[2]=K sp。
温度不变时,K sp不变,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
曲线上方区域的点所示溶液均为[3]过饱和溶液,Q c[4]>K sp。
曲线下方区域的点所示溶液均为[5]不饱和溶液,Q c[6]<K sp2.沉淀溶解平衡对数图像模型图像分析CaSO4与CaCO3的沉淀溶解平衡图像注:pM=pCa2+=-lg c(Ca2+),pR=pS O42-(或pC O32-)=-lg c(S O42-)[或-lg c(C O32-)](1)曲线上任意一点都达到了沉淀溶解平衡状态。
第3章 微专题13 常见的溶解平衡图像类型总结

微专题13常见的溶解平衡图像类型总结类型1c(M n+)、c(A n-)型图像如图为BaSO4沉淀溶解平衡曲线(温度一定):(1)曲线上的任意一点均为达到溶解平衡的平衡点,可利用曲线上点的坐标来计算K sp(BaSO4)。
(2)曲线上方的点溶液过饱和,c(Ba2+)·c(SO2-4)>K sp(BaSO4),有沉淀生成。
(3)曲线下方的点为不饱和溶液,c(Ba2+)·c(SO2-4)<K sp(BaSO4),无沉淀生成,加入BaSO4可继续溶解。
类型2S—pH或c(M n+)—pH图像Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):图中曲线为相应金属离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化物的K sp 的大小以及离子分离方法的选择。
类型3离子浓度负对数(pX)—溶液体积(V)图0.1 mol·L-1 AgNO3溶液滴定20.00 mL含有Cl-、Br-、I-且浓度均为0.1 mol·L-1的混合溶液,绘得滴定曲线如图:(1)图中曲线的起始部分,滴入c(Ag+)不足,c(X-)变化较小,在恰好反应时出现突跃,突跃后的三条曲线为相应AgX的沉淀溶解平衡曲线。
(2)若已知a、b、c所代表的卤素离子的曲线,则可比较相应AgX的K sp大小或利用K sp的大小分析a、b、c分别代表哪种卤素离子的曲线。
类型4离子浓度对数或负对数曲线难溶电解质溶液中离子浓度都很小,为研究方便,常取离子浓度的对数或负对数。
如果横、纵坐标是离子浓度的对数或负对数,则二者的关系应是一条直线。
例如在一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。
已知:pM=-lg c(M),p(CO2-3)=-lg c(CO2-3)图中曲线为相应碳酸盐的沉淀溶解平衡曲线,因此可对比不同碳酸盐K sp的大小,对比线外点对不同碳酸盐来说是过饱和溶液还是不饱和溶液,以及判断相应金属离子与碳酸根离子浓度的大小。
第四节沉淀溶解平衡PPT优选课件

练2:25℃时, Ksp (Mg(OH)2)= 5.6×10-12mol3•L-3求Mg(OH)2 的饱和溶液中的c(Mg2+)和c(OH-)
C(Mg2+)=1.12×10-4mol/L,c(OH-)=2.24×10-4mol/L
相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶。
第四节 难溶电解质的溶解平衡
第一课时
2020/10/18
1
高考考试要求
1通过实例了解难溶电解质的溶 解平衡及溶度积表达式。 2 利用难溶电解质的相互转化应 用于生产和生活实际。
2020/10/18
2
一、 难溶电解质的溶解平衡
1、沉淀溶解平衡:
(1)概念:在一定条件下,当难溶电解质的溶解速率 与溶液中的有关离子重新生成沉淀的速率相等时,此 时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀 溶解平衡.溶解平衡时的溶液是饱和溶液。讲义P109 3D
如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
溶202解0/10度/18:S(AgCl) > S (AgBr) > S(AgI)
6
表示溶解能力的两个量—— 溶解度和浓度及其换算
2020/10/18
7
(2).溶度积Ksp与难溶电解质的溶解度的有关换算 练习1:25℃时Ksp (Mg(OH)2)= 5.6×10-12mol3•L-3 求Mg(OH)2 的饱和溶液中的溶解度.
AgBr(s) AgI(s)
Ag+ (aq) + Br- (aq) Ag+ (aq) + I- (aq)
Ksp= [Ag+][Br-] = 5.0×10-13mol2•L-2 Ksp= [Ag+][I-] = 8.3×10-17mol2•L-2
沉淀溶解平衡共41页PPT资料

①内因:电解质本身的性质 a、绝对不溶的电
②外因:ZnS(s)
解质是没有的。 Zn2+(aqb)、+ S同2-是(a难q)溶电解
质,溶解度差别 a)浓度:①加水 平衡右移,也向很溶大解。方向移动
b)温度:升②温增大相多同数离平子衡通浓对浓向常度于度溶我、溶平 沉解c溶 和 溶们温解、衡 淀方质溶解讲度平易左的向液平时的、衡溶移方移也衡只电外压来,向动可。要解移向因强说存是质动生包等,在饱做成括。在 2、影响溶解度积常数大溶强小液的的中影因进响素行。,可忽略压
Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI) 溶解度:AgCl > AgBr > AgI
迁移应用
几种难溶电解质在25℃时的溶解平衡和溶度积:
AgCl(s) AgBr(s) AgI(s)
Ag+ + ClAg+ + BrAg+ + I-
Ksp= [Ag+][Cl-] = 1.8×10-10mol2L-2 Ksp= [Ag+][Br-] = 5.0×10-13mol2L-2 Ksp= [Ag+][I-] = 8.3×10-17mol2L-2
陕西商洛柞水县柞水溶洞 山东淄博博山溶洞
当我们外出旅游,沉醉于秀 美的湖光山色时,一定会惊叹大 自然的鬼斧神工。石灰石岩层在 经历了数万年的岁月侵蚀之后, 会形成各种奇形异状的溶洞。你 知道它是如何形成的吗?
沉淀溶解平衡
20℃时,溶解度:
大于10g,易溶 1g~10g,可溶 0.01g~1g,微溶 小于0.01g,难溶
Ksp= [Ag+][Br-] = 5.0×10-13mol2L-2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
沉淀溶解平衡曲线沉淀溶解平衡图像题的解题策略1.沉淀溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液。
2.从图像中找到数据,根据K sp公式计算得出K sp的值。
3.比较溶液的Q c与K sp的大小,判断溶液中有无沉淀析出。
4.涉及Q c的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
1.在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
又知t℃时AgCl的K sp=4×10-10,下列说法不正确的是( )A.在t℃时,AgBr的K sp为4.9×10-13B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点C.图中a点对应的是AgBr的不饱和溶液D.在t℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈816答案 B解析根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的K sp为4.9×10-13,A正确;在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,故B错;在a点时Q c<K sp,故为AgBr的不饱和溶液,C正确;选项D中K=c(Cl-)/c(Br-)=K sp(AgCl)/K sp(AgBr),代入数据得K≈816,D正确。
2.已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol·L-1Na2SO4溶液,下列叙述正确的是( )A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO2-4)比原来的大B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO2-4)都变小C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO2-4)都变小D.溶液中无沉淀析出,但最终溶液中c(SO2-4)比原来的大答案 D解析 由图像可知K sp (CaSO 4)=9.0×10-6,当加入400mL0.01mol ·L -1Na 2SO 4溶液时,此时c(Ca 2+)=3.0×10-3mol ·L -1×0.1L 0.5L =6×10-4mol ·L -1,c(SO 2-4)=3.0×10-3mol ·L -1×0.1L +0.01mol ·L -1×0.4L 0.5L=8.6×10-3mol ·L -1,Q c =5.16×10-6<K sp (CaSO 4),所以溶液中无沉淀析出,但最终溶液中c(SO 2-4)比原来大。
3.(2013·江苏,14)一定温度下,三种碳酸盐MCO 3(M :Mg 2+、Ca 2+、Mn 2+)的沉淀溶解平衡曲线如图所示。
已知:pM =-lgc(M),p(CO 2-3)=-lgc(CO 2-3)。
下列说法正确的是( )A .MgCO 3、CaCO 3、MnCO 3的K sp 依次增大B .a 点可表示MnCO 3的饱和溶液,且c(Mn 2+)=c(CO 2-3)C .b 点可表示CaCO 3的饱和溶液,且c(Ca 2+)<c(CO 2-3)D .c 点可表示MgCO 3的不饱和溶液,且c(Mg 2+)<c(CO 2-3)答案 BD解析 结合沉淀溶解平衡曲线及溶度积常数进行分析。
碳酸盐MCO 3的溶度积可表示为K sp (MCO 3)=c(M 2+)·c(CO 2-3),由图像可知,MgCO 3、CaCO 3、MnCO 3的pM 为一定值时,其p(CO 2-3)逐渐增大,由溶度积表达式可知三种物质的K sp 逐渐减小,A 错;a 点在MnCO 3的沉淀溶解平衡曲线上,为其饱和溶液,结合MnCO 3图中曲线可知,c(CO 2-3)=c(Mn 2+),B 对;b 点在CaCO 3的沉淀溶解平衡曲线上,为其饱和溶液,结合CaCO 3图中曲线可知,c(CO 2-3)<c(Ca 2+),C 错;c 点在MgCO 3的沉淀溶解平衡曲线的上方,为其不饱和溶液,溶液中c(CO 2-3)>c(Mg 2+),D 正确。
4.一定温度时,Cu 2+、Mn 2+、Fe 2+、Zn 2+等四种金属离子(M 2+)形成硫化物沉淀所需S 2-最低浓度的对数值lgc(S 2-)与lgc(M2+)的关系如图所示。
下列有关判断不正确的是A. 该温度下,Ksp(MnS)大于1.0×10-35B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出D. 该温度下,溶解度:CuS>MnS>FeS>ZnS【答案】D粉末后c (Fe2+)×c(S2-)大于10-20,所以有FeS沉淀析出,C正确;D、依据此图可知,CuS的Ksp最小,其次是MnS、FeS和ZnS,所以该温度下,溶解度:CuS<MnS<FeS<ZnS,D错误,答案选D。
5.(2014·新课标全国卷Ⅰ,11)溴酸银(AgBrO3)溶解度随温度变化曲线如下图所示。
下列说法错误的是( )A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速度加快C.60℃时溴酸银的K sp约等于6×10-4D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯答案 A解析A项,由题图可知,随着温度升高,溴酸银的溶解度逐渐增大,因此AgBrO3的溶解是吸热过程;B项,由图像曲线可知,温度升高斜率增大,因此AgBrO3的溶解速度加快;C项,由溶解度曲线可知,60℃时,AgBrO3的溶解度约为0.6g,则其物质的量浓度约为0.025mol·L-1,AgBrO3的K sp=c(Ag+)·c(BrO-3)=0.025×0.025≈6×10-4;D项,若KNO3中含有少量AgBrO3,可通过蒸发浓缩得到KNO3的饱和溶液,再冷却结晶获得KNO3晶体,而AgBrO3留在母液中。
6.25℃时,PbCl2固体在不同浓度盐酸中的溶解度曲线如图。
在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )A.蒸馏水B.1.00mol·L-1盐酸C.5.00mol·L-1盐酸D.10.00mol·L-1盐酸答案 B解析观察题图知,PbCl2固体在浓度为1.00mol·L-1的盐酸中溶解度最小。
7.已知:pAg=-lgc(Ag+),K sp(AgCl)=1×10-12。
如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl 溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。
根据图像所得下列结论正确的是[提示:K sp(AgCl)>K sp(AgI)]( )A.原AgNO3溶液的物质的量浓度为0.1mol·L-1B.图中x点的坐标为(100,6)C.图中x点表示溶液中Ag+被恰好完全沉淀D.把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图像在终点后变为虚线部分答案 B解析A项,加入NaCl之前,pAg=0,所以c(AgNO3)=1mol·L-1,错误;B项,由于c(Ag+)=10-6mol·L -1,所以Ag+沉淀完全,n(NaCl)=n(AgNO3)=0.01L×1mol·L-1=0.01mol,所以V(NaCl)=100mL,B正确,C错误;若把NaCl换成NaI,由于K sp(AgI)更小,所以c(Ag+)更小,pAg更大,D错误。
8.【衡阳市2017年十校高考调研冲刺预测卷(五)】如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol·L-1,温度为T1时Ca(OH)2的Ksp = 4×10-6, ≈1.6]。
下列说法正确的是A. 温度: T l<T2B. 温度为T1时,P点分散系中分散质粒子直径均小于1nmC. Q 点的溶液中c(OH -)约为0.0125molD. 加水稀释时溶液碱性减弱,Z 点溶液可转化为Q 点溶液【答案】C【解析】A 、氢氧化钙溶解度是随着温度的升高而降低,根据图像,因此T 1>T 2,故A 错误;B 、P 点属于过饱和溶液,即悬浊液,因此分散质粒子直径大于100nm ,故B 错误;C 、根据K sp =c(Ca 2+)×c 2(OH -),4×10-6=4a ×(2a)2,解得a=6.25×10-3,因此c(OH -)=2×6.25×10-3mol ·L -1=0.0125mol ·L -1,故C 正确;D 、加水稀释,c(Ca 2+)和c(OH -)都减小,故D 错误。
9.【2017新课标3卷】在湿法炼锌的电解循环溶液中,较高浓度的Cl -会腐蚀阳极板而增大电解能耗。
可向溶液中同时加入Cu 和CuSO 4,生成CuCl 沉淀从而除去Cl -。
根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )A .SP (CuCl)K 的数量级为710-B .除Cl -反应为Cu+Cu 2++2Cl -=2CuClC .加入Cu 越多,Cu +浓度越高,除Cl -效果越好D .2Cu +=Cu 2++Cu 平衡常数很大,反应趋于完全【答案】C【解析】K sp (CuCl)=c(Cu +)·c(Cl -),在横坐标-1(Cl )lg mol L c --⋅为1时,纵坐标-1(Cu )lg mol Lc +⋅大于-6,小于-5,所以K sp (CuCl)的数量级是10-7,A 正确;除去Cl -反应应该是Cu+Cu 2++2Cl -=2CuCl ,B 正确;溶液中存在平衡:Cu ++Cl -CuCl 、2Cu +Cu 2++Cu ,加入纯固态物质Cu 对平衡无影响,故C 错误;D .在没有Cl -存在的情况下,反应2Cu +Cu 2++Cu 的平衡常数约为2 6.77.927.32(Cu )1010(Cu )(10)c c +-+-==,平衡常数 很大,反应趋于完全,D 正确。
10.金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。
