Pfizer公司自愿终止西他生坦在全球的销售和临床试验
国家药品监督管理局药品行政保护公告第153号(终止公告)

国家药品监督管理局药品行政保护公告第153号(终止
公告)
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2002.06.19
•【文号】国家药品监督管理局药品行政保护公告第153号
•【施行日期】2002.06.19
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局药品行政保护公告
(第153号终止公告)
申请人所在国:爱尔兰
申请人:杨森制药有限公司
申请药品名称:
通用名:西沙必利混悬剂(Cisapride Suspension)
商品名:普瑞博思混悬剂(Prepulsid Suspension)
授权号:B-IE94121924
授权日:1994年12月19日
该药品于1994年12月19日在中国获得的药品行政保护,已于2002年6月19日期限届满。
特此公告。
国家药品监督管理局药品行政保护办公室
二00二年六月十九日。
医药市场动态10.14

辉瑞制药计划将在法国和西班牙裁员核心提示:辉瑞制药发言人日前称,由于金融危机以及政府削减医药开支的影响,公司计划在法国裁员225人,在其西班牙的分支机构中裁员220人。
辉瑞制药发言人日前称,由于金融危机以及政府削减医药开支的影响,公司计划根据重组方案在法国裁员225人,在其西班牙的分支机构中裁员220人。
辉瑞目前在法国拥有雇员1493人,公司将在晚些时候公布更多信息。
辉瑞在法国中部地区经营一家生产厂。
辉瑞在西班牙的发言人帕斯库埃表示,此次裁员将影响行政管理、销售及研究部门,但辉瑞在马德里和西班牙东北部城市奥洛特的工厂不会受到影响。
脊髓灰质炎再次传入中国核心提示:世界卫生组织(W HO)称中国自1999年以来首次出现脊髓灰质炎疫情,本次疫情是从邻国巴基斯坦传入的。
世界卫生组织(WHO)9月20日称,中国自1999年以来首次出现脊髓灰质炎疫情,并且病毒很有可能随着前往沙特阿拉伯麦加朝圣的人群而进一步扩散。
本次疫情是从邻国巴基斯坦传入的。
WHO发言人表示,目前中国已有9例患者被确诊,而巴基斯坦全国都出现了脊髓灰质炎疫情,主要是因为局势不稳导致该国在Khyber部族区等地的疫苗接种工作受阻。
WHO认为,考虑到Haj(每年10月份的大规模麦加朝圣之旅)的即将到来和Umra(其他时间发生的麦加朝圣),野生脊髓灰质炎病毒株进一步发生跨国传播的风险很高。
评级机构下调辉瑞长期信用评级指其未如约还债核心提示:国际评级机构惠誉上周末宣布,将全球最大的制药企业——美国辉瑞制药公司的长期信用评级由AA-下调至A++;同时将辉瑞制药的评级展望由负面上调至稳定。
国际评级机构惠誉上周末宣布,将全球最大的制药企业——美国辉瑞制药公司的长期信用评级由AA-下调至A+;同时将辉瑞制药的评级展望由负面上调至稳定。
惠誉表示,辉瑞制药2009年收购惠氏公司以来未能如约偿还债务,目前企业的债务水平已经与更高的信用评级不符。
辉瑞制药二季报数据显示,截至8月底,公司的债务总额为其息税、折旧及摊销前利润的1.5倍。
西安杨森两代理药品遭召回强生质量监管屡失守

两款产品本身质量 和安全性 没有 问题 ,而是在生产过程 中管理存在缺陷 ,召 回和停售 只是为了最大
可能 降低风险 的预防性措施 。 “ 由于在 中国楷莱有替代药品 ,因此 西安杨森会进行全面的召 回行为 , 而万珂在华暂时还没有替代 药 ,因此 目前是采取加强安全监管的措施 。 ”西安杨森公关部表示 , 目前 万珂全球 的 3 家工 厂分 别位于美 国、法 国和意大利 ,国内使用产 品全部从美 国工 厂进 口,后续 只需
Y
西 安杨 森两 代理药 品遭 召 回
强 生 质理局最新公告指 出 ,英 国 、法国药品监管机构和美 国食 品药品管理
局 (D ) 于 2 1 年 1 FA 01 1月 7日 1 1日对 B nV n s aoa r s 司 ( e e u b r o e 公 L ti 下称 “ V B L公 司” )在美 国的 生产场地进行 联合 G P ( 品生产质量管理规范)检查 ,发现其无菌灌装过程质量 管理存在缺陷 。 M 药
查 1 0项不合 格。 “ 6月的检查之后 ,1 月 的中期检查发现还有一些灌装工艺方 面的问题 ,目前 ” 在 1
也正在针对这些问题进行改进。 ”任 可 可 告 诉 记 者 。
3 1
B L公 司生产的楷莱 ( V 通用名 “ 盐酸多柔 比星脂质体注射液 ” 、万珂 ( ) 通用名 “ 注射用硼替佐
米” )在 我国均 已经上市使用 ,前者在临床上用 于治疗艾滋病相关的卡波氏肉瘤 ,后者则用于治疗多
发性骨髓瘤和套细胞淋 巴瘤 。西 安杨 森正是这两种药物的国 内进 口代理销售商 。国家药 监局 8日要 求西安杨森立 即按 照 《 药品召回管理办法》 的规定主动召 回市场上所有批号 的楷莱 ;立即停止销售 万珂 ,不再使用于新患者 。 “ 我们 目前对 楷莱和万珂分别实施召 回和停止 向新患者使用 的措施 ,但 具体涉及 的召 回数量 和所需要时 间,还没有最终的统计结果 。 ”西安杨森公关部负责人任可可就此事
辉瑞公司吸入性胰岛素Exubera重要历史事件回顾
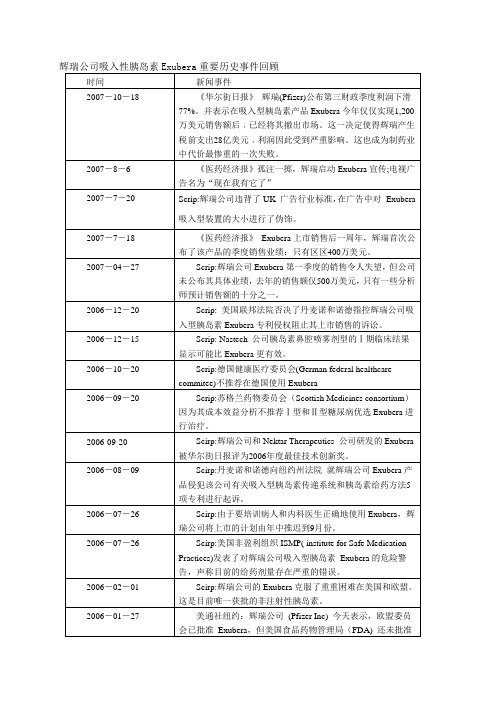
辉瑞公司吸入性胰岛素Exubera重要历史事件回顾时间新闻事件2007-10-18 《华尔街日报》辉瑞(Pfizer)公布第三财政季度利润下滑77%。
并表示在吸入型胰岛素产品Exubera今年仅仅实现1,200万美元销售额后﹐已经将其撤出市场。
这一决定使得辉瑞产生税前支出28亿美元﹐利润因此受到严重影响。
这也成为制药业中代价最惨重的一次失败。
2007-8-6 《医药经济报》孤注一掷,辉瑞启动Exubera宣传;电视广告名为“现在我有它了”2007-7-20 Scrip:辉瑞公司违背了UK 广告行业标准,在广告中对Exubera吸入型装置的大小进行了伪饰。
2007-7-18 《医药经济报》Exubera上市销售后一周年,辉瑞首次公布了该产品的季度销售业绩:只有区区400万美元。
2007-04-27 Scrip:辉瑞公司Exubera第一季度的销售令人失望,但公司未公布其具体业绩,去年的销售额仅500万美元,只有一些分析师预计销售额的十分之一。
2006-12-20 Scrip: 美国联邦法院否决了丹麦诺和诺德指控辉瑞公司吸入型胰岛素Exubera专利侵权阻止其上市销售的诉讼。
2006-12-15 Scrip: Nastech 公司胰岛素鼻腔喷雾剂型的Ⅰ期临床结果显示可能比Exubera更有效。
2006-10-20 Scrip:德国健康医疗委员会(German federal healthcarecommitee)不推荐在德国使用Exubera2006-09-20 Scrip:苏格兰药物委员会(Scottish Medicines consortium)因为其成本效益分析不推荐Ⅰ型和Ⅱ型糖尿病优选Exubera进行治疗。
2006-09-20 Scirp:辉瑞公司和Nektar Therapeutics 公司研发的Exubera被华尔街日报评为2006年度最佳技术创新奖。
2006-08-09 Scirp:丹麦诺和诺德向纽约州法院就辉瑞公司Exubera产品侵犯该公司有关吸入型胰岛素传递系统和胰岛素给药方法5项专利进行起诉。
2024年西妥昔单抗市场分析现状

2024年西妥昔单抗市场分析现状引言西妥昔单抗(Sutiximab)是一种具有靶向作用的免疫调节药物,主要用于治疗恶性肿瘤和自身免疫性疾病。
本文将对西妥昔单抗市场进行分析,包括市场规模、竞争对手和市场前景等。
市场规模西妥昔单抗作为一种创新性药物,其市场规模呈现稳步增长的趋势。
根据市场研究机构的数据,全球西妥昔单抗市场规模在2020年达到了X亿元。
预计在未来几年,西妥昔单抗市场将持续增长,预计到2025年将达到X亿元。
竞争对手目前,西妥昔单抗市场存在着激烈的竞争环境。
主要竞争对手包括:1.全球制药巨头A公司:该公司在西妥昔单抗的研发和生产方面拥有较大的优势,并已获得多个国际市场的批准。
2.B公司:B公司是一家国内制药公司,已成功将自主研发的西妥昔单抗推向市场,并取得了一定的市场份额。
3.C公司:C公司是一家新兴的生物医药企业,正在积极开展西妥昔单抗的研发工作,有望成为未来的竞争对手。
尽管存在激烈的竞争,但由于西妥昔单抗具有较高的疗效和安全性,仍有很大的市场需求,因此,市场份额的争夺将继续激烈。
市场前景西妥昔单抗在治疗恶性肿瘤和自身免疫性疾病方面表现出良好的疗效,具有广阔的市场前景。
随着人们对健康意识的提高和医疗水平的不断提升,对创新性药物的需求也在增加。
因此,西妥昔单抗市场将继续保持较快的增长速度。
此外,随着科技的不断发展和医学研究的深入,西妥昔单抗还有望在其他领域获得更多应用。
例如,一些初步研究已发现西妥昔单抗对其他类型的肿瘤和自身免疫性疾病也具有一定的治疗效果,这为西妥昔单抗的市场前景提供了更大的空间和机遇。
结论西妥昔单抗作为一种创新性药物,在全球市场上具有较大的市场规模和潜力。
尽管面临激烈的竞争,但由于其较高的疗效和安全性,仍有很大市场需求。
未来几年,西妥昔单抗市场有望继续保持快速增长,并在不同领域获得更多应用,进一步拓展市场前景。
(以上内容仅为分析市场现状,不构成投资建议。
)。
Abbott公司自愿终止西布曲明在美、加和澳洲的市场销售

高脂 质体药 物的稳定性 和保质期 。 期待 临床专家深 入探索抗肿瘤药 物脂质体 的临床评 价方法 ,根据脂质体药物 的特点发现其 临床应用 的规律 ,
以科 学 方 法 来 评 价 脂 质 体 药 物 的性 能 ,更 好 地 造 福 于 肿 瘤患 者。 参 考 文 献
[] Ba g ma 1 n h n AD,S a d s tn ih MM ,Wak n C.Dif so f t i sJ fu i n o
杂 志 ,2 0 ,2() 9 — 9 . 0 3 52 :10 12 [】 周 卫 , 吕琦 ,翁 帼 英 ,等 . 7 紫杉 醇 脂 质 体 在 大 鼠体 内 的药
动学 [ ] J .中国药科大学学 报 ,2 0 ,3 () 4 3 4 6 0 0 1 : 4 —4 . 6 [] 胡歌 ,王华庆 ,阎昭 ,等 . 8 长春新碱脂质 体 1 临床单 次 期 耐受性试验 [ ] J .中国新药杂志 ,2 0 ,1() 6 8 6 1 09 8 : 2—3. 7
【] A d ee L e s nS ,J re s nK . d a c ds a ge 9 n rsnT ,J n e S og ne A v n e rt is t e
i i s malc n e h a n lpo o a c rterpy :Pr b e nd p o p cso c ie o l msa r s e t fa tv
要在 体 内有足够 的滞 留时间 ,同时不仅 对肿瘤 细胞有 主 动 靶 向性 ,且 能在肿 瘤组 织 中适 时释放 出抗 肿瘤 药物 。 显然 ,目前 已上市 的脂质体药物均不具有上述所有特点 。
p l me im ie lrpa ltx lfr o y rc c la cia e o multo :To ct n f c c a in xiiya d e a y i
阿斯利康停止胆固醇药物临床试验

阿斯利康停止胆固醇药物临床试验*导读:制药业巨头阿斯利康宣布,前期的研究结果发现Crestor(瑞舒伐他汀钙)与安慰剂相比,可以降低心脏存在问题患者的发病率和死亡率,故阿斯利康已经停止了降胆固醇药物Crestor的临床试验JUPITER。
……美国FDA早在2003年8月根据临床试验结果,批准了Crestor(瑞舒伐他汀)上市。
临床试验结果显示,该药物可以降低总胆固醇、LDL-甘固醇以及甘油三酸酯水平,并可以升高HDL-甘固醇(有益甘固醇)水平。
该药物最常见的副作用包括肌肉疼痛、胃痛、恶心、便秘以及虚弱等。
2005年FDA发布了一项警告,声明服用Crestor的患者在同时服用其他他汀类药物的情况下,可出现横纹肌溶解(严重肌肉损伤)的不良反应。
该声明还表示,与其他已上市他汀类药物相比,使用Crestor的风险并未超过其他药物。
但要求修改药品标签,显著标识关于Crestor安全使用的用药信息,降低出现肌病/横纹肌溶解(严重肌肉损伤)的风险,尤其是在40mg高剂量情况下,更应关注用药安全。
而目前开展JUPITER临床试验,仅针对他汀类药物的初步预防作用,是在26个国家超过1200个地点同时开展的一项对瑞舒伐他汀进行评价的干预性试验。
该项试验设计用于评价Crestor在20mg/天剂量下,是否可以降低无症状心血管疾病患者的主要心血管事件的发生机率,是否可以降低正常LDL胆固醇(所谓不良胆固醇)和较高的C-反应蛋白(CRP)水平。
它是被称为GALAXY的Crestor全球系列临床试验的一部分,GALAXY在55个国家共纳入超过64000名患者。
该公司网站的一份声明表示,临床实验管理委员会以及独立数据检测委员会建议,临床试验JUPITER应该早些停止,因为已有明确迹象表明,与服用安慰剂的患者相比,服用Crestor患者在心血管方面的发病率和死亡率更低。
现在负责该试验的小组已赴各地停止试验程序,将对超过15000名患者进行最终评价。
培高利特因安全性问题撤出美国市场

发布日期20070428栏目化药药物评价>>临床安全性和有效性评价标题培高利特因安全性问题撤出美国市场作者赵建中许真玉部门正文内容审评四部八室赵建中许真玉美国FDA网站2007年3月29日发布消息,由于培高利特可导致患者心脏瓣膜损害,企业自愿将该产品撤出美国市场,撤市的产品包括原发厂礼来公司的产品和两家仿制产品。
关于培高利特存在的心脏瓣膜损害的风险,在2003年已经增加到美国上市产品说明书中,2006年又增加了黑框警告,2007年两篇发表在《新英格兰医学杂志》上的文章进一步证实了培高利特可增加二尖瓣、三尖瓣、主动脉瓣反流的风险。
根据有关文献:1. 服用多巴胺受体激动剂的帕金森病人中,进行了一项流行病学研究,并采用超声心动图进行检查。
发现与对照组比较,培高利特和卡麦角林与中重度瓣膜反流(3/4级)风险的增加有关。
研究中观察了90例对照组,和155例多巴胺受体激动剂组病人,这些病人多巴胺受体激动剂的暴露时间在12个月以上并且未服用其它药物:64例使用培高利特,49例使用卡麦角林,42例使用非麦角类激动剂(罗匹尼罗等)。
受试者主要为男性(平均年龄63岁)。
帕金森病病史和服用药物的时间培高利特组比卡麦角林组和非麦角类激动剂组更长(培高利特组62.7 +/- 28.3 月,卡麦角林组24.4 +/- 15.4月)。
培高利特组和卡麦角林组中重度瓣膜反流(3级或者4级)发生率(23.4%和28.6%)显著高于非麦角类激动剂(0%)和对照组(5.6%)。
非麦角类激动剂(0%)和对照组(5.6%)之间无统计学差异。
中重度二尖瓣和主动脉瓣反流的相关风险在培高利特组和卡麦角林组比对照组也显著升高。
心脏瓣膜反流的严重程度与培高利特和卡麦角林的平均累积剂量相关。
与对照组比较,培高利特和卡麦角林中重度瓣膜反流的相对风险(Zanettini et al, 2007)如下:2. 使用来源于英国General Practice Research Database (GPRD)的数据进行了一项基于人群的病例对照分析(n=31),使用培高利特和卡麦角林与增加新诊断的心脏瓣膜反流的风险有显著的相关性。
Pfizer依西美坦片使用说明

Pfizer依西美坦片【用法用量】成人和老年患者:推荐剂量为25mg,每日一次,每次一片,建议餐后服用。
早期乳腺癌患者应持续服用本品,直至完成5年的联合序贯辅助内分泌治疗(即他莫昔芬序贯依西美坦)。
晚期乳腺癌患者应持续服用本品直至出现肿瘤进展。
患者同时接受细胞色素P-450(CYP)3A4诱导剂,如利福平、苯妥英时,本品的推荐剂量为50mg,每日一次,餐后服用。
尚未进行中度或重度肝肾功能不全患者长期用药安全性的研究。
依西美坦剂量增至每天200mg时,非危及生命的不良事件有中度增加,基于上述经验无需进行剂量调整。
(见【药物相互作用】,【药代动力学】项下“特殊人群”和【注意事项】)【注意事项】1.绝经前的女性一般不用依西美坦片剂。
依西美坦不可与雌激素类药物连用,以免出现干扰作用。
2.中,重度肝功能,肾功能不全者慎用。
超量服用依西美坦可使其非致命性不良反应增加。
3.运动员慎用。
【不良反应】本品的主要有:恶心﹑口干﹑便秘﹑腹泻﹑头晕﹑失眠﹑皮疹﹑疲劳﹑发热﹑浮肿﹑疼痛﹑呕吐﹑腹痛﹑食欲增加﹑体重增加等。
其次文献报道还有高血压﹑抑郁﹑焦虑﹑呼吸困难﹑咳嗽。
其他还有淋巴细胞计数下降﹑肝功能指标(如丙氨酸转移酶等)异常等。
在临床试验中,只有3%的病人由于终止治疗,主要在依西美坦治疗的前10周内,由于在后期终止治疗者不常见(0.3%)。
【禁忌】对本品或本品内赋形剂过敏的患者禁用。
【适应症】本品适用于以他莫昔芬治疗后病情进展的绝经后晚期乳腺癌患者。
【药物相互作用】本品不可与雌激素类药物合用,以免拮抗本品的药效作用;依西美坦主要经细胞色素P4502A4(CYP3A4)代谢,但其与强效的CYP3A4抑制剂(酮康唑)合用时,本品的药动学未发生改变,因此似乎CYP同工酶抑制剂对本品的药动学无显著影响。
但不排除已知的CYP3A4诱导剂降低血浆中依西美坦水平的可能性。
【药理毒理】1.乳腺癌细胞的生长可依赖于雌激素的存在,女性绝经期后循环中的雌激素(雌酮和雌二醇)主要由外周组织中的芳香酶将肾上腺和卵巢中的雄激素(雄烯二酮和睾酮)转化而来。
2024年西妥昔单抗市场规模分析

2024年西妥昔单抗市场规模分析1. 前言西妥昔单抗(Rituximab)是一种用于治疗非霍奇金淋巴瘤和其他一些自身免疫性疾病的重要药物。
该药物的研发和市场应用在过去几年里取得了显著的进展,对全球医疗行业产生了重大影响。
本文将对西妥昔单抗市场规模进行分析,旨在了解其当前的市场状况以及未来发展的趋势。
2. 西妥昔单抗市场规模的历史发展西妥昔单抗自2006年获得美国食品药品监督管理局(FDA)批准用于治疗非霍奇金淋巴瘤以来,其市场规模逐渐扩大。
在过去的十年中,西妥昔单抗的销售额稳步增长,成为非霍奇金淋巴瘤治疗领域的主要药物之一。
3. 西妥昔单抗市场规模的当前状况根据最新的市场数据,西妥昔单抗在全球范围内的市场规模不断扩大。
该药物的销售额在过去几年中保持着两位数的增长率,预计在未来几年内将继续保持良好的增长势头。
尽管面临着一些竞争性药物的挑战,但西妥昔单抗在非霍奇金淋巴瘤治疗市场中的份额仍然稳定。
4. 西妥昔单抗市场规模的发展趋势未来几年,西妥昔单抗市场规模有望进一步增长。
这归因于以下几个因素:•人口老龄化的趋势:随着全球人口老龄化的加剧,非霍奇金淋巴瘤等与年龄相关的疾病的发病率也会增加,从而提高了西妥昔单抗的需求。
•新适应症的扩展:西妥昔单抗的临床应用正在不断拓展,其在治疗其他一些自身免疫性疾病(如风湿性关节炎和系统性红斑狼疮)中的疗效也越来越被认可,这将进一步推动其市场规模的增长。
•新市场的开拓:西妥昔单抗市场正在逐渐向发展中国家扩展。
这些国家面临着疾病负担不断增加的压力,对于创新治疗方法的需求也在增加。
5. 结论西妥昔单抗作为一种重要的治疗非霍奇金淋巴瘤和其他自身免疫性疾病的药物,在全球范围内的市场规模不断扩大。
随着人口老龄化的趋势和新适应症的扩展,西妥昔单抗市场的发展前景广阔。
我们相信,随着科技进步和医疗水平的提高,西妥昔单抗的市场规模将继续保持增长,并为患者提供更好的治疗选择。
辉瑞退出脑肿瘤疫苗研发协议

体拮 抗剂p r m a e 由卫材公司研发, eapnl
用 于癫 痫 部 分 发 作 的 患 者 。近 期 该 公 司
公布了该药的一项I 期随机双盲安慰剂 I I 对照 的平行研 究结果 ,76 0 例患者随机接 受安慰剂或p rm a e 种不同剂量中的 ea p n l 3
合吉非替尼显著改善 了已治的晚期非小
细 胞肺 癌 ( SL )患 者 的 无进 展 生存 期 N CC (F) ,不过 总生存 期 (6 PS 0 )未 能获益 。 而在 此研 究中 ,0为主 要观 察终点 ,而PS 6 F 为次 要 终点 。无 新发 或 非预 期不 良事件 报 告 。 该 公 司 目前 仍 在 对 试 验 数 据 进 行 分
的丙 肝 治疗 药 物 PG 干 扰 素 。 E一
患者, 再将 治疗时间从2 周延至4 周是 4 8 否还能获 益 ( 延长 的快速 病毒学应答 ,
eV ) V re ¥ 药进 行的 ILM NT l R R ? e tx  ̄ LU IAE I l
正式 结盟 ,合作研 发一个 新系列药 物 。此 项交 易将促使 罗氏借 助A l r n i e o 的肽平 台技
■
舒尼替尼联合吉非替尼
改
百特
45 0 0 万美元购得Gls i a sa
近 期 , 百 特 公 司 公 布 从 K m d 购 得 a aa G a s a (Q人 蛋 白酶 抑 制 剂 )独 家 的 商 业 lsi —
完 成 对 仿 制 药 公 司 B o i h 的 收 购 , 此 举 inc e 早 于预 期 时 问 。该 交 易于 上 个 月 公布 。
罗氏、A l o irn e
合作研发新药
辉瑞发展历程

辉瑞发展历程
辉瑞(Pfizer)是一家世界知名的跨国药企,总部位于美国纽约。
以下是辉瑞的发展历程:
1849年,辉瑞由德国化学家查尔斯·辉瑞在纽约创立,最初名为“辉瑞化学制药公司”。
1880年,辉瑞开始生产化学品和药品,成为美国最早的药物制造商之一。
1950年,辉瑞推出了溴化锂,作为治疗精神病的药物。
1980年代,辉瑞致力于生物制药领域的研究和开发,并取得了多个重要突破性药物的发现和上市。
1996年,辉瑞推出了世界上第一种“勃起功能障碍”(ED,即阳痿)的口服治疗药物——伟哥(Viagra),这个药物一度成为全球最畅销的药物之一。
2000年,辉瑞宣布收购华美逊(Warner-Lambert),这是历史上最大的制药业并购之一,使辉瑞成为全球最大的药企之一。
2001年,辉瑞推出了针对癌症的重要药物——吉列达(Gleevec),该药物被认为是目前最成功的靶向癌症治疗药物之一,为辉瑞带来了巨大的商业成功。
20世纪末和21世纪初,辉瑞不断进行收购和兼并,扩大了在
全球范围内的市场份额和业务范围。
2019年,辉瑞与辉凌(Myovant)合作开发了一种新型男性避
孕药物,该药物正在进行临床试验。
2020年,辉瑞和德国生物技术公司BioNTech成功合作开发了
一种新型冠状病毒疫苗,该疫苗在全球范围内推出并广泛使用,成为COVID-19疫情防控的重要工具。
辉瑞作为一家创新药企,始终致力于研发和生产高质量和高效药物,并且在全球范围内享有盛誉。
2004年全球畅销药物前200强处方药点评

2004年全球畅销药物前200强处方药点评来源: 华源医药更新:2005-06-10 点击:121次在2004年全球畅销药物前200强处方药排名中,降血脂药阿托伐他汀(atorvastatin,立普妥,Lipitor)和辛伐他汀(simvastatin,舒降之,Zocor)名列榜首,荣登全球最畅销药物宝座,而精神疗法药物则位列治疗领域第一。
全球畅销药物前十排名Lipitor和Zocor是2004年最畅销的两种药物,这一佳绩已经保持了整整4年。
2004年排名第一位的Lipitor全球年销售高达108.6亿美元,这一数值几乎是排名第二位的Zocor的两倍(见表1)。
据统计,2004年共有90种处方药年销售收入超过10亿美元,与2003年相比增长了23个,2003年销售收入超过10亿美元的处方药共有67种。
2004年共有27种处方药年销售收入超过20亿美元,与2003年相比增长了4个,2003年销售收入超过20亿美元的处方药为23种。
此次全球畅销药物前十排名中有2个新入围者:抗抑郁药文拉法新(venlafaxine,Effexor)和抗凝药氯吡格雷(clopidogrel,波立维,Plavix)。
2004年全球销售排名前十位的畅销药总体销售收入高达470亿美元,而Lipitor则是第一个年销售突破100亿美元的处方药。
表1、2004年全球畅销药物前十排名排名药品名称制药企业销售收入(单位:亿美元)1 Lipitor 辉瑞公司(Pfizer) 108.62 Zocor 默克公司(Merck) 52.03 Advair/Seretide 葛兰素史克公司(GlaxoSmithKline) 45.04 Norvasc 辉瑞公司(Pfizer) 44.65 Zyprexa 礼来公司(Eli Lilly) 44.26 Nexium 阿斯利康公司(AstraZeneca) 38.97 Procrit/Eprex 强生公司(Johnson & Johnson) 35.98 Zoloft 辉瑞公司(Pfizer) 33.69 Effexor 惠氏公司(Wyeth) 33.510 Plavix 百时美施贵宝公司(Bristol-Myers Squibb) 33.3品牌药Lipitor已经连续三年荣登最畅销药物的桂冠宝座了,2001年其仅次于Zocor名列第二。
这些畅销药,在国外或早已被淘汰

这些畅销药,在国外或早已被淘汰。
【本文不作为用药依据,药品使用请咨询主治医生或药剂师意见。
笔者与本文提到的所有药品制造商或其竞争对手无利益关系。
】如果一个药在美国、欧洲和日本都没有上市,或者在这些地区早已被淘汰而却在中国畅销,那你还会去使用吗?这个问题,不能一概而论。
我们举个例子——易瑞沙。
易瑞沙,肺癌靶向药物,于2002年在美国上市,2004年在中国上市。
但在2005年,易瑞沙被美国食品药品监督管理局(FDA)撤回审批,准备退市,原因就是在美国医生在临床应用当中发现易瑞沙并不能延长生命,效果跟化疗没有太大区别。
然而易瑞沙在中国的实际运用效果,却和美国却大有不同。
后来,随着医学界对于肺癌靶向基因的研究深入,发现了易瑞沙的靶点——EGFR突变在中国肺癌患者中的比例大幅高于美国肺癌患者(EGFR突变最重要的四个相关性因素——腺癌、亚裔、女性以及不吸烟)。
这也是为什么在一开始在没有检测EGFR的时候,中国患者使用易瑞沙的疗效会比美国患者好得多。
后来,EGFR检测突变已成了易瑞沙治疗的标准检测,这个药也于2016年在美国重新上市了。
在这里,我们得感谢中国的吴一龙医生对于中国的肺癌靶向研究做出的突出贡献。
然而易瑞沙只是个例,其他大多数外国退市而只在中国上市的药物,临床疗效也许都值得商榷。
我们今天就来罗列几个,像马来酸桂哌齐特这样近期媒体有报道过的就不说了,还有一些容易伤害到民族感情的药物,我们今天也暂时不提,就说几个临床上用的比较多的药物吧。
安乃近常用科室:儿科慎用原因:副作用多,已被多国淘汰。
安乃近,解热镇痛药,临床实际使用多以解热为主。
安乃近是1911年由德国人合成,中国最早是1952年由上海五洲制药厂生产,后在中国广泛使用,估计很多人小时候都用过这个药。
安乃近的退热效果非常快,然而它的不良反应也很多,最主要的不良反应是在血液方面,可能引起粒细胞缺乏症,并且起病迅速,严重者会有生命危险。
由于安乃近的副作用较强,1977年,美国正式禁用了安乃近,之后日本、澳大利亚等三十多个国家也淘汰了安乃近。
辉瑞PCSK9项目意外终止,谁是最大赢家?

辉瑞PCSK9项目意外终止,谁是最大赢家?辉瑞11月1日意外宣布终止热门降脂药PCSK9单抗bococizumab的开发,理由是bococizumab在降低LDL-C的作用强度上没有达到预期,而且相比其他PCSK9抑制剂有较高的免疫原性和注射部位不良反应。
这个消息也引发了连锁反应,造成大家对PSCK9这类新药项目的质疑。
PCSK9(前蛋白转化酶枯草溶菌素9)可介导低密度脂蛋白受体(LDLR)降解,是“后他汀”时代最热门的降脂药靶点。
目前,全球只有两个单抗类PCSK9抑制剂上市,分别是Amgen的Repatha (evolocumab)和赛诺菲/ Regeneron的Praluent (alirocumab)。
除了辉瑞,PCSK项目开发进度最快的是Alnylam和The Medicines Company联合开发的ALN-PCSsc。
全球主要PCSK9抑制剂及销售额Repatha和Praluent均被预测在2020年可实现超过20亿美元的销售收入,销售峰值可超过30亿美元。
但目前看来,这两个药物的表现都只能算中规中矩,过去12个月的销售额加起来也仅1.5亿美元左右,尚未打开局面。
一方面是因为这两个药物比他汀药物贵很多,定价在14000美元/年。
美国高血脂患者大约7500万人,LDL-C水平过高无法控制,适用PCSK9单抗治疗的患者占15%,大约为1100万人,医保难以承受。
根据STAT今年10月份的一篇报道,美国医保对这两个药物支付请求的首轮拒绝率超过88%,而Medicare过去一年的首轮拒绝率达到77%。
这两个药物在过去1年仅被处方了12万次。
另一方面是因为PSCK9单抗尚未获得降低心脏病、卒中风险方面的心血管获益证据,Sanofi/Regeneron和Amgen也都在开展相关研究,相关结果2017年才能揭晓。
如果PCSK9抑制剂能证明可使心血管风险降低20%以上,医生将会非常乐意处方,将对其市场吸收起到极大刺激作用。
多家药企终止药物研发!默克42亿美元项目说停就停

多家药企终止药物研发!默克42亿美元项目说停就停创新药研发过程中,是屡败屡战,还是及时止损?新药项目投资大、风险高、周期长,选错方向就意味着可能失去了做更优质项目的机会。
因此,对于屡次失败的项目,如何取舍至关重要。
今年以来,就有多家药企因研发失利而宣布终止项目研究。
8月23日,默克宣布,根据独立数据监察委员会(IDMC)进行的一次数据审查,默克决定终止II期INTR@PID BTC 055研究。
该研究旨在评估bintrafusp alfa(M7824)联合吉西他滨(gemcitabine)和顺铂一线治疗局部晚期或转移性胆管癌(BTC)患者。
据了解,Bintrafusp alfa是由默克公司内部研发的一款PD-L1/TGF-β双抗。
2019年2月,默克与葛兰素史克达成了关于bintrafusp alfa在难治性癌症研发的合作,两家制药巨头签订了总额高达42亿美元的全球合作开发协议。
然而,被寄予厚望的bintrafusp alfa发展却不如预期,据悉这次是bintrafusp alfa今年失败的第4项II/III期临床研究。
随着本次宣布终止该领域的研发,无疑是为该药能否成功研制画上一个遗憾的“问号”。
默克对此研发项目的终止,也不得不让一些涉及该疗法研究的药企重新审视PD-L1/TGF-β双抗的价值。
资料显示,国内包括恒瑞医药、君实生物、正大天晴等药企已入坑开展PD-L1/TGF-β双抗临床研究。
另外,此次葛兰素史克不仅在默克bintrafusp alfa押上的赌注宣告失败,而且在其上个月二季度财报中披露,已终止一款处于2期临床开发的RSV儿科候选疫苗,原因是经评估后表明该疫苗保护儿童的效力不大可能达到目标值。
近20家药企宣告终止研发项目除了默克和葛兰素史克外,有媒体统计,今年以来有不少于20家制药企业宣布终止或暂停药物领域的研发。
8月18日,药物临床试验登记与信息公示平台显示,恒瑞的SHR-1314注射液治疗成人中重度斑块型银屑病的II期临床研究试验状态变更为主动终止。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[】 中华 内科杂 志编辑委员会 . 1 血液病 / 恶性肿瘤患者侵袭性 真 菌感染 的诊断标 准与 治疗 原则 ( 订版 )[ ] 中华 内 修 J. 科杂志 ,2 0 ,4 () 6 7 6 0 0 7 67 : 0 — 1.
[] B w E , L v r ir ,L s irN, e a .A t u g l 2 o J a e deeM u se t ni n a 1 f
a pe g lo i :Clni a r c i ui ln s o he I f ci us s r il s s i c lp a tce g de i e ft n e to
D sae oit o meia[ .C i Ifc D s 0 8 i ssS ce f e y A r c J] l net i,2 0 , n
患者的 II F 预防已开始使用泊沙康唑 。II F 确诊后 的治疗 , 临床几无争议 , 只要按照 II F 真菌感染 的种类和药敏结果 、 病情轻重 以及患者的脏器功能进行综合判断后 即可给药 。 临床最常见和最难 把握 的是经验 治疗 和先发治疗 的药物 选择 ,需考虑患者 的病 情情况 和经济条件 ,结合 医师 的 临床经验 ,同时参照有关 指南合理选 择药物 ,最基本 的 原则是选用广谱抗 II F 药物 ,并尽可能选 用不 良反应小 、 安全 的药物 。 如果患 者为拟 诊或者 临床诊 断为 II F 且病 原可疑 或 者有一定倾 向性 ,可 以根据感染病原 的可能性 给予 广谱 抗 真菌药 物。美 国 I S D A指南 建议 ,对 于非 粒缺 患者 的 可疑念珠 菌感染 ,推荐 选用氟康唑 、卡泊芬净 、米 卡芬 净或 阿尼芬净进行治疗 ,如果不能耐受 或无药则可选 用 A B或脂 质体 A B; 于粒缺 患者的可 疑念珠菌感 染 , m m 对 应 以卡泊 芬净 或脂 质体 A b为一 线选 择 ( a r 推荐级 别 最 高) ,也可选 用伏立康唑 、氟康唑或伊 曲康唑 ( 推荐级别 稍低 )_ 4 】 。对于持 续粒 缺发 热 、广谱 抗菌 药无 效 、可 疑 曲霉菌感染 的 II F 患者 ,I S D A推荐使 用 的经 验性治疗 药 物包括 A 、脂 质体 A 、伏立 康唑 、伊 曲康 唑和卡泊 mB mB 芬净 。 对 于拟诊 或者 临床诊 断 为 II F 、但感 染病 原完 全不 明的患者 ,抗真菌 药物 的选择需 更慎重 的综 合考虑 。在 B S ( 0 8 )和 E I 欧洲 白血 病感染 会议 ,2 0 CH 20 年 CL( 09 年 )的最 新 指 南 ( 参 见 ht: w . sg i l e. n 请 t / wb h u e n s o p/ w c di c 和 h p/w . m .g 的有关 指南 )中,均推荐应 以卡 t : we t r 上 t/ w b o 泊芬净或脂 质体 A mB作为一线药物 ,其 中卡泊芬净的推 荐级别很高 ,疗效与脂质体 A B相当而安全性更好 。同 m 属棘 白菌素类 药物 的米 卡芬净也获得 推荐 ,但 因临床 证 据较少而推荐级别较低 。伏立康唑在与脂质体 A B进行 a r
n urp ncp t ns: a dmie ,c nrl dt a J . e t ei ai t A rn o zd o t l il[ ] o e oe r
Ci f t i,2 0 ,4 () 14 — 0 1 l I e s 0 9 88 : 0 2 15 . n n cD
z r 司自愿终止西他生坦在全球的销售和临床试验 e/ 公
21 0 0年 1 2月 1 日,Pi r 司 就其 肺 动脉 高压 治 疗 药物 西他 生 坦 ( i x na/h l 发表 声 明称 : 0 fe 公 z sa e tn en) t T i 因存 在 不 能预
测 的严 重肝 损伤 、甚至 使患 者 因此 死亡 的严 重 副反 应 ,将从 即 日起 自愿 自全球 市场 上撤 出西他 生坦 ,同时 终止 正在 进 行 的
( 马培 奇 )
( 稿 日期 : 0 0 2 1 ) 收 2 1-1 - 1
上海医药
2 1年 01
第3 卷 2
第l 期
6
teIfci sD sae o iyo eia[ ] l net h net u i ssSce f o e t Am r c J .Ci Ifc n
D s 0 9 85 5 3 5 5 i,2 0 ,4 ( ): 0 - 3 .
[ Was J n i i E ,D n igD ,e a . ram n f 5 ] l T ,A as e J e nn W h s t Tet e t 1 o
所 有西他 生坦 相关 临床试 验。 西他 生坦 属 选择 性 内皮 素 A 受体拮 抗 剂 ,2 0 0 6年 8月起 先 后在 欧 盟和 澳 、加 等地 区和 国家 获得 批; 隹,用于 一 日 1次
口服 治疗 肺动脉 高压 患者 以改 善活动 能 力。据 查 ,西他 生坦没 有获 准进 入过 中 国市场 ,也 未在 中国进 行过 相关 临床试 验。
【பைடு நூலகம் P p a G,K u m n A,A d s 4 a ps P af a f C n e D,e a . l ia p a t e t 1 C i c l rc c n i
g dei sfrt e ma a e e to a di a i :2 09 u a eb ui l ne h n g m n fc n diss o 0 pd t y
临崩 导 滞 _
药物 。 抗真菌谱包括念珠菌和 曲霉菌等 , 对新生 隐球菌 、 但 镰霉菌和毛霉菌无活性 。 4) 氟胞嘧 啶 : 抗真菌谱窄 , 主要覆 盖念珠 菌和新生 隐球 菌等 。由于单 用该 药易诱 导真 菌 耐药 ,故 治疗 II F
时需联合用药 。 2 . 常 用抗 II .2 2 F 药物 的选择 通常选用氟康唑预防 II F ,而国外 对造血 干细胞移植
C ne ,20 ,9 (2 : 2 0 34 . a cr 0 2 41) 3 3 - 2 6
[] C r o n e 3 o d n i rC,P u a a t s C, Ma r , e a . mp rc l u yS t 1 E i a i
v ru r e t e a t u g l h r p o ih rs e s s p e mp i n i n a e a y f rh g — ik, f b i v f t e rl e,
4( : 2—6 . 63 3 7 3 0 )
( 稿 日期 : 2 1 - 5 1 收 0 0 0 - 4)
一■一一一一■●一一一一■一一一■●一一一●■■■一一一一一 !一!蔓翼笪■一一一一一一一一一一一■一一一■一■一一一一一一一一一一■一一●一■一■■一一一一一●一一■■●一一●一一 一●■一一一■一■一一■■一■■一一■一一■一■■一一一i
的临床对 照研究 中失利 ,伊 曲康唑则 存在与 三唑类药 物 的交叉 耐药性 ,故此 两药在 II F 经验治疗 中均 只获得 较 低级别 的推荐 ,但在 国内指南 中仍都 获得 了推荐 。氟康 唑因抗 真菌谱 窄 ,一般不用 于 II F 经验治疗 。 结合 上述 3 临床 实例 ,例 1 个 患者 因痰涂片和痰 培 养提示存在 白色念珠 菌 ,虽然可能属定植 ,未必是感染 , 但倾 向于 白色念珠菌感 染 ,故选用较 为广谱 的伊 曲康唑 治疗 ; 2患者为粒缺合并感染患者 ,因真菌类型不明 , 例 故选 用广谱 和较 为 安全 的卡 泊芬净 进行 II F 经验 治疗 ; 例 3患者治疗 属早期经验 治疗 ,考虑 到异基 因造血于 细 胞移植 后 曲霉菌感 染发生 率较 高 ,在 积极进行 c T检查 和G M试验 的同时给予 对 曲霉菌感染 疗效较 优的伏立康 唑治疗 ,后 G 试验强 阳性结果证 实 曲霉菌感 染可能性 M 大。以上 3 患者治疗均获得 了较为满意 的疗效。 例
p o h lx sfrs v r l e to e i h moh r p e i in s: r p ya i o e e e yn u rp n c c e t e a y r cp e t
A m t aayio n o i d cnrl dcii lr l J . ea nls f ad m z — ot l l c i s[ ] s r e o e n a ta
