05 第五章 化学平衡
第五章化学平衡ppt课件

2NH3(aq) CO2 (g) H2O(l)
2
NH
4
(aq)
CO32
]
[NH3 ]2 p(CO2 )
该反应可以认为是由下面四个反应加和而成的。
2NH3(aq) 2H2O(l)
2
NH
4
(aq
)
2OH
(aq)
(a)
CO2 (g) H2O(l) H2CO3(aq)
2 0.000 0.000 0.200 0.094 0.094 0.012 0.016
3 0.100 0.100 0.100 0.177 0.177 0.023 0.017
可见,无论从正反应开始(实验1),还是从逆反 应开始(实验2),或者从H2、I2、HI的混合物开始 (实验3),尽管平衡时各物质的浓度不同,但生成 物浓度以方程式中化学计量系数为乘幂的乘积,除以 反应物浓度以方程式中化学计量系数的绝对值为乘幂 的乘积却是一常数。即
如 CaCO3 ( s )
CaO ( s ) + CO2 ( g )
Kp = pCO2 固相不写入。
Cr2O72 - ( aq ) + H2O ( l )
Kc
[CrO42 ]2[H [Cr 2O72 ]
]2
2 CrO4 2 - ( aq ) + 2 H+ ( aq )
H2O 为液相,不写入。
5.2.3 经验平衡常数 1.平衡常数与反应方程式
当反应处于平衡态时,rG 0 显然有
rG
RT ln aEe • aFf aBb • aDd
0
式中aB、aD、aE和aF均是平衡状态下的活度。
令
aEe • aFf aBb • aDd
第五章化学平衡资料

常用术语:
转化率()
=
某反应物消耗掉的数量 该反应物的原始数量
产率 =
转化为指定产物某反应物的数量 该反应物的原始数量
无副反应时,产率等于转化率;有副反应时,
产率小于转化率
例:反应 COCl2(g) CO(g) +Cl2(g) 100 ℃时, K =810-9
求:(1) 总压 p=200 kPa 时,COCl2的解离度 (2) 总压 p=100 kPa 时,COCl2的解离度
= nBB p / (p nB ) B =Kn p / (p nB ) B
p为总压,nB包括系统中不参加反应的惰 性组分。
K
Kp p
B
Kc
c
RT p
B
p B
p
B
Ky
p
Kn p
nB
• K和Kc 仅与T 有关,
K y 还与总压 p有关,Kn 还与总压p 和 nB有关。
• B = (g) 0时, K= Kc = K y= Kn
5.平衡常数的测定及平衡组成的计算
核心:K
由实验测定的平衡组成来计算。 由热力学数据( rGm )求算。
通过测定平衡时各组分的浓度计算K 物理法:测定平衡反应系统某一物理量如压 力、气体体积、折射率、电导、光吸收等, 一般不会影响平衡。 化学法:常采用降温、移走催化剂、加入溶 剂冲淡等方法中止反应。
rG
m
+RT
ln Jpeq = 0
(*)
定义 : Jpeq = pBeq/pB = K 标准平衡常数
由式(*): rGm = RT ln K
(K是纯数,其数值与化学计量式的写法有关)
2. 化学反应方向的判断
物理化学:05 化学平衡

B(T )
RT
ln
fB P
K
f
fG P
fD P
g
d
fH P
fE P
h
e
(2)液相反应
a) aA(l) bB(l) gG(l) hH(l)
如果参加反应的物质是构成理想溶液,物质的化学势
表示式:
B
B
RT
ln
B
代入
K
G g H h A a B b
如果参加反应的物质均溶于一溶剂中,而溶液为稀
2、用作判据
化学反应等温式主要用作判据。等温方程式可以判断
一个化学反应是否能自发进行。因为用 rGm 作判据,
在等温、等压、只作膨胀功(体积功)不作其它功的情况
下,如果一热力学过程的:
G 0 G 0 G 0
能自发进行 达平衡 反应不能自发进行
将此结论推广应用于任意一气相反应,则从 等温方程式可以看出:
平衡时:CaO(s) CO2 ( g ) CaCO3 (s) 0
对于凝聚相(液体或固体),其化学势随压力变化不
大,并且凝聚相均处于纯态不形成固溶体或溶液。则
CaO(s)
CaO( s )
CaCO3 (s)
CaCO3 (s)
CO2 ( g )
CO2 (T )
RT
ln
PCO2 P
P )
P2 SO3
P P 2
SO2
O2
(1/
(1/ P )2 P )2 (1/ P )
KP
1 P
2 ( 2 1)
KP
(P
B )B
B
PB P
B
B=产物的系数和-反应物的系数和 B
K
第五章化学平衡

21:33:59
5. 对于分解温度,若实际温度T>T分解,则分解可以进行。 (分解反应是吸热反应)
例题:
习题4 习题8(1)
21:33:59
§2 理想气体化学反应的等温方程—化学反应方向和限度的判据
1. 等温方程的推导
恒T 、恒 p,且 W´ = 0时,对于理想气体间的化学反应
N2和H2的分压均为1.00×104Pa,NH3的分压为1.24×107Pa。
(1)求反应在1000K时的 K ;(2)当N2和H2的分压仍为
1.00×104Pa,NH3的分压为1.00×105Pa时,计算反应的 rGm ,
并判断反应自发进行的方向。
习题7
21:33:59
§3 平衡组成的计算
Ky
y
c C
y
d D
y
a A
y
b B
B
y B B
b. Ky与 K Kp,Kc关系 : K Ky ( p / p ) B
K p K y p B
Kc
K y p B ( RT ) B
c. Ky是?函数: Ky=f(T,p)
21:33:59
(4)Kn ——用物质的量表示的平衡常数
下的
K p,3
K
3
K c,3
K y,3
习题1
21:33:59
。
5. 多(复)相反应的化学平衡(指有气相参加的多相反应) 讨论最简单的情况:气相是理想气体,液相和固相是纯物质的
系统。 和多相反应有关的两个重要概念: (1)分解压力:指某T时,非气态物质(指固态物质)在真空中分 解达平衡时,气相的总压力。 (2)分解温度:分解压力等于外压时的温度 。
第五章__化学平衡习题和答案

第五章 化学平衡 选择题1. 对于化学平衡, 以下说法中不正确的是(A) 化学平衡态就是化学反应的限度 (B) 化学平衡时系统的热力学性质不随时间变化 (C) 化学平衡时各物质的化学势相等 (D) 任何化学反应都有化学平衡态 答案:C 。
正确的说法应为0BB Bνμ=∑2. 下面的叙述中违背平衡移动原理的是(A) 升高温度平衡向吸热方向移动 (B) 增加压力平衡向体积缩小的方向移动 (C) 加入惰性气体平衡向总压力减少的方向移动 (D) 降低压力平衡向增加分子数的方向移动 答案:C 。
加入惰性气体平衡向总压力增大的方向移动3.要使一个化学反应系统在发生反应后焓值不变, 必须满足的条件是 (A) 温度和内能都不变 (B) 内能和体积都不变(C) 孤立系统 (D) 内能, 压力与体积的乘积都不变 答案:D 。
因ΔH=ΔU+Δ(pV )4. 在等温等压下,当反应的Δr G m = 5kJ·mol -1时,该反应能否进行?(A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行 答案:C 。
应该用Δr G m 判断而不是Δr G m 。
5.已知反应 2NH 3 = N 2 + 3H 2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N 2 + 3/2 H 2 = NH 3 的标准平衡常数为:(A) 4 (B) 0.5 (C) 2 (D) 1 答案:C 。
6.反应 2C(s) + O 2(g) 2CO(g),其rG m /(J·mol -1) = -232600 - 167.7T /K ,若温度升高,则:(A) r G m 变负,反应更完全 (B) K p 变大,反应更完全 (C) K p 变小,反应更不完全 (D )无法判断答案:C7.对于气相反应,当体系总压力p 变化时(A) 对K f 无影响 (B) 对K r 无影响 (C) 对K p 无影响 (D) 对K f 、K r 、K p 均无影响 答案:A 。
05章 化学平衡

例:N2O4(g) ⇌ 2 NO2(g) 无色 红棕色 在 373K 恒温槽中反应一段时间后,反应 混合物颜色不再变化,显示已达平衡,测 得平衡时N2O4、NO2浓度
N2O4(g) ⇌ 2 NO2(g)
N2O4-NO2体系的平衡浓度(373K) 0.100 0 0 0.100 0.100 0.100 -0.060 +0.120 +0.014 -0.028 -0.030 +0.060 0.040 0.120 0.014 0.072 0.072 0.160
三、与“平衡常数”有关的计算
例:C2H5OH + CH3COOH ⇌ CH3COOC2H5 + H2O 若起始浓度c (C2H5OH) = 2.0 mol.dm-3 , c (CH3COOH ) = 1.0 mol.dm-3 , 室温测得经验平衡常数Kc =4.0 , 求平衡时C2H5OH的转化率α。 解:反应物的平衡转化率 α% = (反应物起始浓度 - 反应物平衡浓度) / (反应物起始浓度) × 100
C2H5OH + CH3COOH ⇌ CH3COOC2H5 + H2O 起始浓度/ 2.0 1.0 0 0 平衡浓度/ 2.0- 1.0- Kc = 2 / [(2.0- ) (1,得 = 0.845 mol.dm-3 C2H5OH平衡转化率
pi = ciRT , 代入KP表达式 KP = ( pDd pEe) / ( pAa pB b)
经验平衡常数存在两大问题 : ①多值性; ②△n≠0时,量纲≠1. (2)相对平衡常数:Kr (或标准平衡常数Kø )
定义:“标准压力”为p ø
“标准(物质的量)浓度”为c ø SI制规定:p ø= 1 ×105 Pa(旧:101325 Pa) c ø = 1 mol· dm-3
第五章 化学平衡

• 反应: SO2(g)+0.5O2(g) SO3(g) SO2分子与O2分子会化合生成 SO3分子;但同 时, SO3分子也会分解为SO2和O2分子.
• 若体系的初始组成是原料SO2和O2, 那么在反应初期, 体系中主要 为SO2和O2分子, 它们之间的碰撞频率较高, 而SO3的分子数很少, 其分解的速率自然较低, 故在宏观上,反应向正方进行. • 随着反应进行, SO3分子的浓度逐步提高, 其分解速率也随之提高; SO2和O2的浓度逐步降低, 故合成SO3的速率也随之降低, 当达到 一定程度时, 两者的速率相等。此时,从宏观上看,体系的组成 不再变化,化学反应达到了平衡。
• rGm的单位是: J.mol-1.
• 化学反应通常在恒温、恒压下进行, rGm 可作为反应 过程进行方向的判据 。 1、若 rGm < 0 ,即∑B B < 0
反应物的化学势大于产物的化学势,反应自发正向进行; 2、若 rGm > 0 ,即∑B B > 0
反应物的化学势小于产物的化学势,反应自发逆向进行; 3、若 rGm = 0 ,即∑B B = 0
• 产物与反应物的标准态化学势之差决定了反应在给定条件下的反
应限度,即 eq的大小。
当反应进度 大于 0而小于 1时,由于反应物及产物以混合的方 式存在,产生了负值的混合吉布斯自由能改变量,使G总对的曲 线表现为有最低点的曲线而不是一条直线。 • 若反应物与产物并不相混合,则反应是有可能进行到底的,如一 定条件下碳酸钙的热分解反应或爆炸性反应。
底的=1处,而是在其左侧= eq<1的某处。
• 当反应进行到总自由能达到最低值,就达到了化学平衡而不能使 再加大了. 因为假若反应继续进行,就形成了自发地进行一个dG>
第五章化学平衡要点

K = B(pB /p )B K c = B(cB /c )B K y = B yB B Kn = B nB B
(c = 1moldm-3)
K K c : K = B(pB /p ) B
K = B ((cB /c) c RT/p )B = K c (c RT / p ) B
2. 摩尔反应Gibbs函数与化学反应进度的 关系,平衡条件
对任一反应 0 BB
B
设恒T、p且W’ = 0,有 dG μBdnB
B
因为:dnBBdξ
所以: d G T,p = (BB B ) d
( G / ) T,p = BB B
= rG m
对如下反应: N2 (g) + H2 (g) = NH3(g)
式中第二项 BB RT ln (pB/p )
= RT BB ln (pB/p )
= RT lnB (pB /p )B
令
压力商Jp = B (pB /p )B
rG m = BB B + BB RT ln (pB/p ) = rG m + RT ln Jp
此即理想气体反应的等温方程。
2.标准平衡常数
K Ky: K = B(pB /p ) B = B(ptotal yB /p ) B = B yB B (ptotal /p ) B = K y (ptotal /p ) B (ptotal为总压)
K Kn: K = B(pB /p ) B = B(ptotal yB /p ) B
Jp = K 处于平衡;
Jp > K 反应逆向进行。
K 与化学计量式的写法有关。例如合成氨:
1. N2(g)+3H2(g) = 2NH3(g);
第5章 化学平衡

化学平衡
§5.2.1 标准平衡常数
1、标准平衡常数的表示 (1)气体反应 aA(g)+ bB(g) cC (g)+ dD (g)
K
[ pC / p ]c [ pD / p ]d [ pA / p ] [ pB / p ]
0.016
C(H2) C(I2) C(HI)
C(H2) C(I2) C(HI)
0.188 0.188 0.024
1 0.200 0.200 0.00
2 0.00 0.00 0.200
3 0.100 0.100 0.100
0.094 0.094 0.012
0.177 0.177 0.023
0.016
0.016
(1)求n(H2O)/n(CO)为1时,CO的转化率; (2)求n(H2O)/n(CO)为3时,CO的平衡转化率; (3)从计算结果了什么问题?
第5章
化学平衡
§5.2 化学反应进行的方向
解: (1)设CO和H2O起始浓度均为1mol/L,平衡时 CO2和H2的浓度为x mol/L CO + H2O ↔ CO2 + H2 平衡时浓度(mol/L)1-x 1-x x x
[ p(D)/p ]
[ p(A) / p ]a [c(B) / c ]b
由于纯固相和纯液相(含稀溶液中溶剂) 的标准态是它们本身的纯物质,故物质所处的
状态与标准态相比后所得的数值等于1。
第5章
例如:
化学平衡
§5.2 化学反应进行的方向
CaCO3(s)+2H+(aq)
2
Ca2+(aq)+CO2(g)+H2O(l)
的动态关系;
物理化学-第五章化学平衡

ΔG1=0
ΔG2=RTln(bθ/b)
C4H6O4(饱和溶液, b=0.715 mol/kg)
G
f
G
θ m
(aq)
f
G
θ m
(s)
G1
G2
ΔfG
θ m
(aq)
Δf
G
θ m
(s)
RTln(bθ /b)
5.4 各种因素对化学平衡的影响 问题:
1. 对于已经达到平衡的反应,可否改变其平衡位置?
2. 如何选择最适宜的反应条件? 工业合成氨 3H2(g) + N2(g) = 2NH3(g) 工业生产中的工艺条件一般是在520ºC, 30MPa,
B
pBeq
vB
pθ
平衡分压积
标准平衡常数, 简称平衡常数
rGmθ RT ln K θ 标准平衡常数Kθ热
力学定义式
K θ exp( rGmθ )
适用于任何类型的 化学反应
RT
任意化学反应
0 B BB
当化学反应处于平衡时:rGmeq
v
B
eq
B
0
B
化学势通式:
μB μBθ RTlnaB FB
(1) 根据反应的ΔrHmθ 和ΔrSmθ 计算
rGmθ
r
H
θ m
Tr Smθ
其中:
r
H
θ m
vB
f
H
θ m,
B
标准摩尔生成焓
B
Δr Smθ
vB Smθ , B
B
标准摩尔规定熵
由表中298.15K数据如何求T 下的ΔrGmθ?
T
r
H
θ m
大学物理化学05章_化学平衡.ppt
应物转化率提高,使产物的含量增加。
上一内容 下一内容 回主目录
返回
上一内容 下一内容 回主目录
返回
化学反应的等温方程
2/摩尔反应吉布斯函数与反应进度的关系,平衡 条件
对任一化学反应,有
0 BB
B
根据反应进度的定义,可以得到:
d dnB B
dnB Bd
上一内容 下一内容 回主目录
返回
化学反应的等温方程
dG SdT Vdp BdnB
B
等温、等压条件下,
K与Kp之间的关系:
K=Kp/(p) B 当B=0,则K=Kp。
上一内容 下一内容 回主目录
返回
平衡转化率的计算
平衡转化率又称为理论转化率,是达到平衡后, 反应物转化为产物的百分数。
平衡转化率
达平衡后原料转化为产物的量 投入原料的量
100%
工业生产中称的转化率是指反应结束时,反应物 转化为产物的百分数,因这时反应未必达到平衡,所 以实际转化率往往小于平衡转化率。
物理化学电子教案—第五章
上一内容 下一内容 回主目录
返回
第五章 化学平衡
5.1 化学反应的等温方程 5.2 理想气体化学反应的标准平衡常数 5.3 温度对标准平衡常数的影响 5.4 其它因素对理想气体化学平衡的影响
上一内容 下一内容 回主目录
返回
5.1 化学反应的等温方程
1/摩尔反应吉布斯函数与化学反应亲和势 在恒温恒压及非体积功为零的条件下: rGm0
上一内容 下一内容 回主目录
返回
2惰性气体对平衡转化率的影响
nB
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
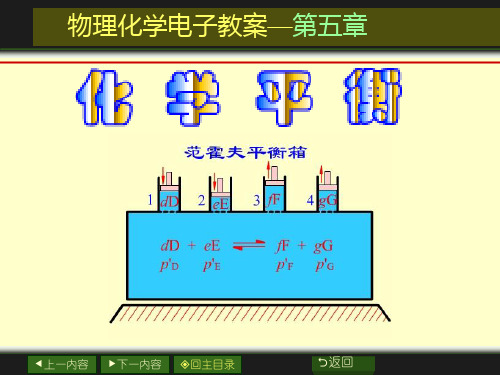
dD + eE +L → gG + hH +L
1. 用压力表示的经验平衡常数 K p .
g pG ⋅ d pD ⋅
Kp =
h pH L νB = Π pB e pE L B
的单位为1。 当 ∑ν B = 0 时, K p 的单位为 。 通常K 通常 p有单位
2.用摩尔分数表示的平衡常数 K x .
2F 为例,在反应过程中吉布斯自 为例, 将反应 D + E 由能随反应过程的变化如图所示。 由能随反应过程的变化如图所示。 R点,D和E未混合时吉布 点 和 未混合时吉布 斯自由能之和; 斯自由能之和; P点,D和E混合后吉布斯 点 和 混合后吉布斯 自由能之和; 自由能之和; T点,反应达平衡时,所有 点 反应达平衡时, 物质的吉布斯自由能之总 和,包括混合吉布斯自由 能; S点,纯产物 的吉布斯自由能。 的吉布斯自由能。 点 纯产物F的吉布斯自由能
(∆ r Gm )T , p > 0
(∆ r Gm )T , p = 0
反应自发地向左进行, 反应自发地向左进行,不可能自发 向右进行 反应达到平衡 反应达到平衡
∂G 判断, 图上曲线的斜率, 用 ( )T , p 判断,这相当于 G ~ ξ 图上曲线的斜率, ∂ξ
因为是微小变化,反应进度处于 之间。 因为是微小变化,反应进度处于0~1 mol之间。 之间
∆rG = −RT ln K
∅ m
∅ a
§ 6.3 平衡常数与化学方程式的关系
∆ r G (T ) = − RT ln K
∅ m ∅ a
时的标准Gibbs自 下标 m 表示反应进度为 1 mol 时的标准 自 由能的变化值。显然,化学反应方程中计量系数呈 由能的变化值。显然,化学反应方程中计量系数呈 ∅ ∅ ∆ r Gm (T )的值也呈倍数关系,而 K a 值则 的值也呈倍数关系 也呈倍数关系, 倍数关系, 倍数关系, 呈指数的关系。 呈指数的关系。 例如: 例如: ∅ ∅ (1) 1 H 2 (g) + 1 I 2 (g) = HI(g) ∆ r Gm , 2 = 2∆ r Gm,1 )2 2 (2) H 2 (g) + I 2 (g) = 2HI(g) )
1922年,比利时热力学专家德唐德(De donder)首 先引进了化学反应亲和势 化学反应亲和势的概念。他定义化学亲和势A为: 化学反应亲和势 def ∂G A − ( )T , p = −∑ν B µB ∂ξ B 或 A = -∆ r Gm A是状态函数,体系的强度性质。用A判断化学反 是状态函数,体系的强度性质。 是状态函数 判断化学反 应的方向具有“势”的性质,即: 应的方向具有“ 的性质, A>0 反应正向进行 A<0 A=0 反应逆向进行 反应达平衡
fB = ∆ r G (T ) + ∑ν B RT ln ∅ p B
∅ m
B
∅ ∆ r G m (T ) 称为化学反应标准摩尔 称为化学反应标准摩尔Gibbs 自由能变
化值,只是温度的函数。 化值,只是温度的函数。
化学反应等温方程式
有任意反应
dD + eE +L → gG + hH +L
∅ m ∅ g ∅ h
对理想气体, 对理想气体, p = cRT
K c = K p ( RT )
−
∑ν B
B
4.液相反应用活度表示的平衡常数 K a .
K a = Π aB B
νB
§ 6.4 复相化学平衡
什么叫复相化学反应 解离压力
什么叫复相化学反应? 什么叫复相化学反应?
有气相和凝聚相(液相、固体) 有气相和凝聚相(液相、固体)共同参与的反应 称为复相化学反应。只考虑凝聚相是纯态的情况, 称为复相化学反应。只考虑凝聚相是纯态的情况,纯 态的化学势就是它的标准态化学势,所以复相反应的 态的化学势就是它的标准态化学势,所以复相反应的 热力学平衡常数只与气态物质的压力有关。 热力学平衡常数只与气态物质的压力有关。 例如,有下述反应,并设气体为理想气体: 例如,有下述反应,并设气体为理想气体:
(dnB = ν B dξ )
B B
∂G ( )T , p = ∑ν B µ B ∂ξ B
当 ξ = 1 mol 时:
(a)
(∆ r Gm), p = ∑ν B µ B T
B
(b)
这两个公式适用条件: 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; 等温、等压、不作非膨胀功的一个化学反应; 保持不变。 (2)反应过程中,各物质的化学势 µ B 保持不变。 反应过程中, 公式(a)表示有限体系中发生微小的变化; 公式(a)表示有限体系中发生微小的变化; (a)表示有限体系中发生微小的变化 公式(b)表示在大量的体系中发生了反应进度等 公式(b)表示在大量的体系中发生了反应进度等 (b) 的变化。 于1 mol的变化。 的变化
§ 6.1 化学平衡的条件
化学反应体系 热力学基本方程 化学反应的方向与限度 为什么化学反应通常不能进行到底 化学反应亲和势
化学反应体系
化学反应体系: 封闭的单相体系, 化学反应体系: 封闭的单相体系,不作非膨胀 发生了一个化学反应,设为: 功,发生了一个化学反应,设为:
dD + eE + ⋅ ⋅ ⋅ → fF + gG + ⋅ ⋅ ⋅
第五章
第六章 化学平衡
§ 6.1 化学平衡的条件和反应的亲和势 § 6.2 化学反应的平衡常数和等温方程式 § 6.3 平衡常数的表示式 § 6.4 复相化学平衡 § 6.5 标准生成吉布斯自由能 § 6.6 温度、压力及惰性气体对化学平衡的影响 § 6.7 同时平衡 § 6.8 反应的耦合 § 6.9 近似计算
CaCO 3 (s) → CaO(s) + CO 2 (g)
K ∅ = p (CO 2 ) / p ∅ p
p (CO 2 ) 称为 CaCO 3 (s) 的解离压力。 的解离压力。
解离压力( 解离压力(dissociation pressure) )
某固体物质发生解离反应时, 某固体物质发生解离反应时,所产生气体的压 称为解离压力,显然这压力在定温下有定值。 力,称为解离压力,显然这压力在定温下有定值。 如果产生的气体不止一种,则所有气体压力的 如果产生的气体不止一种,则所有气体压力的 总和称为解离压。 总和称为解离压。 例如: 例如:
K ∅, 2 = ( K ∅,1 ) 2 f f
经验平衡常数
1. 2. 3. 4.
Kp Kx Kc Ka
反应达平衡时,用反应物和生成物的实际压力、 反应达平衡时,用反应物和生成物的实际压力、 摩尔分数或浓度代入计算, 摩尔分数或浓度代入计算,得到的平衡常数称为经验 平衡常数,一般有单位。例如,对任意反应: 平衡常数,一般有单位。例如,对任意反应:
( fG p ) ( fH p ) … ∆rGm = ∆rG + RT ln ∅ d ∅ e ( f D p ) ( fE p ) …
= ∆rG (T) + RT ln Qf
这就是化学反应等温方程式。 称为“逸度商” 这就是化学反应等温方程式。Q f 称为“逸度商”, 化学反应等温方程式 ∆rG 可以通过各物质的逸度求算。 m (T ) 值也可以通过 可以通过各物质的逸度求算。 ∅ ∆ 多种方法计算, 的值。 多种方法计算,从而可得r Gm 的值。
反应向右自发进行 反应向左自发进行 反应达平衡
K $θ = Q p p
• 推广到任意化学反应, 推广到任意化学反应, △rGm =-RTlnKθ + RTlnQa • Qa称为活度商。将此原理用于任意化学反应,可以 称为活度商。将此原理用于任意化学反应, 判断反应进行的方向. 判断反应进行的方向 • 平衡时
NH 4 HS(s) = NH 3 (g ) + H 2S(g)
解离压力 p = p ( NH 3 ) + p (H 2S) 则热力学平衡常数: 则热力学平衡常数:
p( NH 3 ) p ( H 2 S ) 1 K = ⋅ = ( p / p∅ )2 p∅ p∅ 4
各物质的变化量必须满足: 各物质的变化量必须满足:
0 = ∑ν B B
B
根据反应进度的定义,可以得到: 根据反应进度的定义,可以得到:
dξ =
dn B
νB
dnB = ν Bdξ
热力学基本方程
dG = − SdT + Vdp + ∑ µ B dnB
B
等温、等压条件下, 等温、等压条件下,
(dG), p = ∑ µ B dnB = ∑ν B µ B dξ T
g h xG ⋅ xH L νB K x = d e = Π xB xD ⋅ xE L B
对理想气体,符合 分压定律, 对理想气体,符合Dalton分压定律,pB = pxB 分压定律
Kx = K p p
−
∑ν B
B
3.用物质的量浓度表示的平衡常数 K c .
g h cG ⋅ cH L νB Kc = d e = Π cB cD ⋅ cE L B
∅ m
热力学平衡常数
当体系达到平衡, 当体系达到平衡,∆ r Gm = 0 ,则
( fG p ) ( fH p ) … ∆rG + RT ln =0 ∅ d ∅ e ( fD p ) ( fE p ) …
∅ m
∅ g
∅ h
∆rG = −RT ln K
∅ m
∅ f
K ∅ 称为热力学平衡常数,它仅是温度的函数。在 热力学平衡常数,它仅是温度的函数。 f 称为热力学平衡常数 数值上等于平衡时的“逸度商” 是量纲为1的量 的量, 数值上等于平衡时的“逸度商”,是量纲为 的量, 单位为1。因为它与标准吉布斯自由能有关, 单位为 。因为它与标准吉布斯自由能有关,所以 又称为标准平衡常数。 又称为标准平衡常数。
