九年级化学 酸碱指示剂变色口诀变色范围选择原则变色原理顺口溜
化学指示剂变色范围及规律顺口溜

钠与滴有酚酞的蒸馏水反应现象
忽(浮)闪身(声)四处红。
浮:钠浮在液面上;闪:钠逐渐融成闪亮小球;声: 发出嗤嗤响声;四处:钠球在液面四处游动;红:加入 酚酞的水变成红色。戏说:便是超级短篇武侠小说。 将Na投入CuSO4溶液中的现到寺连寺,酚酞遇到八道士,
紫色石蕊五八枝,山涧均生五彩池。
注释:甲基橙3.1-4.4;酚酞8-10;紫色石蕊5-8;
末句意思为酸浅碱深规律,即同一指示剂分别与酸或碱
溶液作用,酸色比碱色浅,碱色比酸色深。红橙黄绿青
蓝紫颜色浅至深,如: 甲基橙滴入酸溶液显红色,而滴 入碱溶液呈黄色。
中考化学复习:酸碱盐口诀学习法

中考化学复习:酸碱盐口诀学习法初中化学酸碱盐知识系统性比拟强,概念较多,触及到的化合物种类及反响也多,且反响规律较复杂,同窗们在这方面学习一定有些困难。
在这里中考察分网把该章的一些重要内容编成口诀,记忆起来就方便多了,希望对大家有所协助。
1.电离口诀:〝电离电离,遇水便离〞。
说明:〝遇水便离〞是指酸、碱、盐在溶解于水时便同时发作电离,并不是通电后才发作电离。
2.酸碱盐溶液导电缘由口诀:〝溶液能导电,缘由细心辨,光有离子还不行,自在移动是关键〞。
说明:〝光有离子还不行,自在移动是关键〞是指假设溶液中存在离子,假定这些离子不能自在移动,该溶液仍不能导电。
只要溶液中存在自在移动的离子时,溶液才干导电。
3.浓盐酸的特性口诀:〝无色抚慰有酸味,浓酸挥发成白雾;要问白雾是什么,它是盐酸小液滴〞。
说明:假定将〝它是盐酸小液滴〞改为〝它是硝酸小液滴〞,即成为浓硝酸的特性。
4.浓硫酸的特性口诀:〝无色稀薄油状液,不易挥发把水吸;腐蚀皮肤使碳化,沾上硫酸用布拭〞。
说明:〝把水吸〞是指浓硫酸有吸水性,从而推知浓硫酸可作枯燥剂。
〝沾上皮肤用布拭〞是指假设皮肤上沾上硫酸,应立刻用布拭去,再用水冲洗。
而不能象处置其它酸一样先用水洗。
5.指示剂遇酸、碱溶液变色口诀:〝石蕊遇酸紫变红,酚酞遇酸影无踪;石蕊遇碱紫变蓝,酚酞遇碱红彤彤。
〞说明:〝影无踪〞是指无色酚酞试液遇酸不变色(仍为无色)。
〝石蕊遇碱〞、〝酚酞遇碱〞,这里的碱是指碱溶液。
假定是不溶性碱,那么不能使指示剂变色。
6.稀释浓硫酸的方法口诀:〝稀释浓硫酸,应防酸飞溅,要把浓酸注入水,同时再搅拌〞。
说明:〝应防酸飞溅〞,是由于浓硫酸溶于水时会放出少量的热,假设把水注入浓硫酸里,水的密度较浓硫酸小,会浮在酸下面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向周围飞溅。
7.硝酸、浓硫酸跟金属反响口诀:〝硝酸浓硫酸,氧化性很强,遇到金属后,生水不生氢〞。
说明:〝生水不生氢〞是指生成水而不生成氢气。
酸碱指示剂的选择指示剂的颜色变化原理

酸碱指示剂的选择指示剂的颜色变化原理酸碱指示剂的选择与指示剂的颜色变化原理酸碱指示剂是化学实验中常用的一种试剂,通过它们的颜色变化可以判断溶液的酸碱性质。
在选择合适的指示剂时,需要考虑溶液的pH 范围,以及指示剂的反应性和颜色变化原理。
本文将针对酸碱指示剂的选择与指示剂的颜色变化原理展开讨论。
一、酸碱指示剂的选择1. 中性范围指示剂中性范围指示剂可以在接近中性的溶液中发生颜色变化,常用的有酚酞、红石蕊等。
酚酞在pH值在6.8-8.2之间时呈现红色,在低于6.8时呈现无色,在高于8.2时呈现洋红色;红石蕊的颜色则由红变黄再变无色。
2. 酸碱范围指示剂酸碱范围指示剂可以在一定酸碱范围内发生颜色变化,常用的有溴酚蓝、甲基橙等。
溴酚蓝在pH值在5.6-6.8之间呈现绿色,在低于5.6时呈现黄色,在高于6.8时呈现蓝色;甲基橙在酸性条件下呈现红色,而在碱性条件下呈现黄色。
3. 宽范围指示剂宽范围指示剂可以在较广泛的酸碱范围内发生颜色变化,常用的有酚酞蓝、石蕊红等。
酚酞蓝能够在pH值在1.2-2.8之间呈现红色,在低于1.2时呈现浅黄色,在高于2.8时呈现蓝色;石蕊红能够在酸性条件下呈现红色,在碱性条件下呈现蓝色。
二、指示剂的颜色变化原理指示剂的颜色变化原理与指示剂分子内部的化学结构以及与溶液中物质的相互作用密切相关。
1. 酚酞酚酞分子中含有酚性的羟基和酮性的酮基,其颜色变化是通过酚性羟基和酮性酮基的亲电性互相转移电子所致。
在酸性溶液中,酚酞分子被酸质子化,形成无色酚酞酸分子;而在碱性溶液中,酚酞酸分子接受碱质子,形成呈现红色的酚酞阴离子。
2. 红石蕊红石蕊的颜色变化原理是通过氢氧根离子的取代作用引起的。
红石蕊分子中含有两个酚性羟基和一个环状结构,当溶液为酸性时,氢氧根离子(OH-)被酸质子取代,形成无色的红石蕊分子;而在碱性溶液中,氢氧根离子不再取代,从而呈现黄色。
3. 溴酚蓝溴酚蓝分子中含有溴酚基和苯酚基,其颜色变化主要由氢氧根离子的取代作用引起。
初中化学酸碱盐口诀学习

初中化学酸碱盐口诀学习初中化学酸碱盐口诀学习初中化学第八章《酸碱盐》知识系统性比较强,概念较多,涉及到的化合物种类及反应也多,且反应规律较复杂,同学们学习有一定困难。
如果把该章的一些重要内容编成口诀,记忆起来就方便多了。
1.电离口诀:“电离电离,遇水便离”。
说明:“遇水便离”是指酸、碱、盐在溶解于水时便同时发生电离,并不是通电后才发生电离。
2.酸碱盐溶液导电原因口诀:“溶液能导电,原因仔细辨,光有离子还不行,自由移动是关键”。
说明:“光有离子还不行,自由移动是关键”是指如果溶液中存在离子,若这些离子不能自由移动,该溶液仍不能导电。
只有溶液中存在自由移动的离子时,溶液才能导电。
3.浓盐酸的特性口诀:“无色刺激有酸味,浓酸挥发成白雾;要问白雾是什么,它是盐酸小液滴”。
说明:若将“它是盐酸小液滴”改为“它是硝酸小液滴”,即成为浓硝酸的特性。
4.浓硫酸的特性口诀:“无色粘稠油状液,不易挥发把水吸;腐蚀皮肤使碳化,沾上硫酸用布拭”。
说明:“把水吸”是指浓硫酸有吸水性,从而推知浓硫酸可作干燥剂。
“沾上皮肤用布拭”是指如果皮肤上沾上硫酸,应立即用布拭去,再用水冲洗。
而不能象处理其它酸一样先用水洗。
5.指示剂遇酸、碱溶液变色口诀:“石蕊遇酸紫变红,酚酞遇酸影无踪;石蕊遇碱紫变蓝,酚酞遇碱红艳艳。
” 说明:“影无踪”是指无色酚酞试液遇酸不变色(仍为无色)。
“石蕊遇碱”、“酚酞遇碱”,这里的碱是指碱溶液。
若是不溶性碱,则不能使指示剂变色。
(石酸红,石碱蓝,酚酞遇碱变红色)6.稀释浓硫酸的方法口诀:“稀释浓硫酸,应防酸飞溅,要把浓酸注入水,同时再搅拌”。
说明:“应防酸飞溅”,是因为浓硫酸溶于水时会放出大量的热,如果把水注入浓硫酸里,水的密度较浓硫酸小,会浮在酸上面,溶解时放出的热会使水立即沸腾,使硫酸液滴向四周飞溅。
7.硝酸、浓硫酸跟金属反应口诀:“硝酸浓硫酸,氧化性很强,遇到金属后,生水不生氢”。
说明:“生水不生氢”是指生成水而不生成氢气。
九年级化学酸碱盐知识口诀大全

九年级化学酸碱盐知识口诀大全《酸碱盐》知识系统性比较强,概念较多,涉及到的化合物种类及反应也多,且反应规律较复杂,同学们学习有一定困难。
如果把”。
说明:“该章的一些重要内容编成口诀,记忆起来就方便多了。
初中化学第八章《酸碱盐》知识系统性比较强,概念较多,涉及到的化合物种类及反应也多,且反应规律较复杂,同学们学习有一定困难。
如果把该章的一些重要内容编成口诀,记忆起来就方便多了。
1.电离口诀:“电电离离,遇水便离遇水便离”是指酸、碱、盐在溶解于水时便同时发生电离,并不是通电后才发生电离。
2.酸碱盐溶液导电原因口诀:“溶液能导电,原因仔细辨,光有离子还不行,自由移动是关键”。
说明:“光有离子还不行,自由移动是关键”是指如果溶液中存在离子,若这些离子不能自由移动,该溶液仍不能导电。
只有溶液中存在自由移动的离子时,溶液才能导电。
3.浓盐酸的特性口诀:“无色刺激有酸味,浓酸挥发成白雾;要问白雾是什么,它是盐酸小液滴”。
说明:若将“它是盐酸小液滴”改为“它是硝酸小液滴”,即成为浓硝酸的特性。
4.浓硫酸的特性口诀:“无色粘稠油状液,不易挥发把水吸;腐蚀皮肤使碳化,沾上硫酸用布拭”。
说明:“把水吸”是指浓硫酸有吸水性,从而推知浓硫酸可作干燥剂。
“沾上皮肤用布拭”是指如果皮肤上沾上硫酸,应立即用布拭去,再用水冲洗。
而不能象处理其它酸一样先用水洗。
5.指示剂遇酸、碱溶液变色口诀:“石蕊遇酸紫变红,酚酞遇酸影无踪;石蕊遇碱紫变蓝,酚酞遇碱红艳艳。
”说明:“影无踪”是指无色酚酞试液遇酸不变色(仍为无色)。
“石蕊遇碱”、“酚酞遇碱”,这里的碱是指碱溶液。
若是不溶性碱,则不能使指示剂变色。
6.稀释浓硫酸的方法口诀:“稀释浓硫酸,应防酸飞溅,要把浓酸注入水,同时再搅拌”。
说明:“应防酸飞溅”,是因为浓硫酸溶于水时会放出大量的热,如果把水注入浓硫酸里,水的密度较浓硫酸小,会浮在酸上面,溶解时放出的热会使水立即沸腾,使硫酸液滴向四周飞溅。
指示剂变色口诀

指示剂变色口诀
1.茜素红,酸不变;硚青绿,碱见红。
茜素红是指示剂茜素的颜色,在酸性溶液中保持红色不变,在碱性溶液中变为青绿色。
2.甲基橙,酸色黄;佛波酚,酸色红。
甲基橙在酸性溶液中呈现黄色,在碱性溶液中无明显变化;佛波酚在酸性溶液中呈现红色,在碱性溶液中变为无色。
3.甲基橙,甜如橙;甲基红,苦似冰。
甲基橙在酸性溶液中呈现橙色,在碱性溶液中呈现甜橙色;甲基红在酸性溶液中呈现深红色,在碱性溶液中呈现苦冰色。
4.溴酚绿,碱变黄;溴甲蓝,碱如青。
溴酚绿在碱性溶液中呈现黄色,在酸性溶液中无明显变化;溴甲蓝在碱性溶液中呈现青色,在酸性溶液中变为红色。
5.酚酞黄,碱报红;溶菌酶,碱珠蓝。
酚酞黄在碱性溶液中呈现红色,在酸性溶液中呈现黄色;溶菌酶在碱性溶液中呈现珠蓝色,在酸性溶液中呈现无色。
化学颜色顺口溜

化学颜色顺口溜嘿,朋友!你是不是一看到化学里那些五颜六色的现象就头大呀?别担心,今天我就给大家分享超有趣的化学颜色顺口溜,保证让你一下子就记住那些化学知识,就像把小宝贝放进了记忆的小盒子,稳稳当当的。
我记得我上学的时候,有个同桌叫小李。
这小李呀,对化学里的颜色那叫一个迷糊。
老师在讲台上讲什么铜离子是蓝色的,铁离子有不同颜色啥的,他就在下面皱着眉头,那脸呀,苦得像吃了苦瓜一样。
我就跟他说:“嘿,兄弟,我给你讲个好玩的,化学颜色顺口溜。
”我就开始念:“钾紫钠黄锂紫红,铷紫铜蓝钡黄绿。
钙锶砖红洋红美,铁浅绿来铁棕黄。
”小李眼睛一下子就亮了,他说:“哇,这啥呀?像儿歌似的。
”我就给他解释:“你看啊,钾离子在火焰里灼烧的时候就是紫色的,就像神秘的紫水晶一样漂亮;钠离子呢,是黄色的,就像那灿烂的小太阳。
锂离子紫红色,那颜色就像害羞的晚霞。
铷离子也是紫色,铜离子蓝色就像深邃的大海,钡离子黄绿色,像是春天里刚冒头的嫩草。
钙和锶离子的砖红色就像古老城堡的红墙,而铁离子有浅绿色和棕黄色呢,浅绿色的铁离子像刚冒尖的小嫩芽,棕黄色的就像秋天的落叶。
”你再看那些金属氧化物的颜色。
比如说氧化镁是白色的,就像冬天的雪一样纯洁无瑕。
我有个朋友小王,他就特别爱钻牛角尖。
他就问我:“那这氧化镁白色有啥特别的?不都是白的嘛。
”我就跟他说:“嘿,你可别小看这白色。
你想啊,要是化学世界是个大舞台,氧化镁这白色就像那默默站在后面的背景布,没有它的纯净白色衬托,那些有颜色的反应就不会那么显眼啦。
这就好比在一幅画里,白色的底色虽然不那么起眼,但却是让整个画面和谐的关键呢。
”再说说高锰酸钾的紫红色。
那颜色可浓烈了,就像热情似火的大红色玫瑰。
有次做实验,我们看到高锰酸钾溶液的时候,旁边的小赵就惊叹:“哎呀妈呀,这颜色也太扎眼了,像啥呢?”我就笑着说:“这就像一个穿着大红色舞裙的舞者,在化学的舞台上尽情地表演呢。
”还有溴水的橙黄色,它就像那秋天熟透的橘子的颜色。
酸碱指示剂的选择初中化学

酸碱指示剂的选择初中化学(原创版)目录1.酸碱指示剂的定义与作用2.酸碱指示剂的选择原则3.常用酸碱指示剂及其变色范围4.酸碱指示剂在初中化学实验中的应用正文一、酸碱指示剂的定义与作用酸碱指示剂是一种能够在酸碱溶液中显示不同颜色的物质,通常是有机弱酸或弱碱。
在酸碱滴定过程中,酸碱指示剂能够帮助我们判断酸碱反应是否达到中和点,从而确定滴定终点。
二、酸碱指示剂的选择原则选择酸碱指示剂时,需要考虑以下几个原则:1.变色明显:指示剂在酸碱溶液中的颜色变化应该明显,便于观察和判断。
2.变色范围与恰好中和时的 pH 要吻合:指示剂的变色范围应该与恰好中和时的 pH 值相匹配,这样在滴定过程中才能准确判断中和点。
3.选择适当的指示剂:根据酸碱反应的类型和溶液的性质选择合适的指示剂。
三、常用酸碱指示剂及其变色范围初中化学中常用的酸碱指示剂有以下几种:1.石蕊:变色范围为 5-8,但由于其变色范围较宽,红色和紫色之间的变化不够明显,因此一般不作为滴定指示剂。
2.酚酞:酸滴定碱时,颜色由红色刚好褪色;碱滴定酸时,颜色由无色变为红色。
酚酞的变色范围为 8-10。
3.甲基橙:酸滴定碱时,颜色由黄色变为橙色;碱滴定酸时,颜色由橙色变为黄色。
甲基橙的变色范围为 3.1-4.4。
4.淀粉碘化钾:用于检验氯气,当溶液中含有氯气时,淀粉碘化钾会变成蓝色。
四、酸碱指示剂在初中化学实验中的应用在初中化学实验中,酸碱指示剂常用于酸碱滴定实验。
通过观察指示剂的颜色变化,可以判断酸碱反应是否达到中和点,从而确定滴定终点。
此外,酸碱指示剂还可以用于检测溶液的酸碱性质,帮助学生更好地理解酸碱反应的原理。
酸碱指示剂变色口诀

酸碱指示剂变色口诀
酸碱指示剂变色口诀:甲基橙:甲基橙色三四点(3.1-4.4为橙色);酚酞:太太八十红颜在(8.2-10显红色);石蕊:十女舞罢(五八)紫花开(5-8为紫色)。
化学中常用的酸碱指示剂有甲基橙、石蕊和酚酞。
甲基橙的变色范围为3点1~4点4,小于3点1为红色,在3点1到4点4之间为橙色,大于4点4为黄色。
石蕊溶液变色范围为5到8.小于5为红色,位于5到8之间为紫色,大于8为蓝色。
酚酞试液变色范围为8点2到10.小于8点2为无色,位于8点2到10之间为浅红色,大于10为红色。
酸碱指示剂一般是有机弱酸或弱碱,它们的共轭酸碱对具有不同结构而呈现不同颜色。
当溶液的pH改变时,指示剂得到质子,由碱式转变为共轭酸式,或失去质子,由酸式转变为共轭碱式,由于其结构的转变而发生颜色的变化。
初三化学实验口诀整理

初三化学实验口诀整理伟人之所以伟大,是因为他与别人共处逆境时,别人失去了信心,他却下决心实现自己的目标。
读书改变命运,刻苦成就事业,态度决定一切。
下面是小编给大家带来的初三化学实验口诀,欢迎大家阅读参考,我们一起来看看吧!初三化学实验口诀:常见元素的化合价(正价)一价钾钠氢与银,二价钙镁钡与锌,三价金属元素铝;一五七变价氯,二四五氮,硫四六,三五有磷,二四碳;一二铜,二三铁,二四六七锰特别初中化学实验操作技巧口诀:原子最外层与离子及化合价形成的关系“失阳正,得阴负,值不变”:原子最外层失电子后形成阳离子,元素的化合价为正价;原子最外层得电子后形成阴离子,元素的化合价为负价;得或失电子数=电荷数=化合价数值。
初中化学实验操作技巧口诀:金属活动性顺序1、金属活动性顺序由强至弱:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au (按顺序背诵) 钾钙钠镁铝锌铁锡铅(氢) 铜汞银铂金2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
初中化学实验操作技巧口诀:“十字交叉法”写化学式正价左负价右,十字交叉约简定个数,写右下验对错”初中化学实验操作技巧口诀:反应规律、置换反应反应规律:置换反应:(1)金属单质 + 酸→盐 + 氢气(2)金属单质 + 盐(溶液)→另一种金属 + 另一种盐(3)金属氧化物+木炭或氢气→金属+二氧化碳或水复分解反应:①碱性氧化物+酸→盐+H2O ②碱+酸→盐+H2O ③酸+盐→新盐+新酸④盐1+盐2→新盐1+新盐2 ⑤盐+碱→新盐+新碱初中化学实验操作技巧口诀:化学实验基本操作固体需匙或纸槽,手贴标签再倾倒。
酸碱液记忆口诀

酸:解离出的所有阳离子都是H+ ,例HCl (H+和Cl-)碱:解离出的所有阴离子都是OH-,例NaOH(Na+,OH-)氨水也属于碱,氨水不含金属离子(NH3-H2O)盐;解离出金属离子或按根离子和酸根离子。
如 NaCl1.电离口诀:“电离电离,遇水便离”。
说明:“遇水便离”是指酸、碱、盐在溶解于水时便同时发生电离,并不是通电后才发生电离。
2.酸碱盐溶液导电原因口诀:“溶液能导电,原因仔细辨,光有离子还不行,自由移动是关键”。
说明:“光有离子还不行,自由移动是关键”是指如果溶液中存在离子,若这些离子不能自由移动,该溶液仍不能导电。
只有溶液中存在自由移动的离子时,溶液才能导电。
3.浓盐酸的特性口诀:“无色刺激有酸味,浓酸挥发成白雾;要问白雾是什么,它是盐酸小液滴”。
说明:若将“它是盐酸小液滴”改为“它是硝酸小液滴”,即成为浓硝酸的特性。
4.浓硫酸的特性口诀:“无色粘稠油状液,不易挥发把水吸;腐蚀皮肤使碳化,沾上硫酸用布拭”。
说明:“把水吸”是指浓硫酸有吸水性,从而推知浓硫酸可作干燥剂。
“沾上皮肤用布拭”是指如果皮肤上沾上硫酸,应立即用布拭去,再用水冲洗。
而不能象处理其它酸一样先用水洗。
5.指示剂遇酸、碱溶液变色口诀:“石蕊遇酸紫变红,酚酞遇酸影无踪;石蕊遇碱紫变蓝,酚酞遇碱红艳艳。
”说明:“影无踪”是指无色酚酞试液遇酸不变色(仍为无色)。
“石蕊遇碱”、“酚酞遇碱”,这里的碱是指碱溶液。
若是不溶性碱,则不能使指示剂变色。
6.稀释浓硫酸的方法口诀:“稀释浓硫酸,应防酸飞溅,要把浓酸注入水,同时再搅拌”。
说明:“应防酸飞溅”,是因为浓硫酸溶于水时会放出大量的热,如果把水注入浓硫酸里,水的密度较浓硫酸小,会浮在酸上面,溶解时放出的热会使水立即沸腾,使硫酸液滴向四周飞溅。
7.硝酸、浓硫酸跟金属反应口诀:“硝酸浓硫酸,氧化性很强,遇到金属后,生水不生氢”。
说明:“生水不生氢”是指生成水而不生成氢气。
8.金属活动性顺序的意义及应用口诀:<1>意义:“金属位置越靠前,金属活动性越强。
初中酸碱指示剂变色口诀

初中酸碱指示剂变色口诀酸碱指示剂是一种常用于化学实验的试剂,通过变色来指示溶液的酸碱性质。
下面将为大家介绍几个常见的酸碱指示剂及其变色口诀。
1. 茚菲蓝:茚菲蓝是一种常见的酸碱指示剂,它在酸性溶液中呈红色,而在碱性溶液中呈蓝色。
我们可以使用“红蓝分明,酸性红如血”这个口诀来记忆茚菲蓝的变色规律。
2. 甲基橙:甲基橙是另一种常用的酸碱指示剂,它在酸性溶液中呈红色,而在碱性溶液中呈黄色。
我们可以使用“红黄分明,酸性红如火”这个口诀来记忆甲基橙的变色规律。
3. 甲基红:甲基红在酸性溶液中呈红色,而在碱性溶液中呈黄色。
我们可以使用“红黄分明,酸性红如火”这个口诀来记忆甲基红的变色规律。
4. 酚酞:酚酞在酸性溶液中呈无色,而在碱性溶液中呈红色。
我们可以使用“无色如水,碱性红如血”这个口诀来记忆酚酞的变色规律。
5. 金黄色素:金黄色素在酸性溶液中呈橙黄色,而在碱性溶液中呈红色。
我们可以使用“橙红两变,酸性橙如金”这个口诀来记忆金黄色素的变色规律。
6. 酸性紫:酸性紫在酸性溶液中呈红色,而在碱性溶液中呈蓝色。
我们可以使用“红蓝分明,酸性红如血”这个口诀来记忆酸性紫的变色规律。
以上是几种常见的酸碱指示剂及其变色规律,通过口诀的记忆,可以更加轻松地掌握它们的用途及变色特点。
在化学实验中,酸碱指示剂的正确使用可以帮助我们准确判断溶液的酸碱性质,保证实验结果的准确性。
需要注意的是,在使用酸碱指示剂时,要根据具体的实验要求选择合适的指示剂,并严格掌握其变色规律,以免产生误判。
此外,酸碱指示剂的保存也很重要,应避免阳光直射和潮湿环境,以免影响其性质和使用效果。
酸碱指示剂是化学实验中常用的试剂,通过变色来指示溶液的酸碱性质。
通过口诀的记忆,我们可以更加轻松地掌握几种常见酸碱指示剂的变色规律,从而提高实验的准确性和效果。
希望本文对大家有所帮助!。
2019中考化学知识点:学习酸碱盐的必备口诀

2019中考化学知识点:学习酸碱盐的必备口诀新一轮复习备考周期正式开始,为各位初三考生整理了各学科的复习攻略,主要包括中考必考点、中考常考知识点、各科复习方法、考试答题技巧等内容,帮助各位考生梳理知识脉络,理清做题思路,希望各位考生可以在考试中取得优异成绩!下面是《化学知识点:学习酸碱盐的必备口诀》,仅供参考!学习酸碱盐的必备口诀1.电离口诀:“电离电离,遇水便离”。
说明:“遇水便离”是指酸、碱、盐在溶解于水时便同时发生电离,并不是通电后才发生电离。
2.酸碱盐溶液导电原因口诀:“溶液能导电,原因仔细辨,光有离子还不行,自由移动是关键”。
说明:“光有离子还不行,自由移动是关键”是指如果溶液中存在离子,若这些离子不能自由移动,该溶液仍不能导电。
只有溶液中存在自由移动的离子时,溶液才能导电。
3.浓盐酸的特性口诀:“无色刺激有酸味,浓酸挥发成白雾;要问白雾是什么,它是盐酸小液滴”。
说明:若将“它是盐酸小液滴”改为“它是硝酸小液滴”,即成为浓硝酸的特性。
4.浓硫酸的特性口诀:“无色粘稠油状液,不易挥发把水吸;腐蚀皮肤使碳化,沾上硫酸用布拭”。
说明:“把水吸”是指浓硫酸有吸水性,从而推知浓硫酸可作干燥剂。
“沾上皮肤用布拭”是指如果皮肤上沾上硫酸,应立即用布拭去,再用水冲洗。
而不能象处理其它酸一样先用水洗。
5.指示剂遇酸、碱溶液变色口诀:“石蕊遇酸紫变红,酚酞遇酸影无踪;石蕊遇碱紫变蓝,酚酞遇碱红艳艳。
” 说明:“影无踪”是指无色酚酞试液遇酸不变色(仍为无色)。
“石蕊遇碱”、“酚酞遇碱”,这里的碱是指碱溶液。
若是不溶性碱,则不能使指示剂变色。
6.稀释浓硫酸的方法口诀:“稀释浓硫酸,应防酸飞溅,要把浓酸注入水,同时再搅拌”。
说明:“应防酸飞溅”,是因为浓硫酸溶于水时会放出大量的热,如果把水注入浓硫酸里,水的密度较浓硫酸小,会浮在酸上面,溶解时放出的热会使水立即沸腾,使硫酸液滴向四周飞溅。
7.硝酸、浓硫酸跟金属反应口诀:“硝酸浓硫酸,氧化性很强,遇到金属后,生水不生氢”。
化学酸碱指示剂变色的记忆秘诀(适用于初中高中)

化学酸碱指示剂变色的记忆秘诀(适用于初中生、高中生)
酚酞遇酸不变色,酚酞遇碱变红色,石蕊遇酸变红色,石蕊遇碱变蓝色。
下一页的背诵口诀,只有7个字,但笔者保证你看完后立刻能背诵出酸碱指示剂变色规律,而且看完这7个字(不是背诵完),笔者保证你一辈子搞不错酸碱指示剂变色规律!考试时永远答不错酸碱指示剂变色规律题!而考试时你可能就差这2分!
这就是特殊记忆的魅力!这就是非正常记忆的魅力!
就这四句话,每一届都难倒大片大片学生,学生的指示剂考题的得分率向来很低,因为这四句话包含了酸、碱、酚酞、石蕊、不变色、红、蓝7种因素。
很易搞混。
正常的逻辑思维难以推导出记忆方法,初中生学化学,大多讨厌背诵化学酸碱指示剂变色规律。
高中生也是看到指示剂考题就犯晕。
酚酞变色的记忆
酚酞:口诀三个字:太监红。
太监只能红, (现在电视剧中都演太监,太监很红)
解释:太(酚酞的酞)监(酸碱的碱)红(变红) 酚酞的”酚”是粉的谐音,粉可以视为白色与红色的调和色,所以酚酞遇酸不变色。
要说明的是酚酞只能检验碱,检验不出酸,因为酚酞遇水,酸及其他中性溶液都不变色。
所以说“太监只能红”含义是酚酞只能检验碱,这时变红。
石蕊石蕊遇碱变蓝的记忆
口诀四个字:石蕊碱蓝
秘诀:光看字的偏旁,石蕊的石可以看成石字旁.蕊带草字头。
碱字带石字旁,蓝色的蓝也带草字头。
所以,石蕊遇碱变蓝,石蕊碱蓝四个关键的字的偏旁是一样的,甚至连顺序都一样。
石蕊,好像是某种花蕊,当然应该有红色。
反之,石蕊遇酸变红(石蕊遇酸变红无背诵窍门,需用石蕊遇碱变蓝推导)。
化学物质颜色和化合价口诀

一、初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
二、初中化学溶液的酸碱性1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)3、显中性的溶液:水和大多数的盐溶液三、初中化学敞口置于空气中质量改变的(一)质量增加的1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(二)质量减少的1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;2、由于风化而减少的:碳酸钠晶体。
四、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
【高中化学】必记的化学规律,高分必记!
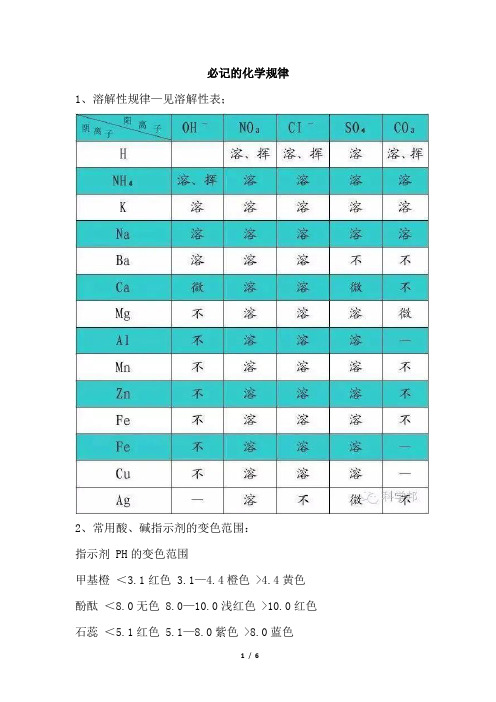
必记的化学规律1、溶解性规律—见溶解性表;2、常用酸、碱指示剂的变色范围:指示剂 PH的变色范围甲基橙<3.1红色 3.1—4.4橙色 >4.4黄色酚酞<8.0无色 8.0—10.0浅红色 >10.0红色石蕊<5.1红色 5.1—8.0紫色 >8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+ >Ag+>Hg2+ >Cu2+ >Pb2+ >Fa2+ >Zn2+ >H+ >Al3+>Mg2+ >Na+ >Ca2+ >K+阳极(失电子的能力):S2- >I- >Br– >Cl- >OH- >含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au 除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑5、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl + 2H2O = H2↑ + Cl2↑ + 2KOH配平:2KCl + 2H2O =H2↑ + Cl2↑ + 2KOH6、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 试写出作为原电池(放电)时的电极反应。
写出二个半反应:Pb –2e- → PbSO4 PbO2 +2e- → PbSO4分析:在酸性环境中,补满其它原子:应为:负极:Pb + SO42- -2e- = PbSO4正极:PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:为:阴极:PbSO4 +2e- = Pb + SO42-阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱指示剂
•酸碱指示剂:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
•紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
•易错点:
①变色的是指示剂,而不是酸或碱的溶液。
如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使
盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定
是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。
如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
•酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。
这些植物色素可以用作石蕊和酚酞等指示剂的代用品。
一些植物的色素及其在酸碱性溶液中的颜色变化如下:。
