植物叶绿素类胡萝卜素测定方法
植物叶绿素类胡萝卜素测定方法

叶绿素、类胡萝卜素含量的测定一、原理根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量;根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C 和液层厚度L成正比,即A=αCL式中:α比例常数;当溶液浓度以百分浓度为单位,液层厚度为1cm 时,α为该物质的吸光系数;各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得;如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和;这就是吸光度的加和性;今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b及类胡萝卜素在该波长下的吸光系数即可求出其浓度;在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰;二、材料、仪器设备及试剂一材料:新鲜或烘干的植物叶片;二仪器设备:1分光光度计;2电子顶载天平感量;3研钵;4棕色容量瓶; 5小漏斗;6定量滤纸;7吸水纸; 8擦境纸;9滴管;三试剂:195%乙醇或80%丙酮v丙酮:v乙醇=2:1的95%水溶液;2石英砂;3碳酸钙粉; 暗中2h,,25ml三、实验步骤1取新鲜植物叶片或其它绿色组织或干材料,擦净组织表面污物,剪碎去掉中脉,混匀;2将取好的样品放入25ml容量瓶中,加混合浸提液无水乙醇:丙酮=5:520ml,放在黑暗条件下,浸泡至叶片发白,用浸提试剂定容至25ml,摇匀备用;3把叶绿体色素提取液倒入1cm光径的比色皿内,以浸提试剂为空白测定吸光度;选择波长663 646 和470nm;四、实验结果计算叶绿素a 的浓度 = OD 633 – OD 646叶绿素b 的浓度 = OD 646– OD 663类胡萝卜素浓度=÷229 单位 mg/L Cmg/L 提取液总量ml叶绿体色素含量mg/g= ____________________________ 烟叶重量g1000注意事项:操作避光研磨时间短些。
植物类胡萝卜素含量检测试剂盒说明书 可见分光光度法

植物类胡萝卜素含量检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4330规格:50T/48S产品简介:类胡萝卜素(carotenoid)是一类重要的天然色素的总称,普遍存在于动物、高等植物、真菌、藻类的黄色、橙红色或红色的色素之中。
类胡萝卜素是体内维生素A的前体,同时还具有抗氧化、免疫调节、抗癌、减轻心血管疾病及着色剂等作用。
植物的类胡萝卜素存在于各种黄色质体或有色质体内;如黄叶,黄色花卉,黄色和红色的果实和黄色块根等组织,样本通过溶剂萃取,分离提取类胡萝卜素,在440±10nm处有特殊吸收峰。
大部分高等植物和藻类微生物的叶绿体内也含有类胡萝卜素,类胡萝卜素主要吸收蓝紫光,而叶绿素a 和叶绿素b既吸收红光又可吸收蓝紫光。
所以针对含叶绿体的组织,为排除叶绿素a和叶绿素b对类胡萝卜素的干扰,根据经验公式先计算出叶绿素a和叶绿素b的含量,再进一步得出类胡萝卜素的含量;针对不含叶绿素的组织可以直接根据类胡萝卜素的经验消光系数进行计算试验中所需的仪器和试剂:可见分光光度计、台式离心机、1mL玻璃比色皿、天平、可调式移液枪、研钵/匀浆器、10mL离心管/试管、蒸馏水和丙酮。
产品内容:提取液:自备,80%丙酮,即将丙酮:蒸馏水(V:V)=4:1混合待用。
试剂一:粉剂×1瓶,4℃保存。
操作步骤:一、样本制备:1、新鲜植物叶片(去掉中脉)或其他组织用蒸馏水洗干净,然后吸干表面水分,称取约0.1g,剪碎放入研钵或匀浆器中。
2、加入1mL蒸馏水,少量试剂一(约10mg),在黑暗或弱光条件下充分研磨,转入10mL离心管或试管中。
3、用提取液冲洗研钵或匀浆器,将所有冲洗液转入10mL 离心管或试管中,用提取液定容至10mL,置于黑暗条件或者包上锡箔纸浸提3h (期间可以颠倒混合2次),观察底部组织残渣接近于白色则提取完全,若组织残渣未完全变白,继续浸提至组织残渣颜色接近于白色。
植物体叶绿素含量的测定实验报告

实验报告植物体叶绿素含量的测定摘要:本实验采用分光光度法,利用95%乙醇提取菠菜叶片中和番茄叶片中叶绿体色素,叶绿素a ,叶绿素b 和类胡萝卜素最大吸收峰的波长分别是665nm 、649nm 和470nm 。
根据分光光度计测定的吸光度值,从而计算出乙醇提取液中叶绿体色素含量。
实验原理:利用95%乙醇提取叶绿体色素,叶绿素a ,叶绿素b 和类胡萝卜素最大吸收峰的波长分别是665nm 、649nm 和470nm 。
根据分光光度计测定的吸光度值,可以计算出乙醇提取液中叶绿体色素含量。
实验目的:掌握分光光度计法对叶绿素a 、叶绿素b 、叶绿素总浓度和类胡萝卜素总浓度测定和计算的方法。
实验材料:生物材料:菠菜叶片0.25g ,自己培养的全素番茄苗叶片0.2g ,缺磷番茄苗叶片0.2g ;试剂:95%乙醇、石英砂、碳酸钙;仪器:分光光度计、电子天平、研钵、漏斗、玻璃棒、小烧杯、10ml量筒、50ml 容量瓶、剪刀、滤纸、滴管。
实验步骤:1.叶绿体色素的提取取新鲜菠菜叶片0.25g ,擦干,去中脉,剪碎放入研钵,加入少许石英砂和CaCO 3,再加入95%乙醇3ml,研磨成匀浆,再加95%乙醇10ml ,静置10min ,用漏斗滤去残渣,用乙醇反复冲洗研钵、残渣至无色;用容量瓶定容至50ml 。
2.吸光度的测定取光径1cm 比色杯,注入上述叶绿素提取液,以95%乙醇注入另一同样的比色杯内作为空白对照,在波长665、649、和470nm 下测定吸光度。
3.结果计算依据下列计算公式,分别计算出叶绿素a 、B 的浓度及其叶绿素总浓度和类胡萝卜素的浓度。
C a (叶绿素a )=13.95A 665 – 6.8A 649C b (叶绿素b )=24.96A 649 – 7.32A 665C T (叶绿素)=C a +C b =18.16A 649 + 6.63A 665C x.c (类胡萝卜素)=(1000A 470 – 2.05C a -114.8C b )/248叶绿体色素含量 = )样品鲜重(稀释倍数)提取液体积()色素浓度(g /mg ⨯⨯L L实验结果:菠菜叶片提取液吸光值:1、测定叶绿素ab为什么选用红光波长?叶绿素吸收红光和蓝紫光,故有两个吸收峰,光合色素还有类胡萝卜素,只吸收蓝紫光,所以不能选蓝紫光区测定,否则被类胡萝卜素干扰,只能用红光。
叶绿素测定分光光度法

叶绿体色素含量的测定——分光光度法叶绿体色素含量的测定——分光光度法叶绿体色素溶液各组成成分在可见光谱中具有不同的特征吸收峰。
因此,应用分光光度计在某一特定波长下所测定的吸光度,根据经验公式即可计算出色素溶液中各色素浓度,不同溶剂所提取的色素吸收光谱有差异,因此,应使用不同的计算公式。
叶绿体色素的提取常用丙酮和乙醇有机溶剂。
叶绿体色素80 %丙酮提取液中叶绿素a 和 b 及类胡萝卜素分别在663nm 、646nm 和470nm 波长下有最大吸收峰,而95 %乙醇提取液中它们则在665nm 石49nm 和470nm 波长下具有最大吸收峰,据此所测得的吸光度值代人不同的经验公式(见结果计算),计算出叶绿体色素丙酮(或乙醇)提取液中叶绿素 a 和 b 的浓度及其叶绿素总浓度和类胡萝卜素的总浓度,并依据所使用的单位植物组织(鲜重、干重或面积),求算出色素的含量。
[ 实验目的]掌握分光光度法对植物叶绿体色素提取液中叶绿素 a 和 b 的浓度及其叶绿素总浓度和类胡萝卜素的总浓度测定与计算方法,以及植物材料中各种色素含量的求算方法。
[ 器材和试剂]1 .植物材料新鲜(或烘干)植物叶片,如菠菜叶片等。
2 .实验器材分光光度计、天平、研钵、剪刀、漏斗、滤纸、棕色容量瓶、吸水纸、擦镜纸和滴管。
3 .实验试剂80 %丙酮(或95 %乙醇)、石英砂和碳酸钙粉。
[ 操作步骤]1 .色素的提取①称取新鲜(或干材料)的洗净擦于的植物叶片0.5g (或一定面积),去中脉、剪碎后放入研钵中,加少量石英砂和碳酸钙粉及2~3ml80 %丙酮(或95 %乙醇),冰浴中研磨至组织变白,再加丙酮10ml ,研成匀浆,暗处静置约10m in 。
②将提取液过滤到50 ml 棕色容量瓶中,用丙酮反复冲洗研体与研棒数次并用少量丙酮反复冲洗滤纸和残渣,直至无绿色为止,以使色素全部转移入容量瓶。
最后用丙酮定容至50 ml ,摇匀,并保存于暗处备用待测。
生理指标的测定2

1 色素含量的测定(叶绿素、类胡萝卜素)采用95%乙醇浸泡法(李合生,2000),称取剪碎的新鲜样品0.1g放入试管中,取95%乙醇15ml,在黑暗条件下浸泡24h,期间摇晃2-3次,至叶片表面变白,取上清液,在波长665nm、649nm、470nm下测定吸光度。
计算公式:叶绿素a(mg/L)=13.95*OD665-6.88*OD649叶绿素b(mg/L)=24.96*OD649-7.32*OD665总叶绿素=(6.63* OD665+18.08* OD649)*15/100类胡萝卜素(mg/L)=(1000OD470-2.05C a-114.8C b)/245色素含量(mg/g)=(色素浓度×提取液体积×稀释倍数)/样品鲜重2 细胞膜透性的测定取新鲜样品1g放入试管中,取25ml蒸馏水,浸泡1h,测得此时电导率值a,再至于沸水浴中处理15min,冷却至室温,测得电导率值b,细胞膜透性=a/b。
注意:煮后一定要冷却到室温才测,可以用冰,煮过后值大致相同。
3 组织含水量的测定4 类黄酮及总酚含量的测定取1g样品(一般用粉末),加入1%的盐酸甲醇溶液(量取27ml分析纯盐酸用分析纯甲醇定容到1000ml)25ml,浸提2h,过滤到50ml容量瓶中,用盐酸甲醇溶液定容到刻度,在325nm和280nm进行比色,分别测定类黄酮和总酚的含量。
4.1.4.8多酚氧化酶(PPO)的测定方法粗酶液的制备:称取西兰花花蕾部分1.0g,加入磷酸缓冲液印pH6.8,0.05m。
比,含l%聚乙烯毗咯烷酮)20mL,冰浴匀浆,离心Zomin(r0000Xg,4oC),上清液即为粗酶液。
酶活性测定:磷酸缓冲液印H6.8,0.05m川几)1.5mL,加入0.1mo比儿茶酚底物2.0mL,35℃保温巧min;再加入0.5mL酶液后迅速混匀,每隔105记录吸光度值灿2。
的变化,共记录3min,试验重复3次。
酶活性以U德.min表示,以翰。
实验二蔬菜中胡罗卜素的测定 (纸层析法) 营养与食品卫生

(7)层析
点样:准确吸取待检液40μl在滤纸下端基线上A、B两 点之间或C、D两点之间迅速来回进行带状点样一次点 完(见图1)。每个样品点2带作为平行样。
首都医科大学
Page 8
营养与食品卫生学
展开:
待纸上所点样液自然挥发干后,将滤纸卷成圆筒状,用定 书机固定两边,置于预先用石油醚饱和的层析缸中(见图 2),进行上行展开。(注意纸纹方向与展开方向一致; 缸内石油醚深度约1cm即可,样斑不能直接接触石油醚。
首都医科大学
Page 10
营养与食品卫生学
五、计算
式中:X2——样品中胡萝卜素的含量,以β
-胡萝卜素计,mg/100g; c——在标准曲线上所查得的胡萝卜素
的含量,μg; V1——点样体积,ml; V2——加入瓷蒸发皿内的样品石油醚
提取液浓缩后的定容体积,ml; m——样品质量,g。
首都医科大学
首都医科大学
Page 5
营养与食品卫生学
(三)样品的采集和处理
(1)粮食:样品用水洗三次,置60℃烤箱 中烤干,磨粉,储于塑料瓶内,放一小包 樟脑精,盖紧瓶塞保存,备用。
(2)蔬菜与其他植物性食物:取可食部用 水冲洗三次后,用纱布吸去水滴,切碎, 用匀浆器制成匀浆,贮于塑料瓶内,冰箱 内保存备用。
营养与食品卫生学
实验二
蔬菜中胡罗卜素的测定 (纸层析法)
叶绿素含量的测定及计算

叶绿素含量的测定及计算叶绿素含量的测定及计算方法如下:1. 原理:根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长下测定其吸光度,即可用公式计算出提取液中各色素的含量。
2. 计算公式:根据朗伯-比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即:A=acl。
式中:a为比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm时,a 为该物质的吸光系数。
各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。
如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和,这就是吸光度的加和性。
3. 测定波长的选择:在测定叶绿素a、b时,为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。
已知叶绿素a、h的80%丙酮提取液在红光区的最大吸收峰分别为663 nm 和645 nm,又知在波长663 nm下,叶绿素a、b在该溶液中的吸光系数分别为82.04和9.27,在波长645 nm下分别为16.75和45.60。
4. 计算:叶绿素a(Ca)、叶绿素b(Cb)和类胡萝卜素(Cx)的浓度可以根据测定的波长吸光度计算得出。
计算公式如下:Ca=(13.95*A665-6.88*A649);Cb=(24.96*A649-7.32*A665);Cx=(1000*A470-2.05*Ca-114.8*Cb)/245。
5. 叶绿素含量计算:根据求得的色素浓度(mg/L),再计算出各色素含量(mg/g鲜重表示)。
叶绿素含量(mg/g)=(色素浓度mg/L * 提取液体积ml * 稀释倍数)/(1000 * 样品鲜重g)。
上述信息仅供参考,如果想要获取更多关于叶绿素含量测定的专业指导,可以查阅相关的学术文献或者咨询专业科研人员。
测定植物叶绿素含量的方法

测定植物叶绿素含量的方法
植物叶绿素是一种广泛存在于植物、藻类和一些细菌中的绿色色素,能够在吸收光子的过程中将光能转化为化学能。
因此,测定植物叶绿素含量是衡量植物光合作用效率的重要指标之一。
1. 乙醇提取法
将待测叶片粉碎后加入适量的95%乙醇中,放置于暗处浸泡数小时或过夜,然后离心收集上清液。
测定上清液吸光度,通过比较不同波长下的吸光度值,可计算出叶绿素a、叶绿素b和类胡萝卜素的含量。
将待测叶片粉碎后加入1.5mL 80%乙醇和0.5mL 1mol/L HCl的混合液中,振荡10分钟后加入玻璃珠摇匀,含有叶绿素的乙醇溶液将变为红褐色。
用0.22µm微孔滤纸过滤,取上清液,用分光光度计测定吸光度值后计算叶绿素含量。
3. 醋酸铜法
将待测叶片加入0.05%醋酸铜溶液中,用滚轴摇匀10分钟后过滤,取上清液后测定吸光度并计算叶绿素含量。
4. 液相色谱法
将待测叶片加入甲醇或乙腈中,使用高效液相色谱仪分析样品中的叶绿素和类胡萝卜素含量。
这种方法需要更为精确的仪器和技术,但可以同时测定多种色素。
无论使用哪种方法测定植物叶绿素含量,都需要注意以下几点:
1. 样品采集应在相同的时间、地点和光照条件下进行,以保证结果可比性。
2. 需要控制乙醇、醋酸铜等试剂用量、摇匀时间和过滤条件等因素,以获得准确的结果。
3. 对于不同种类和部位的植物,可能需要针对性地选择不同的测定方法,并对结果进行修正和比较。
烟叶中叶绿素和类胡萝卜素的测定
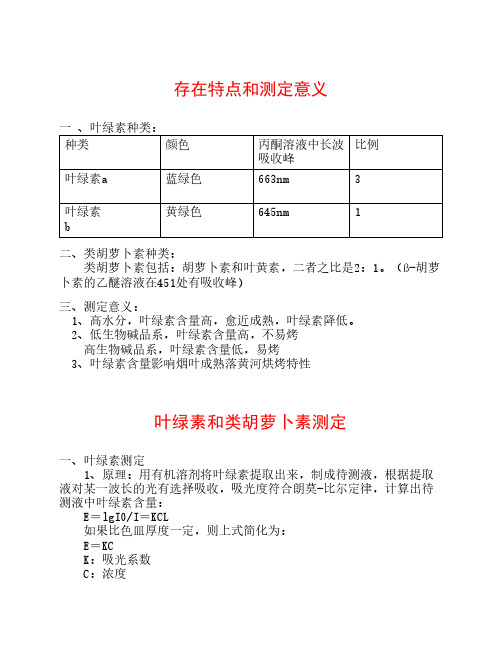
存在特点和测定意义一 、叶绿素种类:比例种类颜色丙酮溶液中长波吸收峰叶绿素a蓝绿色663nm3黄绿色645nm1叶绿素b二、类胡萝卜素种类: 类胡萝卜素包括:胡萝卜素和叶黄素,二者之比是2:1。
(ß-胡萝卜素的乙醚溶液在451处有吸收峰)三、测定意义: 1、高水分,叶绿素含量高,愈近成熟,叶绿素降低。
2、低生物碱品系,叶绿素含量高,不易烤 高生物碱品系,叶绿素含量低,易烤 3、叶绿素含量影响烟叶成熟落黄河烘烤特性叶绿素和类胡萝卜素测定一、叶绿素测定 1、原理:用有机溶剂将叶绿素提取出来,制成待测液,根据提取液对某一波长的光有选择吸收,吸光度符合朗莫-比尔定律,计算出待测液中叶绿素含量: E=lgI0/I=KCL 如果比色皿厚度一定,则上式简化为: E=KC K:吸光系数 C:浓度 如果待测液中含有2种以上有色物质,其吸光度也符合朗莫-比尔定律 溶液中含有2种有色物质时,有下式成立: Eλ1=Ka1 Ca+Kb1 Cb (1) Eλ2=Ka2 Ca+Kb2 Cb (2) 在叶绿素的待测液中含叶绿素a和b ,则有: E663=82.04Ca+9.27Cb (1)E645=16.75Ca+45.6Cb (2) E663=82.04Ca+9.27Cb (1)E645=16.75Ca+45.6Cb (2) 解联立方程式(1)和(2)得到: Ca=0.0127 E663-0.00259 E645 Cb=0.0229 E645-0.00467 E663 Ca+b=0.00805E663+0.0203E6452、测定步骤 ①待测液制备:0.5-2g样品于乳钵(研钵)内,加4倍体积的丙酮和约10mL 80%的丙酮,乳棒研磨。
用吸管仔细吸取抽出液转移到50mL容量瓶内,重向乳钵内加入10mL 80%的丙酮,继续研磨,合并抽出液,如此反复,直至研磨看不出有色素浸出为止,最后用80%丙酮定容到50mL,充分混匀,放冷暗处,使瓶内溶液澄清。
丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较

Abstract Chlorophyll and carotenoids m easurement by dim ethyl sulfoxide (DM SO ) and acetone extractions are two typ ical and popular methods used in p lant ecophysiological research. However, few studies on the compara2 bility between these two methods have been carried out. To answer this question, the contents of p igments in leaves and young branches of 19 woody species were measured in this study and we found the follow ing conclu2 sions. Firstly, chlorophyll a (Chla) , Chlb and total chlorophyll contents measured by the DM SO method were much higher than those measured by the acetone m ethod, however, the result of Chla / b ratio was slightly affect2 ed. Contrarily, carotenoids contents m easured by the acetone method were m uch higher than those m easured by DM SO m ethod. D irect comparison of these data w ill make serious bias; Secondly, both chlorophyll data and ca2 rotenoids data measured by these two methods were significantly linearly correlated. Thus, it is possible to use these linear relations to make data correction in comparative studies; Thirdly, unit differences also affect the data correlations of these two methods. W hen using the unit of fresh mass, the correlation was much higher than that unit of surface area; Fourthly, the influences of these two methods on the data p recision differed between leaves and branches. In the case of branches ( low chlorophylls) , two m ethods give slightly difference. However, the
叶绿素测定仪两种叶绿素测量方法介绍

叶绿素测定仪两种叶绿素测量方法介绍在研究柳树的生长状况时需要了解叶绿素对于柳树生长的影响。
叶绿素测量一般采用叶绿素测定仪进行。
该种仪器测量的优点在于采用光学原理测量叶绿素提取液光谱,根据公式计算出叶绿素含量,结果准确快捷。
如果想要使用叶绿素测定仪测定叶绿素a、b以及类胡萝卜素的含量,只需要测量提取液的特定波长光谱即可计算出含量。
叶绿素测定仪有两种操作方法,第一种是单手操作与快速田间测量。
单手操作意味着研究人员只需要使用一只手就可以通过仪器完成叶绿素的测量实验。
使用叶夹进行在荧光测量前的暗适应过程,在叶绿素测量时,只需要将测量探头放置于叶夹上,打开开叶夹遮光片。
将暗适应后的叶片暴露在由660nm固态光源提供的激发光下,测量光波,然后进行叶绿素计算。
叶绿素快速田间测量是指快速测量经过暗适应的叶片叶绿素值,是科研究人员进行植物胁迫实验的理想仪器。
叶绿素值可以通过仪器的液晶显示屏进行显示。
叶绿素测定仪可以存储最多20000条实验数据以及32条实验迹线,自动存储实验时间。
叶绿素测量数据可通过USB传输到电脑上进行总结和分析。
叶子实验报告

一、实验目的1. 了解植物叶片中色素的组成和功能。
2. 掌握从叶片中提取色素的方法。
3. 学习使用纸层析法分离和鉴定色素。
4. 了解不同光照条件下植物叶片色素的变化。
二、实验原理植物叶片中含有多种色素,如叶绿素、类胡萝卜素、花青素等,这些色素在光合作用过程中起着重要作用。
叶绿素是光合作用的主要色素,负责吸收光能并将其转化为化学能。
类胡萝卜素主要吸收蓝光和紫外光,对植物的生长发育也有重要作用。
花青素主要存在于叶片的表皮层,对植物的抗逆性有重要作用。
本实验采用无水乙醇作为提取剂,利用叶片中的色素在乙醇中的溶解度不同,通过纸层析法分离和鉴定不同色素。
三、实验材料与仪器1. 实验材料:新鲜菠菜叶片、无水乙醇、层析纸、滤纸、铅笔、剪刀、烧杯、滴管、酒精灯、烘箱等。
2. 实验仪器:天平、显微镜、离心机、比色计等。
四、实验步骤1. 叶片处理:将菠菜叶片洗净,晾干,用剪刀剪成细小碎片。
2. 色素提取:将剪好的叶片放入烧杯中,加入适量无水乙醇,用玻璃棒搅拌,使叶片中的色素充分溶解。
3. 离心:将提取液放入离心机中,以3000r/min的速度离心5分钟,取上清液备用。
4. 纸层析:将层析纸剪成适当长度,用铅笔在距离一端约1cm处画一条起始线,将上清液用滴管滴在起始线上,重复滴加3-4次,使色素点直径约为2mm。
5. 展开层析:将层析纸悬挂在烧杯上方,使层析纸的一端浸入装有层析液(如氯仿)的烧杯中,待层析液上升至离起始线约1cm处时,取出层析纸,晾干。
6. 色素鉴定:观察层析纸上的色素带,根据色素在层析液中的溶解度、颜色和形状进行鉴定。
7. 光照实验:将菠菜叶片放置在光照条件下,重复上述实验步骤,观察不同光照条件下叶片色素的变化。
五、实验结果与分析1. 色素提取:通过无水乙醇提取,菠菜叶片中的色素溶解在提取液中,颜色呈绿色。
2. 纸层析:在层析纸上,叶绿素a、叶绿素b、类胡萝卜素和花青素等色素带清晰可见。
- 叶绿素a:蓝绿色,位于层析纸的最下方。
植物叶绿体色素含量的测定

实验四植物叶绿体色素含量的测定高等植物光合作用过程中利用的光能是通过叶绿体色素吸收的。
叶绿体色素含量与光合作用密切相关,是反应叶片生理状态的重要指标。
在植物光和生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。
叶绿素含量也是知道作物栽培生产和选育作物品种的重要指标。
一、原理:根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公事计算出提取液中个色素的含量。
根据朗博—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=aCL。
式中:a为比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm时,a为该物质的吸光系数。
各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。
如果溶液中有数种吸光物质,则此混合溶液在某一波长下的吸光度等于各组分在相应波长下吸光度的总和。
这就是吸光度的加和性。
今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿体a、b及类胡萝卜素在该波长下的吸光系数即可求出其浓度。
在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。
二、植物材料、仪器设备及试剂配制:(一)植物材料:完全液和缺素溶液培养的烟草苗叶片(二)仪器设备:分光光度计、电子天平、剪刀1把、镊子一把、玻璃研钵2个、4个25mL具塞棕色容量瓶、漏斗2个、移液管若干只、吸球、洗瓶、玻璃棒、吸水纸、保鲜膜等。
(三)试剂配制:95%乙醇(分析纯)、石英砂和碳酸钙三、实验步骤:1.称取新鲜植物叶片,擦净组织表面污物,剪碎(去掉中脉),混匀。
2.称取剪碎的新鲜叶片0.2g,共4份,分别放入研钵中,加少量石英砂和碳酸钙及2mL95%乙醇,研成匀浆,在加入乙醇10mL,继续研磨至组织变白。
静置3~5min。
3.取滤纸1张,置漏斗中,用95%乙醇湿润,沿玻璃棒把提取液倒入漏斗中,过滤到25mL棕色容量瓶中,用少量95%乙醇冲洗钵体、研棒及残渣数次,最后连同残渣一起倒入漏斗中。
叶绿素等的测定方法

叶绿素等的测定方法叶绿素是存在于植物和藻类细胞中的一种绿色色素,它在光合作用中起着关键作用。
因此,测定叶绿素及其相关的测定方法对于研究植物生理学、光合作用机理以及环境生态学等方面具有重要意义。
下面将介绍几种常用的叶绿素测定方法。
1.全光谱扫描法全光谱扫描法可以用于测定叶绿素a、叶绿素b以及类胡萝卜素的含量。
该方法基于不同波长下叶绿素和类胡萝卜素的吸光度差异,通过测量样品在300-800nm范围内的吸光度来确定其含量。
全光谱扫描法准确度较高,但需要较贵的设备。
2.分光光度法分光光度法是一种常用的测定叶绿素含量的方法。
该方法基于叶绿素和类胡萝卜素在不同波长下的吸光度差异,通过选择波长进行测定。
常用的波长包括470nm、645nm和663nm等。
该方法简单、快速,并且可以用于高通量样品测定。
3.乙醇提取法乙醇提取法是一种常用的叶绿素提取和测定方法。
该方法将叶样品放入乙醇等有机溶剂中,通过溶剂提取叶绿素并使其溶于溶剂中,然后使用分光光度法或高效液相色谱法等测定溶液中叶绿素的含量。
乙醇提取法可以快速提取样品中的叶绿素,适用于大量样品的测定。
4.高效液相色谱法高效液相色谱法是一种高精度的叶绿素测定方法。
该方法基于叶绿素在特定条件下在高效液相色谱柱中的分离和检测,通过测定样品中叶绿素的峰面积或峰高来确定其含量。
高效液相色谱法准确度高,但需要较为复杂的仪器和操作技术。
除了以上介绍的常用方法外,还有一些新兴的测定方法不断涌现,例如荧光光谱法、激光诱导荧光法、红外反射法等。
这些新方法在提高测定精度、扩展测定范围和降低测定成本方面具有优势,正在逐渐得到广泛应用。
综上所述,叶绿素测定方法多种多样,每一种方法都有其特点和适用范围。
在选择合适的测定方法时,需要考虑实验目的、样品种类、所需精度、设备条件和实验操作难易程度等因素,以确定最适合的测定方法。
叶绿素含量的测定

植物生理学实验报告实验题目:叶绿素含量的测定姓名班级学号一、实验原理和目的根据朗伯—比尔定律,某有色溶液的吸光度 A 与其中溶质浓度 C 和液层厚度L 成正比。
叶绿素(丙酮)在652nm(混合)、663nm、645nm 有最大吸收峰。
叶绿素(95%乙醇)在665nm、649nm,类胡萝卜素在470nm 有最大吸收峰,根据在分光光度计下测定的吸光度,求得叶绿素的含量二、实验器具和步骤植物材料:女贞实验器具:分光光度计;电子天平;研钵;试管;小漏斗;滤纸;吸水纸;移液管;量筒;剪刀试剂:95%乙醇(或80%丙酮);石英砂;碳酸钙粉步骤:1.称取剪碎的新鲜样品0.1g 左右,放入研钵中,加少量石英砂和碳酸钙粉及3~5ml 95%乙醇,研成均浆,继续研磨至组织变白。
静置3~5min2.取滤纸1 张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到10ml 试管中,用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。
3.用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入漏斗中。
直至滤纸和残渣中无绿色为止。
最后用乙醇定容至10 ml ,摇匀4.把叶绿体色素提取液倒入光径1cm 的比色杯内。
以95%乙醇为空白,在波长665nm、649nm、470nm 下测定吸光度5.计算公式:叶绿素的含量(mg/g)= (浓度×提取液体积×稀释倍数)/样品鲜重。
Ca=13.95A665-6.88A649;Cb=24.96A649-7.32A665C 类=(1000A470-2.05Ca-114.8Cb)/245单位:mg/L三、实验数据和作业2、计算叶绿素含量计算公式:叶绿素的含量(mg/g)= (浓度×提取液体积×稀释倍数)/样品鲜重。
Ca=13.95A665-6.88A649;Cb=24.96A649-7.32A665C 类=(1000A470-2.05Ca-114.8Cb)/245单位:mg/L由上面的公式进行代入计算,有:Ca=13.95*1.820-6.88*0.953=18.83236Cb=24.96*0.953-7.32*1.820=10.46448C 类=(1000*1.948-2.05*18.83236-114.8*10.46448)/245=2.8901则:叶绿素含量=(29.29684*10*0.001*1)/0.1=2.9297四、数据分析实验中可能清洗研钵和滤纸不是特别干净可能造成误差五、思考题为什么提取叶绿素时干材料一定要用80%的丙酮,而新鲜的材料可以用无水丙酮提取?答:因为叶绿素存在于叶绿体内囊体上与其上的蛋白质组成色素蛋白复合体,要分离叶绿素和蛋白质必须有水,叶绿素的头部为极性的,有亲水性。
高效液相色谱实验测定叶绿素

实验九高效液相色谱法同时测定叶绿素和类胡萝卜素学时:4一、实验目的1、了解高效液相色谱在叶绿体色素全分析的应用。
2、掌握生物样品的高效液相色谱实验技术。
3、初步掌握梯度洗脱实验技术。
二、实验原理从植物提取液分离出来的叶绿素和胡萝卜素已发现有多种异构体,而且常常是同时存在的。
因此对叶绿素和胡萝卜素的深入研究较为困难。
高效液相色谱既能对单一组分进行定量,又能对混合物中的多组分在分离的基础上进行定量。
既能用于主要成分的含量测定,又能用于微量和痕量组分的测定。
高效液相色谱是一种准确度好和精密度高的分析技术。
因此,尽管难以得到所有的植物色素标准品,但高效液相色谱技术仍被认为是研究叶绿素和胡萝卜素的一种最有效手段。
叶绿体色素提取液可以采用正相或反相高效液相色谱法分析,实验表明,反相高效液相色谱法更加方便。
但由于色素提取液各组分的极性差别较大,等度洗脱可能使某些组分的分离不够完全。
因此,对植物色素提取液的全分析应采用梯度洗脱方式以改善分离和缩短分析时间。
本实验采用高效液相色谱法可对绿色植物叶片提取液中的色素进行较全面的分离,并直接测定叶绿素a、叶绿素b和β-胡萝卜素的含量。
三、实验仪器与试剂1、仪器TSP高压梯度HPLC仪,3500-3200型高压梯度泵,UV-2000型双波长吸收检测器,Rheodyne 7725i六通进样阀,PC1000色谱工作站,微量进样器(100 µl),CQ - 50超声波除气装置,Hypersil BDS C18( 4.0mm×200 mm,5μm)。
2、试剂叶绿素a、叶绿素b和β-胡萝卜素纯品为Sigma公司产品,甲醇、二氯甲烷和乙腈为液相色谱淋洗剂,实验用水为二次去离子水(娃哈哈纯净水),经玻璃系统重蒸馏。
四、实验步骤1、色素的提取取0.5 g左右干净的新鲜的去脉菜叶,准确称重。
剪碎,置于研钵中,加0.1 g MgCO3和 5 mL 90% 丙酮,研磨至浆状,分次加入5 mL 丙酮,沥出提取液。
三七地上部分中叶绿素和类胡萝卜素的含量测定

三七地上部分中叶绿素和类胡萝卜素的含量测定杨晶晶;曲媛;崔秀明【期刊名称】《特产研究》【年(卷),期】2014(000)002【摘要】以不同产地的三七茎、叶和不同产地、不同生长年限的三七花为原材料,采用丙酮研磨法及紫外-可见分光光度法分析三七地上部分中叶绿素和类胡萝卜素的含量。
结果表明,三七茎、叶和花中均含有丰富的叶绿素和类胡萝卜素,不同样品中色素含量有明显差异,其中三七茎、叶中色素含量高于三七花,茎、叶和花中叶绿素含量的变化范围分别在2.12mg/g~4.48mg/g和0.73mg/g~1.55mg/g ,而类胡萝卜素含量的变化范围分别在0.24mg/g~0.53mg/g和0.08mg/g~0.17mg/g。
这为三七地上部分作为新资源食品提供数据支撑。
【总页数】4页(P63-66)【作者】杨晶晶;曲媛;崔秀明【作者单位】昆明理工大学生命科学与技术学院,昆明 650500; 昆明理工大学云南道地药材研究开发中心,昆明 650500;昆明理工大学生命科学与技术学院,昆明 650500; 昆明理工大学云南道地药材研究开发中心,昆明 650500;昆明理工大学生命科学与技术学院,昆明650500; 昆明理工大学云南道地药材研究开发中心,昆明 650500【正文语种】中文【中图分类】R284.2【相关文献】1.丹参地上部分抗动脉粥样硬化活性部位中齐墩果酸和熊果酸的含量测定研究 [J], 李彧;曾荣洁;欧惠根;陈建忠2.糖脂康中试产品中藻蓝素、叶绿素、类胡萝卜素含量测定 [J], 钱金袱;左绍远;张学清;杨云川3.不同方法对龙胆中地上部分有效成分的含量测定 [J], 江蔚新;安胜利;尹清永;杨红梅;江淼4.当归地上部分中绿原酸和金丝桃苷的含量测定 [J], 胡淑毅;刘东来5.三七地上部分提取总皂苷及人参皂苷Rb3工艺研究 [J], 胡庆普;焦家良;付翠花;朱姝;潘杰;杨炳治因版权原因,仅展示原文概要,查看原文内容请购买。
实验4 叶绿体色素的吸收光谱曲线及含量的测定

实验二叶绿体色素吸收光谱曲线及含量的测定一、实验目的掌握分光光度计的使用方法,学会绘制叶绿体色素的吸收光谱曲线。
了解叶绿体色素含量测定的原理,掌握叶绿体色素含量测定的方法。
二、实验原理叶绿素与类胡萝卜素都具有光学活性,表现出一定的吸收光谱,可用分光光度计精确测定。
叶绿素吸收光谱最强的吸收区有两个:一个在波长640~660nm的红光部分,另一个在波长430~450nm的蓝紫光部分。
在光谱的橙光、黄光和绿光部分只有不明显的吸收带,其中尤以对绿光的吸收最少。
胡萝卜素和叶黄素的最大吸收带在蓝紫光部分,不吸收红光等长波的光。
根据朗伯一比尔定律,某有色溶液的吸光度D与其中溶液浓度C和液层厚度L成正比,即:D=KCLD:吸光度,即吸收光的量,C:溶液浓度,K:为比吸收系数(吸光系数),L:液层厚度,通常为1cm。
95 %乙醇提取液中叶绿素a 和b 及类胡萝卜素分别在在665nm 、649nm 和470nm 波长下具有最大吸收峰,据此所测得的吸光度值代人不同的经验公式(见结果计算),计算出叶绿体色素乙醇提取液中叶绿素 a 和 b 的浓度及其叶绿素总浓度和类胡萝卜素的总浓度,并依据所使用的单位植物组织(鲜重、干重或面积),求算出色素的含量。
三、实验材料及器材仪器及试剂:研钵、量筒、滴定管、烧杯、比色杯、滤纸、脱脂棉、分光光度计、95%乙醇材料:菠菜叶片四、实验步骤1、提取称取1g菠菜叶片,加入少许95%乙醇,研磨,用量筒定容至25ml。
2、吸收光谱去1ml提取液,加3ml95%乙醇,置于比色杯中,用95%乙醇作为对照,在400~700nm 之间每隔20nm测一次光,记录波长和吸光度D于下表中,并在标准绘图纸上绘出叶绿体色素的吸收光谱曲线。
λ(nm)400 420 440 460 480 500 …... 600 620 640 660 680 700 A3、将色素提取液充分混匀后,取光径1cm 的比色杯,注入提取液,以95%乙醇作为空白对照,在波长665nm 、649nm 和470nm 下测定吸光度(、和)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物叶绿素类胡萝卜素测定方法
叶绿素、类胡萝卜素含量的测定
一、原理
根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。
根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A,αCL式中:α比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。
各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。
如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。
这就是吸光度的加和性。
今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b及类胡萝卜素在该波长下的吸光系数即可求出其浓度。
在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。
二、材料、仪器设备及试剂
(一)材料:新鲜(或烘干)的植物叶片。
(二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸; 8)擦境纸;9)滴管。
(三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。
暗中2h,0.5g,25ml
三、实验步骤
1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。
2)将取好的样品放入25ml容量瓶中,加混合浸提液(无水乙醇:丙酮
=5:5)20ml,放在黑暗条件下,浸泡至叶片发白,用浸提试剂定容至25ml,摇匀备用。
3)把叶绿体色素提取液倒入1cm光径的比色皿内,以浸提试剂为空白测定吸光度。
选择波长663 646 和470nm。
四、实验结果计算
叶绿素a的浓度 = 12.21 , OD– 2.81 , OD 633 646
叶绿素b的浓度 = 20.13 , OD– 5.03, OD646663
类胡萝卜素浓度=(1000A-3.27C-104C)?229 单位 mg/L 470ab
C(mg/L)*提取液总量(ml)
叶绿体色素含量(mg/g)= ____________________________
烟叶重量(g)*1000
注意事项:操作避光研磨时间短些。
