2018届高考化学一轮复习考情分析检测第3章金属及其化合物3.2铝及其重要化合物教案
最新-2018年高考化学 第3章第3节铝及其重要化合物复习课件 精品

A.2.25 mol·L-1
B.2 mol·L-1
C.0.3 mol·L-1
D.0.6 mol·L-1
[自主解答]
根据最终溶液中电荷守恒和化学反应中质量守恒可得: n(H2SO4)=n(Na2SO4)=12n(NaOH)=12×3 mol·L-1×0.2 L=0.3 mol,
所以c(H2SO4)=00..315mLol=2 mol·L-1。 【答案】 B
3.(2011年无锡质检)将Mg、Cu组成的2.64 g混合物投入适量稀
硝酸中恰好反应,固体完全溶解时收集到的还原产物NO气体
0.896 L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液
60 mL时金属离子恰好沉淀完全。则形成沉淀质量为( )
A.4.32 g
B.4.68 g
C.5.36 g
V=0.15 L=150 mL
②求溶解部分Al(OH)3使之达到3.12 g时所需碱液体积。 Al(OH)3 + OH- = AlO- 2 + 2H2O
78 g (7.8-3.12) g
1 mol 2 mol·L-1·V
V=0.03 L=30 mL
即当加入150 mL+30 mL=180 mL NaOH溶液时, Al(OH)3沉淀亦为3.12 g。
2Al+6HCl = 2AlCl3 + 3H2↑
6 mol
3 mol
3 mol·L-1×0.1 L 0.15 mol
则Al与NaOH反应生成的H2为0.15 mol×2=0.3 mol
2Al+2NaOH+2H2O = 2NaAlO2 + 3H2↑
2×27 g
3 mol
5.4 g
0.3 mol
即投入的铝粉为5.4 g。
18届高考化学一轮复习考情分析检测第3章金属及其化合物3.2铝及其重要化合物新人教版

第3章 金属及其化合物 3.2检测时间:45分钟满分:100分一、选择题(每题6分,共66分)1.下列关于铝及其化合物的叙述正确的是( )A .氧化铝坩埚可用于熔融NaOH 实验B .铝与Fe 2O 3发生铝热反应,反应后固体物质增重C .氧化铝熔点很高,可作耐火材料D .明矾用作净水剂,可以除去废水中的铜离子答案 C解析 A 项,氧化铝能与NaOH 反应,氧化铝坩埚不能用于熔融NaOH 实验,错误;B 项,根据质量守恒定律,反应后固体物质的质量不变,错误;C 项,氧化铝熔点很高,可用于制耐火砖、耐火坩埚、耐火高温实验仪器,正确;D 项,明矾净水时Al 3+水解生成Al(OH)3胶体,可吸附水中不溶于水的杂质形成沉淀,从而起到净水作用,错误。
2.[2017·衡水模拟]下列叙述正确的是( )①含有大量AlO -2的溶液中,NH +4、NO -3、H +、Cl -可以大量共存②0.1 mol·L -1的AlCl 3溶液中,Na +、K +、SO 2-4、HCO -3可以大量共存③向AlCl 3溶液中加入过量的稀氨水,发生反应:Al 3++4NH 3·H 2O===AlO -2+4NH +4+2H 2O ④加入铝粉能放出H 2的溶液中,Ca 2+、Fe 2+、Cl -、NO -3一定能够大量共存⑤用NaOH 溶液除去铝条表面的氧化膜:Al 2O 3+2OH -===2AlO -2+H 2O⑥依据铝热反应原理,能发生反应2Al +3MgO=====高温3Mg +Al 2O 3⑦向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO 2-4+2Ba 2++Al 3++4OH -===2BaSO 4↓+AlO -2+2H 2O⑧常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH 溶液A .⑤⑦ B.③⑤ C.④⑥ D.⑦⑧答案 A解析 ①含大量AlO -2的溶液呈碱性,H +不能大量存在,错误;②Al 3+与HCO -3发生双水解反应:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑,不能大量共存,错误;③Al(OH)3不溶于NH 3·H 2O ,错误;④加入铝粉放出H 2的溶液,可能呈酸性,也可能呈碱性,若呈酸性,不能存在NO -3,若呈碱性,Ca 2+、Fe 2+不能大量共存,错误;⑥金属性:Mg>Al ,铝不能置换出Mg ,错误;⑧常温下,铝在浓硝酸中钝化,错误。
高考化学一轮复习学案课件(人教版)第3章金属及其化合物第2节铝及其重要化合物

(2)用途:①氧化铝是冶炼铝的原料,化学方程式为______________________; ②氧化铝是较好的耐火材料,可用于制造__________、________和耐高温的________ 等。 2. 氢氧化铝 (1)两性氢氧化物:电离方程式为______________________。 ①与盐酸反应的离子方程式:______________________。 ②与氢氧化钠溶液反应的离子方程式: ________________________________________________________________________。 (2)受热分解:化学方程式为______________________。
常温下,铝发 生____,加热 时剧烈反应
3. 镁、铝的制备
工业制备均用电解法,化学方程式分别为__________________________、 __________________________。
答案:
一、1. 银白 金属 较软 较小 < < < 2. 2Mg+O2==2MgO 4Al+3O2==2Al2O3 Mg+Cl2==MgCl2 2Al+3Cl2==2AlCl3 Mg+S==MgS
(1)铝与盐酸反应时,铝过量而盐酸不足。 (2)铝与氢氧化钠反应时,铝不足而氢氧化钠过量。
1. 向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体 b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全, 得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则 下列关系不正确的是( )
铝分别与盐酸、氢氧化钠溶液反应的原理
2Al+6HCl===2AlCl3+3H2↑ 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 1. 等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比=1∶1 2. 足量的铝分别与等物质的量的盐酸和氢氧化钠反应,产生氢气的体积比为=1∶3 3. 一定量的铝分别和一定量的盐酸和氢氧化钠反应,若产生氢气的体积比为(1/3,1) 则必定是:
2018版高考化学一轮总复习第三章金属及其化合物章末检测
第三章金属及其化合物[选题细目表]一、选择题(本题包括7个小题,每小题6分,共42分,每小题仅有一个选项符合题意)1.(2015·全国Ⅰ卷)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,过量的铁粉再与Fe(NO3)3发生反应:Fe+2Fe(NO3)3===3Fe(NO3)2,充分反应后滴加KSCN溶液,溶液不会变为红色,实验现象错误,故A不正确。
B项,铜粉与Fe2(SO4)3溶液发生反应:Cu+Fe2(SO4)3===CuSO4+2FeSO4,实验现象为溶液变蓝色,但是没有黑色固体出现,该实验能说明Fe3+的氧化性比Cu2+强,不能说明金属铁比铜活泼,因为铁没有置换出铜单质,故B不正确。
C项,用砂纸仔细打磨铝箔,能将铝箔表面的致密的氧化铝薄膜除去,但是在酒精灯上加热后,铝和空气中的氧气又生成了氧化铝,因为氧化铝的熔点高于铝的熔点,而氧化铝在铝的表面,所以加热铝箔的时候铝失去光泽,铝熔化但是不会滴落,实验现象不正确,故C不正确。
D项,向MgSO4溶液中加入NaOH 溶液发生反应:MgSO 4+2NaOH===Na 2SO 4+Mg(OH)2↓,有白色沉淀产生,再滴加CuSO 4溶液,白色沉淀转化为浅蓝色沉淀,发生反应为CuSO 4+Mg(OH)2===Cu(OH)2+MgSO 4,因为Cu(OH)2的溶度积比Mg(OH)2的溶度积小,发生了沉淀的转化,故D 正确。
答案:D2.金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。
某化学兴趣小组用实验探究Ti 、Mg 、Cu 的活泼性顺序。
他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:A .三种金属的活泼性由强到弱的顺序是Ti 、Mg 、CuB .若钛粉中混有Mg ,提纯Ti 时可用稀盐酸除去MgC .用Ti 从CuSO 4溶液中置换出Cu 是工业制取Cu 的很好途径D .Cu 和稀盐酸不发生化学反应解析:A 中,Ti 在盐酸中比Mg 放出气泡的速度慢,说明Ti 的金属活动性比Mg 弱,A 错;B 中,由于Ti 、Mg 均能与稀盐酸反应,故不能用此法提纯金属钛;C 中,由于Ti 是较为昂贵的金属,用Ti 来制造Cu ,成本上不划算。
高考一轮复习-化学 第3章 金属及其化合物3-2铝及其重要化合物

Al(OH)3 胶体可以和悬浮于水中的泥沙形成絮状不溶物而
沉降下来,使水澄清
,不能杀菌消毒,
与氯气消毒原理不同。
33
板块一
板块二
板块三
高考一轮总复习 ·化学
判断正误,正确的画“√”,错误的画“×”。 (1)向 1 mol·L-1 AlCl3 溶液中加过量的 6 mol·L-1 NaOH 溶液制备 Al(OH)3 悬浊液。(×) (2)明矾用作净水剂不涉及化学变化。(×) (3)向 NaAlO2 溶液中通入过量 CO2 制 Al(OH)3 的离子 方程式:CO2+AlO-2 +2H2O===Al(OH)3↓+HCO-3 。(√) (4)制备 AlCl3 不能采用将溶液直接蒸干的方法。(√ )
21
板块一
板块二
板块三
高考一轮总复习 ·化学
(5)甲、乙两烧杯中各盛有 100 mL 3 mol·L-1 的盐酸和 NaOH 溶液,向两烧杯中分别加入等质量的铝粉,反应结束 后,测得生成的气体体积比为 V(甲)∶V(乙)=1∶2,则加入 铝粉的质量为___A_____。
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
(2)2Al+2OH-+2H2O===2AlO-2 +3H2↑。其反应机理 应为:铝先与强碱溶液中的水反应生成 H2 和 Al(OH)3,然 后 Al(OH)3 再与 NaOH 反应生成 H2O 和 NaAlO2,反应中 铝作还原剂,水作氧化剂,NaOH 无电子得失。
13
板块一
板块二
板块三
高考一轮总复习 ·化学
2×27 g
3 mol
5.4 g
0.3 mol
即投入的铝粉为 5.4 g。
25
板块一
2018届高考化学一轮复习考情分析检测:第3章 金属及其化合物3-1 Word版含解析

时间:分钟满分:分一、选择题(每题分,共分).下列解释实验现象的反应方程式正确的是( ).切开的金属暴露在空气中,光亮表面逐渐变暗+.钠投入盛有溶液的烧杯中,产生无色气体与红褐色沉淀:+++()↓+++↑.在潮湿的空气中放置一段时间,变成白色黏稠物++.向溶液中加入过量的澄清石灰水,出现白色沉淀+++-↓++答案解析在空气中与反应生成,项错;钠投入盛有溶液的烧杯中,先与反应:①++↑,生成无色气体,与反应;②+()↓+,生成红褐色沉淀,将①②联立得离子方程式:+++()↓+++↑,项正确;在潮湿空气中吸水,生成,项错;澄清石灰水过量,则不可能以离子形式存在,项错。
.下列实验装置不能达到实验目的的是 ( )答案解析中反应放热导致大试管中气体压强增大,红墨水柱右侧上升;中胶头滴管中为浓溶液,能吸收较多的使圆底烧瓶中气体压强减小;焰色反应可用光洁无锈的铁丝、镍丝、钨丝等代替铂丝;中应将置于小试管中,置于大试管中,加热时右边烧杯中澄清石灰水变浑浊,左侧烧杯中澄清石灰水不变浑浊,说明热稳定性:>。
.[·江西联考]如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。
已知钠及其氧化物的物质的量均为,水的质量为。
下列说法正确的是( ).反应③最多能产生.反应①的离子方程式为+++-+↑.中阴阳离子数目之比为∶.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③答案解析与反应,过量,反应③最多能产生,选项正确;反应①的离子方程式应为+++-+↑,选项错误;中阴阳离子数目之比为∶,选项错误;①、②、③充分反应后所得溶液中溶质()的质量分数从大到小:③=②>①,选项错误。
.一定量和均匀混合物分成质量相等的甲乙两份。
将甲投入稀盐酸,固体完全溶解,收集到标准状况下的干燥气体。
再将生成的气体全部导入装有乙的干燥管中,充分吸收后,收集到一种单质气体,标准状况下体积为。
根据以上信息,下列有关推断不正确的是( ).甲乙两份混合物中均含.甲乙两份混合物中均含.原混合物中与物质的量之比无法确定.盐酸物质的量浓度可能为答案解析标准状况下,混合气体为与,共,单质气体为。
2018最新版本高考化学一轮复习3-2铝及其重要化合物课件(新人教版)
解析:根据Al与盐酸和NaOH反应的化学方程式,生成等量 的H2消耗的盐酸与NaOH物质的量之比为3:1。
答案:C
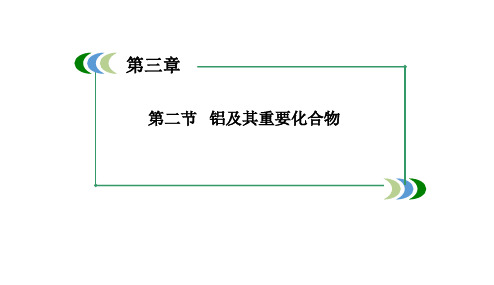
2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气 体的体积(V)与时间(t)关系如图。反应中镁和铝的( )
A.物质的量之比为3:2 B.质量之比为3:2 C.摩尔质量之比为2:3 D.反应速率之比为2:3
碱的反应,Al2O3、Al(OH)3的两性等基础知识上,还可能涉及 铝的重要化合物的用途,如明矾净水、含铝药品、食品的摄入 等与生活联系密切的内容。
自主复习
一、铝的主要性质及应用 1.物理性质 银白色有金属光泽的固体,有良好的 导电性、导热性 和延展 性,密度较小,质地柔软。 2.化学性质
写出图中有关反应的化学方程式或离子方程式:
(3)用途:是一种比较好的耐火材料,还可制作各种宝石。
2.氢氧化铝 (1) 白 色胶状不溶于水的固体,有较强的 吸附 性。 (2)化学性质:
写出图中有关反应的化学方程式或离子方程式:
+ 3+ Al(OH) + 3H ===Al +3H2O 3 ① - - Al(OH) + OH ===AlO 3 2 +2H2O ②
答案:C
2.(2013· 南昌一模)某溶液能与Al粉反应放出H2,该溶液中可 能大量共存的离子组是(
+ +
)
- -
A.NH4 、Ba2 、HCO3 、Cl B.K 、Al3 、S2 、ClO
+ + - + + - -
C.Na 、Fe3 、Cl 、SO2 4
+ + -
-
D.NH4 、Mg2 、SO2 4 、NO3
+ +
Fe2O3+6H ===2Fe3 +3H2O
+ +
(2)Al(OH)3能溶于强碱溶液但不溶于氨水,用氨水不能将 Fe(OH)3和Al(OH)3分离。
高考化学一轮复习 第3章 金属及其化合物 第2讲 镁、铝及其化合物课件.ppt

Ca2++SO24-===CaSO4↓,即产品 1 为 CaSO4。由表中数据,可
知 1 L 浓海水中含有 28.8 g Mg2+,则最多可得到产品 2 的
质
量
为
:
m[Mg(OH)2]
=
28.8 24
g·L-1×1 g·mol-1
L ×58
g · mol - 1 =
69.6 g。
(3)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反 应的化学方程式为:MgCl2(熔融)=电==解==Mg+Cl2↑,熔融 MgCl2 中若有少量的水存在,则会发生 Mg+2H2O=高==温==
1.(高考经典题)某同学通过系列实验探讨Mg及其化 合物的性质,操作正确且能达到目的的是( )
A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探 讨Mg的活泼性
B . 将 NaOH 溶 液 缓 慢 滴 入 MgSO4 溶 液 中 , 观 察 Mg(OH)2沉淀的生成
14
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗 中过滤,洗涤并收集沉淀 D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐 酸,加热蒸干得无水MgCl2固体
21
解析:(1)根据Cl、H、O三种元素守恒可知,在空气 中加热MgCl2·6H2O,除生成Mg(OH)Cl或MgO外, 还有HCl和H2O生成。
(2)为防止引入新杂质,可用MgCl2溶液或Mg(NO3)2 溶液将Ca(OH)2转化为Mg(OH)2,然后过滤、洗涤。
15
解析:本题考查镁及其化合物的性质、常见的基本 实验操作。稀释浓硫酸时,应将浓硫酸沿着器壁或 玻璃棒慢慢加入水中,并及时搅拌,A是错误的; 过滤时需要用玻璃棒引流,因此C不正确;蒸发溶 液时应该用蒸发皿而不是表面皿,由于MgCl2会发 生水解,所以加热时必需在HCl的气氛中加热才能 得到MgCl2固体,所以D不正确。 答案:B
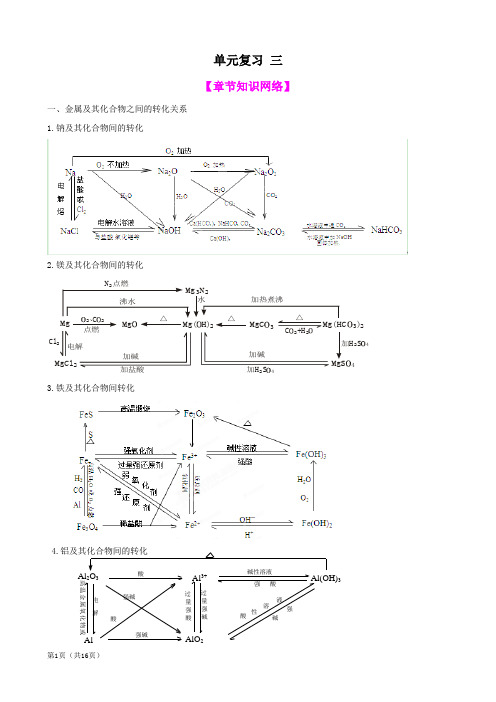
化学一轮精品复习学案:第3章 金属及其化合物 单元复习三(必修1)
单元复习 三【章节知识网络】一、金属及其化合物之间的转化关系 1.钠及其化合物间的转化2.镁及其化合物间的转化MgMg( H)Mg(HC )MgSMgCl Mg222242C Cl N 点燃、点燃电解沸水Mg N 32水加热煮沸2342加碱加H S 加盐酸△△△3.铁及其化合物间转化4.铝及其化合物间的转化AlAl 3+Al 2O 3Al(OH)3AlO 2_ 碱性溶液 强酸 强 碱酸性溶液碱过 量 强 酸过量 强 酸强碱 强碱酸电解高温金属氧化物或5.铜及其化合物间转化二.金属及其化合物对照表 三.金属活动顺序表CuSO 45H 2O CuCuOCu(OH)2Cu 2OCuSO 4O 2 COH 2 乙醇含醛基化合物H 2OOH -H 2SO 4FeZn浓H 2SO 4【章节巩固与提高】一、选择题1.(2012·宜春模拟)下列有关金属的说法中正确的是( )①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用 ②纯铁比生铁抗腐蚀性更强③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属 ④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病 ⑤青铜、不锈钢、硬铝都是合金 ⑥可通过焰色反应区分钾元素和钠元素A.②④⑤⑥B.②③④⑤C.①③④⑤D.①②⑤⑥ 2.(2012·东城模拟)下列各组离子在指定条件下一定能大量共存的是( )A.在加入铝粉能产生氢气的溶液中:22443NH Fe SO NO ++--、、、 B.能使淀粉碘化钾试纸变蓝的溶液中:24Na NH S Br ++--、、、 C.能使红色石蕊试纸变蓝的溶液中:2332Na K CO NO AlO ++---、、、、 D.在含有大量Fe 3+的溶液中:4NH Na Cl SCN ++--、、、 3.(2012·郑州模拟)下列叙述正确的是( )①Na 2O 与Na 2O 2都能和水反应生成碱,它们都是碱性氧化物 ②Na 2CO 3溶液和NaHCO 3溶液都能跟CaCl 2溶液反应得到白色沉淀 ③钠在常温下不容易被氧化 ④Na 2O 2可作供氧剂,而Na 2O 不行⑤Cu 与HNO 3溶液反应,由于HNO 3浓度不同可发生不同的氧化还原反应 A.都正确 B.②③④⑤ C.②③⑤ D.④⑤4.(2012·盐城检测)若1.8 g 某金属与足量盐酸充分反应,放出2.24 L(标准状况)氢气,则该金属是( )A .MgB .AlC .FeD .Zn5.(2012·西安模拟)将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。
2018届高考化学一轮复习考情分析检测第3章金属及其化合物3.3铁及其重要化合物
第3章金属及其化合物 3.3检测时间:45分钟满分:100分一、选择题(每题6分,共60分)1.铁是日常生活中使用最广泛的金属,下列关于铁的一些说法正确的是( )A.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸B.铁是较活泼的金属,它与卤素单质(X2)反应的生成物均为FeX3C.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3D.Fe3O4溶解于盐酸既有FeCl2又有FeCl3生成,故Fe3O4属于混合物答案 C解析A项,常温下铁在浓硫酸中钝化,钝化是化学变化,错误;B项,铁与碘化合生成FeI2,错误;D项,四氧化三铁是纯净物,错误。
2.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )解析Cl2与FeCl2反应,A错误;Fe与FeCl3、CuCl2均反应,B错误;D有新的杂质CuSO4生成。
3.[2017·湖南东部六校联考]下列离子方程式书写正确的是( )A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-B.NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O===Fe(OH)2↓+2HClOC.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FeO2-4+3Cl +-+H2O+4HD.Fe3O4与稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O答案 A解析足量的氯气将Br-和Fe2+完全氧化成Br2和Fe3+,A项正确;NaClO溶液和FeCl2溶液混合,会发生氧化还原反应,B项错误;在强碱溶液中不生成H+,正确的离子方程式为2Fe(OH)3+3ClO-+4OH-===2FeO2-4+3Cl-+5H2O,C项错误;Fe3O4与HNO3反应时,+2价铁被氧化为+3价,D项错误。
高考化学一轮复习资料:金属及其化合物知识梳理及重要化学方程式总结

金属及其化合物知识网络及重要化学方程式总结【学习目标】1.金属及其化合物知识网络构建2.重要化学方程式总结【知识梳理】1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写出离子方程式。
①Na和H2O的反应2Na +2H 2O===2Na ++2OH -+H 2↑;②Na 在空气中燃烧2Na +O 2=====点燃Na 2O 2;③Na 2O 2和H 2O 的反应2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑;④Na 2O 2和CO 2的反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2;⑤向NaOH 溶液中通入过量CO 2OH -+CO 2===HCO -3;⑥将Na 2CO 3溶液与石灰乳混合CO 2-3+Ca(OH)2===CaCO 3↓+2OH -;⑦向Na 2CO 3稀溶液中通入过量CO 2CO 2-3+CO 2+H 2O===2HCO -3;⑧将NaHCO 3溶液和NaOH 溶液等物质的量混合 HCO -3+OH -===CO 2-3+H 2O ;⑨将NaHCO 3溶液与澄清石灰水等物质的量混合 HCO -3+Ca 2++OH -===CaCO 3↓+H 2O ;⑩将NaHCO 3溶液与少量澄清石灰水混合2HCO -3+Ca 2++2OH -===CaCO 3↓+CO 2-3+2H 2O 。
2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式。
①Al和NaOH溶液的反应2Al+2OH-+2H2O===2AlO-2+3H2↑;②Al(OH)3和NaOH溶液的反应Al(OH)3+OH-===AlO-2+2H2O;③Al(OH)3和盐酸的反应Al(OH)3+3H+===Al3++3H2O;④Al2O3和NaOH的反应Al2O3+2OH-===2AlO-2+H2O;⑤Al2O3和盐酸的反应Al2O3+6H+===2Al3++3H2O;⑥NaAlO2和过量盐酸的反应AlO-2+4H+===Al3++2H2O;⑦向NaAlO2溶液中通入过量CO2气体AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3;⑧将NaAlO2溶液与NaHCO3溶液混合AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3;⑨将NaAlO2溶液与AlCl3溶液混合3AlO-2+Al3++6H2O===4Al(OH)3↓;⑩将AlCl3溶液与NaHCO3溶液混合Al3++3HCO-3===Al(OH)3↓+3CO2↑。
2018届高考化学一轮复习考情分析检测:第3章 金属及其化合物3-4 含解析

时间:45分钟满分:100分一、选择题(每题6分,共66分)1.[2017·山东潍坊高三联考]我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”;②“以曾青涂铁,铁赤色如铜”。
下列有关叙述正确的是 ( )A .①中描述的化学反应是可逆反应B .“曾青”是含有Cu 2+的溶液,如硫酸铜溶液C .“积变又还成丹砂”中的“还”可理解为“被还原”D .水银能跟曾青发生置换反应生成单质铜 答案 B解析 ①中描述的化学反应为HgS=====△Hg +S 、Hg +S===HgS ,两个反应的反应条件不同,不是可逆反应,A 项错误;“铁赤色如铜”,说明铁置换出铜,故“曾青”应为可溶性铜盐的水溶液,B 项正确;“积变又还成丹砂”,发生的反应是Hg +S===HgS ,Hg 发生了氧化反应,“还”是指恢复原来的状态,C 项错误;Hg 的活动性比Cu 弱,因此水银不能与曾青发生置换反应生成单质铜,D 项错误。
2.[2016·石家庄模拟]下列关于金属的冶炼方法叙述不正确的是( )解析 用电解熔融NaCl 来制取金属钠,电解饱和NaCl 溶液得到的是NaOH、H2和Cl2。
3.[2017·兰州一中高三月考]如图所示的反应均是在高温引燃后进行,选项中的物质表示A和B,不合理的是( )A.MgO Al B.CO2MgC.Fe3O4Al D.CuO H2答案 A解析Mg的活泼性强于Al,若A为MgO,B为Al,二者不能发生铝热反应,A项错误;CO2与Mg反应生成C(即C)和MgO(即D),Mg 与O2反应生成MgO,C与足量O2反应生成CO2,B项正确;Fe3O4与Al 能发生铝热反应,生成Fe(即C)和Al2O3(即D),C项正确;H2还原CuO 生成Cu(即C)和H2O(即D),D项正确。
4.[2017·大连二十四中测试]人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。
高三一轮复习第三章铝及其化合物3-2

考源教学资源网
第26页
返回导航
第三章·第二讲
名师一号 · 高考总复习· 模块新课标 · 新课标版 · 化学
【 典 例 1】 甲 、 乙 两 烧 杯 中 各 盛 有 酸 和 氢 氧 化 钠 溶 液 , 向 两 烧 杯 中 分 别 加 入 等 质 量 的 铝 粉 , 反 应 结 束 后 测 得 生 成 的 气 体 体 积 比 为 ( ) A.5.4g C.2.7g
为 1:1。 而 题 中 实 际 为 而对 N a O H 反 应 的 铝 粉 应 为
[答案]
考源教学资源网
3 N H 3↓+
+
4
;
2 +6H2O === 4 A O ( lH )
-
3↓;
=== A O ( lH )
3↓。
考源教学资源网
第19页
返回导航
第三章·第二讲
名师一号 · 高考总复习· 模块新课标 · 新课标版 · 化学
2 ( A )O ( lH ) A O ( lH ) 3 ( A )l
100mL 3 mo L / l
的盐
1:2, 则 加 入 铝 粉 的 质 量 为
B.3.6g D.1.6g
考源教学资源网
第27页
返回导航
第三章·第二讲
名师一号 · 高考总复习· 模块新课标 · 新课标版 · 化学
[解析]
根 据 铝 与 盐 酸 和 铝 与 氢 氧 化 钠 溶 液 反 应 的 化 学 H C l 和N a O H 溶 液 中 加 入 H C l
2 ( ) 足 量 的 铝 分 别 与 等 物 质 的 量 的 盐 酸 和 氢 氧 化 钠 反 应 , 产 生 氢 气 的 体 积 VH C l H2 比 为 : =1:3。 VN H O a H 2
高考化学一轮复习单元质检卷3金属及其化合物(含解析)新人教版

单元质检卷(三) 金属及其化合物(时间:45分钟满分:100分)可能用到的相对原子质量:H1 O16 Na23 Mg24 Fe56一、选择题(本题共10小题,每小题5分,共50分。
每小题只有一个选项符合题目要求)1.(2018江苏化学)下列有关物质性质与用途具有对应关系的是( )。
A.NaHCO3受热易分解,可用于制胃酸中和剂B.SiO2熔点高、硬度大,可用于制光导纤维C.Al2O3是两性氧化物,可用作耐高温材料D.CaO能与水反应,可用作食品干燥剂项,NaHCO3用于制胃酸中和剂应用的是NaHCO3能与胃酸反应生成NaCl、CO2和H2O这一性质,与NaHCO3受热易分解无关;B项,SiO2用于制光导纤维与其熔点、硬度等性质无关;C项,Al2O3用作耐高温材料是因为其熔点高,与其是两性氧化物无关。
2.下列实验操作、现象和结论均正确的是( )。
解析:溶液变红,原溶液中可能有Fe3+,不一定有Fe2+,A项错误;2Na2O2+2H2O4NaOH+O2↑,溶液先变红说明过氧化钠与水反应生成了碱,后褪色说明生成了H2O2,H2O2具有强氧化性,能把有色物质氧化漂白,结论错误,B项错误;酒精灯内焰温度低,有挥发出的乙醇,氧化铜与乙醇发生反应:CH3CH2OH+CuO CH3CHO+Cu+H2O,黑色铜丝变成红色,CuO被乙醇蒸气还原,C项正确;向饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O 2NaHCO3↓,NaHCO3的溶解度小于Na2CO3,D项错误。
3.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )。
答案:D解析:将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,发生反应的先后顺序为Ba(OH)2+CO2 BaCO3↓+H2O、2KOH+CO2K2CO3+H2O、2KAlO2+CO2+3H2O2Al(OH)3↓+K2CO3、K2CO3+CO2+H2O2KHCO3、BaCO3+CO2+H2O Ba(HCO3)2,根据物质的溶解性可知,只有D项符合题意。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3章 金属及其化合物 3.2检测时间:45分钟满分:100分一、选择题(每题6分,共66分)1.下列关于铝及其化合物的叙述正确的是( )A .氧化铝坩埚可用于熔融NaOH 实验B .铝与Fe 2O 3发生铝热反应,反应后固体物质增重C .氧化铝熔点很高,可作耐火材料D .明矾用作净水剂,可以除去废水中的铜离子答案 C解析 A 项,氧化铝能与NaOH 反应,氧化铝坩埚不能用于熔融NaOH 实验,错误;B 项,根据质量守恒定律,反应后固体物质的质量不变,错误;C 项,氧化铝熔点很高,可用于制耐火砖、耐火坩埚、耐火高温实验仪器,正确;D 项,明矾净水时Al 3+水解生成Al(OH)3胶体,可吸附水中不溶于水的杂质形成沉淀,从而起到净水作用,错误。
2.[2017·衡水模拟]下列叙述正确的是( )①含有大量AlO -2的溶液中,NH +4、NO -3、H +、Cl -可以大量共存②0.1 mol·L -1的AlCl 3溶液中,Na +、K +、SO 2-4、HCO -3可以大量共存③向AlCl 3溶液中加入过量的稀氨水,发生反应:Al 3++4NH 3·H 2O===AlO -2+4NH +4+2H 2O ④加入铝粉能放出H 2的溶液中,Ca 2+、Fe 2+、Cl -、NO -3一定能够大量共存⑤用NaOH 溶液除去铝条表面的氧化膜:Al 2O 3+2OH -===2AlO -2+H 2O⑥依据铝热反应原理,能发生反应2Al +3MgO=====高温3Mg +Al 2O 3⑦向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO 2-4+2Ba 2++Al 3++4OH -===2BaSO 4↓+AlO -2+2H 2O⑧常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH 溶液A .⑤⑦ B.③⑤ C.④⑥ D.⑦⑧答案 A解析 ①含大量AlO -2的溶液呈碱性,H +不能大量存在,错误;②Al 3+与HCO -3发生双水解反应:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑,不能大量共存,错误;③Al(OH)3不溶于NH 3·H 2O ,错误;④加入铝粉放出H 2的溶液,可能呈酸性,也可能呈碱性,若呈酸性,不能存在NO -3,若呈碱性,Ca 2+、Fe 2+不能大量共存,错误;⑥金属性:Mg>Al ,铝不能置换出Mg ,错误;⑧常温下,铝在浓硝酸中钝化,错误。
故A 项符合题意。
3.[2017·河南郑州高三质检]某无色溶液含有下列离子中的若干种:H +、NH +4、Cu 2+、Ba 2+、Al 3+、CO 2-3、Cl -、OH -、NO -3。
向该溶液中加入铝粉,只放出H 2,则溶液中能大量存在的离子最多有( )A .3种B .4种C .5种D .6种答案 C解析 Cu 2+在溶液中为蓝色,则溶液中一定不含有Cu 2+。
能与铝粉反应放出H 2,则溶液中含有H +或OH -。
若溶液中含有H +,则不含CO 2-3、OH -、NO -3,一定含有Cl -,可能含有NH +4、Ba2+、Al3+。
若溶液中含有OH-,则不含H+、NH+4、Al3+,结合溶液呈电中性知,一定含有Ba2+,一定不含CO2-3,可能含有Cl-、NO-3。
综上所述,溶液中能大量存在的离子最多有5种。
4.[2017·山东重点中学联考]下列物质组合中,既能和酸反应又能和碱反应的化合物共有( )①(NH4)2CO3②Al2O3③Al2(SO4)3④Al⑤NaHSO3⑥Al(OH)3A.3种 B.4种 C.5种 D.6种答案 B解析Al为单质,排除④;(NH4)2CO3与酸反应生成CO2,与碱反应生成NH3;Al2O3、Al(OH)3为两性物质,均能与强酸、强碱反应;NaHSO3与酸反应生成SO2,与碱反应生成Na2SO3;Al2(SO4)3只能与碱反应,不能与酸反应。
故既能与酸反应也能与碱反应的化合物是①②⑤⑥,B项正确。
5.下列各项所述内容对应的图象正确的是( )答案 D解析A选项,因为含有H+,所以开始不会生成沉淀,错误;B选项,最终有BaSO4沉淀生成,错误;C选项,Al产生的氢气多,错误。
6.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是( )解析铝箔在酒精灯火焰上加热熔化但不滴落是因为Al2O3的熔点高于金属Al,故B错;明矾水解产生Al(OH)3胶体,可净化水,但不能进行消毒,故C错;铁、铝遇浓硫酸、浓硝酸钝化,并不是不反应,故D错。
7.[2016·福建四地六校联考]用铝土矿(主要成分为Al2O3,含有Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是 ( )A.试剂X可以是盐酸B.反应①过滤后所得沉淀为氢氧化铁C.图中所示转化反应都不是氧化还原反应D.操作②中发生的化学方程式为NaAlO2+2H2O+CO2===Al(OH)3↓+NaHCO3答案 D解析A项,分离氧化铝和氧化铁,应用氢氧化钠溶液,不可能用盐酸,因为二者都可与盐酸反应,故A错误;B项,氧化铁与NaOH不反应,则反应①过滤后所得沉淀为氧化铁,故B错误;C项,电解熔融Al2O3属于氧化还原反应,故C错误;D项,操作②中向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3,故D正确。
8.[2016·日照联考]甲和乙两烧杯中各装有100 mL 0.2 mol·L-1 AlCl3溶液,向两烧杯中分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成。
下列判断正确的是( )A.实验过程中甲中和乙中的现象始终保持一致B.甲中沉淀一定比乙中的少C.甲中沉淀可能比乙中的多D.乙中沉淀可能比甲中的多答案 D解析Al(OH)3能溶于NaOH溶液,而不溶于氨水,NaOH溶液和氨水均为一元碱的水溶液,根据加入的碱溶液的量进行分析,可能出现以下几种情况:①若加入的碱溶液均不足量或均恰好完全反应生成Al(OH)3,则甲、乙中的现象一致,生成的沉淀的量相等;②若加入的碱溶液均过量,过量的NaOH会使生成的Al(OH)3沉淀部分溶解或完全溶解,而加入氨水的烧杯中生成的Al(OH)3不会溶解。
综上分析,只有D项符合题意。
9.一块表面被氧化的铝分成两等份,若向其中一份中滴加1 mol·L-1的NaOH溶液,向另一份中滴加x mol·L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示。
下列说法不正确的是( )A .该铝块的总质量为8.46 gB .a =260C .b =780D .该铝块中氧化铝与铝单质的物质的量之比为3∶20答案 A解析 当铝块与NaOH 溶液反应时,由关系式Al 2O 3~2NaOH 可得,n (Al 2O 3)=12n (NaOH)=0.03 mol ;由关系式2Al ~2NaOH ~3H 2可得,n (H 2)=1.5n (Al)=1.5n (NaOH)=0.3 mol ,n (Al)=0.2 mol ,n (NaOH)=0.2 mol ,V (NaOH)=200 mL ,a =260。
当铝块与盐酸反应时,由关系式Al 2O 3~6HCl 可得,n (HCl)=0.03 mol×6=0.18 mol ,c (HCl)=0.18 mol 0.18 L=1 mol·L -1;由关系式Al ~3HCl 可得,n (HCl)=3n (Al)=0.6 mol ,V (HCl)=0.6 mol 1 mol·L-1×1000 mL·L -1=600 mL ,b =180+600=780。
该铝块中氧化铝与铝单质的物质的量之比为0.03 mol∶0.2mol =3∶20。
铝块的总质量为(0.03 mol×102 g·mol -1+0.2 mol×27 g·mol -1)×2=16.92g 。
10. 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH =14的溶液,然后用1 mol/L 的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )A .原合金质量为0.92 gB .产生氢气的体积为896 mL(标准状况下)C .图中m 的值为1.56D.图中V2的值为60答案 C解析由图象可知,向合金溶解后的溶液中加盐酸,先发生反应NaOH+HCl===NaCl+H2O,后发生反应NaAlO2+HCl+H2O===NaCl+Al(OH)3↓,最后发生反应Al(OH)3+3HCl===AlCl3+3H2O,合金溶解后剩余的氢氧化钠的物质的量为0.02 L×1 mol/L=0.02 mol,则V1为0.02 mol÷1 mol/L=0.02 L=20 mL,生成沉淀时消耗的盐酸为40 mL-20 mL=20 mL,其物质的量为0.02 L×1 mol/L=0.02 mol,生成沉淀的物质的量为0.02 mol,合金中钠的物质的量为0.04 mol,铝的物质的量为0.02 mol。
由原子守恒可知,合金的质量为0.04 mol×23 g/mol+0.02 mol×27 g/mol=1.46 g,故A错误;由Al(OH)3+3HCl===AlCl3+3H2O可知,溶解沉淀需要0.06 mol HCl,其体积为60 mL,则V2为40 mL+60 mL=100 mL,故D错误;由上述计算可知,生成沉淀0.02 mol,其质量为0.02 mol×78 g/mol=1.56 g,C正确;由2Na+2H2O===2NaOH+H2↑、2Al+2H2O+2NaOH===2NaAlO2+3H2↑可知,生成氢气的物质的量为0.02 mol+0.03 mol=0.05 mol,在标准状况下的体积为0.05 mol×22.4 L/mol=1.12 L,B错误。
11.某烧杯中盛有含0.2 mol NH4Al(SO4)2的溶液,向其中缓缓加入4 mo l·L-1的NaOH 溶液200 mL,使其充分反应,此时烧杯中铝元素的存在形式为( )A.Al3+和Al(OH)3B.AlO-2C.AlO-2和Al(OH)3D.Al(OH)3答案 D解析由NH+4+OH-===NH3·H2O,Al3++3OH-===Al(OH)3↓及题给数据知,Al3+恰好全部转化为Al(OH)3。
二、非选择题(共34分)12.[2017·云南高中统一检测](12分)铝(熔点660 ℃)是一种应用广泛的金属,工业上用Al2O3(熔点2045 ℃)和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。
