无机化学C10s区元素
无机化学S区元素概述单质及其物理化学性质

无机化学S区元素概述单质及其物理化学性质S区元素是指周期表中第三周期的元素,包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu和Zn。
这些元素的单质是指它们在自然界中以纯态存在的形态。
下面将对这些S区元素的单质及其物理化学性质进行概述。
Scandium(Sc)是一种银白色金属,熔点1541℃,沸点2836℃。
它的密度为2.989 g/cm³,熔化热为15.8 kJ/mol。
Scandium的化学性质活泼,可以与氢气、氧气和氮气反应。
它可以形成多种化合物,如ScCl3、Sc2O3等。
Titanium(Ti)是一种银灰色金属,熔点1668℃,沸点3260℃。
它的密度为4.506 g/cm³,熔化热为13.8 kJ/mol。
Titanium具有低密度、高强度和良好的耐腐蚀性。
它与氧、氮、氢等非金属元素反应生成化合物,如TiO2、TiN等。
Vanadium(V)是一种银白色金属,熔点1890℃,沸点3380℃。
它的密度为6.0 g/cm³,熔化热为21.5 kJ/mol。
Vanadium的化学性质活泼,可以与氧气、氮气和氟气反应。
它可以形成多种氧化态,如V2O5、VO2等。
Chromium(Cr)是一种银灰色金属,熔点1907℃,沸点2672℃。
它的密度为7.18 g/cm³,熔化热为20.5 kJ/mol。
Chromium的外层电子构型为3d54s1,具有良好的抗腐蚀性。
它可以形成多种化合物,如Cr2O3、CrCl3等。
Manganese(Mn)是一种银灰色金属,熔点1244℃,沸点1962℃。
它的密度为7.21 g/cm³,熔化热为13.2 kJ/mol。
Manganese与氧气反应生成二氧化锰(MnO2),具有一定的催化性能。
它还可以形成多种化合物,如MnCl2、MnSO4等。
Iron(Fe)是一种银灰色金属,熔点1538℃,沸点2861℃。
它的密度为7.874 g/cm³,熔化热为13.8 kJ/mol。
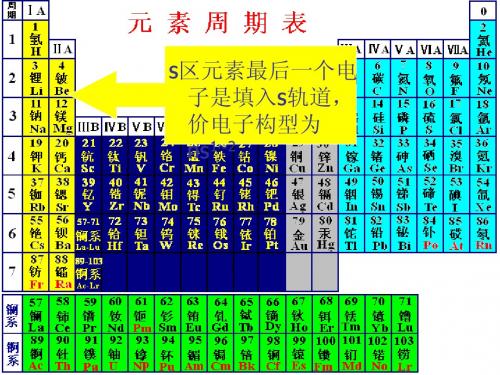
s区元素概述

铷
铯
钫
ⅡA Be Mg Ca Sr Ba Ra
铍镁钙锶钡镭
第十章 碱金属和 碱土金属元素
碱金属和碱土金属的存在
10.1 S区元素概述
ⅠA Li Na K Rb Cs Fr
主白要云锂以石菱[M镁gC石钠a((COM3)g2C]钾存O3在)、 铷
铯
钫
ⅡA Be Mg Ca Sr Ba Ra
铍镁钙锶钡镭
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 5 Rb Sr Y Zr Ne Mo Tc Re Rh Pa Ag Cd In Sn Sb Te I Xe
55 6 Cs
56
5771
Ba La
72 Hf
73 Ta
74 W
75 76 77 Re Os Ir
7
87 Fr
88
89103
104
Ra Ac Rf
105 Db106Fra bibliotekSg107 Bh
108 109 Hs Mt
110
Uun
111 Uuu
112 Uub
第十章 碱金属和 碱土金属元素
10.1 S区元素概述
ⅠA
1 1 H ⅡA
0
2 ⅢA ⅣA ⅤA ⅥA ⅦA He
34 2 Li Be
5 6 7 8 9 10 B C N O F Ne
ⅡA Be Mg Ca Sr Ba Ra 铍镁钙锶钡镭
第十章 碱金属和 碱土金属元素
碱金属和碱土金属的存在
10.1 S区元素概述
ⅠA Li Na K Rb Cs Fr
锂钠钾铷铯钫 ⅡA 主B要e 以NaMCgl形式存Ca在于海S洋r 、盐B湖a和岩石Ra中
无机化学第七章S区元素

无机化学第七章S区元素第七章主要介绍了S区元素的性质和应用。
S区元素是指周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素具有一些共同的性质和特点,包括氧化态的规律和趋势、同族元素的化学性质等。
S区元素的氧化态规律和趋势是其重要的特点之一、氧化态是指元素在化合物中的电荷数。
在S区元素中,氧通常呈-2的氧化态,露卜那呈-1的氧化态,硫、硒和碲的氧化态则比较复杂,可以是正或负的多个值。
这种规律是由于这些元素的外层电子结构决定的。
氧的外层有6个电子,可以通过接受2个电子来填满外层,从而达到稳定的8个电子的结构。
而露卜那的外层只有一个电子,可以通过捐赠一个电子来达到稳定的结构。
而硫、硒和碲的外层电子结构类似,有6个电子,可以通过得失2个电子来达到稳定的8个电子的结构。
在S区元素中,氧是一个非金属元素,而硫、硒和碲则是亚稳金属。
氧具有较高的电负性,能够与其他元素形成较强的电负性键。
它在自然界中广泛存在,包括空气中的氧气、水中的水分子等。
由于氧的高电负性,它可以与其他元素形成氧化物,包括过氧化物、酸性氧化物和碱性氧化物等。
氧化物有着重要的应用,例如过氧化氢可用作漂白剂和消毒剂。
硫、硒和碲是黄顺子亚稳金属,它们具有较高的化学活性。
它们主要存在于矿石中,包括铁矿石中的硫化铁矿石。
硫还广泛存在于化学品中,包括硫酸、硫酸铜等。
硫还可以形成众多的无机化合物,例如硫化物和亚硫酸盐。
硫化物在冶金工业中有重要应用,例如焦炭的熔融炉和脱硫设备。
在亚稳金属中,硒是比较特殊的元素。
它可以形成六亚硒酸盐,具有良好的光敏性。
六亚硒酸盐可以用于摄影中的胶片和相纸的显影剂,以及红外线辐射计的探测剂。
此外,硒还可以形成硒化物,具有一定的半导体性能。
碲也是一种亚稳金属,具有类似硒的性质。
它可以形成一种黑色固体的碲化铋,具有比较好的半导体性能。
碲化铋被广泛应用于红外线成像和热电传感器等领域。
除了硫、硒和碲,S区元素中还有钋,它是一种放射性元素。
无机化学C10s区元素

同周期IA和IIA比较
ⅠA 主要氧化态 原子半径 电负性 +1 最大 最小 > < ⅡA +2 较大 较小
第一电离势 最低 熔沸点
硬度 导电性
< <
< >
较低
活泼
金属活泼性 非常活泼 >
同 族 比 较
r
Li Na K Rb Cs 152 186 227 248 265
电负性 I1
0.98 0.93 0.82 0.82 0.79 521 499 421 405 371
I2
7295 4591 3088 2675 2436
r
Be 111 Mg 160
电负性 I1
1.57 1.31 905 742
I2
1868 1460
Ca 197
Sr 215 Ba 218
1.00
0.95 0.89
593
552 564
1152
1070 971
原子半径逐渐增大 电负性依次减小 金属活泼性逐渐增大
碱金属的EӨ(M+/M)数值都很小,所以 它们都是很强的还原剂。从电势数值上看,锂 的活泼性应与铯相似,但实际上当锂与水反应 时还不如钠激烈。这主要有两方面的原因: ①因为锂的熔点较高(或升华热较 大),需要更高的温度使其变为小的颗粒。 ②反应产物LiOH的溶解度较小,覆盖在 金属表面,阻碍反应的进一步进行。
综
电 离 能 、 电 负 性 减 小
金 属 性 、 还 原 性 增 强
合 比 较
原 子 半 径 增 大
IA Li Na K Rb Cs IIA Be Mg Ca Sr Ba
原子半径减小
金属性、还原性减弱
无机s区元素
3、超氧化物:除Li、Be、Mg外,s 区元素与O2反 应生成超氧化物: K+O2=KO2 2KO2+2H2O=H2O2+O2↑+KOH 4KO2+2CO2=3O2↑+2K2CO3 O22- [(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2 (π2p)4(π2p*)4] O2- [(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)3] 4、对角相似规则:周期表中某元素的性质与它左 上方或右下方的另一元素的性质相似 原因:离子极化能力相近,离子极化能力大小 取决于离子原子半径、电荷数、电子层构型
(二)氢氧化物
酸式离解
碱式离解
R离子的离子势φ=Z/r, 氢 氧 7< φ1/2 <10 φ 1/2 <7 化 物 碱
φ1/2 >10 酸
1、在同一周期,最高氧化态的阳离子Rn+, 从左到右,电荷数依次增大,半径依次减 小,氢氧化物酸性增强。
Na+
半径 95 /pm φ1/2 3.2
Mg2+ Al3+ 65 5.5 50 7.7
3、形成结晶水合物及热稳定性特征: 水合离子:离子所带电荷越多,半径越小, 水合作用越强。水合离子半径 Na+>K+ 热稳定性:MX和M2SO4稳定,M2CO3只有 Li2CO3不稳定,MNO3不稳定。 4、几种重要的盐: NaCl、KCl 、CaCl2 ·6H2O 、BaCl2 ·2H2O 泻盐 MgSO4 重晶石 BaSO4 CaSO4 ·2H2O 烧石膏 CaSO4 ·1/2H2O 无水 CaCl2 石膏
+
+
Li的电极电势最低,但是Li与水反应不如 Na反应激烈,为什么? 单质Li熔点高,与水反应放热不足以使其 液化,分散性差,反应活性降低。LiOH 溶解度小,覆盖于金属表面,阻碍反应 进行。后者是Li与水反应不如Na剧烈的主 要原因
【精品】无机化学课件--第三章--S区元素概要教学资料

M1(NH3)y+ + e(NH3)x- M2(NH3)y2+ + 2 e(NH3)x-
长期放置或有催化剂存在:
2M(s)
2NH3 (l) →2M
2NH
2
H 2 (g)
钠汞齐: NaxHgx, 钠和汞的合金。含钠 约1- 10%,钠的含量在1%以下的是液体;1- 2.5%以上的是固体。银白色。置于空气中与氧 和水份作用,在表面上覆盖一层氢氧化钠薄膜。 可分解水而放出氢,但其作用较纯钠迟缓的多。 用作还原剂,也可用于制氢。由将汞加热到15 0-200度后加入小块钠而制得
3. 氢原子是周期表中结构最简单的原子。 4. 氢化学是内容最丰富的元素化学领域之一。 5. 氢形成氢键。如果没有氢键,地球上不会存在液
态水!人体内将不存在现在的DNA双螺旋链! 6. 氢是周期表中唯一尚未找到确切位置的元素。
3.2 S区的通性
一、物理性质 二、化学性质 三、重要的化合物
3.2 S区的通性 ( nS1-2 ⅠA ⅡA )
★氢能源研究面临的三大问题:
氢气的发生(降低生产成本)
氢气的储存
氢气的输送(利用)
化学元素中, 氢在哪些方面显得独一无二?
1. 氢是宇宙中丰度最大的元素, 按原子数计占90%, 按 质量计则占75%。
2. 氢的三种同位素质量之间的相对差值特别高,并因此 而各有自己的名称, 这在周期表元素中绝无仅有。
同温同压下所有气体中氢气的密度最小常用来填充气存在氢是宇宙中丰度最高的元素在地球上的丰度排在第15位某些矿物例如石油天然气和水是氢的主要资源大11000kkpa1077kkpa1025金刚石砧氢的状态金属氢s液态氢l固态氢s密度gcm3056200710089液态或固态氢在上百万大气压的高压下变成的导电体由于导电是金属的特性故称金属氢氢化合物二元氢化合物在周期表中的分布氢的大多数二元化合物可归入下述三大类中的某一类
无机化学第三版课件第17章 s 区元素

● 与CO2 的作用
Li2O + CO2 = Li2CO3 2 Na2O2 + 2CO2 = 2 Na2CO3 + O2 4 KO2 + 2 CO2 = 2 K2CO3 + 3 O2
二、氢氧化物
M 2 O, MO MOH, M(OH) 2
H 2O
● 溶解度
碱金属氢氧化物 在水中溶解度都 很大,但是碱土 金属氢氧化物在 水中溶解度要小 的多。 ● 易吸水溶解 LiOH 碱 性 递 增
第17章
Chapter 17
s 区元素
s-Block Elements
s 区元素在周期表中的位置
本章教学要求
1. 掌握 s 区元素的电子构型与性质递s 区元素的氢化物、氧化物、氢氧化
物的性质,特别注意氢氧化物的碱性变 化规律。 3.了解 s 区元素的重要盐类化合物。 4.了解对角线规则。
化学活泼性
升 硬 熔 华 度 沸 能 点 极 水 电 电 化 合 负 离 力 能 性 能
递 减
递 增
§9-2
●
●
单质
都是最活泼的金属
同一族自上而下性质的变化有规律
●
●
通常只有一种稳定的氧化态
形成的化合物大多是离子型的
一、单质的物理性质
碱金属密度小、硬度小、熔点低、导电性 强,是典型的轻金属。碱土金属的密度、 熔点和沸点则较碱金属为高。锂是固体单 质中最轻的,它的密度约为水的一半。碱 土金属的密度稍大些。
Ti + 4NaCl + 2H2
(3) 与 H2O 作用
● 碱金属被 H2O 氧化: 2 M + 2 H2O = 2 M+ + 2 OH-+ H2↑
大学无机化学第十二章S区元素PPT课件

碱土金属的导电性和 导热性良好,其良好 的延展性也使其易于 加工。
碱土金属的密度较大, 且随原子序数增加而 增大。
碱土金属的化学性质
碱土金属的化学性质活泼,有较 强的还原性,容易失去电子成为
正离子。
碱土金属离子具有较强的水合能 力,易与水反应生成氢氧化物。
碱土金属的氧化物大多数为碱性 或两性氧化物,表现出较强的碱
镓的化合物在医药、农业和电子工业等领域也有广泛应用。
镓、铟、铊的性质和用途
铟的性质和用途
铟是一种银白色的软金属,具有较好的延展性和导电性,主要用于制作液晶显示 器和电子元件。
镓、铟、铊的性质和用途
铊的性质和用途 铊是一种银白色的金属,具有较低的熔点和沸点,主要用于制作高温温度计和光电管等器件。
铊的化合物在医药和农业等领域也有一定的应用。
铋的性质和用途
铅是一种青白色的金属,具有较高的密 度和耐腐蚀性,主要用于制作电池、颜 料和涂料等材料。
铅的化合物在医药、农药和染料等领域 也有广泛应用。
THANKS
感谢观看
S区元素在周期表中的位置
总结词
S区元素在周期表中占据第1列和第2 列的位置。
详细描述
在周期表中,S区元素占据第1列和第 2列的位置,这些位置对应于元素周期 表的s区和p区。这些元素具有相似的 电子构型和化学性质,通常表现出强 烈的金属性质。
S区元素的特点和性质
要点一
总结词
S区元素具有低原子序数、小原子半径、高电离能、低电子 亲和能等特点。
大学无机化学第十二章s 区元素ppt课件
• S区元素的概述 •氢 • 碱金属 • 碱土金属 • 其他S区元素
01
S区元素的概述
S区元素的定义
无机化学课件12-s区元素

对土壤的影响
土壤污染
S区元素在工业生产过程中 可能通过废渣、废气等途 径进入土壤,导致土壤污 染。
土壤质量下降
这些元素在土壤中积累, 可能影响土壤的理化性质 ,导致土壤质量下降。
农产品安全问题
被污染的土壤可能影响农 作物的生长和品质,进而 影响农产品安全。
对大气的影响
大气污染
S区元素可能以气态或颗粒物的形 式排放到大气中,造成大气污染 。
SUMMAR Y
01
S区元素的概述
定义与特性
定义
S区元素指的是元素周期表中第12族(IIIB族)的元素,包括钪(Sc)、钇(Y )、镧(La)、锕(Ac)等。
特性
S区元素都是金属元素,具有金属的通性,如导电、导热、延展性等。它们在化 学反应中通常表现出较强的还原性,易于失去电子成为正离子。
S区元素在自然界中的存在形式
金属氢化物是S区元素与氢反应生成的化合物,它们具有高的能量密度和稳定性。金属氢化物在能源储存和转换领域有潜在的 应用价值。
金属氢化物在工业中有一定的应用,如作为储氢材料和制备其他金属氢化物的原料。此外,一些金属氢化物还具有特殊的物 理和化学性质,可用于制备新型材料和器件。
REPORT
CATALOG
环保催化剂
利用硫元素制备的催化剂可用于 处理工业废气,降低污染物排放 。
合成新物质
含硫化合物
硫单质或硫化物可与其他元素合成多 种含硫化合物,如硫酸、硫代硫酸盐 等。
高分子材料
含硫元素的高分子材料具有特殊性能 ,如耐高温、抗氧化等,在航空、航 天等领域有广泛应用。
REPORT
CATALOG
DATE
REPORT
CATALOG
DATE
碱金属和碱土金属元素:s区元素概述

-△hHm(H+)
-
1 2
D
(H-H)
H+(g) + e-
-I1(H)
△hHm (M+) H(g)
M(g)
I1(M)
M+(g) +e-
△rH由m上=式{△可sub计H算m +碱I金1(M属)在+水△溶hH液m (中M+)} 转变+为{水-△合hH离m子(H过+)程- 12的D△(rHm-H) -I1(H)}
Cs(铯)
密度 0.53
0.97 0.86
1.53
1.88
(g·cm-3)
电负性 1.0
0.9 0.8
0.8
0.7
氧化氧数化数+1与族号+1一致,+1 +1 +1
E (*M(VE+)/M()L-3i.+0/4L常i)见反-常2的.7,1化3 是合由-物2.于92以4Li离+的子(-半2.9型8径) 为较(-主小3.02,6)易 与ⅡA水由分于B子eL(铍结i+)、合B生Meg成2(镁+半水) 合径C离小a(子钙,)放出S较r(锶多) 能量Ba所(钡致)
La Hf Ta W Re Os Ir Pt Au
80 Hg
81 Tl
82 Pb
83 Bi
84 85 Po At
86 Rn
7
87 Fr
89-
88 10 Ra 3
Ac
10 4
Rf
10 5
Db
10 6
Sg
107
10 8
Bh Hs
10 9
Mt
110111 112
无机化学课件:s区元素2017

总H焓2θ变/ k△JH• mmo/kl J1•mol-1
θ θ
(计算值) / V(实验值) /V
Li
150.5
520.1 -514.1 163.1 -454.5 -291.4 -3.02 -3.0401
Na
109.5
495.7 -413.8 197.3 -454.5 -275.2 -2.67 -2.71
保持在较小的数值。不难预料随Pk变小,ΔrGm向负值的方向 变动,有利于反应向右进行。
5.2.3 用途概述
两族元素金属和化合物的重要性可排出如下顺序:
金 属: Na>> Li >K > Cs > Rb Mg >> Ca > Be > Ba > Sr
化合物: Na > K >> Li >> Cs > Rb Ca >> Mg >> Ba >> Sr > Be
● 碱金属的液氨溶液比纯溶剂密度小
● 液氨中随 C(M) 增大,顺磁性减少
(2e
e22- )
钠溶于某些干燥的有机溶剂(如醚)也会产生溶剂合
电子的颜色.
用钠回流干燥这些溶剂时,颜色的出现可看作溶剂
处于干燥状态的标志。
Question 4
金属钠与水、液氨、乙醇的
反应有何不同?
Solution
2 Na(s) + 2 H2O(l)
5.1 概述 Generalization
碱金属 (alkalin metals) 碱土金属 (alkalin earth
(ⅠA): ns1
metals)
(ⅡA): ns2
电 金 原 锂 lithium
离属子
能性半 、、径
钠
sodium
电还增 负原大
钾
potassium
无机化学第五版s区元素42页PPT

41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不机化学第五版s区元素
36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
无机化学第七章S区元素

性质
Li Na
m.p./K
453.69 370.96
MOH 在水中
5.3
的溶解度/(mol·L-1)
26.4
K Rb Cs 336.8 312.04 301.55 19.1 17.9 25.8
无机化学
§7.2 s区元素的单质及其化合物的性质
(3) 与液氨作用
碱金属在液氨中的溶解度 (-35℃)
碱金属元素M
无机化学
§7.2 s区元素的单质及其化合物的性质
信号弹
无机化学
红绿锶钡信号弹
§7.2 s区元素的单质及其化合物的性质
§7.2.2 氧化物
1、碱金属-三类氧化物,碱土金属-普通氧化物
正常氧化物(O2-)
过氧化物(O22-)
超氧化物(O2-)
Li2O
Na2O2
KO2
2 氧化物的制备
直接法 2N O 2 a N2O a2
碱土金属(IIA ): ns2(因为它们的氧化物兼有碱性和土性) Be, Mg, Ca, Sr, Ba, Ra
✦土性 — 化学上把难溶于水和难熔融的性质称为 “土性”
无机化学
都是活泼金属
§7.1
s区元素的通性
碱金属
(alkalin
电金原 离属子 能性半 、、径 电还增 负原大 性性 减增 小强
metals) (ⅠA): ns1
电负性
0.98 0.93 0.82 0.82 0.79
标准电极电势(酸) -3.045 -2.711 -2.923 -2.925 -2.923
M+(g)水合热 /kJ·mol-1
无机化学
519 406 322 293 264
§7.1 s区元素的通性
大学无机化学第十二章 S区元素

N2
O2
MO2 (M = Ba), MO
H2O
M
NH3
M(NH2)2 + H2
水蒸气
MO + H2 (M = Be, Mg)
NaOH
HMO2- + H2 (M = Be)
MH2 (M = Ca, Sr, Ba)
3. 焰色反应
12.2.2 s区元素的存在和单质的制备
均以矿物形式存在: 钠长石: NaAlSi 3O8
I1
+,g) +,aq ) = △ (M H (M + I + fHm △ △subHm h m 1
+,g) +,aq ) = △ (M H (M + I + fHm △subHm △ h m 1
Li
Na
107.32 502.04
K
89.24 425.02
Rb
80.88 409.22
(2e e )
22
如果液氨保持干燥和足够高的纯度(特别是没有过渡金 属离子存在),溶液就相当稳定. 钠溶于某些干燥的有机溶剂(如醚)也会产生溶剂合电 子的颜色.
用钠回流干燥这些溶剂时,颜色的出现可看作溶剂处于 干燥状态的标志.
碱 金 属 单 质 的 某 些 典 型 反 应
M3 P M3N (M = Li) P N2 X2 MX (X = 卤素) M2 S M2O (M = Li, Na) M2O2 (M = Na, K, Rb, Cs) MO2 (M = K, Rb, Cs)
3.贵金属:这类金属包括金,银和铂族元 素(锇、铱、铂、钌、铑和钯).
4.准金属:一般指硅、硒、碲、砷、硼. 5.稀有金属:通常是指在自然界中含量很 少(但不绝对,如Ti为0.45%,在元素中 占第十位),分布稀散、发现较晚,难以 从原料中提取的或在工业上制备和应用 较晚的金属。
