高一化学必修2第二章单元测试题及答案
高一化学必修2第二章单元测试题及答案解析[001]
![高一化学必修2第二章单元测试题及答案解析[001]](https://img.taocdn.com/s3/m/ae15399852d380eb63946d0c.png)
高一化学第二章单元测试题(时间60分钟,满分100分)班别座号姓名评分_____ ___相对原子质量:Na 23 Al 27 Fe 56 Cu 64 H 1 O 16 C 12 S 16 Cl 35.5一、选择题(每小题只有一个选项符合题意,每小题2分,共10*2=20分)1.下列能源中,不会对环境造成污染而且又廉价方便的是()A.石油B.天然气C.氢气D.太阳能2.下面的能源中属于二次能源的是()A.电能、蒸汽B.电能、风能C.蒸汽、风能D.煤、石油3.下列反应中属吸热反应的是()A.镁与盐酸反应放出氢气B.氢氧化钠与盐酸的反应C.硫在空气或氧气中燃烧D.Ba(OH)2•8H2O与NH4Cl反应4.在空气中发生的燃烧,缓慢氧化和自燃的共同点是()A.都需要达到着火点B.都产生热量C.都要点燃D.都属于氧化反应5.下列说法正确的是()A.需要加热方能发生的反应一定是吸热反应 B.放热反应在常温下一定很容易发生C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小D.化学反应只生成新物质,没有能量的变化6.已知反应X+Y=M+N为放热反应,对该反应的说法正确的是( )。
A.X的能量一定高于M B.Y的能量一定高于NC. X和Y的总能量一定高于M和N的总能量D.因为该反应为放热反应,故不必加热就可发生7、决定化学反应速率的主要因素是()A、反应物的浓度B、反应温度C、使用催化剂D、反应物的性质8.现在电池的种类非常多,且由电池造成的污染越来越严重,下列电池不会造成环境污染的是()A.锂电池B.锌锰电池 C.氢氧燃料电池 D.镍镉电池9.下列关于燃料充分燃烧的说法,不正确...的是A.空气量越多越好B.应通入适量空气C.固体燃料燃烧前要粉碎D.液体燃料燃烧时可以以雾状喷出10)A C D二、选择题(每小题只有一个选项符合题意,每小题3分,共3*10=30分)11.火力发电是通过化石燃料燃烧,使化石燃料中化学能转化为电能,其能量转化方式正确的是()A.化学能→电能B.化学能→机械能→电能C.化学能→热能→电能D.化学能→热能→机械能→电能12.下列有关化石燃料的说法正确的是( )A.化石燃料是可再生的,因此地球上的蕴藏量也是无限的B.化石燃料虽然在地球上的蕴藏量有限,但形成化石燃料的速率相当快,所以化石燃料相当于是无限的C.化石燃料的形成非常复杂,需时间较长,但化石燃料在地球上的蕴藏量是无限的D.化石燃料在地球上的蕴藏量是有限的,而且又都是非再生能源13、20mL 0.5mol/L的盐酸与一块大理石反应,下列措施不能提高反应速率的是( )A、加入10mL 1mol/L的盐酸B、加入30mL 10mol/L的盐酸C、所用的大理石研磨成粉末D、加入10mL H2O14、已知反应A +3B =2C +D在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为()A、0.5mol·L-1·min-1B、1 mol·L-1·min-1C、2 mol·L-1·min-1D、3 mol·L-1·min-115、铜片和铁片用导线连接后插入稀硫酸中,铁片是()A.阴极B.正极C.阳极D.负极16、下列装置中,电流计G中有电流通过的是()17、合成氨的反应为:3H2+ N22NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是()A、v(H2)=v(N2)= v(NH3) B、v(H2)=3 v(N2) C、v(N2)=2 v(NH3) D、v(NH3)=3/2v(H2) 18.下列反应既是氧化还原反应,又是吸热反应的是()A.铝片与稀硫酸反应B.Ba(OH)2·8H2O与NH4Cl的反应C.灼热的炭与CO2反应D.甲烷在O2中燃烧反应19、可逆反应H2(g) +I2(g) 2HI(g)达到平衡的标志是()A、H2、I2、HI的浓度相等B、H2、I2、HI的浓度保持不变C、混合气体的密度保持不变D、混合气体的质量不再改变20.下列选项中说明氢气作为燃料的优点的是( )①燃烧时发生氧化反应②充分燃烧的产物不污染环境③氢气是一种再生能源④燃烧时放出大量热量A、①②③B、①②④C、①③④D、②③④三、填空题(每空2分,共34分)21.从能量的角度看,断开化学键要,形成化学键要。
版高一化学必修2第二章测试题(附答案)

高一化学必修 2 第二章测试题一、选择题1.化学反响陪伴着能量的变化。
以下过程中的能量变化不是由化学反响惹起的是 ()A.天然气焚烧 B .中和反响C.冰的融化D.Ba(OH) 2·8H2 O 晶体与氯化铵晶体反响2.对于反响中的能量变化,表述正确的选项是()A.放热反响中,反响物的总能量大于生成物的总能量B.断开化学键的过程会放出能量C.加热才能发生的反响必定是吸热反响D.氧化反响均为吸热反响4.以下对于反响速率的说法错误的选项是()A.反响速率用于权衡化学反响进行的快慢B.可逆反响达到化学均衡状态时,正、逆反响速率都为 0C.决定反响速率的主要要素是反响物的性质D.增大反响物浓度,提升反响温度都能增大反响速率V 2O55.2SO 2 (g) +O2(g)2SO 3(g)是制备硫酸的重要反响。
下△列表达正确的选项是 ()A.催化剂 V2 O5不改变该反响的逆反响速率B.增大反响系统的压强,反响速率必定增大C.该反响是放热反响,降低温度将缩短反响达到均衡的时间D.在 t1、t2时辰, SO 3(g) 的浓度分别是 c1、c2,则时间间隔c2-c1t1~t2内, SO 3 (g)生成的均匀速率为v=t2-t17.在必定条件下, N2和 H2在密闭容器内反响合成NH 3。
下列说法不正确的选项是 ()A.反响开始时,正反响速率最大,逆反响速率为零B.跟着反响的进行,正反响速率渐渐减小,最后为零C.跟着反响的进行,逆反响速率渐渐增大,最后不变D.跟着反响的进行,正反响速率渐渐减小,最后不变9.为了说明影响化学反响快慢的要素,甲、乙、丙、丁四位学生疏别设计了以下A~D 四个实验,你以为结论不正确的选项是()A.在同样条件下,等质量的大理石块和大理石粉与同样的盐酸反响,大理石粉反响快B.将同样大小、形状的镁条和铝条分别与同样浓度的盐酸反响时,二者速率同样大C.将浓硝酸分别放在冷暗处和强光照耀下,会发现光照能够加速浓硝酸的分解D.两支试管中分别加入同样浓度同样体积的双氧水,此中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不一样14.必定温度下,可逆反响3X(g) + Y(g)2Z(g) 达到限度的标记是 ()A.单位时间内生成 3n mol X ,同时耗费 n mol YB.X 的生成速率与 Z 的生成速率相等C.X、Y、Z的浓度相等D.X、Y、Z 的分子数之比为 3∶1∶2二、非选择题19 . (12 分)Ⅰ.在恒温条件下将必定量 X 和 Y 的混淆气体通入一容积为 2 L 的密闭容器中, X 和 Y 两物质的浓度随时间变化状况以以下图。
高中化学必修二第二章习题(含答案)

第二章化学反应与能量一.选择题(每小题只有一个正确选项,每小题3分,共48分)1.下列物质加入水中发产生吸热反应得就是 ( )A.生石灰B.固体NaOHC.浓硫酸D.固体NH4NO32.已知 2SO2+O2 2SO3为放热反应,对该反应得下列说法中正确得就是( )A.O2得能量一定高于SO2得能量B.SO2与O2得总能量一定高于SO3得总能量C.SO2得能量一定高于SO3得能量D.因该反应为放热反应,故不必加热就可发生3.下列反应既属于氧化还原反应,又就是吸热反应得就是 ( )A.锌粒与稀硫酸得反应B.灼热得木炭与COz反应C.甲烷在氧气中得燃烧反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体得反应4.下列关于燃料充分燃烧得说法,不正确...得就是 ( )A.空气量越多越好B.应通入适量空气C.固体燃料燃烧前要粉碎D.液体燃料燃烧时可以以雾状喷出5.下列各个装置中能组成原电池得就是 ( )6.有A、B、C、D四种金属。
将A与B用导线连接起来,浸入电解质溶液中,B为正极。
将A、D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B得盐溶液里,无明显变化。
如果把铜浸入C得盐溶液里,有金属C析出。
据此判断它们得活动性由强到弱得顺序就是 ( )A.DCABB.DABCC.DBACD.BADC7.下列化学电池不易造成环境污染得就是 ( )A. 氢氧燃料电池B.锌锰电池C.镍镉电池D. 铅蓄电池8.对于锌一铜一稀酸组成得原电池装置中,当导线中有1 mol电子通过时,理论上得两极变化就是( )。
①锌片溶解了32、5g②锌片增重32、5g③铜片上析出lg H2④铜片上析出1mol H2A.①与③B.①与④C.②与③D.②与④9.过量得锌粉与一定量得稀盐酸反应,为了减慢反应速率,但就是又不影响生成得氢气总量,可以采取得措施就是 ( )A.升高温度B.加入适量得水C.加入少量CuSO4溶液D.加入浓度较大得盐酸10.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快得就是 ( )A.10℃ 20mL 3mol/L得盐酸溶液B.20℃ 30mL 2mol/L得盐酸溶液C.20℃ 20mL 2mol/L得盐酸溶液D.20℃ 10mL 4mol/L得盐酸溶液11.一定温度下,可逆反应3X(g)+Y(g) 2Z(g)达到限度得标志就是( )A、单位时间内生成3n mol X,同时消耗n mol YB、X得生成速率与Z得生成速率相等C、X、Y、Z得浓度相等D、X、Y、Z得分子个数比为3:1:212.决定化学反应速率得主要因素就是 ( )A.参加反应得物质本身得性质B.催化剂C.温度、压强以及反应物得接触面D.反应物得浓度13.下列叙述正确得就是 ( )A.化学反应除了生成新得物质外,还伴随着能量得变化B.物质燃烧不一定就是放热反应C.放热得化学反应不需要加热就能发生D.吸热反应不加热就不会发生14.把镁条投入到盛有盐酸得敞口容器中,产生H2得速率可由右图表示。
高中化学必修二第二章单元测试题及答案解析

第二章单元测试题班级 姓名相对原子质量: Na 23 Al 27 Fe 56 Cu 64 H 1 O 16 C 12 S 16 Cl 一、选择题(每题只有一个选项切合题意)1.以下能源中,不会对环境造成污染并且又低价方便的是()A .石油B .天然气C .氢气D.太阳能2.下边的能源中属于二次能源的是()A .电能、蒸汽B .电能、风能C .蒸汽、风能D .煤、石油3. 以下反响中属吸热反响的是()A. 镁与盐酸反响放出氢气B.氢氧化钠与盐酸的反响C. 硫在空气或氧气中焚烧(OH)?8H O 与 NHCl 反响2244. 在空气中发生的焚烧,迟缓氧化和自燃的共同点是( )A. 都需要达到着火点B. 都汲取热量C. 都重点燃D.都属于氧化反响5. 以下说法正确的选项是()A . 需要加热方能发生的反响必定是吸热反响B .放热反响在常温下必定很简单发生C .反响是放热仍是吸热,一定看反响物和生成物所拥有的总能量的相对大小D .化学反响只生成新物质,没有能量的变化6.已知反响 X+Y = M+N 为放热反响,对该反响的说法正确的选项是 ( )。
A . X 的能量必定高于 MB . Y 的能量必定高于 N C. X和 Y 的总能量必定高于 M 和 N 的总能量D .由于该反响为放热反响,故不用加热便可发生 7、决定化学反响速率的主要要素是( )A 、反响物的浓度B 、反响温度C 、使用催化剂D、反响物的性质8.此刻电池的种类特别多,且由电池造成的污染愈来愈严重,以下电池不会造成环境污染的是( )A .锂电池B .锌锰电池C .氢氧燃料电池D .镍镉电池9.以下对于燃料充足焚烧的说法,不正确 的是( )...A .空肚量越多越好B .应通入适当空气C.固体燃料焚烧前要粉碎D.液体燃料焚烧时能够以雾状喷出10、以下各装置中,不可以组成原电池的是(电解质都为稀硫酸) () A 、Zn BFe、CuCFe、CD Fe 、FeC11.火力发电是经过化石燃料焚烧,使化石燃猜中化学能转变为电能, 其能量转变方式正确的是( )A.化学能C.化学能→ 电能→ 热能→电能B.化学能D.化学能→ 机械能→电能→ 热能→ 机械能→电能12.以下相关化石燃料的说法正确的选项是()A.化石燃料是可重生的,所以地球上的储藏量也是无穷的B.化石燃料固然在地球上的储藏量有限,但形成化石燃料的速率相当快,所以化石燃料相当于是无穷的C.化石燃料的形成特别复杂,需时间较长,但化石燃料在地球上的储藏量是无穷的D.化石燃料在地球上的储藏量是有限的,并且又都是非重生能源13、 20mL L 的盐酸与一块大理石反响,以下举措不可以提升反响速率的是()A、加入 10mL 1mol/L 的盐酸B、加入 30mL 10mol/L的盐酸C、所用的大理石研磨成粉末D、加入 10mL H O214、已知反响 A + 3B= 2C + D 在某段时间内以 A 的浓度变化表示的化学反响速率为- 1- 1C 的浓度变化表示的化学反响速率为()1mol· L · min,则此段时间内以A、· L-1· min -1B、 1 mol · L-1· min-1C、 2 mol ·L-1·min-1D、 3 mol · L-1· min-115、铜片和铁片用导线连结后插入稀硫酸中,铁片是()A. 阴极B.正极C.阳极D. 负极16、以下装置中,电流计G中有电流经过的是()17、合成氨的反响为: 3H2+ N 2 2NH3,其反响的速率可分别表示为v(H 2) 、 v(N 2) 、 v(NH3)( 单位为 mol ·L-1·s-1) ,则以下关系正确的选项是()A、 v(H) =v(N)= v(NH)B、 v(H ) =3 v(N)22322C、 v(N) =2 v(NH )D、 v(NH ) = 3/2v(H )233218.以下反响既是氧化复原反响,又是吸热反响的是()A.铝片与稀硫酸反响B. Ba(OH) ·8H O与 NHCl 的反响224C.灼热的炭与 CO反响D.甲烷在 O 中焚烧反响2219、可逆反响 H (g)+ I (g) 2HI(g)达到均衡的标记是()22A、H、I 、HI 的浓度相等B、H、I、 HI 的浓度保持不变2222C、混淆气体的密度保持不变D、混淆气体的质量不再改变20.以下选项中说明氢气作为燃料的长处的是( )①焚烧时发生氧化反响②充足焚烧的产物不污染环境③氢气是一种重生能源④焚烧时放出大批热量A、①②③B、①②④C、①③④D、②③④二、填空题21.从能量的角度看,断开化学键要,形成化学键要。
最新版高一化学必修2第二章测试题(附答案)

高一化学必修2第二章测试题一、选择题1.化学反应伴随着能量的变化。
下列过程中的能量变化不是由化学反应引起的是( )A.天然气燃烧B.中和反应C.冰的熔化D.Ba(OH) 2·8H2O 晶体与氯化铵晶体反应2.对于反应中的能量变化,表述正确的是( )A.放热反应中,反应物的总能量大于生成物的总能量B.断开化学键的过程会放出能量C.加热才能发生的反应一定是吸热反应D.氧化反应均为吸热反应4.下列关于反应速率的说法错误的是( )A.反应速率用于衡量化学反应进行的快慢B.可逆反应达到化学平衡状态时,正、逆反应速率都为0 C.决定反应速率的主要因素是反应物的性质D.增大反应物浓度,提高反应温度都能增大反应速率V 2O55.2SO2(g)+O2(g) 2SO3(g)是制备硫酸的重要反应。
下△列叙述正确的是( )A.催化剂V2O5 不改变该反应的逆反应速率B.增大反应体系的压强,反应速率一定增大C.该反应是放热反应,降低温度将缩短反应达到平衡的时间D.在t1、t2 时刻,SO3(g)的浓度分别是c1、c2,则时间间隔c2-c1t1~t2 内,SO3(g)生成的平均速率为v=t2-t17.在一定条件下,N2 和H2 在密闭容器内反应合成NH3。
下列说法不正确的是( )A.反应开始时,正反应速率最大,逆反应速率为零B.随着反应的进行,正反应速率逐渐减小,最后为零C.随着反应的进行,逆反应速率逐渐增大,最后不变D.随着反应的进行,正反应速率逐渐减小,最后不变9.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D 四个实验,你认为结论不正确的是( )1A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,两者速率一样大C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解D.两支试管中分别加入相同浓度相同体积的双氧水,其中同一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不14.一定温度下,可逆反应3X(g)+Y(g) 2Z(g)达到限度的标志是( )A.单位时间内生成3n mol X ,同时消耗n mol YB.X 的生成速率与Z 的生成速率相等C.X、Y、Z 的浓度相等D.X、Y、Z 的分子数之比为3∶1∶ 2题择二、非选19.(12 分)Ⅰ.在恒温条件下将一定量X 和Y 的混合气体通化2 L 的密闭容器中,X 和Y 两物质的浓度随时间变入一容积为情况如下图。
人教版高一下化学必修二第二章单元测试(含答案)
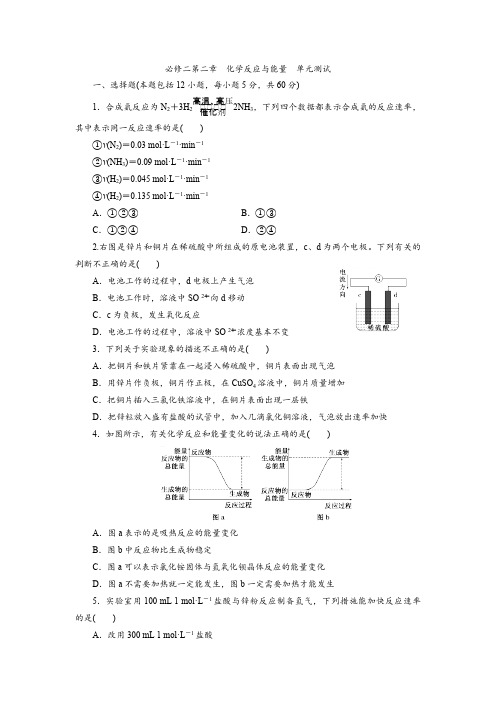
二、非选择题(本题包括 3 小题,共 40 分) 13. (12 分 )在 1×105 Pa、 298 K 时,将 1 mol 气态 AB 分子分离成气态 A 原子和 B 原 子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知氨分子中有三个等价 的氮氢共价键): 共价键 键能(kJ·mol-1) H—H 436 N≡N 945 N—H 391
2.右图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d 为两个电极。下列有关的 判断不正确的是( ) A.电池工作的过程中,d 电极上产 2-
C.c 为负极,发生氧化反应
4 浓度基本不变 D.电池工作的过程中,溶液中 SO 2-
3.下列关于实验现象的描述不正确的是( ) A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 B.用锌片作负极,铜片作正极,在 CuSO4 溶液中,铜片质量增加 C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 4.如图所示,有关化学反应和能量变化的说法正确的是( )
8.在一定温度下,可逆反应 2A(g)+B(g)⇌C(g)+D(g)达到平衡的标志是( ) A.C 的生成速率和 B 的消耗速率相等 B.v 正(A)=2v 正(B) C.2v 正(A)=v 逆(B) D.反应混合物中 A、B、C、D 的质量分数不再发生变化 9.被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边 镀二氧化锰)作为传导体。在纸内的离子“流过 ”水和氧化锌组成的电解液。电池总反应为 Zn+2MnO2+H2O===ZnO+2MnO(OH),下列说法正确的是( ) A.该电池的正极为锌 B.该电池反应中二氧化锰起催化剂作用 C.当 0.1 mol Zn 完全溶解时,转移电子个数为 1.204×1024 D.电池正极反应式为 2MnO2+2e-+2H2O===2MnO(OH)+2OH- 10.反应 3X(g)+ Y(g)⇌ 2Z(g)+ 2W(g)在 2 L 密闭容器中进行, 5 min 后 Y 减少了 0.5 mol,则此反应的平均速率 v 为( ) A.v(X)=0.05 mol·L-1·min-1 B.v(Y)=0.10 mol·L-1·min-1 C.v(Z)=0.10 mol·L-1·min-1 D.v(W)=0.05 mol·L-1·s-1
人教版高中化学必修2第二章单元测试题(含解析)

………装…………○________姓名:___________班………装…………○人教版高中化学必修2第二章单元测试题(含解析) 第I 卷(选择题) 一、单选题 1.下列变化过程,属于放热过程的是 A .液态水变成水蒸气 B .酸碱中和反应 C .弱酸电离 D .NH 4Cl 晶体与Ba(OH)2·8H 2O 混合搅拌 2.下列反应不可能作为原电池工作时发生的反应的是 A .Cu+2AgNO 3=Cu(NO 3)2+2Ag B .2Fe+O 2+2H 2O =2Fe(OH)2 C .NaOH+HCl =NaCl+H 2O D .2H 2+O 2=2H 2O 3.表面镀有保护金属层的铁片,当镀层有破损时比普通铁片更难腐蚀的是 A .白铁(镀锌铁) B .马口铁(镀锡铁) C .镀铅铁 D .镀铜铁 4.一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C 2H 5OH + 3O 2 = 2 CO 2 + 3H 2O ,电池构造如下图。
下列关于该电池的说法不正确...的是 A .放电过程中,电源内部的H +从正极区向负极区迁移 B .通入乙醇的电极是负极 C .该电池的正极反应为:4H + + O 2 + 4e -= 2H 2O D .用该电池做为电源,用惰性电极电解饱和NaCl 的水溶液时,每消耗0.2 mol C 2H 5OH ,阳极产生标准状况下气体的体积为26.88 L 5.氯碱工业的原理示意图如图。
下列说法正确的是○…………订…………线…………__班级:___________考号:_________○…………订…………线………… A .M 为负极B .通电使氯化钠发生电离C .出口c 收集到的物质是氯气D .通电一段时间后,阴极区pH 降低 6.某化学科研小组研究在其他条件不变时,改变某一条件对A 2(g)+3B 2(g)2AB 3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T 表示温度,n 表示物质的量),根据如图可得出的判断结论正确的是( ) A .反应速率a >b >c B .达到平衡时,AB 3的物质的量大小为:b > c > a C .若T 2>T 1,则正反应一定是吸热反应 D .达到平衡时A 2的转化率大小为:b >a >c 7.下列生产或实验事实引出的相应结论不正确的是( ) 一定条件下:H 2(g)+I 2(g) 2HI(g)达到反应………订……___________考号:___………订……A .AB .BC .CD .D 8.下列热化学方程式中,ΔH 的数值能表示可燃物标准燃烧热的是( ) A .CO(g)+1/2O 2(g)===CO 2(g) ΔH++283 kJ·mol -1 B .CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g) ΔH++802.3 kJ·mol -1 C .2H 2(g)+O 2(g)===2H 2O(l) ΔH++571.6 kJ·mol -1 D .H 2(g)+1/2O 2(g)===H 2O(g) ΔH++242 kJ·mol -1 9.在一固定容积的密闭容器中,充入2 mol A 和1 mol B 发生如下反应:2A(g)+B(g)xC(g),达到平衡后,C 的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A 、0.3 mol B 和1.4 mol C 为起始物质,达到平衡后,C 的体积分数也为w%,则x 的值为 A .5 B .4 C .3 D .1 10.在一定条件下,向某容器中充入N 2和H 2合成NH 3,以下叙述错误的是( ) A .开始反应时,正反应速率最大,逆反应速率为零 B .随着反应的进行,正反应速率逐渐减小,最后减小为零 C .随着反应的进行,逆反应速率逐渐增大,最后保持恒定 D .随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定 11.已建立平衡的可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是 +生成物的百分含量一定增加; +生成物的产量一定增加; +反应物的转化率一定增加; +反应物物质的量浓度一定减小; +正反应速率一定大于逆反应速率; +使用了催化剂 A .++ B .++ C .++ D .+++ 12.最近我国科学家发明“可充电钠-二氧化碳电池”(如下图),放电时电池总反应为:4Na+3CO 2=2Na 2CO 3+C 。
高中化学必修2第二章单元检测有答案

必修2第二章检测题可能用到的原子量: H :1 O :16 Cl:35.5一、选择题(每题只有1个正确选项,每小题2分,共20分) 1.下列说法正确的是A. 物质发生化学反应都伴随着能量变化 B .伴有能量变化的物质变化都是化学变化C .在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 D. 放热反应的发生无需任何条件2.Co 6027是γ放射源,可用于农作物诱变育种,我国用该方法培育出了许多农作物新品种,对Co 6027原子的叙述不正确...的是 A 、质量数是60 B 、质子数是60C 、中子数是33D 、电子数是27 3.下列叙述不正确的是 A .H 2S 、H 2O 、HF 的稳定性依次增强 B .RbOH 、KOH 、Mg(OH)2的碱性依次减弱 C .Na +、Mg 2+、Al 3+的氧化性依次减弱 D .H 4SiO 4、H 2CO 3、H 2SO 4酸性依次增强 4.下列说法正确的是A 、离子键就是阴阳离子间的静电引力B 、所有金属元素与所有非金属间都能形成离子键C 、钠原子与氯原子结合成氯化钠后体系能量降低D 、在离子化合物氯化钙中,两个氯原子间也存在离子键 5.下列有关原子结构和元素周期律表述正确的是①原子序数为15的元素的最高化合价为+3 ②ⅦA 族元素是同周期中非金属性最强的元素③第二周期ⅣA 族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA 族 A .①②B .①③C .②④D .③④6、下列比较错误的是A 、金属性:Na>Mg>AlB 、非金属性:Cl>S>P>SiC 、碱性:NaOH>Mg(OH)2>Al(OH)3D 、酸性:HClO>H 2SO 3>H 3PO 4>H 4SiO 47、某元素A 的最高正化合价与负化合价的代数和等于4,它的最高价氧化物中氧占60%,且A 的原子中具有相同的质子数和中子数,则A 的元素符号为 A 、C B 、Cl C 、S D 、P8.原电池产生电流的本质原因是 A.原电池中溶液能电离出自由移动的离子 B.有导线将两个活动性不同的电极连接C.正极发生了氧化反应,而负极发生了还原反应 D .电极上进行的氧化还原反应中会有电子的转移9.短周期元素X 、Y 、Z 在周期表中的位置关系如图所示,已知X 最外层电子数为2,则 下列叙述中正确的是A .Z 一定是活泼的金属元素B .Y 的最高价氧化物的水化物是一种强酸C .1molX 的单质跟足量水反应时,发生转移的电子为2molD .Y 的氢化物稳定性大于Z 的氢化物稳定性10.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是 A .半导体材料砷化镓 B .吸氢材料镧镍合金 C .透明陶瓷材料硒化锌 D .超导材料K 3C 60二、选择题(每小题有1—2个正确选项,每小题2分,共30分) 11.下列有关叙述中错误的是A 、元素的性质随着相对原子质量的递增而呈周期性变化B 、两个原子如果核外电子排布相同,一定是同一种元素C 、原子的次外层电子数不一定是8个D 、一切原子的原子核都是由质子和中子构成12.下列说法中正确的是A 、两个原子或多个原子之间的相互作用叫做化学键B 、阴阳离子间通过静电引力而形成的化学键叫做离子键C 、只有金属元素和非金属元素化合时才能形成离子键D、大多数的盐、碱和低价金属氧化物中含有离子键13.下列关于元素周期表和元素周期律的说法中正确的是A、在周期表中,元素的族序数都等于其原子的最外层电子数B、周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强C、同主族元素随原子核电荷数的递增,原子半径依次增大D、ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点降低。
高一化学人教版必修2:第二章检测题及答案

高一化学人教版必修2:第二章检测题学校_______班级________学号_______姓名______第I卷(选择题)一、单选题1.已知化学反应2C(s)+O2(g)=2CO(g)和2CO(g)+O2(g)=2CO2(g)都是放热反应。
据此判断,下列说法中不正确的是(其他条件均相同)A. 12 g C所具有的能量一定高于28 g CO所具有的能量B. 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的能量C. 12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量D. 将一定质量的C燃烧,生成CO2比生成CO时放出的热量多2.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。
由图可得出的正确结论是A. 反应在c点达到平衡状态B. 反应物浓度:a点小于b点C. 反应物的总能量低于生成物的总能量D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段3.在可逆反应CO(g)+H2O(g) CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是()。
A.升高温度B.降低温度C.使用催化剂D.增大CO浓度4.假设某化学反应的反应过程如下图所示观察分析,符合图中变化的化学反应为A. A 2+3B 22AB 3B. 2AB 2+B 22AB 3C. 2A 2B+5B 2==4AB 3D. 2AB 2+B 2="=2" AB 35.甲:在试管中加入1 g粉末状大理石,加入4 mol/L盐酸20 mL(过量);乙:在试管中加入2 g颗粒状大理石,加入4 mol/L盐酸20 mL(过量);下列CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图合理的是A. AB. BC. CD. D6.如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法正确的是( )A.X为负极,电极反应式为Si-4e-===Si4+B.X为正极,电极反应式为4H2O+4e-===4OH-+2H2↑C.X为负极,电极反应式为Si+6OH--4e-===SiO+3H2OD.Y为负极,电极反应式为Fe-2e-===Fe2+7.可逆反应2NO22NO+O2在密闭容器中反应,达到平衡状态的标志是( )①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态④混合气体的颜色不再改变的状态A. ①④B. ②③C. ①③④D. ①②③④8.可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是A. 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH-B. 以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-═Al(OH)3↓C. 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变D. 电池工作时,电子通过外电路从正极流向负极9.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )A. 反应的化学方程式为X(g)+Y(g) Z(g)B. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1D. 反应开始到10 s,Y的转化率为79.0%10.某反应由两步反应A B C构成,它的反应能量曲线如图,下列叙述正确的是A. 两步反应均为吸热反应B. 三种化合物中C最稳定C. A与C的能量差为E4D. A B反应,反应条件一定要加热11.在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。
化学人教版高中必修2必修2第二章第二节单元检测(含答案)

(时间:90分钟,分数:100分)一、单项选择题(每小题4分,共44分)1.下列说法中不.正确的是()A.任何化学反应都伴随着能量的变化B.化学反应中一定有新物质生成C.经过加热而发生的化学反应不一定都是吸热反应D.只要有化学键的断裂,一定发生化学反应解析:选D。
任何化学反应都伴随着能量的变化,A项正确;化学反应中一定有新物质生成,B项正确;很多放热反应也需要加热或点燃才能发生,C项正确;化学反应中既有反应物的旧化学键断裂,又有生成物的新化学键形成,D项错误。
2.关于反应Br+H2HBr+H的能量与反应历程的示意图如下图所示,下列叙述中正确的是()A.正反应为放热反应B.加入催化剂能加快化学反应速率C.反应物总能量高于生成物总能量D.升高温度可增大正反应速率,降低逆反应速率解析:选B。
图中反应物总能量低于生成物总能量,表示吸热反应,故A、C不正确;加入催化剂能加快化学反应速率,故B正确;升高温度,正、逆反应速率均加快,故D不正确。
3.下列措施对增大反应速率明显有效的是()A.Na与水反应时增大水的用量B.Fe与稀硫酸反应制取H2时,改用浓硫酸C.在K2SO4与BaCl2两溶液反应时,增大压强D.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉解析:选D。
水为纯液体,浓度为定值;Fe与浓H2SO4常温下会发生钝化;对于溶液中的离子反应,压强不会改变反应速率;将铝片改为铝粉,增大固体与气体的接触面积,反应速率增大。
4.人造卫星常用到的一种高能电池——银锌蓄电池,它在放电时的电极反应为Zn+2OH--2e-===ZnO+H2O、Ag2O+H2O+2e-===2Ag+2OH-,据此判断氧化银是() A.负极,被氧化B.正极,被还原C.负极,被还原D.正极,被氧化解析:选B。
原电池就是把氧化还原反应拆分成氧化反应和还原反应两部分,分别在两个电极上发生,使电子经外电路移动,从而产生电流。
负极上发生氧化反应,正极上发生还原反应。
高中化学必修二第二章习题(含答案)

第二章化学反应与能量一.选择题(每小题只有一个正确选项,每小题3分,共48分)1.下列物质加入水中发产生吸热反应的是()A.生石灰B.固体NaOHC.浓硫酸D.固体NH4NO3 2.已知2SO2+O22SO3为放热反应,对该反应的下列说法中正确的是()A.O2的能量一定高于SO2的能量B.SO2和O2的总能量一定高于SO3的总能量C.SO2的能量一定高于SO3的能量D.因该反应为放热反应,故不必加热就可发生3.下列反应既属于氧化还原反应,又是吸热反应的是() A.锌粒与稀硫酸的反应B.灼热的木炭与COz反应C.甲烷在氧气中的燃烧反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应4.下列关于燃料充分燃烧的说法,不正确...的是()A.空气量越多越好B.应通入适量空气C.固体燃料燃烧前要粉碎D.液体燃料燃烧时可以以雾状喷出5.下列各个装置中能组成原电池的是() 6.有A、B、C、D四种金属。
将A与B用导线连接起来,浸入电解质溶液中,B为正极。
将A、D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B的盐溶液里,无明显变化。
如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是()A.DCAB B.DABC C.DBAC D.BADC7.下列化学电池不易造成环境污染的是() A.氢氧燃料电池B.锌锰电池C.镍镉电池D.铅蓄电池8.对于锌一铜一稀酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是()。
①锌片溶解了32.5g②锌片增重32.5g③铜片上析出lgH2④铜片上析出1molH2A.①和③B.①和④C.②和③D.②和④9.过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是()A.升高温度B.加入适量的水C.加入少量CuSO4溶液D.加入浓度较大的盐酸10.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是()A.10℃20mL3mol/L的盐酸溶液B.20℃30mL2mol/L的盐酸溶液C.20℃20mL2mol/L的盐酸溶液D.20℃10mL4mol/L的盐酸溶液11.一定温度下,可逆反应3X(g)+Y(g)2Z(g)达到限度的标志是()A.单位时间内生成3nmolX,同时消耗nmolYB.X的生成速率与Z的生成速率相等C.X、Y、Z的浓度相等D.X、Y、Z的分子个数比为3:1:212.决定化学反应速率的主要因素是()A.参加反应的物质本身的性质 B.催化剂C.温度、压强以及反应物的接触面D.反应物的浓度13.下列叙述正确的是()A.化学反应除了生成新的物质外,还伴随着能量的变化B.物质燃烧不一定是放热反应C.放热的化学反应不需要加热就能发生D.吸热反应不加热就不会发生14.把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。
高一化学必修二第二章测验试卷含答案及解析

高一化学必修二第二章测验试卷(含答案及解析)高一化学必修二第二章单元测试题(含答案及解析)时间:90分钟满分:100分一、选择题(每小题3分,共48分)1.在众多的环境污染中,废旧电池的污染可谓让人触目惊心,废电池中对环境形成污染的主要物质是()A.镉B.锌.二氧化锰D C.石墨A【答案】镉是致癌物质,是对环境形成污染的主要物质。
【解析】.有如下两个反应:2电解高温↑↑+Cl①2HCl=====H↑+↑②2HCl=====HCl2222) 关于这两个反应的叙述错误的是( A.①②两反应都是氧化还原反应B.①②两反应中的能量转换方式都是热能转变为化学能C.①反应是热能转变为化学能D.②反应是电能转变为化学能B【答案】是电能转变为②有单质生成的分解反应一定是氧化还原反应,A项正确;反应【解析】是吸热反应,是热能转变为化学能,C项正确。
B化学能;项错误,D项正确;反应①) 3.面粉厂必须严禁烟火的主要原因是( .防止污染面粉B.防止火灾发生AC.防止面粉爆炸D .吸烟有害健康D【答案】导致氧气与面粉的接触面【解析】面粉颗粒极小,当其扩散在空气中与空气充分接触,——爆炸。
面积增大一旦引发反应,极易发生剧烈的氧化还原反应) (4.化学电池可以直接将化学能转化为电能,化学电池的本质是A.化合价的升降 B .电子的转移.电能的储存D .氧化还原反应CB【答案】而电子转移则是氧化还原反应的实【解析】化合价的升降是氧化还原反应的表现形式,质,而只有氧化还原反应才能设计为原电池。
9/ 1高一化学必修二第二章测验试卷(含答案及解析)5.某同学做完铜、锌原电池的实验后得到了下列结论,你认为不正确的是()A.构成原电池正极和负极的材料必须是两种金属B.由铜、锌电极与硫酸铜溶液组成的原电池铜是正极C.电子沿导线由锌流向铜,在铜极上氢离子得到电子而放出氢气D.铜锌原电池工作时,锌溶解,所以才产生电子【答案】A【解析】一般构成原电池负极的是金属,而且是活泼性的金属,而正极可以是导电的非金属,如石墨碳棒;但负极也不一定是金属6.锌电池可代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应是2Zn +O===2ZnO。
高中化学必修二--第二章测试题参考答案

.
.
高中化学必修二 第二章测试题参考答案:
一、选择题(本题20个小题,每小题3分,共60分)
1、C
2、A
3、AB
4、A
5、D
6、B
7、A
8、C
9、AC 10、B 11、C 12、
B 13、D 14、B 15、B 16、BD 17、B 18、D 19、
C 20、C
二、填空题(本题4个小题,共29分)
21.(7分)(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体。
(3分)
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体。
(2分)
(3)Mg+2H +=Mg 2++H 2(1分) (4)小于(1分)
22. (6分)(1)亮 a Mg-2e= Mg 2+ 2H ++2e -= H 2(2)亮 a 6 H 2O+6e -=3 H 2+6OH - 2Al-6e -+2OH -=2AlO 2+6 H 2O (每空均1分)
23.(4分)(1)铝 Al-3e —==Al 3+ (2)铜 正 (每空均1分)
24.(12分)(1)L mol V a
/ L mol V
b / 0 ν(正) ν(逆)(2)减小 减小 增大 减小 增大 (3)相等 保持不变(每空均1分)。
三、计算题(本题两个小题,共11分)
25. (1)2:6:1 (2分) (2)20% (2分) (3)0.1 mol/L ·min (2分)
26.(1)1.2mol/L (2分) (2)0.6mol/L ·min (3分)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学第二章单元测试题
相对原子质量:Na 23 Al 27 Fe 56 Cu 64 H 1 O 16 C 12 S 16 Cl 35.5
一、选择题(每小题只有一个选项符合题意,每小题2分,共10*2=20分)
1.下列能源中,不会对环境造成污染而且又廉价方便的是()A.石油B.天然气C.氢气D.太阳能
2.下面的能源中属于二次能源的是()A.电能、蒸汽B.电能、风能C.蒸汽、风能D.煤、石油
3.下列反应中属吸热反应的是()
A.镁与盐酸反应放出氢气
B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧
D.Ba(OH)2•8H2O与NH4Cl反应
4.在空气中发生的燃烧,缓慢氧化和自燃的共同点是()
A.都需要达到着火点
B.都产生热量
C.都要点燃
D.都属于氧化反应
5.下列说法正确的是()
A.需要加热方能发生的反应一定是吸热反应 B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.化学反应只生成新物质,没有能量的变化
6.已知反应X+Y=M+N为放热反应,对该反应的说法正确的是( )。
A.X的能量一定高于M B.Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热就可发生
7、决定化学反应速率的主要因素是()
A、反应物的浓度
B、反应温度
C、使用催化剂
D、反应物的性质
8.现在电池的种类非常多,且由电池造成的污染越来越严重,下列电池不会造成环境污染的是()A.锂电池B.锌锰电池 C.氢氧燃料电池 D.镍镉电池
9.下列关于燃料充分燃烧的说法,不正确
...的是
A.空气量越多越好B.应通入适量空气
C.固体燃料燃烧前要粉碎D.液体燃料燃烧时可以以雾状喷出
10
)
A C D
二、选择题(每小题只有一个选项符合题意,每小题3分,共3*10=30分)
11.火力发电是通过化石燃料燃烧,使化石燃料中化学能转化为电能,其能量转化方式正确的是()A.化学能→电能B.化学能→机械能→电能
C.化学能→热能→电能D.化学能→热能→机械能→电能12.下列有关化石燃料的说法正确的是( )
A.化石燃料是可再生的,因此地球上的蕴藏量也是无限的
B.化石燃料虽然在地球上的蕴藏量有限,但形成化石燃料的速率相当快,所以化石燃料相当于是无限的
C.化石燃料的形成非常复杂,需时间较长,但化石燃料在地球上的蕴藏量是无限的D.化石燃料在地球上的蕴藏量是有限的,而且又都是非再生能源
13、20mL 0.5mol/L的盐酸与一块大理石反应,下列措施不能提高反应速率的是( )
A、加入10mL 1mol/L的盐酸
B、加入30mL 10mol/L的盐酸
C、所用的大理石研磨成粉末
D、加入10mL H2O
14、已知反应A +3B =2C +D在某段时间内以A的浓度变化表示的化学反应速率为
1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为()
A、0.5mol·L-1·min-1
B、1 mol·L-1·min-1
C、2 mol·L-1·min-1
D、3 mol·L-1·min-1
15、铜片和铁片用导线连接后插入稀硫酸中,铁片是()
A.阴极
B.正极
C.阳极
D.负极
16、下列装置中,电流计G中有电流通过的是()
17、合成氨的反应为:3H2+ N22NH3,其反应的速率可分别表示为v(H2)、v(N2)、
v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是()A、v(H2)=v(N2)= v(NH3) B、v(H2)=3 v(N2) C、v(N2)=2 v(NH3) D、v(NH3)=3/2v(H2) 18.下列反应既是氧化还原反应,又是吸热反应的是()A.铝片与稀硫酸反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应D.甲烷在O2中燃烧反应
19、可逆反应H2(g) +I2(g) 2HI(g)达到平衡的标志是()
A、H2、I2、HI的浓度相等
B、H2、I2、HI的浓度保持不变
C、混合气体的密度保持不变
D、混合气体的质量不再改变
20.下列选项中说明氢气作为燃料的优点的是( )
①燃烧时发生氧化反应②充分燃烧的产物不污染环境
③氢气是一种再生能源④燃烧时放出大量热量
A、①②③
B、①②④
C、①③④
D、②③④
三、填空题(每空2分,共34分)
21.从能量的角度看,断开化学键要,形成化学键要。
化学反应是释
放能量还是吸收能量取决于,当反应物的
总能量高于生成物时,该反应为反应;当反应物的总能量低于生成物时,该反应为
反应。
22.(6分)如图所示是8000C时,X、Y、Z三种气体的浓度(c)随时
间(t)的变化情况,t2是反应达到平衡的时间,写出反应的化学方程
式:
(第24题图)
23.已知拆开1 mol H —H 键、1 mol I —I 、1 mol H —I 键分别需要吸收的能量为436kJ 、151k J 、299k J 。
则由氢气和碘反应生成1 mol HI 需要 (填“放出”或“吸收”) k J 的热量。
24.指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭 ,(2)给手机的电池充电 ,
(3)用蓄电池点亮灯泡 ,(4)电解水得到O 2和H 2
25.某可逆反应从0—2分钟进行过程中,在不同反应时间各物质的量的变化情况如右图所示。
则该反应的的反应物是 ,生成物
是 ,化学方程式为 ;反应开
始至2分钟时,能否用C 表示反应速率?若能,其反应速率为 ,若不能,则其原因为 _
_________ ;2分钟后A 、B 、C 各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了_________ 状态。
四、计算题(共16分)
26、A 和B 反应生成C ,假定反应由A 、B 开始,它们的起始浓度均为1mol/L 。
反应进行2min 后A 的浓度为0.8mol/L ,B 的浓度为0.6mol/L ,C 的浓度为0.6mol/L 。
则2min 内反应的平均速率V A =__________,V B =_____________,V C =___________。
该反应的化学反应方程式为___________________________。
新课标第一网
27、某温度时,在一个2L 的密闭容器中,X 、Y 、Z 三种物质的物质的量随时间的变化曲线如图所示。
根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)从开始至2min ,Z 的平均反应速率为
;
参考答案及评分标准
物质的量
21吸收能量,放出能量,反应物和生成物能量的相对大小,放热,吸热
22 2X=Y+3Z 23 放出,11 。
24 (1)化学能转变热能(2)电能转变化学能(3)化学能转变电能(4)电能转变化学能25 A B ,C ,2A+B=2C,不能,因为不知道此反应的容器体积不能计算物质的浓度,平衡
26 V A=0.1 mol·L-1·min-1 V B=0.2 mol·L-1·min-1V C=0.3 mol·L-1·min-1
A+2B=3C
27 (1)Y+3X=2Z (2) Vz=0.1 mol·L-1·min-1。
