无机化学习题参考答案
无机化学_习题集(含答案)

55.在[Cu(NH3)4]2+配离子中,Cu2+的氧化数和配位数各为( )。
A)+2和4B)0和3C)+4和2D)+2和8
56.分别向沉淀物PbSO4(Kθsp=1.6×10-8)和PbCO3(Kθsp=7.4×10-14)中加入适量的稀HNO3,它们的溶解情况是( )。
A)两者都不溶B)两者全溶
A)1.4×10-7B)3.3×10-5C)1.7×10-5D)6.7×10-8
45.等量的酸和碱中和,得到的pH值应是()。
A)呈酸性B)呈碱性C)呈中性D)视酸碱相对强弱而定
46.弱酸的解离常数值由下列哪项决定?()
A)溶液的浓度B)酸的解离度
C)酸分子中含氢数D)酸的本质和溶液温度
47.下列离子中,变形性最大的是( )。
C)任何温度均自发D)任何温度均不自发
5.PCl3分子中,与Cl成键的P采用的轨道是()。
A)px、py和pz轨道B)三个sp2杂化轨道
C)二个sp杂化轨道与一个p轨道D)三个sp3杂化轨道
6.在酒精的水溶液中,分子间的作用力有( )。
A)取向力、诱导力B)色散力、氢键
C)A、B都有D)A、B都没有
33.根据酸碱电子理论,下列物质中不可作为Lewis碱的是()。
A)H2O B)NH3C)Ni2+D)CN-
34.下列各对物质,能在酸性溶液中共存的是()。
A)FeCl3和液D)N2H4和HgCl2溶液
35.硫化铵溶液放置久了变成黄棕甚至红棕色,其原因是生成了()。
42.既可在盐酸中溶解,又可在氢氧化钠溶液中溶解的物质是( )。
A)Mg(OH)2B)Sb(OH)3C)Bi(OH)3D)As2S3
《无机化学》习题册及答案

《无机化学》课程习题册及答案第一章溶液和胶体一、是非题:(以“+”表示正确,“-”表示错误填入括号)1.渗透压力比较高的溶液,其物质的量浓度也一定比较大。
()2.相同温度下,物质的量浓度均为200mmol·L-1的NaCl溶液和葡萄糖溶液,其渗透压相等()3.相同温度下,渗透浓度均为200mmol·L-1的NaCl溶液和CaCl2溶液,其渗透压相等()4.临床上的两种等渗溶液只有以相同的体积混合时,才能得到等渗溶液。
()5. 两种等渗溶液以任意比例混合所得溶液在临床上必定是等渗溶液()6.临床上,渗透浓度高于320 mmol⋅L-1的溶液称高渗液()7.在相同温度下,0.3 mol⋅L-1的葡萄糖溶液与0.3 mol⋅L-1的蔗糖溶液的渗透压力是相等的()8. 物质的量浓度均为0.2mol·L-1的NaCl液和葡萄糖液渗透浓度相等()9. 对于强电解质溶液,其依数性要用校正因子i来校正。
()二、选择题1.使红细胞发生溶血的溶液是()A.0.2mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖 D.0.4mol·L-1 NaCl2.物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最大的是()A.葡萄糖 B.NaCl C.CaCl2 D.无法比较3.使红细胞发生皱缩的溶液是()A.0.1mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖 D.0.2mol·L-1 NaCl4.在相同温度下,物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最小的是()A.葡萄糖 B.NaCl C.CaCl2 D.无法比较5.物质的量浓度均为0.1 mol·L-1的下列溶液,在临床上属于等渗溶液的是()A.葡萄糖 B.NaCl C.CaCl2 D.蔗糖6. 试排出在相同温度下下列溶液渗透压由大到小的顺序 ( )a. c(C6H12O6)= 0.2 mol·L-1b. c[(1/2)Na2CO3]= 0.2 mol·L-1c. c[(1/3)Na3PO4]= 0.2 mol·L-1d. c(NaCl)= 0.2 mol·L-1A. d>b>c>aB. a>b>c>dC. d>c>b>aD. b>c>d>a7. 医学上的等渗溶液,其渗透浓度为()A. 大于280 mmol·L-1B. 小于280 mmol·L-1C. 大于320 mmol·L-1D. 280-320 mmol·L-18.欲使同温度的A、B两种稀溶液间不发生渗透,应使两溶液(A、B中的基本单元均以溶质的“分子”式表示) ( )A 质量摩尔浓度相同B 物质的量浓度相同C 质量浓度相同D 渗透浓度相同9. 质量浓度为11.1g·L-1CaCl2 (M=111.0 g·mol-1)溶液的渗透浓度是 ( )A.100mmol ·L-1B.200mmol ·L-1C.300mmol ·L-1D.400mmol ·L-1三、填充题:1.10.0 g·L-1NaHCO3(Mr=84)溶液的渗透浓度为__________mol·L-1。
无机化学习题答案

⽆机化学习题答案第1章原⼦结构与元素周期律1-1在⾃然界中氢有三种同位素,氧也有三种同位素,问:总共有多少种含有不同核素的⽔分⼦?由于3H 太少,可忽略不计,问:不计3H 时天然⽔中共有多少种同位素异构⽔分⼦?解:共有18种不同核素的⽔分⼦共有9种不同核素的⽔分⼦1-2.答:出现两个峰1-3⽤质谱仪测得溴的两种天然同位素的相对原⼦质量和同位素丰度分别为 79Br 占 %,81Br 占 %,求溴的相对原⼦质量。
解:1-4铊的天然同位素203Tl 和205Tl 的核素质量分别为和,已知铊的相对原⼦质量为,求铊的同位素丰度。
解:设203Tl 的丰度为X ,205Tl 的丰度为1-X= + (1-X) X= %1-5等质量的银制成氯化银和碘化银,测得质量⽐m (AgCl ):m (AgI )= 1:,⼜测得银和氯的相对原⼦质量分别为和,求碘的原⼦量。
解: X=1-8为什么有的元素原⼦量的有效数字的位数多达9位,⽽有的元素的原⼦量的有效数字的位数却少⾄3~4位?答:单核素元素只有⼀种同位素,因⽽它们的原⼦量⼗分准确。
⽽多核素元素原⼦量的准确性与它们同位素丰度的测量准确性有关(样品的来源、性质以及取样⽅式⽅法等)。
若同位素丰度涨落很⼤的元素,原⼦量就不可能取得很准确的数据。
1-13.解:(1)r=c /λ=(3×108)/(633×10-9) = ×1014Hz 氦-氖激发是红光(2)r=c/λ=×108)/×10-9) = ×1014Hz 汞灯发蓝光18)21(313121322=+?=?+?c c c c 91.79%46.499163.80%54.509183.78)Br (=?+?=Ar X 107.86835.453107.86863810.11)AgI ()AgCl (++==m m(3)r=c/λ=×108)/×10-9) = ×1014Hz 锂是紫红1-14 Br 2分⼦分解为Br 原⼦需要的最低解离能为,求引起溴分⼦解离需要吸收的最低能量⼦的波长与频率。
无机化学课后习题参考答案大全【优秀】

无机化学课后习题参考答案大全【优秀】(文档可以直接使用,也可根据实际需要修订后使用,可编辑推荐下载)无机化学课后习题参考答案大全第一章原子结构与元素周期系 (1)第二章分子结构 (4)第三章晶体结构 (6)第4章酸碱平衡 (9)第五章化学热力学基础 (15)第六章化学平衡常数 (16)第七章化学动力学基础 (23)第八章水溶液 (29)第9章配合物 (32)第十章沉淀平衡 (34)第11章电化学基础 (39)第12章配位平衡 (43)第13章卤素 (44)第14章氧族元素 (46)第15章氮磷砷 (48)第16章碳硅硼 (51)第17章S区金属(碱金属与碱土金属) (55)第18章过渡元素(一) (58)第18章过渡元素(二) (63)第19章镧系与锕系金属 (66)第一章原子结构与元素周期系1-1:区分下列概念(1) 质量数和相对原子质量(2) 连续光谱和线状光谱(3) 定态、基态和激发态(4) 顺磁性和逆磁性(5) 波长、波数和频率(6) 经典力学轨道和波动力学轨道(7) 电子的粒性与波性(8) 核电荷和有效核电荷答:(1) 质量数:指同位数原子核中质子数和中子数之和, 是接近同位素量的整数。
相对原子质量:符号为Ar,被定义为元素的平均原子质量与核素12C 原子质量的1/12 之比,代替“原子量”概念(后者已被废弃);量纲为1(注意相对概念)。
(2) 连续光谱: 波长连续分布的光谱。
炽热的固体、液体或高压气体往往发射连续光谱。
电子和离子复合时,以及高速带电离子在加速场中运动时亦能发射这种光谱。
线状光谱:彼此分立、波长恒定的谱线。
原子受激发(高温、电孤等)时,电子由低能级轨道跃迁到高能级轨道,回到低能级时产生发射光谱(不同原子具有各自特征波长的谱线)。
(3) 定态是由固定轨道延伸出来的一个概念。
电子只能沿若干条固定轨道运动,意味着原子只能处于与那些轨道对应的能态,所有这些允许能态统称为定态。
主量子数为1 的定态叫基态,其余的定态都是激发态。
完整版)大学无机化学试题及答案

完整版)大学无机化学试题及答案1.对于H2O2和N2H4,下列叙述正确的是:(C)都具有氧化性和还原性。
2.下列含氧酸中属于三元酸的是:(C)H3PO3.3.下列各对含氧酸盐热稳定性的大小顺序,正确的是:(B)CaCO3<CdCO3.4.铝在空气中燃烧时,生成(A)单一化合物Al2O3.5.下列含氧酸根中,属于环状结构的是:(C)。
6.下列化合物与水反应放出HCl的是:(C)POCl3.7.InCl2为逆磁性化合物,其中In的化合价为(C)+3.8.鉴别Sn4+和Sn2+离子,应加的试剂为(D)硫化钠(过量)。
9.下列各组化合物中,都有颜色的一组化合物是(B)CCl4,NO2,HgI2.10.将过量SiF4通入NaOH溶液中,主要产物是(C)Na2SiO3,Na2SiF6.11.将NCl3.(缺少选项,无法判断正确与否)。
改写后的文章:无机化学试题一、选择题1.H2O2和N2H4都具有氧化性和还原性。
2.H3PO3是三元酸。
3.正确的含氧酸盐热稳定性大小顺序是:CaCO3<CdCO3.4.铝在空气中燃烧时生成单一化合物Al2O3.5.环状结构的含氧酸根是C。
6.与水反应放出HCl的化合物是POCl3.7.InCl2为逆磁性化合物,其中In的化合价为+3.8.鉴别Sn4+和Sn2+离子,应加的试剂是硫化钠(过量)。
9.有颜色的一组化合物是CCl4,NO2,HgI2.10.将过量SiF4通入NaOH溶液中,主要产物是Na2SiO3,Na2SiF6.11.(缺少选项,无法判断正确与否)。
填空题:16.N2O5很容易分解为NO2和O2.将棕黄色的NO2冷却到-15℃左右,它几乎全部转变为淡黄色的N2O5.经X射线衍射研究,证明固体N2O5含有两种离子。
17.NCl3的水解产物是NH3和HCl;PCl3的水解产物是H3PO3和HCl;SbCl3的水解产物是SbOCl和HCl;BiCl3的水解产物是BiOCl和HCl;AsCl3的水解产物是AsO(OH)和HCl。
无机化学基础习题参考答案

无机化学基础习题参考答案《无机化学基础》习题解答第一章物质的量1、计算下列物质的摩尔质量。
(1)Fe (2)H2(3)HCl (4)HNO3(5)H2SO4(6)Al(OH)3(7)KOH (8)Ba(OH)2 (9)K2HPO4(10)NH4Cl (11)Cl—(12)PO43—解:物质的摩尔质量是以g/mol为单位,在数值上等于该物质的式量(分子量或原子量)。
所以以上物质的摩尔质量分别为:(1)mol (2)2 g/mol (3) g/mol (4)63 g/mol (5)98 g/mol (6)84 g/mol (7)56 g/mol (8)171 g/mol (9)174 g/mol (10) g/mol (11) g/mol (12)95 g/mol。
2、计算下列物质的物质的质量。
(1)90g H2O (2)22g CO2(3)Fe3O4(4)200gCaCO3解:H2O、CO2、Fe3O4、CaCO3的摩尔质量M分别为:18 g/mol、44 g/mol、232 g/mol、100 g/mol。
根据公式:n = m / M,计算得出以上物质的量分别为:(1)5 mol (2)mol (3)mol (4)2 mol。
3、计算下列物质的质量。
(1)2molNaHCO3(2)(3)3molCaCl2 (4)解:NaHCO3、AgNO3、CaCl2、Na2SO4的摩尔质量M分别为:84 g/mol、170 g/mol、111 g/mol、142 g/mol。
根据公式:m = n*M ,计算得出以上物质的质量分别为:(1)168 g (2)255g (3)333 g (4)71 g4、请写出下列反应中各物质的“物质的量”之比。
(1)2Na + 2H2O = 2NaOH + H2↑(2)Fe + H2SO4 = FeSO4 + H2↑(3)Cl2 + 2KBr = 2KCl + Br2(4)Fe2O3 + 6HCl = 2FeCl3 + 3H2O(5)Acl3 + 3NaOH = Al(OH)3↓+ 3NaCl(6)Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑解:根据反应中各物质的“物质的量”之比等于反应中各物质前的系数之比。
无机化学课后习题及答案

北师大版本无机化学课后习题与答案北师大版本第一章物质的结构 (2)第二章分子结构 (11)第三章晶体结构 (17)第4章酸碱平衡 (22)第五章化学热力学基础 (32)第六章化学平衡常数 (49)第七章化学动力学基础 (57)第八章水溶液 (71)第9章配合物 (75)第十章沉淀平衡 (78)第十一至三十章元素化学 (85)第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
无机化学习题及答案

第一章化学反应的一般原理1.是非题(对的在括号内填 +,错的填 -)(1) 已知下列过程的热化学方程式为:UF 6 (l) → UF 6 (g) θ1r m 30.1kJ mol H -∆=⋅则此温度时蒸发 1mol UF 6 (l),会放出热 30.1 kJ. ( )(2) 在定温定压条件下,下列两化学反应放出的热量相同。
( ) 2221H (g)O (g)H O (l)2+→ 2222H (g)O (g)2H O (l)+→(3) ∆r S 为正值的反应都是自发反应。
( )(4) 在常温常压下,空气中的N 2和O 2长期存在而不会生成NO ,这表明此时该反应的吉布斯函数变是负值。
( )(5) 反应 C(s) + H 2O (g) = CO (g) + H 2 (g),θ1r m (298.15K)131.3kJ mol H -∆=⋅,由于方程式两边物质的化学计量数的总和相等,所以增加总压力对平衡无影响。
( )(6) 上述反应达平衡后,若升高温度,则正反应速率增加,逆反应速率减小,即平衡向右移动。
( )(7) 反应的级数取决于反应方程式中反应物的化学计量数。
( )2. 选择题(将所有正确答案的标号填入空格内)(1) 下列反应中,反应 ______ 放出的热量最多。
(A) 4222CH (l)2O (g)CO (g) + 2H O (g)+=(B) 4222CH (g)2O (g)CO (g) + 2H O (g)+=(C) 4222CH (g)2O (g)CO (g) + 2H O (l)+= (D) 4223CH (g)O (g)CO(g) + 2H O (l)2+= (2) 定温定压下,某反应的θ1r m ()10kJ mol G T -∆=⋅,这表明该反应 _______。
(A) 能自发进行。
(B) 不能自发进行。
(C) 能否自发进行,还需要具体分析。
(3) 某温度时,反应 H 2 (g) + Br 2 (g) = 2HBr (g) 的标准平衡常数 K θ = 4⨯10-2,则反应 HBr (g) = 2211H (g)+Br (g)22的标准平衡常数K θ = _______。
无机化学习题参考答案

无机化学习题参考答案(文中#号应为标准态符号o) 第一章习题参考答案1. 求0.01㎏NaOH 、0.10㎏(21Ca 2+)、0.10㎏(21Na 2CO 3)的物质的量。
解 NaOH 、21Ca 2+和21Na 2CO 3的摩尔质量分别为: M (NaOH )= 40g ·mol -1 M (21Ca 2+)= 20g ·mol -1M (21Na 2CO 3)= 53g ·mol -1所以,它们的物质的量分别为:n (NaOH) =40100001.0⨯= 0.25 (mol ) n (21Ca 2+) =20100010.0⨯= 5.0 (mol) n (21Na 2CO 3) =53100010.0⨯= 1.9 (mol) 2. 将5.0g NaOH 、NaCl 、CaCl 2分别置于水中,配成500ml 溶液,试求溶液物质的量浓度c (NaOH)、c (NaCl)、c (21CaCl 2) 。
解 NaOH 、NaCl 和21CaCl 2的摩尔质量分别为: M (NaOH )= 40g ·mol -1 M (NaCl )= 58.5g ·mol -1 M (21CaCl 2)= 55.5g ·mol -1 所以,它们的物质的量浓度分别为:c (NaOH) =1000/50040/0.5= 0.25 (mol ·L -1)c (NaCl) =1000/5005.58/0.5= 0.17 (mo ·L -1)c (21CaCl 2) =1000/5005.55/0.5= 0.18 (mol ·L -1)3. Each 100ml blood plasma contains K + of 20mg and Cl - of366mg .Count their amount of substace concentration , with the unit mmol ·L -1 .Key : The amount of substace concentration of K + and Cl - are :c (K +) =100.039/20= 5.13 (mmol ·L -1) c (Cl -) =100.05.35/366= 103 (mmol ·L -1)4. 试将30.0g 蔗糖(C 12H 22O 11)试样,配成下列各种溶液:(1)ρ(C 12H 22O 11) = 105g ·L -1 (2) c (C 12H 22O 11) = 0.10mol ·L -1(3) b (C 12H 22O 11) = 0.10mol ·㎏-1 (4) x (C 12H 22O 11) = 0.0186 应怎样配制?解 M (C 12H 22O 11) = 342g ·mol -1(1)V =105.30= 0.286 (L) = 286 (ml) 准确称取30.0g 蔗糖,用适量蒸馏水溶解后,加水稀释至286ml ,混匀,即可配制成105g ·L -1的蔗糖溶液。
无机化学练习题(含答案)

无机化学练习题(含答案)第1章原子结构与元素周期系1-1 试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解1—2 Br2离需要吸收的最低能量子的波长与频率.1—3 氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1—4 周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1—5 什么叫惰性电子对效应?它对元素的性质有何影响?1-6 当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121。
6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656。
3nm。
问哪一个光子的能量大?1-7 有A,B,C,D四种元素.其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1—8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A〉B>C,已知C有3个电子层.(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E 的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子.第2章分子结构2-1 ~σ键可由s—s、s—p和p—p原子轨道“头碰头"重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的~σ键分别属于哪一种?2-2 NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
《无机化学》习题册及答案

《无机化学》课程习题册及答案第一章溶液和胶体一、是非题:(以“+”表示正确,“-”表示错误填入括号)1.渗透压力比较高的溶液,其物质的量浓度也一定比较大。
()2.相同温度下,物质的量浓度均为200mmol·L-1的NaCl溶液和葡萄糖溶液,其渗透压相等()3.相同温度下,渗透浓度均为200mmol·L-1的NaCl溶液和CaCl2溶液,其渗透压相等()4.临床上的两种等渗溶液只有以相同的体积混合时,才能得到等渗溶液。
()5. 两种等渗溶液以任意比例混合所得溶液在临床上必定是等渗溶液()6.临床上,渗透浓度高于320 mmol⋅L-1的溶液称高渗液()7.在相同温度下,0.3 mol⋅L-1的葡萄糖溶液与0.3 mol⋅L-1的蔗糖溶液的渗透压力是相等的()8. 物质的量浓度均为0.2mol·L-1的NaCl液和葡萄糖液渗透浓度相等()9. 对于强电解质溶液,其依数性要用校正因子i来校正。
()二、选择题1.使红细胞发生溶血的溶液是()A.0.2mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖D.0.4mol·L-1 NaCl2.物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最大的是()A.葡萄糖B.NaCl C.CaCl2D.无法比较3.使红细胞发生皱缩的溶液是()A.0.1mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖D.0.2mol·L-1 NaCl4.在相同温度下,物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最小的是()A.葡萄糖B.NaCl C.CaCl2D.无法比较5.物质的量浓度均为0.1 mol·L-1的下列溶液,在临床上属于等渗溶液的是()A.葡萄糖B.NaCl C.CaCl2D.蔗糖6. 试排出在相同温度下下列溶液渗透压由大到小的顺序( )a. c(C6H12O6)= 0.2 mol·L-1b. c[(1/2)Na2CO3]= 0.2 mol·L-1c. c[(1/3)Na3PO4]= 0.2 mol·L-1d. c(NaCl)= 0.2 mol·L-1A. d>b>c>aB. a>b>c>dC. d>c>b>aD. b>c>d>a7. 医学上的等渗溶液,其渗透浓度为()A. 大于280 mmol·L-1B. 小于280 mmol·L-1C. 大于320 mmol·L-1D. 280-320 mmol·L-18.欲使同温度的A、B两种稀溶液间不发生渗透,应使两溶液(A、B中的基本单元均以溶质的“分子”式表示)( ) A 质量摩尔浓度相同 B 物质的量浓度相同C 质量浓度相同D 渗透浓度相同9. 质量浓度为11.1g·L-1CaCl2 (M=111.0 g·mol-1)溶液的渗透浓度是( )A.100mmol ·L-1B.200mmol ·L-1C.300mmol ·L-1D.400mmol ·L-1三、填充题:1.10.0 g·L-1NaHCO3(Mr=84)溶液的渗透浓度为__________mol·L-1。
习题答案1-5

无机化学习题参考答案(1-5章)第一章习题:1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?BCl 3酸性强。
因为CH 3推电子,使B 的缺电子性质减弱,而Cl 吸电子,主要与CH 3相反。
2.题目本身有问题。
3. 无水AlCl 3可作为傅氏烷基化反应的催化剂, 而吸水后则失效, 原因何在?AlCl 3作催化剂是利用其Lewis 酸性(配位不饱和),而吸水后配位饱和,失去Lewis 酸性和催化能力。
,4. p.29, 1.4 (其中的UO 2F 6该为UOF 4)(1)H 2O 22C(2)S 2O 32-3v C(3)N 2O(N -N -O 方式)v C ∞(4)Hg 2Cl 2h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4C 4v (7)BF 4-d T(8)SClF 54v C(9)反-Pt(NH 3)2Cl 22h D(10)PtCl 3(C 2H 4)-2v C第二章习题:2.1 解:顺磁性和反磁性可参看p.38的2.3图, 四面体为高自旋, 平面四方形为低自旋.Ni 2+ d 8组态 Pt 2+ d 8组态 第四周期(分裂能小) 第六周期(分裂能大)P Ni ClPClClPtCl P Ptrans cis 四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3) 2.2 解(1)MA 2B 4 (2)MA 3B 3M A ABB M A BA BM A BAB M A AA Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cis Co(en)(NH 3)2Cl 2+3Cl 333NH NH 33trans(1) trans(2)cis 注意: 光活异构体的数量, 多! 2.4 Co(en)33+ Ru(bipy)32+ 手性分子D 3 D 3 PtCl(dien)+ dien HNCH 2CH 2CH 2NH 2NH 2CH 2基本上为平面分子, 无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
《无机化学》习题及解答(思考题)

《无机化学》习题及解答第一章物质极其变化思考题1.下列说法是否正确:⑴某物质经分析后,只含一种元素,此物质一定是单质。
⑵某物质经分析,含五种元素,此物质有可能是纯净物。
⑶某物质的组成分子经分析,含有相同种类元素,且百分组成也相同,可确定该物质为纯净物。
⑷某物质只含一种元素,但原子量不同,该物质是混合物。
1.⑴不一定。
有些同素异形体的混合物,如白磷与红磷或黑磷的混合物,氧气和臭氧的混合物,元素确实只有一种,但物质(分子)不只一种,是混合物,不是单质。
⑵正确,一种分子可以含多种元素,如(NH4)2Fe(SO4)2,虽含多种元素,但分子只有一种,是纯净物。
⑶不正确。
对于单质的同素异形体,就不是单质。
对于同分异构体,虽分子式相同,但结构不同,性质也不同,不是纯净物。
2.某气态单质的分子量为M,含气体的分子个数为x,某元素的原子量为A,在其单质中所含原子总数为y,N A为阿佛加德罗常数,则M/N A用克为单位表示的是这种气体的质量数值;用x/N A表示这种气态单质的摩尔数;y/N A是表示这种单质中A原子的摩尔数;A/N A 用克为单位表示这种元素的A原子的质量数值。
3.下列说法是否正确:⑴分子是保持物质性质的最小微粒。
⑵36.5克氯化氢含阿佛加德罗常数个分子,气体的体积约为22.4L。
⑶1体积98%浓硫酸与1体积水混合,所得溶液的浓度为49%。
⑷2克硫与2克氧气反应后,生成4克二氧化硫。
3.⑴正确。
⑵不正确。
36.5克氯化氢确实含阿佛加德罗常数个分子,但气体的体积与温度和压力有关,只有在标准态,即0℃,1个大气压时的体积约为22.4L。
⑶不正确。
98%浓硫酸与水的密度不同,由于浓硫酸密度大,混合后,所得溶液的浓度为远大于49%。
⑷不正确。
化学反应严格按化学反应方程式上的量进行反应,不是简单的按投入量反应。
4.下列有关气体的说法是否正确:⑴同温同压下不同气体物质的量之比等于它们的体积比。
⑵同温同压下,相同质量的不同气体体积相同。
无机化学习题(含答案)

9. 比较下列每组两个化合物与乙醇形成氢键的能力:
2
(1) (H3Si)2O 和(H3CH2C)2O;(2) (H3Si)3N 和(H3C)3N 答:对同一种 H 给体(如乙醇)而言,Lewis 碱性越强形成的氢键也越强。因为 O 和 N 上
的电子可扩充到 Si 的空 d 轨道上,因此与 Si 结合的 O 和 N 较与 C 结合的 O 和 N 的
TlCl(s) + NaI(aq) = TlI(s) + NaCl(aq)
Tl(I)卤化物像银的卤化物一样,在水中难溶,因而上述反应可能进行得很慢。
(4) Me2SAlCl3 + GaBr3 = Me2SGaBr3 + AlCl3
Ga-S 为软软结合。
25.液氨的酸碱化学往往相似于水溶液中的酸碱化学。试写出固体 Zn(NH2) 2 与下列两种
教学参考
《无机化学选论》 习题及解答
目录
第 1 章 酸碱理论与非水溶液..................................................2 第 2 章 对称性与群论基础......................................................8 第 3 章 配位化学基础............................................................12 第 4 章 配合物的电子光谱....................................................30 第 5 章 簇状化合物................................................................42 第 6 章 无机固体化学............................................................54
无机化学练习题(附答案)
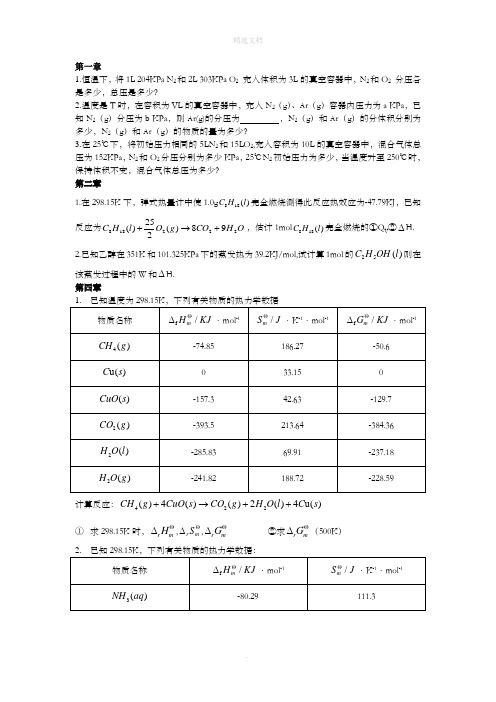
第一章1.恒温下,将1L 204KPa N 2和2L 303KPa O 2 充入体积为3L 的真空容器中,N 2和O 2 分压各是多少,总压是多少?2.温度是T 时,在容积为VL 的真空容器中,充入N 2(g )、Ar (g )容器内压力为a KPa ,已知N 2(g )分压为b KPa ,则Ar(g)的分压为 ,N 2(g )和Ar (g )的分体积分别为多少,N 2(g )和Ar (g )的物质的量为多少?3.在25℃下,将初始压力相同的5LN 2和15LO 2,充入容积为10L 的真空容器中,混合气体总压为152KPa ,N 2和O 2分压分别为多少KPa ,25℃N 2初始压力为多少,当温度升至250℃时,保持体积不变,混合气体总压为多少? 第二章1.在298.15K 下,弹式热量计中使1.0g )(188l H C 完全燃烧测得此反应热效应为-47.79KJ ,已知反应为O H CO g O l H C 22218898)(225)(+→+,估计1mol )(188l H C 完全燃烧的①Q V ②∆H. 2.已知乙醇在351K 和101.325KPa 下的蒸发热为39.2KJ/mol,试计算1mol 的)(52l OH H C 则在该蒸发过程中的W 和∆H. 第四章计算反应:422()4()()2()4u()CH g CuO s CO g H O l C s +→++① 求298.15K 时,r m H Θ∆,r m S Θ∆,r m G Θ∆ ②求r m G Θ∆(500K )2. 已知298.15K ,下列有关物质的热力学数据:用热力学原理计算反应324()H ()NH ()OH ()NH aq O l aq aq +-+→+在298.15K 和373.15K时的K Θ。
3.欲使32()()()CaCO s CaO s CO g →+在101.3KPa 下正向进行,①反应的最低温度应是多少?②计算在298.15K ,101.3Kpa 在密闭容器中CaCO 3分解所产生的平衡分压,已知298.15K时,11160r m S J K mol Θ--∆=⋅⋅12()394.4f m G CO KJ molΘ-∆=-⋅,13()1128.8f m G CaCO KJ mol Θ-∆=-⋅,1()604f m G CaO KJ mol Θ-∆=-⋅4.估算反应222()()()()CO g H g CO g H O g +→+在873K 时的标准摩尔Gibbs 函数变和标准平衡常数,若系统中各组分气体的分压分别为2()p CO =2()p H =127KPa ,()p CO =2()p H O =76KPa ,计算此条件下反应的Gibbs 函数变并判断反应进行的方向,已知298.15K ,5. 已知921()()2() 1.310 C s CO g CO g K θ+→=⨯2222()()() 6.010CO g Cl g COCl g K θ+→=⨯计算2222()()()+2()COCl g C s CO g Cl g →+的3K θ第五章1.PH=8和PH=10的溶液等体积混合,计算混合后的溶液PH 。
无机化学课后习题答案

第一章原子结构和元素周期律1-1. 不可能存在的是:(1)(2)(5)(6)(7)(8)1-2. C1-3. D1-4. D1-5. A1-6. B1-7. B1-8. A为Ca ,B为Mn ,C为Br ,D 为O1-9. A为Na ,B为Mg ,C为Al ,D 为Br ,E 为I ,F 为Cr第二章分子结构与晶体结构2-1. A2-2. C2-3. B2-4. B2-5. C2-6. AD2-7. BD2-8. D2-9. LiH属于s-s,HCl属于s-p,Cl2属于p-p2-10. 主要形成离子键的有:(1),(3),(8)主要形成极性共价键的有:(2),(5),(6),(7)主要形成非极性共价键的有:(4)第三章化学热力学基础3-1. C3-2. A3-3. D3-4.U3-6. (1)不对,可通过作功形式改变温度;(2)不对,热力学能的绝对值目前无法测得,热力学第一定律表达式中有ΔU而不是U;(3)对,冰熔化成0℃水需要吸热。
3-7.3-8.133 kJ·mol-13-9.解:(1)向真空膨胀W1 =-(2)恒外压膨胀J(3)两步恒外压膨胀J由于W3>W2>W1,说明膨胀次数愈多,则体系与环境的压力差愈小,做的功愈大。
3-10.解:=0.01 m3=810.5 JU =H = 0 ,Q = W = 810.6 J第四章化学动力学基础4-1. D 4-2. D 4-3. C 4-4. D 4-5. A4-6. C 4-7. D 4-8. B第五章 化学平衡与平衡原理5-1. 增加总压平衡向左移动;注入惰性气体平衡不变;升高温度平衡向右移动。
5-2. O H 2,+O H 3。
可以作为酸的有:-3HCO ;可以作为碱的有:33,,Ac NH HCO --。
5-3. 溶解度不变。
5-4. (1)AgCl 的溶解度会降低,但对溶度积没影响; (2)AgCl 的溶解度会增加,不影响溶度积; (3)AgCl 的溶解度会增加,不影响溶度积。
无机化学 习题答案

无机化学习题答案无机化学习题答案无机化学是化学的重要分支之一,研究无机物质的组成、性质、结构和变化规律。
在学习无机化学的过程中,习题是不可或缺的一部分,通过解答习题可以加深对知识点的理解和掌握。
下面是一些常见的无机化学习题及其答案,希望对大家的学习有所帮助。
1. 请写出以下化学方程式的平衡方程式:a) 氮气和氢气反应生成氨气。
答案:N2 + 3H2 → 2NH3b) 二氧化硫和氧气反应生成三氧化硫。
答案:2SO2 + O2 → 2SO3c) 氯气和钠金属反应生成氯化钠。
答案:Cl2 + 2Na → 2NaCl2. 请计算以下化学方程式中物质的摩尔比例:a) 2H2O2 → 2H2O + O2答案:2 mol H2O2 → 2 mol H2O + 1 mol O2b) 2Na + Cl2 → 2NaCl答案:2 mol Na + 1 mol Cl2 → 2 mol NaClc) CaCO3 → CaO + CO2答案:1 mol CaCO3 → 1 mol CaO + 1 mol CO23. 请计算以下物质的摩尔质量:a) H2O答案:H2O的摩尔质量 = 2(1.008) + 16.00 = 18.02 g/molb) CO2答案:CO2的摩尔质量 = 12.01 + 2(16.00) = 44.01 g/molc) NaCl答案:NaCl的摩尔质量 = 22.99 + 35.45 = 58.44 g/mol4. 请计算以下反应的理论产率:a) 4NH3 + 5O2 → 4NO + 6H2O如果反应中有100 g NH3,计算理论产量的质量。
答案:根据化学方程式,1 mol NH3 反应生成 1 mol NO,所以100 g NH3 反应生成的 NO 的质量为 (1 mol NO) x (30.01 g/mol) = 30.01 gb) 2C2H2 + 5O2 → 4CO2 + 2H2O如果反应中有50 g C2H2,计算理论产量的质量。
《无机化学》习题及解答(思考题)

《无机化学》习题及解答第一章物质极其变化思考题1.下列说法是否正确:⑴某物质经分析后,只含一种元素,此物质一定是单质。
⑵某物质经分析,含五种元素,此物质有可能是纯净物。
⑶某物质的组成分子经分析,含有相同种类元素,且百分组成也相同,可确定该物质为纯净物。
⑷某物质只含一种元素,但原子量不同,该物质是混合物。
1.⑴不一定。
有些同素异形体的混合物,如白磷与红磷或黑磷的混合物,氧气和臭氧的混合物,元素确实只有一种,但物质(分子)不只一种,是混合物,不是单质。
⑵正确,一种分子可以含多种元素,如(NH4)2Fe(SO4)2,虽含多种元素,但分子只有一种,是纯净物。
⑶不正确。
对于单质的同素异形体,就不是单质。
对于同分异构体,虽分子式相同,但结构不同,性质也不同,不是纯净物。
2.某气态单质的分子量为M,含气体的分子个数为x,某元素的原子量为A,在其单质中所含原子总数为y,N A为阿佛加德罗常数,则M/N A用克为单位表示的是这种气体的质量数值;用x/N A表示这种气态单质的摩尔数;y/N A是表示这种单质中A原子的摩尔数;A/N A 用克为单位表示这种元素的A原子的质量数值。
3.下列说法是否正确:⑴分子是保持物质性质的最小微粒。
⑵36.5克氯化氢含阿佛加德罗常数个分子,气体的体积约为22.4L。
⑶1体积98%浓硫酸与1体积水混合,所得溶液的浓度为49%。
⑷2克硫与2克氧气反应后,生成4克二氧化硫。
3.⑴正确。
⑵不正确。
36.5克氯化氢确实含阿佛加德罗常数个分子,但气体的体积与温度和压力有关,只有在标准态,即0℃,1个大气压时的体积约为22.4L。
⑶不正确。
98%浓硫酸与水的密度不同,由于浓硫酸密度大,混合后,所得溶液的浓度为远大于49%。
⑷不正确。
化学反应严格按化学反应方程式上的量进行反应,不是简单的按投入量反应。
4.下列有关气体的说法是否正确:⑴同温同压下不同气体物质的量之比等于它们的体积比。
⑵同温同压下,相同质量的不同气体体积相同。
无机化学练习题(含答案)第六章化学平衡常数

第六章化学平衡常数6-1 : 写出下列各反应的标准平衡常数表达式(1)2SO2(g) + O 2(g) = 2SO 3(g)(2)NH4HCO3(s) = NH 3(g) + CO 2(g) + H 2O(g)(3)CaCO3(s) = CO 2(g) + CaO(s)(4)Ag 2O = 2Ag(s) + 1/2 O 2(g)(5)CO2(g) = CO 2(aq)(6)Cl 2(g) + H 2O(l) = H +(aq) + Cl -(aq) + HClO(aq)(7)HCN(aq) = H +(aq) + CN - (aq)(8)Ag 2CrO4(s) = 2Ag +(aq) + CrO 42- (aq)(9)BaSO4(s) + CO 32-(aq) = BaCO 3(s) + SO 42-(aq)2+ + 3+(10)Fe 2+(aq) + 1/2 O 2(g) + 2H +(aq) = Fe 3+(aq) + H 2O(l)6-2: 已知反应 ICl(g) = 1/2 I 2(g) + 1/2 Cl 2(g) 在 25℃ 时的平衡常数为 K θ = 2.2 × 10-3,试计算下列反应的平衡常数:(1)ICl(g) = I 2(g) + Cl 2(g)(2)1/2 I 2(g) + 1/2 Cl 2(g) = ICl(g)6-3: 下列反应的 Kp 和 Kc 之间存在什么关系?(1)4H 2(g) + Fe 3O4(s) = 3Fe(s) + 4H 2O(g)(2)N 2(g) + 3H 2(g) = 2NH 3(g)(3) N 2O 4(g) = 2NO 2(g)6-6: 反应 CO (g ) + H 2O (g ) = CO 2 + H 2(g ) 在 749K 时的平衡常数 K θ=2.6 。
设 (1)反应起始时 CO 和 H 2O 的浓度都为 1mol/L (没有生产物,下同);(2)起 始时 CO 和 H 2O 的摩尔比为 1比3,求 CO 的平衡转化率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 原子结构和元素周期系1-1.答:(1)3×3+C 32×C 31=18 (2)2×3+C 22×C 31=91-2.答:出现两个峰1-3.答:Ar=78.9183×50.54%+80.9163×49.46%=79.90651-4. 解:fi 203Tl=x ,fi 205Tl=y ,则有x+y=100%, 202.97×x +204.97×y =204.39由此得到 fi 203Tl=29% fi 205Tl=71%1-5.解:M AgCl :M AgI =143.321(107.868+Ar)=1:1.63810Ar=126.911-6. 解:∆Ar=195.078-194.753=0.3251-8.答:因为元素的相对原子质量的取值决定于两个因素:一,同位素相对原子质量的准确性。
另一是某元素同位素丰度测量准确性。
对于那些只有一种同位素丰度特别大的元素,同位素 测量不准确对原子影响较小。
而几个同位素丰度较大的原子量准确性就不高。
1-9.答:地球上所有比氢重的原子,是在形成太阳系时从其它星体喷发物质中俘获的。
1-13.解:(1)r=c /λ=(3×108)/(633×10-9)=4.74×1014Hz 氦-氖激发是红光(2)r=c/λ=(3.0×108)/(435.8×10-9)=6.88×1014Hz 汞灯发蓝光(3)r=c/λ=(3.0×108)/(670.8×10-9)=4.47×1014Hz 锂是紫红1-14.解:r=E/h=(190×103)/(6.02×1023×6.63×10-34)=4.7676×1014Hzλ=c/r=(3×108)/(4.7676×1014)=638nm1-17. 解:r=E/h=(310×103)/(6.63×10-34×6.02×1023) 则λ=c/r397nm1-18. 解:λ=h×z/E=(6.63×10-34×3×108×6.02×1023)/(305×103)=392nm 属于紫外层当λ=320nm 时,则此时光的能量E=5.64×10-19>E 最低,所以会解离1-19.解:ΔE=hc/λ=(6.63×10-34×3×108)/(103×10-9)=10.2ev E1=-13.6ev E2=-3.4ev 它相应于氦原子核外电子的L-K 跃迁1-21.解:M li =7.02×1.66×10-27kg=1.165×10-26kgλ电子=h/p=(6.63×10-34)/(9.109×10-31×3.0×108×20%)=12pmλLi =h/p=(6063×10-34)/(1.165×10-26×3.0×108×20%)=9.48×10-4pm1-23.解:K 层电子最大数目:2 L 层电子最大数目:8 M 层电子最大数目:81-24.解:(b )1p (d) 2d (f) 3f 这些符号是错误的。
1-25.解:N=1 l=1 m=0 这一套量子数是不存在的1-26.解:(a ) l=0 (b) l=1 (c) l=2 (d) l=0 (e) l=3 (f) l=41-27. 解:4s 能级有1个轨道 5p 能级有3个轨道6d 能级有5个轨道 7f 能级有7个轨道5g 能级有9个轨道1-28.解:(a )K : 1s 22s 22p 63s 23p 64s 1 (b) AL: 1s 22s 22p 63s 23p 1(c) Cl : 1s 22s 22p 63s 23p 5 (d) Ti : 1s 22s 22p 63s 23p 64s 23d 2(e) Zn :2263s23p 64s 23d 10 (f ) As : 1s 22s 22p 63s 23p 64s 23d 104p 31-30. 解:a .Beb. N 2s 2p 3c. F 2s2pd.Cl--3p 6e. Ne +2s 22p 5f. Fe 3+ 4s 2 3dg. As 3+ 4s 21-31. 解: 1s 2s 2p这组组态符合洪特规则1-32.解:(a ) 1s 22s 2是基态原子 (b ) 1s 23s 1是激发态(c )1s 23d 3是激发态 (d ) [Ne]3s 23d 1是不可能电子组态(e )[Ar]3d 24s 2是基态原子 (f ) 1s 22s 22p 63s 1是基态原子(g )[Ne]3s 23d 12是不可能电子组态 (h) [Xe]4f 7是激发态(i) [Ar]3d 6是激发态原子组态1-33.解:LI + 次外层(最外层)1s 2 Na + 次外层1s 2 最外层2s 2p 6K +次外层2s 22p 6 最外层3s 3p 6 Rb +次外层3s 23p 6 最外层4s 23d 104p 6Cs +次外层4s 23d 104p 6最外层5s 24d 105p 61-34.Al +,Cs +具有8电子外壳1-35.解:a . 3s 23p 5属于p 区VIIA 第三周期 .b. 3d 64s 2属于d 区VIII 第四周期c. 5s 2属于s 区IIA 第五周期 d. 4f 96s 2属于f 区 镧系 第六周期 e. 5d 106s 1属于d 区 IB 第六周期1-36.解:Ti :1s 22s 22p 63s 23p 64s 23d 2 Ge:1s 22s 22p 63s 23p 64s 23d 104p 2Ag:1s 22s 22p 63s 23p 64s 23d 104p 65s 14d 10 Rb:1s 22s 22p 63s 23p 64s 23d 104p 65s 1Ne:1s 22s 22p 61-37. 解:第六周期电子排布:2,8,18,32,18,8,共86个第七周期电子排布:2,8,18,32,32,18,8,共118个所以 114号元素处于第七周期 ,118号为0族, 114号元素为第IVA1-42.解:1s 22s 22p 63s 23p 64s 23d 104p 65s 24d 105p 66s 24f 121-43. 解:最外层电子数6,次外层18个,可能氧化态:+6,+4,+2,0,-2,位于第四周期VIA P 区基态电子未成对电子数为2,氢化物为H 2Se 1-44.解:此元素位于d 区,是第五周期IVB ,离子电子构型为1s 22s 22p 63s 23p 64s 23d 104p 6 AO 21-47. 解:氟的电负性最大。
铯的电负性最小1-50 答:ⅣB 族,铜,银,金和稀有气体。
1-52 答:从上到下,同族元素氧化态稳定性增强,但第五周期非金属的氧化态很不稳定,第六周期的汞,铊,铅,铋的最稳定氧化态不是族序数,而是0,+1,+2,+3,第Ⅷ族从左到右最高氧化态的稳定性下降,从上到下最高正氧化态稳定性增强。
第二章分子结构2-1 解:O2:.. .. H2O2: .. ..: O =O: H—O—O—H共12e 共14eCO: .. CO2: .. ..:C =O: :O=C=O:共10e 共16eNCl3.. SF4FCl |F —S—FN .. |FCl Cl共34e共26e2-3 答:LiH: Li的电子排布:1s22s1H的电子排布:1s1该分子内的б键由s—s原子轨道重叠构建,即形成s—sб键.HCl: H的电子排布:1s1Cl的电子排布:1s22s22p63s23p5该分子内的б键由s—p原子轨道重叠构建,即形成s—pб键.Cl2: Cl的电子排布:1s22s22p63s23p5该分子内的б键由p—p原子轨道重叠构建,即形成p—pб键.2-4 答:N的基态电子组态为1s22s22p3,这说明N原子的3个2p电子各自占有一个2p轨道,即p x ,p y , p z ,这三个轨道相互正交,这样就形成了由一个б键和2个π键构成的三键,即在该图中,中间的直线代表--N—N –б骨架,两个方框表示形成π键的两对2p 电子的电子云在空间的取向.2-5答:①CO2: m=(4-2×2+0)/2=0,故其分子属于AY2型分子,其分子的立体结构为: O=C=O 直线型分子②H2O: m=(6-1×2+0)/2=2,故其分子属于AY4型分子,其VSEPR模型为正四面体,其分子结构为角型分子③NH3: m=(5-1×3+0)/2=1,故其分子属于AY4型分子,其VSEPR模型为正四面体,其分子结构为三角锥体④CO32—: m=(4-2×3+2)/2=0,故其分子属于AY3型分子,其VSEPR模型和其分子结构都是平面三角形,⑤PO33—: m=(5-2×3+3)/2=1,即其分子属于AY4型分子,其VSEPR模型为正四面体,其分子结构为三角锥体,即⑥PO3—: m=(5-2×3+1)/2=0,故其属于AY3型分子,其VSEPR模型和其分子结构都是平面三角形。
⑦PO43—: m =(5-2×4+3)/2=0,故其分子属于AY4型分子,其VSEPR模型和其分子的立体结构都是正四面体。
2-7 答: 由三个.丙烷分子中的每个C原子都是sp3杂化,形成正四面体,故只有三个原子可以处于同一个平面内,如图2-8 解:金刚烷的立体构型为由图可知,立体烷分子中有四个六元环,这些六元环各不相同,因为C10H16中的C原子取SP3杂化,而每个C原子与其连的原子有差异,形成的4个SP3杂化轨道有差异,是不等性杂化,故形成的六元环不相同。
当分子中的次甲基处于立方体的面心位置时,根据杂化轨道理论,分子中的―CH―基团的C原子将处于立方体的四个面上,而其中―CH―上的4个氢原子位于四个顶点上。
2-9 解:(1)OF2:由VSEPR模型知,OF2属于AY4型分子型分子,其空间构型为正四面体,由杂化轨道模型可知,四个键的键角应为109o28’;由斥力顺序可知,∠l-O-L>∠L-O-F>∠F-O-F故OF2的分子构型为角型分子,键角小于109o28’(2)CClF3由VSEPR模型知,CClF3分子属于AY5型分子,其空间构型为三角双锥体,有3种空间结构:F E E F FClF Cl F FF C l (a) F (b) F E (c)比较三种构型的斥力,可得(a)的斥力最小,故CClF3的空间构型为(a)型。
