2015年第2期江西省药品质量公告抽验假冒样品汇总表
基层药品抽验中的问题与解决办法

基层药品抽验中的问题ቤተ መጻሕፍቲ ባይዱ解决办法
D u a pl T s g i t e Gr s — o t I s e n oI ti n r g S m e e ti n h a s r o s s u s a d S u o s n
T a L q n Y c e g C u t , H n n P o i c b h F o n r g I s e i n h n qi ( 7 0 0 in iig u hn on y e a r v n e y t e o d a d D u n p ct o S a g u 4 6 0 )
药品抽验是药 品监督管理部 门履行职责 ,考察药 品 质量状况,发现假劣药 品的重要手段 。根据 国家食 品药
量公告中的假劣药 品往往无药品检验报 告书 ,若仅凭质
量公告就进行处罚 ,恐有违 《 药品管理法 》第七十八条
之规定 ;二是 ,从影响药品质量的各种 因素来看 ,许多
品监督管理局 《 品质量抽查检验管理规 定》的要求 , 药 基层药品监督部 门以监督性抽验为主 ,最大可能地发现 质量可疑 的药品,同时尽量避免盲 目和无效抽验 。在长 期的工作实践中, 笔者发现仍然存在者一些影响抽验顺利 开展 的问题,本文就这些问题进行分析并提 出解决办法 。 1 基层药 品抽验 中存在的问题 11 抽样记录与凭证书写不规范 主要表现 为:填 写不 . 完整,有 空缺项 ;记录编号随意性大 ,不具有唯一性和 连贯性 ;名称书写不完整,有错 写,漏写 ,多写 ,重写 和涂 改现象 ;字迹难 以辨认。药品抽样记录与凭证是药 品监督执法 中最重要的原始证据材料之一 ,书写不规范 必会遭到药检部 门的拒 收, 从而给执法办案带来 困难 。 1 抽样操作需进一步规范 抽样工作的灵魂是它本身 . 2 所包含 的真实性 ,代表 性和针对性 。真实性是指抽验过 程本身是真实发生的,是药 品监督检查 的重要 内容和重 要过程之一 。它包括必 须保证所抽样 品的完整性和质量 稳定性 。抽验的代表性 是指对抽验方法的要求,例如 : 中药材 的抽样必须按照 《 中国药典》规定的抽样 方法进 行抽样才能保证所抽样 品的代表性 ;而进行中药材杂质 限度检查 时则必须对抽检样 品采取 “ 四分法 ”取样才 能 保证所取样品对 于抽检样 品具有代表性 。如果抽验不具 有代表性 ,也就 失去 了通过检验样品来 了解和控制整批 药 品质量 的意义,所 出具 的药 品检验报告书也就 失去 了 应有 的法律效力。抽样 的针对性是指抽样的效率 ,即要 尽可能的抽到那些不合格 的药 品, 减少盲 目抽验 ,节约检 验资源,提高检验效率和药品监督管理效率。在 实际工 作 中,抽 样的盲 目性仍然很大 ,样品封签 操作不规范 , 样 品保管条件较差 ,缺少必要的冷藏设备。 1 抽验量不足 问题 由于受抽验数量规定的限制,许 . 3 多农村,乡镇个体诊所或卫生室的不少药品不够一次抽 验量,但 尚够一次或两次检验量,如放弃抽样 ,势必造 成不合格 药品漏抽漏检 , 给制假 , 贩假分子 以可乘之机 , 给人民群众用药带来安全隐患 。 1 药品质 量公告 和药 品质量信 息平 台所发布 的不合 . 4 格 药品在本地查处的问题 药品质 量公告和药 品质量信 息平 台所发布的不合格药品在本地 查处时还是否需要再 次抽样 的问题 ,笔者认为值 得商榷 。一是 ,上述药品质
国家药品监督管理局关于发布2002年第二季度国家药品质量公告的通知

国家药品监督管理局关于发布2002年第二季度国家药品质量公告的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】2002.07.25•【文号】国药监市[2002]261号•【施行日期】2002.07.25•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】质量监督检验检疫综合规定正文国家药品监督管理局关于发布2002年第二季度国家药品质量公告的通知(国药监市[2002]261号2002年7月25日)各省、自治区、直辖市药品监督管理局,解放军总后卫生部,武警总部卫生部,中国药品生物制品检定所:为加强对全国中药材专业市场的监督管理,根据全国药品抽验计划,国家药品监督管理局组织中国药品生物制品检定所及部分省药品监督管理局和省级药品检验所,组成6个小组,分别对全国17家中药材专业市场进行监督抽验,现将监督抽验结果予以公告并通知如下:此次监督检查抽验共抽取样品1075件,涉及药材品种88种,不合格为442件(详见药品质量公告第52期)。
其中重点抽验了常用中药材丹参、金银花、山茱萸、防己、全蝎、菟丝子、黄芩、知母8个品种,共抽验了650件样品,有261件样品不合格。
对上述中药材专业市场中抽到的不合格药材,各有关省级药品监督管理部门应依据有关法规进行处理,并应加大监督管理力度,定期对中药材专业市场进行监督检查抽验,及时向社会公布抽查检验结果,以便中药材购入单位及时了解、掌握药材市场中药材质量动态。
同时我局也将继续加大对中药材专业市场的督查力度,逐步扩大抽验范围。
各有关省药品监督管理部门应针对中药材专业市场存在的问题,认真分析原因,按照《关于开展药品药材集贸市场专项整治工作的通知》(国药监市[2002]03号文)要求,进一步做好中药材专业市场的专项整治工作。
附件:国家药品监督管理局药品质量公告(总第52期)(略)。
gsp需要的表格-Microsoft-Word-文档-(9)

新版GSP认证零售药店需要哪些记录表格?一、质量管理体系文件1 文件发放回收记录……………………………… ZD—WJ—01—012 文件变更履历表………………………………… ZD—WJ—01—023 文件销毁申请单………………………………… ZD—WJ—01—034 文件销毁记录…………………………………… ZD—WJ—01—045 文件制作申请单………………………………… GC—WJ—02—016 文件会审单……………………………………… GC—WJ—02—02二、质量管理7 质量信息处理审批单…………………………… ZD—ZG—03—018 质量信息汇总表………………………………… ZD—ZG—03—029 现场调查记录…………………………………… ZD—ZG—04—0110 质量事故报告…………………………………… ZD—ZG—04—0211 质量查询函……………………………………… ZD—ZG—05—0112 质量查询及处理记录…………………………… ZD—ZG—05—0213 药品不良反应报告表…………………………… ZD—ZG—06—0114 归档资料凭单…………………………………… ZD—ZG—08—0115 档案资料借阅登记簿…………………………… ZD—ZG—08—0216 档案资料销毁审批表…………………………… ZD—ZG—08—0317 档案资料销毁记录……………………………… ZD—ZG—08—0418 质量制度检查考核记录………………………… ZD—ZG—09—0119 供货单位质量管理体系评价表………………… ZD—ZG—10—0120 供货单位质量管理体系评价报告表…………… ZD—ZG—10—0221 购货单位质量管理体系评价表(生产、经营) ZD—ZG—11—0122 购货单位质量管理体系评价表(医疗机构)… ZD—ZG—11—0223 药品质量评审计划…………………………… ZD—ZG—12—01 序号记录名称记录编号24 药品购进情况质量评审表……………………… ZD—ZG—12—0225 药品质量评审报告……………………………… ZD—ZG—12—0326 质量管理体系内部审核计划………………………GC—ZG—01—0127 质量管理体系内部审核实施方案……………… GC—ZG—01—0228 质量管理体系内部审核检查表……………………GC—ZG—01—0329 纠正/预防措施跟踪记录表………………………GC—ZG—01—0430 质量管理体系内部审核会议记录…………………GC—ZG—01—0531 质量管理体系内部审核报告………………………GC—ZG—01—0632 参加会议人员签到表………………………………GC—ZG—01—0733 公司质量方针、目标实施情况检查表……………GC—ZG—02—0134 部门质量方针、目标实施情况自查表……………GC—ZG—02—0235 质量方针、目标实施情况评价汇总表……………GC—ZG—02—0336 质量投诉调查处理记录……………………………GC—ZG—03—0137 质量投诉处理结果反馈与跟踪记录………………GC—ZG—03—0238 药品经营各环节质量风险管理评价与控制表……GC—ZG—04—0139 质量风险评估表……………………………………GC—ZG—04—0240 质量风险控制表……………………………………GC—ZG—04—0341 质量风险审核表……………………………………GC—ZG—04—0442 管理评审计划………………………………………GC—ZG—05—0143 管理评审报告………………………………………GC—ZG—05—0244 管理评审改进跟踪验证表…………………………GC—ZG—05—03三、人员与培训45 职工教育培训计划…………………………………ZD—RP—01—0146 培训方案……………………………………………ZD—RP—01—0247 培训签到表…………………………………………ZD—RP—01—0348 个人培训考核记录…………………………………ZD—RP—01—0449 培训考核汇总表……………………………………ZD—RP—01—05 序号记录名称记录编号50 培训汇总表…………………………………………ZD—RP—01—0651 外出培训登记表……………………………………ZD—RP—01—0752 健康检查工作安排…………………………………ZD—RP—02—0153 员工健康档案表……………………………………ZD—RP—02—0254 体检汇总表…………………………………………ZD—RP—02—0355 员工健康异常情况报告单…………………………ZD—RP—02—0456 企业员工花名册……………………………………ZD—RP—03—0157 应聘登记表…………………………………………ZD—RP—03—02四、设施设备58 设施设备台帐…………………………………… ZD—SS—01—0159 设备检查记录…………………………………… ZD—SS—01—0260 设备保养记录…………………………………… ZD—SS—01—0361 设备维修记录…………………………………… ZD—SS—01—0462 设施设备档案…………………………………… ZD—SS—01—05五、校准与验证63 检定、校准与验证计划………………………… ZD—JY—01—01六、计算机64 计算机系统操作权限授权审批表…………………ZD—JX—02—01七、采购65 首营企业审批表………………………………… ZD—CG—02—0166 首营品种审批表………………………………… ZD—CG—03—0167 销售员资格验证记录卡………………………… ZD—CG—04—0168 药品采购计划…………………………………… GC—CG—01—0169 中药材采购计划………………………………… GC—CG—01—0270 中药饮片采购计划……………………………… GC—CG—01—0371 药品采购记录…………………………………… GC—CG—01—0472 中药材采购记录………………………………… GC—CG—01—05 序号记录名称记录编号73 中药饮片采购记录……………………………… GC—CG—01—0674 专门管理药品采购记录………………………… GC—CG—01—0775 冷藏、冷冻药品采购记录……………………… GC—CG—01—0876 直调药品采购记录……………………………… GC—CG—01—0977 购进药品退出通知单…………………………… GC—CG—01—1078 购进药品退出记录……………………………… GC—CG—01—1179 购进专门管理药品退出记录…………………… GC—CG—01—1280 购进中药材退出记录…………………………… GC—CG—01—1381 购进中药饮片退出记录………………………… GC—CG—01—14八、收货与验收82 药品收货记录…………………………………… GC—SY—01—0183 中药材收货记录………………………………… GC—SY—01—0284 中药饮片收货记录……………………………… GC—SY—01—0385 冷藏、冷冻药品收货记录……………………… GC—SY—01—0486 专门管理药品收货记录………………………… GC—SY—01—0587 药品到货拒收记录……………………………… GC—SY—01—0688 中药材到货拒收记录…………………………… GC—SY—01—0789 中药饮片到货拒收记录………………………… GC—SY—01—0890 冷藏、冷冻药品到货拒收记录………………… GC—SY—01—0991 专门管理药品到货拒收记录…………………… GC—SY—01—1092 委托运输药品收货记录………………………… GC—SY—01—1193 委托运输中药材收货记录……………………… GC—SY—01—1294 委托运输中药饮片收货记录…………………… GC—SY—01—1395 委托运输冷藏、冷冻药品收货记录…………… GC—SY—01—1496 委托运输专门管理药品收货记录……………… GC—SY—01—1597 药品到货拒收单……………………………………GC—SY—01—1698 销后退回药品收货记录………………………… GC—SY—01—17序号记录名称记录编号99 销后退回中药材收货记录…………………………GC—SY—01—18 100 销后退回中药饮片收货记录………………………GC—SY—01—19 101 销后退回冷藏、冷冻药品收货记录………………GC—SY—01—20 102 销后退回专门管理药品收货记录…………………GC—SY—01—21 103 销后退回药品到货拒收单…………………………GC—SY—01—22 104 销后退回药品到货拒收记录………………………GC—SY—01—23 105 销后退回中药材到货拒收记录……………………GC—SY—01—24 106 销后退回中药饮片到货拒收记录…………………GC—SY—01—25 107 销后退回冷藏、冷冻药品到货拒收记录…………GC—SY—01—26 108 销后退回专门管理药品到货拒收记录……………GC—SY—01—27 109 药品验收记录…………………………………… GC—SY—02—01 110 中药材验收记录………………………………… GC—SY—02—02 111 中药饮片验收记录……………………………… GC—SY—02—03 112 专门管理药品验收记录………………………… GC—SY—02—04 113 冷藏、冷冻药品验收记录……………………… GC—SY—02—05 114 销后退回药品验收记录………………………… GC—SY—02—06 115 销后退回中药材验收记录……………………… GC—SY—02—07 116 销后退回中药饮片验收记录………………………GC—SY—02—08 117 销后退回专门管理药品验收记录…………………GC—SY—02—09 118 销后退回冷藏、冷冻药品验收记录………………GC—SY—02—10119 直调药品验收记录…………………………………GC—SY—02—11 120 药品验收拒收单…………………………………GC—SY—02—12 121 药品验收拒收记录…………………………………GC—SY—02—13 122 中药材验收拒收记录………………………………GC—SY—02—14 123 中药饮片验收拒收记录……………………………GC—SY—02—15 124 专门管理药品验收拒收记录………………………GC—SY—02—16 125 冷藏、冷冻药品验收拒收记录……………………GC—SY—02—17 序号记录名称记录编号126 销后退回药品验收拒收单………………………GC—SY—02—18 127 销后退回药品验收拒收记录……………………GC—SY—02—19 128 销后退回中药材验收拒收记录……………………GC—SY—02—20 129 销后退回中药饮片验收拒收记录…………………GC—SY—02—21 130 销后退回专门管理药品验收拒收记录……………GC—SY—02—22 131 销后退回冷藏、冷冻药品验收拒收记录…………GC—SY—02—23 九、储存与养护132 近效期药品催销月报表…………………………ZD—CY—03—01 133 外来人员进出库房登记表…………………………ZD—CY—05—01 134 药品库存记录……………………………………GC—CY—01—01 135 专门管理药品库存记录………………………… GC—CY—01—02 136 中药材库存记录………………………………… GC—CY—01—03 137 中药饮片库存记录……………………………… GC—CY—01—04 138 冷藏、冷冻药品库存记录……………………… GC—CY—01—05 139 库房巡检记录…………………………………… GC—CY—01—06 140 药品养护计划…………………………………… GC—CY—02—01 141 重点养护药品养护计划………………………… GC—CY—02—02 142 药品养护记录……………………………………GC—CY—02—03 143 中药材养护记录…………………………………GC—CY—02—04 144 中药饮片养护记录………………………………GC—CY—02—05 145 重点养护药品养护记录…………………………GC—CY—02—06 146 重点养护中药材养护记录………………………GC—CY—02—07 147 重点养护中药饮片养护记录……………………GC—CY—02—08 148 设施设备、环境、卫生养护检查记录…………GC—CY—02—09 149 药品养护分析报告表……………………………GC—CY—02—10 150 不合格药品库存记录……………………………GC—CY—03—01 151 不合格药品销毁审批表…………………………GC—CY—03—02 序号记录名称记录编号152 不合格药品报损审批表…………………………GC—CY—03—03 153 不合格药品报损记录…………………………… GC—CY—03—04 154 不合格药品销毁记录…………………………… GC—CY—03—05 155 不合格药品情况汇总分析表…………………… GC—CY—03—06 156 可疑药品报告确认表………………………………GC—CY—03—07 157 库存盘点报表…………………………………… GC—CY—04—01 158 盘点情况原因分析及处理报告………………… GC—CY—04—02 159 直接入库单……………………………………… GC—CY—04—03160 直接出库单……………………………………… GC—CY—04—04 161 直接入库记录…………………………………… GC—CY—04—05 162 直接出库记录…………………………………… GC—CY—04—06 163 库存不合格药品盘点报表……………………… GC—CY—04—07 164 温湿度监测记录………………………………… GC—CY—05—01 十、销售165 购货单位资格审批表…………………………… ZD—XS—01—01 166 药品销售单……………………………………… GC—XS—01—01 167 药品销售记录…………………………………… GC—XS—01—02 168 专门管理药品销售记录………………………… GC—XS—01—03 169 冷藏、冷冻药品销售记录……………………… GC—XS—01—04 170 中药材销售记录………………………………… GC—XS—01—05 171 中药饮片销售记录……………………………… GC—XS—01—06 172 直调药品销售记录……………………………… GC—XS—01—07 173 药品抽样检查出库单…………………………… GC—XS—01—08 174 药品抽样检查出库记录。
江西省地方税务局关于房产税和城镇土地使用税困难减免税有关事项的公告-2015年第2号

江西省地方税务局关于房产税和城镇土地使用税困难减免税有关事项的公告正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 江西省地方税务局关于房产税和城镇土地使用税困难减免税有关事项的公告2015年第2号为进一步规范房产税、城镇土地使用税困难减免审批管理,防范执法风险,切实维护纳税人权益,根据《中华人民共和国房产税暂行条例》《中华人民共和国城镇土地使用税暂行条例》《国家税务总局关于下放城镇土地使用税困难减免税审批权限有关事项的公告》(国家税务总局公告2014年第1号)的相关规定,现将房产税、城镇土地使用税困难减免(以下简称“困难减免”)的有关事项公告如下:一、困难减免的情形(一)符合下列情形之一的纳税人,可申请困难减免:1.因风、火、水、地震等严重自然灾害或其他意外因素等不可抗力,导致纳税人遭受重大损失(减免金额不超过纳税人因不可抗力遭受的损失额);2.因经批准关闭、重组改制等原因停产、停业一年以上(含1年)且无生产经营收入;3.国家及省级重点建设项目、扶持发展项目,缴纳房产税、城镇土地使用税确有困难;4.从事国家鼓励发展产业(主营业务为国家《产业结构调整指导目录》中所列鼓励类项目),缴纳房产税、城镇土地使用税确有困难;5.从事救助、救济、教育、科学、文化、卫生、体育、环境保护、社会公共设施建设和其他社会公共福利事业等公益事业,以及从事自来水生产供应、公共交通、电气热供应、邮电通讯、园林绿化等居民生活服务事业,缴纳房产税、城镇土地使用税确有困难。
以上3、4、5条所述“缴纳房产税、城镇土地使用税确有困难”是指纳税人申请减免税款所属年度发生经营性亏损,亏损额不低于纳税人申请减免税款所属年度主营业务收入与其他业务收入之和的10%。
药品质量公告

药品质量公告
2008年度第1期(总第73期)
国家食品药品监督管理局发布2008年4月
为加强药品监管,保障公众用药安全,国家食品药品监督管理局组织在全国范围内对流感疫苗进行了评价抽验,并对2006年至2007年度抽验的部分生物制品进行了跟踪抽验。
本期公告内容为对2006年至2007年度抽验的部分生物制品跟踪抽验和流感疫苗评价性抽验的药品质量情况。
一、部分生物制品跟踪抽验的质量情况
跟踪抽验涉及8家生物制品生产企业生产的17批制品,经检验,1家生产企业生产的1个品种3批次不合格(见附表1)。
二、流感疫苗评价性抽验的质量情况
被抽验的流感疫苗涉及12家生产企业的77批制品,经检验,均合格(见附表2)。
附表:1.2008年第1期国家药品质量公告部分生物制品跟踪抽验的质量情况
2.2008年第1期国家药品质量公告流感疫苗评价性抽验的质量情况
附表1:
2008年第1期国家药品质量公告部分生物制品跟踪抽验的质量情况
附表2:
2008年第1期国家药品质量公告流感疫苗评价性抽验的质量情况。
对药品质量进行抽查抽验时收不收费

对药品质量进⾏抽查抽验时收不收费药-品是预防和治疗疾病的特殊商品,所以药-品的质量符不符合标准,关系到能不能治病,⽽药-品监督管理部门为了保证药-品质量,可以对市场上流通的药-品进⾏抽样检验,那么对药-品质量进⾏抽查抽验时收不收费?下⾯由汉中医疗纠纷律师为读者进⾏相关知识的解答。
⼀、对药-品质量进⾏抽查抽验时需要收费吗药-品监督管理部门根据监督检查的需要,可以对药-品质量进⾏抽查抽验。
抽查抽验应当按照规定抽样,并不得收取任何费⽤。
所需费⽤按照国务院规定列⽀。
药-品监督管理部门或者其设置、确定的药-品检验机构在药-品检验中违法收取检验费⽤的,由政府有关部门责令退还,对直接负责的主管⼈员和其他直接责任⼈员依法给予⾏政处分。
对违法收取检验费⽤情节严重的药-品检验机构,撤销其检验资格。
《药-品质量监督抽验管理规定》第⼗条药-品抽查检验不收取费⽤,所需费⽤由财政列⽀。
抽查检验费⽤应按照国家有关部门制定的经费管理办法的规定使⽤。
⼆、药-品监督的依据相关法律问题1、药-品监督管理部门有权对相关药-品⽣产、经营企业和医疗机构进⾏检查吗?根据《药-品管理法》第64条的规定,药-品监督管理部门有权按照法律、⾏政法规的规定,对报经其审批的药-品⽣产、经营企业和医疗机构使⽤药-品的事项进⾏监督检查,有关单位和个⼈不得以任何理由拒绝和隐瞒。
同时,药-品监督管理部门在进⾏监督检查时,必须出⽰证明⽂件,对监督检查中知悉的被检查⼈的技术秘密和业务秘密应当保密。
2、药-品监督管理部门⼯作⼈员在对药-品进⾏抽样检查时,应该向检查单位收取费⽤吗?根据《药-品管理法》第65条的规定,药-品监督管理部门根据监督检查的需要,可以对药-品质量进⾏抽查检验。
但是,抽查检验应当按照规定抽样,⽽且不得收取任何费⽤。
其所需费⽤按照国务院规定列⽀。
3、药-品监督管理部门检验药-品的结果可不可以公告?《药-品管理法》第66条规定:“国务院和省、⾃治区、直辖市⼈民政府的药-品监督管理部门应当定期公告药-品质量抽查检验的结果;公告不当的,必须在原公告范围内予以更正。
江西省药品监督管理局关于印发《江西省核发药品生产许可证实施细则》的通知-

江西省药品监督管理局关于印发《江西省核发药品生产许可证实施细则》的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 江西省药品监督管理局关于印发《江西省核发药品生产许可证实施细则》的通知各药品上市许可持有人、药品生产企业,药品注册处、中药监管处、药品生产处、药品检查监督办,行政受理与投诉举报中心、认证审评中心、检查员中心、樟树药监局:《江西省核发〈药品生产许可证〉实施细则》已经局长办公会通过,现印发给你们,请遵照执行。
2021年11月4日江西省核发《药品生产许可证》实施细则为加强我省药品生产监督管理,规范《药品生产许可证》办理事项,根据《药品管理法》《疫苗管理法》《药品生产监督管理办法》《药品注册管理办法》《药品上市后变更管理办法(试行)》《药品检查管理办法(试行)》以及《国家药监局关于实施新修订〈药品生产监督管理办法〉有关事项的公告》(国家药监局公告2020年第47号)等规定,现将我局核发《药品生产许可证》有关事项规定如下:一、严格落实药品生产许可制度药品上市许可持有人(简称“持有人”)、药品生产企业从事药品生产活动,应当经省药监局批准,取得《药品生产许可证》。
持有人、药品生产企业申领《药品生产许可证》,应当符合《药品管理法》第四十二条、《药品生产监督管理办法》第六条规定的条件,并符合《药品生产质量管理规范》(2010年修订)及附录(简称“药品GMP”)和《江西省核发〈药品生产许可证〉评定标准(试行)》(仅适用于委托他人生产制剂的持有人申请情形)要求。
申请人申报剂型尚未取得相应药品批准证明文件(含原料药批准通知书)的,应明确拟生产品种,对拟生产品种制订生产工艺和质量标准等文件,完成厂房、设施设备有关确认及验证后,提出核发或变更《药品生产许可证》申请。
国家食品药品监督管理局公告2009年第21号――国家药品质量公告(2009年第1期,总第77号)

国家食品药品监督管理局公告2009年第21号――国家药品质量公告(2009年第1期,总第77号)文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2009.04.23•【文号】国家食品药品监督管理局公告2009年第21号•【施行日期】2009.04.23•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局公告(2009年第21号)国家药品质量公告(2009年第1期,总第77号)为加强药品监管,保障公众用药安全,根据国家药品评价抽验计划,国家食品药品监督管理局近期组织对盐酸二甲双胍片、板蓝根颗粒、麻疹腮腺炎风疹三联减毒活疫苗3个品种进行了全国评价抽验。
结果显示,总体质量状况良好。
现将抽验结果公告如下:一、盐酸二甲双胍片全国共有180个药品批准文号、165家生产企业。
本次在流通领域抽样987批,涉及71家生产企业。
经内蒙古自治区食品药品检验所检验,981批次抽验结果为合格,6批次不符合标准规定,辽源市迪康药业有限责任公司生产的批号为20080204的2批次,不合格项目中1批次为检查(溶出度)、1批次为性状及检查(溶出度),批号为20060601的1批次,不合格项目为检查(溶出度);常州制药厂有限公司生产的批号为0706011的1批次,不合格项目为含量测定;河南兴源制药有限公司生产的批号为0705330的1批次,不合格项目为检查(重量差异);北京市永康药业有限公司生产的批号为071102789的1批次,不合格项目为检查(溶出度)。
二、板蓝根颗粒全国共有916个药品批准文号、777家生产企业。
本次在流通领域抽样775批,涉及155家生产企业。
经北京市药品检验所检验,771批次抽验结果为合格,4批次不符合标准规定,分别为陕西省中医药研究院汉唐制药有限公司生产的批号为080101的2批次,不合格项目均为检查(微生物限度);广西润达制药有限公司生产的批号为070905的1批次,不合格项目为检查(装量差异);哈药集团世一堂制药厂生产的批号为0706514的1批次,不合格项目为检查(水分)。
量公告 (总第20期)药品抽验不
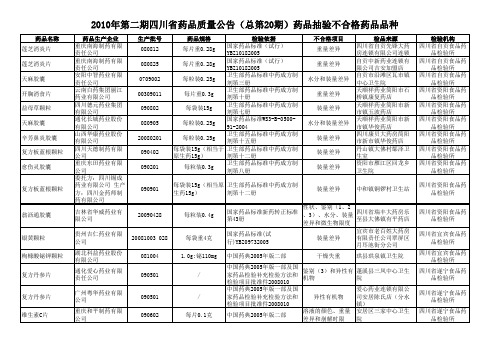
090302 090207 090405 090401 090403 090603 090603 100101
8ml:20mg 8ml:20mg 8ml:20mg 8ml:20mg 8ml:20mg 8ml:20mg 8ml:20mg \
有关物质 有关物质 有关物质 有关物质 有关物质 有关物质 有关物质 含量测定
水分和装量差异 水分
男宝胶囊
20070902
水分
麝香接骨胶囊
20090301
每粒装0.3g
装量差异
炎可宁片
四川省三星堆制药 有限公司 安徽三超药业有限 公司 安徽示康药业有限 公司 天津金虹胜利药业 有限公司 四川德元药业集团 有限公司 天津金虹胜利药业 有限公司 四川泰华堂制药有 限公司 安徽示康药业有限 公司 四川省尚善堂制药 有限公司
益肺胶囊
080101
每粒装0.3g
水分
维C银翘片
090301
/
诺氟沙星胶囊 诺氟沙星胶囊 妇科十味片
090315 090314 20080618
0.1g 0.1g 每片重0.3克
性状、鉴别(4)和 绵阳天达康药业有限 含量测定(维生素C 责任公司 、对乙酰氨基酚) 四川好医生制药有限 溶出度 公司 四川好医生制药有限 溶出度 公司 太极大药房眉山尚义 重量差异 回春店 装量差异 圣丹堂药品连锁彭山 公义镇八十九店 四川和平药房眉山连 锁青神店 仁寿县文林镇春燕村 第三卫生室 仁寿县芝林大药房 仁寿县百鑫大药房陵 州店 四川合江飞龙药业有 限公司 泸州金伟医药有限公 司 泸州宝光药房连锁有 限公司叙永摩尼分店 四川康贝大药房连锁 有限公司叙永二十四 店
080903
基片重0.3g
土大黄苷
复方氨基酸注射液(18AA)质量评价

2020年12月 第17卷 第23期复方氨基酸注射液(18AA)是含有多种氨基酸的肠外营养制剂,属于营养用氨基酸注射液[1],包含8种必须和10种非必须氨基酸,2012年被列为国家基本药物。
该品种临床上应用广泛,常用于创伤、烧伤、术后患者蛋白质及营养缺乏,改善肠道功能失调引起的蛋白质消化和吸收障碍,蛋白质合成紊乱,治疗肝昏迷,提供慢性、消耗性疾病、恶性肿瘤及体质虚弱不能正常进食或超高代谢、病情危重患者的静脉营养。
该品种最早由广州侨光制药厂于20世纪90年代初研制,采用日本进口氨基酸原料,以异亮氨酸等18种氨基酸与山梨醇配制而成的灭菌水溶液,目前该品种在我国均采用国内生产的氨基酸原料生产该制剂。
在市售复方氨基酸注射液类中,获得国家药监局批准文号共计121个,共有62家生产企业。
包装有玻璃瓶与非PVC软袋包装,共三个规格:250 mL∶30 g(总氨基酸)、250 mL∶12.5 g(总氨基酸)、500 mL∶25 g(总氨基酸)。
本次研究共涉及市售的6家生产企业,29批次样品,两个规格:250 mL∶12.5 g(总氨基酸)28批次、500 mL∶25 g(总氨基酸)1批次。
1 现行标准检验复方氨基酸注射液(18AA)标准收载于中国药典2015年版二部,国外无收载。
标准包括主要性状、检查项与含量测定,根据现有标准对样品进行检验,均符合药典标准规定,但结果差异较大(详见表1)。
结果提示可能存在以下的问题需进一步分析与研究。
1.1 颜色不同批次间注射液颜色差异较明显,现行标准中规定为无色至微黄色,而不同生产厂家不同批次注射液颜色呈现不同程度的黄色。
标准规定为无色至微黄色,颜色差异虽然可以直接反映游离氨基酸氧化程度,但主观判定颜色差异极大。
变色原因主要与注射液中色氨酸有关[2,3]。
色氨酸生产使用的合成法和酶法均以吲哚为原料,但在分离纯化过程中吲哚和色氨酸不易分离,由于吲哚环容易发生氧化反应[4],这种氧化反应属自氧化反应,是个很缓慢的过程,影响的因素较多:氧气、重金属离子、pH、光照、加热均会加速氧化反应。
药品质量信息汇总分析表部分

药品质量信息汇总分析表×××2013 年8 月□报刊杂志□上级来文来源□其他网上下载收集时间2013年23日8月收集人×××国家总局办公厅同意注销北京双鹤现代医药技术有限公司溴异丙)东莨菪碱气雾剂药品批准证明文件及批准文号(国药准字H11022168 质量信息分析在今后的经营活动中也要禁止该我公司未经营过该品种,经排查,品种的流入管理应用备注1 / 16×××药品质量信息汇总分析表2013 年8 月□报刊杂志□上级来文来源□其他网上下载收集时间201327日年8月收集人×××充分认识到了当前禁毒工作的严峻形势,严格按照《通知》和《关严的有关要求,于切实加强部分含特殊药品复方制剂销售管理的通知》杜绝现金交格审查供货方和销售方资质,加强特药的流通和票据管理,质量信息分析易,防止流入非法渠道附件的相关信息表已报送临沂市食品药品监督管理管理应用备注2 / 16药品质量信息汇总分析表×××2013 年8 月□报刊杂志□上级来文来源□其他网上下载收集时间2013年8月30日×××收集人的规定,(试行)》国家总局根据《处方药与非处方药分类管理办法种,中成药种药品(化学药品组织论证和审定,将肠炎宁胶囊等132种药品名单及其非处方药说明书范本(见1113种)转换为非处方药,不得继续使用原药品说明书月30日前,102013;附表)生产企业在年质量信息分析)。
双跨的品种除外(3 / 16药品质量信息汇总分析表×××9月2013 年□报刊杂志□上级来文来源□其他网上下载收集时间日月9 年20139收集人×××3264年上半年完成的市两级药品检验机构本质量公告为省、2013批次产品不符合标准规定,抽验批的基本药物抽验情况汇报,其中,6 99.82%合格率为,被抽验基本药物总体质量良好。
上海市食品药品监督管理局发布2015年第二季度药品监督抽验质量公告

k
N F ;《 H
。
维普资讯
圜步 一
■量 尉
2
%
鬻
。
. _
,
赫 漤 ~ 嗡 黪 滕鼢黼隧褂
i
.
{
r
t
l
t
●
1 ,
,
p
{
《
1
囊盈 k
J
负 责人
三 亚 半 岛龙 湾、Fra bibliotek天 津首 创 宝 翠 花都项 目 的 室 内配 饰 设 计
每当提起 家
漂 亮的家具
、
,
每 个 人都 会有个 比较 具 体 的概念
、
—
—
房子
、
海的语 言符号是 以前这种风 格里不 常 出现 的
去赶海
,
,
度假的日 子
,
美 丽 的装饰
。
古 老 的收藏
、
…
…
还 有 和 谐 的 家人
,
,
种原 始的
色彩 鲜艳
浓郁
,
女性很喜欢
、
很多 男主人 又 接 受不 了
,
沉重 感和冲击力
把我们从过 多 的香 艳 梦 里带 回 到 原创艺 术的
这 么香 艳 的东西
然 材质
,
。
为营 造 实用
,
轻 松 的 家居 环 境
适合 采用天
。
惊叹里
。
内敛朴素
让 人 彻底 从 城 市 的 重 压 下 放松 心 境
,
对 比强烈 的色彩
。
,
不 是花枝招展
,
,
而是要跳 进 你 的眼 的
一
柚木 的 家 具 是 东 南 亚 特有 的 的质 地
药品质量抽验工作方案(3篇)

药品质量抽验工作方案为保证我区市场药品质量,保障公众用药安全有效,根据《市药品、医疗器械和药用包装材料质量抽验程序》以及市食品药品监督管理__关于《年市药品、医疗器械和药包材质量抽验计划__》的要求,结合我区药品质量监控的实际情况,特拟定区年度药品质量抽验实施方案,计划如下:一、抽验原则:遵循客观、公正、科学、合理的原则。
今年重点加强药品生产企业、质量薄弱环节和重点品种抽样的针对性,切实提高发现药品存在质量隐患的能力,充分体现药品质量安全监管的目标和效能。
二、抽验总数和对象:(一)全年计划药品监督抽验数为___件,抽验对象为区内饮片生产企业、药品批发企业、医疗机构以及零售药店,其中___件按比例落实到具体单位,另外预留___件作为机动。
(二)药品生产企业(包括原辅料)的日常监督抽验由市局和分局按《年本市药品生产企业监督抽验计划》(另行下达)___实施。
(三)专项、评价抽验根据需要由市局安排另行___。
(四)___年度发生过药品质量问题的单位作为重点抽验对象。
三、重点抽验品种:根据国家局要求和本市监管实际与药品的特点,对以下产品重点进行抽验:(一)近两年转制、法人变更和主要管理层人员发生变化的药品批发企业的产品;(二)05版药典提高标准的品种;(三)高风险品种(注射剂、大输液、生物制品等);(四)近两年各级药品质量抽验不合格企业的品种;(五)不良反应较多的产品;(六)本市医疗机构集中招标采购以及本区统一采购的品种;(七)降价幅度较大的品种和同种价格相差悬殊的低价药品。
四、计划抽验监督比例:全年计划抽样构成比例:公立医疗机构___件,占___%;药品批发企业(含饮片生产企业)___件,占___%;零售药店___件,占___%;民办医疗机构___件,占___%,医保内设医疗机构___件,占___%;机动___件作为涉案抽样、专项抽样。
药品抽验比例为:饮片:中成药:西药比例为:04:3.6(+0.5):6(+0.5)(医院制剂、饮片生产企业抽验不列入上述比例范围)五、抽验频度:(一)突出对药品的源头生产企业(包括原辅料)的抽验力度,原则上每年不少于___次;对其生产品种进行全覆盖抽验;(二)抓好药品批发企业以及___家饮片生产企业的抽验工作,每年每家不少于___次,覆盖率___%;(三)强化民办综合性医院、公立医院药房和经济药店的管理,全年每家___次抽验,覆盖率___%;(四)有效提高单体药房的监管,抽样覆盖率达___%,平均每家抽样___件;(五)适度加强区内大型企业医保内设医疗机构的抽样工作,覆盖率___%,平均每家抽样___件;六、抽验方法:(一)由分局向被抽验单位发出《年度药品质量监督抽验计划书》;(二)抽验前,先由分局向被抽验单位发出《药品抽样指令单》;(三)分局执行任务的抽样人员按《药品抽样指令单》拟定的抽验日期、品种和件数,到被抽验单位进行抽样。
药品再注册过程中注意事项

药品再注册要求一、再注册申报办理要求1. 资料格式注意事项:基本格式要求:PDF扫描件,与纸版资料一致。
纸版申报资料格式要求(1)申报资料按顺序编号,按项目编号单独装订成册,按顺序装入档案袋,在档案袋底部注明药品名称、批准文号、企业名称。
(2)申报资料应使用A4纸打印,内容完整、清楚,不得涂改。
(3)复印件应当由原件复制,与原件一致,并加盖企业公章。
(4)封面应包含:项目编号、药品名称、项目名称、企业名称、联系人、电话、批准文号到期时间。
封面须加盖公章。
电子版资料要求文档名称体现编号和项目每项资料一个文档文档内容完整、清楚包含封面,加盖公章常见问题:提供WORD版;由WORD直接转换成的PDF;图片格式无封面;承诺书及封面未盖章;一项资料分为多个文件;内容不清晰,不完整,文件无法打开。
2.补正阶段注意事项:按照发补意见要求,一次性、及时提交补正资料。
如申请表需补正的,需另行提交RVT格式,提交纸版资料时需同时提交原申请表。
提出撤回申请,需上传撤回申请表的PDF扫描件。
常见问题:补正资料未上传即提交;补正资料仅上传未提交。
二、再注册审评要求(一) 资料项目《药品再注册申请表》申报资料1.证明性文件:(1)药品批准证明文件及药品监督管理部门批准变更文件的复印件。
(2)《药品生产许可证》正副本的复印件。
(3)《营业执照》正副本的复印件。
(4)《药品生产质量管理规范》认证证书的复印件。
2.五年内生产、销售、抽验情况总结。
3.五年内药品临床使用情况及不良反应情况总结。
4.有下列情形之一的,应当提供相应资料或者说明。
5.提供药品处方、生产工艺、药品标准及处方工艺真实性的承诺书。
6.生产药品制剂所用原料药的来源,未变更原料药来源的承诺书。
7.药品最小销售单元的现行标签和说明书实样或者样稿。
资料项目:可缺省的情形审查要点:各项内容的填写是否完整、准确、规范。
各项内容是否与申报材料一致注意事项填表前,务必仔细阅读填表说明。
国家质量监督检验检疫总局公告2015年第18号——关于公布2014年国家监督抽查产品质量状况的公告

国家质量监督检验检疫总局公告2015年第18号——关于公布2014年国家监督抽查产品质量状况的公告文章属性•【制定机关】国家质量监督检验检疫总局(已撤销)•【公布日期】2015.02.03•【文号】国家质量监督检验检疫总局公告2015年第18号•【施行日期】2015.02.03•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】质量管理和监督正文国家质量监督检验检疫总局公告2015年第18号质检总局关于公布2014年国家监督抽查产品质量状况的公告2014年,质检总局认真贯彻落实中央关于调整经济结构、深化改革和改善民生等重大战略部署,以及节能减排、重点产品质量提升、妇女儿童权益保障等工作要求,坚持依法行政,紧密围绕“抓质量、保安全、促发展、强质检”的工作方针,认真组织开展了日用及纺织品、电子电器、轻工产品、农业生产资料、机械及安防、电工及材料、建筑装饰装修材料、食品相关产品等8大类产品质量国家监督抽查。
现将有关情况公告如下:一、基本情况(一)全年国家监督抽查产品159种。
其中包括:儿童及婴幼儿服装、玩具、学生用品、运动服及针织泳装、旅游鞋、皮鞋和旅行箱等22种日用及纺织品;电冰箱、房间空气调节器、储水式电热水器、电风扇、台式计算机等25种电子电器;纸巾纸、家用燃气用具、家用卫生杀虫用品和家用洗涤剂等17种轻工产品;磷肥、杀虫灯、脱粒机和植物保护机械等11种农业生产资料;安全带、消防水带、车床、锁具等30种机械及安防产品;永磁直流电动机、三相异步电动机、器具开关、液化石油气和隔离开关等21种电工及材料产品;建筑防水卷材、人造板、建筑涂料等28种建筑装饰装修材料;餐具洗涤剂、食品用纸包装、容器、工业和商用电热食品加工设备、食品用塑料包装容器工具等5种食品相关产品。
按照抽查企业数划分,8大类产品抽查比例见下图。
(二)全年共抽查了24245家企业生产的25672批次产品,产品抽查合格率为92.3 %。
药剂科药品质量抽检记录表模版
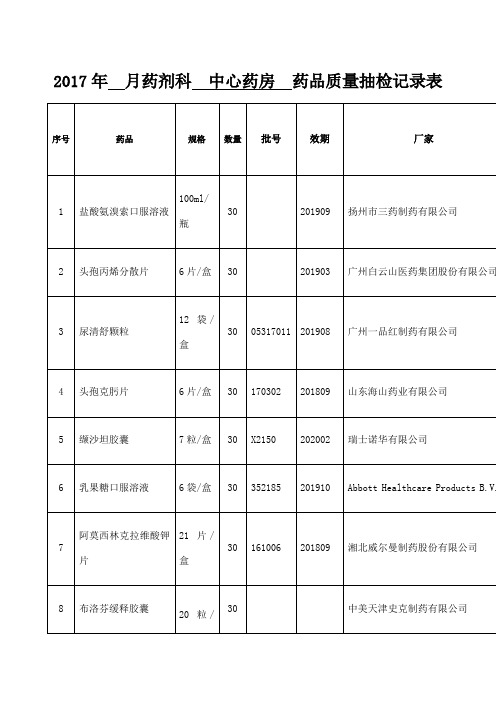
完好
合格
26
厄贝沙坦氢氯噻嗪片
30片/盒
30
2010730
赛诺菲(杭州)制药有限公司
完整
完好
合格
27
培哚普利叔丁胺片
7片/盒
30
1702095
201908
施维雅(天津)制药有限公司
完整
完好
合格
28
复方甲氧那明胶囊
60粒/盒
30
SS056AA
202001
第一三共制药(上海)有限公司
完整
完好
合格
29
完整
完好
合格
15
伤科接骨片
60片/瓶
30
大连美罗中药厂有限公司
完整
完好
合格
16
产复康颗粒
18袋/盒
30
170315
201902
深圳三顺制药有限公司
完整
完好
合格
17
桂枝茯苓胶囊
100粒/盒
30
170425
202003
江苏康缘药业有限公司
完整
完好
合格
18
罗红霉素胶囊
12粒/盒
30
202003
扬子江药业集团有限公司
完整
完好
合格
19
枸橼酸氢钾钠颗粒
100G/罐
30
B1403554
201907
德国马博士大药厂
完整
完好
合格
20
盐酸曲美他嗪片
30盒
30
2010815
施维雅(天津)制药有限公司
完整
完好
合格
21
苯磺酸左旋氨氯地平片
2015出台的医疗器械政策汇总表

完整版:2015医疗器械政策汇总一、分类界定序号分类界定颁发机构日期1 食品药品监管总局办公厅关于乳腺摄影立体定位装置等153个产品分类界定的通知(食药监办械管〔2015〕49号)最新15个Ⅲ类医疗器械分类界定总局 3.31最新58个Ⅱ类医疗器械分类界定最新51个Ⅰ类医疗器械分类界定最新29个非医疗器械分类界定2 食品药品监管总局办公厅关于人工血管接环等172个产品分类界定的通知(食药监办械管〔2015〕69号))总局受理中心5.183 食品药品监管总局办公厅关于恒温核酸扩增检测仪等22个产品分类界定的通知(食药监办械管〔2015〕75号)总局受理中心6.114 食品药品监管总局办公厅关于多功能超声骨刀等127个产品分类界定的通知(食药监办械管〔2015〕104号)总局受理中心7.2二、政策法规序号法规名称颁发机构日期1 食品药品监管总局关于加强避孕套质量安全管理的通知(食药监械监〔2015〕30号)总局 3.232 食品药品监管总局办公厅关于印发体外诊断试剂质量评估和综合治理工作方案的通知(食药监办械监〔2015〕55号)总局 4.073 主动脉覆膜支架系统临床试验审评要点医疗器械技术审评中心4.234 全降解冠状动脉药物洗脱支架临床试验审评要点医疗器械技术审评中心4.235 国务院关于印发《中国制造2025》的通知(国发〔2015〕28号)国务院 5.86 国家发展改革委、财政部关于印发《药品、医疗器械产品注册收费标准管理办法》的通知(发改价格[2015]1006号)国家发展改革委5.127 食品药品监管总局关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)总局 6.088 食品药品监管总局关于对取消和下放行政审批事项加强事中事后监管的意见(食药监法〔2015〕65号)总局 6.99 《药品医疗器械飞行检查办法》(国家食品药品监督管理总局令第14号)总局 6.2910 《医疗器械分类规则》(国家食品药品监督管理总局令第15号)总局7.1411 食品药品监管总局办公厅关于经营免验配耳背式数字助听器有关问题的复函(食药监办械监函〔2015〕414号)总局7.1412 欧洲通过医疗器械和体外诊断器械新法规提案的普遍方法商务部7.213 食品药品监管总局关于进一步加强药品医疗器械保健食品广告审查监管工作的通知(食药监稽〔2015〕145号)总局7.3114 国家卫生计生委医政医管局关于印发《药物代谢酶和药物作用靶点基因检测技术指南(试行)》和《肿瘤个体化治疗检测技术指南(试行)》的通知国家卫生计生委7.3115 食品药品监管总局发布医疗器械软件注册技术审查指导原则总局8.716 食品药品监管总局关于印发医疗器械经营企业分类分级监督管理规定的通知(食药监械监〔2015〕158号)总局8.1717 食品药品监管总局关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知(食药监械监〔2015〕159号)总局8.1718 国务院关于改革药品医疗器械审评审批制度的意见(国发〔2015〕44号)国务院8.1819 食品药品监管总局介绍药品医疗器械审评审批制度改革情况中国政府8.1820 食品药品监管总局办公厅关于个体工商户从事医疗器械经营活动有关问题的复函(食药监办械监函〔2015〕533号)总局9.0221 食品药品监管总局办公厅关于启用医疗器械注册管理信息系统备案子系统的通知(食药监办械管函〔2015〕534号)总局9.0222 食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)总局9.2523 食品药品监管总局印发《医疗器械生产质量管理规范现场检查指导原则》等4个现场检查指导原则总局10.124 食品药品监管总局等部门关于印发开展打击非法制售和使用注射用透明质酸钠行为专项行动工作方案的通知(食药监械监〔2015〕236号)总局10.1425 食品药品监管总局关于印发医疗器械经营质量管理规范现场检查指导原则的通知(食药监械监〔2015〕239号)总局10.1526 《医疗器械使用质量监督管理办法》(国家食品药品监督管理总局令第18号)总局10.2127 食品药品监管总局办公厅关于经营体外诊断试剂相关问题的复函(食药监办械监函〔2015〕646号)总局10.2228 食品药品监管总局发布医疗器械使用质量监督管理办法总局10.2329 医疗器械注册管理法规解读之四总局11.230 食品药品监管总局关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知(食药监械管〔2015〕247号)总局11.431 食品药品监管总局关于印发医疗器械检验机构资质认定条件的通知(食药监科〔2015〕249号)总局11.432 医疗器械注册管理法规解读之五总局11.1933 关于《医疗器械使用质量监督管理办法》的说明总局11.334 《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)总局12.21三、公告/通知/通告/通报序号公告、通知、通告、通报颁发机构日期1国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(2015年第1号)总局 1.192关于调整行政许可事项申报资料接收方式的公告(第133号)总局受理中心 1.303关于采用签收方式接收申报资料的公告(第136号)总局受理中心 2.124关于医用电气设备受理有关问题的公告(第137号)总局受理中心 2.275关于国家食品药品监督管理总局食品安全监管三司、医疗器械注册管理司咨询安排的公告(第139号)总局受理中心 2.286关于调整行政受理、制证咨询服务电话接听安排的公告(第140号)总局受理中心 2.287国家食品药品监督管理总局关于批准发布YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准的公告(2015年第8号)总局 3.028国家食品药品监督管理总局药物临床试验机构资格认定复核检查公告(第4号)总局 3.199关于调整注册申报资料接收方式的公告(第141号)总局受理中心 3.2010关于医疗器械(含体外诊断试剂)延续注册申报资料有关问题的公告(第144号)总局受理中心 3.3111关于医疗器械延续注册申请过渡期相关问题的公告(第143号)总局受理中心 3.3112关于印发《体外诊断试剂抽验工作方案》的通知(食药监械监便函〔2015〕37号)总局器械监管司4.813国家食品药品监督管理总局关于发布生物制品稳定性研究技术指导原则的通告(2015年第10号)总局 4.1514国家食品药品监督管理总局关于发布雌激素受体、孕激素受体抗体试剂及检测试剂盒技术审查指导原则的通告(2015年第11号)总局 4.1715国家食品药品监督管理总局关于注销医疗器械注册证书的公告(2015年第12号)总局 4.1716国家食品药品监督管理总局关于发布医疗器械临床评价技术指导原则的通告(2015年第14号)总局 5.1917第一批优秀国产医疗设备品目遴选顺利完成国家卫生计生委5.2118国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(2015年第53号)总局 5.2719国家食品药品监督管理总局关于发布医疗器械产品出口销售证明管理规定的通告(2015年第18号)总局 6.0120国家食品药品监督管理总局关于发布《中华人民共和国药典》(2015年版)的公告(2015年第67号)总局 6.0521关于执行《国家食品药品监督管理总局关于发布医疗器械产品出口销售证明管理规定的通告》有关事宜的公告(第148号)总局受理中心 6.2422关于调整注册申报资料接收方式的公告(第150号)总局受理中心7.0123国家卫生计生委关于取消第三类医疗技术临床应用准入审批有关工作的通知国家卫生计生委7.224关于发布《前列腺特异性抗原检测前列腺癌临床应用》等4项推荐性卫生行业标准的通告国家卫生计生委7.225国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告(2015年第87号)总局7.0326国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(2015年第103号)总局7.127国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(2015年第101号)总局7.128国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(2015年第102号)总局7.129国家发展改革委关于实施增强制造业核心竞争力重大工程包的通知(发改产业[2015]1602号)国家发展改革委7.1330国家食品药品监督管理总局关于贯彻落实小微企业行政事业性收费优惠政策的通告(2015年第31号)总局7.1431国家食品药品监督管理总局关于发布乙型肝炎病毒基因分型检测试剂技术审查指导原则的通告(2015年第32号)总局7.1532国家食品药品监督管理总局关于发布影像型超声诊断设备新技术注册技术审查指导原则的通告(2015年第33号)总局7.1533关于办理受理和领取批件等行政许可事项的公告(第151号)总局受理中心7.1634食品药品监管总局办公厅关于印发2015年国家医疗器械抽验产品检验方案的通知(食药监办械监〔2015〕100号)总局7.1635国家医疗器械不良事件监测年度报告(2014年度)总局7.236第二批优秀国产医疗设备产品遴选工作启动国家卫生计生委7.23372014年度食品药品监管统计年报总局7.2438国家医疗器械质量公告(2015年第1期,总第6期)总局7.2439关于发布医疗器械软件注册技术审查指导原则的通告(2015年第50号)总局8.0540国家医疗器械质量公告(2015年第2期,总第7期)总局9.241食品药品监管总局办公厅关于启用医疗器械注册管理信息系统备案子系统的通知(食药监办械管函〔2015〕534号)总局9.242关于体外诊断试剂临床试验机构盖章有关事宜的公告(第154号)总局受理中心9.0943国家食品药品监督管理总局关于发布结核分枝杆菌复合群核酸检测试剂注册技术审查指导原则的通告(2015年第65号)总局9.2144关于对部分发补未回的申报资料进行退审的公告医疗器械技术审评中心9.2245国家食品药品监督管理总局关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(2015年第203号)总局10.2146国家食品药品监督管理总局关于规范含银盐医疗器械注册管理有关事宜的公告(2015年第225号)总局11.947国家食品药品监督管理总局关于发布药物临床试验数据现场核查要点的公告(2015年第228号)总局11.148关于药品注册审评审批若干政策的公告(2015年第230号)总局11.1149医疗器械不良事件信息通报(2015年第1-3期)总局11.1250国家食品药品监督管理总局关于征求《关于解决药品注册申请积压实行优先审评审批的意见(征求意见稿)》意见的公告(2015年第227号)总局11.1351国家食品药品监督管理总局关于发布丙型肝炎病毒核糖核酸测定试剂等4个医疗器械技术审查指导原则的通告(2015年第93号)总局11.2652医疗器械不良事件监测的主要目的和意义总局11.2653国家食品药品监督管理总局关于发布医疗器械注册指定检验工作管理规定的通告(2015年第94号)总局11.2754国家食品药品监督管理总局首次组织开展对境外医疗器械生产企业生产现场检查总局12.255食品药品监管总局办公厅关于医疗器械检验机构资质认定条件有关事项的通知(食药监办科函〔2015〕775号)总局12.756广东省探索试行《第二类创新医疗器械特别审批程序》总局12.1157食品药品监管总局办公厅关于启用医疗器械注册管理信息系统受理和制证、技术审评、行政审批子系统的通知(食药监办械管函〔2015〕804号)总局12.1558国家食品药品监管总局出台食品药品领域主要信访事项法定办理途径及相关法律依据总局12.2159广东省率先实施医疗器械注册无纸化审评审批总局12.2260关于征求加强医疗器械监督抽验复检工作有关意见的函(食药监械监便函〔2015〕137号)总局12.2461国务院关于同意建立药品医疗器械审评审批制度改革部际联席会议制度的批复国务院12.2462国家食品药品监督管理总局发布2015年第3期国家医疗器械质量公告总局12.25四、征求意见序号征求意见颁发机构日期1关于征求医疗器械生产质量管理规范无菌医疗器械附录和植入性医疗器械附录意见的函(食药监械监便函〔2015〕6号)总局器械监管司 2.092关于征求《医疗器械生产质量管理规范体外诊断试剂附录》意见的函(食药监械监便函〔2015〕10号)总局器械监管司 2.163关于征求《出具医疗器械出口销售证明管理规定》意见的函(食药监械监便函〔2015〕14号)总局器械监管司 3.134关于征求医疗器械临床试验备案有关事宜意见的函(食药监械管便函〔2015〕25号)总局器械注册司 4.285关于《腹腔内置疝修补补片动物实验技术审评要点》第一次征求意见的通知医疗器械技术审评中心4.36关于对《动物源性医疗器械产品注册申报资料指导原则(修订版)》征求意见的通知医疗器械技术审评中心6.17关于《人红细胞反定型试剂技术审查指导原则》(征求意见稿)公开征求意见的通知医疗器械技术审评中心6.188关于征求《医疗器械经营企业分类分级监督管理规定(征求意见稿)》意见的函(食药监械监便函〔2015〕89号)总局器械监管司7.039国家食品药品监督管理总局关于公开征求《医疗器械命名规则(试行)》﹙征求意见稿﹚意见的通知总局7.110国家食品药品监督管理总局关于公开征求《医疗器械临床试验机构资质认定管理办法》﹙征求意见稿﹚意见的通知总局7.211关于征求《医疗器械生产质量管理规范现场检查指导原则》等四个指导原则意见的函(食药监械监便函〔2015〕98号)总局器械监管司7.2412关于《主动脉覆膜支架系统的临床试验指导原则》(修订稿)公开征求意见的通知医疗器械技术审评中心9.2213关于《α-氰基丙烯酸酯类医用粘合剂产品注册申报资料指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心9.2214关于征求相关医疗器械注册事项办理程序意见的函(食药监械管便函〔2015〕61号)总局器械注册司9.2815关于对《软性接触镜上市前临床试验指导原则》征求意见的通知医疗器械技术审评中心9.2816关于对《脊柱后路内固定系统产品注册技术审查指导原则》征求意见的通知医疗器械技术审评中心9.2817关于《影像型超声诊断设备(第三类)产品注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心9.318国家食品药品监督管理总局器械监管司公开征求《医疗器械工艺用水质量管理指南》意见总局器械监管司10.0919关于《粒子束治疗系统注册申报资料指导原则》&《一次性使用脑积水分流器注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心10.1920关于《植入式心脏起搏器注册申报资料指导原则(征求意见稿)》征求意见的通知医疗器械技术审评中心10.2621关于《医用X射线诊断设备(第三类)产品注册技术审查指导原则(征求意见稿)》&《离心式血液成分分离设备非临床注册技术审查指导原则(征求意见稿)》征求意见的通知征求意见的通知医疗器械技术审评中心10.2622关于《可吸收性外科缝线产品注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心10.2723关于《治疗呼吸机注册技术审查指导原则》征求意见的通知医疗器械技术审评中心11.224关于《脉搏血氧仪设备临床评价技术审查指导原则》征求意见的通知医疗器械技术审评中心11.325关于《高频手术设备注册技术审查指导原则》&《强脉冲光治疗仪产品注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心11.626关于《牙科基托聚合物材料注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心11.627关于对《无源植入类骨关节产品说明书编写指导原则》及《常见无源植入类骨关节产品说明书示例》征求意见的通知医疗器械技术审评中心11.1228食品药品监管总局办公厅国家卫生计生委办公厅关于公开征求医疗器械不良事件监测和再评价管理办法(征求意见稿)意见的函(食药监办械监函〔2015〕723号)医疗器械技术审评中心11.1229关于对《髋关节假体注册技术审查指导原则—临床试验部分》征求意见的通知医疗器械技术审评中心11.2430关于征求对《椎间融合器技术审查指导原则(征求意见稿)》意见的通知医疗器械技术审评中心11.2731关于征求对《免于进入临床试验的第二类医疗器械目录(第二批)(征求意见稿)和《免于进行临床试验的第三类医疗器械目录(第二批)(征求意见稿)意见的通知医疗器械技术审评中心12.1432关于征集“胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)”生产企业信息的通知医疗器械技术审评中心12.23来源:奥咨达整理。
药品质量公告2015年第2期
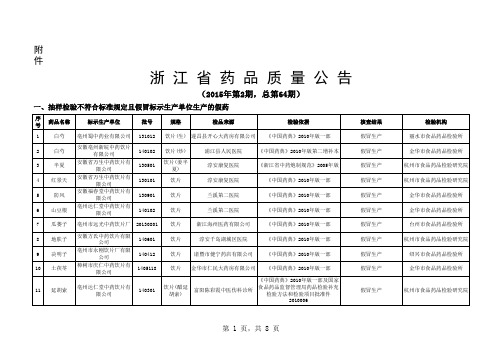
饮片
淳安千岛湖城区医院
《中国药典》2010年版一部
9
决明子
亳州市永刚饮片厂有限 公司
14O412
饮片 诸暨市健宁药店有限公司 《中国药典》2010年版一部
10
土茯苓
樟树市庆仁中药饮片有 限公司
1405118
饮片 金华市仁民大药房有限公司 《中国药典》2010年版一部
《中国药典》2010年版一部及国家
杭州市食品药品检验研究院
第 1 页,共 8 页
12
皂角刺
安徽亳州浙皖中药饮片 有限公司
130524
13 枳壳 浙江宇晨药业有限公司 14051605
14
地骨皮
亳州市国苑中药材饮片 有限公司
140120
15 瓜蒌子 亳州市远光中药饮片厂 20130801
饮片 饮片 饮片
舟山百姓医药连锁有限公司 环城西路店
16 木通 亳州市远光中药饮片厂 20130701
17
山慈菇
亳州市国苑中药材饮片 有限公司
140122
18
五加皮
亳州市国苑中药材饮片 有限公司
140120
19 川贝母 亳州蜀中药业有限公司 140918
饮片 饮片 饮片 饮片
三门县仁爱堂药店 《中国药典》2010年版第一增补本
三门县仁爱堂药店
《中国药典》2010年版一部
假冒生产
金华市食品药品检验所
21 菟丝子 亳州蜀中药业有限公司 140918
饮片
金华市正涵堂大药房
《中国药典》2010年版一部
假冒生产
金华市食品药品检验所
22 乌梢蛇 亳州蜀中药业有限公司 140918
饮片
金华市正涵堂大药房 《浙江省中药炮制规范》2005年版
国家药品监督管理局关于印发《药品质量监督抽查检验工作管理暂行规定》的通知

国家药品监督管理局关于印发《药品质量监督抽查检验工作管理暂行规定》的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】2001.08.17•【文号】•【施行日期】2001.08.17•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药品监督管理局关于印发《药品质量监督抽查检验工作管理暂行规定》的通知各省、自治区、直辖市药品监督管理局、药品检验所,解放军总后卫生部、药检所,武警总部卫生部、药检所,中国药品生物制品检定所,国家药品监督员办公室:为加强和规范药品质量监督抽查检验工作,保证药品抽验工作的质量,现将《药品质量监督抽查检验工作管理暂行规定》印发给你们,请遵照执行。
请各地药品监督管理部门、药品检验所认真组织学习贯彻,指导药品抽验工作,对实践中发现的问题,及时报告我局市场监督司。
特此通知。
附件:药品质量监督抽查检验工作管理暂行规定及抽样指导原则国家药品监督管理局二00一年八月十七日附件:药品质量监督抽查检验工作管理暂行规定第一章总则第一条为加强和规范药品质量抽查检验工作,保证抽样、检验工作的质量,促进药品质量提高,保障人民用药安全有效,根据《中华人民共和国药品管理法》,特制定本规定。
第二条国家药品监督管理局主管全国药品质量监督抽查检验工作。
省、自治区、直辖市药品监督管理部门负责本行政区域内的药品质量监督抽查检验工作。
第三条本办法适用于中华人民共和国境内的药品监督管理部门及其设置和确定的药品检验机构和从事药品生产、经营、使用的单位或者个人。
药品监督管理部门设置和确定的药品检验机构,承担依法实施药品监督检查所需的药品质量检验工作。
从事药品的生产、经营、使用的单位或者个人,应当依照本规定接受监督检查,配合药品质量抽查检验工作的开展。
第二章监督抽查检验的原则第四条国家对生产、经营、使用的药品质量实行监督抽查检验。
监督抽查检验分为专项监督抽查检验和日常监督抽查检验。
国家专项监督抽查检验是由国家药品监督管理局在全国范围内组织的药品质量监督抽查检验工作,主要包括:(一)全国范围内的药品同品种质量考核;(二)临床不良反应严重的药品的质量考核;(三)国家药品质量公告中公布的不合格药品;(四)生物制品;(五)国家药品监督管理局认为需要抽查检验的药品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015年第2期江西省药品质量公告抽验假冒样品汇总表
序号 标示检品 名称 标示生产单位 标示批号 规格 被抽样单位 检验依据 检验结果 不符合规 定项目 报告书编号 检验单位
1
2
3
4 5
《中国药典》2010年版一部 亳州市豪门中药 20140401 及国家食品药品监督管理局 菟丝子 饮片有限公司(假 中药饮片 安义九洲医院 药品检验补充检验方法和检 冒) 验项目2011024号 《中国药典》2010年版一部 天马(安徽)中 20140320 安义县不育症 及国家食品药品监督管理局 菟丝子 药饮片科技有限 中药饮片 专科医院 药品检验补充检验方法和检 公司(假冒) 验项目2011024号 安徽新兴中药材 赣州春源大药 麸炒枳壳 饮片有限公司 20110902 中药饮片 《中国药典》2010年版一部 房 (假冒) 江苏吴中医药集 怡和花园卫生 利巴韦林 1ml:0.1g 服务所(抚州 《中国药典》2010年版二部 团有限公司苏州 140422 注射液 制药厂(假冒) 市广昌县) 时珍堂巴东药业 20121208 泰和县人民医 沉香 中药饮片 《中国药典》2010年版一部 有限公司(假 院
