CL21-2015(卫生检疫)申请书
出入境特殊物品卫生检疫审批申请表

中华人民共和国出入境检验检疫ENTRY-EXIT INSPECTION ANG QUARANTINE OF THE PEOPLE'S REPUBLIC OF出入境特殊物品卫生检疫审批申请表APPLICATION OF IMPORT / EXPORT SPECIAL ARTICLES FOR VERIFICATION OF HEALTH AND QUARANTINE编号No:A 0000000 中华人民共和国质量监督检验检疫总局印制中华人民共和国出入境检验检疫ENTRY-EXIT INSPECTION ANG QUARANTINE OF THE PEOPLE'S REPUBLIC OF出入境特殊物品卫生检疫审批申请表(附表)APPLICATION OF IMPORT / EXPORT SPECIAL ARTICLES FOR VERIFICATION OF HEALTH AND QUARANTINE( ATTACHMENT )填写单位(盖章)日期年月日Applying unit (Stamp)DateCIQ标志中华人民共和国出入境检验检疫ENTRY-EXIT INSPECTION ANG QUARANTINE OF THEPEOPLE'S REPUBLIC OF出入境特殊物品卫生检疫审批单APPROVAL OF IMPORT / EXPORT SPECIAL ARTICLES FOR VERIFICATION OF HEALTH AND QUARANTINE编号No.A 0000000 中华人民共和国质量监督检验检疫总局印制中华人民共和国出入境检验检疫ENTRY-EXIT INSPECTION ANG QUARANTINE OF THE PEOPLE'S REPUBLIC OF出入境特殊物品卫生检疫审批单(附表)APPROVAL OF IMPORT / EXPORT SPECIAL ARTICLES FOR VERIFICATION OF HEALTH AND QUARANTINE ( ATTACHMENT )填写单位(盖章)日期年月日Applying unit (Stamp)Date。
检验检疫申请报告

检验检疫申请报告
尊敬的检验检疫部门:
我方希望向贵部门提交一份检验检疫申请报告,希望得到您的认可和支持。
一、申请单位及联系方式
申请单位:XXX公司
单位地址:XXXXXXXXXXXX
联系人:XXX
联系电话:XXXXXXXX
电子邮箱:XXXXXXXXX
二、申请物品信息
1. 物品名称:XXXXX
2. 物品数量:XXXXX
3. 物品描述:(在这里详细描述物品的特征、材料、用途等相关信息)
三、检验检疫要求
1. 检验要求:请贵部门对所申请的物品进行检验,确保其符合相关法律法规和标准要求。
2. 检疫要求:请贵部门对所申请的物品进行检疫,确保其不会对国家生态环境和公共卫生造成任何危害。
四、申请理由
(在这里详细陈述申请的理由,包括但不限于以下几点)
1. 需要经过检验检疫的法律法规规定。
2. 避免违反国家相关法律法规和标准要求。
3. 保证物品的品质和安全性。
4. 其他附加说明。
五、申请附属文件清单
1. 申请单位营业执照复印件
2. 物品相关证书(可以根据具体情况列出)
3. 其他相关文件备份(可以根据具体情况列出)
六、申请时间及费用
1.申请时间:XXX年XX月XX日
2.申请费用:请贵部门告知具体申请费用及缴费方式。
请贵部门在收到本申请报告后尽快回复,并告知相关的后续流程和要求。
我方将全力配合并提供所需的配合和合作。
此致
XXXX公司
附:申请单位盖章
日期:XXXX年XX月XX日。
CNAS-CL21:2015《检测和校准实验室能力认可准则在卫生检疫领域的应用说明》

CNAS-CL21检测和校准实验室能力认可准则在卫生检疫领域的应用说明Guidance on the Application of Laboratory Accreditation Criteria in the Field of Health Quarantine中国合格评定国家认可委员会前言卫生检疫是中国合格评定国家认可委员会(英文缩写:CNAS)对实验室的认可领域之一,该领域应考虑人的精神、心理因素和医学伦理问题。
本文件是CNAS 根据卫生检疫的特性而对CNAS-CL01:2006《检测和校准实验室能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
因此,本文件采用针对CNAS-CL01:2006《检测和校准实验室能力认可准则》的具体条款提出应用说明的编排方式,故章节号是不连续的。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL01:2006中章、节的条款号和条款名称,对CNAS-CL01:2006应用说明的具体内容在对应条款后给出。
本文件需与CNAS-CL01:2006《检测和校准实验室能力认可准则》同时使用。
本文件替代CNAS-CL21:2006。
相对于CNAS-CL21:2006,本文件除编辑性修订外,主要技术变化见附录A。
检测和校准实验室能力认可准则在卫生检疫领域的应用说明1 范围本文件适用于CNAS对卫生检疫领域实验室的认可活动。
卫生检疫领域包括生物学、微生物学、免疫学、化学、血液免疫学、血液学、生物物理学、细胞学、病理学、遗传学、媒介生物学等检测。
2 引用标准3 术语和定义4 管理要求4.1 组织4.1.3 在固定设施以外的场所,进行检测和抽取样品时,应在技术控制和有效监督下进行并保留所有活动的记录。
4.1.5 实验室应:c) 有保护客户信息和所有权的规定,且充分体现医学伦理。
如不收集与检测工作无关的个人信息,采样时对客户任何操作均应告知并得到同意、充分保护隐私,对检验结果保密,未经授权不公开等。
出入境特殊物品卫生检疫审批申请材料要求

出入境特殊物品卫生检疫审批申请材料要求提交申请材料时须注意的事项一、所有申请材料均需加盖申请单位公章;二、所有外文内容均需翻译成中文;三、申请材料的文字、图像、符号应该清晰;四、提交的申请材料大小为A4纸;五、《特殊物品审批申请单》和《特殊物品审批申请单附表》还需提交电子文本;由于该行政许可实施电子监管,申请单位提交书面申请材料的同时,请在口岸卫生检疫电子监管系统()中登陆并录入许可证申请信息,并可在该系统查询许可证办理的情况。
➢首先在企业注册页面填写有关信息(所在地检验检疫机构请选择重庆局本部),提交注册申请后,获得一个12位数字的注册号(此号为企业的用户名)。
➢注册申请通过后,在“特殊物品企业登陆”页面,输入用户名,密码(在注册时自行设定),验证码,登陆系统后,点击“申请书提交”,在申请书页面录入有关信息后提交申请。
➢疑问请咨询当地检验检疫机构工作人员,或重庆检验检疫局卫检处67757909。
入境的,用于治疗、预防、诊断的生物制品、血液制品一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、国家药品监督管理部门出具的相关批准证明,《医疗器械产品注册登记表》、《医疗器械注册证》或《进口药品注册证》三、医疗器械进口批件(与仪器配套的诊断试剂需提供)四、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)五、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;出境的,用于治疗、预防、诊断的生物制品、血液制品一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、国家药品监督管理部门出具的《药品销售证明》、《中华人民共和国药品GMP 证书》、《药品生产企业许可证》;经国家认可机构认可的实验室出具的检验报告三、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)四、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;入出境的,用于其它领域的生物制品、血液制品一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、相关主管部门出具的准许出入境证明(未能提供的,需要提交保函)三、产品所含成分、来源等情况说明四、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件) (科研用特殊物品需提供)五、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入出境单个或几个医用特殊物品,且属于人道主义捐赠、救助或疾病诊断用的(如骨髓、脐带血、角膜、血液、尿液等)一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、地方卫生主管部门出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件) (科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入出境医学科研样品(如细胞株、生物制品、生物芯片、克隆人体细胞组织等)一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、地方卫生主管部门出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件) (科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入境医用特殊物品,且属于新药国际多中心临床研究项目的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、卫生部科教司出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件) (科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入境医用特殊物品小样本(100人份以下,含100人份)的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、地方卫生主管部门出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件) (科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入境医用特殊物品大样本(100人份以上)一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、卫生部科教司出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)出境医用特殊物品小样本(100人份以下,含100人份),且不涉及家系、特定地区和人类遗传资源的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、地方卫生主管部门出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)出境医用特殊物品大样本(100人份以上),且不涉及人类遗传资源的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、卫生部科教司出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入出境医用特殊物品,且含有或可能含有1级—2级病原微生物的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、地方卫生主管部门出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入出境医用特殊物品,且含有或可能含有3级—4级病原微生物的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、卫生部科教司出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入出境医用特殊物品,且来源于疫区的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、卫生部科教司出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)出境医用特殊物品,且涉及家系或特定地区和人群,但不涉及人类遗传资源的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、卫生部科教司出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)出境人体物质,且涉及人类遗传资源的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、人类遗传资源管理办公室出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件) (科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入境的,且用于食品、药品生产的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、国家食品药品主管部门出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入出境的,且用于其它领域的一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、国务院相应主管部门出具的准许出入境证明三、特殊物品所含病原微生物的学名(中文和拉丁文)和生物学特性(中英文对照件)的说明性文件四、使用单位P3级或相应等级以上实验室认可证明(含有或者可能含有3级—4级病原微生物的入境特殊物品,及含有或者可能含有尚未分级病原微生物的入境特殊物品需提供)五、科研项目批准文件原件或者科研项目申请人与国内外合作机构协议(原件和复印件中、英文对照件)(科研用特殊物品需提供)六、有资质医院出具的供体健康证明和相关检验报告(供移植用器官需提供)七、其它材料:合同(中、英文);发票(中、英文);箱单(中、英文);产品说明书(中、英文);安全性说明;输出国相关的检疫、检验证书(中、英文)入境的,科学实验或其他生产、实验过程所需的培养基一、《出入境特殊物品卫生检疫审批申请单》及《出入境特殊物品卫生检疫审批申请单附表》二、产品目录、输出国官方出具的检疫证书原件及中文翻译件,成分列表;输出国为非疯牛病疫区的,官方检疫证书中须列明产品中不含有反刍动物源性物质或含有反刍动物源性物质但来源于非疯牛病发生地区的健康动物;输出国为疯牛病疫区的,官方检疫证书中须列明产品中不含有反刍动物源性物质。
出入境特殊物品卫生检疫的申请和办理

出入境特殊物品卫生检疫的申请和办理2017-10-09一、项目名称出入境特殊物品卫生检疫的申请和办理二、依据(一)《中华人民共和国国境卫生检疫法》第四条“入境、出境的人员、交通工具、运输设备以及可能传播检疫传染病的行李、货物、邮包等物品,都应当接受检疫,经国境卫生检疫机关许可,方准入境或者出境”。
(二)《中华人民共和国国境卫生检疫法实施细则》第十一条“入境、出境的微生物、人体组织、生物制品、血液及其制品等特殊物品的携带人、托运人或者邮递人,必须向卫生检疫机关申报并接受卫生检疫,未经卫生检疫机关许可,不准入境、出境。
海关凭卫生检疫机关签发的特殊物品审批单放行。
“第十九条“卫生检疫机关的职责:(四)对入境、出境的微生物、生物制品、人体组织、血液及其制品等特殊物品以及能传播人类传染病的动物,实施卫生检疫;(三)《出入境特殊物品卫生检疫管理规定》”(四)《艾滋病防治条例》第三十七条“进口人体血液、血浆、组织、器官、细胞、骨髓等,应当经国务院卫生主管部门批准;进口人体血液制品,应当依照药品管理法的规定,经国务院药品监督管理部门批准,取得进口药品注册证书。
经国务院卫生主管部门批准进口的人体血液、血浆、组织、器官、细胞、骨髓等,应当依照国境卫生检疫法律法规的有关规定,接受出入境检验检疫部门的检疫。
未经检疫或者检疫不合格的,不得进口。
”第四十条“县级以上人民政府卫生主管部门和出入境检验检疫部门可以封存有证据证明可能被艾滋病病毒污染的物品,并予以检验或者进行消毒。
经检验,属于被艾滋病病毒污染的物品,应当进行卫生处理或者予以销毁;对未被艾滋病病毒污染的物品或者经消毒后可以使用的物品,应当及时解除封存。
”第五十九条“未经国务院卫生主管部门批准进口的人体血液、血浆、组织、器官、细胞、骨髓等,进口口岸出入境检验检疫部门应当禁止入境或者监督销毁。
提供、使用未经出入境检验检疫部门检疫的进口人体血液、血浆、组织、器官、细胞、骨髓等的,由县级以上人民政府卫生主管部门没收违法物品以及违法所得,并处违法物品货值金额3倍以上5倍以下的罚款;对负有责任的主管人员和其他直接责任人员由其所在单位或者上级主管部门依法给予处分。
CNAS-CL01-A012:2018《检测和校准实验室能力认可准则在卫生检疫领域的应用说明》

CNAS-CL01-A012检测和校准实验室能力认可准则在卫生检疫领域的应用说明Guidance on the Application of Laboratory Accreditation Criteria in the Field of Health Quarantine中国合格评定国家认可委员会前言卫生检疫是中国合格评定国家认可委员会(英文缩写: CNAS)对实验室的认可领域之一,该领域应考虑人的身体、心理因素和医学伦理问题。
本文件是CNAS 根据卫生检疫的特性而对CNAS-CL01:2018 《检测和校准实验室能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
因此,本文件采用针对CNAS-CL01:2018《检测和校准实验室能力认可准则》的具体条款提出应用说明的编排方式,故章节号是不连续的。
本文件在结构编排上,均采用CNAS-CL01:2018中章、节的条款号和条款名称,对应CNAS-CL01:2018条款后给出应用说明的具体内容。
本文件需与CNAS-CL01:201:8《检测和校准实验室能力认可准则》同时使用。
本文件替代CNAS-CL21:2015。
检测和校准实验室能力认可准则在卫生检疫领域的应用1 范围本文件适用于CNAS对卫生检疫领域实验室的认可活动。
卫生检疫领域包括生物学、微生物学、免疫学、化学、血液免疫学、血液学、生物物理学、细胞学、病理学、遗传学、媒介生物学等检测。
本文件在使用中应同时参照CNAS其他领域应用说明。
2 引用标准下列参考文件对于本文件的应用不可缺少。
对注明日期的参考文件,只采用所引用的版本。
CNAS-CL01:2018 检测和校准实验室能力认可准则3 术语和定义在CNAS-CL01:2018中确立的术语和定义适用于本文件。
4 通用要求4.1 公正性4.2 保密性4.2.1实验室应有文件规定保护实验室活动中产生和获得的信息,并签署保密协议:保护客户的信息和所有权,且充分体现医学伦理。
植物检疫申请书

年 月日
申请单位 (人)
申请单位 地址
联系人 电话
收货单 单位名称
位(人) 地 址
货物名称
调 运 检 疫
重量 (公斤)
件数 包 装 原产地
联系人 电话
检疫证明编号
起运 地点 植物 名称
产
地
检
疫
品种名称
运往地 点
种(苗) 来源
生产面积
预计产量
运输方式 生产地点
生产期限
填表说明:1、此表请用兰黑色签字笔填写或用打印机打印,同时加盖单位公章(如申请者是个人, 需申请人按手印)。
2、地址一栏要写详细地址。 3、检疫证明编号一栏:如果是本地生产的种子需要调 出本地,本栏需填写产地检疫证明编号 并在编号前标注“产”字;如果是从外地调入本地后再需要调出的,则需填写在检疫站备案时的调 运检疫申请书的编号,并在编号前标注“调”字。
出入境特殊物品卫生检疫审批申请表(样本)

CUSTOMS OF THE PEOPLE'S REPUBLIC OF CHINA
出入境特殊物品卫生检疫审批申请表
APPLICATION OF IMPORT / EXPORT SPECIAL ARTICLES FOR
VERIFICATION OF HEALTH AND QUARANTINE
入境 / 出境口岸 入境 / 出境日期
Port of entry / departurexxDate of arrival / departure20xx-xx-xx
入境后的生产、加工、使用、存放地址
The place of manufacture, machining, use or hold after entry存放于xx实验室
申请流水号 No:
中文名称
Chinese name
英文名称
English name
数量
Quantity
重量Weight
主要成份列项
List of component
用 途
Purpose
xxxx
xxxxx
xx
xx
xxxx
用于xxx的研究
填写单位(盖章) 日期20xx年xx月xx日
Applying unit (Stamp) Date
用途说明
Purpose describe用于xx研究
储存条件: □ 常温 □ 冷藏冷冻 □ 其它
Deposited condition: □Normal temperature □RefrigerationFreeze □Others
含有或可能含有的微生物 微生物危险性等级
Microbe which contain or likely containxxRisk lever无
CL23-2015申请书核查表

5.8.4
实验室应采取适当防护措施,防止样品在储存和处置过程中有害生物逃逸、扩散。
注:实验室要有适当措施防止样品在储存过程中生虫、霉变等情况发生。
5.9检测和校准结果质量的保证
5.9.1
实验室应制定结果复核程序,并保留所有复核记录。该程序应包括(但不限于):
——何种情况需要进行复核;
5.6.3.3
实验室应制定程序和计划,核查并保证所使用的参考物质的完整性,以及可产生预期特征和特性(如致病性、抗原性、产孢能力和活性等)。
注:实验室要有标准物质/标准样品、标本、标准菌株等核查程序,该程序至少要包括以下内容:(1)核查对象;(2)核查内容;(3)核查方法;(4)核查人员;(5)发现问题的处理措施。
实验室应对正在使用中的培养、栽植或处理可能携带危险性有害生物检测样品的设备加以警示标识,防止他人误用,造成危险性有害生物逃逸、扩散。
5.5.6
实验室应建立相应的程序,对器具的灭菌、洗涤等做出规定。
5.6测量溯源性
5.6.3.2
实验室使用的标准菌株、毒源、标本和诊断试剂等应是标准物质/标准样品,或经认可的途径获得或经相关专家确认的,并保留相关记录。
2.本核查表只在CNAS-CL23适用时填写。
4.6服务和供应品的采购
4.6.2
实验室用于检测鉴定最终结果判定的诊断试剂,在使用前应经过验证,证明能够满足检测方法规定的要求。
4.7服务客户
4.7.1
实验室最高管理者应根据客户提出的相关业务咨询问题,授权有一定专业背景且有一定工作经历的技术人员或管理人员为其做出口头或书面的解释说明。
4.1.5 c)
实验室应建立向有关部门报告检出危险性有害生物的程序。
农药残留物检测申请书模板

尊敬的XX检测机构:您好!我代表XX公司,向您提交一份农药残留物检测申请。
我们希望通过您的专业检测,了解我司产品中农药残留物的实际情况,以确保产品符合我国及国际相关标准,保障消费者健康。
一、申请检测产品简介1. 产品名称:XX蔬菜(或其他农产品)2. 产品类型:新鲜蔬菜(或其他农产品类别)3. 产地:XX地区4. 生产日期:XX年XX月XX日5. 产品规格:XX公斤/箱(或其他规格)二、检测项目及标准1. 检测项目:根据我国GB 2763-2019《食品安全国家标准食品中农药最大残留限量》以及其他相关国际标准,包括但不限于以下农药残留物:- 有机磷农药:水胺硫磷、甲基对硫磷、甲胺磷、乙酰甲胺磷、杀螟硫磷、三唑磷、对硫磷、马拉硫磷等;- 有机氯农药:六氯苯、五氯硝基苯、七氯、艾氏剂、狄氏剂、硫丹等;- 其他农药残留物:如菊酯类农药、新烟碱类农药等。
2. 检测标准:GB 2763-2019、《食品安全国家标准食品中农药最大残留限量》、CIPAC分析方法等。
三、检测目的1. 确保产品中农药残留物符合我国及国际相关标准,保障消费者健康;2. 提高产品质量和市场竞争力;3. 为企业制定合理的农药使用政策提供科学依据。
四、检测方式及流程1. 请您根据申请检测的产品,按照相关标准和方法进行检测;2. 检测过程中,如有需要,请及时与我们沟通,以便我们提供相关协助;3. 检测完成后,请您出具检测报告,并告知我们检测结果;4. 我们将根据检测结果,采取相应措施,确保产品安全。
五、申请日期本申请于XX年XX月XX日提交。
六、联系方式联系人:XX电话:XX邮箱:XX地址:XX在此,我们感谢您对我司产品的关注和支持,期待与您携手共创美好未来!此致敬礼!XX公司代表:XXXX年XX月XX日。
进口受控消耗臭氧层物质申请书

___________年_______月____址
联 系 人
联系电话
主管单位
(地区)
出口单 位
单位名称
单位地址
国家(地区)
生产单 位
单位名称
单位地址
国家(地区)
此次申请进口ods名称及代号
商品编号
此次申请进口ods数量(吨)
备
注
主管部门审查意见及批准数量:
进口ods代号________________________________
进口ods物质来源____________________________
本次进口数量(吨)_________________________
预计进口时间_______________________________
报关口岸___________________________________
经办人签字:
批准日期: 年 月 日
有效期:
进口受控消耗臭氧层物质申请书
进口单位__________________________(盖公章)
对外成交单位_______________________________
进口ods商品编号____________________________
进口ods名称________________________________
国际动植物检疫许可申请全攻略

国际动植物检疫许可申请全攻略在进行国际贸易时,动植物检疫许可是必不可少的。
如果您计划从一个国家或地区出口动植物产品,您必须明白该国家或地区的检疫要求,并且按照该要求申请许可。
本文将为您提供关于国际动植物检疫许可申请的全面指南,以确保您的申请顺利进行。
1. 了解目标国家或地区的要求在准备国际动植物检疫许可申请之前,您需要研究并了解目标国家或地区的动植物检疫要求。
这些要求可能涉及产品种类、数量、包装、标签以及必要的证明文件等。
您可以通过该国家或地区的官方网站、贸易机构以及相关协会或组织获得这些信息。
2. 开展必要的检测和检疫措施根据目标国家或地区的要求,您可能需要对您的产品进行必要的检测和检疫措施。
这可能包括检测有害生物、进行疫情监测、执行必要的消毒等。
确保您按照要求执行这些措施,并保留相应的检测和检疫记录。
3. 编写申请文件根据目标国家或地区的要求,您需要编写申请文件。
这些文件可能包括申请表格、产品描述、检测和检疫报告、出口商资质证明等。
确保您按照要求填写和提供这些文件,以免延误申请过程。
4. 寻求专业支持如果您对动植物检疫许可申请流程感到困惑或不确定,您可以寻求专业支持。
专业的贸易咨询机构或律师可以为您提供指导,并确保您的申请满足目标国家或地区的要求。
5. 申请许可一旦您准备好所需的文件和资料,您可以向目标国家或地区的相关部门提交申请。
确保您按照要求提交申请,并注意申请审核的时间。
如果需要缴纳申请费用,确保在提交申请之前支付相应费用。
6. 跟进申请进展申请许可后,您可能需要跟进申请进展。
如果需要补充材料或提供进一步的信息,确保及时响应并提供所需的文档。
保持与相关部门的沟通,并咨询申请的状态。
7. 收到许可并遵守要求一旦您收到动植物检疫许可,您需要确保遵守许可中的所有要求。
这可能包括特定的包装方式、标签规定、运输要求等。
确保您的产品符合这些要求,并配备必要的证明文件以备查验。
总结:国际动植物检疫许可申请是确保在国际贸易中顺利进行必不可少的步骤。
CNAS-CL21检测和校准实验室能力认可准那么在卫生检疫实验室的应用说明核查表
实验室对接触病原体的设备、器具是否进行有效的卫生控制?
污染的和非污染的设备、器具是否有明确的标识加以区别?
实验室是否有措施保证设备在维修或报废前消除其污染?
测量溯源性
.2
实验室是否使用符合试验要求的标准品和质控品?
这些标准品或质控品宜来自权威或被行业内所认可的部门。
如实验室自配质控品时,实验室是否有相应的程序保证其质量可靠,并保留相关记录?
实验室是否:
c)在保护客户的机密信息和所有权的政策和程序中充分体现医学伦理?在接受、采集及结果报告期间均充分保护客户隐私?
检测和校准的分包
实验室是否定期评审与分包实验室的协议,评价分包实验室的能力,以确保分包实验室有能力持续满足分包要求?由客户或法定管理机构指定的分包方除外。
填表说明:1.“自查结果说明”栏应逐个条款进行描述。
附表6(CNAS-CL21:2006)
《检测和校准实验室能力认可准那么在卫生检疫实验室的应用说明》核查表
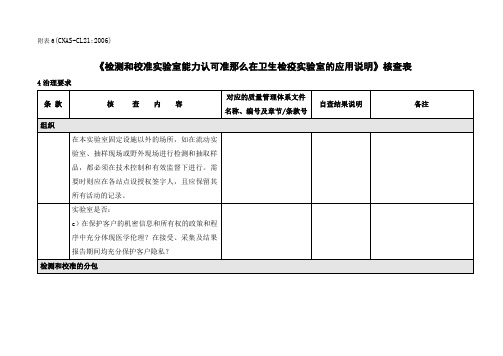
4治理要求
条 款
核 查 内 容
对应的质量管理体系文件名称、编号及章节/条款号
自查结果说明
备注
组织
在本实验室固定设施以外的场所,如在流动实验室、抽样现场或野外现场进行检测和抽取样品,都必须在技术控制和有效监督下进行。需要时则应在各站点设授权签字人,且应保留其所有活动的记录。
测试和校准物品的处置
实验室制定的样品控制程序是否包括对检测样品和验余样品的弃置规定,确保样品中的病原体不传播扩散?如可行,是否对不同检测样品的运输条件和接收条件提出要求?
实验室是否根据卫生检疫要求规定检测样品的保留期,并合理处置按规定保存的样品?
检测和校准结果的质量保证
a)实验室是否根据内部质量控制的要求,建立适用的内部质量控制程序,并有效实施?
检疫申请书

检疫申请书背景随着全球化的发展,人们的跨国交流越来越频繁,各种动植物及其产品的跨境贸易也日益增多。
为了保障国家的生态安全和人民的健康,各国都采取了一系列的检疫措施,对进出口的动植物及其产品进行检疫。
在中国,检疫工作由国家质量监督检验检疫总局和各地方质量技术监督局负责。
检疫申请书的作用在进行动植物及其产品的进出口贸易时,需要向检疫机构提交检疫申请书。
检疫申请书是一种正式的申请文件,用于向检疫机构申请检疫服务。
它是进出口贸易中不可或缺的一环,具有以下作用:1.申请检疫服务。
检疫申请书是向检疫机构申请检疫服务的正式文件,必须按照规定的格式填写和提交。
2.提供相关信息。
检疫申请书需要提供进出口货物的相关信息,包括货物名称、数量、产地、生产厂家、运输方式等,以便检疫机构进行检疫。
3.保障贸易安全。
检疫申请书是保障贸易安全的重要手段之一,它可以帮助检疫机构对进出口货物进行全面、准确的检疫,防止疫情和有害生物的传播。
检疫申请书的内容检疫申请书的内容应包括以下几个方面:1.申请人信息。
包括申请人名称、地址、联系电话、传真等。
2.货物信息。
包括货物名称、数量、产地、生产厂家、运输方式等。
3.检疫要求。
包括检疫方式、检疫标准、检疫地点等。
4.申请日期和签名。
申请日期是指填写检疫申请书的日期,签名是指申请人或其代表在检疫申请书上签字确认。
检疫申请书的填写要求为了保证检疫申请书的有效性和规范性,填写时需要注意以下几个方面:1.填写清晰、准确。
检疫申请书需要填写清晰、准确的信息,以便检疫机构进行检疫。
2.按照规定格式填写。
检疫申请书需要按照规定的格式填写,不得随意更改或省略必要的信息。
3.提供必要的证明材料。
有些货物需要提供相关的证明材料,如动物及其产品需要提供动物卫生证书等。
4.申请人签字确认。
申请人或其代表需要在检疫申请书上签字确认,以便检疫机构核实申请人的身份和意愿。
结语检疫申请书是进出口贸易中不可或缺的一环,它是保障贸易安全和生态安全的重要手段之一。
检疫证申请书

尊敬的【检疫局名称】:我单位(或个人)现就【动物/产品名称】的检疫事宜,特向贵局提出申请,具体内容如下:一、申请单位基本信息单位名称:【申请单位名称】单位地址:【申请单位地址】法定代表人/负责人:【法定代表人/负责人姓名】联系电话:【联系电话】电子邮箱:【电子邮箱】二、申请检疫的动物/产品信息1. 名称:【动物/产品名称】2. 品种:【动物/产品品种】3. 数量:【动物/产品数量】4. 生产/养殖单位:【生产/养殖单位名称】5. 生产/养殖地址:【生产/养殖地址】6. 出/入境日期:【出/入境日期】三、申请检疫的原因1. 【动物/产品】需【出境/入境】,按照我国相关法律法规,需进行检疫。
2. 【动物/产品】来源于【生产/养殖单位】,为确保其健康、安全,需进行检疫。
3. 【动物/产品】在运输、储存过程中,存在一定的风险,为确保公共卫生安全,需进行检疫。
四、申请检疫的具体要求1. 对【动物/产品】进行全面的健康检查,确保其无疫病。
2. 对【动物/产品】进行必要的疫苗接种,预防疫病传播。
3. 对【动物/产品】进行必要的消毒处理,消除病原体。
4. 提供完整的检疫证明文件,包括检疫报告、疫苗接种证明、消毒证明等。
五、申请检疫的承诺1. 我单位(或个人)保证所提供的申请材料真实、准确、完整。
2. 我单位(或个人)将严格按照我国相关法律法规,执行检疫措施,确保【动物/产品】健康、安全。
3. 我单位(或个人)将积极配合贵局的工作,接受检疫监督。
敬请贵局对本次检疫申请予以审批,并尽快安排检疫工作。
如有需要,我单位(或个人)将全力配合,确保检疫工作的顺利进行。
特此申请!申请单位(或个人)签名:申请日期:【申请日期】附件:1. 动物/产品生产/养殖单位资质证明2. 动物/产品健康检查报告3. 动物/产品疫苗接种证明4. 动物/产品消毒证明5. 其他相关证明材料敬请查收!。
草坪检疫申请书范文

尊敬的草坪检疫部门:我单位/个人(单位名称/姓名)因近期计划在(具体地点)种植草坪,为确保草坪的健康生长,预防植物病虫害的传播,特向贵部门申请进行草坪检疫。
现将有关情况说明如下:一、申请单位/个人基本信息单位名称:________________单位地址:________________联系人:________________联系电话:________________邮箱:________________二、草坪来源及用途1. 草坪来源:本次种植的草坪来自(草坪供应商名称),草坪品种为(草坪品种名称)。
供应商承诺草坪符合国家相关规定,未携带病虫害。
2. 草坪用途:本次种植的草坪主要用于(草坪用途,如:公园绿化、小区景观、运动场等)。
三、草坪种植地点及面积种植地点:________________种植面积:________________平方米四、草坪检疫需求1. 检疫项目:本次申请检疫的项目包括:病虫害检测、土壤检测、草坪品种鉴定等。
2. 检疫时间:希望贵部门在收到申请后(具体时间,如:5个工作日内)安排检疫人员到现场进行检疫。
五、检疫费用及支付方式1. 检疫费用:根据贵部门相关规定,本次草坪检疫费用为人民币(具体金额)。
2. 支付方式:我单位/个人同意按照贵部门规定的支付方式进行支付,具体支付方式为(如:银行转账、现金支付等)。
六、承诺事项1. 我单位/个人承诺,提供的草坪来源信息真实可靠,草坪符合国家相关规定。
2. 我单位/个人将积极配合贵部门开展草坪检疫工作,确保检疫工作的顺利进行。
3. 如在检疫过程中发现病虫害等问题,我单位/个人将按照贵部门要求进行处理,确保草坪健康生长。
请贵部门予以审批,并尽快安排检疫工作。
如有需要,我单位/个人将提供相关证明材料。
特此申请!申请人:(单位名称/姓名)申请日期:____年__月__日。
梅毒抗体酶联免疫吸附法检测试剂盒性能验证及评价

梅毒抗体酶联免疫吸附法检测试剂盒性能验证及评价宗春辉;赵辉;马千真;孟伟;辛国辉【摘要】目的探讨酶联免疫吸附试验(ELISA)检测中试剂盒的性能验证评价方法,并对该实验室梅毒抗体(anti-TP)检测中所使用的英科新创生产的ELISA试剂盒进行性能验证评价,以判断所用试剂盒是否能满足实验室检测工作的基本要求.方法利用全自动酶标仪进行ELISA检测,从试剂盒最低检出限、重复性、精密度、正确度四个方面,评价该试剂盒的性能指标,并对试剂盒的CUTOFF值进行验证,判断其是否适合本实验室常规检测人群.结果梅毒抗体(anti-TP)ELISA检测中,该实验室所用英科新创试剂盒最低检出限为0.25 NCU/mL,低于厂家声称的0.3 NCU/ml,适合大批量样本筛检,避免了漏检;批内精密度试验中,弱阳性浓度水平(0.5 NCU/mL)和临界值浓度水平的变异系数(CV)分别为4.0%和3.2%;批间精密度实验中,在弱阳性浓度水平(0.5 NCU/mL)和临界值浓度水平的CV为8.5%和7.6%,均低于厂家声明的标准;正确度验证方面,阴阳性符合率达到100%;CUTOFF值验证实验中,检测的样本OD值的x+3SD=0.027,小于试剂盒提供的CUTOFF值0.105.结论该梅毒抗体检测试剂盒的各项性能指标符合本实验室的要求,CUTOFF值适合本实验室日常检测工作和受检人群.【期刊名称】《口岸卫生控制》【年(卷),期】2017(022)003【总页数】4页(P23-26)【关键词】酶联免疫吸附法;性能验证;全自动酶标仪;梅毒抗体【作者】宗春辉;赵辉;马千真;孟伟;辛国辉【作者单位】泰安出入境检验检疫局山东,泰安,271000;泰安出入境检验检疫局山东,泰安,271000;泰安出入境检验检疫局山东,泰安,271000;泰安出入境检验检疫局山东,泰安,271000;泰安出入境检验检疫局山东,泰安,271000【正文语种】中文【中图分类】R514梅毒是由梅毒螺旋体(TP)引起的一种慢性传染病,主要通过性接触和血液传播,本病危害性极大,是《中华人民共和国传染病防治法》中,列为乙类防治管理的病种。
检测处理程序申请材料及格式

附件1:检测处理程序申请材料及格式一、正式申请书1.申请人及生产厂名称及地址、申请人及生产厂有关介绍、说明;(申请人如为个人需提供身份证件号码)2.申请产品的特点;3.未取得认证的原因、理由并提供证明这种原因、理由的证据(如海关手册等);4.说明申请产品的名称、商标、数量、规格/型号,如果产品有序列号需提供产品序列号(如数量较多,请附细表。
);机动车产品须提供车辆VIN号和发动机号(如数量较多,请附细表。
);5.对该产品的安全性能作出保证,自我声明对该产品在生产或使用中的安全负责,自我对维修及召回相关事宜负责;6.对所提供资料的真实性、合法性负责,并承诺协助国家认监委或直属出入境检验检疫局对资料真实性、合法性的调查。
7. 汽车产品须提供技术信息(见附表)。
二、申请人工商营业执照的复印件三、产品符合性声明(中文),声明该产品符合中国的哪些安全标准要求四、进口许可证(如该产品需进口许可证,复印件即可)五、配额证明(如该产品需配额证明,复印件即可)六、商业合同(复印件即可),海运提单、装箱单、发票及其他官方证明等说明性文件。
七、其他所需的材料车型结构及主要技术参数免于强制性产品认证进口产品检测处理程序批准书编号:申请人:(如为个人需提供身份证件号码)收货人:申请原因:(可另加附页)合同号:海运提单号:产品名称:产品型号:产品商标:产品数量:产品序列号(如整车VIN编码,发动机号):(可另加附页)产品最终用户或特定销售使用区域:生产厂名:直属局审核意见:(加盖公章)检测处理程序检测机构:此批产品检测结论:□合格□不合格(加盖公章)(检测报告附后)根据国家认监委的有关规定,上述产品符合检测处理程序要求,批准免于强制性产品认证。
本证明有效期:直属出入境检验检疫局批准日期:(加盖公章)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
条 款
核 查 内 容
对应的质量管理体系文件名称、编号及章节/条款号
自查结果说明
备注
4.3 文件控制
4.3.3.4
实验室是否制定程序文件对用于采集、处理、记录、报告、贮存或恢复检测数据和信息的信息系统进行维护?以保证正常运作并提供必要的环境和操作条件保持数据和信息的完整性,并记录。
5.3设施和环境条件
5.3.1
实验室是否实施安全风险评估?对有不同卫生要求的设施、区域是否合理设置?予以明确的标识,并能有效的控制,防止病原体的扩散或媒介生物的逃逸,避免潜在的对样品污染和对人员的危害。
分子生物学实验室是否:
a)应有分区设置;
b)各区的设备和物品不可混用;
c)应实施单一流向。
5.3.2
b) 实验室人员是否熟悉生物安全操作知识和消毒知识?每年是否定期对技术人员和辅助人员进行生物安全培训?
c)基于生物安全考虑,实验室工作人员是否定期进行健康状况监测?并建立相关记录,包括岗位风险说明及员工的知情同意书、职业暴露记录、免疫接种情况等。
d)对从事有特殊检测要求的检测人员(如HIV检测、分子生物学检测),是否经被行业所承认的相关技术培训?能证明其技术能力和资格,并持证上岗。
b) 室间质评或能力验证计划是否由从事常规检验工作的人员使用相同的检测系统检测质控样品与客户样品?是否有禁止与其他实验室核对上报结果的规定?对“不满意”的结果进行分析并采取纠正措施,并记录。
对没有室间质评的检验项目,是否制定计划定期与其他实验室比对?
当实验室间比对不可行或不适用时,实验室是否制定评价检验结果与临床诊断一致性的方法?判断检验结果的可接受性。每年至少评价1次,并记录。
定量方法的验证是否包括正确度、精密度和检测结果可报告范围、生物参考区间?
定性方法的确认是否包括阳性、阴性符合率?
5.5 设备
5.5.2
计算机程序是否:
a) 支持计算机信息系统管理员作相关故障排除、系统或程序修改;
b) 对计算机信息系统进行授权使用。计算机信息系统的授权应详细;
c) 维护所有计算机和信息系统中客户信息的保密性;
5.7 抽样
5.7.1
实验室是否对采样前客户准备、采样和样品处理的过程文件化?并充分考虑客户隐私、样品的有效性和生物安全。是否对样品送检过程实施监控?生物样品送检的容器或包装材料是否满足生物安全防护要求?
5.8检测和校准物品的处置
5.8.1
实验室制定的样品控制程序是否包括对检测样品和验余样品的弃置规定?确保样品中的病原体不传播扩散以及防止媒介生物样品的逃逸。如可行,是否对不同检测样品的运输条件和接收条件提出要求?
5.5.7
设备故障修复后,是否对故障情况进行分析评估?如果设备故障影响了分析性能,是否选择以下合适的方式进行相关的检测、验证:
a) 可校准的项目实施校准或校准验证;
b) 质控品检测结果在允许范围内;
c) 与其他仪器的检测结果比较,偏倚﹤1/2允许总误差( TEa);
d) 使用留样再测结果进行判断,(批间)偏倚﹤1/2允许总误差( TEa)。
附表6(CNAS-CL21:2015)
《检测和校准实验室能力认可准则在卫生检疫实验室的应用说明》核查表
4管理要求
条 款
核 查 内 容
对应的质量管理体系文件名称、编号及章节/条款号
自查结果说明
备注
4.1组织
4.1.3
在固定设施以外的场所,进行检测和抽取样品时,是否在技术控制和有效监督下进行并保留所有活动的记录?
5.8.4
实验室是否根据卫生检疫要求规定检测样品的保留期?并合理处置留存的样品。
5.9 检测和校准结果的质量保证
5.9.1
a) 实验室是否制定室内质量控制程序?并有效实施, 内容包括:
—— 使用恰当的质控规则,包含随机误差和系统误差;
—— 质控品的类型、浓度和检测频度;
—— 应通过实际检测,确定质控品的均值和标准差;
d) 设有计算机安全措施,防止通过其他计算机系统非授权获得任何客户实验室 信息及非授权进行更改;
e) 实验室应对计算机软件,包括建立仪器或系统所用的通用软件(例如文字处 理或数据表应用程序),进行验证。
5.5.5
实验室是否对接触病原体的设备、器具进行有效的卫生控制?除二、三级生物安全实验室外,对污染的和非污染的设备、器具是否有明确的标识加以区别?实验室是否有措施保证设备在维修或报废前消除其污染?
5.10.7
是否定期核查计算机内的最终检验报告结果与原始输入数据是否一致?是否定期核查数据在处理及存储过程中是否出现错误?
5.6测量溯源性
5.6.3.2
实验室是否使用符合实验要求的标准品?
这些标准品是否来自权威或被行业内所认可的部门?
如实验室自配标准液时,实验室是否有相应的程序保证其质量可靠,并保留相关记录?
如实验室无法溯源到SI单位,是否采用有证参考物质、正确度控制品等进行正确度验证或与经确认的参考方法(参考实验室)进行结果比对以证明实验室检验结果的正确度?
相同检验项目在不同仪器或系统上进行检测时,是否对检验结果的可比性进行比对?每年至少1次。
注: 使用不同生物参考区间的检测系统间不宜进行比对。
5.10结果报告
5.10.1
实验室是否有措施对检测结果和检测中获得的信息或个人隐私保密?实验室是否确保检测报告单达到无害性?
5.10.2
f) 如果收到不符合检测要求的样品,是否通知重新采集?否则报告中应注明实际情况。
e)实验室技术负责人至少应具有相关专业技术职称,应有本专业的教育经历。
注1:实验室在程序中应对负责检测报告中评价和说明的人员的专业背景、培训经历或资格做出详细规定。对结果报告所含意见和解释负责的人员,在进行结果解释时应充分考虑人的精神、个人隐私和医学伦理等问题。
注2:对于疾病相关检测项目,其结果应由临床医师结控品时, 应进行平行测定,获得满足要求的数据后,重新确定新批号质控品的均值和标准差。
绘制室内质控图,可使用Levey-Jennings质控图和(或) Z分数图。质控图是否包括质控结果等有关信息?
是否制定程序对失控进行分析并采取相应的措施?
如ELISA免疫是否选择人血清基质质控物?用弱阳性质控物(浓度宜在2倍临界值左右)和阴性质控物?
4.13 记录的控制
4.13.1.2
规定记录的保存期是否充分考虑检测的性质或记录的特殊性?尤其是国家、地区或地方对特殊检测记录保存期限的规定。
5技术要求
条 款
核 查 内 容
对应的质量管理体系文件名称、编号及章节/条款号
自查结果说明
备注
5.2 人员
5.2.1
a) 有颜色视觉障碍的人员不应从事涉及辨色的检测工作。
实验室检测区域是否按照相关规范或要求?配置生物安全设施。
5.3.3
实验室是否建立生物安全管理制度和应急预案?是否有妥善处理废弃样品和有害废弃物的制度?
5.3.4
实验室是否对高压灭菌器的消毒效果进行有效的监控和评价?
5.4 检测和校准方法及方法的确认
5.4.5.3
实验室是否有程序确认或验证检测方法?
定量方法的确认是否包括正确度、精密度、分析灵敏度、分析特异性、检测结果的可报告范围、生物参考区间等分析性能?
4.1.5
实验室是否:
c)有保护客户信息和所有权的规定,且充分体现医学伦理。如不收集与检测工作无关的个人信息,采样时对客户任何操作均应告知并得到同意、充分保护隐私,对检验结果保密,未经授权不公开等。
注: 客户携带申请单自行到实验室并愿意接受普通的采集程序如静脉穿刺,即视为客户已同意采样操作。
填表说明:1.“自查结果说明”栏应逐个条款进行描述。
