2019版一轮优化探究化学(苏教版)练习:章末排查练8 Word版含解析
教育最新K122019版一轮优化探究化学(人教版)练习:章末排查练(四) Word版含解析-

章末排查练(四)授课提示:对应学生用书第104页一、排查易错易混点正误判断,正确的打“√”,错误的打“×”。
(1)稀盐酸可除去烧瓶内残留的MnO 2。
( )(2)富集溴一般先用热空气和水蒸气吹出单质溴,再用SO 2将其还原吸收。
( )(3)燃料的脱硫脱氮、SO 2的回收利用和NO x 的催化转化都是减少酸雨产生的措施。
( )(4)利用NaOH 溶液和浓H 2SO 4通过洗气的方法可以除去CO 中的CO 2。
( )(5)实验室里用锌粒与稀HNO 3反应制取H 2。
( )(6)Cu 溶于稀HNO 3反应的离子方程式:Cu +2H ++NO -3===Cu 2++NO 2↑+H 2O 。
( ) (7)将可调高度的铜丝伸入稀HNO 3中,溶液变蓝,说明铜与稀HNO 3发生置换反应。
( )(8)液氨用做制冷剂不涉及化学变化。
( )(9)除去Cl 2中少量HCl 气体的方法是将混合气体依次通入盛有饱和食盐水和浓H 2SO 4的洗气瓶。
( )(10)MnO 2与浓盐酸反应制Cl 2的离子方程式:MnO 2+4HCl(浓)=====△Mn 2++2Cl -+Cl 2↑+2H 2O 。
( )(11)制取二氧化氮时,用水或NaOH 溶液吸收尾气。
( )(12)标准状况下,6.72 L NO 2与水充分反应转移的电子数目为0.1N A 。
( )(13)硬度:晶体硅<金刚石。
( )(14)浓氨水可检验氯气管道漏气。
( )(15)P 2O 5可用于干燥Cl 2和NH 3。
( )答案:(1)× (2)√ (3)√ (4)√ (5)× (6)×(7)× (8)√ (9)√ (10)× (11)× (12)×(13)√ (14)√ (15)×二、排查41个主要化学方程式1.碳、硅及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。
2019版一轮优化探究化学(人教版)练习:章末排查练(六) Word版含解析

章末排查练(六)一、原电池电极反应式或总反应式的书写1.铁镍电池(负极-Fe ,正极-NiO 2,电解液-KOH 溶液) 已知:Fe +NiO 2+2H 2O 放电充电Fe(OH)2+Ni(OH)2,则:负极:________________________________________________________________________; 正极:________________________________________________________________________; 阴极:________________________________________________________________________; 阳极:________________________________________________________________________。
答案:Fe -2e -+2OH -===Fe(OH)2 NiO 2+2H 2O +2e -===Ni(OH)2+2OH -Fe(OH)2+2e -===Fe +2OH -Ni(OH)2-2e -+2OH -===NiO 2+2H 2O2.LiFePO 4电池(正极-LiFePO 4,负极-Li ,含Li +导电固体为电解质) 已知:FePO 4+Li 放电充电LiFePO 4,则负极:________________________________________________________________________; 正极:________________________________________________________________________; 阴极:________________________________________________________________________; 阳极:________________________________________________________________________。
【高考汇编】2019版高考一轮优化探究化学练习汇编 265页(58份,含解析))

2019版高考一轮优化探究化学练习汇编目录2019版一轮优化探究化学(人教版)练习:大题规范练(01) Word版含解析2019版一轮优化探究化学(人教版)练习:大题规范练(02) Word版含解析2019版一轮优化探究化学(人教版)练习:大题规范练(03) Word版含解析2019版一轮优化探究化学(人教版)练习:大题规范练(04) Word版含解析课时作业1.(RJ必修1·P202题改编)安全是顺利进行实验的保障,下列实验处理或方法符合实验安全要求的是()A.尾气(主要含氯气)用澄清石灰水吸收B.氢气和氯气混合光照制氯化氢C.导管口点燃一氧化碳时要先验纯D.将鼻子贴近集气瓶口直接闻气体气味答案:C2.(2017·甘肃河西联考)下列有关试剂的保存方法正确的是()①NaOH固体保存在配有橡胶塞的细口瓶中②Na2CO3溶液通常保存在配有橡胶塞的细口瓶中③液溴通常用水封保存④锂保存在煤油中⑤浓硝酸通常保存在棕色细口瓶中A.①③⑤B.②③⑤C.②④⑤D.①③④答案:B3.下列说法或做法正确的是()A.试管可以做液体或溶液反应的实验,不能做固体反应的实验B.用蒸发皿小心蒸发碳酸氢钙溶液,最终得到碳酸氢钙晶体C.做氯气与钠反应的实验时,可用玻璃燃烧匙或在普通燃烧匙中铺一层细沙D.熔融氢氧化钠固体,可用陶瓷坩埚解析:试管可以做固体反应的实验,如加热KClO3和MnO2的混合物制取O2;Ca(HCO3)2在溶液中受热会分解生成CaCO3;熔融的NaOH与陶瓷中的SiO2发生反应,所以不可用陶瓷坩埚熔融NaOH 固体。
答案:C4.在做化学实验时必须注意安全操作,下列实验操作或事故处理正确的是()①在点燃易燃气体前,必须检验气体的纯度②浓硫酸对皮肤有腐蚀性,如不慎溅到皮肤上,用较多的水冲洗,再涂上稀硼酸溶液③给试管中的液体加热时,液体体积不超过试管容积的1/3④点燃添满酒精的酒精灯⑤用10 mL量筒量取8.55 mL蒸馏水A.仅①B.仅①②C.仅①③D.全部答案:C5.下列操作中错误之处最多的是()解析:A 项有一处错误,读数时应平视而不应仰视;B 项存在两处错误,一是不能将水加入浓硫酸中,二是不能在量筒中稀释浓硫酸;C 项有一处错误,不能把NaOH 直接放在纸上称量;D 项有一处错误,溶解固体时应用玻璃棒搅拌而不是摇动。
高考化学新探究大一轮复习专题综合检测八含2019届新题含解析苏教版20190417270

专题综合检测(八)(时间:45分钟;满分:100分)一、选择题(本题包括9小题,每小题5分,共45分)1.正常人胃液的pH 在0.3~1.2之间,胃酸(一般用盐酸表示)多了需要治疗。
某些用以治疗胃酸过多的药物中含MgCO 3、NaHCO 3,也可用酒石酸钠来治疗。
下列说法正确的是( )A .碳酸、酒石酸都不是强酸B .对人而言,酒石酸是必需的营养品C .MgCO 3、NaHCO 3与胃酸作用产生CO 2,在服药后有喝汽水的舒服感D .酒石酸钠水解显酸性解析:选A 。
用NaHCO 3、 酒石酸钠治疗胃酸过多,说明NaHCO 3、酒石酸钠能与H +反应生成弱电解质,碳酸、酒石酸都不是强酸。
C 选项由于生成大量CO 2,胃有膨胀的感觉,会不舒服。
2.某合作学习小组的同学对冰醋酸在25 ℃下的稀释过程,有如下思辨,你认为不正确的是( )A .醋酸的电离常数不变B .溶液中c (H +)持续增大C .pH 先减小后增大D .醋酸的分子数不断减少解析:选B 。
电离常数只与温度有关,A 正确;c (H +)先增大后减小,B 不正确,C 正确;稀释过程中,电离平衡右移,CH 3COOH 分子数不断减少,D 正确。
3.下列实验操作正确的是( )A .用100 mL 容量瓶配制50 mL 一定浓度的HCl 溶液B .中和滴定前,锥形瓶用蒸馏水洗净后直接装入待测液C .用稀硫酸洗涤久置石灰水的试剂瓶D .测pH 时用pH 试纸蘸取稀盐酸,取出与标准比色卡对比解析:选B 。
A 项中100 mL 容量瓶只能配制100 mL 的溶液。
C 项中硫酸钙是微溶物,应用稀盐酸或稀硝酸洗涤。
D 项中会污染盐酸且所测pH 不准确,应用玻璃棒蘸取溶液点在pH 试纸中部,再与标准比色卡对比。
4.(2019·石家庄高三模拟)25 ℃时,关于①0.1 mol·L -1的NH 4Cl 溶液 ②0.1 mol·L -1的NaOH 溶液,下列叙述正确的是( )A .若向①中加适量水,溶液中c (Cl -)/c (NH +4 )的值减小B .若向②中加适量水,水的电离平衡正向移动C .若将①和②均稀释100倍,①的pH 变化更大D .若将①和②混合,所得溶液的pH =7,则溶液中的c (NH 3·H 2O)>c (Na +)解析:选B 。
2024版一轮优化探究化学(人教版)练习:章末排查练(一) Word版含解析

章末排查练(一)一、常考易错选择题选项再排查1.15个基本操作正误推断。
(1)灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+。
()(2)滴定管用蒸馏水洗涤后,装入标准液进行滴定。
()(3)假如不慎将酸粘到皮肤或衣物上,马上用较多的水冲洗(假如是浓硫酸,必需快速用抹布擦拭,然后用水冲洗),再用3%~5%的NaHCO3溶液来冲洗。
()(4)假如将碱溶液粘到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
()(5)可干脆加热的常见仪器有试管、蒸发皿、坩埚。
其中蒸发皿用于溶液浓缩或蒸发,坩埚用于固体物质的高温灼烧,且二者都须要用坩埚钳夹取。
()(6)三种计量仪器的精确度:①托盘天平:0.1 g;②量筒:0.1 mL;③滴定管:0.01 mL。
其中量筒无“0”刻度,滴定管的“0”刻度在上方。
()(7)pH试纸可定量(粗略)测定溶液的酸碱性强弱;淀粉-KI试纸可检验Cl2等氧化性物质;品红试纸可检验SO2等漂白性物质。
()(8)过滤所需的主要仪器有铁架台(附铁圈)、烧杯、漏斗、玻璃棒;蒸发所需的主要仪器有铁架台(附铁圈)、酒精灯、蒸发皿、玻璃棒。
()(9)蒸馏是利用液态混合物中各组分的沸点不同,除去易挥发、难挥发或不挥发的杂质的方法。
所需主要玻璃仪器有酒精灯、蒸馏烧瓶、温度计、冷凝管等。
()(10)萃取时,分液漏斗倒转振荡要适时旋开活塞放气,因为萃取剂多为易挥发的有机溶剂,蒸气压较大,若不放气,使内外气压不平衡,有时会冲出塞子。
()(11)分液时,要把分液漏斗上端的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔,其目的是使漏斗内外空气相通,压强相等,保证漏斗里的液体能顺当流出。
()答案:(1)×(2)×(3)√(4)√(5)√(6)√(7)√(8)√(9)√(10)√(11)√2.“N A”关联类排查(推断正误)(1)含N A个阴离子的Na2O2溶于水形成1 L溶液,所得溶液的浓度为1 mol/L。
2019版高考化学(苏教版)一轮精选习题选修物质结构与性质4模块综合检测Word版含解析
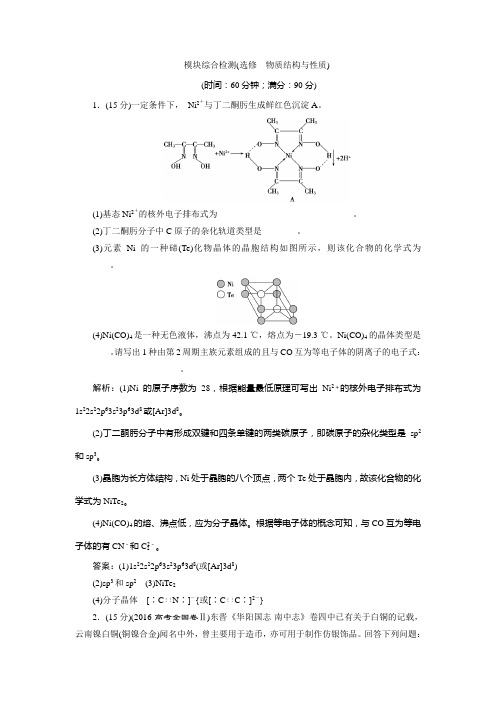
模块综合检测(选修物质结构与性质)(时间:60分钟;满分:90分)1.(15分)一定条件下,Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni2+的核外电子排布式为_______________________________。
(2)丁二酮肟分子中C原子的杂化轨道类型是________。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为________。
(4)Ni(CO)4是一种无色液体,沸点为42.1 ℃,熔点为-19.3 ℃。
Ni(CO)4的晶体类型是________。
请写出1种由第2周期主族元素组成的且与CO互为等电子体的阴离子的电子式:________________________。
解析:(1)Ni的原子序数为28,根据能量最低原理可写出Ni2+的核外电子排布式为1s22s22p63s23p63d8或[Ar]3d8。
(2)丁二酮肟分子中有形成双键和四条单键的两类碳原子,即碳原子的杂化类型是sp2和sp3。
(3)晶胞为长方体结构,Ni处于晶胞的八个顶点,两个Te处于晶胞内,故该化合物的化学式为NiTe2。
(4)Ni(CO)4的熔、沸点低,应为分子晶体。
根据等电子体的概念可知,与CO互为等电子体的有CN-和C2-2。
答案:(1)1s22s22p63s23p63d8(或[Ar]3d8)(2)sp3和sp2(3)NiTe2(4)分子晶体[∶C⋮⋮N∶]-{或[∶C⋮⋮C∶]2-}2.(15分)(2016·高考全国卷Ⅱ)东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。
回答下列问题:(1)镍元素基态原子的电子排布式为_________________________________,3d 能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成[Ni(NH 3)6]SO 4蓝色溶液。
2019版一轮优化探究化学(苏教版)练习:专题8 第25讲 盐类水解 Word版含解析

课时作业1、下列过程或现象与盐类水解无关的是()A、纯碱溶液去油污B、铁在潮湿的环境下生锈C、加热氯化铁溶液颜色变深D、浓硫化钠溶液有臭味答案:B2.为了配制NH+4的浓度与Cl-的浓度之比为1∶1的溶液,可在NH4Cl溶液中加入()A、适量的HClB、适量的NaClC、适量的氨水D、适量的NaOH答案:C3、在25 ℃时,在浓度为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH+4)分别为a、b、c(单位:mol·L-1)。
下列判断正确的是()A、a=b=cB、a>b>cC、a>c>bD、c>a>b答案:D4、用一价离子组成的四种盐溶液:AC、BD、AD、BC,其物质的量浓度均为1 mol·L-1。
在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液pH<7,则正确的是()5、0.1 mol·L -1Na 2CO 3水溶液中存在平衡CO 2-3+H 2OHCO -3+OH -。
下列说法不正确的是( ) A 、稀释溶液,c (HCO -3)·c (OH -)c (CO 2-3)增大 B 、通入CO 2,溶液pH 减小 C 、升高温度,平衡常数增大 D 、加入NaOH 固体,c (HCO -3)c (CO 2-3)减小 答案:A6、为除去MgCl 2酸性溶液中的Fe 3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸,这种试剂是( )A 、NH 3·H 2OB 、NaOHC 、Na 2CO 3D 、MgCO 3答案:D7、用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )A 、20 mL 2 mol·L -1FeCl 3溶液B 、40 mL 1 mol·L -1NaHCO 3溶液C 、20 mL 1 mol·L -1Na 2SO 3溶液D 、40 mL 2 mol·L -1NH 4HCO 3溶液 答案:A8、常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )A 、由水电离产生的c (H +)=10-12 mol·L -1的溶液中:K +、Na +、ClO -、I -B 、c (H +)=K w mol·L -1的溶液中:K +、Fe 3+、Cl -、CO 2-3C、常温下,c(H+)c(OH-)=1×10-12的溶液:K+、AlO-2、CO2-3、Na+D、pH=13的溶液中:AlO-2、Cl-、HCO-3、SO2-4解析:A项,由水电离产生的c(H+)=10-12 mol·L-1的溶液可能呈酸性也可能呈碱性,ClO-在酸性条件下不能大量存在ClO-可以与I-发生氧化还原反应而不能大量共存;B项,c(H+)=K w mol·L-1的溶液呈中性,Fe3+、CO2-3发生相互促进的双水解反应,不能大量共存;D 项pH=13的溶液呈碱性,HCO-3不能大量共存。
2019版一轮优化探究化学练习:章末排查练(三)含解析

章末排查练(三)授课提示:对应学生用书第75页排查50个重要反应的化学、离子方程式1.钠及其重要化合物①Na和H2O的反应________________________________________________________________________ ②Na和CH3COOH的反应________________________________________________________________________ ③Na2O2和H2O的反应________________________________________________________________________ ④NaH和水的反应________________________________________________________________________ ⑤向NaOH溶液中通入过量CO2________________________________________________________________________ ⑥将Na2CO3溶液与石灰乳混合________________________________________________________________________ ⑦向Na2CO3溶液中通入过量CO2________________________________________________________________________ ⑧将Na2CO3和Ca(HCO3)2混合________________________________________________________________________ ⑨将含等物质的量NaHCO3溶液和NaOH溶液混合________________________________________________________________________ ⑩将含等物质的量NaHCO3溶液与澄清石灰水混合________________________________________________________________________ ⑪将NaHCO3溶液与少量澄清石灰水混合________________________________________________________________________ ⑫向饱和Na2CO3溶液中通入过量CO2气体________________________________________________________________________ 答案:①2Na+2H2O===2Na++2OH-+H2↑②2Na+2CH3COOH===2CH3COO-+2Na++H2↑③2Na2O2+2H2O===4Na++4OH-+O2↑④NaH+H2O===Na++OH-+H2↑⑤OH-+CO2===HCO-3⑥CO2-3+Ca(OH)2===CaCO3↓+2OH-⑦CO2-3+CO2+H2O===2HCO-3⑧CO 2-3+Ca 2+===CaCO 3↓ ⑨HCO -3+OH -===CO 2-3+H 2O ⑩HCO -3+Ca 2++OH -===CaCO 3↓+H 2O ⑪2HCO -3+Ca 2++2OH -===CaCO 3↓+CO 2-3+2H 2O ⑫2Na ++CO 2-3+CO 2+H 2O===2NaHCO 3↓ 2.铝及其重要化合物⑬Al 和NaOH 溶液的反应________________________________________________________________________ ⑭Al(OH)3和NaOH 溶液的反应________________________________________________________________________ ⑮Al(OH)3和盐酸的反应________________________________________________________________________ ⑯Al 2O 3和NaOH 的反应________________________________________________________________________ ⑰Al 2O 3和盐酸的反应________________________________________________________________________ ⑱NaAlO 2和过量盐酸的反应________________________________________________________________________ ⑲向NaAlO 2溶液中通入过量CO 2气体________________________________________________________________________ ⑳将NaAlO 2与NaHCO 3混合________________________________________________________________________ ○21将NaAlO 2与AlCl 3溶液混合 ________________________________________________________________________ ○22向AlCl 3溶液中加入过量NaOH 溶液 ________________________________________________________________________ ○23向AlCl 3溶液中加入过量氨水 ________________________________________________________________________ ○24将AlCl 3溶液与NaHCO 3溶液混合 ________________________________________________________________________ 答案:⑬2Al +2OH -+2H 2O===2AlO -2+3H 2↑⑭Al(OH)3+OH -===AlO -2+2H 2O ⑮Al(OH)3+3H +===Al 3++3H 2O ⑯Al 2O 3+2OH -===2AlO -2+H 2O ⑰Al 2O 3+6H +===2Al 3++3H 2O ⑱AlO -2+4H +===Al 3++2H 2O ⑲AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3 ⑳AlO -2+HCO -3+H 2O===Al(OH)3↓+CO 2-3 ○213AlO -2+Al 3++6H 2O===4Al(OH)3↓ ○22Al 3++4OH -===AlO -2+2H 2O ○23Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4 ○24Al 3++3HCO -3===Al(OH)3↓+3CO 2↑3.铁及其重要化合物○25Fe 和过量稀HNO 3的反应 ________________________________________________________________________ ○26Fe 高温下和水蒸气的反应 ________________________________________________________________________ ○27Fe 2O 3和Al 的反应 ________________________________________________________________________ ○28Fe 2O 3高温下和CO 的反应 ________________________________________________________________________ ○29FeCl 3溶液和Cu 的反应 ________________________________________________________________________ ○30FeCl 3与KSCN 的反应 ________________________________________________________________________ ○31向FeCl 2溶液中加入等物质的量的Na 2O 2 ________________________________________________________________________ ○32向FeCl 2溶液中加入NaClO ________________________________________________________________________ ○33Fe(OH)2长时间置于空气中 ________________________________________________________________________ ○34Fe 3O 4和稀盐酸的反应 ________________________________________________________________________ ○35Fe 3O 4和稀HNO 3的反应 ________________________________________________________________________ ○36FeO 和稀盐酸的反应 ________________________________________________________________________ ○37FeO 和稀HNO 3的反应 ________________________________________________________________________ ○38Fe(OH)2和稀盐酸的反应 ________________________________________________________________________ ○39Fe(OH)2和稀HNO 3的反应 ________________________________________________________________________ ○40Fe(OH)3和HI 的反应 ________________________________________________________________________ ○41FeBr 2和少量Cl 2的反应 ________________________________________________________________________○42FeBr 2和Cl 2等物质的量的反应 ________________________________________________________________________ ○43FeBr 2和过量Cl 2的反应 ________________________________________________________________________答案:○25Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O ○263Fe +4H 2O(g)=====高温Fe 3O 4+4H 2 ○27Fe 2O 3+2Al=====高温2Fe +Al 2O 3 ○28Fe 2O 3+3CO=====高温2Fe +3CO 2 ○292Fe 3++Cu===2Fe 2++Cu 2+ ○30Fe 3++3SCN -Fe(SCN)3 ○314Fe 2++4Na 2O 2+6H 2O===4Fe(OH)3↓+8Na ++O 2↑ ○322Fe 2++ClO -+4OH -+H 2O===2Fe(OH)3↓+Cl - ○334Fe(OH)2+O 2+2H 2O===4Fe(OH)3 ○34Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O ○353Fe 3O 4+28H ++NO -3===9Fe3++NO ↑+14H 2O ○36FeO +2H +===Fe 2++H 2O ○373FeO +10H ++NO -3===3Fe 3++NO ↑+5H 2O ○38Fe(OH)2+2H +===Fe 2++2H 2O ○393Fe(OH)2+10H ++NO -3===3Fe3++NO ↑+8H 2O ○402Fe(OH)3+6H ++2I -===2Fe 2++I 2+6H 2O ○412Fe 2++Cl 2===2Fe 3++2Cl - ○422Fe 2++2Br -+2Cl 2===2Fe 3++Br 2+4Cl - ○432Fe 2++4Br -+3Cl 2===2Fe 3++2Br 2+6Cl - 4.铜及其重要化合物○44Cu 在硫蒸气中燃烧 ________________________________________________________________________ ○45铜在空气中生成铜绿 ________________________________________________________________________ ○46用惰性电极电解CuSO 4溶液 ________________________________________________________________________ ○47Cu 和浓HNO 3的反应 ________________________________________________________________________ ○48Cu 和稀HNO 3的反应 ________________________________________________________________________ ○49Cu 和浓H 2SO 4的反应 ________________________________________________________________________ ○50胆矾受热分解 ________________________________________________________________________答案:○442Cu +S =====△Cu 2S ○452Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3 ○462Cu 2++2H 2O=====通电2Cu +4H ++O 2↑ ○47Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ○483Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ○49Cu +2H 2SO 4(浓)=====△Cu 2++SO 2-4+SO 2↑+2H 2O。
2019版一轮优化探究化学(苏教版)练习:章末排查练1 Word版含解析

章末排查练(一)一、常考易错选择题选项再排查1.15个基本操作正误判断。
(1)灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+。
()(2)滴定管用蒸馏水洗涤后,装入标准液进行滴定。
()(3)如果不慎将酸粘到皮肤或衣物上,立即用较多的水冲洗(如果是浓硫酸,必须迅速用抹布擦拭,然后用水冲洗),再用3%~5%的NaHCO3溶液来冲洗。
()(4)如果将碱溶液粘到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
()(5)可直接加热的常见仪器有试管、蒸发皿、坩埚。
其中蒸发皿用于溶液浓缩或蒸发,坩埚用于固体物质的高温灼烧,且二者都需要用坩埚钳夹取。
()(6)三种计量仪器的精确度:①托盘天平:0.1 g;②量筒:0.1 mL;③滴定管:0.01 mL。
其中量筒无“0”刻度,滴定管的“0”刻度在上方。
()(7)pH试纸可定量(粗略)测定溶液的酸碱性强弱;淀粉-KI试纸可检验Cl2等氧化性物质;品红试纸可检验SO2等漂白性物质。
()(8)过滤所需的主要仪器有铁架台(附铁圈)、烧杯、漏斗、玻璃棒;蒸发所需的主要仪器有铁架台(附铁圈)、酒精灯、蒸发皿、玻璃棒。
()(9)蒸馏是利用液态混合物中各组分的沸点不同,除去易挥发、难挥发或不挥发的杂质的方法。
所需主要玻璃仪器有酒精灯、蒸馏烧瓶、温度计、冷凝管等。
()(10)萃取时,分液漏斗倒转振荡要适时旋开活塞放气,因为萃取剂多为易挥发的有机溶剂,蒸气压较大,若不放气,使内外气压不平衡,有时会冲出塞子。
()(11)分液时,要把分液漏斗上端的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔,其目的是使漏斗内外空气相通,压强相等,保证漏斗里的液体能顺利流出。
()答案:(1)×(2)×(3)√(4)√(5)√(6)√(7)√(8)√(9)√(10)√(11)√2.“N A”关联类排查(判断正误)(1)含N A个阴离子的Na2O2溶于水形成1 L溶液,所得溶液的浓度为1 mol/L。
2019版一轮优化探究化学(苏教版)练习:专题1 第2讲 物质的量 物质的聚集状态 Word版含解析

课时作业1.“物质的量”是国际单位制中的一个基本物理量,有关说法正确的是( )A .质量相等的O 2和O 3,物质的量之比为2∶3B .2 mol 氧气的摩尔质量为64 g·mol -1C .1 mol 任何物质都含有6.02×1023个分子D .2 g H 2含有1 mol 氢分子答案:D2.(2017·邢台模拟)下列有关气体体积的叙述正确的是( )A .在一定的温度和压强下,各种气态物质体积的大小由气体分子的大小决定B .在一定的温度和压强下,各种气态物质体积的大小由物质的量的多少决定C .不同的气体,若体积不同,则它们所含的分子数一定不同D .气体摩尔体积是指1 mol 任何气体所占的体积,约为22.4 L 答案:B3.已知a g N 2含有b 个分子,则阿伏加德罗常数的数值为( )A.b 28B.a 28C.28b aD.28a b答案:C4.如图是两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )A .所含原子数相等B .气体密度相等C.气体质量相等D.摩尔质量相等解析:同温同压下,体积相等的两瓶气体,具有相同的分子数,因为都是双原子分子,故所含原子数相等,由于N2和O2的比例不确定,故两瓶气体的质量不一定相等,密度和摩尔质量也不一定相等。
答案:A5.在三个容积相同的密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是()A.p(Ne)>p(H2)>p(O2)B.p(O2)>p(Ne)>p(H2)C.p(H2)>p(O2)>p(Ne)D.p(H2)>p(Ne)>p(O2)答案:D6.下列条件下,两种气体分子数一定不相等的是()A.相同质量、不同密度的N2O和CO2B.相同体积、相同密度的CO和C2H4C.相同温度、相同压强、相同体积的O2和O3D.相同压强、相同质量的NO2和N2O4答案:D7.(2017·济南模拟)同温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同。
2019版一轮优化探究化学(苏、浙专版)练习:章末排查练(二) Word版含解析

章末排查练(二)一、常考易错选择题选项再排查排查 物质的变化、分类及胶体正误判断1.(1)六水氯化钙可用作食品干燥剂。
( )(2)打磨磁石制指南针不涉及化学反应。
( )(3)食醋具有氧化性可以用于除水垢。
( )(4)漂白粉具有氧化性可以用于漂白织物。
( )(5)SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物。
( )(6)金属氧化物均为碱性氧化物。
( )(7)石油是混合物,其分馏产品汽油为纯净物。
( )(8)232Th转化成233U是化学变化。
( )(9)纯碱具有氧化性可以用于去油污。
( )(10)SO2、SiO2、CO均为酸性氧化物。
( )(11)稀豆浆、硅酸、氯化铁溶液均为胶体。
( )(12)福尔马林、水玻璃、氨水均为混合物。
( )(13)化学反应有新物质生成,并遵循质量守恒和能量守恒定律。
( )(14)从海水中提取物质都必须通过化学反应才能实现。
( )(15)用活性炭去除冰箱中的异味,没有发生化学变化。
( )(16)黑火药由硫黄、硝石、木炭三种物质按一定比例混合而成。
( )(17)用浸泡过高锰酸钾溶液的硅藻土保鲜水果,没有发生化学变化。
( )答案:(1)× (2)√ (3)× (4)√ (5)× (6)× (7)× (8)× (9)× (10)× (11)× (12)√ (13)√ (14)× (15)√ (16)√ (17)×排查 氧化还原反应概念正误判断2.(1)置换反应全部属于氧化还原反应,因为有单质参加和生成,化合价发生了变化。
( )(2)复分解反应全部属于非氧化还原反应,因为反应前后元素的化合价没有变化。
( )(3)有单质参加的化合反应属于氧化还原反应,因为单质中元素化合价必然发生变化。
( )(4)有单质生成的分解反应属于氧化还原反应,因为单质中元素化合价必然发生变化。
2019版一轮优化探究化学练习:章末排查练(三)含解析

章末排查练(三)1.钠及其重要化合物①Na和H2O的反应_____________________________________________________________________ ②Na和CH3COOH的反应_____________________________________________________________________ ③Na2O2和H2O的反应_____________________________________________________________________ ④NaH和水的反应_____________________________________________________________________ ⑤向NaOH溶液中通入过量CO2_____________________________________________________________________ ⑥将Na2CO3溶液与石灰乳混合_____________________________________________________________________ ⑦向Na2CO3溶液中通入过量CO2_____________________________________________________________________ ⑧将Na2CO3和Ca(HCO3)2混合_____________________________________________________________________ ⑨将含等物质的量NaHCO3溶液和NaOH溶液混合_____________________________________________________________________ ⑩将含等物质的量NaHCO3溶液与澄清石灰水混合_____________________________________________________________________ ⑪将NaHCO3溶液与少量澄清石灰水混合_____________________________________________________________________ ⑫向饱和Na2CO3溶液中通入过量CO2气体_____________________________________________________________________ 答案:①2Na+2H2O===2Na++2OH-+H2↑②2Na+2CH3COOH===2CH3COO-+2Na++H2↑③2Na2O2+2H2O===4Na++4OH-+O2↑④NaH+H2O===Na++OH-+H2↑⑤OH-+CO2===HCO-3⑥CO2-3+Ca(OH)2===CaCO3↓+2OH-⑦CO2-3+CO2+H2O===2HCO-3⑧CO2-3+Ca2+===CaCO3↓⑨HCO-3+OH-===CO2-3+H2O⑩HCO-3+Ca2++OH-===CaCO3↓+H2O⑪2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O⑫2Na++CO2-3+CO2+H2O===2NaHCO3↓2.铝及其重要化合物⑬Al和NaOH溶液的反应_____________________________________________________________________ ⑭Al(OH)3和NaOH溶液的反应_____________________________________________________________________ ⑮Al(OH)3和盐酸的反应_____________________________________________________________________ ⑯Al2O3和NaOH的反应_____________________________________________________________________ ⑰Al2O3和盐酸的反应_____________________________________________________________________ ⑱Na[Al(OH)4]和过量盐酸的反应_____________________________________________________________________ ⑲向Na[Al(OH)4]溶液中通入过量CO2气体_____________________________________________________________________ ⑳将Na[Al(OH)4]与NaHCO3混合_____________________________________________________________________ ○21将Na[Al(OH)]与AlCl3溶液混合4_____________________________________________________________________○22向AlCl溶液中加入过量NaOH溶液3_____________________________________________________________________○23向AlCl溶液中加入过量氨水3_____________________________________________________________________○24将AlCl溶液与NaHCO3溶液混合3答案:⑬2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑⑭Al(OH)3+OH-===[Al(OH)4]-⑮Al(OH)3+3H+===Al3++3H2O⑯Al2O3+2OH-+3H2O===2[Al(OH)4]-⑰Al2O3+6H+===2Al3++3H2O⑱[Al(OH)4]-+4H+===Al3++4H2O⑲[Al(OH)4]-+CO2===Al(OH)3↓+HCO-3⑳[Al(OH)4]-+HCO-3===Al(OH)3↓+CO2-3+H2O○213[Al(OH)]-+Al3+===4Al(OH)3↓○22Al3++4OH-===[Al(OH)4]-4○23Al3++3NH·H2O===Al(OH)3↓+3NH+43○24Al3++3HCO-===Al(OH)3↓+3CO2↑33.铁及其重要化合物○25Fe和过量稀HNO的反应3_____________________________________________________________________ ○26Fe高温下和水蒸气的反应_____________________________________________________________________○27FeO3和Al的反应2_____________________________________________________________________○28FeO3高温下和CO的反应2_____________________________________________________________________○29FeCl溶液和Cu的反应3_____________________________________________________________________○30FeCl与KSCN的反应3_____________________________________________________________________○31向FeCl溶液中加入等物质的量的Na2O22○32向FeCl溶液中加入NaClO2_____________________________________________________________________○33Fe(OH)长时间置于空气中2_____________________________________________________________________○34FeO4和稀盐酸的反应3_____________________________________________________________________○35FeO4和稀HNO3的反应3_____________________________________________________________________ ○36FeO和稀盐酸的反应_____________________________________________________________________○37FeO和稀HNO的反应3_____________________________________________________________________○38Fe(OH)和稀盐酸的反应2_____________________________________________________________________○39Fe(OH)和稀HNO3的反应2_____________________________________________________________________○40Fe(OH)和HI的反应3_____________________________________________________________________○41FeBr和少量Cl2的反应2_____________________________________________________________________○42FeBr和Cl2等物质的量的反应2_____________________________________________________________________○43FeBr 2和过量Cl 2的反应 _____________________________________________________________________答案:○25Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O ○263Fe +4H 2O(g)=====高温Fe 3O 4+4H 2 ○27Fe 2O 3+2Al=====高温2Fe +Al 2O 3 ○28Fe 2O 3+3CO=====高温2Fe +3CO 2 ○292Fe 3++Cu===2Fe 2++Cu 2+ ○30Fe 3++3SCN -Fe(SCN)3 ○314Fe 2++4Na 2O 2+6H 2O===4Fe(OH)3↓+8Na ++O 2↑ ○322Fe 2++ClO -+4OH -+H 2O===2Fe(OH)3↓+Cl - ○334Fe(OH)2+O 2+2H 2O===4Fe(OH)3 ○34Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O ○353Fe 3O 4+28H ++NO -3===9Fe 3++NO ↑+14H 2O ○36FeO +2H +===Fe 2++H 2O○373FeO +10H ++NO -3===3Fe 3++NO ↑+5H 2O ○38Fe(OH)2+2H +===Fe 2++2H 2O ○393Fe(OH)2+10H ++NO -3===3Fe 3++NO ↑+8H 2O ○402Fe(OH)3+6H ++2I -===2Fe 2++I 2+6H 2O ○412Fe 2++Cl 2===2Fe 3++2Cl - ○422Fe 2++2Br -+2Cl 2===2Fe 3++Br 2+4Cl - ○432Fe 2++4Br -+3Cl 2===2Fe 3++2Br 2+6Cl -4.铜及其重要化合物○44Cu 在硫蒸气中燃烧 _____________________________________________________________________ ○45铜在空气中生成铜绿 _____________________________________________________________________○46用惰性电极电解CuSO 4溶液 _____________________________________________________________________ ○47Cu 和浓HNO 3的反应 _____________________________________________________________________ ○48Cu 和稀HNO 3的反应 _____________________________________________________________________ ○49Cu 和浓H 2SO 4的反应 _____________________________________________________________________ ○50胆矾受热分解 ________________________________________________________________________答案:○442Cu +S=====△Cu 2S ○452Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3 ○462Cu 2++2H 2O=====通电2Cu +4H ++O 2↑ ○47Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ○483Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ○49Cu +2H 2SO 4(浓) =====△Cu 2++SO 2-4+SO 2↑+2H 2O ○50CuSO 4·5H 2O=====△CuSO 4+5H 2O。
2019版一轮优化探究化学(苏教版)练习:专题2 第4讲 氧化还原反应的基本概念和规律 Word版含解析

课时作业1、化学与生活密切相关,下列应用中利用了物质的氧化性的是()A、SO2漂白纸浆B、纯碱清洗油污C、Na2S除污水中的Cu2+D、漂白粉漂白织物解析:SO2漂白纸浆利用了二氧化硫的漂白性,A错误;纯碱清洗油污,利用了纯碱溶液显碱性,碱性条件下油脂能水解彻底,B错误;Na2S除污水中的Cu2+发生的是复分解反应,利用的是CuS 的难溶性,C错误;漂白粉漂白织物是利用的漂白粉的氧化性将有色物质氧化褪色,D正确。
答案:D2、(2017·浙江瑞安四校联考)下列变化过程不涉及氧化还原反应的是()A、将一小块钠放在石棉网上加热,生成淡黄色物质B、向新制氯水中加入足量亚硫酸钠溶液,氯水褪色C、向纯碱溶液中滴加酚酞,溶液变红色D、向氢碘酸中滴加FeCl3溶液,产生棕色物质解析:将一小块钠放在石棉网上加热,生成的淡黄色物质为过氧化钠,反应过程中Na、O元素化合价发生变化,属于氧化还原反应,故A 错误;向新制氯水中加入足量亚硫酸钠溶液,氯气将SO2-3氧化成SO2-4,Cl、S元素化合价发生变化,属于氧化还原反应,故B错误;向纯碱溶液中滴加酚酞,溶液变红色,说明CO2-3水解显碱性,没有化合价变化,不属于氧化还原反应,故C 正确;向氢碘酸中滴加FeCl 3溶液,产生棕色物质,说明Fe 3+将I -氧化成碘单质,Fe 和I 元素化合价发生变化,属于氧化还原反应,故D 错误。
答案:C3、氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影3区域的是( )A 、Cl 2+2NaI===2NaCl +I 2B 、CH 4+2O 2=====点燃CO 2+2H 2OC 、4Fe(OH)2+O 2+2H 2O===4Fe(OH)3D 、2H 2O 2=====MnO 22H 2O +O 2↑答案:B4、高铁酸钾(K 2FeO 4)是一种新型的自来水处理剂,它的性质和作用是( )A 、有强氧化性,可消毒杀菌,还原产物能吸附水中杂质B 、有强还原性,可消毒杀菌,氧化产物能吸附水中杂质C 、有强氧化性,能吸附水中杂质,还原产物能消毒杀菌D 、有强还原性,能吸附水中杂质,氧化产物能消毒杀菌答案:A5、在化学反应:8NH 3+3Cl 2===N 2+6NH 4Cl 中,氧化剂与还原剂的物质的量之比为( )A、8∶3B、3∶8C、2∶3D、3∶2答案:D6、氢化钙(CaH2)可作为生氢剂,反应的化学方程式为CaH2+2H2O===Ca(OH)2+2H2↑,下列说法不正确的是()A、CaH2既是还原剂,又是氧化剂B、H2既是氧化产物,又是还原产物C、CaH2是还原剂,H2O是氧化剂D、氧化产物与还原产物的质量比为1∶1答案:A7、化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就不再向环境排放该种有害物质。
版轮优化探究化学(苏教版)练习:章末排查练 Word版含解析 ()

章末排查练(三)排查50个重要反应的化学、离子方程式1.钠及其重要化合物①Na和H2O的反应.②Na和CH3COOH的反应.③Na2O2和H2O的反应.④NaH和水的反应.⑤向NaOH溶液中通入过量CO2.⑥将Na2CO3溶液与石灰乳混合.⑦向Na2CO3溶液中通入过量CO2.⑧将Na2CO3和Ca(HCO3)2混合.⑨将含等物质的量NaHCO3溶液和NaOH溶液混合.⑩将含等物质的量NaHCO3溶液与澄清石灰水混合.⑪将NaHCO3溶液与少量澄清石灰水混合.⑫向饱和Na2CO3溶液中通入过量CO2气体.答案:①2Na+2H2O===2Na++2OH-+H2↑②2Na+2CH3COOH===2CH3COO-+2Na++H2↑③2Na2O2+2H2O===4Na++4OH-+O2↑④NaH+H2O===Na++OH-+H2↑⑤OH-+CO2===HCO-3⑥CO2-3+Ca(OH)2===CaCO3↓+2OH-⑦CO2-3+CO2+H2O===2HCO-3⑧CO2-3+Ca2+===CaCO3↓⑨HCO-3+OH-===CO2-3+H2O⑩HCO-3+Ca2++OH-===CaCO3↓+H2O⑪2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O⑫2Na++CO2-3+CO2+H2O===2NaHCO3↓2.铝及其重要化合物⑬Al和NaOH溶液的反应.⑭Al(OH)3和NaOH溶液的反应.⑮Al(OH)3和盐酸的反应.⑯Al2O3和NaOH的反应.⑰Al2O3和盐酸的反应.⑱NaAlO2和过量盐酸的反应.⑲向NaAlO2溶液中通入过量CO2气体.⑳将NaAlO2与NaHCO3混合.21将NaAlO2与AlCl3溶液混合.○22向AlCl3溶液中加入过量NaOH溶液.○23向AlCl3溶液中加入过量氨水.○24将AlCl3溶液与NaHCO3溶液混合.○答案:⑬2Al+2OH-+2H2O===2AlO-2+3H2↑⑭Al(OH)3+OH-===AlO-2+2H2O⑮Al(OH)3+3H+===Al3++3H2O⑯Al2O3+2OH-===2AlO-2+H2O⑰Al2O3+6H+===2Al3++3H2O⑱AlO-2+4H+===Al3++2H2O⑲AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3⑳AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3213AlO-2+Al3++6H2O===4Al(OH)3↓○22Al3++4OH-===AlO-2+2H2O ○23Al3++3NH3·H2O===Al(OH)3↓+3NH+4○24Al3++3HCO-3===Al(OH)3↓+○3CO2↑3.铁及其重要化合物25Fe和过量稀HNO3的反应.○26Fe高温下和水蒸气的反应.○27Fe2O3和Al的反应.○28Fe2O3高温下和CO的反应.○29FeCl3溶液和Cu的反应.○30FeCl3与KSCN的反应.○31向FeCl2溶液中加入等物质的量的Na2O2.○32向FeCl2溶液中加入NaClO .○33Fe(OH)2长时间置于空气中.○34Fe3O4和稀盐酸的反应.○○35Fe 3O 4和稀HNO 3的反应 . ○36FeO 和稀盐酸的反应 . ○37FeO 和稀HNO 3的反应 . ○38Fe(OH)2和稀盐酸的反应 . ○39Fe(OH)2和稀HNO 3的反应 . ○40Fe(OH)3和HI 的反应 . ○41FeBr 2和少量Cl 2的反应 . ○42FeBr 2和Cl 2等物质的量的反应 . ○43FeBr 2和过量Cl 2的反应 . 答案:○25Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O ○263Fe +4H 2O(g)=====高温Fe 3O 4+4H 2 ○27Fe 2O 3+2Al=====高温2Fe +Al 2O 3 ○28Fe 2O 3+3CO=====高温2Fe +3CO 2 ○292Fe 3++Cu===2Fe 2++Cu 2+ ○30Fe 3++3SCN -Fe(SCN)3 ○314Fe 2++4Na 2O 2+6H 2O===4Fe(OH)3↓+8Na++O 2↑ ○322Fe 2++ClO-+4OH-+H 2O===2Fe(OH)3↓+Cl - ○334Fe(OH)2+O 2+2H 2O===4Fe(OH)3 ○34Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O ○353Fe 3O 4+28H ++NO -3===9Fe3++NO ↑+14H 2O ○36FeO +2H +===Fe 2++H 2O ○373FeO +10H ++NO -3===3Fe 3++NO ↑+5H 2O○38Fe(OH)2+2H +===Fe 2++2H 2O ○393Fe(OH)2+10H ++NO -3===3Fe3++NO ↑+8H 2O ○402Fe(OH)3+6H ++2I -===2Fe 2++I 2+6H 2O ○412Fe 2++Cl 2===2Fe 3++2Cl - ○422Fe 2++2Br -+2Cl 2===2Fe 3++Br 2+4Cl - ○432Fe 2++4Br -+3Cl 2===2Fe 3++2Br 2+6Cl - 4.铜及其重要化合物○44Cu 在硫蒸气中燃烧 . ○45铜在空气中生成铜绿 . ○46用惰性电极电解CuSO 4溶液 . ○47Cu 和浓HNO 3的反应 . ○48Cu 和稀HNO 3的反应 . ○49Cu 和浓H 2SO 4的反应 . ○50胆矾受热分解 .答案:○442Cu +S=====△Cu 2S ○452Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3 ○462Cu 2++2H 2O=====通电2Cu +4H ++O 2↑ ○47Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ○483Cu +8H ++2NO-3===3Cu 2++2NO ↑+4H 2O ○49Cu +2H 2SO 4(浓)=====△Cu 2++SO 2-4+SO 2↑+2H 2O ○50CuSO 4·5H 2O=====△CuSO 4+5H 2O。
2019版高中化学一轮复习练习:章末检测第八章 Word版含解析

章末检测一、选择题(本题包括12个小题,每小题4分,共48分。
)1.合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是()A.金属焊接时可用NH4Cl溶液作除锈剂B.配制FeSO4溶液时,加入一定量Fe粉C.长期施用铵态氮肥会使土壤酸化D.向FeCl3溶液中加入CaCO3粉末后有气泡产生解析:NH4Cl溶液水解显酸性,能和铁锈反应从而除去铁锈,故和盐类水解有关,A错误;亚铁离子易被氧化,配制FeSO4溶液时,加入一定量Fe粉的目的是防止氧化,与盐类的水解无关,B正确;铵根水解显酸性,所以长期施用铵态氮肥会使土壤酸化,与盐类的水解有关,C错误;FeCl3是强酸弱碱盐,水解显酸性,故加入碳酸钙后有气泡产生,和盐类的水解有关,D错误。
答案:B2.下列事实不能证明HNO2是弱电解质的是()①滴入酚酞,NaNO2溶液显红色②用HNO2溶液做导电实验,灯泡很暗③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强④0.1 mol·L-1HNO2溶液的pH=2⑤HNO2与CaCO3反应放出CO2气体⑥c(H+)=0.1 mol·L-1的HNO2溶液稀释至1 000倍,pH<4A.①⑤B.②⑤C.③⑥D.③④解析:NO-2水解,生成弱电解质HNO2和OH-,使酚酞试液显红色,①能证明;HNO2溶液做导电实验,灯泡很暗,只能说明溶液中离子的浓度小,并不能说明HNO2部分电离,②不能证明;等pH、等体积的盐酸和HNO2溶液,HNO2中和碱能力强,0.1 mol〃L-1HNO2溶液的pH=2,都能说明HNO2部分电离,③④能证明;HNO2与CaCO3反应放出CO2气体,说明HNO2的酸性比碳酸强,但并不一定是弱电解质,⑤不能证明;HNO2若是强酸,⑥中pH应等于4,⑥能证明。
答案:B3.醋酸钡[(CH3COO)2Ba·H2O]是一种酶染剂,下列是有关0.1 mol·L-1醋酸钡溶液中粒子浓度的比较,其中不正确的是() A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)C.c(H+)=c(OH-)-c(CH3COOH)D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)解析:CH3COO-离子水解程度较小,水解后溶液呈碱性,由(CH3COO)2Ba可知,则有c(CH3COO-)>c(Ba2+),c(OH-)>c(H+),正确的顺序应为c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+),故A错误;溶液呈电中性,溶液中阳离子所带电荷等于阴离子所带电荷,故c(H +)+2c(Ba2+)=c(CH3COO-)+c(OH-),故B正确;根据溶液电中性可知:c(H+)+2c(Ba2+)=c(OH+)+c(CH3COO-),根据物料守恒可知,c(CH3COOH)+c(CH3COO-)=2c(Ba2+),则有c(H+)+c(CH3COOH)+c(CH3COO-)=c(OH-)+c(CH3COO-),则c(H+)=c(OH-)-c(CH3COOH),故C正确;由(CH3COO)2Ba,根据物料守恒可知,c(CH3COOH)+c(CH3COO-)=2c(Ba2+),故D正确。
(苏教版)2019高考化学一轮复习精选练习:章末排查练9 Word版含解析

(苏教版)2019高考化学一轮复习精选练习章末排查练(九)一、排查36个实验装置·正误判断(1)(2)() ()(3)(4)() ()(5)(6)() ()(7)(8)() ()(9)(10)() () (11)(12)() () (13)(14)() () (15)(16)() () (17)(18)() () (19)(20)() () (21)(22)() () (23)(24)() () (25)(26)() () (27)(28)() () (29)(30)() () (31)()(32)()(33)()(34)()(35)()(36)()答案:(1)×(2)×(3)×(4)√(5)√(6)×(7)×(8)×(9)×(10)×(11)×(12)×(13)×(14)√(15)√(16)√(17)×(18)√(19)×(20)×(21)×(22)×(23)√(24)×(25)√(26)√(27)×(28)×(29)√(30)×(31)×(32)×(33)√(34)×(35)×(36)×二、基本操作·正误判断1.用氨水清洗做过银镜反应的试管()2.用氢氧化钠溶液清洗存放过苯酚的试管()3.将金属钠放在无水酒精中保存()4.用50 mL量筒量取5 mL液体()5.用托盘天平进行称量时,一般可精确到0.01 g()6.用25 mL碱式滴定管量取19.50 mL高锰酸钾溶液()7.容量瓶上标有温度和容量()8.中和滴定时,锥形瓶用蒸馏水洗净后即可盛待测溶液()9.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,再涂上稀硼酸溶液()10.可用分液漏斗分离甘油和水的混合液()11.用pH试纸测定溶液的pH值,可将一小段试纸浸入溶液1~2分钟,取出试纸与标准比色卡比较,确定之()12.盛装溴水、高锰酸钾、汽油的试剂瓶都不宜使用橡胶塞()13.为了安全,实验室里不能把强氧化剂和易燃易爆物混放()14.从试剂瓶中取出的任何药品,若有剩余不能再放回试剂瓶()15.可燃性气体点燃前必须验纯()16.用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中()17.在中和滴定的实验过程中,目光应注视滴定管中的液面()18.蒸馏时,应使用温度计水银球靠近蒸馏烧瓶支管口()19.在某溶液中加入氯化钡溶液和盐酸,产生白色沉淀,说明原溶液中一定含有SO2-4()20.实验室制取氟化氢的装置与制取氯化氢的装置相同()21.稀释浓硫酸时,将浓硫酸沿器壁慢慢加入水中,并不断搅拌()22.蒸发皿加热后要放在石棉网上冷却()23.制取蒸馏水时,为防止蒸馏烧瓶内产生爆沸现象,应先向烧瓶中加入几片碎瓷片()24.用结晶法提纯氯化钠和硝酸钾混合物中的硝酸钾()25.用加热法分离碘和氯化铵的混合物()答案:1.× 2.√ 3.× 4.× 5.× 6.×7.√8.√9.√10.×11.×12.√13.√14.×15.√16.×17.×18.√19.×20.×21.√22.√23.√24.×25.×。
2019版一轮优化探究化学练习:章末排查练(八)含解析

章末排查练(八)一、答题语言再规范1.在80 ℃时,纯水的pH值小于7,为什么?________________________________________________________________________________________________________________________________________________。
答案:已知室温下,纯水中的c(H+)=c(OH-)=10-7 mol·L-1,又因水的电离(H2O H++OH-)是吸热反应,故温度升高到80 ℃,电离程度增大,致使c(H+)=c(OH-)>10-7 mol·L-1,即pH<72.甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比________(填“大于”“等于”或“小于”)10。
请说明理由。
________________________________________________________________________________________________________________________________________________。
答案:小于甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,故甲瓶氨水的电离程度比乙瓶氨水的电离程度小,所以甲、乙两瓶氨水中c(OH-)之比小于103.用电解法制取金属镁时,需要无水氯化镁。
在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是________________________________________________________________________________________________________________________________________________。
江苏省2019版一轮优化探究高一化学练习:章末排查练4 Word版含解析

章末排查练(四)一、排查易错易混点正误判断,正确的打“√”,错误的打“×”。
(1)稀盐酸可除去烧瓶内残留的MnO 2。
( )(2)富集溴一般先用热空气和水蒸气吹出单质溴,再用SO 2将其还原吸收。
( )(3)燃料的脱硫脱氮、SO 2的回收利用和NO x 的催化转化都是减少酸雨产生的措施。
( )(4)利用NaOH 溶液和浓H 2SO 4通过洗气的方法可以除去CO 中的CO 2。
( ) (5)实验室里用锌粒与稀HNO 3反应制取H 2。
( )(6)Cu 溶于稀HNO 3反应的离子方程式:Cu +2H ++NO -3===Cu 2++NO 2↑+H 2O 。
( )(7)将可调高度的铜丝伸入稀HNO 3中,溶液变蓝,说明铜与稀HNO 3发生置换反应。
( )(8)液氨用做制冷剂不涉及化学变化。
( )(9)除去Cl 2中少量HCl 气体的方法是将混合气体依次通入盛有饱和食盐水和浓H 2SO 4的洗气瓶。
( )(10)MnO 2与浓盐酸反应制Cl 2的离子方程式:MnO 2+4HCl(浓)=====△Mn 2++2Cl -+Cl 2↑+2H 2O 。
( )(11)制取二氧化氮时,用水或NaOH 溶液吸收尾气。
( )(12)标准状况下,6.72 L NO 2与水充分反应转移的电子数目为0.1N A 。
( ) (13)硬度:晶体硅<金刚石。
( ) (14)浓氨水可检验氯气管道漏气。
( ) (15)P 2O 5可用于干燥Cl 2和NH 3。
( )答案:(1)× (2)√ (3)√ (4)√ (5)× (6)× (7)× (8)√ (9)√ (10)× (11)× (12)× (13)√ (14)√ (15)×二、排查41个主要化学方程式 1.碳、硅及其化合物 (1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
章末排查练(八)授课提示:对应学生用书第160页一、答题语言再规范1.在80 ℃时,纯水的pH值小于7,为什么?_________________________________________________________________________________________________________________________。
答案:已知室温下,纯水中的c(H+)=c(OH-)=10-7 mol·L-1,又因水的电离(H2O H++OH-)是吸热反应,故温度升高到80 ℃,电离程度增大,致使c(H+)=c(OH-)>10-7 mol·L-1,即pH<72.甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比________(填“大于”“等于”或“小于”)10。
请说明理由。
_________________________________________________________________ _____________________________________________________________。
答案:小于甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,故甲瓶氨水的电离程度比乙瓶氨水的电离程度小,所以甲、乙两瓶氨水中c(OH-)之比小于10 3.用电解法制取金属镁时,需要无水氯化镁。
在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
答案:在干燥的HCl气流中,抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水蒸气,故能得到无水MgCl24.为了除CuSO4溶液中的FeSO4,其操作是滴加H2O2溶液,稍加热;当Fe2+完全转化后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
控制溶液pH=3.5的原因是_________________________________________________________________ _______________________________________________________________。
答案:使Fe3+全部转化为Fe(OH)3沉淀,而Cu2+不会转化为Cu(OH)2沉淀5.硅酸钠水溶液俗称水玻璃。
取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。
写出实验现象并给予解释。
_______________________ ____________________________________________________________。
答案:生成白色絮状沉淀,有刺激性气味的气体生成;原因是SiO2-3与NH+4发生双水解反应,SiO2-3+2NH+4===2NH3↑+H2SiO3↓6.常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO2-3)(填“>”“=”或“<”),原因是________________ ___________________________________________(用离子方程式和必要的文字说明)。
答案:>HCO-3+H2O CO2-3+H3O+(或HCO-3CO2-3+H+),HCO-3+H2O H2CO3+OH-,HCO-3的水解程度大于电离程度7.为了除去氨氮废水中的NH3,得到低浓度的氨氮废水,采取以下措施,加入NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。
(1)用离子方程式表示加NaOH溶液的作用:_____________________________________________________________________ _________________________________________________________________ _______________________________________________________________。
(2)用化学平衡原理解释通空气的目的:_________________________________________________________________ _______________________________________________________________。
答案:(1)NH+4+OH-===NH3·H2O(2)废水中的NH3被空气带走,使NH3·H2O NH3+H2O的平衡向正反应方向移动,利于除氨8.为了获得更多的Cl2,电解饱和食盐水要用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用:_____________________________________________________________________ ______________________________________________________________。
答案:由于阳极上生成氯气,而氯气可溶于水,并发生下列反应Cl2+H2O HCl+HClO,根据平衡移动原理可知增大盐酸的浓度可使平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出9.铈(Ce)是地壳中含量最高的稀土元素。
在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。
其中NH4Cl 的作用是_____________________________________。
答案:分解出HCl气体,抑制CeCl3水解10.利用浓氨水分解制备NH3,应加入NaOH固体,试用化学平衡原理分析NaOH的作用。
_________________________________________________________________ ___________________________________________________________。
答案:NaOH溶于氨水后放热;增大OH-浓度,使平衡NH3+H2ONH3·H2O NH+4+OH-向逆方向移动,加快氨气逸出11.某工艺流程通过将AgCl沉淀溶于NH3的水溶液,从含金、银、铜的金属废料中来提取银。
已知在溶解后的溶液中测出含有[Ag(NH3)2]+,试从沉淀溶解平衡移动的角度解释AgCl沉淀溶解的原因:__________________________________________________________________________________________________________________。
答案:AgCl固体在溶液中存在沉淀溶解平衡AgCl(s)Ag+(aq)+Cl-(aq),由于Ag+和NH3·H2O结合成[Ag(NH3)2]+使Ag+浓度降低,导致AgCl的沉淀溶解平衡向着溶解的方向移动12.(1)为探究纯碱溶液呈碱性是由CO2-3引起的,请你设计一个简单的实验方案:___________________________________________________________ _______________________________________________________________。
(2)为探究纯碱溶液中CO2-3的水解是吸热的,请你设计一个简单的实验方案:_____________________________________________________________________ __________________________________________________________。
答案:(1)向纯碱溶液中滴入酚酞溶液,溶液呈红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去(2)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再加热该溶液,溶液的红色加深二、滴定实验再思考1.酸式滴定管怎样查漏?答案:将旋塞关闭,滴定管里注入一定量的水,把它固定在滴定管夹上,放置10分钟,观察滴定管口及旋塞两端是否有水渗出,旋塞不渗水才可使用。
2.酸碱中和滴定实验操作的要点是什么?如何判断滴定终点?(以标准氢氧化钠溶液滴定未知浓度的盐酸为例,酚酞做指示剂)答案:左手控制滴定管活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,当滴入最后一滴氢氧化钠溶液,溶液由无色变为浅红色,且半分钟内不恢复。
3.在酸碱中和滴定时,滴定管或锥形瓶未润洗,对滴定结果有何影响?(注:用标准液滴定未知液)答案:滴定管未润洗,所测结果偏高;锥形瓶未润洗无影响。
4.滴定前读数正确,滴定完毕俯视或仰视读数对滴定结果有何影响?(注:用标准液滴定未知液)答案:俯视读数,结果偏低;仰视读数,结果偏高。
5.下表是某学生三次实验的记录数据,依据数据计算该NaOH 溶液的物质的量浓度答案:V =26.11 mL +26.09 mL2=26.10 mL c (NaOH)=0.100 0 mol·L -1×26.10 mL 25.00 mL=0.104 4 mol·L -1 6.常温下某同学测定土壤浸出液的酸碱性,用氨水滴定一定体积的浸出液,所得溶液的pH 记录如下:(1)所测土壤酸碱性如何?(2)所用氨水的pH和c(OH-)分别为多少?答案:(1)土壤呈酸性(2)pH=10;c(OH-)=10-4 mol·L-17.用0.1 mol·L-1的NaOH溶液分别滴定0.1 mol·L-1的HCl、0.1 mol·L-1的CH3COOH所得pH变化曲线如下:则________是NaOH滴定CH3COOH的pH变化曲线,判断的理由是_____________________________________________________________________ _____________________________________________________________。
答案:图ⅡCH3COOH为弱电解质,0.1 mol·L-1的CH3COOH的pH大于18.用标准酸性KMnO4溶液测定某补血口服液中Fe2+的含量时,酸性KMnO4溶液应放在________滴定管中,判断滴定终点的方法。
