化学xiti
化学基础复习题(附答案)

化学基础复习题(附答案)一、单选题(共100题,每题1分,共100分)1、下列化合物中,不能发生酯化反应的是A、HCOOHB、CH3COOHC、CH3CH2OHD、CH3CHO正确答案:D2、能与浓溴水反应生成白色沉淀的是()A、乙烯B、苯酚C、乙醇D、苯正确答案:B3、乙醇沸点(78.3℃)与分子量相等的甲醚沸点(-23.4℃)相比高得多是由于 ( )A、乙醇能形成分子间氢键,甲醚不能B、甲醚能与水形成氢键C、甲醚能形成分子间氢键,乙醇不能D、乙醇能与水形成氢键,甲醚不能正确答案:A4、分子中含有碳碳双键的是( )A、苯B、丙烯C、乙炔D、聚乙烯正确答案:B5、下列使蛋白质变性的物理方法是( )A、紫外线照射B、加重金属盐C、加酸D、加有机溶剂正确答案:A6、一定温度下,加水稀释弱酸,数值将减小的是( )B、αC、pHD、[H+]正确答案:D7、与溶液渗透压大小有关的因素是A、溶质颗粒的大小B、溶质的颗粒总数C、溶质的性质D、溶剂的性质正确答案:B8、欲配制PH=4.50的缓冲溶液,若用HAc及NaAc配制,则c(HAc)及c(NaAc)的浓度之比为(HAc的pKa=4.76)( )A、4.76/1B、1/4.76C、1.78/1D、1/1.78正确答案:C9、下列哪项不属于羧酸衍生物()A、乳酸B、甲酸乙酯C、乙酰胺D、乙酸酐正确答案:A10、苯酚俗称()A、石炭酸B、溴苯C、苄醇D、甘油正确答案:A11、在常温下,pH=6的溶液与pOH=6的溶液相比,其氢离子浓度A、高10倍B、高2倍C、高100倍正确答案:C12、单糖与浓酸和α-萘酚反应能显紫色,这一鉴定糖的反应叫( )A、糖脎反应B、Seliwanoff反应C、成苷反应D、Molish反应正确答案:D13、下列不能做为配位体的物质是( )A、C6H5NH2B、CH3NH2C、NH4+D、NH3正确答案:C14、为了保证某工作液的PH值为4--5,应选用( )缓冲对配制缓冲溶液。
分析化学习题库(含参考答案)

分析化学习题库(含参考答案)一、单选题(共50题,每题1分,共50分)1、用NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中:A、氢离子浓度相等B、H2SO4和HAc的浓度相等C、H2SO4的浓度为HAc的1/2D、两个滴定的PH突跃范围相同正确答案:A2、如发现容量瓶漏水,则应:A、调换磨口塞;B、在瓶塞周围涂油;C、摇匀时勿倒置D、停止使用;正确答案:D3、醋酸的pKa = 4.74,则Ka值为:A、2.0×10-5B、1.8×10-5C、1.82×10-5D、2×10-5正确答案:A4、下列有关灼烧容器的叙述,错误的是:A、灼烧容器在灼烧沉淀物之前或之后,必须恒重B、恒重至少要灼烧两次,两次称重一致才算恒重C、灼烧玻璃砂芯滤器的时间可短些D、灼烧后称重时,冷却时间一致,恒重才有效正确答案:C5、单次测定的标准偏差越大,表明一组测定值的什么越低:A、相对误差B、准确度C、绝对误差D、精密度正确答案:D6、测定NaOH中Na2CO3时,当加入酚酞指示剂时呈红色,加入一定量HCl滴定至无色时,再加入甲基橙溶液呈黄色。
说明:A、不含有Na2CO3B、不含有NaHCO3C、不含有NaOHD、无法判断正确答案:D7、分析纯试剂瓶签的颜色为:A、金光红色B、深绿色C、中蓝色D、玫瑰红色正确答案:A8、只需烘干就可称量的沉淀,选用()过滤。
A、玻璃砂芯坩埚或漏斗B、无灰滤纸上C、定量滤纸D、定性滤纸正确答案:A9、双指示剂法测混合碱,加入酚酞指示剂时,消耗HCl标准滴定溶液体积为15.20mL;加入甲基橙作指示剂,继续滴定又消耗了HCl标准溶液25.72mL,那么溶液中存在:A、NaOH + Na2CO3B、Na2CO3 + NaHCO3C、NaHCO3D、Na2CO3正确答案:B10、分析实验中一般要求平行测定3~4 次,然后求平均值作为实验结果,其目的是:A、减少实验的试剂误差B、减少实验的偶然误差C、减少实验的主观误差D、减少实验的操作误差正确答案:B11、滴定分析中,若怀疑试剂失效,可通过哪种方法进行验证:A、仪器校正B、对照分析C、多次平行测定D、空白实验正确答案:B12、挥发法常用于()试样中水分、结晶水或其他易挥发组分的含量测定。
高中化学习题及正确答案

高中化学习题及正确答案
第一题
问题:铁与硫反应生成什么物质?
答案:铁与硫反应生成硫化铁。
第二题
问题:化学方程式H2 + O2 → H2O中,氧气的化学式是什么?答案:氧气的化学式是O2。
第三题
问题:什么是氧化还原反应?
答案:氧化还原反应是指物质的电荷状态发生变化的化学反应。
第四题
问题:什么是酸碱中和反应?
答案:酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
第五题
问题:甲烷的化学式是什么?
答案:甲烷的化学式是CH4。
第六题
问题:什么是化学键?
答案:化学键是指原子之间相互结合的力。
第七题
问题:什么是化学元素周期表?
答案:化学元素周期表是将化学元素按照原子序数和元素性质组织起来的表格。
第八题
问题:什么是电解质?
答案:电解质是指在溶液中能够导电的物质。
第九题
问题:什么是离子?
答案:离子是带电的原子或分子。
第十题
问题:什么是化学反应速率?
答案:化学反应速率是指化学反应单位时间内物质浓度的变化率。
以上是高中化学研究题及正确答案,希望对您有帮助。
《大学化学》习题及答案

《⼤学化学》习题及答案《⼤学化学》习题⼀、单选题1、在定温定压条件下,某反应的ΔG>0,这表明该反应(B)A.正向⾃发进⾏B.逆向⾃发进⾏C.视具体情况⽽定D.不能确定2、往1 dm3, 0.10mol·dm3HAc溶液中加⼊⼀些NaAc晶体,并使之溶解,会发⽣的情况是: (C)A.HAc的Ka值增⼤B. HAc的Ka值减⼩C.溶液的PH值增⼤D. 溶液的PH值减⼩3、下列分⼦中键⾓最⼤的是:(C)A.H2OB.BF3 C.HgCl2D.NH34、已知A+B=M+N;△Hθ1=35 KJ?mol-12M+2N=2D;△Hθ2=-80 KJ?mol-1则A+B=D的△Hθ3是(B)A.-10 KJ?mol-1B.-5 KJ?mol-1 C.-45 KJ?mol-1 D.-25 KJ?mol-15、在标准条件下,下列反应均向正⽅向进⾏:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O2Fe3+ +Sn2+ = 2Fe2+ +Sn4+他们中间最强的氧化剂和最强的还原剂是(D)A. Sn2+和Fe3+B. Cr2O72-和Fe3+C. Cr3+和Sn4+D. Cr2O72-和Sn2+6、对可逆反应,加⼊催化剂的⽬的是(C)A.改变反应进⾏的⽅向B.加快正反应速度⽽减慢逆反应速度C.缩短达到平衡的时间D.使平衡向右移动7、盖斯定律适⽤条件是(B)A.定温或定压B.定压或定容C.定温或定容D.不确定8、⾃然界中,硬度最⼤的⾦属是(A)A.Cr B.Au C.⾦刚⽯D.SiO29、导电性能最好的⾦属是(A )A. AgB. CuC. AlD. Au10、下列溶液凝固点⾼低顺序排列正确的是:( C )a)1.00mol·dm-3NaCl; b) 1.00mol·dm-3H2SO4;c) 0.10mol·dm-3C6H12O6; d) 0.10mol·dm-3CH3COOH溶液A.a>b>c>dB.b>a>c>d C.c>d>a>b D.a>b>d>c11、下列分⼦中键⾓最⼩的是:(A)A.H2OB.BF3 C.HgCl2D.NH312、下列各物质中,含有氢键的是(A )A.HFB.NaClC.CH4/doc/f036d59df424ccbff121dd36a32d7375a417c63b.html l413、在稀醋酸溶液中,加⼊等物质量的固态NaAc,在混合溶液中不变的量是( C )A.pHB.电离度C.电离常数D.OH-离⼦的浓度14、稀溶液依数性中⼼的核⼼性质是( D )A.溶液的沸点升⾼B.溶液的凝固点下降C.溶液是有渗透压D.溶液的蒸⽓压下降15、下列各组量⼦数合理的是( C )A. n=2, l=0, m=1, m s=1/2B. n=2, l=2, m=0, m s=1C. n=1, l=0, m=0, m s=-1/2D. n=1, l=0, m=-1, m s=-1/216、下列各物质的分⼦间只存在⾊散⼒的是( A )A. CO2B. H2O;C. NH3D. CHCl317、在下列溶液中AgCl的溶解度最⼩的是( B )A. 0.1mol/L的NaCl溶液B. 0.1mol/L的MgCl2溶液C. 0.1mol/L的AgNO3溶液D. 0.5mol/L的Na2SO4溶液18、以电对MnO4-/Mn2+与Fe3+/Fe2+组成原电池,已知Eθ(MnO4-/Mn2+)> Eθ(Fe3+/Fe2+) ,则反应物是( A )A. MnO4-与Fe2+B. MnO4-与Fe3+C. Mn2+与Fe2D. Mn2+与Fe3+19、已知下列反应的平衡常数:(1)A=B;K1θ(2)B+C=D;K2θ则反应:A+C=D的平衡常数是下列中的( B )A. (K1θK2θ)2B. K1θ K2θC. K2θ/ K1θD. K1θ/ K2θ20、已知氢氧化合反应:H2(g) + 1/2O2 (g) = H20(l),反应△r Hmθ(298.15℃)=-285.kJ.mol-1,要有利于取得H2的最⼤转化率,可采取的措施是( A )A. 低温⾼压B. ⾼温低压C. 低温低压D. ⾼温⾼压21、下列个物质的化学键中,只存在σ键的是( C )A. N2B. C2H4C. PH3D. ⽆法确定22、下列物质中不属于毒品的是( B )A. 吗啡B. 黄曲霉素C. 海洛因D. 冰毒23、具有下列表现:⼉童⾻质⽣长不良和⾻化不全,囟门晚闭,出⽛晚,“鸡胸”或佝偻病,成⼈患软⾻病、易⾻折,⼿⾜抽搐是由于缺乏什么元素造成( A )A.CaB.ZnC.FeD.I224 真实⽓体⾏为接近理想⽓体性质的外部条件是:( B )(A)低温⾼压(B) ⾼温低压(C) 低温低压(D)⾼温⾼压25、向等体积的浓度均为1mol·dm-3 HAc和NaAc 混合溶液中加⼊0.01 mol·dm-3的HCl溶液0.005ml,则溶液PH值的改变为( C )A. 增⼤B. 减⼩C. 基本不变D. ⽆法确定26、试指出下列物质中何者不含有氢键( B )A. B(OH)3B. HIC. CH3OHD. H2NCH2CH2NH227、⼀⽀充满氢⽓的⽓球,飞到⼀定⾼度即会爆炸,这主要取决于⼀定⾼度上的(D )A.外压B.温度C.湿度D.外压和温度28、电镀⼯艺是将欲镀零件作为电解池的(A)A. 阴极B. 阳极C. 阴阳两极D. ⽆法确定29、下列对于功和热叙述中正确的是( A )A. 都是途径函数,⽆确定的变化途径就⽆确定的数值B. 都是途径函数,对应于某⼀状态有⼀确定值C. 都是状态函数,变化量与途径⽆关D. 都是状态函数,始终态确定,其值也确定30.将物质a.K(s);b.Na(s);c.Br2(l);d.Br2(g);e.KCl(s)的标准熵值Smθ(298.15K)由⼤到⼩顺序排列的是( C )A. abcdeB. bdcaeC. dceabD. cdeba31、下列各物质结构中,含有叁键的是( C )A. ⼄烯B. H2O;C. N2D. BF332、升⾼温度可以加快反应速率,最主要是因为( B )A. 增加了分⼦总数B.增加了活化分⼦的百分数C. 降低了反应的活化能D.促使平衡向吸热⽅向移动33、向等体积的浓度均为1mol·dm-3 HAc和NaAc 混合溶液中加⼊0.01 mol·dm-3的HCl 溶液0.005ml,则溶液PH值的改变为(C )A. 增⼤B. 减⼩C. 基本不变D. ⽆法确定34、依据酸碱质⼦理论,PO43-:( C )A.是酸,其共轭碱是H3PO4。
高中化学习题及正确答案

高中化学习题及正确答案一、选择题1. 下列哪种物质是一种酸?A. 氢氧化钠B. 硫酸C. 氧化铁D. 碳酸氢钠答案:B. 硫酸2. 下列哪种物质是一种碱?A. 盐酸B. 氢氧化钾C. 硝酸D. 碳酸钙答案:B. 氢氧化钾3. 下列哪种物质是一种盐?A. 氢氧化铁B. 硫酸铜C. 氢氧化钠D. 氧化铜答案:B. 硫酸铜4. 下列哪种物质是一种氧化物?A. 硫酸B. 氢氧化钠C. 二氧化碳D. 氯化钠答案:C. 二氧化碳5. 下列哪种物质是一种有机物?A. 硫酸B. 氢氧化铁C. 碳酸氢钠D. 甲烷答案:D. 甲烷二、填空题1. 氢氧化钠的化学式为_______。
答案:NaOH2. 硫酸的化学式为_______。
答案:H2SO43. 氧化铁的化学式为_______。
答案:Fe2O34. 碳酸氢钠的化学式为_______。
答案:NaHCO35. 氢氧化钾的化学式为_______。
答案:KOH三、简答题1. 酸、碱、盐、氧化物和有机物的定义分别是什么?答案:酸:在水溶液中能够产生氢离子(H+)的物质。
碱:在水溶液中能够产生氢氧根离子(OH-)的物质。
盐:由酸和碱反应生成的物质。
氧化物:由两种元素组成,其中一种是氧元素的化合物。
有机物:一般指含碳的化合物,除了碳的氧化物、碳酸和碳酸盐。
四、计算题1. 25克氢氧化钠溶液的pH值是12,求溶液中的氢离子浓度。
答案:10^-2 M2. 50毫升0.1M硫酸溶液中,硫酸的物质的量是多少?答案:0.005 mol3. 10克氧化铁的摩尔质量是多少?答案:159.69 g/mol4. 8克碳酸氢钠的相对分子质量是多少?答案:84.01 g/mol5. 100毫升0.01M氢氧化钾溶液中,氢氧根离子的物质的量是多少?答案:0.0001 mol以上是高中化学习题及正确答案的一个简单示例,可以根据需要进行扩展和修改。
化学基础习题库及答案

化学基础习题库及答案一、单选题(共100题,每题1分,共100分)1、下列化合物能与托伦试剂反应生成银镜的是()A、丙酸B、丙酮C、甲醇D、甲酸正确答案:D2、下列化合物中酸性最强的是()A、α-羟基丙酸B、β-羟基丙酸C、丙酸D、α,β-二羟基丙酸正确答案:D3、在氨溶液中加入少量盐酸,使:( )。
A、溶液OH-浓度变小B、NH3的Kb变大C、NH3的α增大D、pH值保持不变正确答案:C4、下列说法正确的是:()A、增大反应物的浓度,平衡向生成物浓度增大的方向移动。
B、有气体存在的可逆反应,该变压强,都会使化学平衡移动。
C、加热能使吸热反应速率加快,放热反应速率减慢,平衡向吸热反应方向移动。
D、凡能影响反应速率的因素,都能使化学平衡移动正确答案:A5、下列可用来区分葡萄糖和果糖的是( )A、斐林试剂B、苯肼C、托伦试剂D、赛利凡诺夫试剂正确答案:D6、 CH3CH2CH2CH3与CH3CH(CH3)2是什么异构体?( )A、碳架异构B、位置异构C、官能团异构D、互变异构正确答案:A7、既能发生水解反应,又能发生银镜反应的物质是()A、麦芽糖B、蔗糖C、丙酸甲酯D、葡萄糖甲苷正确答案:A8、欲使蛋白质沉淀而不变性,应选用( )A、浓硫酸B、重金属盐C、甲醛D、硫酸铵正确答案:B9、人体血浆中最重要的缓冲对是A、H2PO4 — HPO42-B、HCO3 — CO32-C、H2CO3 — HCO3-D、HPO42 — PO43-正确答案:C10、下列试剂中,常用于糖尿病患者尿液中葡萄糖含量检查的是( )A、FeCl3B、溴水C、班氏试剂D、茚三酮溶液正确答案:C11、医用生理盐水的质量浓度是多少?A、8g/LB、10g/LC、9g/LD、7g/L正确答案:C12、有关简单的饱和链烃的叙述:①都是易燃物;②特征反应都是取代反应;③相邻两个烷烃在分子上组成相差一个甲基。
正确的是( )A、②和③B、①和②C、①D、①和③正确答案:B13、可以用来判断油脂不饱和程度的是( )A、酸值B、皂化值C、碘值D、密度正确答案:C14、某缓冲溶液的共轭碱的Kb=1.0×10-6,从理论上推算该缓冲溶液的缓冲范围是( )A、5~7B、6~8C、7~9D、5~6正确答案:C15、 HPO42-的共轭酸是( )A、H2PO4-B、OH-C、H3PO4D、PO43-正确答案:A16、下列哪种物质具有致癌性( )A、蒽B、菲C、萘D、苯并芘正确答案:D17、下列有机物分子中不含有羧基的是()A、苯甲酸B、过氧乙酸C、乳酸D、苯酚正确答案:D18、人的肠胃不能消化的多糖是. ( )A、纤维素B、糖原C、右旋糖酐D、淀粉正确答案:A19、将淀粉碘化钾混合溶液装在半透膜中,浸泡在盛有蒸馏水的烧杯中,过一段时间后取出杯中液体进行试验,不能证明半透膜有破损的是:( )A、加入碘水变蓝B、加入碘化钠不变蓝C、加入FeCl3 溶液变蓝D、加入溴水变蓝正确答案:B20、下列化合物中无顺反异构现象的是()A、2-氯-2-丁烯B、2-甲基-2-丁烯C、3-甲基-2-戊烯D、2-丁烯正确答案:B21、下列不属于有机物的是 ( )A、HCOOHB、C2H4C、CH3OHD、HCN正确答案:D22、不能配制 pH = 7 左右的缓冲溶液的共轭酸碱混合物是( ) (已知HClO :K = 3.4 × 10-8 H2CO3 :K1 = 4.2 × 10-7 ,K2 = 5.6 × 10-11 H3PO4 :K1 = 7.6 × 10-3 ,K2 = 6.3 × 10-8 ,K3 = 4.4 × 10-13)A、NaHCO3-Na2CO3B、NaH2PO4-Na2HPO4C、HClO-NaClOD、H2CO3-NaHCO3正确答案:A23、构成蛋白质的基本单位是( )A、多肽B、β-氨基酸C、α-氨基酸D、肽链正确答案:C24、β-醇酸加热脱水生成( )。
化学习题答案
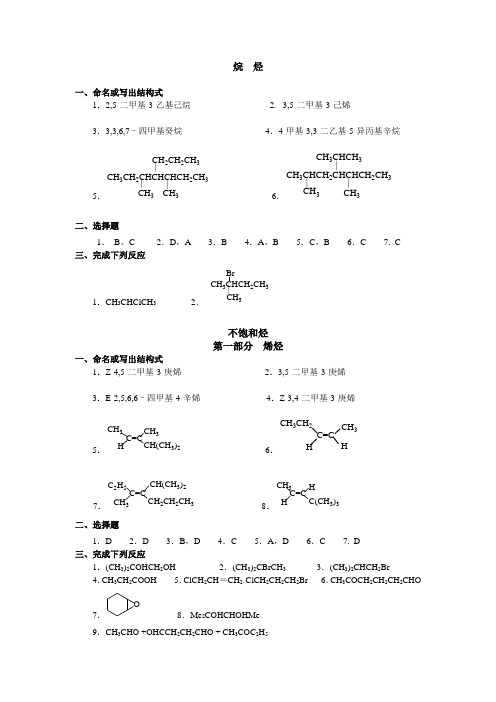
烷烃一、命名或写出结构式1.2,5-二甲基-3-乙基己烷2.3,5-二甲基-3-己烯3.3,3,6,7–四甲基癸烷4.4-甲基-3,3-二乙基-5-异丙基辛烷5.CH3CH2CHCHCHCH2CH3|CH3|CH2CH2CH3|CH36.CH3CHCH2CHCHCH2CH3|CH3|CH3CHCH3|CH3二、选择题1.B、C 2.D,A 3.B 4.A,B 5.C,B 6.C 7. C 三、完成下列反应1.CH3CHClCH32.|CH3CH3CHCH2CH3Br不饱和烃第一部分烯烃一、命名或写出结构式1.Z-4,5-二甲基-3-庚烯2.3,5-二甲基-3-庚烯3.E-2,5,6,6–四甲基-4-辛烯4.Z-3,4-二甲基-3-庚烯5.CH3CH3H3)2C=C6.CH3CH2C=CCH3H H7.C2H5CH(CH3)2CH3CH2CH2CH3C=C8.CH3HH C(CH3)3C=C二、选择题1.D 2.D 3.B,D 4.C 5.A,D 6.C 7. D三、完成下列反应1.(CH3)2COHCH2OH 2.(CH3)2CBrCH33.(CH3)2CHCH2Br4.CH3CH2COOH 5.ClCH2CH=CH2,ClCH2CH2CH2Br 6.CH3COCH2CH2CH2CHO7.O8.Me2COHCHOHMe9.CH3CHO +OHCCH2CH2CHO + CH3COC2H510.CH 3COCH 3 + CH 3CH 2CHO 11.||ClOH四、推断结构1.解:H 2催化剂AB ||2(1)O 3OHCCH 2CH 2CHOA||2.解:(1)CH 2=C(CH 3)2 (2) CH 3CH=CHC(CH 3)2 (3)CH 3或CH 3(4) CH 3CH 2CH=CHCH 2CH 3五、由指定有机原料合成下列化合物解:1.CH 3CH =CH 2−−−−→−︒C Cl 500/2CH 2=CHCH 2Cl −→−2Br T.M 2.CH 3CHOHCH 3−−−→−∆/42SO H CH 3CH =CH 2−−→−HOBr T.M3.CH 3CHOHCH 3−−−→−∆/42SO H CH 3CH =CH 2−−−−→−22/O H HBr T.M4.Cl第二部分 炔烃和二烯烃一、命名或写出结构式1.2,2-二甲基-3-庚炔 2.6-溴己炔 3.1,4-己二烯4.4-甲基-2-己炔 5.2,2,6,6-四甲-3-庚炔 6.3-丁基-1,6-庚二烯7.(CH 3)2CHC ≡CC(CH 3)3 8.(CH 3)3CC ≡C CH 2CH 2CH 39.CH 2=C(CH 3)CH=CHCH 2CH 3 10.HC ≡CCH=CHCH 3 二、选择题1.C 2.A 3.C 4. B 5.C 三、完成下列反应1.CH 3CH 2CH 2C(Br)=CH 2 2. CHO3.CH 3CH 2C(CN)=CH 24.CH 3COCH 3 5. CHCH=CH 2 + BrCH 2C=CHCH 3_BrCH 2_|CH 3|CH 36.C=CHCH 2Br_CH 3|CH 3四、鉴定与提纯1.解:⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−−→−−−→−−−→−−−−→−↓+C B ANH Ag CCl Br 无白色褪色不褪色未知物2342)(/ 2.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧−−−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−−→−−→−−−→−−−−−→−−−→−−−−→−↓↓+A B D CNH Ag CCl Br 不褪色无白色顺丁烯二酸酐无白色褪色未知物2342)(/ 五、推断结构1.解:ClCH 2CH =CH 2−−−−←高温/2Cl CH 3CH =CH 3−−−→−低温/2Cl CH 3CHClCH 2ClC A B↓C 2H 5MgICH 3CH 2CH 2CH =CH 2−−→−NBS CH 3CH 2CHBrCH =CH 2 D E ↓KOH ―EtOHCH 3CH =CHCH =CH 2 FO O O+O OOO O O+O O O2.解:A CH 3CH=CC ≡CH_C 2H 52H 5B CH 3CH=CCH=CH 2CH 3C C O==OO_C 2H 5_六、以乙炔为原料合成下列化合物解:1.2CH ≡CHCH ≡CCH=CH 2H 24Cu 2Cl 2CH 2=CHCH=CH 2CH ≡CH224CH 2TM2.3CH ≡CNaC 2H 5ClCH 3CH 2C ≡CHH 2O424NaNH 2TMCH ≡环 烃一、命名或写出结构式1.3-甲基环己烯 2.反-1-甲基-4-乙基环己烷 3.4-硝基-2-氯甲苯4.3-甲基-4-硝基苯磺酸 5.3,5-二溴乙苯 6.对溴苯胺7.8.CH 3 9.|NH 2ClBr10.NO 2二、选择题1.D 2.A 3.A ,C 4.A 5.A 6.D 7.B 8. A , B 9. B 10. B 11.B 三、完成下列反应1.(CH 3)2CHCBr(CH 3)2 2.COOH CH 3H 3C+CH 3COOH3.C(CH 3)3C(CH 3)3H 3CH 2C C(CH 3)3HOOC4. O5.CH 3CH 3 +ClCl四、鉴定下列化合物1.解:⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−−→−−−→−−−−→−−−→−−−→−−−−→−C B A KMnO CCl Br 褪色不褪色褪色不褪色未知物442/ 2.解:⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧−−→−−−→−−−−→−−−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−→−−−−−→−−→−−→−−−−→−−−→−−→−↓↓+E A D C BKMnO NH Ag Br 不褪色褪色不褪色无白顺丁烯二酸酐无白褪色未知物4232)( 五、推断结构1.解:ACH 3 B C CH 3CH 2CHBrCH 3 D CH 3CH 2CH 2CH 3BrCH 3+Br 2BrCH 2CH 2CHBrCH 3CH 3+HBr CH 3CH 2CHBrCH 3+HBrCH 3CH 2CH 2CH 2Br2.解:构造式及有关的反应式:C CH 332C CH 3CCuAC CH 3C 2H 5CH 3CHH 2/cat-H 2OO OOB CDCCH 3CH+E3.解:+COOHH 2SO 4HNO 3NO 2_CH 2CH 2CH 3[O]_|___CH 2CH 2CH 3CH 2CH 2CH 3NO 2AH 2SO 4HNO 3NO 2|C|_|CH 3CH 3CH 3|_|COOHCOOHCOOH|_|CH 3CH 3CH 3六、以甲苯为原料合成下列化合物1.CH 33CH ||NO 24|KMnO 4||COOHNO 22.|3223_CH 3CH 3CH(CH 3)23.BrBr 2NO2|CH 3_CH 3_FeBr 3BrCOOH3H 2SO 4Br __COOH4.CH 32|||_||NO 2CH 3324BrCH 3NO 2|Br旋光异构一、命名或写出结构式1.(3R)-4-甲基-3-溴戊烯 2.(2R,3S)-2,3-二甲基-2,3-二羟基丁二酸3.(2S ,3S)-3-氯-2-丁醇 4.(R)-2,3-二甲基己烷 5.(R)-2-氯丙酸6.3C ≡CHH CH 2CH 3 7.6H 13-n IH CH 38.6H 5H HOCH 39.HHC 2H 5C 2H 5NO 2NO 2 10.C 2H 5H HOCH 3二、选择题1.C 2.D 3.D 4. A 5. D 6. A 7.D卤代烃一、命名或写出结构式1.(E)-4,4-二甲基-3-氯甲基-2-戊烯 2.2,4,4-三甲基-2-溴戊烷3.3-甲基-4-氯环戊烯 4.2-甲基-3-氯-6-溴-1,4-己二烯5.顺-1-氯-3-溴环己烷 6.2-溴-1-己烯-4-炔7.CHClC 2H 5C 2H 5H H 3C 8. HC ≡CCHCHCH 2CH 3C 2H 5_Cl _9.CH 2=CHCH 2Cl 10.ClCH 2Cl二、选择题1.D ,A 2.A ,B 3.A ,B 4.C 5.A 6.B,C,D,F/A,E 三、完成下列反应1. C 6H 5CH 2MgCl ,C 6H 5CH 2COOMgCl ,C 6H 5CH 2COOH 2.CH 2=CHCH 2OC 2H 5 3.MgBrCH 3,CH 34. Br Br, ,CHO5. CH 2ClCl四、写出下列反应机理解:CH 3CHCHCH 3CH 3Cl3CHCHCH 3CH 3+OH 2CH 3CCH 2CH CH 3+OH 2H 2O CH 3CHCHCH CH 3+CH 3CHCH 2CH 3CH 3+H 2O -H +-H +3CHCHCH 3CH 3OH 3CCH 2CH 3CH 3OH五、推断结构1.解:A CH 3CH 2CH 2CH 2Br B (CH 3)3CBr C C 2H 5CHBrCH 32.解:CH 3CH 2CH 2Br −−−−→−-EtOHKOHCH 3CH=CH 2−−→−HBr CH 3CHBrCH 3 A B C六、由2-甲基-1-溴丙烷及其它无机试剂制备下列化合物解:1.(CH 3)2CHCH 2Br −−−−→−-EtOHKOHT.M 2.(CH 3)2CHCH 2Br −−→−NaOHT.M 3.(CH 3)2CHCH 2Br −−−−→−-EtOHKOH (CH 3)2C=CH 2−−→−HBr T.M 4.(CH 3)2CHCH 2Br −−−−→−-EtOH KOH (CH 3)2C=CH 2−→−2Br T.M 5.(CH 3)2CHCH 2Br −−−−→−-EtOH KOH (CH 3)2C=CH 2−−→−HOBr T.M醇酚醚一、命名或写出结构式1.4-羟基-2-戊烯 2.2-苯基乙醇 3.乙基异丙基醚4.苯乙醚 5.1-甲基环己醇 6.1,2-环氧丁烷7.2-甲基-4-乙基苯酚 8.4,5-二甲基萘酚9.CHOH |CH 2OHCH 2OH 10.CH 2OH11.O O12.NO 2OHNO 2O 2N13.OHOCH 3OCH 3二、选择题1.B ,C 2.A ,C 3. A/B ,D/D 4.D 5.C 6.C三、完成下列反应1.CH 2BrHO2. CH 3COCH 33.CH 3CHCH 2OH OCH 3 ,CH 2=CHCH 2CHCH 3OH 4.HO + CH 3I5. CH 3CHCH 2OCH 3OH 6.,Br Br7. CH 3I+CH 3CH 2CH 2OH 8. BrCH 2CH 2CH 2CH 2CH 2Br9.,OHOH ,HOC(CH 2)4CHO 四、用化学方法鉴别下列各组化合物1.解:⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−↑B AC FeCl H Na无无紫色未知物32 2.解:⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−↑B C A FeCl H Na 无无紫色未知物32 五、推断结构1.解:AOH OHCH 3CH 3BCH 3CH 3 C H 3C H 3C OHOH2.解:A .CH 3CH 2OCHMe 2 B .CH 3CH 2Br C .BrCHMe 2D .CH 3CH 2OHE .HOCHMe 2F .CH 3CHOG .CH 3COCH 3六、合成1.解:CH 2=CHCH 3−−−−→−22/O H HBr CH 3CH 2CH 2Br −−→−-OH CH 3CH 2CH 2OH −→−Na CH 3CH 2CH 2ONa CH 2=CHCH 3−−→−NBS CH 2=CHCH 2Br −−−−−→−ONaCH CH CH 223T.M 2.解:PhCH 3−−→−NBSPhCH 2Br −−→−-OHT.M 七、写出下列反应机理解:H 3C CH 3OH H+H 3CCH 3OH +2H 3CCH333醛酮一、命名或写出结构式1.2-羟基-4-甲氧基苯乙酮 2.对甲基苯甲醛 3.苯乙醛 3.2-甲基丙醛 4.3-甲基丁酮 5.丙烯醛 6.2,5-己二酮 7.OO8.CH 3CH 2COCH 2CHO 9.BrCH 2CHCHO10.PhCOCH 3 11.Cl 3CCH 2COCH 2CH 3二、选择题1.AC/D 2.A 3.D/A 4.B 5.D 6.BC 7.A/B 8.D 9.D 10.D三、完成下列反应1. NNHC 6H 52. CH 3CCH 2CH 3NOH3.CH 3CH 2CHOHCH(CH 3)CHO 4.ArCC 2H 5OHCH 35.(CH 3)3CCOOH + (CH 3)3CCH 2OH 6 .ArCH=CHCOCH3 7.BrCH 2CH 2COCH 38.CNCH=CHCHO + CH 2=CHCHOHCN 9.ArCOCH 2Cl 10.ArCOOH + CHCl3四、鉴别下列各组化合物1.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−→−−→−⎪⎩⎪⎨⎧−→−−−→−−−−→−−−→−−−−−−→−↓-↓-↓C D A B NaOHI NaOH I 无黄无无黄黄二硝基苯肼未知物22-4,2 2.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−→−−→−−−→−−−−→−−→−−−−→−↓↓-↓+D C A BAg NH Ag NaOH I NaHSO 无无无黄白未知物2323)(3.解:⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−−→−⎪⎩⎪⎨⎧−→−−−→−−−−→−−−→−−−−−−→−↑↓↓+A C B E D FeCl H Na Ag NH Ag 无无紫色无无黄二硝基苯肼未知物3223)(-4,2 五、推断结构1.解:A CH 3COCH=CHCH 3 CH 3COCH 2CH(CH 3)2 C (CH 3)2CH(OH)CH=CHCH 3D CH 3CH=CHC(CH 3)=CH 2E CH 3H 3COH OH2.解:A CH 3OB CH 3HO OC CH 3CH 2D CH 3CH 3ECOCH 3CHOH 3CFCOCH 3COOH H 3C六、合成解:1.2CH 3COCH 3−−−→−NaOH%5 (CH 3)2COHCH 2COCH 3−−−→−-∆OH 2/(CH 3)2C=CHCOCH 3−−−−−→−+HNaOH I )2(;/)1(2(CH 3)2C=CHCOOH2.解:CH 2=CH 2−−−→−∆+,/2H O H CH 3CH 2OH −−−→−莎瑞特试剂CH 3CHO↓HClCH 3CH 2Cl −−−→−OEt Mg 2/CH 3CH 2MgCl −−−−−−→−+OH H CHO CH 23,)2(,)1(T.M 3.解:CH 3CH 2CH =CH 2−−−→−∆+,/2H O H CH 3CH 2CHOHCH 3−−−−→−∆+,/722H O Cr K3+CH 3CCH 2CH 3CNOHCH 3CH 2COCH CH 3CCH 2CH 3COOHOH4.解:CH 3CH 3CH 3COCH 2CH 2Br 22H +CH 3CH 3H 3CCCH 2CH 2BrO O2CH 3CH 3H 3CCCH 2CH 2MgBrO OT.M。
初中化学经典习题(含答案)

初中化学经典习题(含答案)化学是一门研究物质组成、性质和变化的科学。
初中化学作为学科中的一部分,是培养学生科学思维和实践能力的重要学科之一。
今天,我带大家回顾一些经典的初中化学习题,并提供答案。
1. 物质的分类:将以下物质分类,分为元素和化合物。
答案:元素:金属铁、非金属氧化铝化合物:水、食盐2. 化学反应的观察:以下哪个实验中发生了化学反应?A. 将钠丢入水中B. 将冰块放置在室温下C. 温度升高时水的蒸发量增加D. 加热金属后其长度变化答案:A. 将钠丢入水中3. 化学符号:根据元素的符号填空。
氧气的化学符号是___,氮元素的化学符号是___。
答案:氧气的化学符号是O,氮元素的化学符号是N。
4. 化学式:根据物质的名称写出化学式。
氯化钠的化学式是___,硫酸的化学式是___。
答案:氯化钠的化学式是NaCl,硫酸的化学式是H2SO4。
5. 原子结构:答案写出原子结构的组成部分及其电荷。
答案:原子结构由质子(正电荷)、中子(无电荷)和电子(负电荷)组成。
6. 电离反应:以下哪个物质可以电离?A. 食盐B. 青草C. 糖D. 纯水答案:A. 食盐7. 溶液的浓度:若将10g的食盐溶解在100g的水中,求溶液的质量百分浓度。
答案:溶液的质量百分浓度=溶质的质量/溶液的质量×100%,即10/(10+100)×100%=9.09%8. 氧化与还原:以下哪个反应是氧化还原反应?A. 镁颗粒与盐酸反应产生氢气B. 食盐溶解在水中C. 醋与小苏打反应产生二氧化碳D. 铁与氯气反应生成三氯化铁答案:A. 镁颗粒与盐酸反应产生氢气9. 酸、碱和盐:以下哪个是常见的酸?A. 果汁B. 醋C. 雪碧D. 矿泉水答案:B. 醋10. 化学能:以下哪种能量是化学能?A. 太阳能B. 电能C. 燃烧放出的热能D. 动能答案:C. 燃烧放出的热能希望这些经典的初中化学习题能够帮助大家复习和巩固化学知识。
有机化学练习题大全

有机化学练习题大全绪论章节习题1.指出下列化合物中带“*”号碳原子的杂化类型:1)4)2)(3)5)6)2.写出下列化合物的结构式:1)(2)CH 3 CH 2 ―O―CH 2 CH 2 CH 3 (3)CH 3 CH 2 CH 2 CH 2 CH 3(4)(5)CH 3 CH 2 ―O―CH(CH 3 ) 2 (6)7)(8)3.下列化合物各属于哪一类化合物?(1)(2)(3)4)(5)(6)CH 3 ―NH 24.π键是怎样构成的?它有哪些特点?5.下列化合物哪些易溶于水?哪些难溶于水?(1)CH 3 OH (2)CH 3 COOH (3)CCl 4(4)(5)(6)CH 3 (CH 2)16 CH 36.某化合物的实验式为CH,其相对份子质量为78,试推算出它的份子式。
7.某化合物的相对分子量为80,其元素组成为:C45%,H7.5%,F47.5%。
试推算出它的分子式。
8.下列化合物是否有偶极矩?如果有,请指出方向。
1)CH 2 Cl 2(2)CH 3 Br(3)CH 3 ―0―CH 34)CH 3 CH 2 NH 2(5)HCO 2 H(6)CH 3 CHO第二章开链烃章节习题1.用系统命名法命名下列化合物,若是顺反异构体应在名称中标明构型.1)(C2H5)2CHCH(C2H5)CH2CH(CH3)2(2)(CH3CH2)2CHCH3(3)4)(5)(6)7)(8)(9)10)(11)(12)2.写出以下化合物的布局式:(1)3-甲基-4-乙基壬烷(2)异己烷3)2,3,4-三甲基-3-乙基戊烷(4)4-甲基-3-辛烯5)2-甲基-3-乙基-3-辛烯6)(E)-2-己烯7)(Z)-3-甲基-2-戊烯(8)2,7-二甲基-3,5-辛二炔9)(3顺,5反)-5-甲基-1,3,5-庚三烯10)顺-3,4-二甲基-3-己烯3.写出C 5 H 12烷烃的所有一氯代衍生物。
4.下列化合物哪些有顺、反异构体?写出其顺、反异构体的构并用顺、反命名法或Z、E命名法命名。
基础化学练习题

1.用18mol·L-1 的浓硫酸3.5ml配成350ml的溶液,该溶液的物质的量浓度为()。
A. 0.25mol·L-1B. 0.28mol·L-1C. 0.18mol·L-1D. 0.35mol·L-1选择一项:a. A b. B c. C d. D2.静脉滴注9.0 g/L的NaCl溶液,结果会()。
A. 正常B. 基本正常C. 胞浆分离D. 溶血选择一项:a. A b. B c. C d. D3.将一块冰放在273k的食盐水中则()。
A.冰的质量增加B.无变化C.冰逐渐熔化D.溶液温度升高选择一项:a. A b. B c. C d. D4.5.8%NaCl溶液产生的渗透压接近于()。
A.5.8%蔗糖溶液B.5.8%葡萄糖溶液C.2.0 mol·L-1蔗糖液D.1.0 mol·L-1葡萄糖溶液选择一项:a. A b. B c. C d. D5.土壤中NaCl含量高时植物难以生存,这与下列稀溶液的性质有关()。
A. 蒸气压下降B. 沸点升高C. 凝固点下降D. 渗透压选择一项:a. A b. B c. C d. D6.会使红细胞发生皱缩的是()。
A. 12.5 g/L NaHCO3(M = 84 g/mol)B. 1.00 g/L NaClC. 112 g/L NaC3H5O3(M = 112 g/mol)D. 50 g/L 葡萄糖选择一项:a. A b. B c. C d. D7.两溶液的pH值相差为3,则[ H+]相关()。
A.2倍B.20倍C.lg2倍D.103倍选择一项:a. A b. B c. C d. D8.下列离子中只能作为质子碱的是()。
A. B. C. D.选择一项:a. A b. B c. C d. D9.不是共轭酸碱对的一组物质是()。
A.、B.、C.、D.、选择一项:a. A b. B c. C d. D10.的共轭碱是()。
化学知识练习题库+参考答案

化学知识练习题库+参考答案一、单选题(共30题,每题1分,共30分)1、气体检测仪按气体按气体进样方式分类的为( )。
A、黏贴式B、泵吸式C、接触式D、沾染式正确答案:B2、充装氧气、二氧化碳、氯气、氮气钢瓶的颜色分别为( )。
A、天蓝色、铝白色、草绿色、黑色B、草绿色、铝白色、天蓝色、黑色C、铝白色、草绿色、天蓝色、黑色D、天蓝色、铝白色、黑色、草绿色正确答案:A3、外照射实用辐射量计量单位为( )。
A、居里B、微居C、戈瑞D、贝克正确答案:C4、二硫化碳蒸气与空气混合物爆炸限( )。
A、3~30%B、1~25%C、3~50%D、1~60%正确答案:D5、氧氯化磷的分子式是( )。
A、POCL3B、(C2H5)3AlC、NHO3D、HCLO4正确答案:A6、下列属于致死性生物剂的是( )。
A、霍乱B、葡萄球菌肠毒素C、天花病毒D、布氏杆菌正确答案:C7、芥子气的渗透能力很强,落在皮肤上的芥子气液滴,在( )分钟后全部渗入皮肤。
A、15~20B、5~10C、2~5D、1~2正确答案:A8、下列不属于影响化学事故危害的主要因素的是( )。
A、发生事故的时间和地点B、化学物质的理化性质和毒性C、化学事故的类型和起始参数D、现场人员正确答案:D9、下列器材中不能检测到γ射线的是( )。
A、RDK探头3B、RDK探头4C、核放射探测仪D、PGM-7800正确答案:D10、在处置( )事故时,应该做好防冻伤防护。
A、沙林B、氰化氢C、液化石油气D、氯气正确答案:C11、常规防毒面具、防烟面具和毛巾对下列( )气体防护无效。
A、一氧化碳B、氯化氢C、硫化氢D、氨气正确答案:A12、二甲苯的毒性比( )低。
A、氯黄酸.高氯酸B、二氧化硫.丙烯晴C、苯.甲苯D、氢气.氨气正确答案:C13、下列属于自燃物品的是( )。
A、硫化氢B、氯化腈C、硫化钠D、二氧化硫正确答案:C14、下列不属于化学有毒气体的是( )。
A、一氧化碳B、氯气C、氨气D、氮气正确答案:D15、真空吸附堵漏器的覆盖层由( )材质制成。
化学练习题目

化学练习题目一、选择题1. 下列不属于有机物的是:A. 甲烷B. 乙醇C. 水D. 丙烯2. 下列化合物中键的键能最大的是:A. 水B. 氧气C. 氨D. 氢气3. 以下选择物质不属于酸的是:A. HClB. HNO3C. H2SO4D. NaOH4. 已知氧原子负电性更大于硫原子,下列化合物中键的极性最大的是:A. H2OB. H2SC. H2SeD. H2Te5. 化学方程式2H2 + O2 → 2H2O中,原子电荷是否守恒?A. 守恒B. 不守恒二、填空题1. 在自然界中,氮通常以__N2__ 的形式存在。
2. 金属与非金属形成的是__离子键__。
3. CuSO4溶液中最不能共存的金属是__Cu__。
4. 堆积如山的纯物质叫做__物质__。
5. 化学反应中放热的反应称为__放热反应__。
三、简答题1. 什么是化学元素?举例说明。
化学元素是指由具有相同原子序数的原子组成的纯物质。
例如,氧气(O2)、氢气(H2)和氧化铁(Fe2O3)。
2. 请解释酸与碱的概念及其性质。
酸是指在水溶液中能够产生H+离子的物质,具有酸味,能腐蚀金属,能改变染料颜色等性质。
碱是指在水溶液中能够产生OH-离子的物质,具有碱味,能中和酸,能腐蚀皮肤,能使红色石蕊试剂变绿等性质。
3. 解释什么是化学反应,并提供一个例子。
化学反应是指物质由一种或多种物质转变为其他物质的过程。
例如,氢气与氧气反应生成水分子,化学方程式为2H2 + O2 → 2H2O。
四、计算题1. 计算化学方程式2H2 + O2 → 2H2O中氧化氢(H2)和氧气(O2)的摩尔比。
根据化学方程式,2 mol H2需要1 mol O2,所以氢气(H2)和氧气(O2)的摩尔比为2:1。
2. 已知反应式2H2 + O2 → 2H2O,如果有4 mol氧气参与反应,请计算生成多少摩尔的水分子?根据化学方程式,2 mol氧气生成2 mol水分子,所以4 mol氧气生成4 mol水分子。
初三化学练习题附答案

初三化学练习题附答案一、选择题1. 原子核外电子在化学反应中起到()作用。
A. 构成化学键的作用B. 构成共价键的作用C. 构成离子键的作用D. 平衡化学方程式的作用2. 化学反应时,电子的转移是由()完成的。
A. 电子云B. 共价键C. 离子键D. 化学键3. 电子云是由()组成的。
A. 电子B. 质子和中子C. 像云一样的物质D. 原子核外电子4. 简化的分子结构式表示()。
A. 分子中的原子个数B. 分子的大小C. 分子中原子的种类和相对位置D. 分子中原子的核外电子5. 溶液中,具有酸性的溶质的例子是()。
A. 醋酸B. 苏打粉C. 酒精D. 食盐6. 溶液中,具有碱性的溶质的例子是()。
A. 醋酸B. 苏打粉C. 酒精D. 食盐7. 酸的氨基酸是指()。
A. 具有酸性的氨基酸B. 具有碱性的氨基酸C. 具有中性的氨基酸D. 不属于氨基酸的酸8. 碱的氨基酸是指()。
A. 具有酸性的氨基酸B. 具有碱性的氨基酸C. 具有中性的氨基酸D. 不属于氨基酸的碱9. 金属反应时,它们的外层电子会()。
A. 在离子键中进行电子转移B. 在共价键中进行电子转移C. 在电子云中进行电子转移D. 在自由电子中进行电子转移10. 化学反应中,反应物和生成物之间的化学键()。
A. 总是完全断裂B. 总是完全重新形成C. 可能断裂、重新形成或保持不变D. 不会发生任何改变二、填空题1. 硝酸在水中离解会产生[H+]离子,因此硝酸属于(酸/碱/盐)性溶液。
2. 乙醇在水中离解会产生[H+]离子,因此乙醇属于(酸/碱/盐)性溶液。
3. 氨水在水中离解会产生[OH-]离子,因此氨水属于(酸/碱/盐)性溶液。
4. 盐酸在水中离解会产生[H+]离子,因此盐酸属于(酸/碱/盐)性溶液。
5. 氢氧化钠在水中离解会产生[OH-]离子,因此氢氧化钠属于(酸/碱/盐)性溶液。
三、解答题1. 请写出具有酸性的食物和具有碱性的食物各三种,并说明其理由。
化学习题

第九章习题一、名词解释1有机化合物2有机化学3共价键4同分异构现象二、填空题l.按照有机化合物的碳骨架形式,可将有机物分为____、____两大类。
2.官能团是指决定有机化合物的主要____原子或原子团。
3.有机化合物之间的反应速度____,而且反应产物____,常伴有____反应发生。
4.按照反应方式可将有机反应分为,____、____、____、____、____五种类型。
三、选择题1.下列有机物中,属于开链化合物的是( )2.下列物质中,属于有机物的是( )A、CH4B、HCNC、NaHCO3D、CO3.炔烃的官能团是( )A、羟基B、醛基C、碳碳叁键D、碳碳双键4.下列物质中,容易燃烧的是( )A、KCIB、无水酒精C、HNO3D、金属Cu5.下列物质中,不容易变质的是( )A、维生素片剂B、抗生素片剂C、油脂D、大理石四、筒答题1、筒述有机化合物的特性。
2、简述有机化合物的结构特点。
五、指出下列化合物所属类别及所含的官能团的名字1、CH3CH2OCH2CH32、CH3CH2OH3、CH3CH2CHO4、CH3CH2CH2NH25、CH3CH2CH2COOH、6、CH3—CH2—CH2—CH=CH2第十章习题一、名词解释1、同系物2、取代反应3、加成反应二、填空题1、烷烃的分子通式为;烯烃的分子通式为;炔烃的分子通式为。
2、苯和苯的同系物的分子通式为。
3、分子中台有________的链烃称为烯烃;分子中合有的链烃称为炔烃,最简单的烯烃是;最简单的炔烃是。
三、选择题1、不能使酸性高锰酸钾溶液褪色的是( )A、乙烯B、乙炔C、苯D、甲苯2、下列化合物中同时含有伯、仲、叔、季碳厚子的是( )A、正丁烷B、异丁烷C、新戊烷D、2,2,d三甲基戊烷3、既能用酸性高锰酸钾溶液鉴别,又能用溴的四氯化碳溶液鉴别的一组物质是( )A、苯与甲苯B、己烷与苯C、乙烯与乙炔D、乙烯与乙烷4、关于苯的下列说法中不正确的是( )A、苯不能发生取代反应和加成反应B、苯环中6个碳碳键键长完全相同C、苯环中碳碳键的键能介于C-C和C=C之间D、组成苯的12个原子在同一平面上5、下列物质中,没有固定沸点的是( )A、苯B、石油C、煤油D、氯仿6、在相同条件下,下列哪种燃料产生的污染程度最低( )A、沼气B、石油C、煤D、木柴7、下列分子武表示烯烃的是( )A、C4H8B、C6H6C、C6H14D、C7H88、下列物质能与硝酸银的氨溶液反应生成白色沉淀的是( )A、乙醇B、乙烯C、1-丁炔D、2-丁炔9、鉴别环丙烷、丙烯与丙炔需要的试剂是( )A、AgNO3的氧溶液;KMnO4溶液B、HgSO4/H2SO4;KMnO4溶液C、Br2的CC14溶液;KMnO4溶液D、AgNO3的氨溶液10、下列不属于有机化合物的为( )A、乙烷B、碳酸C、乙烯D、乙醇四、用系统命名法命名下列化合物或根据名称写出结构式1、2、3、4、5、2-甲基-3-乙基戊烷6、环己烷7、甲苯8、对二甲苯9、4-甲基-2-已烯10、硝基苯五、完成下列反应方程式1、CH3-CH=CH2+Br2→2、CH3-CH2-CH=CH2+HI→3、4、5、六、用化学方法鉴别下列各组化台物1、l-丁炔和2-丁炔2、苯和甲苯3、乙烷、乙烯、乙炔七、分子式为C4H6的化合物,能使高锰酸钾溶液褪色,而且能与硝酸银的氨溶液发反应,试写出该化合物的结构式。
普通化学习题参考答案

习题参考答案习题一一、判断题对的,在括号内填“√”,错的填“×” 1. )g (O 21)g (H 22+===O(l)H 2和)g (O )g (2H 22+===O(l)2H 2的Θ∆m r H 相同; × 2. 功和热是在系统和环境之间的两种能量传递方式,在系统内部不讨论功和热;√3. 反应的H ∆就是反应的热效应; ×4. Fes 和)l (Cl 2的Θ∆m r H 都为零; ×5. 盖斯定律认为化学反应的热效应与途径无关,是因为反应处在可逆条件下进行的缘故; ×6. 同一系统不同状态可能有相同的热力学能; ×7. 由于H ∆=p q ,H 是状态函数,H ∆的数值只与系统的始、终态有关,而与变化的过程无关,故p q 也是状态函数; ×8. 由于3CaCO 固体的分解反应是吸热的,故它的标准摩尔生成焓是负值; ×9. 当热量由系统传递给环境时,系统的内能必然减少; ×10. 因为q ,w 不是系统所具有的性质,而与过程有关,所以热力学过程中w q +的值也应由具体的过程决定; ×二、选择题将正确的答案的标号填入空格内1. 对于封闭体系,体系与环境间 BA. 既有物质交换,又有能量交换B. 没有物质交换,只有能量交换C. 既没物质交换,又没能量交换D. 没有能量交换,只有物质交换2. 热力学第一定律的数学表达式w q U +=∆只适用于 CA. 理想气体B. 孤立体系C. 封闭体系D. 敞开体系3. 环境对系统作10kJ 的功,且系统又从环境获得5kJ 的热量,问系统内能变化是多少 DA. 15-kJB. 5-kJC. +5kJD. +15kJ4. 已知2PbSs + 3)g (O 2=== 2PbOs + 2)g (SO 2的Θ∆m r H =4.843-1mol kJ -⋅,则该反应的V q 值是多少1mol kJ -⋅ DA. B. C. 9.845- D. 9.840-5. 通常,反应热的精确实验数据是通过测定反应或过程的哪个物理量而获得的;DA. H ∆B. V p ∆C. p qD. V q6. 下列对于功和热的描述中,正确的是哪个 AA. 都是途径函数,无确定的变化途径就无确定的数值B. 都是途径函数,对应于某一状态有一确定值C. 都是状态函数,变化量与途径无关D. 都是状态函数,始终态确定,其值也确定7. 在温度T 的标准状态下,若已知反应A→2B 的标准摩尔反应焓Θ∆1,m r H ,与反应2A→C 的标准摩尔反应焓Θ∆2,m r H ,则反应C→4B 的标准摩尔反应焓Θ∆3,m r H 与Θ∆1,m r H 及Θ∆2,m r H 的关系为Θ∆3,m r H = DA. ΘΘ∆+∆2,1,2m r m r H HB. ΘΘ∆-∆2,1,2m r m r H HC. ΘΘ∆+∆2,1,m r m r H HD. ΘΘ∆-∆2,1,2m r m r H H8. 对于热力学可逆过程,下列叙述不正确的是哪个 CA. 变化速率无限小的过程B. 可做最大功的过程C. 循环过程D. 能使系统与环境都完全复原的过程9. 下述说法中,不正确的是哪个 DA. 焓只有在某种特定条件下,才与系统吸热相等B. 焓是人为定义的一种具有能量量纲的热力学量C. 焓是状态函数D. 焓是系统能与环境进行热交换的能量10. 封闭系统经过一循环过程后,其下列哪组参数是正确的 CA. q =0,w =0,U ∆=0,H ∆=0B. q ≠0,w ≠0,U ∆=0,H ∆=qC. q =w -,U ∆=w q +,H ∆=0D. q ≠w ,U ∆=w q +,H ∆=011. 以下说法正确的是哪个 BA. 状态函数都具有加和性B. 系统的状态发生改变时,至少有一个状态函数发生了改变C. 因为V q =U ∆,p q =H ∆,所以恒容或恒压条件下,q 都是状态函数D. 虽然某系统分别经过可逆过程和不可逆过程都可达到相同的状态,但不可逆过程的熵变值不等于可逆过程的熵变值;12. 盖斯定律反映了 BA. 功是状态函数B. H ∆取决于反应体系的始终态,而与途径无关;C. 热是状态函数D. H ∆取决于反应体系的始终态,也与途径有关;13. 298K 时,下列各物质的Θ∆m f H 等于零的是哪个 AA. 石墨B. 金刚石C. 溴气D. 甲烷14. 在下列反应中,进行l mol 反应时放出热量最大的是哪个 CA. )g (O 2)l (CH 24+===O(g)H 2)g (CO 22+B. )g (O 2)g (CH 24+===O(g)H 2)g (CO 22+C. )g (O 2)g (CH 24+===O(l)H 2)g (CO 22+D. )g (O 23)g (CH 24+===O(l)H 2)g (CO 2+15. 下列反应中Θ∆m r H 等于产物Θ∆m f H 的是 D A. CO 2g + CaOs === CaCO 3s B. HI(g)(g)I 21(g)H 2122===+ C. H 2g + Cl 2g === 2HClg D. O(g)H (g)O 21(g)H 222===+ 三、计算及问答题1.试计算下列情况的热力学能变化:1 系统吸收热量500J,对环境作功400J ;解:J w q U 100)400()500(=-++=+=∆2 系统吸收热量500J,环境对系统作功800J;解:J w q U 1300)800()500(=+++=+=∆2. 在和100kPa 下,由1mol 水汽化变成1mol 水蒸气,此气化过程中系统吸热kJ ;求: 1 系统膨胀对外作功w =液体水体积可忽略不计2 此过程内能改变U ∆=解:113)(.10.315.37310314.81---=⨯⨯⨯-=-=∑mol kJ RT w Bg B ν213)(.53.3715.37310314.8163.40--=⨯⨯⨯-=-==∆∑mol kJ RT q q U Bg B p v ν3.反应N 2g+3H 2g === 2NH 3g 在恒容量热器中进行,生成2mol NH 3时放热,求反应的)K 15.298(Θ∆m r U 和298K 时反应的)K 15.298(Θ∆mr H ; 解:kJ q U v mr 7.82-==∆Θ 4. 已知100kPa ,18℃时1mol Zn 溶于稀盐酸时放出kJ 的热,反应析出1mol 2H 气;求反应过程的w ,U ∆,H ∆;解:)()()()(2g H aq ZnCl aq HCl s Zn +===+5. 在下列反应或过程中,V q 与p q 有区别吗简单说明;并根据所列的各反应条件,计算发生下列变化时,各自U ∆与H ∆之间的能量差值;1 HS(s)NH 4−−→−C25o S(g)H )g (NH 23+,mol HS(s)NH 4的分解; 2 (g)Cl (g)H 22+−−→−C 25o )g (2HCl ,生成mol )g (HCl ; 3 (s)CO 2−−→−C 25o )g (CO 2,mol (s)CO 2干冰的升华; 4 NaCl(aq)(aq)AgNO 3+−−→−C25o (aq)NaNO )AgCl(s 3+,沉淀出mol )AgCl(s ; 解:113,.96.429810314.8)11(2---=⨯⨯⨯+⨯-=-=∆-∆∑mol kJ RT H U Bg B νξ2无体积变化,H U ∆=∆3 13,.39.1229810314.815---=⨯⨯⨯⨯-=-=∆-∆∑mol kJ RT H U Bg B νξ4 无体积变化,H U ∆=∆6. 计算下列反应的1 )K 15.298(Θ∆m r H ;2 )K 15.298(Θ∆mr U 和3 K 进行l mol 反应时的体积功体w ;)g (Cl 4)g (CH 24+===)g (HCl 4)l (CCl 4+解::./)15.298(1-Θ∆mol kJ K H m f 011.86.429)81.74(0)44.135()307.92(4)15.298(-ΘΘ-=----+-⨯=∆=∆∑mol kJ H K H m Bf B mr ν 2RT K H K U Bg B m r mr ∑-∆=∆ΘΘ,)15.298()15.298(ν =4-4-113.38.42715.29810314.8---=⨯⨯⨯mol kJ313g ,.479.215.29810314.8)144(--=⨯⨯⨯---=-=∑mol kJ RT w BB ν体7. 葡萄糖完全燃烧的热化学反应方程式为)g (O 6)s (O H C 26126+===O(l)H 6)g (CO 622+,Θ∆m r H =2820-1mol kJ -⋅当葡萄糖在人体内氧化时,上述反应热约30%可用做肌肉的活动能量;试估计一食匙葡萄糖 g 在人体内氧化时,可获得盼肌肉活动的能量;解:1.16.180-=mol g M 葡萄糖8. 已知下列热化学方程式:)g (CO 3)s (O Fe 32+===)g (CO 3)s (Fe 22+,Θ∆1m r H =6.27-1mol kJ -⋅)g (CO )s (O 3Fe 32+===)g (CO )s (O Fe 2243+,Θ∆2m r H =6.58-1mol kJ -⋅)g (CO )s (O Fe 43+===)g (CO )s (3FeO 2+,Θ∆3m r H =1.381mol kJ -⋅不用查表,试计算下列反应的Θ∆4m r H ;)g (CO )s (FeO +===)g (CO )s (Fe 2+ 解:13,2,1,4,.7.16623-ΘΘΘΘ-=∆-∆-H ∆=H ∆mol kJ H H m r m r m r m r 9. 利用附录3数据,计算下列反应的)K 15.298(Θ∆mr H ; 1 )aq (H 2)s (Zn ++===)g (H )aq (Zn 22++2 O(l)H )s (CaO 2+===)aq (OH 2)aq (Ca 2-++解:1)15.298()15.298(,K H K H B m f BB m r ΘΘ∆=∆∑ν-12)15.298()15.298(,K H K H B m f BB m r ΘΘ∆=∆∑ν10. 已知在25℃和标准状态下,铝燃烧生成Al 2O 3s 放热,求Al 2O 3s 的Θ∆m f H 298K;解:11132.68.1669.92.30.272)298,(---Θ-=⨯⨯-=∆mol kJ g kJ mol g K O Al H m f11. 用来焊接金属的铝热反应涉及32O Fe 被金属Al 还原的反应:)s (O Fe )s (Al 232+−→−)s (Fe 2)s (O Al 32+,试计算:1 298K 时该反应的Θ∆m r H ;2 在此反应中若用铝,问能释放出多少热量解:1)15.298()15.298(,K H K H B m f BB m r ΘΘ∆=∆∑ν=1.5.85102)2.824()7.1675(02--=⨯----+⨯mol kJ21.19.4210)5.851(2720.267)298(-Θ-=-⨯⨯=∆⨯=mol kJ K H q m r ξ 12. 已知)l (H N 42、42O N g 和O H 2l 在时的标准摩尔生成焓分别是1mol kJ -⋅、1mol kJ -⋅和80.285-1mol kJ -⋅,计算火箭燃料联氮和氧化剂四氧化二氮反应:)g (O N )l (H 2N 4242+===O(l)H 4)g (N 322+1 反应的标准摩尔反应焓变Θ∆m r H =2 计算32 g 液态联氮完全氧化时所放出的热量为多少解:1 )15.298()15.298(,K H K H B m f BB m r ΘΘ∆=∆∑ν 2 1.06.627)12.1254(32232)298(-Θ--=-⨯⨯=∆⨯=mol kJ K H q m r ξ 13. 试通过计算说明下列甲烷燃烧反应在进行1mol 反应进度时,在定压和定容条件燃烧热之差别,并说明差别之原因;CH 4g + 2O 2g === CO 2 g + 2H 2Ol解:13,.96.415.29810314.8)121(1--=⨯⨯⨯--⨯-=-=∆-∆∑mol kJ RT H U Bg B νξ原因:0,≠∑Bg B ν14. 辛烷188H C 是汽油的主要成分,试计算298K 时,100g 辛烷完全燃烧时放出的热量; 解:)(9)(8)(225)(222188l O H g CO g O l H C +===+ 15. 通过吸收气体中含有的少量乙醇可使722O Cr K 酸性溶液变色从橙红色变为绿色,以检验汽车驾驶员是否酒后驾车违反交通规则;其化学反应可表示为)l (OH H C 3)aq (H 16)aq (O Cr 252272+++-===COOH(l)3CH O(l)H 11)aq (Cr 4323+++试利用标准摩尔生成焓数据求该反应的)K 15.298(Θ∆mr H ; 解:∑ΘΘH ∆=∆Bm f B m r K K H )15.298()15.298(ν=)69.277(3016)3.1490(2)1.1999(4)83.285(11)5.484(3-⨯-⨯--⨯--⨯+-⨯+-⨯=--1mol kJ •习题二一、判断题对的在括号内填“√”,错的在括号内填“×”1. S r ∆为正值的反应均是自发反应; ×2. 反应产物的分子数比反应物多,该反应的S ∆>0; ×3. Θ∆m r G <0的反应一定是自发进行的; ×4. 稳定单质的Θ∆m f H 和Θ∆m f G 都为0,因此其标准熵ΘS 也为0; ×5. 如果一个反应的Θ∆m r H >0,Θ∆m r S <0,则此反应在任何温度下都是非自发的;√6. 升高温度,反应的ΘT K 增大,则说明该反应为吸热反应; √7. 对于全部是气体反应的系统,当达到平衡时,恒容加入惰性气体后平衡不发生移动; √8. 在一定温度和浓度下,无论使用催化剂与否,只要反应达到平衡时,反应物与产物的浓度为一定值; √9. 反应的级数取决于反应方程式中反应物的化学计量数绝对值; ×10. 催化剂能改变反应历程,降低反应的活化能,但不能改变反应的Θ∆m r G ; √11. 反应速率只取决于温度,而与反应物或生成物的浓度无关; ×12. 对于可逆反应:O(g)H )s (C 2+)g (H )g (CO 2+,Θ∆m r H >0,升高温度使正v 增大,逆v 减小,故平衡向右移动; ×13. 根据分子碰撞理论,具有一定能量的分子在一定方位上发生有效碰撞,才可能生成产物; √14. 活化能的大小不一定能表示一个反应的快慢,但可以表示一个反应受温度的影响是显着还是不显着; √15. 在一定温度下,对于某化学反应,随着反应的进行,反应速率逐渐减慢,反应速率常数逐渐变小; ×二、选择题将正确的答案的标号填入空格内1. 下列体系变化过程中熵值减少的是哪个 CA. 食盐溶于水B. 干冰升华C. 活性炭吸附氧气D. 高锰酸钾受热分解2. 等温等压下且不做非体积功条件下,反应自发进行的判据是哪个 CA. Θ∆H <0B. Θ∆S <0C. G r ∆<0D. Θ∆m r G <03. 下列反应中Θ∆m r G 等于产物Θ∆m f G 的是哪个 CA. )aq (Cl )aq (Ag -++−→−)s (AgClB. )g (Cl )s (Ag 22+−→−)s (2AgClC. )g (Cl 21)s (Ag 2+−→−)s (AgClD. )l (Cl 21)s (Ag 2+−→−)s (AgCl 4. 某温度时,反应)g (Br )g (H 22+===)g (HBr 2的标准平衡常数ΘK =2104-⨯,则反应)g (HBr ===)g (Br 21)g (H 212+的标准平衡常数ΘK 等于多少 B A. 21041-⨯ B. 21041-⨯ C. 2104-⨯ D. 2104-⨯ 5. 反应 H 2 g+Br 2 g2HBrg 在800K 时平衡常数K θ=×105,1000K 时平衡常数K θ=×103,则此反应是: BA. 吸热反应B. 放热反应C. 无热效应的反应D. 无法确定6. 升高温度可以增加反应速率,最主要是因为什么 BA. 增加了分子总数B. 增加了活化分子的百分数C. 降低了反应的活化能D. 促使平衡向吸热方向移动7. 在恒温下仅增加反应物浓度,化学反应速率加快的原因是什么 DA. 化学反应速率常数增大B. 反应物的活化分子百分数增加C. 反应的活化能下降D. 反应物的活化分子数目增加8. 温度升高而一定增大的量是下列哪个 BA. Θ∆m r GB. 吸热反应的平衡常数ΘKC. 反应的速率vD. 反应的速率常数k9. 一个化学反应达到平衡时,下列说法中正确的是哪个 AA. 各物质的浓度或分压不随时间而变化B. Θ∆m r G =0C. 正、逆反应的速率常数相等D. 如果寻找到该反应的高效催化剂,可提高其平衡转化率10. 某基元反应)g (B )g (A 2+===)g (C ,将2mol )g (A 和1mol )g (B 放在1L 容器中混合,问A 与B 开始反应的反应速率是A,B 都消耗一半时反应速率的多少倍 CA. B. 4 C. 8 D. 111. 当反应22B A +===A B 2的反应速率方程式为v =22B A c kc ⋅时,则此反应为什么反应 CA. 一定是基元反应B. 一定是非基元反应C. 无法肯定是否是基元反应D. 对A 来说是个二级反应12. 升高温度时,化学反应速率增加倍数较多的是下列哪种反应 CA. 吸热反应B. 放热反应C. a E 较大的反应D. a E 较小的反应13. 对于反应速率常数,以下说法正确的是哪个 DA. 某反应的Θ∆m r G 越小,表明该反应的反应速率常数越大B. 一个反应的反应速率常数可通过改变温度、浓度、总压力和催化剂来改变C. 一个反应的反应速率常数在任何条件下都是常数D. 以上说法都不对14. 对于催化剂特性的描述,不正确的是下列哪个 BA. 催化剂只能缩短反应达到平衡的时间而不能改变平衡状态B. 催化剂在反应前后其化学性质和物理性质皆不变C. 催化剂不能改变平衡常数D. 加入催化剂不能实现热力学上不可能进行的反应15. 若有两个基元反应,均属B 2A +−→−C 型,且第一个反应的反应速率常数1k 大于第二个反应速率常数2k ,忽略频率因子不同的影响,则这两个反应的活化能1a E 与2a E 的关系与下列哪一种相符 DA. 1a E >2a EB. 1a E <2a EC. 1a E =2a ED. 不能确定三、计算及问答题1. 不用查表,将下列物质按其标准熵)K 15.298(ΘmS 值由大到小的顺序排列,并简单说明理由;1)s (K ;2)s (Na ;3)l (Br 2;4)g (Br 2;5)s (KCl ;解:4)g (Br 2 3)l (Br 2 5)s (KCl 1)s (K 2)s (Na理由:一般相对分子质量相近时气态的大于液态的;液体的大于固体物质的;而当温度和聚集态相同时,分子或晶体结构较复杂的物质的熵大,原子序数大的大于小的;2. 分析下列反应的熵值是增加还是减少,并说明理由;1)s (I 2−→−)g (I 2;2O(l)H 2−→−)g (O 21)g (H 22+; 3)g (O )g (CO 22+−→−)g (CO 22;4)g (B )s (A 22+−→−)g (AB 2; 解:1增加:气态大于固态2增加:气态大于液态3减少:气体分子数减少4增加:气体分子数增多3.试用书末附录3中的标准热力学数据,计算下列反应的)K 15.298(Θ∆mr S 和)K 15.298(Θ∆m r G ;1O(l)4H Fe(s)32+===)g (H 4)s (O Fe 243+;2)aq (H 2)s (Zn ++===)g (H )aq (Zn 22++;3O(l)H )s (CaO 2+===)aq (OH 2)aq (Ca 2-++;4 AgBrs ===)l (Br 21)s (Ag +; 解:)15.298()15.298(,K S K S B m BB m r ΘΘ∑=∆ν1 )K 15.298(Θ∆m r S =11K mol J --⋅⋅ )K 15.298(Θ∆m f G =-1mol kJ -⋅2 )K 15.298(Θ∆m r S =-11K mol J --⋅⋅ )K 15.298(Θ∆m f G =-1mol kJ -⋅3 )K 15.298(Θ∆m r S =-11K mol J --⋅⋅ )K 15.298(Θ∆m f G =-1mol kJ -⋅4 )K 15.298(Θ∆m r S =-11K mol J --⋅⋅ )K 15.298(Θ∆m f G =1mol kJ -⋅4. 试分析下列反应自发进行的温度条件:1)g (CO 2)g (NO 2+−→−)g (CO 2)g (N 22+,Θ∆m r H =5.746-1mol kJ -⋅;2)s (HgO −→−)g (O 21)l (Hg 2+,Θ∆m r H =1mol kJ -⋅; 3)g (O )g (N 222+−→−)g (O 2N 2,Θ∆m r H =1mol kJ -⋅;4)l (O H 222−→−)g (O )l (O 2H 22+,Θ∆m r H =196-1mol kJ -⋅;解:自发进行的温度条件是:0<∆-∆ΘΘm r mr S T H ∴二者同号且ΘΘΘ∆∆>>∆m r m r mr S H T S 时:0 ; ΘΘΘ∆∆<<∆m r m r m r S H T S 时:0 1=∆Θmr S 11.89.197761.2102674.197250.19174.2132---=⨯-⨯-+⨯K mol J 2 =∆Θm r S 30.10829.7002.76138.20521=-+⨯11..--K mol J 3 Θ∆m r S <0,Θ∆m r H >0,任何温度下非自发;4Θ∆m r S >0,Θ∆m r H <0,任何温度下均自发;5. 用锡石2SnO 制取金属锡,有建议可用下列几种方法:1 单独加热矿石,使之分解;2 用碳以石墨计还原矿石加热产生2CO ;3 用)g (H 2还原矿石加热产生水蒸气;今希望加热温度尽可能低一些;试利用标准热力学数据通过计算,说明采用何种方法为宜;解:1)()()(SnO 22g O s Sn s +===查表计算得:Θ∆m r S =11..--K mol J ; Θ∆m r H =1.-mol kJ2)()()(),(22g CO s Sn s SnO s C +===+石墨查表计算得:Θ∆m r S =11..--K mol J ; Θ∆m r H =1.-mol kJ3)()()()(2222g O H g SnO g H s SnO +===+查表计算得:Θ∆m r S =11..--K mol J ; Θ∆m r H =1.-mol kJ由计算可知:用氢气还原锡矿石温度最低;6. 己知下列反应:)g (H )s (S Ag 22+===S(g)H )s (Ag 22+在740K 时的ΘK =;若在该温度下,在密闭容器中将mol S Ag 2还原为银,试计算最少需用2H 的物质的量;解:设最少需要2H 的物质的量为xmol .)g (H )s (S Ag 22+===S(g)H )s (Ag 22+起始时物质的量mol : x 0 0反应后的变化量mol : 2×平衡时物质的量mol : 0 0.1-x定温定压下,分压之比等于物质的量之比,故:解得:8.3=x7. 利用标准热力学函数估算反应:)g (H )g (CO 22+===O(g)H )g (CO 2+在873 K 时的标准摩尔吉布斯函数变和标准平衡常数;若此时系统中各组分气体的分压为)CO (2p =)H (2p =127kPa ,)CO (p =)O H (2p =76kPa ,计算此条件下反应的摩尔吉布斯函数变,并判断反应进行的方向;解:1 )g (H )g (CO 22+===O(g)H )g (CO 2+2B BB mr m r p p RT T G T G ν)/(ln )()(∏ΘΘ+∆=∆ 0.3)100/127()100/76(ln 87310314.843.4)873(223-=⨯⨯⨯+=∆-K G m r 1.-mol kJ <0 故此条件下反应正向进行;8. 求化学反应)g (O )g (2SO 22+)g (2SO 3在600K 时的平衡常数ΘK ; 解: )g (O )g (2SO 22+)g (2SO 3=×/1000=1.-mol kJ9. 在308K 和总压强100kPa 时,42O N 有%分解为2NO ;1 计算反应)g (O N 42===)g (2NO 2的ΘK ;2 计算308K,总压强增加1倍时,42O N 的离解百分率;3 从计算结果说明压强对平衡移动的影响;解:1设有100mol 42O N 发生分解)g (O N 42===)g (2NO 2平衡时的物质的量mol %)2.271(100-⨯ %2.271002⨯⨯= =2当总压强为200kPa 时:设离解百分率为x %)g (O N 42===)g (2NO 2平衡时的物质的量mol %)1(100x -⨯ %1002x ⨯⨯=100-x =x 2得:6.19=x 即离解百分率为%;3增加压强,N 2O 4的离解百分率降低,即向气体分子数减少的方向移动;10. 在一定温度和压强下,某一定量的5PCl 气体体积为1L,此时5PCl 已经有50%离解为3PCl 和2Cl ,试判断在下列情况下,5PCl 的离解度是增加还是减少1 减少压强,使5PCl 的体积变为2L ;2 保持压强不变,加入氮气,使体积增加至2L ;3 保持体积不变,加入氮气,使压强增加1倍;4 保持压强不变,加入氯气,使体积变为2L ;5 保持体积不变,加入氯气,使压强增加1倍;解:1增加 2增加 3不变 4 减小 5 减小11. 研究指出下列反应在一定温度范围内为基元反应:1 写出该反应的速率方程;2 该反应的总级数是多少3 其他条件不变,如果将容器的体积增加到原来的2倍,反应速率如何变化4 如果容器体积不变而将NO 的浓度增加到原来的3倍,反应速率又将怎样变化 解:1)()(22Cl c NO kc =ν 22+1=33反应的初速率为原来的1/8倍 4反应的初速率为原来的9倍12. 对于制取水煤气的下列平衡系统:O(g)H )s (C 2+===)g (H )g (CO 2+,Θ∆m r H >0;问:1 欲使平衡向右移动,可采取哪些措施2 欲使正反应进行得较快且较完全平衡向右移动的适宜条件如何这些措施对ΘK 及)(正k 、)(逆k 的影响各如何解:1增加O(g)H 2的分压或浓度;减少)g (H )g (CO 2、的分压或浓度;减少系统总压力;升高温度 ;2使正反应进行得较快且较完全的条件有:增加温度,这使得ΘK 及)(正k 、)(逆k 均增大;增加O(g)H 2的分压或浓度,这使得ΘK 及)(正k 、)(逆k 均不变;13. 如果一反应的活化能为1mol kJ -⋅,问在什么温度时反应的速率常数'k 的值是400K 速率常数k 的值的2倍 解:'''''314.84001000)400(15.117400)400(2ln ln T T RT T Ea k k ⨯⨯⨯-⨯=-⨯== 14. 将含有3dm mol -⋅33AsO Na 和3dm mol -⋅322O S Na 的溶液与过量的稀硫酸溶液混合均匀,产生下列反应:今由实验测得在17℃时,从混合开始至溶液刚出现黄色的32S As 沉淀共需时1515s ;若将上述溶液温度升高10℃,重复上述实验,测得需时500s,试求该反应的活化能a E 值; 解:300290314.81000105001515ln ln ln ln 211212⨯⨯⨯⨯====Ea t t k k νν15. 反应)g (NO 22===)g (O )g (NO 22+是一个基元反应,正反应的活化能)(正a E 为1141mol kJ -⋅,Θ∆m r H 为1131mol kJ -⋅;1 写出正反应的反应速率方程式;2 在398K 时反应达到平衡,然后将系统温度升至598K,分别计算正、逆反应速率增加的倍数,说明平衡移动的方向;解:122)(NO kc =ν21.1113-114)((-Θ==∆-≈mol kJ H Ea Ea m r 正逆)由计算结果可知:升高温度,正反应速率增加的倍数远远大于逆反应速率增加的倍数,平衡向着正反应方向移动;这与升高温度,平衡向着吸热反应方向移动时一致的;。
化学基础知识习题

一、选择题:1. 对分子的叙述,正确的是A、分子是构成物质的惟一粒子B、由分子构成的物质,保持物质性质的是分子C、同种物质的每一个分子的化学性质都相同D、分子的大小会随着物质体积的增大而变大2 下列变化中,构成物质的分子本身发生变化的是A、糖溶于水B、衣箱中樟脑丸不久不见了C、工业上蒸发液态空气制氧气D、红磷燃烧3、分子和原子的主要区别是A. 分子是构成物质的微粒,原子不是构成物质的微粒B. 分子质量都大于原子质量C. 分子永恒运动,原子在分子中是不运动的D. 分子在化学反应中可分,原子在化学反应中不能再分4. 保持水的化学性质的粒子是A. 氢原子B. 氧分子C. 氢分子D. 水分子5. 下列物质中,肯定是由一种分子(或原子)构成的物质是A、水B、纯净物C、混合物D、糖水6. 2008年9月27日,我国航天员翟志刚进行了首次太空行走。
在此次活动中需要“人造空气”来供航天员呼吸,这种“人造空气”中含有体积分数为70%的氮气、20%以上的氧气、还有二氧化碳。
下列关于“人造空气”的说法中,不正确的是A. “人造空气”比空气中的氮气含量低B. “人造空气”中供给航天员呼吸的是氧气C. “人造空气”中的氧气和空气中的氧气化学性质相同D. 氮气对航天员呼吸没有任何作用,因此“人造空气”可以不需要氮气7.分子和原子的主要区别是()。
A.分子大、原子小B.分子的质量大,原子的质量小C.分子可直接构成物质,原子则要先构成分子后再构成物质D.在化学变化中分子可再分,原子则不能再分8.下列变化能证明分子在化学反应中可分的是()。
A.铁矿石磨成粉末B.碘受热升华C.加热水有水蒸气生成D.加热氧气汞生成汞和氧气9.下列说法中,正确的是()。
A.化学反应中,分子的种类改变,但分子的数目不变B.电解水产生氢气和氧气,所以水中含有氢气和氧气C.分子能构成物质,有些原子也能直接构成物质D.氧气是由两个氧原子构成的10.由分子参加的化学反应,反应前后一定发生变化的是()。
初三化学化学元素练习题及答案

初三化学化学元素练习题及答案一、选择题1.下列元素中,电子层数最多的是:A. 钙B. 铁C. 钠D. 铝答案:A2.在以下元素中,属于卤素的是:A. 氧B. 氯C. 铜D. 铁答案:B3.以下元素中,属于有机物主要成分的是:A. 氧B. 碳C. 铁D. 银答案:B4.下列元素中,属于惰性气体的是:A. 氦B. 氮C. 氧D. 氯答案:A5.以下元素中,属于金属的是:A. 碳B. 氯C. 铁D. 硫答案:C二、填空题1.氧的原子序数是____,原子符号是____。
答案:8,O2.氢的原子序数是____,原子符号是____。
答案:1,H3.金的原子序数是____,原子符号是____。
答案:79,Au4.氯的原子序数是____,原子符号是____。
答案:17,Cl5.铜的原子序数是____,原子符号是____。
答案:29,Cu三、判断题1.氧气是一种金属元素。
答案:错误2.铅是一种有机物。
答案:错误3.铁元素受热后会发生氧化反应。
答案:正确4.酸雨是由氧气和水反应产生的。
答案:错误5.碳是一种非金属元素。
答案:正确四、简答题1.请说明什么是化学元素?答案:化学元素是指由相同种类的原子组成的纯粹物质,它们在化学性质和物理性质上具有共同的特征。
化学元素是构成物质的基本单位,目前已经发现和确认的元素有118个。
2.请举例说明金属元素和非金属元素的区别。
答案:金属元素具有良好的导电性和导热性,常处于固态或液态,具有金属光泽和良好的延展性和塑性,例如铁、铜和铝。
而非金属元素则多呈现气态、液态或脆性固态,不具备金属的光泽和导电性,例如氧、氮和碳。
3.有机物和无机物有何区别?答案:有机物主要由碳元素组成,常见的有机物包括糖、脂肪和蛋白质,它们通常是生命体系的重要组成部分。
无机物则是除了有机物以外的所有物质,包括无机酸、无机盐和一些金属化合物等。
无机物通常不参与生命活动,但在地球化学循环和工业生产中具有重要作用。
五、解答题1.请写出氧元素的化学符号、原子序数和原子量,并描述其在自然界中的存在形式和应用领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章热化学能源选择题:下列情况中属于封闭体系的是()1)氢气在盛有氯气的密闭绝热容器中燃烧2)反应N2O4(g)⎛ 2NO2(g)在密闭容器中进行。
3)氢氧化钠与盐酸在烧杯中的反应4)用水壶烧开水是非题:1)聚集状态相同的物质混在一起,一定是单相体系。
2)系统内相界面越多,则相越多。
思考题:1)高炉炼铁反应中,FeO(s)+CO(g)⎛Fe(s)+CO2(g) ,问该系统中共有几相?2)密闭容器中,反应2Fe2O3(s)+3C(s) ⎛4Fe(s)+3CO2(g) 达到平衡时,该体系中,有()相。
3) 气态、液态、固态与气相、液相,固态的区别?第二章化学反应的基本原理第一节化学反应的方向和吉布斯函数变判断题1)某化学反应的ΔrGmθ>0,此反应是不能发生。
2)在标准状态下,任何纯净物质的标准生成吉布斯函数变ΔfGmθ等于零。
3)298K时稳定态的单质,其标准摩尔熵的值为零。
4)对于一个反应来说,当温度发生改变,通常对ΔH和ΔS影响较小,而对ΔG值则影响较大。
5)对于一个反应,如果ΔHθ>ΔGθ,则该反应必是熵值增大的反应。
6)在一定的条件下,一定量的纯铁与碳钢相比,S(纯铁)>S(碳钢)。
7)两个体积相同,温度相等的球形容器中,装有同一种气体,当连接两容器的活塞打开时,ΔS为零。
8)1mol、100℃,101325Pa下的水变成同温同压下的水蒸汽,该过程的ΔU=0 。
9)100℃,101325Pa的水,变成同温同压下的水汽,该过程的ΔG <0。
10)系统反应过程熵值增加,有利于自发进行。
第三节化学反应的速率判断题:1)平衡常数Kθ值可直接由反应的ΔG值求得。
2)反应的平衡常数越大,反应速率就越大。
3)反应级数取决于反应方程式中反应物的计量系数。
4)在常温常压下,空气中的N2和O2长期存在而不化合,这表示此时该反应的ΔrG为负。
5)已知某反应2A(g)+B(g)=2C(g)的ΔH<0,升高温度,使V逆增大,V正减小,将导致平衡向左移动。
6)若反应的ΔGθ值越大,则一定温度下的标准平衡常数Kθ也就越大。
7)可逆反应C(s) + H20(g) = CO(g)+ H2(g)的ΔrHθ=121kJ/mol。
由于化学方程式两边物质的计量系数总和相等,所以增加总压力对平衡无影响。
8)某反应的ΔG>0,正向不自发,加催化剂后降低了反应的活化能,则正向可自发。
9)标准平衡常数就是化学反应在标准条件下达平衡时的反应商。
10)某给定的反应,只要温度不变则Kθ不变,浓度或压力的改变,不影响Kθ值。
11)反应物浓度增大,则反应速率加快,所以反应速率常数增大。
12)根据化学反应的速率表达式,某些反应的反应速率与反应物的浓度无关。
13)温度升高,反应速率加快,从而使反应速率常数增大。
14)某反应是放热反应,升高温度不利于反应的进行,因此反应速率会大大减慢选择题:1)某温度时,反应H2(g)+ Cl2(g) = 2HCl(g)的K1θ为4×10-2,则反应HCl(g) = 1/2 H2(g)+1/2Cl2(g)的K2θ为()A)1/(4×10-2 ) B) 4×10-2C)(4×10-2) -1/2。
D) (4×10-2)22) 反应NO(g)+CO(g)= ½N2(g)+CO2(g)的ΔrHθ=-370.0kJ/mol.若欲提高NO(g)和CO(g)的转化率,可采取的方法为()A) 高温高压B) 低温低压C) 低温高压。
D) 低压高温3)判断下列反应CH4(g)+ 2O2(g)= CO2(g)+2H2O(l)的熵变( )A)增大B)不变。
C)变小D)无法判断4) 若A反应的速率大于B反应的速率则其反应热效应的关系为()A)ΔrHθ(A)< ΔrHθ(B) B)ΔrHθ(A) =ΔrHθ(B)C) ΔrHθ(A)> ΔrHθ(B) D) 不能确定。
5)判断下列反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的熵变)A)增大B)不变。
C)变小D)无法判断6)已知下列反应用2A(g)+ B(g) 2C(g)则va:vb:vc=( )A)2:1:2 B)1:2:1C)1:1:1 。
D)不能确定选择题:1)已知2NO(g)+O2(g)= 2NO2(g)是个基元反应,则vNO= ( )A)vO2。
B)1/2vO2 C)2vO2 D)无法确定2)对于下列基元反应A+2B→C,其速率常数为k,若某一时刻(时间为秒),A的浓度为2mol/L,B的浓度为3mol/L ,则反应速率为: A)6k mol/L.s B)12k mol/L.s C)18k mol/L.s 。
D)36k mol/L.s3)已知2NO(g)+Br2(g)= 2NOBr(g)为基元反应,在一定温度下,当总体积扩大一倍时,正反应速度为原来的( )A)4倍B)2倍C)8倍D)1/8倍。
4)三级反应的反应速率系数单位为()A)dm6.mol-2.s-2 B)dm6.mol2.s-2C)dm3.mol-1.s-1 D)dm6.mol-2.s-1。
5)在800度时,CaO(s)+CO2(g)=CaCO3(s),其Kθ=277pθ,此时CO2的分压PCO2为( )A)277 B)2771/2 C)1/277。
D)27726)对某一化学反应,随着反应的进行将发生下列哪项变化?()A)反应速率降低;B)速率常数变小C)平衡常数变小D)不好确定7)质量作用定律适用于()A)反应物和产物系数均为1的反应B)一步完成的简单反应。
C)任何实际能进行的简单反应D)所有反应8)关于反应速率方程表达式说法正确的是()A)质量作用定律可以用反应物的分压表示B)反应速率方程表达式中幂次之和为反应级数。
C)速率方程式中幂次出现分数的反应肯定不是基元反应D)凡化学反应速率方程表达式与质量定律的书写方式相符的反应必为基元反应.选择题:1)有三个反应,其Ea(kj/mol)分别为:a反应320,b反应40,c反应为80,当温度升高时,以上反应速度增加倍数的大小顺序为()A) a>c>b B) a>b>c C) b>c>a D)c>b>a2)有两个基元反应,均属A+2B→C型,且第一个反应的速度常数k1大于第二个反应的速率常数k2,则这两个反应的活化能Ea1与Ea2的关系与下列哪一项相符()A)Ea1 >Ea2 B)Ea1< Ea2C)Ea1= Ea2 D)不能确定3) 已知某反应的Ea正1 >Ea逆,则有()A)ΔrHmθ<0 B)ΔrHmθ>0C)ΔrHm <0 D)ΔrHm>04) 在反应活化能测定实验中,对某一反应通过实验测得有关数据,按lgk与1/T作图,所得直线的斜率为()A)-Ea/2.303R . B)-Ea/RC)-2.303 Ea/R D)Ea/2.303R5) 下列几种反应条件的改变中,不能引起反应速率常数改变的变化是()A)改变反应体系的温度B)改变反应体系使用的催化剂C)改变反应物的浓度。
D)改变反应的途径6) 对于阿仑尼乌斯公式,下列说法正确的是()A)阿仑尼乌斯公式适合一切化学反应。
B)可以利用阿仑尼乌斯计算反应的ΔrHmθC)阿仑尼乌斯公式适用于具有明确反应级数和速率常数的所有反应。
D)阿仑尼乌斯公式适用于气相中的复杂反应。
7) 在反应活化能测定实验中,对某一反应通过实验测得有关数据,按lgk与1/T作图,所得直线的斜率为-3655.9,该反应的活化能E=()A)76 kj/mol B)70 kj/mol.C)80 kj/mol D)86 kj/mol8) 有两个基元反应,均属A+B C型,且第一个反应的速度常数k1大于第二个反应的速度常数k2,则这两个反应的活化能Ea1与Ea2的关系为()A)Ea1> Ea2 B)Ea1< Ea2 .C)Ea1= Ea2 D)不能确定判断题:1)下列关于催化剂的说法正确的是()A)不改变反应的ΔG,可改变反应的ΔHΔUΔSB)不改变反应的ΔGΔS,可改变反应ΔHΔUC)不改变反应的ΔHΔUΔS,可改变反应ΔGD)不改变反应的ΔG ΔS ΔH ΔU。
2)下列几种反应条件的改变中,不能引起反应速率常数变化的是()A)改变反应体系的温度B)改变反应体系所使用的催化剂C)改变反应物的浓度D)改变反应的途径。
3)升高温度可以增加反应的速率,主要原因是()A)增加分子总数。
B)增加活化分子百分数C)降低反应的活化能D)使平衡向吸热方向移动4)已知某物质A通过平行反应生成B和C两种产物,若要提高B的产率同时降低C的产率,则可采取()A)改变反应体系的温度B)增加产物C的浓度C)选择某种催化剂D)增加反应物A的浓度5) 在25度、101325 Pa 下: O3(g)+ NO(g) → O2(g)+NO2(g)反应的活化能是10.7kJ/mol ,ΔrHm θ=-193.8kJ/mol ,则逆反应的活化能为( )A )204.5.B )342C )684D )114第三章 水化学 水污染第二节 水溶液中的单相离子平衡例3.1 计算0.100mol/dm3 HAc 溶液中的H+(aq)浓度及其pH 值解:从附录5查得HAc 的Ka=1.76 ×10-5.方法1 设H+(aq)的平衡浓度为 x mol/dm3,则3352531033.1)( 1033.1 1076.1100.0 100.0100.0, 1076.1100.0)()()( )(mol/dm xx x -0100 )()()( -+----+-+⨯≈⨯≈⨯≈≈-⨯=-⋅=⋅=+==H c x x x Ka xx x HAc c Ac c H c Ka aq Ac aq H aq HAc eq eq eq eq 所以很小由于平衡浓度5.12)10-lg(7.5pH /105.7100.01065.5)(.1065.5(aq)NH)aq (H (aq)NH )aq (NH .NH ,Cl :.pH H Cl 0.100NH : 2.88)10-lg(1.33pH /1033.1100.01076.1)(6-3610104344-43-335=⨯≈⨯≈⨯⨯=⋅≈∴⨯=+⇔=⨯≈⨯≈⨯⨯=⋅≈---+++++--+dm m ol c Ka aq c Ka dm m ol c Ka H c eq eq 的查得的解离平衡只考虑在溶液中可认为中性解值浓度及溶液中的求例得方法2.直接用公式.例3.2 (1)计算含0.100mol/dm3HAc,0.100mol/dm3NaAc 的缓冲溶液水合H+浓度,pH 值和HAc 的解离度。
