2020-2021备战高考化学知识点过关培优训练∶高无机综合推断及答案
2020-2021备战高考化学知识点过关培优训练∶高无机综合推断附详细答案

2020-2021备战高考化学知识点过关培优训练∶高无机综合推断附详细答案一、无机综合推断1.固体X由四种元素组成,为探究其组成和性质,设计并完成如下实验:(1)固体X中含有H、O、______和______元素。
(2)写出固体X受热分解的化学方程式______。
(3)取少量固体B溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子方程式______。
【答案】C Cu Cu3(OH)2(CO3)23CuO+H2O+2CO2↑ 2Cu2++4I-=2CuI↓+I2【解析】【分析】由固体隔绝空气加热生成1.8g水可知,含H原子的物质的量n=1.8g/18g∙mol-1×2=0.2mol,质量为0.2g;气体A与石灰水反应生成白色沉淀为碳酸钙,其物质的量n=20.0g/100g∙mol-1=0.2mol,所以碳原子的物质的质量为m=0.2mol×12g/mol=2.4g;固体B与CO反应生成紫红色固体为Cu,则B为CuO,其物质的量为24.0g/80g∙mol-1=0.3mol,所以铜的质量为m=0.3mol×64g/mol=19.6g;剩余质量为34.6g-0.2g-2.4g-19.6g=12.4g,所以X中含O为n=12.4g/16g∙mol-1=0.8mol,则n(Cu):n(C):n (H):n(O)=3:2:2:8,X为Cu3(OH)2(CO3)2,以此来解答。
【详解】(1)由上述分析可知,固体X中含有H、O、C、Cu元素,故答案为:C;Cu;(2)固体X受热分解的化学方程式为Cu3(OH)2(CO3)23CuO+H2O+2CO2↑,故答案为:Cu3(OH)2(CO3)23CuO+H2O+2CO2↑;(3)取少量固体B溶于稀硫酸,生成硫酸铜,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,可知生成碘和CuI,产生该现象的离子方程式为2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2。
2020-2021高考化学培优(含解析)之高无机综合推断含答案解析

2020-2021高考化学培优(含解析)之高无机综合推断含答案解析一、无机综合推断1.固体X由四种元素组成,为探究其组成和性质,设计并完成如下实验:(1)固体X中含有H、O、______和______元素。
(2)写出固体X受热分解的化学方程式______。
(3)取少量固体B溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子方程式______。
【答案】C Cu Cu3(OH)2(CO3)23CuO+H2O+2CO2↑ 2Cu2++4I-=2CuI↓+I2【解析】【分析】由固体隔绝空气加热生成1.8g水可知,含H原子的物质的量n=1.8g/18g∙mol-1×2=0.2mol,质量为0.2g;气体A与石灰水反应生成白色沉淀为碳酸钙,其物质的量n=20.0g/100g∙mol-1=0.2mol,所以碳原子的物质的质量为m=0.2mol×12g/mol=2.4g;固体B与CO反应生成紫红色固体为Cu,则B为CuO,其物质的量为24.0g/80g∙mol-1=0.3mol,所以铜的质量为m=0.3mol×64g/mol=19.6g;剩余质量为34.6g-0.2g-2.4g-19.6g=12.4g,所以X中含O为n=12.4g/16g∙mol-1=0.8mol,则n(Cu):n(C):n (H):n(O)=3:2:2:8,X为Cu3(OH)2(CO3)2,以此来解答。
【详解】(1)由上述分析可知,固体X中含有H、O、C、Cu元素,故答案为:C;Cu;(2)固体X受热分解的化学方程式为Cu3(OH)2(CO3)23CuO+H2O+2CO2↑,故答案为:Cu3(OH)2(CO3)23CuO+H2O+2CO2↑;(3)取少量固体B溶于稀硫酸,生成硫酸铜,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,可知生成碘和CuI,产生该现象的离子方程式为2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2。
2020-2021备战高考化学高无机综合推断综合练习题附详细答案

2020-2021备战高考化学高无机综合推断综合练习题附详细答案一、无机综合推断1.某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:依据以上信息,回答下列问题:(1)上述离子中,溶液X中肯定含有的是:________________;不能肯定的是:_______________。
对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:_________。
(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)(2)气体F的电子式为:_______________,实验中,可以观察到反应②的现象是:__________________。
(3)写出步骤①所有发生反应的离子方程式________________________、___________________。
【答案】SO42-、Al3+、Fe2+、NH4+ Fe3+⑤气体由无色变成红棕色 Ba2++SO42-=BaSO4↓ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O【解析】【详解】(1)在强酸性溶液中氢离子和碳酸根离子反应生成二氧化碳和水,硅酸根离子和氢离子反应生成硅酸沉淀,所以一定不会存在CO32-和SiO32-离子;加入过量硝酸钡生成沉淀,钡离子和硫酸根离子反应生成硫酸钡沉淀,说明一定含有SO42-,含有SO42-离子就一定不含Ba2+离子;气体A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+,一定不含NO3-离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+;溶液H中溶于CO2气体,生成沉淀K,则K为Al (OH)3,L为NaOH和NaAlO2,说明溶液中含有Al3+;不能确定是否含有的离子Fe3+,检验用硫氰化钾溶液,取少量X溶液放在试管中,加入几滴KSCN,溶液变红色说明有Fe3+,反之无Fe3+;(2)溶液B中加入过量NaOH溶液,生成气体F:NH4++OH-=NH3↑+H2O,氨气电子式为;一氧化氮易被氧化为二氧化氮,则实验中,可以观察到反应②的现象是无色一氧化氮变为红棕色二氧化氮气体;(3)步骤①在强酸性溶液中加入过量硝酸钡,钡离子和硫酸根离子反应生成硫酸钡沉淀,Ba2++SO42-=BaSO4↓,二价铁离子具有还原性,硝酸具有氧化性,二价铁离子被硝酸氧化生成三价铁离子,硝酸被还原成一氧化氮,一氧化氮在空气中被氧化成红棕色的二氧化氮,离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
2020-2021高考化学知识点过关培优训练∶高无机综合推断及答案解析

2020-2021高考化学知识点过关培优训练∶高无机综合推断及答案解析一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为__________________________________。
②A溶液与C溶液反应的化学方程式为______________________________________。
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_____________。
②A溶液一步转化为C溶液的反应离子方程式为________________________________。
(3)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③一定条件下B与CO反应的化学方程式为_____________________________。
(4)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
则C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为________________________。
【答案】CO32-+H2O+CO2=2HCO3- NaOH+NaHCO3=Na2CO3+H2O 2Al+2NaOH+2H2O =2NaAlO2 +3H2↑ Al3-+ 4OH- =AlO2- + 2H2O NO 不能 2NO+2CO2CO2+N2S+2H2SO4(浓)3SO2↑+2H2O【解析】【分析】(1) 若A、B、C 三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3;(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1,则A为N2、W为O2、B为NO、C为NO2;(4) 若A 为淡黄色固体单质,W 为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 。
2020-2021高考化学培优专题复习高无机综合推断练习题及详细答案

2020-2021高考化学培优专题复习高无机综合推断练习题及详细答案一、无机综合推断1.甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:(1)甲物质为____________(填化学式)。
(2)乙与甲反应的化学方程式为____________,丙与甲反应的化学方程式为____________。
(3)D能使湿润的有色布条褪色,其褪色原因是____________(结合化学反应方程式描述原因)。
(4)D可用于制取“84”消毒液,反应的化学方程式为____________,也可用于工业上制取漂白粉,反应的化学方程式为____________,但漂白粉保存不当易变质,变质时涉及到的化学方程式为____________。
【答案】Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2Cl2+H2O=HCl+HClO、 HClO有漂白性 Cl2+2NaOH=NaClO+NaCl+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO2HCl+O2↑【解析】【分析】甲、乙、丙均为化合物,甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,甲能既能与乙反应也能与丙反应,可知甲为Na2O2,乙为H2O,丙为CO2,则A 为NaOH,B为O2,C为Na2CO3,D为黄绿色气体,则D为Cl2,D(Cl2)与A(NaOH)反应生成NaCl、NaClO,F的溶液能与丙(CO2)反应C与I,则F为NaClO、E为NaCl、I为HClO,G与C(Na2CO3)反应得到E(NaCl)与丙(CO2),则G为HCl,据此解答。
【详解】根据上述分析可知:甲为Na2O2,乙为H2O,丙为CO2,A为NaOH,B为O2,C为Na2CO3,D为Cl2,E为NaCl,F为NaClO,G为HCl,I为HClO。
2020-2021备战高考化学高无机综合推断综合题及详细答案

2020-2021备战高考化学高无机综合推断综合题及详细答案一、无机综合推断1.黑色固体物质A有如下图所示的转化关系。
每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________【答案】FeSO4 H2S 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+【解析】【分析】从框图中可以看出,反应②是解题的突破口。
因为它的已知信息多,不仅有“D、E有共同的阳离子”,而且有Cl2这种具有强氧化性的特殊物质。
【详解】(1)由反应②知,B物质具有还原性;由反应④知,E物质具有氧化性,F气体具有还原性。
综合分析反应②和④,可得出B中的阳离子具有还原性,从而得出其为亚铁盐。
结合反应③,可得出F气体为SO2,C气体为H2S。
再回到反应④,F为SO2,氧化产物必然为H2SO4,从而得出E为Fe2(SO4)3、B为FeSO4、G为H2SO4。
由反应①,很容易得出A为FeS。
由反应②,可得出D为FeCl3。
答案为:B是FeSO4、C是H2S。
(2) 反应④的化学方程式为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+【点睛】无机框图题是难度较大的一类题,因为它要求我们必须熟练掌握元素及其化合物的性质,尤其是一些具有特殊性质的物质。
比如Cu、Cl2、Fe2O3、CuO、FeS等物质的颜色,需要高温、通电、催化剂等条件的反应,具有较强氧化性的金属离子(比如Fe3+),具有较强还原性的气体(比如SO2)等。
解题时,条件特殊、已知条件多、具有特殊性的反应,常常是解题的切入点和突破口。
2020-2021备战高考化学 高无机综合推断 培优练习(含答案)附答案解析

2020-2021备战高考化学高无机综合推断培优练习(含答案)附答案解析一、无机综合推断1.下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。
各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):(1)A的电子式:___________________;(2)写出甲与C反应的化学方程式:________________________________;(3)在F和E的混合溶液中用___________试剂(填化学式)检验E中阳离子;(4)整个转换过程中属于氧化还原反应的有___________个;(5)写出反应③E与G按物质的量之比2:1的反应的离子方程式___________________。
【答案】3Fe + 4H2O(g) Fe3O4 + 4H2KMnO46个6Fe2+ + 3Na2O2 +6H2O = 4Fe(OH)3↓ + 2Fe3+ + 6Na+【解析】【分析】由题意可知,G为淡黄色固体化合物,J为生活中常见的调味品,则G是Na2O2, J为NaCl;I为红褐色固体,则I是氢氧化铁,甲是Fe单质;B、D分别为黑色粉末和黑色晶体,Fe与物质C发生置换反应生成另一种非金属单质,根据Fe与水蒸气在高温条件下反应生成氢气和黑色固体四氧化三铁可知C是水,乙是氢气,D是Fe3O4;A与B反应生成水和一种非金属单质,且①是实验室制取丁的反应之一,判断A是过氧化氢,B是二氧化锰,过氧化氢在二氧化锰做催化剂作用下发生分解反应生成水和氧气,所以丁是氧气;四氧化三铁与K反应生成两种物质E、F,可以相互转化,则K是盐酸,盐酸与四氧化三铁反应生成氯化亚铁和氯化铁,F与Fe反应生成E,则F是氯化铁,E是氯化亚铁,氯化铁与过氧化钠反应生成氢氧化铁、氯化钠、氧气,氯化亚铁与一定量的过氧化钠反应生成氯化铁、氢氧化铁、氯化钠。
2020-2021备战高考化学复习高无机综合推断专项综合练附答案

2020-2021备战高考化学复习高无机综合推断专项综合练附答案一、无机综合推断1.氢能源是一种重要的清洁能源。
现有两种可产生H2的化合物甲和乙。
将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。
化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。
请回答下列问题:(1)甲的化学式是__________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________。
(3)气体丙与金属镁反应的产物是__________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。
【答案】AlH3 AlH3+3H2O=Al(OH)3↓+3H2↑ Mg3N2 2NH3+3CuO3Cu+N2+3H2O 将固体溶于稀硫酸中,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O【解析】【分析】将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,因此白色沉淀是Al(OH)3,则金属单质是铝,因此甲是AlH3。
化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g·L-1,则丙的相对分子质量是1.25×22.4=28,因此丙是氮气,则乙是氨气NH3,据此解答。
【详解】(1)根据以上分析可知甲的化学式是AlH3。
乙是氨气,含有共价键的共价化合物,电子式为;(2)甲与水反应生成氢气和氢氧化铝,反应的化学方程式是AlH3+3H2O=Al(OH)3↓+3H2↑。
2020-2021高考化学知识点过关培优训练∶高无机综合推断及详细答案

2020-2021高考化学知识点过关培优训练∶高无机综合推断及详细答案一、无机综合推断1.现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的名称:丙-_______________;(2)写出下列物质的化学式:F________________;(3)气体乙是一种重要的化工原料,在工农业生产、生活中有着重要的应用。
请你根据所学知识回答下列问题:① 把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因__________________。
② 某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。
其反应原理为:(用化学方程式表示)______________。
【答案】氯化氢 Ca(ClO)2先变红后褪色氯气和水反应生成HCl、HClO,溶液显酸性使石蕊变红HClO具有漂白性(或强氧化性)使溶液褪色 Cl2+2NaOH=NaCl+NaClO+H2O 【解析】【分析】金属单质A和氧气反应生成淡黄色固体G,所以A是钠、G是过氧化钠;乙是黄绿色气体,乙是氯气;钠与水反应生成氢气和氢氧化钠;氢气和氯气生成氯化氢,氯化氢溶于水生成盐酸;浓盐酸与二氧化锰加热生成氯气;氯气与石灰乳反应生成漂白粉;氢氧化钠与氯气生成次氯酸钠。
据此分析解答。
【详解】(1)根据以上分析,丙是氯化氢;(2)F是Ca(ClO)2;(3)①把氯气通入紫色石蕊溶液中,氯气与水生成盐酸和次氯酸,溶液呈酸性,石蕊变红色,次氯酸具有漂白性,所以石蕊褪色,可以观察到的现象是:先变红后褪色;②氢氧化钠与氯气生成次氯酸钠的方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
2.已知A为金属单质,它们之间能发生如下反应(部分产物未标出)请根据以上信息回答下列问题:(1)写出物质B的化学式:___________(2)写出下列反应的化学方程式:反应①______________________________________________________________________反应②______________________________________________________________________(3)写出下列反应的离子方程式:反应C→D______________________________________________________________________ 反应D→C _____________________________________________________________________(4)检验D中阳离子的方法:_________________________________________________________【答案】Fe3O4 4Fe(OH)2+O2+2H2O===4Fe(OH)3 3Fe + 4H2O(g) Fe3O4 + 4H2 2Fe2++ Cl2 =2Fe3++2Cl-2Fe3++Fe=3Fe2+取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。
2020-2021高考化学 高无机综合推断 培优练习(含答案)及答案

2020-2021高考化学高无机综合推断培优练习(含答案)及答案一、无机综合推断1.现有H、N、O、Na、S、Cl、Fe、Cu八种常见元素,回答下列问题:(1)Cl在周期表中的位置____________________;(2)Na+离子的结构示意图为__________________;(3)能说明非金属性Cl比S强的事实是_____________(用化学方程式表示);(4)物质A~L是由上述八种元素中的一种、二种或三种组成,A的摩尔质量166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E都为氢氧化物,E呈红褐色。
F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。
它们有如下图所示的关系(部分反应条件及产物已略去):①C的化学式为____________________;②D的电子式为____________________;③L的稀溶液与H反应的离子方程式为_________________;④反应(a)的化学方程式为_______________。
【答案】第3周期ⅦA族 Cl2+H2S=S↓+2HCl Cu3N 3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O 4Na2FeO4 +10H2O = 4Fe(OH)3↓+8NaOH + 3O2↑【解析】【分析】前三问考查了元素周期表中“位构性”三者关系,后一问为无机推断大题,其推导思路: B 是最常见的液体则为水;E呈红褐色为氢氧化铁,D、E属同类物质,且D应该也含有钠元素故为氢氧化钠;F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体即为Cu,C 中两元素的质量比为96:7,C分解得到G和H,可知生成Cu和氮气,故C为Cu3N,G为氮气;氮气与氧气放电生成NO,故F为氧气,J为一氧化氮,与氧气反应生成K为二氧化氮,二氧化氮与水反应生成L是常见的强酸硝酸;I是黄绿色气体则为氯气;A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素,结合D、E、F可推知A为Na2FeO4。
2020-2021高考化学知识点过关培优训练∶高无机综合推断含答案解析
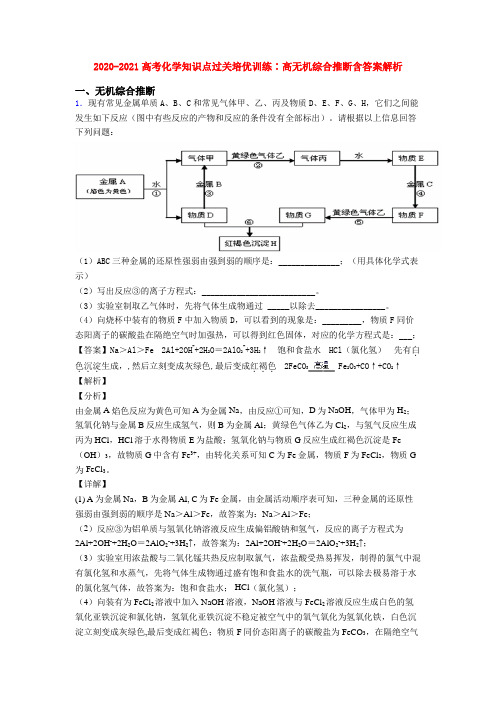
2020-2021高考化学知识点过关培优训练∶高无机综合推断含答案解析一、无机综合推断1.现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)ABC三种金属的还原性强弱由强到弱的顺序是:______________;(用具体化学式表示)(2)写出反应③的离子方程式:__________________________。
(3)实验室制取乙气体时,先将气体生成物通过_____以除去________________。
(4)向烧杯中装有的物质F中加入物质D,可以看到的现象是:_________,物质F同价态阳离子的碳酸盐在隔绝空气时加强热,可以得到红色固体,对应的化学方程式是:___;【答案】Na>Al>Fe2Al+2OH-+2H2O=2AlO2-+3H2↑饱和食盐水HCl(氯化氢)先有白.色沉淀...2FeCO3Fe2O3+CO↑+CO2↑...生成,,然后立刻变成灰绿色,最后变成红褐色【解析】【分析】由金属A焰色反应为黄色可知A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,则B为金属Al;黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸;氢氧化钠与物质G反应生成红褐色沉淀是Fe (OH)3,故物质G中含有Fe3+,由转化关系可知C为Fe金属,物质F为FeCl2,物质G 为FeCl3。
【详解】(1) A为金属Na,B为金属Al, C为Fe金属,由金属活动顺序表可知,三种金属的还原性强弱由强到弱的顺序是Na>Al>Fe,故答案为:Na>Al>Fe;(2)反应③为铝单质与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)实验室用浓盐酸与二氧化锰共热反应制取氯气,浓盐酸受热易挥发,制得的氯气中混有氯化氢和水蒸气,先将气体生成物通过盛有饱和食盐水的洗气瓶,可以除去极易溶于水的氯化氢气体,故答案为:饱和食盐水; HCl(氯化氢);(4)向装有为FeCl2溶液中加入NaOH溶液,NaOH溶液与FeCl2溶液反应生成白色的氢氧化亚铁沉淀和氯化钠,氢氧化亚铁沉淀不稳定被空气中的氧气氧化为氢氧化铁,白色沉淀立刻变成灰绿色,最后变成红褐色;物质F同价态阳离子的碳酸盐为FeCO3,在隔绝空气时加强热,得到红色固体为Fe2O3,化学方程式为2FeCO3Fe2O3+CO↑+CO2↑,故答案为:先有白色沉淀生成,,然后立刻变成灰绿色,最后变成红褐色;2FeCO3Fe2O3+CO↑+CO2↑。
2020-2021高考化学知识点过关培优训练∶高无机综合推断及答案

2020-2021高考化学知识点过关培优训练∶高无机综合推断及答案一、无机综合推断1.黑色固体物质A有如下图所示的转化关系。
每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________【答案】FeSO4 H2S 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+【解析】【分析】从框图中可以看出,反应②是解题的突破口。
因为它的已知信息多,不仅有“D、E有共同的阳离子”,而且有Cl2这种具有强氧化性的特殊物质。
【详解】(1)由反应②知,B物质具有还原性;由反应④知,E物质具有氧化性,F气体具有还原性。
综合分析反应②和④,可得出B中的阳离子具有还原性,从而得出其为亚铁盐。
结合反应③,可得出F气体为SO2,C气体为H2S。
再回到反应④,F为SO2,氧化产物必然为H2SO4,从而得出E为Fe2(SO4)3、B为FeSO4、G为H2SO4。
由反应①,很容易得出A为FeS。
由反应②,可得出D为FeCl3。
答案为:B是FeSO4、C是H2S。
(2) 反应④的化学方程式为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+【点睛】无机框图题是难度较大的一类题,因为它要求我们必须熟练掌握元素及其化合物的性质,尤其是一些具有特殊性质的物质。
比如Cu、Cl2、Fe2O3、CuO、FeS等物质的颜色,需要高温、通电、催化剂等条件的反应,具有较强氧化性的金属离子(比如Fe3+),具有较强还原性的气体(比如SO2)等。
解题时,条件特殊、已知条件多、具有特殊性的反应,常常是解题的切入点和突破口。
2020-2021高考化学高无机综合推断(大题培优)及详细答案

2020-2021高考化学高无机综合推断(大题培优)及详细答案一、无机综合推断1.已知A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种化合物:甲、乙、丙。
甲、乙、丙三种化合物的分子中含有相同数目的电子;丙与甲、乙均能发生化学反应,且甲、丙为无色有不同刺激性气味的物质,化合物丁与C的某种单质在常温下反应可生成红棕色气体;B、C、D三种元素的单质与甲、乙、丁三种化合物之间存在如图所示的转化关系(反应条件已略去):(1)D在元素周期表中的位置为________________。
(2)B、C、D的原子半径的大小关系为________(用元素符号表示)。
(3)丁与C的单质在常温下反应的化学方程式为______________。
(4)甲、乙、丙分子中的电子数均为________,实验室如何检验丙_______ 。
(5)C的单质+丙→乙+丁的化学方程式为_______________。
【答案】第2周期ⅤA族 N>O>F 2NO+O2===2NO2 10 能使湿润的红色石蕊试纸变蓝色 5O2+4NH36H2O+4NO【解析】【分析】本题有几个重要的突破口:①甲、乙、丙三种化合物的分子中含有相同数目的电子;②丙为无色有不同刺激性气味的物质;③化合物丁与C的某种单质在常温下反应可生成红棕色气体,说明丁为NO,C的某种单质可能为O2。
【详解】A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种化合物:甲、乙、丙。
化合物丁与C的某种单质在常温下反应可生成红棕色气体,则丁为NO、C为O元素;丙与甲、乙均能发生化学反应,且甲、丙为无色有不同刺激性气味的物质,由图中信息可知,丙与O元素的单质反应生成NO,也可以由O的单质与D的单质化合而得,则丙为NH3、D为N元素,乙为H2O;甲、乙、丙三种化合物的分子中含有相同数目的电子,则其都有10个电子,结合图中信息,B的单质可以与H2O反应生成甲和O 元素的单质,故甲为HF、B为F元素。
2020-2021高考化学 高无机综合推断 培优易错试卷练习(含答案)含答案

2020-2021高考化学高无机综合推断培优易错试卷练习(含答案)含答案一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为__________________________________。
②A溶液与C溶液反应的化学方程式为______________________________________。
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_____________。
②A溶液一步转化为C溶液的反应离子方程式为________________________________。
(3)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③一定条件下B与CO反应的化学方程式为_____________________________。
(4)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
则C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为________________________。
【答案】CO32-+H2O+CO2=2HCO3- NaOH+NaHCO3=Na2CO3+H2O 2Al+2NaOH+2H2O =2NaAlO2 +3H2↑ Al3-+ 4OH- =AlO2- + 2H2O NO 不能 2NO+2CO2CO2+N2S+2H2SO4(浓)3SO2↑+2H2O【解析】【分析】(1) 若A、B、C 三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3;(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1,则A为N2、W为O2、B为NO、C为NO2;(4) 若A 为淡黄色固体单质,W 为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 。
2020-2021备战高考化学高无机综合推断综合练习题及详细答案

2020-2021备战高考化学高无机综合推断综合练习题及详细答案一、无机综合推断1.现有H、N、O、Na、S、Cl、Fe、Cu八种常见元素,回答下列问题:(1)Cl在周期表中的位置____________________;(2)Na+离子的结构示意图为__________________;(3)能说明非金属性Cl比S强的事实是_____________(用化学方程式表示);(4)物质A~L是由上述八种元素中的一种、二种或三种组成,A的摩尔质量166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E都为氢氧化物,E呈红褐色。
F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。
它们有如下图所示的关系(部分反应条件及产物已略去):①C的化学式为____________________;②D的电子式为____________________;③L的稀溶液与H反应的离子方程式为_________________;④反应(a)的化学方程式为_______________。
【答案】第3周期ⅦA族 Cl2+H2S=S↓+2HCl Cu3N 3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O 4Na2FeO4 +10H2O = 4Fe(OH)3↓+8NaOH + 3O2↑【解析】【分析】前三问考查了元素周期表中“位构性”三者关系,后一问为无机推断大题,其推导思路: B 是最常见的液体则为水;E呈红褐色为氢氧化铁,D、E属同类物质,且D应该也含有钠元素故为氢氧化钠;F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体即为Cu,C 中两元素的质量比为96:7,C分解得到G和H,可知生成Cu和氮气,故C为Cu3N,G为氮气;氮气与氧气放电生成NO,故F为氧气,J为一氧化氮,与氧气反应生成K为二氧化氮,二氧化氮与水反应生成L是常见的强酸硝酸;I是黄绿色气体则为氯气;A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素,结合D、E、F可推知A为Na2FeO4。
2020-2021化学高无机综合推断的专项培优练习题(含答案)附详细答案

2020-2021化学高无机综合推断的专项培优练习题(含答案)附详细答案一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为__________________________________。
②A溶液与C溶液反应的化学方程式为______________________________________。
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_____________。
②A溶液一步转化为C溶液的反应离子方程式为________________________________。
(3)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③一定条件下B与CO反应的化学方程式为_____________________________。
(4)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
则C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为________________________。
【答案】CO32-+H2O+CO2=2HCO3- NaOH+NaHCO3=Na2CO3+H2O 2Al+2NaOH+2H2O =2NaAlO2 +3H2↑ Al3-+ 4OH- =AlO2- + 2H2O NO 不能 2NO+2CO2CO2+N2S+2H2SO4(浓)3SO2↑+2H2O【解析】【分析】(1) 若A、B、C 三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3;(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1,则A为N2、W为O2、B为NO、C为NO2;(4) 若A 为淡黄色固体单质,W 为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 。
2020-2021高考化学知识点过关培优训练∶高无机综合推断附详细答案

2020-2021高考化学知识点过关培优训练∶高无机综合推断附详细答案一、无机综合推断1.某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:依据以上信息,回答下列问题:(1)上述离子中,溶液X中肯定含有的是:________________;不能肯定的是:_______________。
对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:_________。
(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)(2)气体F的电子式为:_______________,实验中,可以观察到反应②的现象是:__________________。
(3)写出步骤①所有发生反应的离子方程式________________________、___________________。
【答案】SO42-、Al3+、Fe2+、NH4+ Fe3+⑤气体由无色变成红棕色 Ba2++SO42-=BaSO4↓ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O【解析】【详解】(1)在强酸性溶液中氢离子和碳酸根离子反应生成二氧化碳和水,硅酸根离子和氢离子反应生成硅酸沉淀,所以一定不会存在CO32-和SiO32-离子;加入过量硝酸钡生成沉淀,钡离子和硫酸根离子反应生成硫酸钡沉淀,说明一定含有SO42-,含有SO42-离子就一定不含Ba2+离子;气体A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+,一定不含NO3-离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+;溶液H中溶于CO2气体,生成沉淀K,则K为Al (OH)3,L为NaOH和NaAlO2,说明溶液中含有Al3+;不能确定是否含有的离子Fe3+,检验用硫氰化钾溶液,取少量X溶液放在试管中,加入几滴KSCN,溶液变红色说明有Fe3+,反之无Fe3+;(2)溶液B中加入过量NaOH溶液,生成气体F:NH4++OH-=NH3↑+H2O,氨气电子式为;一氧化氮易被氧化为二氧化氮,则实验中,可以观察到反应②的现象是无色一氧化氮变为红棕色二氧化氮气体;(3)步骤①在强酸性溶液中加入过量硝酸钡,钡离子和硫酸根离子反应生成硫酸钡沉淀,Ba2++SO42-=BaSO4↓,二价铁离子具有还原性,硝酸具有氧化性,二价铁离子被硝酸氧化生成三价铁离子,硝酸被还原成一氧化氮,一氧化氮在空气中被氧化成红棕色的二氧化氮,离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
2020-2021备战高考化学培优(含解析)之高无机综合推断附详细答案

2020-2021备战高考化学培优(含解析)之高无机综合推断附详细答案一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:(1)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_______________。
②A溶液一步转化为C溶液的反应离子方程式为________________。
(2)若X是一种黄绿色的气体,Y的饱和溶液滴入沸水中能生成红褐色胶体。
①检验溶液Z是否变质最灵敏的一种试剂是____________________(名称);②一定条件下W与水反应的化学方程式_______________________________。
(3)X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法____________________,X转化为Y的化学方程式为______________________;(4)X为一元强碱溶液,W是形成酸雨的主要气体。
①则Y到Z的离子方程式为________________________________________;②请画出向含0.01molX和0.01molY的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像___________。
【答案】2Al+2NaOH+2H2O =2NaAlO2 +H2 Al3-+ 4OH- =AlO2- + 2H2O 硫氰化钾溶液 3Fe + 4H2O(g) === Fe3O4 + 4H2使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒产生白烟)4NH3+5O24NO+6H2O SO32-+SO2+H2O=2HSO3-【解析】【分析】W为NaOH。
B为两性物质且含有一种金属元素,确定该金属元素为铝元素,因在溶液中产生了B,所以B为Al(OH)3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021备战高考化学知识点过关培优训练∶高无机综合推断及答案一、无机综合推断1.黑色固体物质A有如下图所示的转化关系。
每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________【答案】FeSO4 H2S 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+【解析】【分析】从框图中可以看出,反应②是解题的突破口。
因为它的已知信息多,不仅有“D、E有共同的阳离子”,而且有Cl2这种具有强氧化性的特殊物质。
【详解】(1)由反应②知,B物质具有还原性;由反应④知,E物质具有氧化性,F气体具有还原性。
综合分析反应②和④,可得出B中的阳离子具有还原性,从而得出其为亚铁盐。
结合反应③,可得出F气体为SO2,C气体为H2S。
再回到反应④,F为SO2,氧化产物必然为H2SO4,从而得出E为Fe2(SO4)3、B为FeSO4、G为H2SO4。
由反应①,很容易得出A为FeS。
由反应②,可得出D为FeCl3。
答案为:B是FeSO4、C是H2S。
(2) 反应④的化学方程式为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+【点睛】无机框图题是难度较大的一类题,因为它要求我们必须熟练掌握元素及其化合物的性质,尤其是一些具有特殊性质的物质。
比如Cu、Cl2、Fe2O3、CuO、FeS等物质的颜色,需要高温、通电、催化剂等条件的反应,具有较强氧化性的金属离子(比如Fe3+),具有较强还原性的气体(比如SO2)等。
解题时,条件特殊、已知条件多、具有特殊性的反应,常常是解题的切入点和突破口。
另外,解无框图题时,不要考虑太复杂,要大胆进行尝试。
2.A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。
它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:(1)A所含元素在周期表中的位置为________________,C的电子式为________。
(2)A与H在加热条件下反应的化学方程式为__________________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为___________________,I是较强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量之比为1∶4,该反应的离子方程式为_____________。
(4)向含有0.4 mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),过滤,向反应后澄清溶液中加入过量FeCl3溶液,得到沉淀3.2 g,则a=________L。
【答案】第三周期第ⅥA族 3S+6NaOH 2Na2S+Na2SO3+3H2O 2H+ +S2O32-=S↓+ SO2↑+H2O 4Cl2+S2O32-+5H2O=8Cl-+2SO42-+10H+ 2.24【解析】【分析】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,则A为S;B、D是气体,均与硫单质反应,E为D与硫反应生成的有漂白性的物质,则D为O2,E为SO2,F、G、H的焰色反应均为黄色,均含有Na元素,水溶液均显碱性,结合转化关系可知,H为NaOH、G为Na2SO3,F为Na2S,B为H2,C为H2S,以此解答该题。
【详解】根据上述分析可知:A为S,B为H2,C为H2S,D为O2,E为SO2,F为Na2S,G为Na2SO3,H为NaOH。
(1)A是硫单质,S是16号元素,原子核外电子排布为2、8、6,根据原子结构与元素位置的关系可知S位于元素周期表第三周期ⅥA元素;C为H2S,属于共价化合物,S原子与2个H原子形成2对共用电子对,使分子中每个原子都达到稳定结构,电子式为;(2)S单质与热的NaOH溶液发生歧化反应,生成Na2S和Na2SO3和水,根据原子守恒、电子守恒,可得反应的方程式为:3S+6NaOH2Na2S+Na2SO3+3H2O;(3)S和沸腾Na2SO3得到化合物Na2S2O3,Na2S2O3在酸性条件下发生歧化反应生成S和SO2,反应的离子反应方程式为:2H+ +S2O32-=S↓+ SO2↑+H2O,Cl2具有强氧化性,能把S2O32-氧化成SO42-,Cl2被还原成Cl-,Na2SO3和Cl2的物质的量之比为1:4,即两者的系数为1:4,其离子反应方程式为4Cl2+S2O32-+5H2O=8Cl-+2SO42-+10H+;(4)F为Na2S,G为Na2SO3,向含有0.4 mol Na2S、0.1 mol Na2SO3的混合溶液中加入过量HCl,发生反应:2S2-+SO32-+6H+=3S↓+3H2O,0.1 mol Na2SO3反应消耗0.2 mol Na2S,剩余0.2 mol的Na2S,反应产生0.2 mol H2S,取反应后的溶液加入过量FeCl3溶液,得到3.2 g沉淀,说明溶液中溶解了H2S,根据反应2Fe3++H2S =2Fe2++S↓+2H+,反应产生S的物质的量n(S)=m 3.2?gM32?g/mol=0.1 mol,该反应消耗0.1 mol H2S,所以放出H2S气体的物质的量为0.1 mol,其标准状况下的体积为V(H2S)=n·V m=0.1 mol×22.4 L/mol=2.24 L。
【点睛】本题考查无机物推断,题中焰色反应及特殊反应为推断突破口,需要学生熟练掌握元素化合物的性质,(4)中计算为易错点、难点,学生容易认为混合物与盐酸反应得到硫化氢完全逸出,忽略溶液中溶解硫化氢,侧重考查学生的分析能力。
3.已知A为金属单质,它们之间能发生如下反应(部分产物未标出)请根据以上信息回答下列问题:(1)写出物质B的化学式:___________(2)写出下列反应的化学方程式:反应①______________________________________________________________________反应②______________________________________________________________________(3)写出下列反应的离子方程式:反应C→D______________________________________________________________________ 反应D→C _____________________________________________________________________(4)检验D中阳离子的方法:_________________________________________________________【答案】Fe3O4 4Fe(OH)2+O2+2H2O===4Fe(OH)3 3Fe + 4H2O(g) Fe3O4 + 4H2 2Fe2++ Cl2 =2Fe3++2Cl-2Fe3++Fe=3Fe2+取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。
【解析】红褐色固体固体出现,为氢氧化铁,说明金属单质A为铁,铁与盐酸反应生成氯化亚铁(C)和氢气(F),氯化亚铁被氯气氧化为氯化铁(D),氯化铁又被铁还原为氯化亚铁,氯化亚铁与氢氧化钠溶液反应生成白色沉淀氢氧化亚铁(E),接着被氧气氧化为红褐色固体氢氧化铁,铁与水蒸气加热条件下反应生成四氧化三铁(B)和氢气(F);(1)B为四氧化三铁,正确答案为 Fe3O4 。
(2)正确答案:① 4Fe(OH)2+O2+2H2O===4Fe(OH)3;② 3Fe + 4H2O(g) Fe3O4 + 4H2。
(3)氯化亚铁被氯气氧化为氯化铁:2Fe2++ Cl2 =2Fe3++2Cl-;氯化铁又被铁还原为氯化亚铁:2Fe3++Fe=3Fe2+;正确答案:2Fe2++ Cl2 =2Fe3++2Cl-;2Fe3++Fe=3Fe2+。
(4) Fe3+检验方法:①加入氢氧化钠溶液,生成红褐色沉淀;②加入硫氰化钾溶液,出现红色溶液,该方法简单易操作;正确答案:取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。
点睛:推断题要抓住题眼:红褐色固体为氢氧化铁,从而推出金属单质铁。
4.已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:(1)C元素在周期表中的位置____________。
(2)画出D元素的简单离子结构示意图_______________________。
(3)将CB2与D2以体积比1:1混合后通入品红溶液中,品红溶液不褪色,请用一个化学方程式来解释:_________________________________。
(4)AB2与水反应的化学方程式为___________,在一定温度和压强下,将一个容积为15mL 的试管充满AB2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管液面仍保持在原高度,则应通入的O2为___________mL。
(5)甲、乙、丙均为含A元素的化合物,丁为单质,甲、乙、丙、丁四种物质有如下转化关系(反应条件及部分产物已略去)①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则一个乙分子所含有的电子数目___________。
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丙的化学式___________。
【答案】第三周期ⅥA族 SO2 +Cl2+2H2O=H2SO4 +2HCl 3NO2 + H2O=2HNO3 + NO8.75 15 Fe(NO3)2【解析】【分析】由常温常压下AB2是一种红棕色气体可知,A为N元素、B为O元素;由B与C同主族可知,C为S元素;由A、B、C、D是原子序数依次递增的短周期主族元素可知,D为Cl元素。
【详解】(1) C为S元素,位于周期表第三周期ⅥA族,故答案为第三周期ⅥA族;(2)D为Cl元素,Cl原子得到一个电子形成Cl—,离子结构示意图为,故答案为;(3)SO2与Cl2以体积比1:1反应生成硫酸和盐酸,反应的化学方程式为SO2 + Cl2 +2H2O = H2SO4 + 2HCl,故答案为SO2 + Cl2 +2H2O = H2SO4 + 2HCl;(4)NO2与水反应生成硝酸和一氧化氮,反应的化学方程式为3NO2 +H2O =2HNO3 +NO;在一定温度和压强下,将一个容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,试管中NO体积为1153ml⨯=5mL,相同条件下通入O2,NO先与O2发生反应4NO+3O2+2H2O =4HNO3使试管中无气体溶液全充满,此时通入O2的体积为354ml⨯=3.75mL,再通入5mLO2使试管液面仍保持在原高度,则通入O2的体积为(5mL+3.75mL)=8.75mL,故答案为3NO2 +H2O =2HNO3 +NO;8.75;(5)由题意甲、乙、丙均为含N元素的化合物。
