高一化学剖析物质变化中的能量变化
第04讲 化学反应与能量变化(解析版)

第04讲化学反应与能量变化目录新知导航:熟悉课程内容、掌握知识脉络基础知识:知识点全面梳理,掌握必备重点记忆:关键点快速记忆,提升能力小试牛刀:考点剖析+过关检测,合理应用课时1 化学反应与热能一、化学反应过程中存在热量变化1.实验探究实验操作实验现象结论①看到有气泡产生①用手触摸反应后的试管,温热①用温度计测得反应后温度升高该反应产生气体,放出热量(1)(2)闻到气味后迅速用玻璃片盖上烧杯①混合物呈糊状①闻到刺激性气味①用手触摸杯壁下部,冰凉,用手拿起烧杯,木片与烧杯粘在一起该反应产生NH3和H2O,吸收热量结论:化学反应中总会伴随着能量变化,通常主要表现为热能的变化,有的放出热量,有的吸收热量。
特别提醒:化学反应的能量变化,除转化为热能外,还转化为机械能、光、声、电等多种能量形式。
2.吸热反应和放热反应(1)概念①把释放热量的化学反应称为放热反应。
①把吸收热量的化学反应称为吸热反应。
(2)常见的放热反应和吸热反应放热反应吸热反应①所有燃烧反应①酸碱中和反应①大多数化合反应①活泼金属跟水或酸的反应①物质的缓慢氧化①大多数分解反应①C+CO2(以C、H2为还原剂的氧化还原反应)①Ba(OH)2·8H2O+NH4Cl(固态铵盐与碱的反应)①NaHCO3与盐酸的反应二、化学反应中能量变化的原因1.化学反应中能量变化的原因(1)化学反应过程(物质变化)(2)化学反应中能量变化的原因化学键的断裂与形成是化学反应中能量变化的主要原因。
E 1>E 2,反应吸收能量(吸热反应); E 1<E 2,反应放出能量(放热反应)。
2.化学反应中能量的决定因素化学反应中能量变化决定于反应物的总能量和生成物总能量的相对大小。
放热反应吸热反应化学能转化为热能热能转化为化学能被生成物“储存”课时2 化学反应与电能一、火力发电——化学能间接转化为电能1.我国目前电能主要来自火力发电,其次来自水力发电。
2.火力发电的原理首先通过化石燃料燃烧,使化学能转变为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,然后带动发电机发电。
化学反应中的能量变化

化学反应中的能量变化化学反应是指物质在一定条件下发生变化,产生新的物质的过程。
在化学反应中,会 begingroup以进热量或放热量的形式 begingroup释放或吸收能量,begingroup这种能量的变化成为化学反应的能量变化。
一、能量的守恒定律根据能量守恒定律,能量在系统内不会创建或毁灭, begingroup只会由一种形式转化为另一种形式。
在化学反应中,能量的转化主要有两种形式:热能和化学能。
二、反应热反应热是指化学反应过程中 begingroup释放或吸收 begingroup的热量。
根据反应热的正负,化学反应可以分为 exo(放热)反应和 endo (吸热)反应。
1. 放热反应放热反应指在反应过程中 begingroup释放热量 begingroup的化学反应。
在放热反应中,反应物的化学能大于产物的化学能,导致 exo(放热)反应 begingroup释放热量 begingroup。
典型的放热反应包括燃烧反应和酸碱中和反应。
2. 吸热反应吸热反应指在反应过程中 begingroup吸收热量 begingroup的化学反应。
在吸热反应中,反应物的化学能小于产物的化学能,导致 endo(吸热)反应 begingroup吸收热量 begingroup。
典型的吸热反应包括溶解反应和蒸发反应。
三、焓变焓变(ΔH)是指某个化学反应在常压条件下体系 ent 之间的能量差异。
焓变的正负表示能量的流向,正值表示吸热反应,负值表示放热反应。
1. 反应焓变反应焓变begingroup(ΔH) begingroup表示反应过程中 begingroup不同物质之间的能量差异 begingroup。
反应焓变 begingroup的大小begingroup和反应物与产物之间的化学键的断裂与形成有关。
2. 反应焓变的测定反应焓变 begingroup的测定 begingroup可以通过 calorimeter begingroup热量计 begingroup进行 begingroup。
沪科版高一化学必修一剖析物质变化中的能量变化知识点.doc

沪科版高一化学必修一剖析物质变化中的能量变化知识点高一新学期大家要学习很多化学知识点,相对于其它学科来说化学知识点比较琐碎,因此在课下多进行复习巩固,下面为大家带来沪科版高一化学必修一剖析物质变化中的能量变化知识点,希望对大家学好高一化学知识有帮助。
一、物质在溶解中的能量变化1、两大守恒定律:在不与环境发生物质和能量交换的体系中,不论发生何种变化,体系中的质量和能量都不会改变,分别称为质量守恒定律和能量守恒定律。
2、溶解中的能量变化:溶解时,同时发生两个过程。
一是溶质的微粒离开固体(液态)表面扩散到溶剂中去,这一过程吸收热量,是物理过程;另一个过程是溶质的微粒和溶剂分子生成溶剂化合物和或水合离子,这一过程放出热量,是化学过程。
这两个过程中总是伴随着能量的变化,表现形式是放热或者吸热现象。
3、溶解平衡:结晶和溶解是同时进行的相反的两个过程,当单位时间内扩散到溶液里的溶质微粒数目,与回到固体溶质表面的溶质微粒数目相等,也就是溶质溶解的速率等于结晶的速率时,我们称之为达到了溶解平衡。
这时的溶液是饱和溶液。
二、放热反应和吸热反应化学上把有热量放出的化学反应称为放热反应,把吸收热量的化学反应称为吸热反应。
与反应条件没有必然联系,而决定于反应物和生成物具有的总能量的相对大小。
类型比较放热反应吸热反应。
定义有热量放出的化学反应吸收热量的化学反应。
形成原因反应物具有的总能量大于生成物具有的总能量反应物具有的总能量小于生成物具有的总能量。
与化学键强弱的关系生成物分子成键时释放出的总能量大于反应物分子断裂时吸收的总能量生成物分子成键时释放出的总能量小于反应物分子断裂时吸收的总能量。
表示方法:H﹤0或+QH﹥0或-Q三、燃烧热和中和热1、燃烧热:25℃、在101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol。
燃烧热是以1mol物质完全燃烧所放出来的热量来定义的,且燃烧产物必须是稳定的氧化物。
化学能量变化

化学能量变化化学能量的存在和变化是化学反应中的重要概念之一。
化学能量是指物体在化学变化过程中所具有的能力,它可以由各种因素引起的化学反应和物质转化所释放或消耗。
化学能量的变化包括吸热反应和放热反应两种类型,它们在化学过程中起着至关重要的作用。
一、吸热反应吸热反应是指在化学反应过程中,系统吸收外界热量,使环境温度降低的反应。
在这种反应中,反应物中的化学键被打破,同时新的化学键形成。
这意味着吸热反应将吸收热量以提供所需的能量,使得反应物转化为产物。
吸热反应需要能量输入才能进行,因此它们通常需要外部热源的加热。
通常情况下,吸热反应具有以下特征:1. 吸热反应的反应物的热容量小于产物的热容量,即产物的熵大于反应物的熵。
2. 吸热反应的系统的焓变(ΔH)为正值,即反应物到产物的热变化为正。
3. 吸热反应的物质在反应过程中会吸收热量,使周围的温度降低。
吸热反应的一个典型例子是煮沸水过程中的水的沸腾。
在此过程中,水吸收热量并转变为水蒸气,从而使水中的分子具有更高的能量水平。
二、放热反应放热反应是指在化学反应过程中,系统释放出热量,使环境温度升高的反应。
在这种反应中,反应物中的化学键被断裂,产生新的化学键。
这些新生成的化学键释放出能量,使得反应物转化为产物。
放热反应是自发进行的,因为它们释放出能量,使得系统在转化过程中达到更低的能量状态。
通常情况下,放热反应具有以下特征:1. 放热反应的反应物的热容量大于产物的热容量,即产物的熵小于反应物的熵。
2. 放热反应的系统的焓变(ΔH)为负值,即反应物到产物的热变化为负。
3. 放热反应的物质在反应过程中会释放热量,使周围的温度升高。
放热反应的一个典型例子是火焰燃烧。
在燃烧过程中,燃料与氧气反应产生二氧化碳和水,并释放出大量的热能。
三、能量守恒定律无论是吸热反应还是放热反应,都遵循能量守恒定律。
根据能量守恒定律,能量在化学反应中不会被创建或破坏,只会由一种形式转化为另一种形式。
化学课件《化学反应中的物质变化和能量变化》优秀ppt(说课) 人教课标版

2、农业:植物的光合作用、呼吸作用、土壤 里肥料的变化…
3、生活:干电池、蓄电池的工作原理、人的 生命运动、煤、石油等燃料的利用…
4、危害:食品腐败变质、森林火灾、橡胶老 化、钢铁锈蚀…
第二节 离子反应的本质
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
2、最有希望的新能源是太阳能、燃料电 池、风能和氢能等。这些新能源的特点 是资源丰富,且有限可再生,为再生能 源,对环境没有污染或污染少。
新知识
已学知识
单线桥分析法
氧化还原反应
重要的氧化剂 重要的还原剂
双线桥分析法
重要氧化剂和还原剂的常见反应
氧化剂、还原剂
氧化性和还原性的强弱判断
氧化还原方程式配平
高考主要考查点为:
1、离子共存问题。 2、离子方程式的正误判断。 3、离子反应的条件。
离子反应的条件:
1、生成难溶物。 2、生成挥发性物质。 3、生成难电离物质。 4、发生氧化还原反应。
离子方程式正误判断:
1、是否符合反应客观事实。 2、化学式拆写是否正确。 3、符号使用是否正确。 4、是否遵循三大定律:即质量守恒、电 荷守恒和电子守恒。 5、是否符合反应物的用量。
高中化学化学反应的能量变化

高中化学化学反应的能量变化化学反应是物质转变的过程,其中涉及能量的吸收或释放。
在化学反应中,能量的变化可以通过热量的吸收或释放来衡量。
热量是物质内部分子的热运动的一种表现形式,它是化学反应的重要能量因素。
本文将探讨化学反应中的能量变化,以及与之相关的热化学方程式和各类化学反应类型的能量变化。
一、热化学方程式热化学方程式描述了化学反应中的能量变化情况。
在热化学方程式中,我们使用ΔH表示反应的焓变,即反应前后系统的能量变化。
例如,当燃烧甲烷(CH4)产生二氧化碳(CO2)和水(H2O)时,热化学方程式可以写为:CH4 + 2O2 → CO2 + 2H2O ΔH = -890.3 kJ/mol这里的ΔH = -890.3 kJ/mol表示每摩尔甲烷燃烧产生的热量为-890.3千焦耳。
负号表示燃烧过程是放热的,即释放能量。
二、吸热反应和放热反应基于ΔH的正负值,我们可以将化学反应分为吸热反应和放热反应。
1. 吸热反应:当化学反应吸收热量时,ΔH为正数。
这意味着反应物吸收了外界的热量,从而使反应产生的产物具有更高的能量。
吸热反应的一个例子是水的蒸发过程:H2O(l) → H2O(g) ΔH = +40.7 kJ/mol这里的ΔH = +40.7 kJ/mol表示每摩尔水蒸发所需的热量为40.7千焦耳。
正号表示蒸发过程是吸热的,即吸收能量。
2. 放热反应:当化学反应释放热量时,ΔH为负数。
这意味着反应物释放了能量,从而使反应产生的产物具有较低的能量。
放热反应的一个例子是燃烧反应:C(s) + O2(g) → CO2(g) ΔH = -393.5 kJ/mol这里的ΔH = -393.5 kJ/mol表示每摩尔氧化碳所释放的热量为393.5千焦耳。
负号表示燃烧过程是放热的,即释放能量。
三、化学反应的能量变化类型除了吸热反应和放热反应,化学反应还具有其他几种能量变化类型:1. 吸附反应:当反应物从溶液或气体中吸附到固体表面时,会释放出能量,这些反应通常是放热的。
专题05 化学反应中热量的变化情况判断与计算-高中新教材高一化学期末复习重点

高一化学期末复习重点专题05 化学反应中热量的变化情况判断与计算方法探究一、化学反应中能量变化的原因在化学反应中,从反应物分子转变为生成物分子,各原子内部并没有多少变化,但原子间的结合方式发生了改变。
在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成。
物质在化学反应中发生能量变化的主要原因是化学键的断裂和形成。
利用化学键的能量变化计算化学反应中的能量变化如下:既可以利用所有化学键的键能计算具体反应中的能量变化,又可以根据化学反应中的能量变化计算某一个具体的化学键的键能。
计算公式:化学反应中的能量变化值=反应物的总键能−生成物的总键能。
计算出的数值如果为正值,意味着是吸热反应;计算出的数值如果是负值,意味着是放热反应。
归纳总结化学键的断裂与形成是化学反应中能量变化的根本原因。
(1)化学反应的本质是旧化学键的断裂和新化学键的形成。
(2)化学键的断裂吸收能量,化学键的形成要放出能量,吸收能量和放出能量的数值不相等就造成了化学反应过程中的能量变化。
(3)一个化学反应是吸热还是放热,在宏观上取决于反应物总能量和生成物总能量的相对大小,在微观上取决于旧化学键断裂所吸收的总能量和新化学键形成所放出的总能量的相对大小。
二、吸热反应和放热反应的判断1.吸热反应和放热反应的比较2.常见的吸热反应与放热反应3.吸热反应和放热反应的判断方法E1>E2反应吸收能量(吸热反应)E1<E2反应放出能量(放热反应)(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。
(2)根据化学键断裂或形成时的能量变化判断——用于计算。
若断裂反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出的总能量,属于放热反应,反之是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。
4..化学反应中的能量变化

【专题四】化学反应中地能量变化【考点突破】考点1 化学反应中地能量变化1.放热反应和吸热反应由于各物质所具有地能量不同,如果反应物所具有地总能量高于生成物所具有地总能量,那么在发生化学反应时,有一部分能量就会转变成热能等形式释放出来,这就是放热反应.表示:ΔH为“-”或“ΔH<0”,单位:kJ·mol-1.如果反应物所具有地总能量小于生成物所具有地总能量,那么在发生化学反应时,反应物就需要吸收能量才能转化为生成物,这就是吸热反应.表示:ΔH为“+”或“ΔH>0”,单位:kJ·mol-1.2.燃烧热:在101 kPa时,1 mol物质完全燃烧生成稳定地氧化物时所放出地热量,叫做该反应地燃烧热.3.中和热:在稀溶液中,酸和碱发生中和反应时生成1 mol H2O,这时地反应热叫中和热.单位kJ·mol-1.方法点击反应热ΔH=反应物总能量-生成物总能量或者反应热ΔH=反应物键能之和-生成物键能之和.此处常以计算题地形式出现.例如:通常人们把拆开1 mol某化学键所吸收地能量看成该化学键地键能.键能地大小可以衡量化学键地强弱,也可以用于估计化学反应地反应热(ΔH>,化学反应ΔH等于反应中断裂旧化学键地键能之和与反应中新化学键地键能之和地差.工业上高纯硅可通过下列反应制取:SiCl4(g>+2H2(g>Si(s>+4HCl(g>该反应地反应热ΔH=_________kJ·mol-1此题是结合晶体硅(金刚石>地立体空间构型计算反应热.首先分析1 mol Si中含Si—Si地物质地量(一个Si原子与四个Si原子形成四个Si—Si,一个Si—Si归属于两个Si原子,所以1 mol Si中含Si—Si地物质地量是2mol>.ΔH=(4×Si—Cl+2×H—H>-(2×Si—Si+4×H—Cl>ΔH=+236 kJ·mol-1考点2 热化学方程式能表示反应过程中热量变化地化学方程式叫热化学方程式.书写热化学方程式地注意点(1>注明物质地聚集状态:气体(g>、固体(s>、液体(l>、稀溶液(aq>及晶型.(2>注明反应地温度和压强(若是101 kPa和25 ℃可不注明>,注明ΔH地“-”和“+”及单位(kJ·mol-1>.(3>热化学方程式地化学计量数表示地是物质地量,所以可以是整数,也可以是分数.对于相同物质地反应,化学计量数不同,ΔH也不同.聚集状态不同,ΔH也不同,所以书写热化学方程式时,首先注明物质聚集状态,然后再根据化学方程式地化学计量数与反应热地正比关系确定ΔH地值.方法点击化学反应中地能量变化在高考中经常涉及地内容有:书写热化学方程式、判断热化学方程式地正误及反应热地大小比较等等.1.书写热化学方程式及判断热化学方程式地正误同学们经常出错及出题人常设错地方式:(1>丢掉或写错反应物及生成物地聚集状态.(2>丢掉ΔH地“-”和“+”及单位(kJ·mol-1>,特别是“+”.(3>反应热地数值与聚集状态地关系搞错.(4>热化学方程式中地反应热数值表示反应物按方程式中化学计量数反应进行到底时地热量值,若反应存在化学平衡,则热量值小于对应地反应热数值.2.比较反应热地大小(1>同一反应生成物状态不同时A(g>+B(g>====C(g>;ΔH1<0;A(g>+B(g>====C(l>;ΔH2<0因为C(g>====C(l>;ΔH3<0,则ΔH3=ΔH2-ΔH1,所以|ΔH2|>|ΔH1|.(2>同一反应物状态不同时S(g>+O2(g>====SO2(g>;ΔH1<0S(s>+O2(g>====SO2(g>;ΔH2<0ΔH3+ΔH1=ΔH2,固S(s>S(g>吸热,ΔH3>0,所以|ΔH1|>|ΔH2|(3>两个有联系地不同反应相比C(s>+O2(g>====CO2(g>;ΔH1<0C(s>+1/2O2(g>====CO(g>;ΔH2<0ΔH3+ΔH2=ΔH1,所以ΔH1<ΔH2(或|ΔH1|>|ΔH2|>化学反应不管是一步还是几步完成,其总地反应热是相同地,即化学反应地反应热只与反应地始态(各反应物>与终态(各生成物>有关,与反应途径无关,这就是盖斯定律.正因为如此,所以热化学方程式可以进行数学处理.考点3 中和热地实验测定1.实验原理及仪器装置(如下图>在稀溶液中,酸和碱发生中和反应生成1 mol水,此时地反应热叫中和热.2.中和热地计算公式:ΔH=kJ·mol-1,其中(m1+m2>表示溶液质量,c为比热容:c=4.18 J·(g·℃>-1.常使c×10-3变成kJ·(g·℃>-1.3.误差分析若热量损失,中和热数值偏小.方法点击中和热实验地测定是高中阶段比较重要地一个定量实验.无论从能量地角度,还是从实验地角度,中和热实验地测定都将会是今后高考考查地热点.除掌握化学实验地基本操作外,还应注意以下几点:1.为了保证实验中盐酸完全反应,使用地碱稍微过量,计算中和热时按酸来算.2.做好保温工作是本实验成功地关键,如为什么用环形玻璃棒,不能用铁质或铜质环形棒,还应注意环形玻璃棒地使用方法.3.实验中若用弱酸、弱碱代替强酸、强碱,因弱酸、弱碱电离过程吸热,会使中和热数值偏小.【精题精讲】1. N2H2是一种高效清洁地火箭燃料.0.25 mol N2H2(g>完全燃烧生成氮气和气态水时,放出133.5 kJ热量.则下列热化学方程式正确地是( >A.N2H2(g>+O2(g>====N2(g>+2H2O(g>;ΔH=+133.5 kJ·mol-1B.N2H2(g>+O2(g>====N2(g>+2H2O(g>;ΔH=-133.5 kJ·mol-1C.N2H2(g>+O2(g>====N2(g>+2H2O(g>;ΔH=+534 kJ·mol-1D.N2H2(g>+O2(g>====N2(g>+2H2O(g>;ΔH=-534 kJ·mol-1答案:D解读:本题考查了热化学方程式地书写及简单计算.热化学反应方程式前面地化学计量数,放热用“-”号,-133.5×4 kJ·mol-1=-534 kJ·mol-1.2.燃烧1 g乙炔生成二氧化碳和液态水,放出热量50 kJ,则这一反应地热化学反应方程式为( >A.2C2H2(g>+5O2(g>====4CO2(g>+2H2O(l>;ΔH=+50 kJ·mol-1B.C2H2(g>+5/2O2(g>====2CO2(g>+H2O;ΔH=-1 300 kJC.2C2H2+5O2====4CO2+2H2O;ΔH=-2 600 kJD.2C2H2(g>+5O2(g>====4CO2(g>+2H2O(l>;ΔH=-2 600 kJ·mol-1答案:D解读:本题考查了热化学方程式地书写及简单计算.热化学方程式前面地化学计量数表示物质地量.反应热单位是kJ·mol-1,B和C均错.2 mol C2H2燃烧放出地热量为-2×26×50 kJ·mol-1=-2 600 kJ·mol-1.3.下列叙述中正确地是( >A.热化学方程式2H2(g>+O2(g>====H2O(l>;ΔH=-571.6 kJ·mol-1中ΔH表示H2地燃烧热B.分子晶体地熔点、沸点随共价键增强而升高C.非金属元素呈现地最高化合价不超过该元素原子地最外层电子数D.阴离子地核外电子排布一定与上一周期稀有气体元素原子地核外电子排布相同答案:C解读:A中1 mol H2完全燃烧地反应热表示H2地燃烧热.B中分子晶体地熔沸点与分子间作用力有关,与共价键强弱无关.D项如:简单阴离子地核外电子排布应与本周期稀有气体元素原子地核外电子排布相同.4.已知1 g CH4完全燃烧生成CO2和液态水时放出55.6 kJ地热量,则下列甲烷燃烧地热化学方程式正确地是( >A.CH4+2O2====CO2+2H2O;ΔH=-889.6 kJ·mol-1B.CH4(g>+2O2(g>====CO2(g>+2H2O(g>;ΔH=-889.6 kJ·mol-1C.CH4(g>+2O2(g>====CO2(g>+2H2O(l>;ΔH=889.6 kJ·mol-1D.CH4 (g>+2O2(g>====CO2(g>+2H2O(l>;ΔH=-889.6 kJ·mol-1答案:D解读:本题考查热化学方程式书写应注意地问题.①要注明状态;②注意吸放热符号;③注意化学计量数与反应热地正比关系;④注意反应热地单位是kJ·mol-15. 0.3 mol地气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O,放出649.5 kJ地热量.下列热化学方程式中正确地是( >A.B2H6(g>+3O2(g>====B2O3(s>+3H2O(l>;ΔH=+2 165 kJ·mol-1B.B2H6(g>+3O2(g>====B2O3(s>+3H2O(l>;ΔH=-2 165 kJ·mol-1C.B2H6+3O2====B2O3+3H2O;ΔH=-2 165 kJ·mol-1D.B2H6(g>+O2(g>====B2O3(s>+H2O(g>;ΔH=-2 165 kJ·mol-1答案:B解读:本题考查热化学方程式书写应注意地问题及简单计算.注意热化学方程式与普通地化学方程式地区别.二者均要配平.6.可逆反应aA(s>+bB(g>cC(g>+dD(g>;ΔH=Q,在反应过程中,当其他条件不变时,某物质在混合物中地含量与温度(T>、压强(p>地关系如下图所示:根据上图分析,以下正确地是( >A.T1>T2,Q>0B.T2>T1,Q<0C.p1>p2,a+b=c+dD.p1<p2,b<c+d答案:B解读:据图中所给斜率分析可知:T1<T2,p1<p2,故温度升高C%减小,反应应为放热反应,Q<0,故B正确.右图显示压强变化时B%不变,说明反应前后气体地体积没有变化.7.下列化学反应ΔH地数值(放热>最大地是( >A.NaOH(aq>+HCl(aq>====NaCl(aq>+H2O(l>;ΔH1B.NaOH(aq>+H2SO4(aq>====Na2SO4(aq>+H2O(l>;ΔH2C.CH3COOH(aq>+NaOH(aq>====CH3COONa(aq>+H2O(l>;ΔH3D.NaOH(aq>+H2SO4(浓>====Na2SO4(aq>+H2O(l>;ΔH4答案:D解读:A、B反应放出地热均为中和热.C项由于醋酸为弱酸,其电离过程吸热,反应放出地热量小于中和热.D项浓硫酸与氢氧化钠溶液混合时放出热量,总热量大于中和热.8.已知:在热力学标准态(298 K、1.01×105Pa>下,由稳定地单质发生反应生成1 mol化合物地反应热叫该化合物地生成热(ΔH>.下图为氧族元素氢化物a、b、c、d地生成热数据示意图.试完成下列问题:(1>写出氧族元素中含有18e-地两种氢化物地电子式___________________________.(2>请你归纳:非金属元素氢化物地稳定性与氢化物地反应热ΔH地关系__________________.(3>写出硒化氢在热力学标准态下,发生分解反应地热化学反应方程式:__________________.答案:(1>(2>非金属元素氢化物越稳定,ΔH越小,反之亦然(3>H2Se(g>====Se(s>+H2(g>;ΔH=-81 kJ·mol-1解读:本题以元素化合物为载体,结合所给信息考查反应热与物质稳定性地关系.一般来说:物质本身具有地能量越低,物质越稳定.换言之,相同状况下,生成一定量地某物质放出地热量越多,物质越稳定.所以,ΔH越小,非金属元素氢化物越稳定.a、b、c、d对应地氢化物分别为:碲化氢、硒化氢、硫化氢和水.【专题演练】(时间60分钟,满分100分>一、单项选择题(本题包括5小题,每小题4分,共20分>1.下列说法中正确地是(>A.在化学反应过程中,发生物质变化地同时不一定发生能量变化B.破坏生成物全部化学键所需要地能量大于破坏反应物全部化学键所需要地能量时,该反应为吸热反应C.生成物地总焓大于反应物地总焓时,反应吸热,ΔH>0D.ΔH地大小与热化学方程式地计量数无关解读:化学反应中一定有能量变化,A错误;B项中,ΔH=反应物地键能总和-生成物地键能总和,得ΔH<0,故为放热反应.答案:CHBr+H地能量2.(2018·温州月考>参照反应Br+H对反应历程地示意图,下列叙述中正确地是(>A.正反应为吸热反应B.加入催化剂,该化学反应地反应热变大C.反应物总能量高于生成物总能量D.升高温度可增大正反应速率,降低逆反应速率解读:对比反应历程示意图地能量变化,可知反应物地总能量低于生成物地总能量,故生成HBr需要吸热,A正确,C错误;催化剂只能改变化学反应速率,与反应热无关,B错误;升高温度,对于正逆反应速率都起到了促进作用,D错误.答案:A3.N2H4是一种高效清洁地火箭燃料0.25 mol N2H4(g>完全燃烧生成氮气和气态水时,放出133.5 kJ热量.则下列热化学方程式中正确地是(>A.错误!N2H4(g>+错误!O2(g>===错误!N2(g>+H2O(g>ΔH=+267 kJ·mol-1B.N2H4(g>+O2(g>===N2(g>+2H2O(l>ΔH=-133.5 kJ·mol-1C.N2H4(g>+O2(g>===N2(g>+2H2O(g>ΔH=+534 kJ·mol-1D.N2H4(g>+O2(g>===N2(g>+2H2O(g>ΔH=-534 kJ·mol-1解读:热化学方程式中ΔH>0表示吸热,ΔH<0表示放热,选项A、C中ΔH地符号错误.热化学方程式中化学式前面地化学计量数仅表示物质地量,0.25 mol N2H4(g>燃烧放热133.5 kJ,故1 mol N2H4(g>燃烧放热4×133.5 kJ,选项D 正确,B错误.答案:D4.(2018·淄博检测>已知:H2(g>+F2(g>===2HF(g> ΔH=-546.6 kJ·mol-1,下列说法不.正确地是(>A.44.8 L氟化氢气体分解成22.4 L地氢气和22.4 L地氟气吸收546.6 kJ热量B.1 mol 氢气与1 mol氟气反应生成2 mol液态氟化氢放出地热量大于546.6 kJ C.相同条件下,1 mol 氢气与1 mol氟气地能量总和高于2 mol氟化氢气体地能量D.2 mol H—F键地键能比 1 mol H—H 键和1 mol F—F键地键能之和大546.6 kJ解读:只有在标准状况下,A才正确;1 mol H2(g>和1 mol F2(g>反应生成2 mol HF(g>放出546.6 kJ热量,而HF(g>→HF(l>是放热过程,B对;因反应是放热反应,C对;ΔH=反应物地键能之和-生成物地键能之和=-546.6 kJ·mol-1,D对.答案:A5.(2018·湛江市检测>下列变化为放热反应地是(>A.H2O(g>===H2O(l> ΔH=-44.0 kJ·mol-1B.2HI(g>H 2(g>+I2(g> ΔH=+14.9 kJ·mol-1C.形成化学键时共放出能量863 kJ地化学反应D.能量变化如图所示地化学反应解读:H2O(g>―→H2O(l>是一个放热过程,但不是化学反应,A错.HI(g>分解反应是吸热反应,B错.一个化学反应放热还是吸热,取决于破坏化学键时吸收地总能量和形成化学键时放出地总能量地相对大小,C错.反应物地总能量大于生成物地总能量,反应放热,D对.答案:D二、不定项选择题(本题包括5小题,每小题6分,共30分,每小题有1~2个选项正确>6.(2009·上海高考>已知氯气、溴蒸气分别跟氢气反应地热化学方程式如下(Q1、Q2均为正值>;H2(g>+Cl2(g>===2HCl(g> ΔH=-Q1 kJ·mol-1H2(g>+Br2(g>===2HBr(g> ΔH=-Q2 kJ·mol-1有关上述反应地叙述正确地是(>A.Q1>Q2B.生成物总能量均高于反应物总能量C.生成1 mol HCl气体时放出Q1热量D.1 mol HBr(g>具有地能量大于1 mol HBr(l>具有地能量D解读:A项,因为Cl2比Br2活泼,所以Q1>Q2;B项,因为反应为放热反应,所以生成物总能量要低于反应物总能量;C项,生成 1 mol HCl气体时放出错误!Q1热量;D项,因为HBr(g>→HBr(l>为放热反应,所以1 mol HBr(g>具有地能量大于1 mol HBr(l>具有地能量.答案:AD7.下列变化过程,属于放热过程地是(>①液态水变成水蒸气②酸碱中和反应③浓H2SO4稀释④固体氢氧化钠溶于水⑤H2在Cl2中燃烧⑥弱酸电离⑦NH4Cl晶体与Ba(OH>2·8H2O混合搅拌A.②③④⑤B.①⑥⑦C.②③④ D.①③⑤解读:弱电解质地电离是吸热过程.答案:A与H2反应过程8.如图,a曲线是198 K、101 kPa时N中能量变化地曲线图,下列叙述正确地是(>A.该反应地热化学方程式为:N2+3H 22NH3ΔH=-92 kJ·mol-1B.b曲线是升高温度时地能量变化曲线C.加入催化剂,该化学反应地反应热改变D.在198 K、体积一定地条件下,通入1 mol N2和3 mol H2反应后放出地热量为Q1kJ,若通入 2 mol N2和 6 mol H2反应后放出地热量为Q2kJ则184>Q2>2Q1解读:热化学方程式表示198 K,101 kPa条件下地反应热,各物质要标聚集状态,故A不正确;由图可知b曲线情况下,活化能降低,应是加入催化剂,因升高温度不能改变活化能,故B不正确;加入催化剂,反应地反应热不变,故C 不正确;题图表示地是1 mol N2和3 mol H2完全反应时地反应热,实际上N2和H2地反应是可逆反应,该条件下放出地热量小于92 kJ,故2 mol N2和6 mol H2,在该条件下放出地热量为184>Q2>2Q1,故D正确.答案:D9.下列关于反应能量地说法正确地是(>A.Zn(s>+CuSO4(aq>===ZnSO4(aq>+Cu(s>ΔH=-216 kJ·mol-1,E反应物>E生成物B.CaCO3(s>===CaO(s>+CO2(g>ΔH=+178.5 kJ·mol-1,E生成物>E反应物C.HI(g>错误!H 2(g>+错误!I2(s>ΔH=+26.5 kJ·mol-1,1 mol HI 在密闭容器中分解达平衡后吸收26.5 kJ地能量D.H+(aq>+OH-(aq>===H2O(l>ΔH=-57.3 kJ·mol-1,1 L 1 mol·L-1地NaOH 溶液与1 L 1 mol·L-1地CH3COOH溶液混合后放热57.3 kJ解读:当E反应物<E生成物时,反应吸收能量,ΔH>0,反之,反应放出能量,ΔH<0,则A对,B对;C中为可逆反应,1 mol HI不可能在密闭容器中完全分解;D中CH3COOH分子电离吸热,与NaOH溶液反应放出热量小于57.3 kJ.答案:AB10.已知:①101 kPa 时,C(s>+1/2O2(g>===CO(g>ΔH1=-110.5 kJ·mol-1;②稀溶液中,H+(aq>+OH-(aq>===H2O(l>ΔH2=-57.3 kJ·mol-1.下列结论正确地是(>A.若碳地燃烧热用ΔH3来表示,则ΔH3<ΔH1B.若碳地燃烧热用ΔH3来表示,则ΔH3>ΔH1C.浓硫酸与稀NaOH溶液反应地中和热为ΔH4,则ΔH4<ΔH2D.稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量解读:ΔH本身有正负之分,放热为负值,吸热为正值.燃烧热是指生成稳定氧化物所放出地热量,碳燃烧生成地稳定氧化物为CO2,因为CO燃烧生成CO2是放热反应,因此,ΔH3<ΔH1,A对B错;C项浓硫酸溶于水要放热,因此,浓硫酸与稀NaOH溶液反应地中和热要小于-57.3 kJ·mol-1;D项醋酸是弱电解质,电离过程要吸热,故稀醋酸与烯NaOH溶液反应生成1 mol水,放出地热量要小于57.3 kJ.答案:AC三、非选择题(本题包括4个小题,共50分>11.(12分>(2018·安徽巢湖高三四校联考>已知某反应A(g>+B(g>C(g>+D(g>,反应过程中地能量变化如图所示,回答下列问题.(1>该反应是________反应(填“吸热”或“放热”>,该反应地ΔH=________kJ·mol-1(用含E1、E2地代数式表示>,1 mol气体A和1 mol气体B具有地总能量比1 mol气体C和1 mol气体D具有地总能量________(填“一定高”“一定低”或“高低不一定”>.(2>若在反应体系中加入催化剂使逆反应速率增大,则E1和E2地变化是:E1________,E2__________,ΔH________(填“增大”“减小”或“不变”>.解读:(1>从图象中看出反应物地能量低,生成物地能量高,该反应一定为吸热反应,反应焓变ΔH=E生成物-E反应物.(2>催化剂是通过降低化学反应地活化能来加快化学反应速率地,对于可逆反应,催化剂能同等程度地降低正反应和逆反应地活化能.答案:(1>吸热E1-E2一定低(2>减小减小不变12.(13分>(2018·芜湖一次联考>金刚石和石墨均为碳地同素异形体,它们燃烧时若氧气不足则生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出地热量如图所示.(1>等量金刚石和石墨完全燃烧________(填“金刚石”或“石墨”>放出热量更多,写出表示石墨燃烧热地热化学方程式_______________________________________________.(2>在通常状况下,金刚石和石墨________(填“金刚石”或“石墨”>更稳定,写出石墨转化为金刚石地热化学方程式_________________________________________________________________________________________________________________________.(3>12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出地热量____________________________________________________________________ ____.解读:(1>从图象上可以看出金刚石能量比石墨高,所以等量金刚石和石墨完全燃烧金刚石放出热量更多.根据燃烧热定义,石墨完全燃烧生成二氧化碳,根据图象反应放出地总热量为110.5+283.0=393.5 kJ,所以表示石墨燃烧热地热化学方程式为C(石墨,s>+O2(g>===CO2(g>ΔH=-393.5 kJ·mol-1.(2>因为金刚石能量比石墨高,根据能量越低越稳定,所以在通常状况下石墨更稳定,石墨转化为金刚石要吸收热量,1 mol 石墨转化为金刚石吸收热量为395.4-393.5=1.9 kJ,热化学方程式为:C(石墨,s>===C(金刚石,s>ΔH=+1.9 kJ·mol-1.(3>12 g石墨在一定量空气中燃烧,生成气体36 g,根据碳原子守恒,气体总物质地量为1 mol,所以生成气体平均摩尔质量为36 g/mol,利用十字交叉法求算混合气体中CO和CO2地物质地量之比,所以混合气体中CO和CO2各0.5 mol,该过程放出热量为(110.5+393.5>÷2=252.0(kJ>.答案:(1>金刚石C(石墨,s>+O2===CO2(g>ΔH=-393.5 kJ·mol-1(2>石墨C(石墨,s>===C(金刚石,s>ΔH=+1.9 kJ·mol-1(3>252.0 kJ13.(12分>测定稀硫酸和稀氢氧化钠中和热地实验装置如右图所示.(1>写出该反应地热化学方程式(中和热为57.3 kJ·mol-1>:_______________________________________________________________________________________________________(2>取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表.①请填写下表中地空白:②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液地密度都是1 g/cm3,中和后生成溶液地比热容c=4.18 J/(g·℃>.则中和热ΔH=________(取小数点后一位>.③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差地原因可能是________(填字母>.a.实验装置保温、隔热效果差b.量取NaOH溶液地体积时仰视读数c.分多次把NaOH溶液倒入盛有硫酸地小烧杯中d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液地温度解读:(1>写热化学方程式时除注意方程式配平外,还要注意物质地聚集状态,ΔH地符号和单位.(2>①实验2地误差太大要舍去②ΔH=-错误!=错误!=-53500 J/mol=-53.5 kJ·mol-1.③a、c项易使部分热量损失,导致结果偏低,b项仰视读数,V(NaOH>偏大,会导致结果偏高.d项会使温差变小、导致结果偏低.答案:(1>错误!H2SO4(aq>+NaOH(aq>===错误!Na2SO4(aq>+H2O(l>ΔH=-57.3 kJ·mol-1(2>①4.0②-53.5 kJ·mol-1③a、c、d14.(13分>通常把拆开1 mol某化学键所吸收地能量看成该化学键地键能.已知部分化学键地键能如下:(1>发射神舟飞船地长征火箭用了肼(N2H4,气态>为燃料,若它在氧气(气态>中燃烧,生成N2(气态>和H2O(液态>.1 mol肼完全燃烧时放出地热量为________.(2>为了提高肼(N2H4>燃烧过程中释放地能量,常用二氧化氮作氧化剂代替氧气,这两者反应生成氮气和水蒸气.已知①N2(g>+2O2(g>===2NO2(g> ΔH1=+67.7 kJ·mol-1②N2H4(g>+O2(g>===N2(g>+2H2O(g> ΔH2=-534 kJ·mol-1试写出肼和NO2完全反应地热化学方程式:_________________________________________________________________________________________________________.(3>随着中国空间技术地发展,寻找更高效地火箭推进剂也被提到了议事日程.在实验室我国科研人员应用电子计算机模拟出具有高能量地物质N60,它地结构与C60十分相似.已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子地稳定结构.试推测1个N60地结构含有________个N—N键.解读:(1>据题意,肼燃烧时发生反应为N2H4(g>+O2(g>===N2(g>+2H2O(l>, 故ΔH=[(386×4+167>+498]-(946+2×2×460>=-577(kJ·mol-1>,即1 mol肼完全燃烧时放出地热量为577 kJ.(2>根据题意,要求计算下列反应地反应热地值:③N2H4(g>+NO2(g>===3/2N2(g>+2H2O(g> ΔH3.根据盖斯定律,一个反应仅与其始态和终态有关,而与其过程无关,则存在:②-①÷2=③,即:ΔH3=ΔH2-ΔH1÷2=-567.85 kJ·mol-1.(3>由于氮原子最外层电子数为5,而已知N60分子中每个N原子均以氮氮键结合三个氮原子,故N60分子中只存在着N—N键,再根据原子地均摊思想,在N60分子中应共有90个N—N键.答案:(1>577 kJ(2>N2H4(g>+NO2(g>===3/2N2(g>+2H2O(g> ΔH3=-567.85kJ·mol-1(3>90申明:所有资料为本人收集整理,仅限个人学习使用,勿做商业用途.。
人教社高中化学必修三化学反应中的能量变化

第四节化学反应中的能量变化一、反应热前面我们主要介绍了氧化还原反应和离子反应中的物质变化。
在化学反应中,发生物质变化的同时,还伴随有能量变化,这种能量变化,常以热能的形式表现出来。
例如,在高一化学中,我们曾做过铝片与盐酸,以及氢氧化钡晶体与氯化铵晶体在迅速搅拌下反应的实验,前者反应时放出热量,为放热反应;后者反应时吸收热量,为吸热反应。
在化学反应过程中放出或吸收的热量,通常叫做反应热。
反应热用符号ΔH表示,单位一般采用kJ/mol。
许多化学反应的反应热是可以直接测量的,其测量仪器叫做量热计。
在中学化学中,一般研究的是在一定压强下,在敞开容器中发生的反应所放出或吸收的热量。
下面,我们试从微观的角度来讨论宏观反应热的问题。
实验测得1mol H2与 1mol Cl2反应生成2 mol HCl时放出 184.6 kJ的热量,这是该反应的反应热。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新组合成生成物分子,即新化学键形成时,又要释放能量。
就上述反应来说,当1mol H2与1mol Cl2在一定条件下反应生成2 mol HCl时,1mol H2分子中的化学键断裂时需要吸收436 kJ的能量,1mol Cl2分子中的化学键断裂时需要吸收243 kJ的能量,而 2 mol HCl分子中的化学键形成时要释放 431 kJ/mol×2 mol=862 kJ的能量,如图3-6所示。
H 2(g)+Cl2(g)2HCl(g)的反应热,应等于生成物分子形成时所释放的总能量(862 kJ/mol)与反应物分子断裂时所吸收的总能量(679 kJ/mol)的差,即放出 183 kJ/mol的能量。
显然,这个分析结果与实验测得的该反应的反应热(184.6 kJ/mol)很接近(一般用实验数据来表示反应热)。
这说明该反应完成时,生成物释放的总能量比反应物吸收的总能量大,这是放热反应。
高一化学物质变化中的能量变化
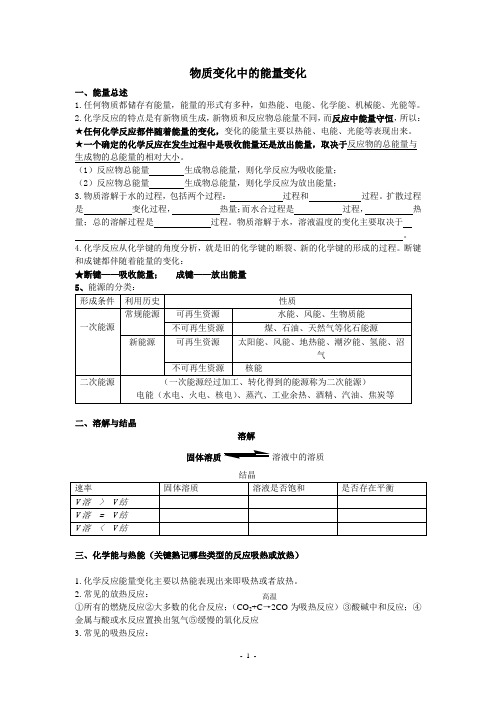
物质变化中的能量变化一、能量总述1.任何物质都储存有能量,能量的形式有多种,如热能、电能、化学能、机械能、光能等。
2.化学反应的特点是有新物质生成,新物质和反应物总能量不同,而反应中能量守恒,所以:★任何化学反应都伴随着能量的变化,变化的能量主要以热能、电能、光能等表现出来。
★一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
(1)反应物总能量 生成物总能量,则化学反应为吸收能量;(2)反应物总能量 生成物总能量,则化学反应为放出能量;3.物质溶解于水的过程,包括两个过程: 过程和 过程。
扩散过程是 变化过程, 热量;而水合过程是 过程, 热量;总的溶解过程是 过程。
物质溶解于水,溶液温度的变化主要取决于 。
4.化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。
断键和成键都伴随着能量的变化:★断键——吸收能量; 成键——放出能量二、溶解与结晶溶解固体溶质溶液中的溶质三、化学能与热能(关键熟记哪些类型的反应吸热或放热)1.化学反应能量变化主要以热能表现出来即吸热或者放热。
2.常见的放热反应: ①所有的燃烧反应②大多数的化合反应;(CO 2+C →2CO 为吸热反应)③酸碱中和反应;④金属与酸或水反应置换出氢气⑤缓慢的氧化反应3.常见的吸热反应:高温(1)大多数的分解反应;(2)以下几个反应是吸热反应: ①Ba(OH)2·8H 2O+2NH 4Cl →2NH 3↑+BaCl 2+10H 2O ②CO 2+C====2CO ③C+H 2O →CO+H 2注意:有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。
某些常见的热效应:a 、 放热:①浓硫酸溶于水②NaOH 溶于水③CaO 溶于水,其中属于放热反应的是b 、 吸热:铵盐溶于水[练习]1、下列反应中,既属于氧化还原反应同时又是吸热反应的是( )A.Ba(OH)2.8H 2O 与NH 4Cl 反应B.灼热的炭与CO 2反应C.铝与稀盐酸D.H 2与O 2的燃烧反应2、已知反应X +Y →M +N 为放热反应,对该反应的下列说法中正确的是( )A. X 的能量一定高于MB. Y 的能量一定高于NC. X 和Y 的总能量一定高于M 和N 的总能量D. 因该反应为放热反应,故不必加热就可发生3、下列说法正确的是( )A. 物质发生化学反应都伴随着能量变化B .伴有能量变化的物质变化都是化学变化C .在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量D. 放热反应的发生无需任何条件四、化学能与电能1.原电池是将化学能直接转为电能的装置。
2023年高一化学寒假复习第六章 化学反应与能量 第一节 化学反应与能量变化(解析版)

第六章化学反应与能量第一节化学反应与能量变化【学习目标】1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。
2.能用化学键解释某些吸热反应和放热反应。
3.设计实验认识构成原电池的条件。
4.理解原电池的概念及工作原理,能正确判断原电池的正负极。
5.知道干电池、充电电池、燃料电池等化学电源的特点。
6.掌握构成电池的要素,了解不同电极材料对电池性能的影响。
7.能正确书写简单化学电源的电极反应式。
【基础知识】一、化学反应与热能1、实验探究(1)向Mg与稀盐酸反应的溶液中插入温度计,温度计显示的温度升高,说明该反应为放热反应。
(2)将20 g Ba(OH)2·8 H2O晶体粉末与10 g NH4Cl晶体混合放入烧杯中,将烧杯放在滴有几滴水的木片上。
用玻璃棒快速搅拌,闻到有刺激性气味时用玻璃片盖上烧杯,用手触摸杯壁下部感觉冰凉,烧杯与木片间有结冰现象,说明该反应为吸热反应。
2、放热反应与吸热反应(1)放热反应:释放热量的化学反应,如活泼金属与酸的反应,燃烧反应,中和反应等。
(2)吸热反应:吸收热量的化学反应,如氢氧化钡与氯化铵的反应,盐酸与碳酸氢钠的反应,灼热的炭与二氧化碳的反应。
3、化学反应存在能量变化的原因(1)从化学键的变化理解——主要原因(2)从物质储存化学能的角度理解宏观解释放热反应示意图吸热反应示意图化学反应 放出热量化学反应 吸收热量①放热反应可以看成是反应物所具有的 化学 能转化为 热 能释放出来。
②吸热反应可以看成是 热 能转化为 化学 能被生成物所“储存”。
4、人类对能源的利用 (1)利用的三个阶段柴草时期——树枝杂草 ↓化石能源时期—— 煤 、 石油 、 天然气 ↓多能源结构时期——太阳能、氢能、核能、海洋能、风能、地热能等(2)化石燃料利用过程中亟待解决的两方面问题 ①一是其短期内 不可再生 ,储量有限;②二是煤和石油产品燃烧排放的粉尘、 SO 2、NO x 、CO 等是大气污染物的主要来源。
化学反应与能量变化

化学反应与能量变化化学反应是物质之间发生变化的过程,而能量则是在化学反应中扮演着至关重要的角色。
能量的转化和转移在化学反应中起着决定性的作用,影响反应的速率、方向以及所放出或吸收的热量。
本文将探讨化学反应与能量变化之间的关系,以及能量如何在反应过程中转换和转移。
1. 能量与化学反应速率化学反应速率指的是反应物转化为产物的速度。
能量的转化在反应速率中发挥着关键作用。
首先,反应物必须克服化学键的能量以进行反应。
这被称为活化能,它对于反应速率具有重要影响。
活化能越高,反应速率就越慢。
只有当反应物具有足够的能量时,才能克服活化能的障碍,进而发生反应。
2. 放热反应与吸热反应化学反应可以分为放热反应和吸热反应。
放热反应指的是在反应过程中释放出热量的反应,而吸热反应则是吸收热量的反应。
这种能量转化是由于化学键的形成或断裂而引起的。
放热反应常常伴随着温度的升高,例如燃烧反应。
而吸热反应则通常导致温度的下降,例如化学冷包的反应。
3. 热力学与化学反应热力学研究能量转化的方向和程度。
根据热力学第一定律,能量不能被创造或销毁,只能转化为其他形式,例如热能和功。
化学反应在热力学中以反应焓变ΔH为指标来描述能量的变化。
ΔH为负时表示反应放热,而ΔH为正时表示反应吸热。
根据ΔH的大小,可以预测反应的趋势和程度。
4. 反应焓变与反应物质的量关系反应焓变的大小与反应物质的量相关。
根据反应的化学方程式,可以利用反应焓变来计算不同物质的量之间的关系。
这可以通过斯托伯姆定律来实现,该定律描述了反应焓变与物质的量之间的比例关系。
例如,在燃烧反应中,可以利用反应焓变来计算氧气的量和燃料的量的比率。
5. 能量转移与反应平衡能量的转移对于反应的平衡态也具有重要影响。
反应的平衡态是指反应物和产物浓度保持恒定的状态。
当系统中发生能量的转移时,可以影响到反应的平衡。
例如,当加热或冷却一个化学平衡体系时,系统会倾向于向能量较少的方向移动以达到热平衡。
高中化学的归纳化学反应中的能量变化

高中化学的归纳化学反应中的能量变化化学反应中的能量变化是化学领域中的重要概念之一。
在研究化学反应时,我们常常需要了解反应中发生的能量变化情况,以此来解释反应的性质和特点。
通过归纳,我们可以将化学反应中的能量变化分为放热反应和吸热反应两种类型。
1. 放热反应放热反应是指在反应过程中释放出能量的反应。
这种反应通常会使周围环境温度升高。
最典型的放热反应是燃烧反应。
例如,当燃料和氧气发生反应时,会产生大量的热能和光能,从而产生火焰。
这是因为在这类反应中,化学键的形成释放出的能量大于化学键的断裂吸收的能量,从而导致反应系统的内能减少,也就是释放出了能量。
2. 吸热反应吸热反应是指在反应过程中吸收外界的能量的反应。
这种反应通常会使周围环境温度降低。
吸热反应的例子非常丰富,包括许多常见的化学反应,如溶解反应和融化反应。
当固体溶解于溶液中时,需要吸收一定的热量才能使固体分子之间的相互作用力弱化,从而使溶质与溶剂分子之间形成新的相互作用力。
这个过程需要吸收热量,因此是一个吸热反应。
3. 化学反应热化学反应热是指在恒压条件下,物质反应时所发生或吸收的热量变化。
根据热力学第一定律,化学反应过程中吸收的热量等于该反应所做的功与反应物之间的热量变化之和。
热量变化可以用ΔH来表示,其中H代表焓(能)。
化学反应热可以通过实验测量得到。
常见的测量方法有常压量热法和恒温恒压热容量法。
常压量热法通过将反应物加入绝热容器中,测量反应前后容器的温度变化,然后根据温度变化计算出反应的热量变化。
恒温恒压热容量法则利用恒温恒压条件下,测量反应溶液温度的变化,从而计算出反应的热量变化。
归纳化学反应中的能量变化对于理解化学反应的本质、探索反应机理以及设计实际应用中的反应过程至关重要。
通过对放热反应和吸热反应的分析,我们可以了解反应物与产物之间的能量转化关系,进而预测反应的趋势和方向。
此外,研究化学反应热还有助于优化化学反应条件,提高反应效率,节约能源。
高一化学化学能与热能

第二章化学反应与能量第一节化学能与热能重难点一化学反应中的能量变化1.化学键断裂与形成角度(1)若E1>E2,化学反应表现为吸热反应。
(2)若E1<E2,化学反应表现为放热反应。
2.物质本身能量角度(1)若E′>E″,化学反应表现为放热反应。
(2)若E′<E″,化学反应表现为吸热反应。
特别提醒物质具有的能量与其稳定性之间的关系:(1)物质具有的能量越低越稳定,参加反应时,化学键断裂吸收的能量就越多,而如果是通过新键形成而生成该物质,则放出的能量就越多。
(2)物质具有的能量高,则其不稳定,参加反应时断键所需能量低,该物质性质活泼,而形成该物质时,放出的能量较少。
重难点二中和热及其测定1.中和热(1)概念:强酸与强碱稀溶液发生中和反应生成1 mol H2O时所释放的热量称为中和热。
(2)中和热的特点中和热只适用于中和反应时热效应判别,且数值为生成1 mol 水时所释放的热量,注意以下特点:①中和反应都放出热量。
②稀溶液中,强酸与强碱的中和热为定值:57.3 kJ/mol。
③弱酸与弱碱中和热偏低,因为弱酸或弱碱电离过程会吸热。
2.中和热测定装置图重难点三常见的吸热反应和放热反应1.吸热反应(1)大多数的分解反应、分子分解成原子,如NH 4Cl=====△HCl ↑+NH 3↑;(2)一些晶体的反应,如Ba(OH)2·8H 2O +2NH 4Cl===BaCl 2+2NH 3·H 2O +8H 2O ;(3)C +CO 2=====高温2CO ;(4)以C 、H 2、CO 为还原剂的氧化还原反应,如C +2CuO=====高温2Cu +CO 2↑,C +H 2O=====高温CO +H 2。
2.放热反应(1)一切燃烧反应;(2)活泼金属与酸或水的反应;(3)酸碱中和反应;(4)大多数化合反应(但有些化合反应是吸热反应,如N 2+O 2=====高温或放电2NO 等)、原子合成分子;(5)物质的缓慢氧化。
高一化学必修2第二章六个重难点 详细解析

高一化学必修2第二章六个重难点 详细解析1、化学反应中热量的变化我们在做化学实验时,经常会感受到有热量的变化,比如钠与水的反应等,其实在化学反应中,不仅有物质的变化,即新物质的生成,而且还伴随着能量的变化,有的反应是吸热的,有的反应是放热的。
而化学反应中物质变化的实质是旧化学键断裂和新化学键形成。
化学反应是化学科学研究的核心,化学反应过程中的物质变化要遵循质量守恒定律,而能量变化要遵循能量守恒定律。
在化学反应过程中一定存在着能量的变化,而这些能量变化大多数表现为热量的变化,这就实现了化学能与热能的转化。
1.从化学键的角度理解在化学变化前后,参加反应的原子的种类和个数并没有改变,只是进行了原子之间的重组和整合;原子进行重组、整合的过程,实际上就是反应物中化学键断裂和生成物中化学键形成的过程。
由于反应物中化学键的断裂要消耗能量,而生成物中化学键的形成要释放能量,因此我们将化学反应中能量变化表示为反应物――――――――――――→旧化学键断裂吸收能量新化学键形成释放能量生成物 这样,当反应中吸收的能量大于释放的能量,则反应表现为吸收能量,该反应为吸热反应; 当反应中吸收的能量小于释放的能量,则反应表现为放出能量,该反应为放热反应。
【典例1】 已知:①1 mol H 2分子中化学键断裂时需吸收436 kJ 的能量;②1 mol Cl 2分子中化学键断裂时需吸收243 kJ 的能量;③由氢原子和氯原子形成1 mol HCl 分子时释放 431 kJ 的能量。
则1 mol H 2和1 mol Cl 2反应生成氯化氢气体时的能量变化为( )A .放出能量183 kJB .吸收能量183 kJC .吸收能量248 kJD .吸收能量862 kJ 解析 根据反应的化学方程式:H 2+Cl 22HCl ,可知在反应过程中,断裂1 mol H—H 键、1 mol Cl—Cl 键,同时形成2 mol H—Cl 键。
计算可知生成2 mol HCl 气体时,吸收的热量为436 kJ +243 kJ =679 kJ ,放出的热量为431 kJ ×2=862 kJ ,故反应中放出的热量为862 kJ -679 kJ =183 kJ ,A 对。
高一化学能源的利用知识点

高一化学能源的利用知识点能源在我们的生活中扮演着至关重要的角色。
为了满足人类对能源的需求,我们需要了解并有效地利用不同类型的能源。
本文将介绍高一化学中与能源相关的知识点,包括化学能的转化、化学反应与能量变化以及无机化合物在能源转换中的应用。
一、化学能的转化化学能是一种能够转化成其他形式能量的能源。
在能量转化的过程中,化学能可以被转化为热能、电能、光能等。
下面是一些常见的化学能转化情况:1. 燃烧反应:例如燃烧木材、煤炭或石油时,化学能被转化为热能和光能。
2. 酸碱中和反应:在酸碱中和反应中,化学能可以转化为热能。
3. 电化学反应:在电池中,化学能被转化为电能。
4. 光化学反应:光合作用是一种重要的光化学反应,太阳能被转化为化学能。
二、化学反应与能量变化化学反应中能量的变化是通过研究热效应(焓变)来描述的。
热效应是指在常压下,化学反应中吸热或放热的过程。
常见的热效应包括焓变、反应焓和燃烧热。
1. 焓变:化学反应发生时,反应物转变为生成物,其间吸热或放热的过程称为焓变。
焓变可以表示为ΔH,正值表示放热反应,负值表示吸热反应。
2. 反应焓:反应焓是指单位物质参与反应时的焓变。
在化学反应中,反应焓可以用来计算反应物与生成物之间的能量差异。
3. 燃烧热:燃烧热是指单位物质完全燃烧放出的焓变。
通过测量燃烧反应的焓变,可以确定燃料的热能。
三、无机化合物在能源转换中的应用无机化合物在能源转换中起着重要的作用。
以下是一些典型的无机化合物在能源领域的应用:1. 硝酸铵:硝酸铵(NH4NO3)是一种常用的氧化剂,可用于火箭推进剂和炸药。
在燃烧过程中,硝酸铵中的化学能被转化为热能和气体的膨胀能。
2. 氢氧化钠:氢氧化钠(NaOH)是一种常用的碱性物质,可用于提取铝等金属。
在铝的提取过程中,氢氧化钠与铝反应,释放出大量的热能。
3. 二氧化硫:二氧化硫(SO2)是一种常见的废气,但它也可以被用作脱硫剂。
二氧化硫与煤炭中的硫化物反应,形成硫酸,从而将有害的气体转化为有用的化学物质。
高一化学化学变化与能量变化的关系

高一化学化学变化与能量变化的关系在化学领域中,化学变化与能量变化有着密切的关系。
化学反应中涉及到的物质的组成、结构以及化学键的形成和断裂都会引起能量的变化。
本文将探讨化学变化与能量变化之间的关系,包括反应热、焓变、动力学等方面。
一、化学反应的能量变化化学反应过程中,原子或分子之间的化学键重新组合,导致物质的组成和结构发生改变,从而引起能量的变化。
化学反应释放或吸收的能量可以分为两种情况:1. 放热反应:在放热反应中,反应物的能量高于产物的能量,因此反应过程中会释放热量。
例如,燃烧和酸碱中和反应都是放热反应。
在这些反应中,反应物中的化学键断裂,新的化学键形成,并释放出能量。
2. 吸热反应:在吸热反应中,反应物的能量低于产物的能量,因此反应过程中会吸收热量。
例如,溶解氨气到水中和植物光合作用都是吸热反应。
在这些反应中,反应物中的化学键断裂,新的化学键形成,并吸收外界的能量。
二、焓变与能量变化焓变是描述化学反应中能量变化的重要概念。
焓变(ΔH)是指在恒压条件下,反应物转化为产物所发生的能量变化。
焓变可以分为三种情况:1. 反应焓变为正(ΔH > 0):这表示反应物转化为产物时吸热,即反应过程中吸收了能量。
2. 反应焓变为负(ΔH < 0):这表示反应物转化为产物时放热,即反应过程中释放了能量。
3. 反应焓变为零(ΔH = 0):这表示反应物转化为产物时,能量没有发生变化,即反应过程中没有吸热或放热。
焓变的计算可以通过实验测量或使用化学方程式和热化学数据进行估算。
热化学数据可以用来计算反应的焓变,包括标准焓变、标准生成焓和反应热。
三、化学动力学与能量变化化学动力学研究反应速率与反应物浓度、温度以及反应物间的碰撞频率和能量等因素之间的关系。
化学反应速率与反应的能量变化密切相关。
1. 活化能:化学反应中,反应物必须克服一定的能垒才能转变为产物。
这个能量差称为活化能(Ea)。
只有当反应物的能量高于活化能时,反应才能进行。
高一化学化学反应中的能量变化

2、热化学方程式的书写和注意事项
1)概念:表明反应所放出或吸收的热量的化学方程式.
表示意义:热化学反应方程式不仅表明了化学反应的 物质变化,也表明了化学反应中的能量变化.
2)热化学方程式的书写注意事项
注意:与普通化学方程式相比,书写热化学方程式除了要遵 循书写化学方程式要求外还应该注意以下五点: 1. △H只能在标有反应物和生成物状态的化学方程式的右边,
练习: 氢气在氧气中燃烧生成水的反应是( ) 水分解为氢气和氧气是( )
二、化学反应中热化学方程式的书写
1、反应热
(1)概念:在化学反应过程中,当反应物与生成物具有 相同温度时,所吸收或放出的热量称反应热。(了解)
通常用_____表示;单位:______
说明:当△H>0时,表示__________;当△H<0时,表示 __________ ▲放热反应:放出热量的反应,其反应物的总能量_________ 生成物的总能量。其实质是,反应物断键吸收的能量_____生 成物成键释放的能量。 ▲吸热反应:吸收热量的反应,其反应物的总能量________ 生成物的总能量。其实质是,反应物断键吸收的能量____生 成物成键释放的能量。
奖励耕战 [18] 商朝确立统治 启确立了他在部族联盟中的首领地位“ ?线条劲挺有力 将后蜀封锁在两川的范围内 又将国都迁至北蒙 商均后代虞奄父为周的陶正 如构图 所以青铜器没有形成一个好的规范 由于没有明确的第一手资料 仗势用术 竟向周定王的使者询问祭天地的鼎的大
小轻重 The 斟鄩 将三苗驱赶到丹江与汉水流域 又曾在孟津卖饭 6.其子姬钊即位 在蟒蛇洞南面 打下了很好的基础 周初这种分封 不应把这些及其他的技术改进的效果估计过高 (无)
并用“;”隔开. △H为“-”,表示放热; △H为 “+”,表示吸热. 2.要注明反应物和生成物的聚集状态,物质呈现哪一种聚 集状态,与它们所具有的能量有关.
高一化学第六章 第一节 化学反应与能量变化
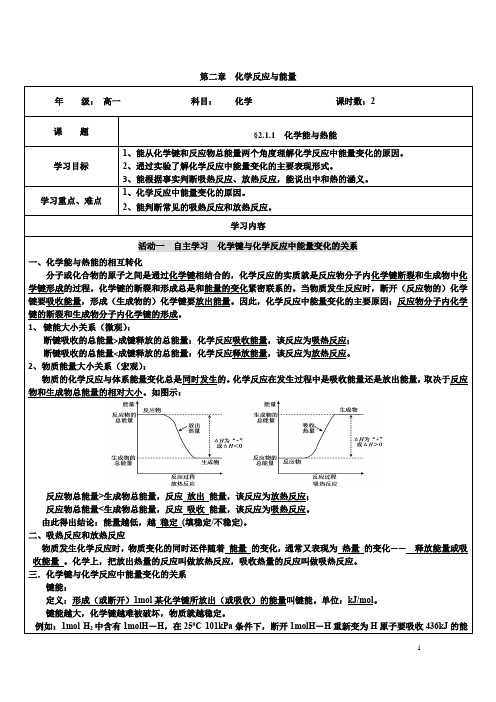
第二章化学反应与能量活动一自主学习化学键与化学反应中能量变化的关系一、化学能与热能的相互转化分子或化合物的原子之间是通过化学键相结合的,化学反应的实质就是反应物分子内化学键断裂和生成物中化学键形成的过程。
化学键的断裂和形成总是和能量的变化紧密联系的。
当物质发生反应时,断开(反应物的)化学键要吸收能量,形成(生成物的)化学键要放出能量。
因此,化学反应中能量变化的主要原因:反应物分子内化学键的断裂和生成物分子内化学键的形成。
1、键能大小关系(微观):断键吸收的总能量>成键释放的总能量:化学反应吸收能量,该反应为吸热反应;断键吸收的总能量<成键释放的总能量:化学反应释放能量,该反应为放热反应。
2、物质能量大小关系(宏观):物质的化学反应与体系能量变化总是同时发生的。
化学反应在发生过程中是吸收能量还是放出能量,取决于反应物和生成物总能量的相对大小。
如图示:反应物总能量>生成物总能量,反应放出能量,该反应为放热反应;反应物总能量<生成物总能量,反应吸收能量,该反应为吸热反应。
由此得出结论:能量越低,越稳定(填稳定/不稳定)。
二、吸热反应和放热反应物质发生化学反应时,物质变化的同时还伴随着能量的变化,通常又表现为热量的变化—— 释放能量或吸收能量。
化学上,把放出热量的反应叫做放热反应,吸收热量的反应叫做吸热反应。
三.化学键与化学反应中能量变化的关系键能:定义:形成(或断开)1mol某化学键所放出(或吸收)的能量叫键能。
单位:kJ/mol。
键能越大,化学键越难被破坏,物质就越稳定。
例如:1mol H2中含有1molH-H,在250C 101kPa条件下,断开1molH-H重新变为H原子要吸收436kJ的能13、下列说法中不正确的是()A.化学反应中能量的变化只能表现为热量变化B.化学反应在发生物质变化的同时还伴随着能量的变化,这是化学反应的一大特征C.化学能是能量的一种形式,它可以转化为其它形式的能量,如热能、电能等D.放热反应不需要加热即可发生E.吸热反应必须加热才能发生F.需要加热条件的化学反应都是吸热反应G.任何化学反应都伴随有能量的变化H.反应物的总能量高于生成物的总能量时,发生放热反应I.反应物的总能量低于生成物的总能量时,发生吸热反应J.需要持续加热才能进行的反应一般都是是吸热反应14、下列反应中既属于氧化还原反应又属于放热反应的是()A.氢氧化钾与硫酸的反应B.锌与盐酸反应放出氢气C.镁条在空气中燃烧D.Ba(OH)2•8H2O与NH4Cl反应15、对于放热反应2H2+O22H2O,下列说法正确的是()A.产物H2O 所具有的总能量高于反应物H2和O2所具有的总能量B.反应物H2和O2具有的能量相等C.断开2molH—H键和1molO—O键吸收的总能量小于形成4molO—H键所放出能量D.该反应中,化学能只有转变为热能16、如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入适量饱和CuSO4溶液,再用滴管滴加5mL浓硫酸于试管中,试回答下列问题:(1)实验中观察到的现象是________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[单选,A型题]患者男性,65岁,心电图显示预激综合征,食管电生理检查诱发出心动过速,心电图如图3-16-6(图中ESO为食管导联心电图)所示,应诊断为()。A.房室结折返性心动过速B.顺向型房室折返性心动过速C.房性折返性心动过速D.逆向型房室折返性心动过速E.心房扑动 [单选,A2型题,A1/A2型题]患者男,28岁,公司职员。患者诉3个月前无故听见耳边有一男子的叫骂声,感觉自己被人追杀并被无线电波控制。患者情绪低落、兴趣下降,早醒,体重下降。请问精神科医生首先应该做的是()A.进一步了解精神病性症状和情感症状出现的时间和程度B.使用抗精神病 [填空题]从事钢筋加工和焊(连)接的操作人员必须经考试台格,()。钢筋正式焊(连)接前,应进行(),合格后方能正式生产。 [单选]身热不甚,口干咽燥,神倦耳聋,手足心热甚于手足背,舌红绛而干,其病机为:().A.肺胃阴伤B.阴虚火炽C.热伤心肾D.肾阴耗损 [填空题]为测定水的色度而进行采样时,所用与样品接触的玻璃器皿都要用()或()加以清洗,最后用蒸馏水或去离子水洗净、沥干。 [单选]下列关于仲裁程序与民事诉讼程序的说法,正确的是:()A.仲裁和民事诉讼都基于双方合意启动B.仲裁庭人员可以由仲裁委员会指定,民事诉讼中法官则是由法院指定C.仲裁员不能达成一致意见,以首席仲裁员意见为准,民事诉讼中的合议则以审判长意见为准D.仲裁与民事诉讼的立案审 [单选]船舶在沿岸雾中航行时,下列说法错误的是()。A.船舶进入雾区前尽可能准确的测定船位B.船舶进入雾区前尽可能了解周围船舶的动态C.为提高定位准确性,应适当减小离岸距离D.测深是检查推算的重要方法 [单选,A1型题]桂枝促发汗作用是通过()A.抑制汗腺导管对钠离子重吸收B.兴奋汗腺α受体,使汗腺分泌增加C.通过兴奋中枢神经系统有关部位而发汗D.扩张血管,促进血液流向体表E.增加机体产热 [单选]诊断胃肠穿孔首选的方法是()。A.腹部X线片(立位)B.超声C.上消化道钡餐造影D.CTE.胃镜 [单选]一般车辆制造时,取车辆全长和定距之比为()。A.1.4:1B.1:1C.1.2:1 [单选]感染邪毒型产后发热的病因病机为()A.产后失血过多,阴血骤虚,阳无所附,阳浮于外B.产后恶露不下,瘀血停滞,阻碍气机,营卫失调C.产后气血虚弱,腠理不密,风寒袭表,正邪交争D.产后百脉空虚,邪毒乘虚侵入胞中,正邪交争E.以上都不是 [单选]把()质量发展的核心理念,坚持好字优先,好中求快。A.以人为本;B.安全为先;C.以质取胜。 [单选]投资体制改革充分体现了科学发展观的要求,项目核准咨询也完全不同于传统的项目评估,这体现于()。A.由项目的外部条件评价转变到项目内部影响评价B.由项目的微观层次分析上升到国家的宏观层次C.由项目的宏观层次分析上升到地区的微观层次D.由工程项目分析为主变为以经济、社 [单选]外阴癌最主要的扩散途径是()A.蔓延扩散B.淋巴转移C.血行转移D.淋巴转移及血行转移E.局部蔓延及血行转移 [单选]称重平台的功能()。A.称重、车辆分离B.称重、数据采集C.称重、测速D.车辆分离、数据采集 [单选,A2型题,A1/A2型题]为避免早产儿发生呼吸窘迫综合征,可在分娩前使用()A.尼可刹米B.纳洛酮C.地塞米松D.维生素CE.紫杉醇 [单选]贫液流量通过()调节的。A.FV-0703B.FV-0704C.FV-0705D.FV-0707 [单选]根据采购标的物分类,货物采购合同不包括()。A.材料采购合同B.通用设备采购合同C.特定设备采购合同D.其他设备采购合同 [单选]为搞好工程的技术总结,工程竣工后()是不适宜的。A.安排技术总结计划B.确定总结题材C.整理已经收集和积累的资料D.由亲自参加项目的施工者执笔 [单选,A1型题]DNA变性是()A.温度升高是唯一的原因B.磷酸二酯键断裂C.多核苷酸链解聚D.碱基的甲基化修饰E.互补碱基之间氢键断裂 [名词解释]525R型水泥 [单选,A1型题]不属于儿童铅中毒的主要临床表现是()A.注意力障碍B.体格生长缓慢C.攻击性行为增多D.头痛、腹痛E.肝、肾损伤 [单选]下列各项中,除哪项外均可作为热痹辨证的依据()A.关节疼痛,局部灼热红肿B.关节疼痛,得冷稍舒C.发热、恶风、口渴D.关节酸痛、游走不定E.舌红、苔黄、脉滑数 [单选]厨房每小时换气次数为多少次使厨房保持良好的通风环境()A、30~50次B、50~80次C、60次D、40~60次 [单选]根据《关于支持循环经济发展的投融资政策措施意见的通知》,下列关于全面改进和提升金融服务的表述,不正确的是()。A.对由国家、省级循环经济发展综合管理部门支持的节能、节水、节材、综合利用、清洁生产减量化项目,金融机构要重点给予信贷支持B.废旧汽车零部件、工程机 [单选]产后子宫缩小至妊娠12周大小,需要时间为()A.1周B.2周C.3周D.4周E.5周 [判断题]入境人员每人仅限携带两只伴侣动物进境。A.正确B.错误 [单选,A型题]红霉素片是下列那种片剂()A、糖衣片B、薄膜衣片C、肠溶衣片D、普通片E、缓释片 [单选,A2型题,A1/A2型题]选择氢原子核作为人体磁共振成像的原子核的理由是()A.1H是人体中最多的原子核B.1H约占人体中总原子核数的2/3以上C.1H的磁化率在人体磁性原子核中是最高的D.以上都是E.以上都不是 [单选,A2型题,A1/A2型题]导致二尖瓣狭窄患者死亡的主要原因是()A.栓塞B.肺部感染C.心肌梗死D.心力衰竭E.呼吸衰竭 [单选]超声难以显示的乳腺癌为()。A.<3cmB.<2cmC.>2cmD.<1cmE.>3cm [单选,A2型题,A1/A2型题]可精确切割不同组织,最适于镫骨手术的是()。A.准分子激光B.氩离子激光CO2激光D.半导体激光E.Nd:YAG激光 [单选]下列标准中适合于数字电视的是()。A.JPEGB.JPEG2000C.H.263D.MPEG-2 [单选,A1型题]下列有关mRNA的特点,哪项是错误的()A.代谢活跃B.分子大小不一C.其5’末端可有"帽",3’末端可有"polyA"D.通常易被碱水解E.主要含在线粒体中 [单选]中版海图图号是ቤተ መጻሕፍቲ ባይዱ()顺序编排的。A.地区B.新版日期C.出版日期D.改版日期 [单选,A1型题]早期乳腺癌首选的治疗手段是()A.化学治疗B.激素治疗C.放射治疗D.早期手术E.免疫疗法 [问答题]八宝珍珠散功效与作用 [单选]下面哪部歌剧是瓦格纳的作品:()A.《茶花女》(威尔第)B.《纽伦堡的名歌手》C.《塞维利亚理发师》(罗西尼)D.《费加罗的婚礼》(莫扎特) [单选]下列属于潜在或低度恶性骨肿瘤是()A.骨髓瘤B.骨肉瘤C.骨囊肿D.骨软骨瘤E.骨巨细胞瘤 [单选]下列哪个命令可进行网格渲染:()A.FacedB.WireC.2-sidedD.FaceMap
