《共价键与分子的空间构型第三课时》课件5
《共价键与分子的空间构型》第三课时参考课件
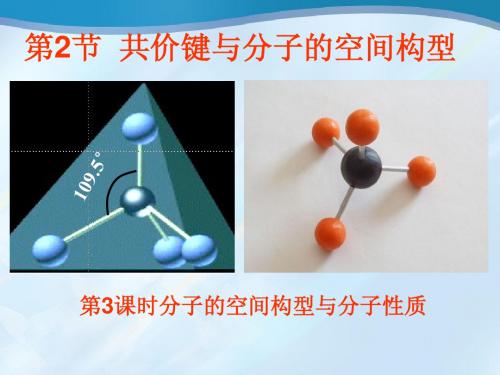
正电荷重心和负电荷重心不相重合的分子
分子极性的判断方法 1.双原子分子 取决于成键原子之间的共价键是否有极性 2.多原子分子(ABm型) 取决于分子的空间构型
ABm分子极性的判断方法
1. 化合价法 ①若中心原子A的化合价的绝对值等于该元素所 在的主族序数,则为非极性分子,若不等则为
极性分子;
②若中心原子有孤对电子(未参与成键的电子对
第2节 共价键与分子的空间构型
第3课时分子的空间构型与分子性质
二、分子的空间构型与分子性质
1.分子的对称性
对称性普遍存在于自然界。
例如五瓣对称的梅花、桃花,六
瓣对称的水仙花、雪花(轴对称 或中心对称);建筑物和动物的 镜面对称;美术与文学中也存在 很多对称的概念。
自然界中的 对称性
依据对称轴的旋转或借助对称面的反映能够
)则为极性分子,若无孤对电子则为非极性分子。
请判断PCl3、CCl4、CS2、SO2分子的极性。
ABm分子极性的判断方法
1. 化合价法
2. 物理模型法 将分子中的共价键看作作用力,不同的共价 键看作不相等的作用力,运用物理上力的合成
与分解,看中心原子受力是否平衡,如平衡则
为非极性分子;否则为极性分子。
2.下列化合物中含有2个“手性”碳原子的是 B( Cl OH H ) A.OHC—CH—CH2OH B. OHC—CH—C—Cl OH Cl H Br C.HOOC—CH—C—C—Cl Br Br CH3 D.CH3—CH—C—CH3 CH3
思考
根据电荷分布是否均匀,共价键有极
性、非极性之分,以共价键结合的分 子是否也有极性、非极性之分呢?
1. 凡是含有极性键的分子一定是极性分子。
2. 极性分子中一定含有极性键。
人教版《共价键》优秀课件PPT

【阅读思考1】(1)阅读教材P30页内容,结合表2-1, 思考键能的概念是什么?键能与分子的稳定性有何关系?
①键能是气态基态原子形成1 mol化学键 释放的最低能量。键能的单位是kJ·mol-1。例如:形成1 mol H—H键释放的最低能量为436.0 kJ,即H—H键的键能 为436.0 kJ·mol—1。
【问题探究3】(3)“键长越短,键能越大”适合于一切 分子吗?
①不适合,如F2。F原子的半径很小,因此 其键长短,而由于键长短,两F原子形成共价键时,原子 核之间的距离很近,排斥力很大,因此键能不大,F2的稳 定性差,很容易与其他物质反应。 ②一般来讲,形成共 价键的两原子半径之和越小,共用电子对数越多,则共价 键越牢固,含有该共价键的分子越稳定。如HF、HCl、HBr、 HI中,分子的共用电子对数相同(1对),因F、Cl、Br、I 的原子半径依次增大,故共价键牢固程度H—F>H—Cl> H—Br>H—I,因此,稳定性HF>HCl>HBr>HI。
【对应训练】
(人教版选修3) 第 二章《分子结构与性质》
1.下列说法正确的是( ) A.分子的结构是由键角 决定的 B.共价键的键能越大,共价键越牢固,由该键 形成的分子越稳定 C.CF4、CCl4、CBr4、CI4中C—X(X =F、Cl、Br、I)键的键长、键角均相等 D.H2O分子中 两个O—H键的键角为180°
(人教版选修3) 第 二章《分子结构与性质》
核心素养发展目标
1.通过阅读思考、数据分析,认识键能、键长、 键角等键参数的概念,能用键参数――键能、键 长、键角说明简单分子的某些性质。
课件_人教版选修三《价键》PPT_完美课件-课PPT课件_优秀版

418
H-I
N≡N
946
H-H
键能 176 607 142 497.3 413.4 462.8 390.8 568 431.8 366 298.7 436
练习:
由下表的数据判断,下列分子的稳定性:
A.Cl2, Br2, I2
B.NH3 , H2O
键 Cl-Cl Br-Br
I-I O-H
键能 242.7 193.7 152.7 462.8
键 C≡C C-H O-H N-H N≡N Si-Si Si-O
键能 812 413.4 462.8 390.8 946
键长 120 109 96 101 110 235 162
3.键角:
两个共价键之间的夹角称为键角。 键角决定分子的空间构型。
键角一定,表明共价键具有方向性。键角是描 述分子立体结构的重要参数,分子的许多性质与 键角有关。
键能越大,化学键越牢固,分子越稳定。
△H为负值说明该反应为放热反应。
相反,H—Br的键能比H—Cl的键能小,所以HBr分子比HCl更容易发生热分解生成相应的单质。
用质谱仪测定分子结构:
破坏1mol化学键形成气态基态原子所需的最低能量。
(2)一般成键原子有未成对电子。
复习回顾 什么是化学键? 什么是离子键? 什么是共价键?
3.这两种重叠方式是否相同?为什么? Cl―Cl的p-p σ键形成
△H为负值说明该反应为放热反应。 为什么不可能有H3、H2Cl、Cl3分子的形成?
请推测两个氮原子如何通过原子
即负值越大,放出能量越多。
垂直于键轴方向,相互平行的“肩并肩”
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
共价键与分子的空间构型66页PPT

16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——美华纳
40、学而不思则罔,思而不学则殆。——孔子
课件:2.2共价键与分子的立体构型鲁科版高中化学选修三

有古志之者 立能大使事石者头,长不出惟青有草超来世。之材,亦必有坚忍不拨之志。
个s轨道和 人穷惟人患 的无孩志子,早有当志家无。有不成者。
贫心困随教 朗会月贫高困,者志一与切秋。霜洁。 胸鸟有不凌 展云翅志膀,难无高高飞不。可攀。
个p轨道杂化,产生
个sp3杂化轨道, sp3
杂化轨道间夹角 ,其中有两个杂化轨道上已有成对电
sp3
参与杂化的轨道 杂化轨道数
成键轨道夹角
1个s+1个p 1个s+2个p 1个s+3个p
2
3
4
180°
120°
109.5°
分子空间构型 实例
直线形
BeCl2 C2H2
平面三角形 正四面体
C2H2 BF3
CH4 CCl4
二、共价键与分子空间构型
杂化轨道的要点
原子形成分子时,是电子先激发,再杂化,后成键 同一原子中不同类型、能量相近的原子轨道参与杂化 杂化前后原子轨道个数不变 杂化后形成的杂化轨道的能量相同 杂化后轨道的形状、伸展方向发生改变 杂化轨道参与形成σ键,未参与杂化的轨道形成π键
配对成键,且孤电子对对成键电子对起排斥作用,所以氨
气呈
形。
sp2杂化
激发
Sp2杂化
重叠
形成3个(sp2-p) σ键 BF3分子形成过程
BF3分子形成过程
F
F
B
F
➢sp2杂化轨道示意图 ➢BF3分子的结构示意图
个s轨道和
个p轨道杂化,产
生 个等同的
sp2杂化轨道,
sp2杂化轨道间
夹角 ,
呈
形。
C的sp2杂化
激发 重叠
BeCl2分子形成过程
《共价键与分子的空间构型第三课时》课件4

分子的空间构型与分子性质
[学习目标定位] 1.知道手性分子的概念,会判断手性碳原子。 2.理清共价键的极性、分子的空间构型与分子极性的关 系,学会判断简单分子极性的方法。
1.共价键的极性 (1) 共价键按 ___________________( 共用电子对是否偏移 成键原子吸引电 子能力差异)可分为两类:
原子连有 3 种原子或基团,1、3 号 C 原子相同,连有 2 个氢原子,即连有 3 种不同原子或基团,故 C 项错误;
分子中 2 号 C 原子连有—CH3、 —H、—COOH、—OH 四种不同的原子或基团,故 D 项正确。
答案 D
2.某链烃 B 的分子式为 C7H10,在 B 的各种结构(不考虑 结构 )中,含有手性碳原子,且与足量 H2 发 生加成反应后仍具有光学活性的有机物有五种,已知其中 两种的结构简式为
2.观察比较下图所示两种分子的结构
分子组成相同,都是CHFClBr;从平 (1)它们的相同点是______________________________________
面上看相似 。不同点是________________________________ 在空间上完全不同,它们构成实 _____________
手性碳原子 。如
互不相同,含有手性碳原子,该有机物分子具有手性。
[归纳总结] (1)手性同分异构体(又称对映异构体、 光学异构体)的两个 分子互为 镜像 关系, 即分子形式的“左撇子和右撇子”。 (2)构成生命体的有机物绝大多数为手性分子。两个手性 分子的性质 不同 , 且手性有机物中必定含 手性碳原子 。
______
极性键、 ________ 极性键、 ________ 非极性键 _______ 非极性键 ________ σ键、 σ键、 ________ ________
2.2共价键与分子的空间构型课件高二化学鲁科版选修物质结构与性质

1、甲烷分子的空间构型
正四面体 键角:109.5°
阅读:P41中联想与质疑
• 客观存在与理论不相符,你能解释吗?
原子间要形成共价键,必须含有未成对的电子
2p
2p
2s
激发 2s
志人不若立 有,志天,下万无事可成为之。事。
C的基态 卒燕子雀过 安河知,鸿意鹄在之吃志帅哉。
课本
sp3杂化
P43
四个sp3杂化轨道在空间的分布呈正四 面体,夹角为109.5°,但是氨气的分子构型 是三角锥形,键角为107.3°,得出的结论与 事实有矛盾,这是为什么?
分析1:氮原子的杂化过程、各个杂化轨道中电子的数目
及各个键的形成过程。
孤对 电子
与3个H原子 形成3个σ键
2p
2s
sp3杂化
注意
• (1)原子轨道的杂化只有在形成分子的过 程中才会发生;
• (2)原子轨道的杂化的原因——外部条件; • (3)杂化的结果—— 原子在形成分子时,
增强成键能力,使分子的稳定性增加;
• 杂化的目的——为了增强成键能力?
•
唯心
碳原子杂化过程
2s 2p 激发 2s
跃迁
2p 杂化
自旋方向相同
4个 杂化轨道
σ
σ 思考5:描述甲烷中共价键的形成过程:
乙烯分子中各个键的形成过程及键的类型 志不立,天下无可成之事。
无钱之人脚杆硬,有钱之人骨头酥。
(3)杂化的结果—— 原子在形成分子时,增强成键能力,使分子的稳定性增加;
甲烷分子的正四面体构型是怎样形成的呢?
1、甲烷分子的空间构型
σ σ
2p
2s
化学课件《共价键与分子的空间构型》优秀ppt 鲁科版
C-C
sp2
C=C
sp
C≡C
看中心原子有没有形成双键或叁键,如果有1 个叁键,则其中有2个π键,用去了2个p轨道, 形成的是sp杂化;如果有1个双键则其中有1 个π键,形成的是sp2杂化;如果全部是单键, 则形成的是sp3杂化。
已知:杂化轨道只用于形成σ键或者用来容 纳孤对电子
杂化轨道数=中心原子孤对电子对数 +中心原子结合的原子数
(2)BCl3
(3)CS2
(4) C12O
解析: (1) PCI3:
..
.. C. I.
.. P
.. C. I.
..
SP3 三角锥形
.. ..
.. ..
C. I.
.. CI
(2)BCl3 :
..
.. C. .l
B
.. C. I.
..
SP2
平面三角形
(3)CS2 :
.. S. .
=C
=S.. ..
(4) C12O:
CH2O
P4 NH3
CH4
CH3CH2OH CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
思考:
同为三原子分子,CO2 和 H2O 分子的空间 结构却不同,为什么?
同为四原子分子,CH2O与 NH3 分子的空间 结构也不同,为什么?
一、一些典型分子的空间构型
分析思考:
1、写出C原子电子排布的轨道表示式,并由此 推测:CH4分子的C原子有没有可能形成四个 共价键?怎样才能形成四个共价键?
H
H
激发态
109°28’
sp3 杂化态
1、杂化轨道的概念 在外界条件影响下,原子内部能量相近 的原子轨道重新组合,形成相同数量的 几个能量与形状都相同的新轨道。
高二化学-物构-分子构型-第3课时
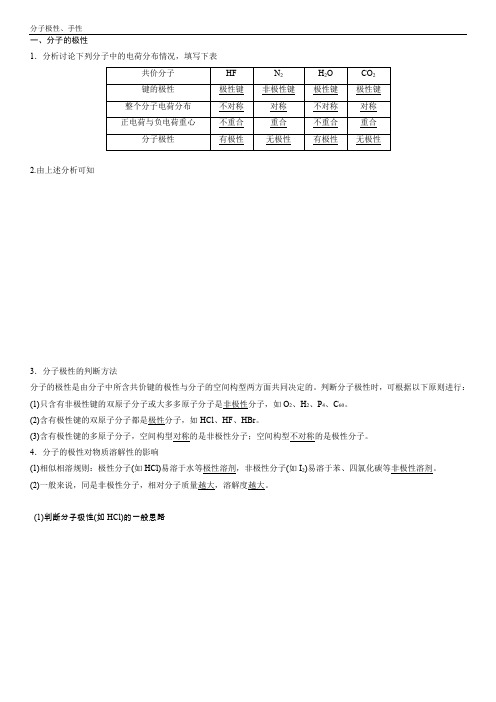
一、分子的极性1.分析讨论下列分子中的电荷分布情况,填写下表2.由上述分析可知3.分子极性的判断方法分子的极性是由分子中所含共价键的极性与分子的空间构型两方面共同决定的。
判断分子极性时,可根据以下原则进行:(1)只含有非极性键的双原子分子或大多多原子分子是非极性分子,如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子,如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间构型对称的是非极性分子;空间构型不对称的是极性分子。
4.分子的极性对物质溶解性的影响(1)相似相溶规则:极性分子(如HCl)易溶于水等极性溶剂,非极性分子(如I2)易溶于苯、四氯化碳等非极性溶剂。
(2)一般来说,同是非极性分子,相对分子质量越大,溶解度越大。
(1)判断分子极性(如HCl)的一般思路(2)键的极性和分子极性的关系分子⎩⎪⎨⎪⎧ 非极性分子⎩⎪⎨⎪⎧ ①只由非极性键形成(如H 2、O 2、Cl 2等)②由极性键形成,结构对称,正电荷重心 和负电荷重心重合(如CO 2、BF 3、CH 4等)极性分子:由极性键形成,空间结构不对称,键的极性 不能抵消(如HCl 、HCN 、H 2O 、NH 3等)例1下列各组分子中,都属于含极性键的非极性分子的是( )A .CO 2、H 2SB .C 2H 4、CH 4 C .Cl 2、C 2H 2D .NH 3、HCl 答案 B 解析 A 项中CO 2和H 2S 都含极性键,但前者是非极性分子(直线形),后者是极性分子(V 形);B 项中C 2H 4是平面分子,CH 4为正四面体型,均含极性键且均为非极性分子;C 项中Cl 2不含极性键;D 项中NH 3、HCl 均为极性分子。
例2碘单质在水中溶解度很小,但在CCl4中溶解度很大,这是因为()A.CCl4和I2都不含氢元素,而H2O中含有氢元素B.CCl4和I2都是非极性分子,而H2O是极性分子C.CCl4与I2都是直线形分子,而H2O不是直线形分子D.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大答案 B 解析CCl4和I2都是非极性分子,而H2O是极性分子,根据“相似相溶”规则可知碘单质在水中溶解度很小,但在CCl4中溶解度很大,与相对分子质量、是否是直线形分子、是否含有氢元素等没有直接的关系,B正确。
共价键与分子的空间构型PPT课件
实例
BeCl2,C2H2
CH4,CCl4
为什么氨分子的 键角是107.3°?
NH3
2p
2s
N
H H H
sp3杂化
H 2O
O
H H3
sp 杂化
2p 2s
sp
3
O H
H
提示:
非中心原子:Cl、F、Br、I=H 中心原子:同主族的可以互换 (如N=P、S=O等) 通常双原子分子中没有发生杂化
课堂练习
sp型的三种杂化
杂化类型 参与杂化 的原子轨 道 杂化轨道 数 杂化轨道 间夹角 空间构型 sp 1个s + 1个p 2个sp杂化轨 道 180o 直线 sp2 1个s + 2个p 3个sp2杂化 轨道 120o 正三角形 BF3, BCl3 sp3 1个s + 3个p 4个sp3杂化 轨道 109.5o 正四面体
BeCl2分子形成
2s
2p
杂化 直线形
Be基态
sp杂化态 直线形
180
Cl
Be
Cl
键合 化合态
sp2 杂化轨道间的夹角是120度,分子的几何构型 BF3分子形成 为平面正三角形
2s 2p 2s 2p 正三角形
2.sp2 杂化
B的基态
激发态
F
sp2 杂化态
F B F F
B F
1200
F
乙烯中的C在轨道杂化时,有一个P轨 道未参与杂化,只是C的2s与两个2p轨道 发生杂化,形成三个相同的sp2杂化轨道, 三个sp2杂化轨道分别指向平面三角形的三 个顶点。未杂化p轨道垂直于sp2杂化轨道所 在平面。杂化轨道间夹角为120°。
高中化学 第2章 第2节 共价键与分子的空间构型课件 鲁科版选修3

D.①③⑤
第十九页,共27页。
[解析] CH4、NH3、CF4、SiH4、CH2Cl2分子中的C、N、 Si在参与成键时都是形成了四个sp3杂化轨道,但只有CH4、CF4、 SiH4分子中的四个sp3杂化轨道分别可以(kěyǐ)结合一个相同的原子, 形成正四面体结构;CH2Cl2分子中的四个sp3杂化轨道结合的原子不 同,形成四面体,但不是正四面体构型;NH3中N的四个sp3杂化轨 道只有三个有未成对电子,分别结合三个氢原子形成三角锥形结构。 C2H4分子中的碳原子是sp2杂化,形成平面结构;CO2分子中的碳 原子是sp1杂化,形成直线形结构。
(3)相似相溶原理:非极性溶质一般能溶于非极性溶剂,极 性溶质一般能溶于极性溶剂。
第十六页,共27页。
2.下列化合物中,化学键的类型(lèixíng)和分子的极性(极性或
非极
性)皆相同的是
()
A.CO2和SO2
B.CH4和SO2
C.BF3和NH3
D.HCl和H2O
解析:CO2、CH4、BF3是非极性分子,SO2、NH3、HCl和
(3)对双原子分子来说,化学键极有极性,分子就
有。极性
(4)多原子分子的极性除了与 键的极性 有关外,还与
分子的 空间构型 有关。
第十五页,共27页。
[师生互动·解疑难]
(1)有机物分子中若存在一个碳原子连有4个不同的原子或原 子团,则该有机物就是手性分子。
(2)双原子分子的极性与键的极性一致,多原子分子除看键 的极性外,还要看分子的空间构型,当分子的空间构型对称时(如 直线形、平面(píngmiàn)正三角形、正四面体形等),虽然含有 极性键,但分子是非极性分子。
2.中心原子没有孤对电子时,分子或离子的空间构型与 杂化轨道的空间构型相同,否则不相同,如NH3、SO2。
2.2.(1、2)共价键与分子的空间构型(共3课时)

SP2
sp2 杂化
同一个原子的1个 ns 轨道与2个 np 轨道进行杂 化组合为 sp2 杂化轨道。 sp2 杂化轨道间的夹角是
120°,分子的几何构型为平面正三角形。
BF3分子形成
2s 2p 激发
2s
2p
正三角形
B的基态
F
激发态
sp2 杂化态
B
F F
120°
sp 杂化
同一原子中 ns-np 杂化成新轨道:一个 s 轨道 和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。
杂化轨道理论解释苯分子的结构:
CHale Waihona Puke H6碳原子的p轨道杂化轨道理论解释苯分子的结构: C为sp2杂化
C-C (sp2-sp2 ) ; C-H (sp2-s )
所有原子(12个)处于同一平面
分子中6个碳原子未杂化的2p轨道 上的未成对电子肩并肩重叠形成
了一个闭合的、环状的大π键
形成的π电子云像两个连续的面包圈,一个位于平面上面, 一个位于平面下面,经能量计算,这是一个很稳定的体系。
杂化轨道 的电子云一 头大,一头 小,成键时 利用大的一 头,可以使 电子云重叠 程度更大, 从而形成稳 定的化学键。 即杂化轨道 增强了成键 能力。
H C
109°28’
H
H
H
sp3 杂化
原子形成分子时,同一个原子中能量相近的 1个 ns 轨道与3个 np 轨道进行混合组成四个新的原子轨道称为 sp3 杂化轨道。
BeCl2分子形成
2s 2p 激发 Be基态 2s
2p 杂化 激发态 sp杂化态
180
Cl
Be
Cl
化合态
小结
杂化 杂化轨道 类型 数目 杂化轨道间 夹角 180° 120° 空间构型 直线 平面三角形 实例
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
发生相对滑动,但不会改变原来的排列方式,金属阳离子
较强作用 未被破坏仍然存在,因而金 和自由电子之间的__________ 属不易断裂有良好的延展性。 (2)导电性:金属内部的原子之间的“自由电子”的流动是无 方向性的,在外加电场的作用下,“自由电子”在电场中 定向移动 ________形成电流。 (3)导热性:当金属中有温度差时,不停运动着的“自由电 子”通过它们与阳离子间的碰撞,把能量由高温处传向低
自由 电子之间的强烈的相互作 (1)金属键:金属阳离子与_____ 用。
自由 电子(存在只含阳离子不 (2)成键微粒:金属阳离子和_____ 含阴离子的晶体)
(3)成键条件:金属单质或合金。 (4)实质:电性作用。 (5)金属键的特征:无方向性和饱和性。
金属键与金属性质 3. (1)延展性:当金属受到外力作用时,晶体中各原子层就会
②配位体
配位体(能够提供孤对电子的分子或离子)可以是阴离子, 如X-(卤素离子)、OH-、SCN-、CN-、RCOO-(羧酸根 离子)、C2O42-、PO43-等;也可以是中性分子,如H2O、 NH3、CO、醇、胺、醚等。配位体中直接同中心原子形 配位原子 。配位原子必须是含有 成配位键的原子叫做_________ 孤对电子 的原子或离子,如NH3中的N原子,H2O分子中 _________ 的O原子,配位原子常是ⅤA、ⅥA、ⅦA族的元素的原 子。
Cu(OH)2+4NH3· H2O===[Cu(NH3)4]2++2OH-+4H2O。
实验2:
(1)操作:向2%的AgNO3溶液中逐滴加入稀氨水。 (2)现象:刚开始观察到产生白色沉淀并迅速变为暗褐 色,后来沉淀逐渐溶解。当沉淀恰好完全溶解时所得到的 无色溶液即为做银镜反应实验的重要试剂——银氨溶液。
(2)配位化合物是指金属离子பைடு நூலகம்原子与某些分子或离子(称
为配体)以_______ 配位键 结合形成的化合物,简称配合物。配合 内界和外界 组成的,内界是由中心离子和配位体 物是由___________ 组成的,如
①中心原子
配合物的中心原子(具有空轨道的原子或离子)一般都是 带正电的阳离子 ,过渡金属离子最常见。 _______________
配位键及其形成条件、配合物 2. 共用电子对 由一个原子单方面提供而跟另 (1)配位键是指___________
一个原子共用的共价键。形成条件是形成配位键的一方是 孤对电子 的原子,另一方是具有能够接受孤对 能够提供_________ 空轨道 的原子,配位键常用符号A→B表示。 电子的_______
一定的平衡核间距,形成稳定的离子键,整个体系达到能
量最低状态,从而形成了稳定的离子化合物。
【慎思2】形成配位键的几个实验现象的分析?
提示 实验1: (1)操作:向试管中加入2 mL 5%的硫酸铜溶液,或CuCl2
溶液或Cu(NO3)2溶液,再逐渐滴加入浓氨水,振荡,观察
实验现象。 (2)现象:先有蓝色絮状沉淀,然后沉淀逐渐溶解生成深 蓝色溶液。 (3)原理:Cu2++2NH3· H2O===Cu(OH)2↓+2NH4+;
(3)原理:Ag++NH3· H2O===AgOH↓+NH4+;
2AgOH===Ag2O+H2O;Ag2O+4NH3· H2O=== 2[Ag(NH3)2]++2OH-+3H2O{或AgOH+2NH3· H2O=== [Ag(NH3)2]++OH-+2H2O}。
实验3: (1)操作:向FeCl3溶液中加入1滴KSCN溶液。 (2)现象:溶液呈血红色。 (3)原理:Fe3++SCN-===Fe(SCN)2+或Fe3++3SCN-
笃学一 离子键合配位键
1. 离子键的形成过程、成键条件、实质及其特征 金属元素的原子与电负性较大的 (1)当电负性较小的_____ 非金属 元素的原子相互接近到一定程度时,容易发生电 _______
子得失而形成____________ 阴、阳离子 ,____________ 阴、阳离子 通过静电作用
③配位数
直接同中心原子形成配位键的原子数目叫中心原子的配位 数。如[Fe(CN)6]4-中Fe2+的配位数为___ 6 。 (3)配离子的电荷数 配离子的电荷数等于中心离子和配位体总电荷数的代数 和。
笃学二 金属键
1. 金属的物理通性 光泽 ; (1)金属_____ (2)不透明; 导热 性,延性和展性等。 (3)良好的_____ 导电 性、_____ 金属键及其实质 2. 在金属固体内部,金属原子的价电子可以从原子上“脱落 自由 电子,它们之间存在着强烈的 下来”形成金属离子和_____ 金属键 。即金属晶 相互作用,把这种强的相互作用称为_______ 金属键 而相互连接在一起的。 体是靠_______
温处,使金属表现出导热性。
【慎思1】怎样理解离子键的实质?
提示
离子键的实质是静电作用,它包括阴、阳离子之间
的静电引力使阴、阳离子相互吸引,阴离子的核外电子与 阳离子的核外电子之间、阴离子的原子核与阳离子的原子 核之间的静电斥力使阴、阳离子相互排斥。当阴、阳离子 之间的静电引力和静电斥力达到平衡时,阴、阳离子保持
离子化合物。 形成稳定的_____ 阴、阳离子 之间的静电作用;成键微粒是 (2)离子键就是___________ 阴、阳离子 ;成键元素是电负性较小的_____ 金属 元素和电负 ___________ 非金属 元素;成键条件是电负性差值超过___ 性较大的_______ 1.7; 静电 作用;特征是_____ 没有 方向性和饱和性。 实质是_____
第三节 离子键、配位键与金属键
理解离子键的形成过程及在方向性、饱和性上的特征。 1.
了解简单配位键的形成实质和配位化合物在生物、化学等 2. 领域的广泛应用。 知道金属键的实质,并能用金属键解释金属的某些特征性 3. 质。
电性 作用。 1.化学键的实质就是成键原子之间的_____ 共价键的形成条件是:成键原子所属元素电负性差别 2. 较小 ;当差别为0时,形成的共价键就是_______ 非极性 键; _____ 极性 越强;当差值很大时(大 差值越大,形成的共价键的_____ 离子 键。 于1.7以上),就认为是_____
