中学常见物质电子式分类书写
高一化学电子式结构式的书写方法

O
K
O
]
[
K
2
K
]
Mg
F
F
Mg
F
2
[
2
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
A
B
C
D
1. 用电子式表示下列离子化合物的形成过程: (1)CaO (2)Na2O (3)CaCl2
A
2、用电子式表示共价键的形成过程
+
2
H
×
+
H
H
×
×
指出下列物质含有什么化学键 KCl MgCl2 Cl2 HF CaO H2 O
: :
: :
: :
: :
Cl Cl
C
Cl
Cl
_ _
_ _
一氯甲烷的电子式、结构式
C
H
Cl
H H
: :
: :
: :
C
H
Cl
H H
_ _
_ _
: :
次氯酸的电子式、结构式
H
O
Cl
:
:
:
:
: :
:
H Cl
O
__
__
氢氰酸的电子式、结构式
H C N
:::
H C N
—
—
—
—
三氟化硼的结构式
B
F
F
F
—
—
—
—
NaOH的电子式
2 + O H
O
+
氢氧化钡的电子式
Na
:
:
常见的电子式书写

电子式书写规则在元素符号周围用“·"和“×”来表示原子的最外层电子(价电子),这种式子叫做电子式。
1。
原子的电子式由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过2个电子。
例如,、、、。
2. 金属阳离子的电子式金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出。
所以金属阳离子的电子式即为离子符号.如钠离子的电子式为;镁离子的电子式为,氢离子也与它们类似,表示为。
3. 非金属阴离子的电子式一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]"括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号.例如,、、。
4。
共价化合物的电子式共价化合物是原子间通过共用电子对结合而成的。
书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子。
例如,、。
5。
根离子的电子式根离子中,若不同原子间以共价键结合,画法同共价化合物,因根离子带有电荷,所以应把符号用“[]”括起来,右上角标出电荷数.例如,铵根阳离子:;氢氧根离子:. 6。
离子化合物的电子式先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并.例如,NaCl、MgCl2、Na2O的电子式分别为、、。
7。
用电子式表示物质的形成过程①离子化合物的形成过程形成用“→"表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后为离子化合物的电子式。
例如,NaCl的形成过程为:的形成过程为:MgCl2②共价化合物或非金属单质的形成过程表示方法基本同离子化合物相同,不同的是因没有电子得失,所以不要再画弯箭头,并且“→"之后为共价化合物或非金属单质的电子式。
高一化学电子式_结构式的书写方法

NaCl
CaCl2
HCl
HClO
离子化合物和共价化合物的电子式书写有何不同? 离子化合物要求有方括号和电荷 共价化合物不能有方括号和电荷
比较C、N、O、F原子的电子式和CH4、NH3、 H2O、HF的电子式,能找到什么规律? ⅥA · · C· ·
CH4
ⅤA · · · N· ·
NH3
ⅥA · · · O· · ·
: :
+: : Na O H
::
-
2+ : O: H Ba : O: H
::
氢氧化钡的电子式
::
氮化钠的电子式
+ : : Na+ Na
3-
+ : : : Na O O Na
+
2-
::
::
氯化铵的电子式
: :
H
: :
Cl : H: N: H :
+
H
Na : O: Cl :
原子结构的表示方法
核组成符号极其含义: A ZX
原子结 构的表 示方法 原子结构示意图:S2电子式:在元素符号的周围用小点点表 示原子最外层电子数的式子。
电子排布式
一、原子电子式书写方法 (书写单质分子和化合物电子式的基础) ⅠA ⅡA
· Li · Na
0 ⅥA ⅦA · · · · · · · · · · · O · ∶ F · Be · · · · C · B · · N· · ∶Ne∶ · · · · · · · · · · · · · · · ∶Ar · · ∶ Si · · ∶ Mg · · Cl · · Al · · · S · · P · · · · · · · ·
电子式书写之诀窍

电子式书写之诀窍电子式是一种重要的化学用语,能清楚地表示出原子、离子、离子化合物和共价化合物的结构,是中学化学教学的重点,也是高考考纲中要求学生必须掌握的重要内容之一,已成为各类考试的热点。
电子式在表达形式上有严格的要求,学习时一定要掌握其书写诀窍。
一、明确物质类别,分类记忆书写规则1.原子的电子式直接在原子符号周围用小黑点“·”或“×”来表示原子的最外层电子。
如:2.离子的电子式⑴简单阳离子:离子符号即为电子式。
如:Na +、Mg 2+、Al 3+⑵复杂阳离子和阴离子:在原子符号周围用小黑点“·”或“×”来表示原子的最外层电子,并用方括号括起来,在方括号的右上角标明所带的电荷数。
如:3.化合物的电子式⑴共价化合物共价化合物是原子间通过共用电子对结合而形成的,书写时将共用电子对画在两原子之间。
每个原子的未成对电子和孤对电子也应画出,使每个原子周围的电子都达到稳定结构。
如:⑵离子化合物离子化合物是阴、阳离子通过离子键结合而形成的,书写时先根据离子电子式的书写方法,分别画出阳离子和阴离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能并合。
如:二、善于归纳总结,熟练掌握规律技巧1.同一个式子中同一元素原子的电子要用同一符号,都用“·”或“×”。
2.要注意共价化合物与离子化合物电子式的区别。
前者不加括号,不写表示电荷的符号,后者阴离子(复杂阳离子)加方括号,括号外写表示电荷的符号。
3.离子化合物中阴阳离子个数比不是1∶1时,要注意每一个离子都与带相反电荷的离子O N ClH直接相邻的事实。
如:4.不同元素的原子形成分子时,共用电子对的数目不同,一般原子的共用电子对数目=8—最外层电子数。
三、有备无患,储存记忆常见物质电子式1.离子化合物2.共价化合物(单质分子)3.特殊微粒CaC 2NH 4ClNH 3 CH 4 HClO CCl 4 OH —(氢氧根离子) —OH (羟基)。
常见物质电子式的书写

复习思考一:①CaBr 2的构成微粒是:②相邻这些微粒之间的作用是Ca 2+、Br --[归纳]离子键:静电作用带相反电荷离子之间的相互作用。
离子化合物:由离子键构成的化合物。
思考二:①HCl 的构成微粒是:②相邻这些微粒之间的作用是[归纳]共价键:原子间通过共用电子对所形成的相互作用。
共价化合物:由共用电子对形成分子的化合物。
H 和Cl共用电子对的相互作用2.上述物质中含有共价键,是共价化合物。
[归纳]共价键和共价化合物的关系:只有共价键的化合物才是共价化合物。
E 、F 、G 、HB 、C 、D 、E 、F 、G 、H 1.上述物质中含有离子键,是离子化合物。
A 、B 、CA 、B 、C [归纳]离子键和离子化合物的关系:含有离子键的化合物就是离子化合物。
A 、CaBr 2B 、NaOHC 、NH 4ClD 、N 2E 、HClF 、H 2O 2G 、NH 3H 、CO 2从组成元素上判断的规律:一般来说,离子化合物由活泼的金属元素(IA ,IIA )和活泼的非金属元素(VIA ,VIIA )组成;共价化合物只由非金属元素组成(例外:NH 4Cl 等铵盐是离子化合物)小结[判断离子化合物、共价化合物的方法]强碱、大部分金属氧化物、大部分盐都是离子化合物;多数非金属单质,气态氢化物,酸分子,酸酐分子,大多数有机物都是共价化合物。
从物质类型上判断的规律:思考电子式的书写电子式定义:在元素符号周围用“· ”或“×”来表示原子最外层电子的式子,叫电子式。
单质化合物离子化合物共价化合物类型:微粒(原子、离子)物质1、微粒电子式的书写:原子的电子式:原子的电子式:在元素符号周围用“.”或“×”来表示其最外层电子数。
离子的电子式:阳离子的电子式:简单阳离子的电子式就是它+)例外。
的离子符号,复杂阳离子(NH4阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出所带电荷“n-”。
(完整版)中学化学中常见的电子式大全(1)
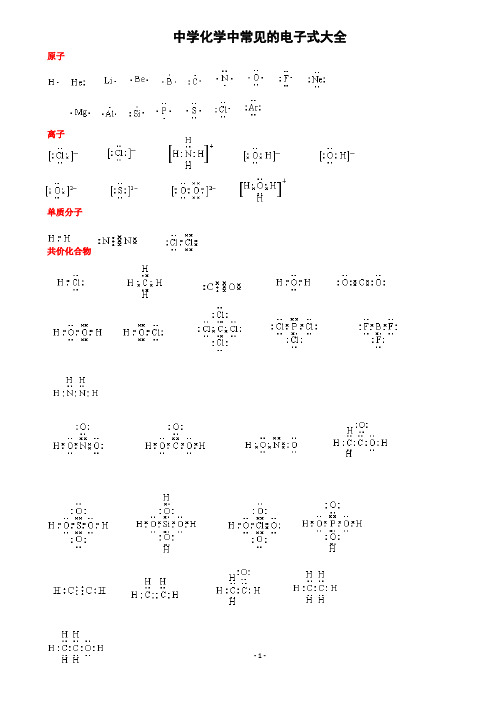
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N NO 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O H CO 2 O C O HclO H O ClNH 3 H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl ClNaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -Cl H N HHNH 4Cl+ - CaC 2 Ca 2+ 2- -CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 )(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况ClCl C C HH C H HO F N H H H H FS 2– Cl Na + Na Mg H H O OK + S 2– K + K 2+ S 2– O – H②例子:HCl 的电子式为 ;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 + NaCl 的形成过程 + K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
高考化学中常见的电子式大全
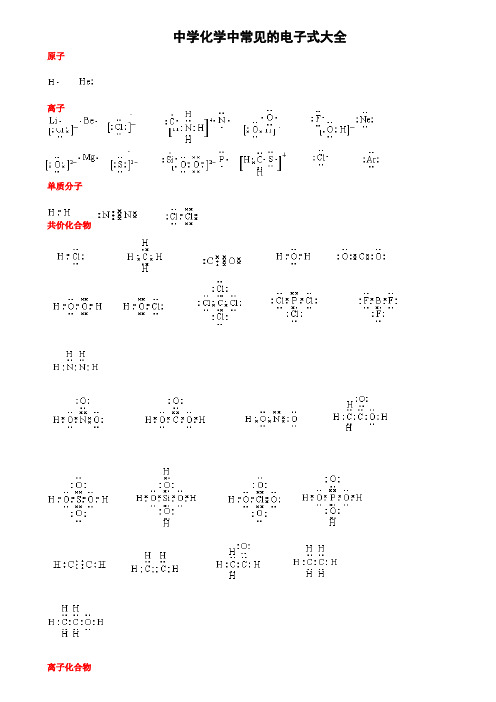
6.“基”中至少有一个原子是不符合8电子稳定结构,“基”是不显电性的,例如:-CH3、-OH。
三、注意微粒间的排列方式。
7.离子化合物多离子微粒阴阳离子交替排列。
8.共价化合物(有机物除外)多原子微粒正负价原子交替排列。
(4) 盐:氯化钠、氯化钙、硫化钠、氯化铵、硫化铵、甲酸钠、乙酸钠、次氯酸钠、次氯酸钙。
Na+[]-[]-Ca2+[]-Na+[]2-Na+
H H H
[]+[]-[]+[]2-[]+
H H H
H
[]-Na+[]-Na+
H
Na+[]-[]-Ca2+[]-
(5)类盐:电石、二氮化三镁。
Ca2+[]2-Mg2+[]3-Mg2+[]3-Mg2+
7.用电子式表示物质的形成过程
①离子化合物的形成过程
形成用“→”表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后为离子化合物的电子式。例如,NaCl的形成过程为:
N2()CO()、
NO+()、
CN-()、
C22-()
CO2(电子式见前)NO2+、N3-、CNS-
SO
PO43-
掌握了微粒电子式的写法,就可以快速书写该微粒的结构式,也可以用电子式来表示微粒的形成过程。对于简单短周期元素的原子形成的微粒还可以依据其电子式推导其空间结构,
如BF3()中B原子上无孤对电子,此分子应为平
一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。例如, 、 、 。
常见物质的电子式及结构式

硫化钾的电子式
K + :S :2-K +
::
氧化钠的电子式
Na + :O:2- Na+
::
过氧化钠的电子式
Na+ :O:O:2-Na+
::
氧化镁的电子式
Mg2+ :O :2-
::
::
溴化镁的电子式
:Br :-Mg2+:Br:-
::
氯化铵的电子式
:: ::
H
+
-
H :N :H :Cl :
H
氮化钠的电子式
:: ::
2+
Fe
: S: S:
2-
碳化钙(电石)的电子式
Ca2+ :C C:2-
:::
:::
乙炔的电子式、结构式
H:C C :H H—C ——— C—H
:
二氧化碳的电子式
O ::C :O O —— C —— O
:: ::
二硫化碳的电子式
S ::C ::S S —C —S
甲烷的电子式、 结构式
: ——
:
H H :C:H
H
H H—C — H
H
:: :: : :
::
四氯化碳的电子式
:Cl : :Cl :C :Cl :
:Cl :
__
四氯化碳的结构式
Cl Cl _ C _ Cl
Cl
一氯甲烷的电子式、结构式
::: __
:Cl : H :C :H
H
Cl H_ C_ H
H
甲醇的电子式、结构式
:: ::
__
H
H
H :C :O :H H_ C_ O _ H
常见物质的电子式及结构式

:
H
次氯酸的电子式、结构式
:: ::
H :O :Cl :
O
H Cl
四氯化碳的电子式 结构式
:: :: : :
::
__
:Cl :
Cl
:Cl :C :Cl :Cl_ C _ Cl
:Cl :
Cl
三氯化磷的电子式、结构式
:: : ::
_
::
::
Cl
Cl
:Cl :P :Cl : Cl _ P _ Cl
:: ::
::
3:离子化合物:
NaOH的电子式
Na+ :O :H -
氢氧化钡的电子式
:O:H - Ba2+:O:H -
::
::
::
过氧化钠的电子式
Na+ :O:O:2-Na+
氧N化a钠+ 的:O电子:式2 - Na +
氢化钠的电子式
Na+ :H -
::
; :S :2 - K+
溴化镁的电子式
:Br :-Mg2+ :Br :-
氧化镁的电子式
Mg2+ :O :2-
::
氯化铵的电子式
H
+
-
H :N :H :Cl :
:: ::
H
:::
乙炔的电子式、结构式
H:C C :H H—C ——— C—H
:: :: : :
氮化镁的电子式 (Mg3N2)
Mg2+:N :3- Mg2+:N :3-Mg2+
常见物质的电子式 及结构式
:: : : :::
1:单质: 氮气的电子式、结构式
常见物质的电子式及结构式68596

常见物质的结构式示例
氧气:O2
氨气:NH3 二氧化碳:CO2
氢氧化钙:Ca(OH)2 硫酸:H2SO4
氢气:H2
水:H2O
甲烷:CH4
氢氧化钠:NaOH 氯化氢:HCl
电子式与结构式的比较
相同点比较
都由元素符号和数字组成
都是表示物质组成的方式
都表示了原子之间的连接方 式
都反映了物质的电子排布情 况
物质的结构与性质的关系在化学研究中的重要性:物质的结构与性质的关系是化学研究的核 心内容之一,对于理解化学反应机理、预测新物质性质以及开发新材料具有重要意义。
常见物质的电子式及结构式总结与 回顾
重点内容总结
常见物质的电子式及结构式的书写规则和技巧 常见物质的电子式及结构式的应用和实例 常见物质的电子式及结构式的比较和鉴别 常见物质的电子式及结构式的重要性和意义
电子式的特点:电 子式中的电子数与 原子的核外电子数 相等
电子式的书写规则: 按照原子核外电子 排布规律书写
电子式与结构式的 区别:电子式表示 原子的电子分布情 况,结构式表示分 子的结构
电子式的书写规则
原子电子式的书写:根据原子的最外层电子数,用小黑点或数字标在元素符号的右上方 离子电子式的书写:先标电荷数,后标电性,离子团用括号括起来 共价化合物电子式的书写:先标元素符号,再标价电子数,最后标电荷数 离子化合物的电子式书写:先标元素符号,再标电荷数,最后标电性
添加标题
添加标题
添加标题
添加标题
结构式可以反映分子中原子的连 接方式和排列顺序,但不能反映 分子的立体构型
结构式是确定化合物化学性质的 重要依据之一,可以通过结构式 推测分子的性质和反应机理
结构式的书写规则
常见物质的电子式及结构式

常见物质的电子式及结构式
常见物质的电子式及结构式是描述物质中原子之间的化学键的方式。
它们是以化学元素符号表示的原子和以线条表示的化学键的组合。
以下是一些常见物质的电子式及结构式的例子:
1.氢气(H2):电子式为H-H,结构式为H
2.水(H2O):电子式为O-H,结构式为H-O-H
3.二氧化碳(CO2):电子式为O=C=O,结构式为O=C=O
4.氯气(Cl2):电子式为Cl-Cl,结构式为Cl
C
5.氨(NH3):电子式为H-N-H,结构式为H
N
H
6.乙烯(C2H4):电子式为C=C,结构式为H
C=C
H
7.苯(C6H6):电子式为C6H6,结构式为HH
H-C=C-C=C
HH
这些例子展示了一些常见物质的电子式及结构式。
电子式用于描述原子之间的化学键,结构式用于表示原子在空间中的相对位置。
通过这些符号和线条的组合,化学家可以更好地理解物质分子的构成和结构,进而研究物质的性质和反应过程。
化学常见电子式
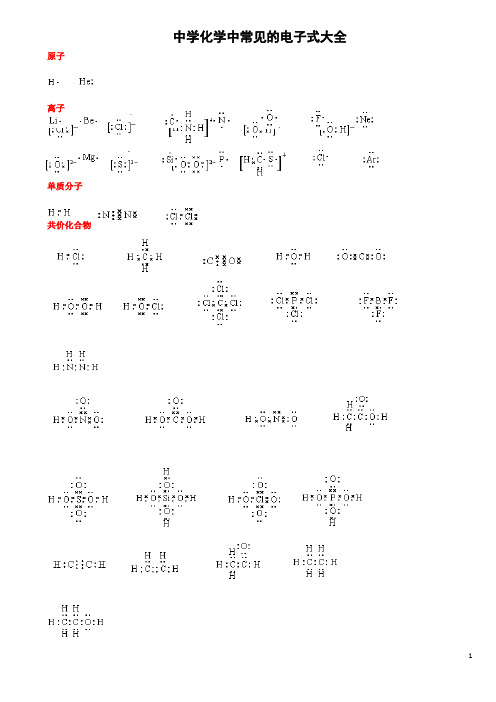
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程1、 原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2、 离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
[ ]2-[ ]2-[ ]2-[ ]- Na + Mg 2+ Al 3+4、“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
H H [ ]-[ ]-[ ]-[ ]-[ ]+ H H 5、单质分子的电子式:H 2 、Cl 2 、N 2。
H· ·· ·C· ····N· ·····O·Na· ·Mg· · ·Al· ···· ·S· ·····Cl ∶·· ·· ∶O ∶ ·· ···· ··∶O ∶O ∶ ·· ·· ∶S ∶ ····∶Cl ∶ ···· ∶O ∶H ·· ···· ·· ∶Cl ∶O ∶ ·· ····H∶C ∶O ∶ ·· ∶O ∶ ···· H ∶N ∶HH ∶H ·· ···· ··∶Cl ∶Cl ∶· ·∶N ∶∶N ∶·· ·· ···· ··H ∶C ∶C ∶O ∶·· ∶O ∶6、共价化合物的电子式:(1) 氢化物:HCl 、H 2O 、NH 3。
常见物质的电子式及结构式

S ::C ::S S —• C —S
硫化氢
H :S :H
S
HH
氨分子的电子式、结构式
:: —
•
H :N :H H—N—H
H
H
甲烷的电子式、 结构式
: ——
:
H H :C:H
H
•
H
H—C — H
H
三氯化磷的电子式、结构式
:: : ::
_
::
•
Cl
Cl
:Cl :P :Cl : Cl _ P _ Cl
氢氧化钡的电子式
:O:H - Ba2+:O:H -
:: ::
氮化钠的电子式
Na+
(Na3N)
Na+ •
:N:3-Na+
过氧化钠的电子式
::
Na+ :O :O:2N- a+
氮化镁的电子式 (Mg3N2)
:: ::
Mg2+
:N
:3-
•
Mg2+:N
:3-Mg2+
氯化铵的电子式
:: ::
H
+ •
::
四氯化碳的电子式 结构式
:: :: : :
::
__
:Cl : •
Cl
:Cl :C :Cl :Cl_ C _ Cl
:Cl :
Cl
:: ::
次氯酸的电子式、结构式
•
H :O :Cl : H
O Cl
三氟化硼的结构式6电子也稳定
F
B
F
F
:: ::
::
NaOH的电子式
Na+ :O :H
初中化学知识点归纳化学式结构式和电子式的表示方法

初中化学知识点归纳化学式结构式和电子式的表示方法初中化学知识点归纳:化学式、结构式和电子式的表示方法化学是一门研究物质的变化及其性质的科学。
在化学研究中,我们经常需要用化学式、结构式和电子式来表示化学物质的组成和结构。
本文将介绍初中化学中常用的化学式、结构式和电子式的表示方法。
一、化学式化学式是用化学符号和数字表示化学物质的组成。
根据化学元素的原子数目,化学式分为分子式和离子式。
1. 分子式分子式用化学元素的符号和数字表示化学物质中原子的种类和数目。
以H2O(水)为例,其中H表示氢元素,O表示氧元素,数字2表示氢原子的个数。
2. 离子式离子式描述的是离子键的组成和比例关系。
以NaCl(氯化钠)为例,其中Na+表示钠离子,Cl-表示氯离子。
离子式中,阳离子在前,阴离子在后。
二、结构式结构式用线条和原子符号表示物质内部的原子结构和原子间的化学键。
不同的物质由于原子间的连接方式不同,结构式也不同。
1. 电键线式电键线式适用于表示有机物的结构。
一根实线表示共价键(电键),两根实线表示双键,三根实线表示三键。
原子间连接关系由线条的位置表示。
2. 简化式简化式常用于表达常见的有机物结构,使用简化的线条表示共价键的连接关系,原子符号只标注在关键位置,并省略了其他部分的结构。
三、电子式电子式用化学元素符号和点(.)表示原子外层电子。
电子式适用于描述电子的分布和原子间的化学键。
1. 电子轨道式电子轨道式用圆圈表示原子的各个电子层和轨道,用点表示轨道上的电子。
2. 电子点式电子点式用点表示原子的外层电子,电子点的位置表示电子所在轨道。
例如氯气(Cl2)的电子点式为:•Cl-Cl•综上所述,化学式、结构式和电子式是初中化学中重要的表示方法。
化学式用于表示化学物质的组成,结构式用于表示原子的连接方式,电子式用于描述电子分布。
通过这些表示方法,我们可以更加直观地了解和研究化学物质的性质和变化规律。
九年级化学电子式的书写规则

电子式的书写•定义:在化学反应中,一般是原子的最外层电子数目发生变化。
为了简便起见,化学中常在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H·、Na·、(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+(3)阴离子的电子式:要画出最外层电子数,用“[ ]”括起来,右上角标出“n-”:、、(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并:、(5)共价化合物的电子式:画出离子最外层电子数:、(6)用电子式表示物质形成的过程:氯化氢的形成过程:氯化镁的形成过程:结构式:共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如:•书写电子式的常见错误:1.漏写未参与成键的电子,如:2.化合物类型不清,漏写或多写“[]”及错写电荷数,如:3.书写不规范,错写共用电子对如:N2的电子式为:,不能写成:,更不能写成:或。
4.不考虑原子间的结合顺序如:HClO的电子式为,而非。
因氧原子需形成2对共用电子才能达到稳定结构,而H、Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如:的电子式为,而非,因中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如:中均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。
它们的电子式分别为:。
常见物质的电子式及结构式解读

:Br :-Mg2+ :Br :-
氧化镁的电子式
Mg2+ :O :2-
::
氯化铵的电子式
H
+
-
H :N :H :Cl :
:: ::
H
:::
乙炔的电子式、结构式
H:C C :H H—C ——— C—H
:: :: : :
氮化镁的电子式 (Mg3N2)
Mg2+:N :3- Mg2+:N :3-Mg2+
H :S :H
结构式
S
HH
氢氰酸的电子式、结构式
H :C N :
H — C ——— N
:: : : :: : :
:
二氧化碳的电子式 结构式
O ::C :O O ——C ——O
二硫化碳的电子式
S ::C ::S S —— C ——S
::
氨分子的电子式、结构式
H :N :H H—N—H
—
H
H
:
甲烷的电子式
:: ::
::
3:离子化合物:
NaOH的电子式
Na+ :O :H -
氢氧化钡的电子式
:O:H - Ba2+:O:H -
::
::
::
过氧化钠的电子式
Na+ :O:O:2-Na+
氧N化a钠+ 的:O电子:式2 - Na +
氢化钠的电子式
Na+ :H -
::
::
::
硫化钾的电子式
K+ :S :2 - K+
氮化钠的电子式
Na+
(Na3N)
高考化学中常见的电子式大全

中学化学中常见的电子式大全原子 离子 单质分子 共价化合物 离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成:; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电O O H O ClH Cl OCl 2荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
