大学精选化学公式(通用版)
大学无机化学所有公式(一)2024

大学无机化学所有公式(一)引言概述:无机化学是化学的一个重要分支,主要研究无机物质的性质、结构和反应。
在大学无机化学的学习中,掌握相关的公式是非常重要的。
本文将给出大学无机化学所有公式(一),并按照五个大点对其进行详细阐述。
一、物质的量计算公式:1. 摩尔质量公式2. 物质的量计算公式3. 有效摩尔质量公式4. 摩尔浓度计算公式5. 摩尔分数计算公式6. 形成常数计算公式7. 离子产率计算公式8. 计算化学反应过程中的物质的量变化公式9. 摩尔比计算公式二、配位化学公式:1. 配合物的化学式表示2. 配合物的离解平衡常数计算公式3. 配位键长计算公式4. 配合物的形成常数计算公式5. 配位反应的速率计算公式6. 配位反应的平衡常数计算公式7. 配位反应的过渡态理论计算公式8. 配位数计算公式9. 配位反应的活化能计算公式三、结构和键相关公式:1. 倍键键长计算公式2. 动力学和热力学条件下键强度计算公式3. 键的电荷分布计算公式4. 键的离子极性计算公式5. 键的共价极性计算公式6. 核磁共振化学位移计算公式7. 键能计算公式8. 分子轨道理论计算公式9. 键的键解离能计算公式四、溶液和酸碱公式:1. 酸碱中和计算公式2. 酸碱平衡常数计算公式3. 氧化还原反应电势计算公式4. 溶解度积计算公式5. 溶液浓度计算公式6. 电动势计算公式7. 膜电位计算公式8. 应用平衡常数计算酸碱溶液酸碱稳定性的公式9. 离子活度计算公式五、化学反应速率及反应机理公式:1. 反应速率计算公式2. 反应级数计算公式3. 反应速率常数计算公式4. 反应活化能计算公式5. 反应机理相关公式6. 温度对反应速率的影响公式7. 浓度对反应速率的影响公式8. 温度对反应平衡常数的影响公式9. 浓度对反应平衡常数的影响公式总结:本文详细介绍了大学无机化学的公式,涵盖了物质的量计算、配位化学、结构和键的计算、溶液和酸碱计算以及化学反应速率和反应机理的计算等方面。
大学化学公式精编版

大学化学公式热力学第一定律功:δW =δW e +δW f (1) 膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2) 非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r=5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =Hp T ⎪⎪⎭⎫⎝⎛∂∂=-()p T C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BA B A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式: (1) 组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2) M axwell 关系:T V S ⎪⎭⎫ ⎝⎛∂∂=V T p ⎪⎭⎫ ⎝⎛∂∂ Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫⎝⎛∂∂ (3) 热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。
大学化学公式

大学化学公式热力学第一定律功:δW =δW e +δW f(1) 膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2) 非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1) 等压热容:C p =δQ p /dT = (∂H/∂T )p (2) 等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =Hp T ⎪⎪⎭⎫⎝⎛∂∂=-()p T C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BA B A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1) 组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2) M axwell 关系:T V S ⎪⎭⎫ ⎝⎛∂∂=V T p ⎪⎭⎫ ⎝⎛∂∂ Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫⎝⎛∂∂ (3) 热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。
(完整版)大学有机化学反应方程式总结(较全)
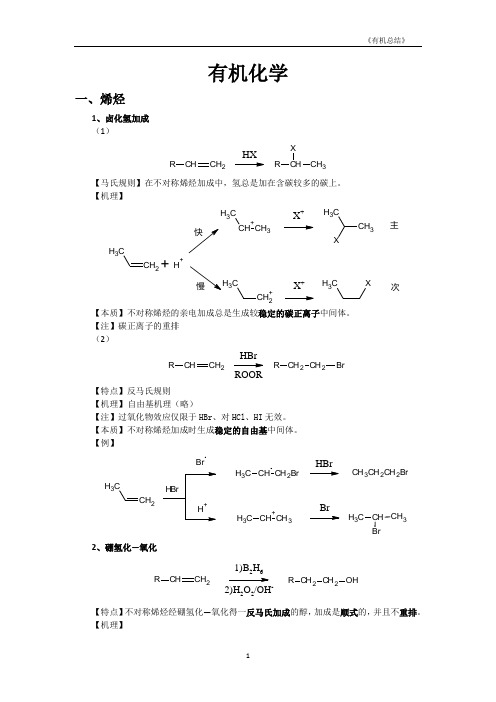
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32 CH CH2CH3HBH2CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2B OCH2CH2CH3H3CH2CH2C2CH2CH3+O H-OHB-OC H2CH2CH3CH2CH2CH3H3CH2CH2B OC H2CH2CH3CH2CH2CH3H2CH2CH3HOO-B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOC H2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr/CClC CBr【机理】CCC CBrBr CBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
大学化学公式

ϴ ΔrSmϴ(298.15K)=ΣBνBSm,B(298.15K )
• 吉布斯-亥姆霍兹公式:
ΔG =ΔH- TΔS
• 反应自发进行的最低温度(反应逆转的转折温度):
T≥ ΔrHm (298.15K)/ ΔrSm(298.15K)
ϴ
ϴ
三、吉布斯函数变与标准平衡常数
• 标准摩尔吉布斯函数变:= lnK源自ϴ ϴ Δr Gm (T )ϴ
ϴ
RT
ϴ
Δ G ( T ) - r m lg K 2.303RT
ϴ
四、温度对化学反应的影响
• 温度对化学平衡的影响:
ϴ
ϴ
ϴ
ϴ ϴ
ϴ
• 温度对化学反应速率的影响: k=A exp(-Ea/RT) • 阿伦尼乌斯公式:
Ea T2- T1 k2 ln ( ) = R T1 k1 T2
一、热力学第一定律与化学反应的反应热
• 对于一个封闭系统,有 Δ U=Q+W • 定容过程的反应热: △U =Q -P△V =QV • 定压过程的反应热: QP =H2-H1=ΔH • 盖斯定律:△rH=∑i△rHi
• 标准摩尔焓变:
ΔrHm (T)= ΣBνBΔfHmB
Ө
Ө
(T)
二、热力学第二定律用于反应的自发性
ΔrGm (T)= ΣBνBΔfGm,B(T)
• 化学 反应等温式——ΔrG、ΔrG 的关系
ϴ ϴ
ϴ
ϴ
、K
之间
ϴ ΔrGm(T)=ΔrGm (T)+RTlnПB(pB/pϴ)νB
• 标准平衡常数的定义:
K
Ө
Ө νB eq =ΠB(pB /p )
大学化学公式

大学化学公式热力学第一定律功:δW =δW e +δW f (1) 膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2) 非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =Hp T ⎪⎪⎭⎫⎝⎛∂∂=-()p T C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BA B A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式: (1) 组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2) M axwell 关系:T V S ⎪⎭⎫ ⎝⎛∂∂=V T p ⎪⎭⎫ ⎝⎛∂∂ Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫⎝⎛∂∂ (3) 热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。
30个常见的的化学公式

30个常见的的化学公式1. 氢气燃烧:公式2H2+O2点燃===2H2O,就像氢气和氧气这俩小伙伴,一点火就变成水啦。
2. 碳完全燃烧:公式C+O2点燃===CO2,碳在氧气里欢快燃烧,变成二氧化碳飘走咯。
3. 碳不完全燃烧:公式2C+O2点燃===2CO,碳没烧透就变成一氧化碳这个有点“调皮”的家伙。
4. 铁在氧气中燃烧:公式3Fe+2O2点燃===Fe3O4,铁在氧气里一烧,就变成四氧化三铁这个新模样。
===2H2O+5. 实验室制氧气(过氧化氢分解):公式2H2O MnO22O2↑,过氧化氢在二氧化锰的催促下,变成水和氧气跑出来啦。
===2KCl+6. 实验室制氧气(氯酸钾分解):公式2KCl O MnO2,33O2↑,氯酸钾在二氧化锰的帮助下加热就放出氧气啦。
7. 实验室制氧气(高锰酸钾分解):公式2KMnO4===K2MnO4+MnO2+O2↑,高锰酸钾一受热,就分解出好几种东西还放出氧气。
8. 水通电分解:公式2H2O通电===2H2↑+O2↑,水电一通电,氢气和氧气就像被分开的小两口各自跑出来了。
9. 二氧化碳和水反应:公式CO2+H2O===H2CO3,二氧化碳和水一混合就变成碳酸这个酸酸的东西。
10. 碳酸分解:公式H2CO3===CO2↑+H2O,碳酸不稳定,一会儿就分解成二氧化碳和水啦。
11. 碳酸钙和稀盐酸反应:公式CaCO3+2HCl===CaCl2+H2O+CO2↑,碳酸钙和盐酸一见面就反应,生成氯化钙、水还有二氧化碳这个气儿。
12. 氢氧化钠和二氧化碳反应(少量二氧化碳):公式2NaOH+CO2=== Na2CO3+H2O,氢氧化钠遇到少量二氧化碳就变成碳酸钠和水。
13. 氢氧化钠和二氧化碳反应(过量二氧化碳):公式NaOH+CO2=== NaHCO3,二氧化碳多了,氢氧化钠就变成碳酸氢钠了。
14. 硫酸铜和氢氧化钠反应:公式CuSO4+2NaOH===Cu(OH)2↓+Na2SO4,硫酸铜和氢氧化钠一搅和,就有氢氧化铜这个蓝色沉淀和硫酸钠生成。
化学公式详细大全

化学公式详细大全一、常见无机化合物1. 氢氧化钠:化学式为NaOH,是一种强碱性化合物,常用于制备肥皂、纸张等工业过程中。
2. 硫酸:化学式为H2SO4,是一种强酸性化合物,常用于制备磷酸、硝酸等化合物,也是重要的化工原料之一。
3. 氨水:化学式为NH3·H2O,是一种弱碱性化合物,可用于制备氨盐、染料等化合物。
4. 氢氧化铝:化学式为Al(OH)3,是一种白色粉末状的无机化合物,可用于制备金属铝、铝合金等物质。
5. 氧化铜:化学式为CuO,是一种黑色粉末状的无机化合物,可用于制备各种含铜化合物。
6. 二氧化碳:化学式为CO2,是一种无色无味的气体,可用于制备饮料、工业气体等。
7. 氯化钠:化学式为NaCl,是一种常见的盐类化合物,可用作调味品、化工原料,还是制备氢氯酸、氢氧化钠等化合物的重要原料之一。
8. 硫化氢:化学式为H2S,是一种有毒的气体,可用于金属硫化、酸洗等工业过程中。
9. 氨气:化学式为NH3,是一种无色有刺激性气味的气体,可用于制备氮化物、氨盐等化合物。
10. 磷酸:化学式为H3PO4,是一种重要的无机化合物,可用于制备肥料、磷化剂、阻燃剂等。
二、常见有机化合物1. 甲烷:化学式为CH4,是一种无色无味气体,主要用于燃料和工业化学反应中。
2. 乙醇:化学式为C2H5OH,是一种常见的酒精,可用于制备酯、乙醛等化合物。
3. 醋酸:化学式为CH3COOH,是一种有机酸,可用于制备需要有机酸催化的化学反应。
4. 丙酮:化学式为C3H6O,是一种无色具有刺激性气味的液体,可用于制备树脂、油漆、纤维素醋酸纤维等化合物。
5. 苯酚:化学式为C6H5OH,是一种有机化合物,可用于制备颜料、染料等。
6. 乙二醇:化学式为HOCH2CH2OH,是一种重要的有机化合物,可用于制备聚酯、粘合剂等化合物。
7. 甲苯:化学式为C7H8,是一种无色液体,可用于制备防腐剂、染料、催化剂等化合物。
8. 丁二酸:化学式为HOOC(CH2)2COOH,是一种常见的返酸,可用于制备聚酯、苯丙酮等化合物。
大学化学全部公式(两篇)

引言:化学是一门研究物质的组成、性质以及变化的学科。
在大学学习化学时,掌握各种化学公式是非常重要的,这些公式能够帮助我们理解和预测化学反应和物质的性质。
本文将介绍大学化学中一些重要的公式,以助于学生更好地理解化学理论和实践。
正文:1.热力学公式1.热力学第一定律公式:ΔU=q+w,其中ΔU表示内能的变化,q 表示热量的变化,w表示做功的变化。
2.热力学第二定律公式:ΔS≥q/T,其中ΔS表示熵的变化,q表示热量的变化,T表示绝对温度。
2.酸碱平衡公式1.酸碱离子浓度公式:pH=log[H+],pOH=log[OH],其中[H+]表示氢离子浓度,[OH]表示氢氧根离子浓度。
2.酸离子平衡常数公式:Ka=[H+][A]/[HA],其中Ka表示酸的离解常数,[H+]表示氢离子浓度,[A]表示酸的共轭碱离子浓度,[HA]表示未离解酸浓度。
3.化学平衡公式1.平衡常数公式:Kc=[C]^c[D]^d/[A]^a[B]^b,其中Kc表示平衡常数,[A]、[B]、[C]、[D]分别表示与反应物A、B、和物C、D 的浓度,a、b、c、d分别表示反应物A、B和物C、D的摩尔系数。
2.平衡常数与温度的关系:ΔG=RTlnK,其中ΔG表示自由能变化,R表示理想气体常数,T表示温度,K表示平衡常数。
4.电化学公式1.电解质流量公式:I=nFAv,其中I表示电流强度,n表示转移的电荷数,F表示法拉第常数,A表示电极表面积,v表示离子流速。
2.电动势公式:Ecell=EredEox,其中Ecell表示电池电势,Ered表示还原半反应的标准电势,Eox表示氧化半反应的标准电势。
5.有机化学公式1.亲核取代反应速率公式:rate=k[Nuc][Electrophile],其中rate表示反应速率,k表示反应速率常数,[Nuc]表示亲核试剂浓度,[Electrophile]表示亲电试剂浓度。
2.还原反应氧化态变化公式:Δox=n(S–R),其中Δox表示氧化状态的变化,n为电子数,S表示原始氧化态,R表示还原产物氧化态。
大学化学主要公式总结

一些热力学公式
• ΔU=Q-W
• δW=pdV, (理想气体pV=nRT) • H=U+pV ΔH=ΔU+pΔV(恒压下)
• ΔH=qP ΔU=qV
其它一些有用的公式
稀溶液的依数性: 沸点升高和凝固点下降
Tb KbmB Tf K f mB
非电解质稀溶液的通性
1. 溶液的蒸气压下降(与纯溶剂相比) 2. 沸点上升 3. 凝固点下降 4. 渗透压
ln
K
2
K
ቤተ መጻሕፍቲ ባይዱ
1
rH
m
(
1
R T2
1
T1
)
阿仑尼乌斯方程:
ln k2 k1
Ea R
(1
T2
1
T1
)
化学动力学
•
反应速率定义:
1
νB
dcB dt
• 一级反应的特征及有关计算
t1/ 2
1 k
ln
c0 c0 / 2
ln 2 k
• 影响化学反应速率的因素:
浓度(质量作用定律) υ kcAacBb
rGm (T ) RT ln K
平衡时, r Gm(T)=0
平衡时的Q 即是KΘ
(酸、碱)电离平衡: 酸碱解离常数: Ka,Kb,Kw
ceq(H ) c0α Ka c0
pH
pK a
lg
c(共轭酸 ) c(共轭碱 )
沉淀溶解平衡: 难溶电解质溶度积:Ksp
配位平衡: 配离子解离常数或稳定常数:K稳、 K不稳
电化学中的几个基本功
大学化学必修+选修全套公式

大学化学必修+选修全套公式1. 物质的组成和结构- 元素周期表:周期表中展示了所有已知元素,包括元素的原子序数、原子质量等信息。
- 化合价:指元素在化合物中与其他元素相连的方式。
例如,氧的化合价通常为-2,氢的化合价为+1。
- 分子式:用来表示分子中各种元素的种类和数量的化学符号。
2. 化学反应和化学方程式- 化学反应:指物质发生变化从而产生新的物质的过程。
- 化学方程式:用化学式和符号表示化学反应的过程和结果。
3. 原子、分子和摩尔- 原子:构成物质的最小单位,由质子、中子和电子组成。
- 分子:由两个或更多原子组成的单元。
- 摩尔:物质的质量在化学反应中的基本单位,一个摩尔的质量等于该物质的相对分子质量或相对原子质量。
4. 功、功率和能量- 功:指力对物体进行的变形或位移所做的功。
功等于力乘以物体的位移。
- 功率:指单位时间内所做功的大小。
功率等于功除以时间。
- 能量:物体具有的使其产生变化或做功的能力。
能量可以存在于多种形式,如动能、势能等。
5. 化学平衡- 化学平衡:指化学反应过程中,反应物与生成物的浓度或物质的数量保持不变的状态。
- 平衡常数:用来表示化学反应达到平衡时,反应物与生成物之间的浓度关系的数值常数。
- 酸碱平衡:指酸和碱在水溶液中反应产生盐和水的过程。
6. 氧化还原反应- 氧化还原反应:指物质与氧化剂或还原剂之间电子的转移过程。
- 氧化剂:在氧化还原反应中接受电子的物质。
- 还原剂:在氧化还原反应中捐赠电子的物质。
以上是大学化学必修和选修课程中常用的公式和概念。
希望对你的学习有所帮助!。
大学化学公式

大学化学公式热力学第一定律功:δW =δW e +δW f (1) 膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2) 非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v常温下单原子分子:C v ,m =C v ,m t=3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫ ⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BA B A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式: (1) 组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2) M axwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=V T p ⎪⎭⎫ ⎝⎛∂∂ Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3) 热容与T 、S 、p 、V 的关系:C V =T VT S ⎪⎭⎫⎝⎛∂∂ C p =T p T S ⎪⎭⎫ ⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。
大学精选化学公式(通用版)

大学精选化学公式(通用版)一、化平衡学化学反应亲和势:A =-r m B B BG γμ∆∑=-化学反应等温式:r m r m a G G RT ln Q Φ∆∆=+平衡常数的表达式:()B B g hG Hfpd e D Ep p K K p p p γΦΦΦ∑-== ()B B p p K K p γΦΦ∑-= ()BBf p K K K p γγΦΦ∑-=BBBBx p p p K K K pp γγΦΦ∑∑⎛⎫ ⎪⎝⎭--== ()BBBBc p p RT K K K RT p γγΦΦ∑⎛⎫∑ ⎪⎝⎭--== 温度,压力及惰性气体对化学平衡的影响:r m 2d ln K H dT RT ΦΦ∆= Cr m 2d ln K U dT RT ΦΦ∆= B Bp C c RT K K p γΦΦΦΦ∑⎛⎫ ⎪⎝⎭=二、电解质溶液法拉第定律:Q =nzF m =M zFQdEr U dl ++= dE r U dl--= t +=-+I I =-++r r r +=-+U U U ++=∞∞+Λm,m λ=()FU U F U ∞∞+∞+-+ r +为离子移动速率,U +( U -)为正(负)离子的电迁移率(亦称淌度)。
近似:+∞+≈,m ,m λλ +∞+≈,m ,m U U m m Λ≈Λ∞(浓度不太大的强电解质溶液)离子迁移数:t B =I I B =Q Q B ∑B t =∑+t +∑-t =1 电导:G =1/R =I/U =kA/l 电导率:k =1/ρ 单位:S ·m -1莫尔电导率:Λm =kV m =k/c单位S ·m 2·mol -1cell lR K Aρρ== cell 1K R kR ρ==科尔劳乌施经验式:Λm =()c1m β-∞Λ离子独立移动定律:∞Λm =()m,m,+U U F λλ∞∞∞∞+--+=+ m U F λ∞∞+,+= 奥斯特瓦儿德稀释定律:Φc K =()mm m 2m c c ΛΛΛΛ∞∞Φ-平均质量摩尔浓度:±m =()v1vv m m --++平均活度系数:±γ=()v1vv --+γγ+平均活度:±a =()1v v a a--++=m m γ±±Φ电解质B 的活度:a B =v a ±=vm m ⎪⎭⎫⎝⎛Φ±±γ+v v v B +a a a a ±--== m +=v +m B m -=v -m B ()1v v vB m v v m +±+--=离子强度:I =∑i2i i z m 21德拜-休克尔公式:lg ±γ=-A|z +z --|I三、可逆电池的电动势及其应用(Δr G )T,p =-W f,max (Δr G m )T,p =zEFNernst Equation :若电池反应为 cC +dD =gG +hH E =Eφ-dDc C hH g G a a a a ln zF RT标准电动势E φ与平衡常数K φ的关系:E φ=φlnK zFRT还原电极电势的计算公式:ϕ=氧化态还原态-a a lnzFRT φϕ计算电池反应的有关热力学函数变化值:m r S ∆=pT E zF ⎪⎭⎫⎝⎛∂∂m r H ∆=-zEF +p T E zFT ⎪⎭⎫ ⎝⎛∂∂ Q R =T m r S ∆=pT E zFT ⎪⎭⎫ ⎝⎛∂∂zF ⎪⎪⎭⎫ ⎝⎛∆⎪⎪⎭⎫⎝⎛21m r 1122T 1T 1H T E T E -=- zF ⎰⎪⎭⎫ ⎝⎛T2E2E 11T E d =dT T H 21T T 2m r ⎰∆ 电极书面表示所采用的规则:负极写在左方,进行氧化反应(是阳极),正极写在右方,进行还原反应(是阴极) 电动势测定的应用:(1) 求热力学函数变量Δr G m 、Δr G m Φ、m r H ∆、m r S ∆及电池的可逆热效应Q R 等。
大学无机化学所有公式

所有公式:1、注意单位,如焦耳,千焦;2、加入溶液时注意体积变化引起的浓度的变化3、能斯特方程注意正负号;4、单质的标准绝对熵不等于零,f G m 稳定态单质,T=0 f G m H +,aq,T=0 Chap 11、热力学温度:T= t + T0 T0=2、理想气体状态方程:pV=nRT 用于温度不太低,压力不太高的真实气体在SI 制中,p 的单位是Pa,V 的单位是m 3,T 的单位是K,n 的单位是mol ;R 是摩尔气体常数,R 的数值和单位与p,V,T 的单位有关,在SI 制中,R = J·K -1·mol -1;3、4、分压5、分体积定律6、溶液的浓度质量百分比浓度 B = mB/m = mB/mB+mA 以溶质B 的质量在全部溶液的质量中占有的百分比质量摩尔浓度 bB = nB/mA溶质B 的物质的量与溶剂A 的质量的比值物质的量分数摩尔分数 = nB/nB+nA溶质B 的物质的量占全部溶液的物质的量的分数物质的量浓度 cB = nB/V溶质的物质的量除以溶液的总体积与温度相关, 单位:molm-3, moldm-3, molL-1 Chap 21、体积功:气体发生膨胀或压缩做的功,一般条件下进行的化学反应,只作体积功 W= -p V = -p V 终-V 始2、热和功不是状态函数3、热力学第一定律:封闭体系中:U = U 2 – U 1 = Q + W4、焓:H = U + pV 等压时:Q p =H 2 – H 1 = H若为理想气体,H = U + pV = U + nRT H = U + nRT 5、等容热效应Q V :U = Q V等压反应热Qp :W= -pV则U = Qp + W = Qp -pVQp = Qv + nRT6、标准摩尔反应焓变:r H m =i f H m 生成物 i f H m 反应物 =y f H m Y+z f H m Z – a f H m A+b f H m B7、S m B,相态,T ,单位是J·mol -1·K -1任一化学反应的标准摩尔熵变: rSm =B Sm 生成物,T-B Sm 反应物,T rSm >0,有利于反应正向自发进行;8、G = H – TSG:吉布斯函数,状态函数, 广度性质, 单位J9、计算已知反应的自由能变r Gmr Gm=B fGm生成物,T-B fGm反应物,TChap 31、恒容条件下的化学反应速率B:化学反应计量数,反应物为负,生成物为正B/t:物质B的物质的量浓度随时间的变化率:基于浓度的反应速率,单位为molL-1s-12、质量作用定律 = k A m B nk: 速率常数,随温度变化,不随浓度变化质量作用定律只使用于基元反应3、4、阿仑尼乌斯Arrhenius公式应用:设活化能与温度无关,根据两个不同温度下的k 值求活化能;5、标准平衡常数表达式:J 为反应商,可作为反应进行方向的判据:6、非标准态下反应的r G m:rGmT = rGmT+lg JlgK T =-r G m T/Van’t Hoff 方程式 :r H m T - T r S m T =r G m T = T在温度变化范围不大时7、平衡常数与温度的关系:Chap 91、价键理论:磁矩与未成对电子数2、配合物与沉淀的生成与转换: AgNH 32+ + Br = AgBrs + 2NH 3K 转= NH 32 / AgNH 32+Br =NH 32Ag +/AgNH 32+BrAg + = K 不稳/K sp AgBrAgBrs + 2NH 3= AgNH 32+ + Br K 转= K 稳·K sp AgBrAgBrs + 2S 2O 32 = AgS 2O 323 + Br K 转= K 稳K sp AgBr溶解效应:由于配位平衡的建立使沉淀溶解 AgCl Ag + + Cl - K s AgCl Ag + + 2NH 3 AgNH 32+ Kst,AgNH 32+ AgCl + 2NH 3 AgNH 32+ + Cl - K Chap8:1、E=正极-负极=氧化型电对—还原型电对2、能斯特方程)2(+=n n μ对于半电池反应:p 氧化型Ox + ze q 还原型Red其中z 为转移电子数 注:纯固纯液不算入方程中计算,记为1; 式中Ox 和Red 应看成 Ox/c 和Red/c 的省写,对气体应看成是p Ox /p 和 p Red /p 3、– G = nFE 可以用于判断反应进行方向G < 0 反应自发进行 E > 0G = 0 达到平衡 E = 0 G > 0 反应不自发 E < 0 若反应在标准状态下进行,可用 E 进行判断当外界条件一定时,反应处于标准状态,反应的方向就取决于氧化剂或还原剂的本性4、电极反应: r G m = -z 电极F F=96485电池反应: r G m = -zE 电池F G 单位:J/mol E 单位:V 5、求氧化还原反应的平衡常数 T=F =×104C, R= JK –1mol –1注意:n 为整个氧化还原反应中所转移的电子数,与化学反应方程式的计量系数有关;E 为标准电动势,可由正负电极的标准电极电势直接得出;7、8、求算未知电对的标准电极电势[Red]-- 2.303lg [Ox]2.303[Red]-lg [Ox]2.303[Ox] +lg [Red]0.0592[Ox] lg [Red]q pqppqp qz F z F RT RT zF RT or zF z θθθθϕϕϕϕϕϕϕϕ+=+===若某元素电势图为∵G1 = - n1F1G2= - n2F2G = - nF n = n1 + n2G = - nF = -n1+ n2FG = G1+G2= -n1F1+-n2F2∴-n1+n2F = -n1F1+-n2F2得到θ与1θ,2θ的关系:自己写一下i个相应电对:相应推广,自己写一下。
大一化学公式知识点总结

大一化学公式知识点总结化学作为一门自然科学,研究物质的性质、组成、结构、变化规律以及与能量的转化关系。
在学习化学的过程中,掌握各种化学公式是非常重要的。
本文将对大一化学中常见的公式进行总结和归纳,以帮助大家更好地掌握化学知识。
一、摩尔质量公式摩尔质量公式是化学中最基本的公式之一,用于计算物质的摩尔质量。
其公式表达为:摩尔质量 = 质量 / 物质的物质量其中,质量可以用克或其他适当单位表示,物质的物质量表示摩尔的数量。
二、摩尔浓度公式摩尔浓度是指单位体积溶液中溶质的物质的量,常用于溶液的配制和化学反应的计算中。
其公式表达为:摩尔浓度 = 物质的物质量 / 溶液的体积其中,物质的物质量可以用摩尔表示,溶液的体积可以用升或其他适当单位表示。
三、摩尔比公式摩尔比是指化学反应中参与反应物的摩尔比例关系。
其公式表达为:摩尔比 = 参与反应物的摩尔数量 / 参与反应物的摩尔数量其中,参与反应物的摩尔数量表示各个反应物的摩尔数量。
四、化学方程式配平公式化学方程式配平是化学反应的基本操作之一。
配平公式可以用于求解未配平的化学方程式。
常见的配平方法有代数法、半反应法等。
五、理想气体状态方程公式理想气体状态方程用于描述理想气体的状态,其公式表达为:PV = nRT其中,P表示气体的压强,V表示气体的体积,n表示气体的摩尔数量,R表示气体常数,T表示气体的温度。
六、酸碱滴定反应公式酸碱滴定是一种常见的化学分析方法,通过滴定试剂和反应物的反应来测定反应物的浓度。
酸碱滴定反应公式一般形式为:酸 + 碱→ 盐 + 水其中,酸和碱表示反应物,盐和水表示生成物。
七、电化学反应公式电化学反应涉及到电流和化学反应之间的关系,常见的电化学反应包括电解、电池反应等。
电化学反应公式根据具体反应类型不同而不同,如离子在电解液中的电离反应、电池反应的电子转移等。
八、平衡常数公式平衡常数用于描述化学反应达到平衡时,反应物和生成物浓度之间的关系。
大一化学公式知识点

大一化学公式知识点化学是一门研究物质的性质、组成、结构以及变化的科学。
在大一化学学习中,我们需要掌握一些重要的化学公式知识点。
本文将为您详细介绍大一化学中常见的公式知识点,帮助您更好地理解和掌握这些内容。
一、摩尔质量及摩尔质量计算公式摩尔质量是指一个物质的摩尔数与其质量的比值,用符号"M"表示,单位为g/mol。
摩尔质量计算公式如下:M = m/n其中,M表示摩尔质量,m表示物质的质量,n表示物质的摩尔数。
二、摩尔体积及摩尔体积计算公式摩尔体积是指一个物质的体积与其摩尔数的比值,用符号"V"表示,单位为L/mol。
摩尔体积计算公式如下:V = V/n其中,V表示摩尔体积,V表示物质的体积,n表示物质的摩尔数。
三、有机化学反应物的化学计量关系有机化学反应物的化学计量关系根据化学方程式中的系数来确定。
常见的化学计量关系包括物质的摩尔比、质量比和体积比。
四、平衡常数及平衡常数计算公式平衡常数是指在化学反应达到平衡时,反应物浓度与生成物浓度的比值的乘积。
平衡常数计算公式如下:Kc = [C]^c[D]^d/[A]^a[B]^b其中,Kc表示平衡常数,[C]、[D]、[A]、[B]表示相应物质的浓度,c、d、a、b表示相应物质的化学计量数。
五、配位化学中的配位数及配位数计算公式配位数是指一个配合物中配位原子与中心离子之间的键合数,常见的配位数有2、4、6等。
配位数计算公式如下:配位数 = 配位原子数 + 配位键数六、氧化还原反应中的氧化数及氧化数计算法则氧化数是指一个原子在化合物或离子中所带的电荷数,可以用来描述一个原子的氧化或还原程度。
氧化数计算法则包括如下几条:1. 原子的氧化数等于其自身原子的氧化数;2. 单负离子的氧化数等于其电荷数;3. 单正离子的氧化数等于其电荷数;4. 在化合物中,非金属元素的氧化数通常为负值,金属元素的氧化数通常为正值。
七、气体状态方程及气体状态方程计算公式气体状态方程是描述气体性质与温度、压力、体积和物质的量之间关系的公式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学精选化学公式(通用版)
一、化平衡学
化学反应亲和势:A =-r m B B B
G γμ∆∑=-
化学反应等温式:r m r m a G G RT ln Q Φ∆∆=+
平衡常数的表达式:()B B g h
G H
f
p
d e D E
p p K K p p p γΦ
ΦΦ∑-== ()B B p p K K p γΦΦ∑-= ()
B
B
f p K K K p γγΦΦ
∑-
=
B
B
B
B
x p p p K K K p
p γγΦΦ∑∑⎛⎫ ⎪
⎝⎭
-
-
== ()B
B
B
B
c p p RT K K K RT p γγΦΦ∑⎛⎫
∑ ⎪
⎝⎭
-
-== 温度,压力及惰性气体对化学平衡的影响:
r m 2
d ln K H dT RT Φ
Φ
∆= C
r m 2
d ln K U dT RT ΦΦ∆= B B
p C c RT K K p γΦ
ΦΦΦ
∑⎛⎫ ⎪⎝⎭
=
二、电解质溶液
法拉第定律:Q =nzF m =M zF
Q
dE
r U dl ++
= dE r U dl
--= t +=-
+
I I =-
+
+r r r +=
-
+U U U ++
=
∞
∞+
Λ
m
,m λ=
(
)
F
U U F U ∞
∞+∞+-+ r +为离子移动速率,U +( U -)为正(负)离子的电迁移率(亦称淌度)。
近似:+∞+≈,m ,m λλ +∞
+≈,m ,m U U m m Λ≈Λ∞
(浓度不太大的强电解质溶液)
离子迁移数:t B =I I B =Q Q B ∑B t =∑+t +∑-t =1 电导:G =1/R =I/U =kA/l 电导率:k =1/ρ 单位:S ·m -1
莫尔电导率:Λm =kV m =k/c
单位S ·m 2
·mol -1
cell l
R K A
ρ
ρ== cell 1K R kR ρ==
科尔劳乌施经验式:Λm =()c
1m β-∞Λ
离子独立移动定律:∞Λm =()m,m,+U U F λλ∞∞∞∞
+--
+=+ m U F λ∞∞+,+= 奥斯特瓦儿德稀释定律:Φc K =()
m
m m 2
m c c ΛΛΛΛ∞∞Φ-
平均质量摩尔浓度:±m =()v
1v
v m m -
-
++
平均活度系数:±γ=()v
1v
v -
-
+γγ+
平均活度:±
a =()1v v a a
--
++
=
m m γ±±
Φ
电解质B 的活度:a B =v a ±
=v
m m ⎪
⎭
⎫
⎝⎛Φ±±γ
+v v v B +a a a a ±--== m +=v +m B m -=v -m B ()
1
v v v
B m v v m +±+-
-=
离子强度:I =∑i
2i i z m 2
1
德拜-休克尔公式:lg ±γ=-A|z +z --|I
三、可逆电池的电动势及其应用
(Δr G )T,p =-W f,max (Δr G m )T,p =zEF
Nernst Equation :若电池反应为 cC +dD =gG +hH E =E
φ
-d
D
c C h
H g G a a a a ln zF RT
标准电动势E φ
与平衡常数K φ
的关系:E φ
=φlnK zF
RT
还原电极电势的计算公式:ϕ=氧化态
还原态-a a ln
zF
RT φϕ
计算电池反应的有关热力学函数变化值:m r S ∆=p
T E zF ⎪⎭⎫
⎝⎛∂∂
m r H ∆=-zEF +p T E zFT ⎪⎭⎫ ⎝⎛∂∂ Q R =T m r S ∆=p
T E zFT ⎪⎭⎫ ⎝⎛∂∂
zF ⎪⎪⎭
⎫ ⎝⎛∆⎪⎪⎭⎫
⎝⎛21m r 1122T 1T 1H T E T E -=- zF ⎰⎪⎭⎫ ⎝⎛T2E2E 11T E d =dT T H 21T T 2m r ⎰∆ 电极书面表示所采用的规则:负极写在左方,进行氧化反应(是阳极),正极写在右方,进行还原反应(是阴极) 电动势测定的应用:
(1) 求热力学函数变量Δr G m 、Δr G m Φ
、m r H ∆、m r S ∆及电池的可逆热效应Q R 等。
(2) 求氧化还原反应的热力学平衡常数K Φ值:K
Φ
=⎪⎪⎭
⎫
⎝⎛ΦRT F zE exp E Φ
=Φ
Φ左右-ϕϕ E =反应物
生成物-a a ln
zF
RT lnK zF RT Φ
(3) 求难溶盐的溶度积K sp 、水的离子积K w 及弱酸弱碱的电离常数等。
(4) 求电解质溶液的平均活度系数±γ和电极的Φϕ值。
(5) 从液接电势求离子的迁移数。
Pt,H 2(p)|HCl(m)|HCl(m ’)| H 2(p),Pt
1-1价型:E j =()()'
m m ln F
RT 1t 2'
m m ln F
RT t t -=-+-+ E =E c +E j =
m'
m
ln F RT t 2+ 高价型:M z+A z -(m 1)|M z +A z -
(m 2) E j =21
m m ln F RT z t z t ⎪⎪⎭⎫
⎝⎛+
+---
(6) 利用醌氢醌电极或玻璃电极测定溶液的pH
四、热力学第一定律
功:δW =δW e +δW f
(1) 膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2) 非膨胀功δW f =xdy
非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT
(1) 等压热容:C p =δQ p /dT = (∂H/∂T )p (2) 等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t
=3R/2 常温下双原子分子:C v ,m =C v ,m t
+C v ,m r
=5R/2 等压热容与等容热容之差:
(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ
=常数 TV
γ-1
=常数 p
1-γT γ
=常数 γ=C p / C v
理想气体绝热功:W =C v (T 1—T 2)=1
1
-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1
nR
-δ(T 1—T 2) 热机效率:η=
2
1
2T T T - 冷冻系数:β=-Q 1/W
可逆制冷机冷冻系数:β=1
21T T T -
焦汤系数: μJ -T =H p T ⎪⎪⎭⎫
⎝⎛∂∂=-
()p T C p H ∂∂
实际气体的ΔH 和ΔU :
ΔU =dT T U V ⎪
⎭⎫
⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫
⎝⎛∂∂+dp p H T
⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B
B γRT
化学反应热效应与温度的关系:
()()()dT B C T H T H 21
T T m p B
1m r 2m r ⎰
∑∆∆,+=γ
五、热力学第二定律
Clausius 不等式:0T
Q S B A
B A ≥∆∑→δ—。
