全国艾滋病检测技术规范(2015年修订版)
全国艾滋病检测技术规范2015版

3. 尿液样品,使用专用采尿管,室温下可保存2周,一年之内存放宜
在2~8℃。长期保存(一年以上)的样本冻存条件、是否添加防腐 剂等以产品说明书为准。
4. 筛查阳性样品应及时进行补充试验,筛查阴性样品,可根据具体需
要决定保存时间,建议至少保存1个月。特殊用途或专项项目的样 品根据具体要求确定保存时间。补充试验阳性样品按照国家生物样 品管理的有关规定执行。
、 保藏机构的上级主管部门对主要负责人、直接负责的主
管人员和其他直接责任人员,依法给予撤职、开除的处分
构成犯罪的,依法追究刑事责任。 ;
13
样本的采集和处理
1. 样品种类由唾液变为口腔粘膜渗出液,专门介绍了口腔黏膜 渗出液和尿液样本; 2. 筛查阴性样品由建议保存1-2月变为建议至少保存1个月; 3. 确证样本由至少保存10年,变为按照国家生物样品管理的相 关规定执行。
全国艾滋病检测 技术规范2015版
内容
1 2
抗体筛查方法及策略
确证检测方法及策略 确证结果判读及报告
3
一
HIV筛查方法及策略
1
样本的采集和处理
2 3
实验室检测方法
HIV抗体筛查策略
样本的采集和处理
2009版 2015版
全血、血清、血浆、唾 液、尿液以及DBS样品 可用于HIV抗体检测。
全血、血清、血浆、口 腔黏膜渗出液、尿液以 及干血斑样品可用于 HIV抗体检测。
员和其他直接责任人员,依法给予撤职、开除的处分;构
成犯罪的,依法追究刑事责任。
12
• 第六十七 条发生病原微生物被盗、被抢、丢失、泄漏, 承运单位、护送人、保藏机构和实验室的设立单位未依照 本条例的规定报告的,由所在地的县级人民政府卫生主管 部门或者兽医主管部门给予警告;造成传染病传播、流行
全国艾滋病检测技术规范

肖瑶
性艾中心参比实验室 xiaoyao@
章节
1. 样品采集和处理 2. HIV抗体检测 3. HIV-1新发感染检测 4. HIV-1抗原检测 5. HIV 核酸检测 6. 艾滋病病毒感染实验室检测策略 7. HIV-1基因型耐药检测 8. CD4+和CD8+T淋巴细胞检测 9. HIV-1的分离培养 10. 附表1-7
不区分抗原抗体的检测试剂
有反应 抗体检测*
无反应
均有反应 一有反应,一无反应
均无反应
补充试验
HIV-1核酸试验 或P24抗原试验 或2-4周后随访
报告HIV抗体阴性 P24抗原阴性
图3 使用不区分抗原抗体联合检测试剂的筛查检测流程
*抗体检测:双份或双孔检测
区分抗原抗体检测试剂
抗体有反应 抗原有反应
HIV核酸定性与定量、基因型检测和HIV-1分离培养。
尿液和口腔黏膜渗出液
尿液:推荐使用专用采尿管,保持尿液稳定。尿液样品可采集随机 尿,女性经期应取中段尿。 口腔黏膜渗出液:使用试剂盒提供的容器收集样品。存放时间和是 否冻存以试剂盒说明书为准。口腔黏膜渗出液应采集口腔渗出液,不 是唾液。
样品的采集和处理
(7)取消实验室生物安全和艾滋病检测实验室质量管 理两个章节。 附表的检测报告仅供使用实验室参考
样品的采集和处理
样品种类及相应的用途 全血、血清、血浆、唾液、尿液以及干血斑样品可用于HIV抗体
检测。 血、血清、血浆可用于HIV抗原检测。 抗凝全血可用于CD4+和CD8+T淋巴细胞测定。 血浆、DBS 可用于HIV-1病毒载量、基因型、耐药检测 淋巴细胞富集液、外周血单核淋巴细胞(PBMC)及全血可用于
全国艾滋病检测技术规范

全国艾滋病检测技术规范艾滋病是一种由人类免疫缺陷病毒(H I V)引起的病毒性感染,对个人和社会都具有极大的危害。
为了有效预防、控制艾滋病传播,提高艾滋病检测技术水平,本文档旨在提供全国艾滋病检测技术规范的主要内容,以便各地开展规范的艾滋病检测工作。
本规范旨在明确艾滋病检测技术的要求、方法和结果判断原则,提高检测质量,为防治艾滋病的科学决策提供技术支持。
本规范适用于全国各级医疗卫生机构、疾病预防控制中心、血液中心等开展艾滋病检测的相关单位。
检测前要求:开展艾滋病检测的单位应具备相应的资质和条件,包括合格的人员、设备、实验室设施等。
检测人员需经过专业培训,掌握艾滋病检测技术和相关政策法规。
检测中要求:艾滋病检测应遵循科学、规范的原则,使用经国家认证的试剂和仪器。
检测过程中应建立严格的质控体系,确保检测结果的准确性和可靠性。
同时,要保护受检者的隐私权和知情权。
检测后要求:检测结束后,应将检测结果及时告知受检者,并为其提供相应的咨询和转介服务。
同时,按照国家相关规定,定期向上级主管部门报送艾滋病疫情信息。
血清学检测:常用方法包括H I V抗体筛查试验和确认试验。
抗体筛查试验包括E L I S A、化学发光或免疫荧光等方法;确认试验常用免疫印迹法。
病毒载量检测:用于监测H I V病毒在体内的复制情况,常用方法有逆转录-聚合酶链反应(RT-PCR)和核酸序列依赖性扩增(NASBA)等。
细胞学检测:通过观察淋巴细胞亚群和细胞因子水平,评估患者的免疫状态。
常用方法包括流式细胞术、免疫细胞化学染色等。
病理学检测:通过活检或尸检观察艾滋病患者的组织病理学变化,对疾病诊断、病情监测和预后评估具有重要意义。
血清学检测:H I V抗体筛查试验阳性,需进行确认试验。
确认试验阳性者即可判定为H I V感染。
病毒载量检测:病毒载量高于正常范围即可判定为H I V感染。
细胞学检测:根据淋巴细胞亚群和细胞因子水平,评估患者的免疫状态。
艾滋病检测技术规范(2015版)勘误表
全国艾滋病检测技术规范(2015年修订版)勘误表
1. 第4页,4.3.5中,“时间不超过24小时”改为“时间不超过48小时”。
2. 第16页,5.4.1.1中,第二行“下表”改为“试剂盒规定的”。
3. 第29页,5.2.
4.2中,第二行“报告检测值,”改为“报告检测值;”。
4. 第30页,
5.3.1.6中,第二行“RNA1033CPs/ml”改为“RNA103CPs/ml”。
5. 第31页,
6.3中,第五行“150003CPs/ml”改为“15000CPs/ml”。
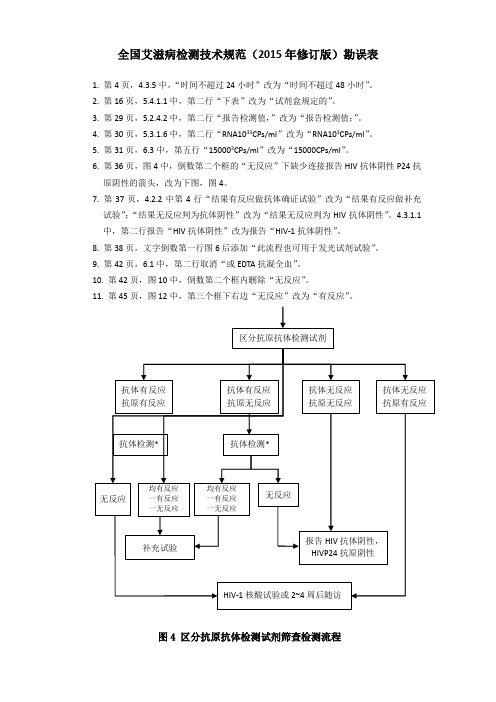
6. 第36页,图4中,倒数第二个框的“无反应”下缺少连接报告HIV抗体阴性P24抗
原阴性的箭头,改为下图,图4。
7. 第37页,4.2.2中第4行“结果有反应做抗体确证试验”改为“结果有反应做补充
试验”;“结果无反应判为抗体阴性”改为“结果无反应判为HIV抗体阴性”。
4.3.1.1中,第二行报告“HIV抗体阴性”改为报告“HIV-1抗体阴性”。
8. 第38页,文字倒数第一行图6后添加“此流程也可用于发光试剂试验”。
9. 第42页,6.1中,第二行取消“或EDTA抗凝全血”。
10. 第42页,图10中,倒数第二个框内删除“无反应”。
11. 第45页,图12中,第三个框下右边“无反应”改为“有反应”。
全国艾滋病检测技术规范解读

2014年美国CDC推荐HIV检测新策略
HIV-1 抗原 抗体联合检 测试剂
第二章 HIV抗体检测
HIV抗体检测目的: 1.“诊断”目的是为了确定个体HIV感染状况,包括
临床检测、自愿咨询检测、根据特殊需要进行的体检等。 2.“血液筛查”目的是为了防止输血传播HIV,包括
献血员筛查和原料血浆筛查。 3.“监测”目的是为了解不同人群HIV感染率及其变
化趋势,包括各类高危人群、重点人群和一般人群。
• When is a 3rd test needed in high prevalence
settings? No • 3rd test should have superior specificity; • Using 3rd test as a “tiebreaker” is NOT
recommended.
快速法抗体检测质控
X 1.试剂内对照--质控带。 X 2.室内质控品 X 采用商用质控品或自制,包含抗体阳性样
品和阴性样品。
X 下列情况需做:更换试剂厂家或批号;更 换检测人员;更换包装。除此之外,建议每个 检测日检测一次阳性和阴性质控品;如果日检 测量大于50份样品,至少应作2次质控。
HIV抗体筛查报告
2
+
+ ‐ HIV‐inconclusive
3
+
‐ Repeat Test with A1 & A2
‐
‐
艾滋病筛查实验室规范化建设和质量管理

1.目的
明确艾滋病病毒操作危害风险,避免发生生物安全事故。
2.使用范围
本操作规程适用于本实验室危害风险评估及事故处理。
3.职责
操作人员:按照相关危害风险评估及事故处理进行正确实验操作。
质量监督员:负责监督实验是否按危害风险评估及事故处理原则进行。
科室负责人:负责综合管理。
4.危害风险评估
按照《实验室生物安全通用要求》(GB 19489-2004),艾滋病病毒属于危害等级Ⅳ病原微生物, 艾滋病病毒主要通过血液传播、性接触传播、母婴传播三种途径传播,一般不通过气溶胶传播。根 据标本中艾滋病病毒含量和操作危险性评估本实验室危害风险。
工作记录
• 酶标仪使用和维护记录 每次使用均要填写。
员至少1名。负责筛查试验的技术人员需具有2年以上从事 病毒性疾病血清学检测工作经验,接受过省级或省级以上 艾滋病检测技术培训,并获得培训证书。
2.建筑条件 实验区域和办公区域分置,实验室或检测区域应分
为清洁区,半污染区和污染区,应符合二级生物安全实验 室(BSL-2)要求。 3.仪器设备条件
配备艾滋病抗体筛查试验所需设备,至少包括酶标 读数仪(或发光检测仪)、洗板机、加样器(仪)、普通 冰箱、低温冰箱、离心机、温箱或水浴箱、消毒与污物处 理设备、实验室恒温设备、安全防护用品和生物安全柜。
• 每台仪器设备设唯一编号,设仪器设备管理人员; • 必须经国家法定部门定期(每年至少1次)校准的仪器至少包括:酶
标仪/洗板机,加样器,温度计,高压灭菌器 。加样器、温湿度计须 经计量部门校准; • 其他仪器,如生物安全柜,离心机等也必须定期(每年1次)校准, 可请生产厂家校准; • 酶标仪与洗板机定期维护、清洗; • 离心机,生物安全柜,高压灭菌器等,每次使用前检查仪器是否处于 正常运转状态,并做好记录,发现故障必须立即停用并及时维修或更 换。 • 操作人员接受仪器设备操作技能培训,具备相应的合格证书或能力; • 每次使用仪器设备均记录使用情况和仪器状态。
全国艾滋病检测技术规范

全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2004年版)中国疾病预防控制中心二○○四年八月前言为贯彻和落实《中国预防与控制艾滋病中长期规划(1998—2010年)》和《中国遏制与防治艾滋病行动计划(2001—2005年)》,加强全国艾滋病检测工作的规范化管理和质量控制,确保检测的准确性和可靠性,保证艾滋病检测实验室安全,及时有效地发现艾滋病病毒(HIV)感染者和上报疫情,在对1997年卫生部颁发的“全国艾滋病检测工作规范”修订的基础上,经卫生部同意于2003年5月由中国疾病预防控制中心颁发了《全国艾滋病检测技术规范(试行)》(下称《规范(试行)》)。
在《规范(试行)》使用期间,卫生部和财政部共同制定了《艾滋病免费自愿咨询检测管理办法(试行)》、《艾滋病及常见机会性感染免、减费药物治疗管理办法(试行)》,卫生部与中医药管理局共同制定了《关于艾滋病抗病毒治疗管理工作的意见》,另外国家还颁布了《实验室生物安全通用要求(GB 18489-2004)》和《医务人员艾滋病病毒职业暴露防护工作指导原则(试行)》等重要政策法规。
根据我国艾滋病流行形势以及防治工作对实验室检测技术和策略的需求,一年来,在广泛听取各有关管理部门和使用单位意见的同时,中国疾病预防控制中心多次组织全国艾滋病检测实验室审评和技术指导专家组、顾问组及艾滋病专家咨询委员会检测组成员,对《规范(试行)》内容多次进行修改、补充和审定,于2004年8月完成了《全国艾滋病检测技术规范》(下称《规范》)正式版本的最终审定。
为了有效配合艾滋病自愿咨询检测(VCT)和抗病毒治疗工作,本次对《规范(试行)》进行了重要修改和增补,包括:(1)对原有章节(样品的采集和处理,HIV抗体、抗原检测,HIV核酸定性检测,艾滋病检测实验室安全防护,实验室质量管理与考评,诊断试剂临床质量评估)的修改,使其更加符合目前艾滋病防治工作的需求,更加具有可操作性;(2)新增有关内容,包括艾滋病的VCT策略,婴幼儿HIV感染诊断和 CD4+/CD8+ T淋巴细胞检测,HIV RNA定量测定(病毒载量测定),并根据新颁布的文件、法规进一步明确了实验室的生物安全和职业暴露预防。
最新全国艾滋病检测技术规范解读

HIV-1核 酸检测 试剂
HIV高流行地区诊断HIV感染血清学检测策略
WHO HIV 诊断指南
2015 • Prevalence (national or subnational)
• ≥5% in the population to be tested.
• Test reagent
补充试验:
通过检测样本中是否存在艾滋病病毒抗体、抗原或者核 酸而确定艾滋病病毒感染的检测方法。
包括抗体确证试验(免疫印迹试验,条带/线性免疫试验, 特定条件下的替代检测)和核酸试验(核酸定性和定量试验)
替代检测:三种酶联免疫试验、三种快速试验或酶联免 疫加快速试验
特定条件:高流行地区(流行率大于5%)、高危人群 (如男男同性恋,吸毒人群)、三种试剂均经过使用地区中 心实验室评价。
• When is a 3rd test needed in high prevalence
settings? No • 3rd test should have superior specificity; • Using 3rd test as a “tiebreaker” is NOT
recommended.
HIV低流行地区诊断HIV感染血清学检测策略
WHO HIV 诊断指南 • 2P0re1v5alence
• < 5% in the population to be tested.
• Test reagent
• A1: RDTs, EIAs • A2: RDTs, EIAs or NAT • A3: EIAs, WB or NAT
HIV抗体筛查试验报告使用附表1(HIV抗体筛查检测 报告)。筛查试验无反应报告为“HIV抗体阴性”;有反 应必须进行复检,复检两次检测均无反应报告为“HIV抗 体阴性”,复检检测均有反应或一个有反应一个无反应 需进行“补充试验”;报告为“HIV感染待确定”,不能 出具阳性报告。
全国艾滋病检测技术规范(修订版)之欧阳文创编

附件1全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2015年修订版)中国疾病预防控制中心二○一五年十二月全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2015年修订版)中国疾病预防控制中心二○一五年十二月前言艾滋病在我国的流行已数十年,随着感染者和临床病人的不断增加、感染人群的变化,艾滋病检测工作量逐渐加大,对监测和检测的需求也不断增加,承担艾滋病检测的实验室已遍及全国各级医疗、疾病预防控制、采供血、妇幼保健机构,出入境检验检疫、军队等各个系统。
为了尽早发现HIV感染者和艾滋病病人,及早提供咨询、治疗,同时为适应基层艾滋病检测工作需求,在新的形势下,根据《关于艾滋病抗病毒治疗管理工作的意见》、《中国预防与控制艾滋病中长期规划(1998—2010年)》、《中国遏制与防治艾滋病十二五行动计划的通知(国办发[2012]4号)》、“四免一关怀”等国家艾滋病防治重要方针政策和十三五防治工作重点,在广泛征求各省、市疾病预防控制机构和医疗机构意见的基础上,在中华人民共和国卫生和计划生育委员会艾滋病专家及省级专家的参与下,中国疾病预防控制中心性病艾滋病预防控制中心对《全国艾滋病检测技术规范(2009年版)》进行修改、增补和完善,制定出《全国艾滋病检测技术规范(2015年版)》(以下简称《规范》),使其既能满足目前艾滋病检测工作的实际需求,又能体现检测技术的发展。
本次《规范》修订工作立足于我国目前检测状况,结合发达国家使用的指南,主要对以下几个方面内容进行了修改、增补和完善:(1)完善了不同的检测策略,并将其整合为独立的一章;(2)增加了HIV-1新发感染检测一章;(3)新增补充试验概念,其内容包括抗体确证试验(WB,RIBA/LIA等)和核酸试验(定性和定量试验);(4)增加了第4代试剂(抗原抗体联合检测试剂)的检测流程;(5)增加核酸检测流程;(6)完善了检测报告。
全国艾滋病检测技术规范2015版

显现条带 没有病毒的特异性条带 只检测出p17抗体,没有其它条带 检测出2条ENV(gp160/gp41和gp120)及 GAG(p17、p24、p55)或POL(p31、p51、 p66)
分析结果 阴性
阴性
HIV-1阳性
检测出2条ENV(gp160/gp41和gp120)及 HIV-1阳性且提示 GAG(p17、p24、p55)或POL(p31、p51、 HIV-2阳性感染 p66)且HIV-2特异性条带清晰可见。 出现任何特异性条带,但不足以被判为阳性 出现任何特异性条带,但不足于被判为阳性, 且HIV-2特异性条带清晰可见 不确定 不确定 但提示HIV-2阳性 感染
送检样品 姓名 国籍 身份证 现住址 户籍地址
检测方法
ELISA□ PA□ 其它实验:______
化学发光□ RT□
检测日期 试剂厂家 批号 有效日期 检测结果 筛查结论 检测者 检测单位(公章): HIV感染待确定□
有反应□ 无反应□ HIV抗体 阴性□
有反应□ 无反应□
有反应□ 无反应□
审核 者 备注:
澳大利亚国家参比实验室(NRL) 一条ENV带和任何三个GAG和POL 1987 带 德国病毒疾控协会(DVV) DIN 58969,第41部分 一条ENV带和至少一条GAG和POL 带
结果判读
我们(MP)推荐使用下列标准对MPD HIV BLOT 2.2检测结果进行分析。对显现的每条条带 均应记录,并将结果分析为阴性、阳性或不确 定。
4. 《可感染人类的高致病性病原微生物菌(毒)种或样本运输
管理规定》(卫生部第45号令,2006年2月1日执行)
筛查方法
1. 酶联免疫吸附试验(ELISA) 这类试验可使用血液(包含血清、血浆和滤纸干血斑)、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全国艾滋病检测技术规范(2015年修订版)附件1全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2015年修订版)中国疾病预防控制中心二○一五年十二月全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2015年修订版)中国疾病预防控制中心二○一五年十二月I前言艾滋病在我国的流行已数十年,随着感染者和临床病人的不断增加、感染人群的变化,艾滋病检测工作量逐渐加大,对监测和检测的需求也不断增加,承担艾滋病检测的实验室已遍及全国各级医疗、疾病预防控制、采供血、妇幼保健机构,出入境检验检疫、军队等各个系统。
为了尽早发现HIV感染者和艾滋病病人,及早提供咨询、治疗,同时为适应基层艾滋病检测工作需求,在新的形势下,根据《关于艾滋病抗病毒治疗管理工作的意见》、《中国预防与控制艾滋病中长期规划(1998—2010年)》、《中国遏制与防治艾滋病十二五行动计划的通知(国办发[2012]4号)》、“四免一关怀”等国家艾滋病防治重要方针政策和十三五防治工作重点,在广泛征求各省、市疾病预防控制机构和医疗机构意见的基础上,在中华人民共和国卫生和计划生育委员会艾滋病专家及省级专家的参与下,中国疾病预防控制中心性病艾滋病预防控制中心对《全国艾滋病检测技术规范(2009年版)》进行修改、增补和完善,制定出《全国艾滋病检测技术规范(2015年版)》(以下简称《规范》),使其既能满足目前艾滋病检测工作的实际需求,又能体现检测技术的发展。
本次《规范》修订工作立足于我国目前检测状况,结合发达国家使用的指南,主要对以下几个方面内容进行了修改、增补和完善:(1)完善了不同的检测策略,并将其整合为独立的一章;(2)增加了HIV-1新II发感染检测一章;(3)新增补充试验概念,其内容包括抗体确证试验(WB,RIBA/LIA等)和核酸试验(定性和定量试验);(4)增加了第4代试剂(抗原抗体联合检测试剂)的检测流程;(5)增加核酸检测流程;(6)完善了检测报告。
将抗体筛查和复检报告整合为HIV 抗体筛查检测报告,增加HIV-1核酸检测报告和婴儿艾滋病感染早期诊断检测报告,取消了流行病检测HIV抗体检测报告单、艾滋病病毒抗体检测数和阳性人数统计报表、艾滋病职业暴露个案登记表和艾滋病防治工作人员职业暴露事故汇总表;(7)取消实验室生物安全一章和艾滋病检测实验室质量管理一章。
所有附表的检测报告仅供使用实验室参考。
本《规范》由中国疾病预防控制中心批准,下发至全国艾滋病检测实验室及有关单位。
本《规范》将为国家、相关部委下发的艾滋病防治工作各项政策法规的有效实施提供强有力的技术支持,并具体指导艾滋病实验室技术人员开展日常工作。
本《规范》起草单位:中国疾病预防控制中心性病艾滋病预防控制中心。
本《规范》参加编写单位:中国人民解放军军事医学科学院、上海市疾病预防控制中心、中国医科大学、北京出入境检验检疫局、云南省疾病预防控制中心、四川省疾病预防控制中心、浙江省疾病预防控制中心、河南省疾病预防控制中心、北京市红十字血液中心、卫生部临床检验中心、江苏省疾病预防控制中心、陕西省疾病预防控制中心、安徽省疾病预防控制中心、首都医科大学附属北京佑安医院、北京市疾病预防III控制中心。
本《规范》编写组人员:蒋岩、汪宁、李敬云、钟平、尚红、邵一鸣、肖瑶、朱红、邢文革、姚均、潘品良、邱茂锋、马艳玲、梁姝、郭志宏、王哲、葛红卫、王盈、李金明、徐晓琴、常文辉、吴建军、张福杰、吴昊、苏雪丽、廖玲洁。
本《规范》参加编写主要国际机构:世界卫生组织(Po-lin CHAN、张岚)。
美国疾病预防控制中心GAP项目(Colin Shepard、郝玲、齐明山)。
本《规范》编写工作联系人:肖瑶。
本《规范》自发布之日起实施,同时终止《全国艾滋病检测技术规范(2009年版)》。
本《规范》适用于全国艾滋病检测实验室。
本《规范》解释权属于中国疾病预防控制中心。
致谢:感谢盖茨基金会在规范修订过程中给予技术和人力等方面的支持。
IV全国艾滋病检测技术规范目录第一章样品的采集和处理.......................................................................................... 6 1 范围............................................................................................................... ................ 6 2 规范性文件引用.. (6)3 样品种类及相应的用途............................................................................................... 7 4 操作步骤............................................................................................................... .. (7)4.1 采样前准备 (7)4.2 样品的采集和处理 (8)4.3 样品的保存 (10)4.4 样品的运送 (11)4.5 样品的接收 (12)第二章HIV抗体检测.............................................................................................. 13 1 范围............................................................................................................... .............. 13 2 规范性文件引用 (13)3 HIV抗体检测实验室要求.......................................................................................... 13 4 HIV 抗体检测的目的和要点.. (14)4.1 HIV抗体检测的目的 (14)4.2 HIV抗体检测的要点.......................................................................................... 14 5 常规HIV抗体检测方法 (15)5.1 试剂和样品 (15)5.2 方法................................................................................................................. ...... 15 6 结果报告............................................................................................................... (17)6.1 筛查报告.............................................................................................................176.2 WB及RIBA/LIA报告......................................................................................... 18 7 质量控制............................................................................................................... (18)7.1 酶免或发光法抗体检测的室内质量控制 (18)7.2 快速法抗体检测质控 (22)第三章HIV-1新发感染检测................................................................................... 24 1 范围............................................................................................................... ............... 24 2 规范性文件引用. (24)3 新发感染检测实验室要求.......................................................................................... 24 4 目的............................................................................................................... (24)1全国艾滋病检测技术规范5 新发感染检测方法 (25)5.1 方法学原理 (25)5.2 方法................................................................................................................. . (25)5.3 样品的入选标准和排除标准 (26)5.4 结果处理和解释 (27)5.5 数据分析.............................................................................................................286质量控制............................................................................................................... .. (30)6.1 人员培训.............................................................................................................306.2 样品质控.............................................................................................................306.3 试剂质控.............................................................................................................316.4 实验过程质控 (31)第四章HIV-1抗原检测............................................................................................ 32 1 范围............................................................................................................... .............. 32 2 规范性文件引用 (32)3 HIV-1P24抗原检测的意义...................................................................................... 32 4 实验室要求............................................................................................................... .. 32 5 检测方法及程序 (33)5.1 试剂................................................................................................................. . (33)5.2 样品................................................................................................................. . (33)5.3 定性检测.............................................................................................................335.4 定量检测.............................................................................................................355.5 结果报告和解释................................................................................................. 35 6 质量控制............................................................................................................... (36)6.1 定性检测.............................................................................................................366.2 定量检测.............................................................................................................37第五章HIV核酸检测.............................................................................................. 38 1 范围............................................................................................................... .............. 38 2 规范性文件引用 (38)3 核酸检测的意义 (39)3.1 HIV-1感染诊断 (39)3.2 治疗效果监测 (40)3.3 病程监控及预测 (40)3.4 耐药性监测......................................................................................................... 40 4 HIV核酸检测实验室要2全国艾滋病检测技术规范4.1 实验室的设计及工作基本原则 (41)4.2 实验室人员和要求 (41)4.3 实验室生物安全................................................................................................. 41 5 HIV-1核酸检测方法及程序.. (41)5.1 HIV-1核酸定性检测 (41)5.2 HIV核酸定量检测 (43)5.3 集合核酸定性检测 (45)5.4 HIV核酸即时检测............................................................................................ 47 6 质量保证和质量控制. (47)6.1 实验室分区和环6.2 仪器设备质量控制 (48)6.3 检测过程质量控制 (48)6.4 外部质量控制 (48)第六章艾滋病病毒感染实验室检测策略................................................................. 49 1 范围............................................................................................................... .............. 49 2 规范性文件引用 (49)3 疫情监测相关的检测策略及结果报告 (49)3.1 HIV匿名无关联检测流程 (49)3.2 HIV匿名关联检测流程...................................................................................... 50 4 临床诊断相关的检测策略及结果报告 (50)4.1 使用抗体检测试剂的检测流程 (50)4.2 使用抗原抗体检测试剂的检测流程 (51)4.3 补充试验检测策略............................................................................................. 53 5 血液筛查相关的检测策略及结果报告..................................................................... 58 6 婴儿HIV-1感染早期诊断相关的检测策略及结果报告.. (61)6.1 核酸检测策略(RNA/DNA) (61)6.2 抗体检测策略及结果报告 (63)第七章HIV-1基因型耐药检测............................................................................... 65 1 范围............................................................................................................... .............. 65 2 规范性文件引用 (65)3 HIV-1基因型耐药检测的意义 (66)3.1 群体耐药监测 (66)3.2 个体耐药检测..................................................................................................... 66 4HIV-1基因型耐药检测实验室要求 (67)3全国艾滋病检测技术规范4.1 实验室功能分区 (67)4.2 实验室人员和要求 (67)4.3 设施和设备......................................................................................................... 68 5 HIV-1基因型耐药检测方法及程序 (68)5.1 样品................................................................................................................. . (68)5.2 检测原理.............................................................................................................685.3 检测方法.............................................................................................................685.4 耐药分析.............................................................................................................69 6 质量保证与质量控制 (70)6.1 室内质控.............................................................................................................706.2 外部质控.............................................................................................................71第八章CD4+和CD8+T淋巴细胞检测....................................................................... 72 1 范围............................................................................................................... ............... 72 2 规范性文件引用. (72)3 CD4+ 和CD8+T淋巴细胞检测的意义 (73)3.1 HIV感染临床分期 (73)3.2 HIV感染儿童免疫抑制分级和治疗辅助指标 (73)3.3 疾病进展监测 (73)3.4 机会性感染的风险评估 (73)3.5 抗病毒治疗适应症选择及疗效评价 (73)3.6 CD8+T淋巴细胞为抑制性/细胞毒性T细胞.................................................... 74 4 CD4+ 和CD8+T淋巴细胞检测实验室要求 (74)4.1 人员................................................................................................................. . (74)4.2 功能分区.............................................................................................................744.3 设施和设备......................................................................................................... 74 5 常规CD4+ 和CD8+T淋巴细胞检测的方法和程序.. (75)5.1 样品采集、运输和接收 (75)5.2 方法................................................................................................................. . (76)5.3 试剂................................................................................................................. . (78)5.4 实验资料的记录 (78)5.5 结果报告.............................................................................................................78 6 质量控制............................................................................................................... (79)第九章HIV-1的分离培养....................................................................................... 81 1 范围............................................................................................................... .. (81)4全国艾滋病检测技术规范2 规范性文件引用 (81)3 HIV-1分离的意义 (81)3.1 HIV抗体不确定或HIV-1阳性母亲所生婴儿的鉴别诊断及诊断 (81)3.2 HIV表型耐药检测及其他HIV生物学特征的研究。
