2019高中化学知识结构网络图ppt
化学必修1化学方程式总结网络图

高中化学必修一方程式总结——网络图一、钠及其化合物的转化关系1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、二、铝及其化合物的转化关系1、2、3、4、5、6、7、8、9、10、11、12、三、铁及其化合物的转化关系1、2、3、4、5、6、7、8、9、10、11、12、13、14、四、硅及其化合物的转化关系1、2、3、4、5、6、7、8、9、五、氯及其化合物的转化关系1、2、3、4、5、6、7、8、9、10、六、硫及其化合物的转化关系1、2、3、4、5、6、7、8、9、10、七、氮及其化合物的转化关系1、2、3、4、5、6、7、8、9、1、钠及其化合物的转化关系O AO Fe(①N 2+O 22N O ▲②2N O +O 2=2N O 2▲③3N O 2+H 2O =2H N O 3+N O 3N O 2+H 2O =2H ++2N O 3-+N O 以上三个反应为“雷雨发庄稼”原理(下面两个反应主要用于气体溶于水时的计算)扩展反应有:▲4N O 2+O 2+2H 2O =4H N O 3▲4N O +3O 2+2H 2O =4H N O 3▲④C u +4H N O 3(浓)=C u(N O 3)2+2N O 2↑+2H 2O C u +4H ++2N O 3-=C u 2++2N O 2↑+2H 2O 或4H N O 34N O 2↑+O 2↑+2H 2OC +4H N O 3(浓)△C O 2↑+2N O 2↑+2H 2O 浓硝酸见光易变黄的原因▲⑤3C u +8H N O 3(稀)=3C u(N O 3)2+2N O ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2N H 33C u +8H ++2N O 3-=3C u 2++2N O ↑+4H 2O 合成氨反应是人工固氮的主要途径⑦N H 3+H C l=N H 4C l ⑧N H 4C l△N H 3↑+H C l ↑N H 3+H +=N H 4+(水溶液中)补充:N H 4H C O 3△N H 3↑+H 2O +C O 2↑氨气与酸均能反应生成铵盐,且与挥发性酸铵盐受热都易分解,但并不是所有的铵盐(如浓H C l 、浓H N O 3)相遇时空气中有白烟都分解出氨气,如N H 4N O 3、(N H 4)2SO 4▲⑧N H 4C l +N aO H△N aC l +N H 3↑+H 2ON H 4++O H-△N H 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
2019高中化学知识结构网络图ppt PPT 课件

在滤液中通足量CO2,再过滤,在滤渣[Al(OH)3]中加盐酸使其溶解。此外还有电解法精炼铜;离子
交换法软化硬水等。
• 多数物质的分离提纯采用物理—业知识
合成氨
石油化工
氯碱工业
硫酸的工业制法
常听见这样的感叹:要是当初2018年 中国大 学毕业 生薪酬 排行榜 通过对 280多 万以及 多届毕 业生调 研后, 计算出 了各高 校毕业 生的薪 酬状况 。 虽然我们都知道名校毕业生的收入会普 遍比较 高,但 这份榜 单告诉 我们, 清华北 大毕业 生的月 薪,平 均近万 ,而普 通院校 的只有 两三千 。
• 化学法要同时考虑到各组成成分及杂质的化学性 质和特点,利用它们之间的差别加以分离提纯。 一般原则是:①引入试剂一般只跟杂质反应;② 后续试剂应能除去过量的前一试剂;③不引进新 杂质;④杂质与试剂生成的物质易与被提纯物分 离(状态类型不同);⑤过程简单,现象明显,纯 度要高;⑥尽可能将杂质转化为所需物质;⑦除 去多种杂质时应考虑加入试剂的合理顺序;⑧如 遇到极易溶解于水的气体时,应防止倒吸现象发 生。在进行化学分离提纯时,进行完必要的化学 处理后,要适时实施某些物理法操作(如过滤、分 液等)。
•
(3)沉淀法:将杂质转变为沉淀除去的方法。如除去CO2中的H2S气体,可将混合气体通入到
CuSO4溶液中,除去H2S气体。
•
(4)汽化法:将杂质转变为气体使之除去的方法。如除去NaCl固体中的Na2CO3固体,可加入
HCl将其中的转变为CO2气体。
•
(5)酸、碱法:利用杂质和酸或碱的反应,将不溶物转变成可溶物;将气体杂质也可转入酸、
• (2)P2O5(酸性干燥剂):可干燥H2S、HBr、HI及浓硫酸能 干燥的气体(不可干燥NH3等)。
高中化学基础知识网络结构图(完整版)
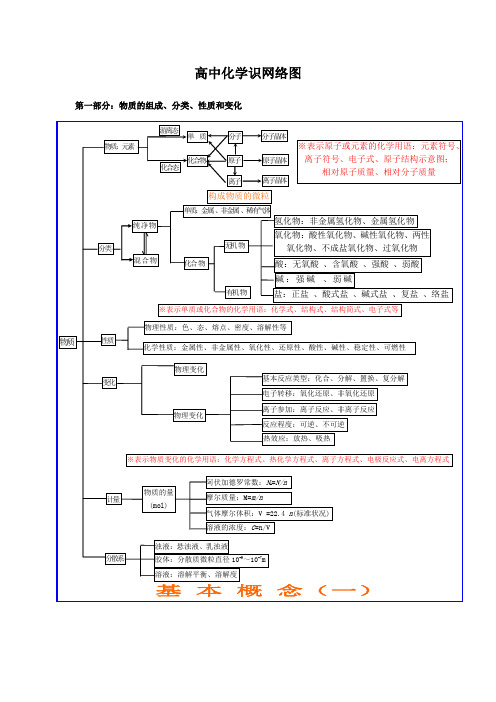
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系有机官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃 饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构) 二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
(完整)高中化学知识结构图
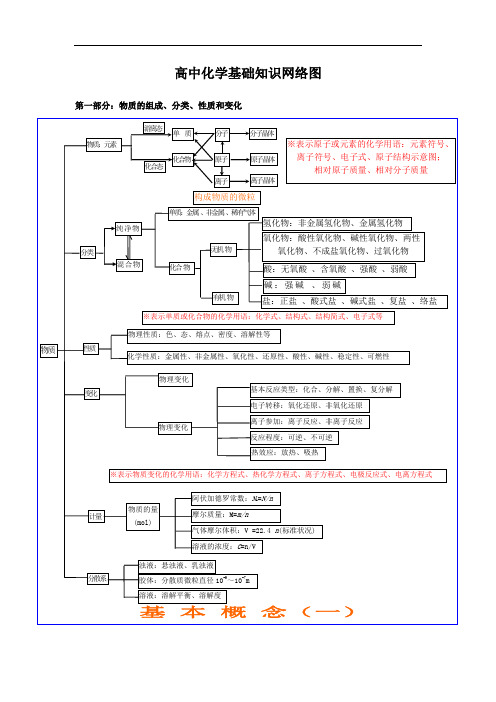
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
高中化学基础知识网络图完整版
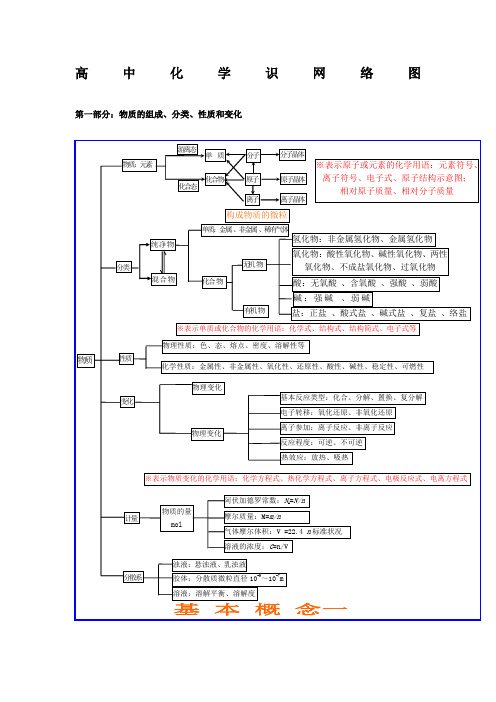
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论物质结构、化学反应速率、化学平衡、电解质溶液第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸官能团:—NH 2和—COOH高分子化合物链烃脂肪烃环烃饱和链烃 烷烃:C n H 2n+2n ≥1R —CH 3不饱和链烃 烯烃:C n H 2n n ≥2 R —CH=CH 2二烯烃:C n H 2n-2n ≥4R —CH=CH —CH=CH 2 炔烃:C n H 2n-2n ≥2 R —C ≡CH环烷烃C n H 2n n ≥3芳香烃苯和苯的同系物C n H 2n-6n ≥6天然高分子:橡胶聚异戊二烯、多糖、蛋白质R卤代烃官能团:—X :饱和一卤代烃C n H 2n+1Xn ≥1R —X 醇 官能团:—OH :饱和一元醇C n H 2n+1OHn ≥1R —OH 醚 C n H 2n+2O n ≥2R —O —R 酚苯酚官能团:—OHC n H 2n-6O n ≥2OH羧酸 官能团:—COOH :饱和一元羧酸 C n H 2n+1O 2 n ≥1R —COOH醛 官能团:—CHOC n H 2n O n ≥1R —CHO 酮 官能团:—CO —C n H 2n O n ≥3R —CO —R ’酯 官能团:—COO —R :饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 n ≥2R —COOR ’ 硝基化合物官能团—NO 2R —NO 2 胺官能团—NH 2R —NH 2单糖:葡萄糖、果糖C 6H 12O 6互为同分异构二糖:蔗糖、麦芽糖C 12H 22O 11互为同分异构 多糖:淀粉、纤维素C 6H 12O 6n n 值不同合成高分子合成塑料合成橡胶 合成纤维有机化合物。
第一章 原子结构与性质课件 高中化学人教版(2019)选择性必修二

向后
首页
尾页
结束
向前
第一章 原子结构与性质 第一节 原子结构
构造原理
原子核外电子排列
能级
能层
一
二
三
四
五
六
七
符号
K
L
M
N
O
P
Q
最多电子数
2
8
18
32
50
72
98
能层
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
6
2
6
10
2
6
10
14
…
2n2
能量增加
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
6
2
6
10
2
6
10
14
…
第一章 原子结构与性质 第一节 原子结构
Fe(26):
向后
首页
尾页
结束
向前
三 构造原理与电子排布
构造原理
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
高中化学基础知识网络图完整版

绝缘体(半导体) 不良 不良
不良 不良 不良
溶解性 典型实例
易溶于极性溶剂 NaCl,KBr
不溶于任何溶剂
相似相溶
单质:金刚石、SiC、 单质:H2、O2
Si、SiO2
化合物:冰、干冰
比较 装置
原电池
电解池
能量转换
化学能→电能
电能→化学能
(实质) (两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)
高中化学识网络图
第一部分:物质的组成、分类、性质和变化
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
比较
类型
构成晶体微粒
离子晶体 阴、阳离子
原子晶体 原子
分子晶体 分子
形成晶体作用力
离子键
共价键
德华力
熔沸点
较高
很高
低
硬度
硬而脆
大
小
物
导电性
不良
理
性 质
传热性
不良
延展性
不良
金属电极做阳极,电极本身被氧化
氧化
M-ne→Mn+
第三部分:元素化合物转化关系
第四部分:有机化学
还原
或 M n++ne→M(不活泼金属的盐溶液)
阳极——连接电源正极
e
e
电源负极→阴极
电源正极→阳极
还原
还原
阴极:2H++2e→H2↑或 M n++ne→M
氧化
惰性电极(石墨或铂)Rn--ne→R
(例 2Cl-—2e Cl2↑)
或 4OH-—4e H2O+O2↑
H2O+O2+4e→4OH-(中性、弱酸性 条件下的吸氧腐蚀)
高中化学2019版 必修一 第一章 第一节 物质的分类 PPT(共28张)

情景导入:
为图 什书 么馆 你里 很有 快许 就许 找多 到多 你的 需书 要籍 的, 书 ?
沃尔玛超市
超市里有成千上万种商品,为什么你能 够迅速挑出你所需要的东西?
分类是根据研究对象的共同点和差异点,将其区分为不同种类 和层次的科学方法。科学的分类能够反映事物的本质特征,有利于 深入研究。所以我们要求的是,分类一定要科学,这样才能进行有 效的研究,那么怎样才能保证分类的科学性?
• 三 • 夏• 天四 • •四五
• 冬天 • 七 • •六数学 • 七
•三 • 语文
••数液学体 • 英语• 物•理物理
• 秋天 • 化学 • 生物 •六
意义:能够 提高人们工 作,学习的 效率,使人 们更快,更 便捷地达到 目的等。
小结:
1、物质的简单分类方法 (1)树状分类法(2)交叉分类法
请同学们根据初中学习的化学知识, 尝试将化网 学物质进行分类,并且交流大家 的分类结果。
复习回顾
分类方法
初中学过有关物质类别的概念
混合物、纯净物、单质、化合物、金属单质、非金属单 质、酸、碱、盐、氧化物、酸性氧化物、碱性氧化物等。
是否由同种元素组成
纯净物
单质
物质
是否由同一种分子组成
混合物
根据组成特点和
•
2.俗话说“蛇不知道自己有毒,人不 知道自 己有错 ”,还 有一句 俗话说 “穷养 富养, 不如有 教养” ,无论 贫穷还 是富裕 ,孩子 有教养 ,即使 再平凡 的躯体 ,也能 因此增 色不少 。 在孩子成长过程中,家长的引导是十分 重要的 。
Cu H2SO4 Ba(O习中,同学们学习了很多的单质,其中有一些 单质是由同种元素形成的,例如:金刚石和石墨都是由碳元 素形成的。在化学上,我们将这样的单质命名为同素异形体。
(完整)高中化学知识结构图.doc
2n
物
物
及
云
素
响
个
2
合
个
个
实
周
物
金
期
理
质
律
性
质
表
元
元
元
核
晶
示
方
素
编素
归
素
外
体
决
制
类
结构简图
法
周
周纳
性
定
电
型
表
期
期
质
子
表
律
的
排
的
电子式
结
周
布
构
期
周
金
分
原
离
性
期
性
属
子
子
子
晶
晶
晶
晶
横:周期
元素种类
体
体
体
体
起止序号
n=1
2
短周期
1~2
n=2
8
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
期
子
等于 反 方程式的系数比
化
内因(主)
反 物的 构、性
学
化
影响因素
度
反
学
学
平
反
用
速
衡
率
温度
和
的 合
外因( )
化
成
催化
氨
其他条件
光、超声
适
化
于
波、激光、放射 ⋯
条
可逆反
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• • • • •
(1)加热分解法:如NaCl中混有少量NH4HCO3,加热使NH4HCO3分解。 (2)氧化还原法:利用氧化还原反应将杂质或氧化或还原,转化为易分离物质。如除去苯中的 少量甲苯,就可利用甲苯与酸性高锰酸钾反应,生成苯甲酸,再加碱生成水溶性苯甲酸钠,从而与 苯分离;又如,除去CO2中的少量O2,可将气体通过热的铜网。 (3)沉淀法:将杂质转变为沉淀除去的方法。如除去CO2中的H2S气体,可将混合气体通入到 CuSO4溶液中,除去H2S气体。 (4)汽化法:将杂质转变为气体使之除去的方法。如除去NaCl固体中的Na2CO3固体,可加入 HCl将其中的转变为CO2气体。 (5)酸、碱法:利用杂质和酸或碱的反应,将不溶物转变成可溶物;将气体杂质也可转入酸、 碱中吸收来进行提纯。如除去CuS中的FeS就可采用加入盐酸,使之充分溶解,利用FeS和盐酸反 应而不与CuS反应的特点来使两者分离。 (6)络合法:有些物质可将其转化为络合物达到分离目的。如BaSO4中的AgCl可通过加入浓氨 水,使AgCl转化为可溶的[Ag(NH3)2]Cl除去。 (7)转化法:利用某些化学反应原理,将杂质转化为所需物质,如NaHCO3溶液中含Na2CO3 可通足量CO2转化,CaO中含CaCO3,可加热使之转化等。有机物的分离一般不用此法,如除去 乙酸乙酯中混有的乙酸,如果采用加入乙醇及催化剂(稀硫酸)并加热的方法,试图将乙酸转化为乙 酸乙酯,这是适得其反的。其一是加入的试剂难以除去;其二是有机反应缓慢、复杂,副反应多, 该反应又是可逆反应,不可能反应到底将乙酸除尽。 (8)水解法:当溶液中的杂质存在水解平衡,而用其他方法难以除之,可用加入合适试剂以破 坏水解平衡,使杂质转化为沉淀或气体而除去。如:MgCl2中的FeCl3,可用加MgO、Mg(OH)2、 MgCO3等,降低H+浓度,促进Fe3+水解为Fe(OH)3↓,而不能加NaOH和NH3· H2O等。 (9)其他:如AlCl3溶液中混有的FeCl3,可利用Al(OH)3的两性,先加过量氢氧化钠溶液,过滤, 在滤液中通足量CO2,再过滤,在滤渣[Al(OH)3]中加盐酸使其溶解。此外还有电解法精炼铜;离子 交换法软化硬水等。 多数物质的分离提纯采用物理——化学综合法。
• •
•
• •
物质的检验
化学工业知识
合成氨
石油化工
氯碱工业
硫酸的工业制法
物质的分离提纯
• 物理分离提纯法
化学分离提纯
• 化学法要同时考虑到各组成成分及杂质的化学性 质和特点,利用它们之间的差别加以分离提纯。 一般原则是:①引入试剂一般只跟杂质反应;② 后续试剂应能除去过量的前一试剂;③不引进新 杂质;④杂质与试剂生成的物质易与被提纯物分 离(状态类型不同);⑤过程简单,现象明显,纯 度要高;⑥尽可能将杂质转化为所需物质;⑦除 去多种杂质时应考虑加入试剂的合理顺序;⑧如 遇到极易溶解于水的气体时,应防止倒吸现象发 生。在进行化学分离提纯时,进行完必要的化学 处理后,要适时实施某些物理法操作(如过滤、分 液等)。
•
化学反应类型
离子反应
氧化还原反应的有关概念的相互关系
化学反应中的能量变化
溶液与胶体
化学反应速率
化学平衡
弱电解质的电离平衡
溶液的酸碱性
盐类的水解
酸碱中和滴定
电化学
元素与化合物
钠及其化合物
碱金属
氯及其化合物
卤素
氧族元素
硫的重要化合物
碳及其化合物
硅及其化合物
材料
氮族元素
氮和磷
氨
硝酸
镁和铝
铁及其化合物
铜及其化合物
有机化学基础
烃
不饱和链烃
芳香烃
烃的衍生物
烃的衍生物结构、通式、化学性质 鉴别 代表物质转化关系
糖类
油脂
• 密度比水小,不溶于水, 易溶于汽油、乙醚、苯等 多种有机溶剂中。 • 化学性质: 1.水解: 酸性条件 碱性条件——皂化反应 2.氢化(硬化)
蛋白质和氨基酸
合成材料(有机高分子化合物) 有机.xls
化学计算
物质的量及气体摩尔体积的计算
相对原子质量、相对分子质量及确 定化学式的计算
物质溶解度、溶液浓度的计算
pH及有关氢离子浓度、氢氧根离子 浓度的计算
化学反应方程式的有关计算
化学实验
化学实验基本操作
常见气体及其他物质的实验室制备
• 试剂的选择或采取的措施是最为关键的,它要根 据除杂的一般原则,分析杂质的状态类型来确定。 ①原物质和杂质均为气体时,一般不选用气体作 为除杂的试剂,而选用固体或液体试剂;②原物 质和杂质均为可溶于水的固体(或溶液)时,杂质 的除去,要根据原物质与杂质中阴阳离子的异同, 选择适当试剂,把杂质中与原物质不相同的阳离 子或阴离子转变成沉淀、气体、水或原物质。试 剂一般选用可溶于水的固体物质或溶液,也可选 用气体或不溶于水的物质;③原物质和杂质至少 有一种不溶物时,杂质的除去一般不选用固体试 剂,而是选用气体或液体试剂,也可采用直接加 热、灼烧等方法除去杂质。
气体发生装置
常见气体的制备
气体的干燥
• 干燥是用适宜的干燥剂和装置除去气体中混有的
少量水分。常用装置有干燥管(内装固体干燥剂)、 洗气瓶(内装液体干燥剂)。 • 所选用的干燥剂不能与所要保留的气体发生反 应。常用干燥剂及可被干燥的气体如下:
•
• •
•
• •
(1)浓硫酸(酸性干燥剂):N2、O2、H2、Cl2、CO、CO2、 SO2、HCl、NO、NO2、CH4、C2H4、C2H2等(不可干燥还 原性或碱性气体)。 (2)P2O5(酸性干燥剂):可干燥H2S、HBr、HI及浓硫酸能 干燥的气体(不可干燥NH3等)。 (3)无水CaCl2(中性干燥剂):可干燥除NH3以外的其他气 体(NH3能与CaCl2反应生成络合物CaCl2· 8NH3)。 (4)碱石灰(碱性干燥剂):可干燥NH3及中性气体(N2、O2、 H2、CO、NO、CH4、C2H4、C2H2等)。不能干燥酸性气体。 (5)硅胶(酸性干燥剂):可干燥Cl2、O2、H2、CO2、CH4、 C2H4、C2H2(硅胶能吸附水,也易吸附其他极性分子,只能 干燥非极性分子气体)。 (6)其他:如生石灰、NaOH也可用于干燥NH3及中性气体 (不可干燥有酸性或能与之作用的气体)。
高中化学知识结构网络图
化学基本概念和基本理论 元素与化合物 有机化学基础 化学计算 化学实验 化学工业知识
化学基本概念和基本理论
物质的分类
组成原电子数 质量数(A)=质子数(Z)+中子数(N)
元素周期律与周期表
化学键与分子结构
晶体类型与性质
