第六章 有机合成的设计
第六章有机合成反应的工业化放大

放大的根本目的是在工业化装置上实现小试研究的收 率和质量,但实际中常常达不到理想的程度。 “放大效应” 实验室装置与工业化设备的区别。
一、温度梯度、浓度梯度不同 反应过程中的温度效应与浓度效应影响反应的选 择性。 宏观状态上小试研究与工业化没有区别,温度控 制和加料方式相同。 微观状态上,在局部、在温度、浓度上的差异有 时很大,这种差异就是放大效应。这种差异是出现在 局部的、关键点上的。 工业化放大,就是关注并解决关键点上的工业化 与小试研究的差异。
1、吸热反应的温度控制 吸热反应必须有外加热源,外加热源的温度就直接影 响了壁温,反应体系的“过热”就在于壁温。 控制“过热”的惟一方法就是控制夹套的加热介质。
例1:杂环化合物环合反应的工业化放大
环合反应为吸热反应,180℃反应6h,小试收率 60~65%。
工业化过程中不同温度下的环合反应收率 批号 反应温度(℃) 油浴温度(℃) 收率(%) 1 180 230 43 2 180 210 58 3 180 200 66 4 180 190 75
四、温度指示的偏差不同
小试过程中温度计显示灵敏且接近反应液真实的瞬 时温度。 工业化过程中反应釜中的反应液一般需要经过温度 计套管再经导热油,最后才加热温度计,这样的传导过 程导致温度计所示温度比实际温度滞后且升降幅度减小。
反应釜内的实际温度与指示温度
第二节 反应过程的影响因素
一、混合状态的影响 1、简单反应与复杂反应 简单反应不存在副反应,也就不不存在温度效应和浓度 效应,因而不存在放大效应的影响。加料方式、温度高低、 混合方式和状态都没有影响。 对于平衡移动的热力学控制的化学反应,可视为简单反 应。
第三节
小试至中式的过程及要求
一个项目从理论到车间产品,这个过程就是项目研发 的过程,包括小试到中试放大全过程 一、文献 项目开始首先是要大量的相关文献搜索。从文献报道 中找你要的信息,路线情况、原料供应情况、专利情况、 杂质情况、晶型情况等等。清楚之后就要对所获得的信息 进行筛选,选择既合理又不侵犯专利等等集诸多好处于一 身的工艺路线了。
有机合成:第六章 开环和关环

14
例如:
CH3
(1)
132 C
戊烷
CH3
H CH3 CH3
H
[加热反应,对旋成键(有机化学P479表19-1)]
15
6.4 开环反应 开环反应在有机合成中主要有以下两个方面的应用:
(1)在开环的产物中,被打破的键的每一端的原子上都 带有官能团。即通过开环反应合成双官能团分子; (2)在一个双环或多环分子中,破裂的两个环共用的键 可导致一个中环或大环分子的产生,而这个环难以用其它 方法制备。即通过开环反应合成中环或大环化合物。
反应特点:
(a)在单环化合物的合成中,闭环步骤常包括碳-杂 原子键的形成;
(b)如果系统中含有2个相邻的杂原子,则在闭环步骤 中很少涉及杂原子-杂原子键的形成;
(c)如果目标分子是双环的,并具有与苯环稠合的杂原 子,则原料几乎总是预先形成苯的衍生物。分有: (I)单环化合物的形成; (Ⅱ)苯并稠环化合物的形成。
位或对位二取代为主。
9
6.2.2 1,3-偶极环加成 1,3-偶极环加成也是一个[4π+2π]的过程,故与Diels-
Alder反应有关, 但4π电子不是二烯而是1,3-偶极,四个 电子分布在三个原子上,如重氮烷和叠氮化合物:
重氮烷: RHC N N
RHC N N
RHC N N
RHC N N
叠氮化合物: RN N N
第六章 开环和关环
关环和开环 涉及关环和开环的反应很多.
关环反应主要分三类 1. 分子内的变型:n个原子的链环化成n元环或n-1元环状化 合物,如Dieckmann反应(分子内Claisen酰基化反应); 2. 环加成反应:涉及两个不同分子间的反应,同时形成两 个键,如Diels-Alder反应; 3. 电环化反应:它是分子内反应,但其机理与环加成反应 有关。
应用电化学课件第6章教学教材

上一内容 下一内容 回主目录
返回
2020/6/19
§6.2 有机电合成的若干发展方向
1. 发展电解中特有的反应 例如己二腈的电解还原合成等,反应选择性高,有竞
争能力并已工业化。 2. 发展能缩短工艺过程的有机电合成 例如,对氨基苯甲醚的合成: 采用化学合成,需三步工艺如下:
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
2020/6/19
§6.2 有机电合成的若干发展方向
9. 两极同时利用的成对电解合成 用适当隔膜隔开阴、阳极,在两室中同时进行一对氧
(8)若作用物没有导电性,则要用支持电解质。如季 胺盐、六氟磷酸盐、六氟硼酸盐、高氯酸盐和甲苯磺酸盐
3. 有机电合成产品要工业化必须达到以下指标:
(1)高的产物得率;(2)电流效率η>50%;(3)能 耗(电解)<8kW·h·kg–1最终产物;(4)在电解液中 最终产物的浓度应>10%;(5)电极寿命>1000h;(6 )膜寿命>2000h;(7)最终产物能简单分离;(8)电 解液经简单处理即可参与循环反应。
–
2CH3COO
→C2H6
+
2CO2
+
2e
很多化学品为精细化学品,如医药品、香料、农药等 是高附加值的产品。传统合成方法采用有机合成和发酵法 ,后来采用电化学方法进行电合成极为有效。近30年来有
上一内容 下一内容 回主目录
返回
2020/6/19
§6.1 概述
机电合成得到迅速发展,成为新世纪化学工业发展的一个 方向。
应用电化学课件第6章
上一内容 下一内容 回主目录
返回
第六章 有机物的电解合成
§6.1 概述 §6.2 有机电合成的若干发展方向 §6.3 己二腈的电解合成 §6.4 四烷基铅(自学) §6.5 糖精 §6.6 苯二酚 §6.7 有机电合成的电化学氟化(自学) §6.8 均匀设计法在有机电化学合成工艺中的应用(自学) §6.9 国外有机电解合成研究方向
有机合成设计

有机合成设计导言有机合成是一门综合化学的领域,旨在通过有机化学反应,将简单的有机化合物转化为目标化合物。
有机合成设计是该领域中至关重要的一部分,它涉及选择适当的反应路径、反应条件和催化剂,以实现高产率和高纯度的产物合成。
本文将深入探讨有机合成设计的关键原则和最新发展。
一、有机合成设计的关键原则1.1 目标分析在进行有机合成设计之前,首先需要对目标化合物进行全面分析。
这包括理解目标化合物的结构、性质和用途,确定其在反应过程中的稳定性和活性。
此外,还需评估合成路径的可行性、成本和环境友好性。
1.2 反应路径选择选择适当的反应路径是有机合成设计中的重要一步。
反应路径应满足以下要求:•化学反应尽量选择可逆反应,以提高产率和减少废弃物的生成。
•选择具有高收率和高选择性的反应。
•考虑反应条件中的温度、压力和溶剂等因素。
1.3 催化剂选择催化剂在有机合成中起到至关重要的作用。
正确选择适当的催化剂可以提高反应速率和选择性,降低反应温度和能耗。
常见的催化剂包括金属催化剂、酶催化剂和有机催化剂。
二、有机合成设计的最新发展2.1 C-H键官能化C-H键官能化是一种高效的有机合成策略,可以直接将C-H键转化为C-X键(X代表官能团)。
这一策略避免了传统方法中需要引入保护基的步骤,简化了合成路径,提高了反应效率。
近年来,许多新的C-H键官能化反应和催化剂得到了开发,为有机合成设计带来了新的可能性。
2.2 基于多组分反应的合成多组分反应是一种将多个底物同时参与反应的方法,可以在一步内合成多个化学键,有效提高合成效率。
随着多组分反应机理和新的催化剂的不断发展,这一策略在有机合成设计中得到了广泛应用。
2.3 反应条件的优化为了减少废弃物的生成和节约能源,反应条件的优化至关重要。
绿色合成已经成为有机合成设计的重要方向之一。
通过选择可再生溶剂、降低反应温度和压力,以及减少有毒试剂的使用,可以实现更可持续、环境友好的有机合成。
2.4 人工智能在有机合成设计中的应用近年来,人工智能在有机合成设计中的应用取得了显著进展。
有机合成化学:第六章 缩合反应
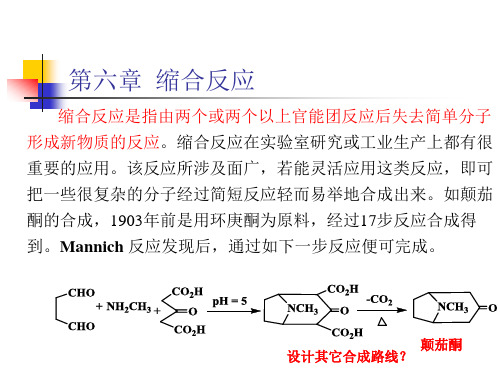
第六章 缩合反应
上例是由于选择不同的起始原料,而选择不同的合成路线,使 产品成本大大降低。如果没有很好的路线选择时,可以通过优化 反应条件,提高产物的收率,降低成本。从产品收率上讲,能提 高1-5%。我们可能认为没什么意义,可对企业讲,产品成本会降 低2-8%左右。如果一个产品产值上亿时,可估算一下其价值了。 所以,一个化工产品刚上市时价格较高,随着生产时间延长,价 格逐渐降低,很大可能是由于生产工艺和生产条件的改变所致。
-CO2
CH3CH CH2CO2H
H3C
O O O
60~76%
CH3NO2 + H3CCH
C H
CO2C2H5
NaOC2H5 CH3CH CH2CO2C2H5
55%
CH2NO2
第六章 缩合反应 CH3
CN
PhCH CO2C2H5 + H2C
C H
CN
KOH 83%
CN
PhC CH2CH2CN CO2C2H5
LDA
H3C
CH3
第六章 缩合反应
羰基化合物烷基化最大负反应是O-烷基化产物。如:
副产物
第六章 缩合反应
LDA CH3(CH2)3CO2CH3 BrCH2CH
CH2
CH3CH2CH2CH CO2CH3 CH2CH CH2
LDA
CH2CH3
C2H5Br CH3CH2Байду номын сангаас CO2CH3
可以分步引入
90%
5. Knoevenagel反应:
这类反应的特点是一个亚甲基上连接两个吸电子基团,使
得其氢活性明显提高,反应较易进行。一般使用弱碱 (有机胺)
有机合成中的保护基

可编辑ppt
2
选择保护基时要考虑:
1、保护基的供应来源,经济易得
2、必须能容易地进行保护,且保护效率要高
3、保护基的引入对化合物的结构论证不致增加过量的复杂 性,如引入新的手性中心 4、保护后的化合物要能承受得起以后进行的反应和后处理 过程
5、保护基团在高度专一的条件下能选择性、高效率地 被除去
6、去保护过程的副产物和产物能容易被分离
可编辑ppt
3
一、酯类保护基
第一节 羟基的保护
酯类保护基的生成
酸酐/酰氯 溶剂:Py-CH2Cl2
HO
OH OH
PivCl (1eq) Py-CH2Cl2
0-25 0C
90 %
Cat: DMAP
OH HO
OO
Nicolaou, K. C.; Webber, S. E. Synthesis 1986, 717.
可编辑ppt
4
酯类保护基的除去
一般情况下,酯类保护基在碱性条件下除去,但各种酰基 的水解能力不同:
t-BuCO < PhCO < MeCO < ClCH2CO…. 常用的碱:K2CO3, NH3, KCN,肼、胍、Et3N或 i-Pr2NEt
位阻较大的酯需要较强的碱性体系:KOH/MeOH
可编辑ppt
Cleavage 1、KHCO3, H2O, MeOH, 20°C, 3 days 2、 Dil. NH3, pH 11.2, 20°C , 62% yield.
I. W. Hughes, F. Smith, and M. Webb, J. Chem. Soc., 3437 (1949).
可编辑ppt
2、KCN, 95% EtOH, 20 0 C to reflux, 12 h, 93% yield.
有机合成路线设计

有机合成路线设计有机合成路线设计是有机化学领域的一项重要工作,它为有机化合物的合成提供了合理而高效的方法。
在设计有机合成路线时,我们需要考虑到合成的步骤和反应条件,以及选择合适的试剂和催化剂。
本文将以设计苯乙酸的合成路线为例,详细介绍有机合成路线设计的过程和注意事项。
苯乙酸是一种重要的有机化合物,广泛应用于染料、药物和聚合物等领域。
它的合成可以通过苯乙烯的氧化反应实现。
下面将从苯乙烯的选择、反应条件和反应步骤三个方面进行合成路线的设计。
首先要选择合适的起始原料,苯乙烯是制备苯乙酸的理想原料之一、苯乙烯具有容易获得、价格低廉和易于反应等优点,因此是较好的选择。
而对于一些特殊的合成需求,例如要求原料质量较高或改变反应路径等,可能需要选择其他合适的起始原料。
其次要确定反应条件,包括反应温度、反应时间和反应pH等。
对于苯乙烯的氧化反应,常用的氧化剂有过氧化苯甲酰、高锰酸钾和氧气等。
反应温度一般在60-120℃之间,反应时间约为4-8小时,反应pH一般在酸性或中性条件下进行。
此外,催化剂的选择也很重要,可以选择过渡金属催化剂如Co、Mn等金属。
最后是确定反应步骤。
苯乙烯的氧化反应一般需要多步进行,首先是苯乙烯的加成反应,将氧化剂加到苯乙烯上形成一个介质,然后进行氧化反应生成苯乙酸。
在氧化反应过程中可能会生成一些副产物,因此还需要进行一些后续的处理步骤,例如中和反应、晶体化、洗涤等。
具体的反应步骤需要根据实验室条件和实际需要进行确定。
在设计有机合成路线时,需要注意以下几个方面。
首先,要注意选择合适的反应物和试剂,具有较高的反应活性和选择性。
其次,要考虑反应条件和反应步骤的可行性和可控性,避免有害副产物的生成和不可逆反应的进行。
最后,要考虑反应的经济性和环保性,选择低成本、低能耗和环境友好的合成方法。
综上所述,有机合成路线设计是有机化学领域的重要工作,需要综合考虑起始原料的选择、反应条件和反应步骤等因素。
合理的合成路线设计可以提高有机合成的效率和产物纯度,为有机化学领域的研究和应用提供更好的方法和途径。
大学有机化学第六章

第六章单环芳烃•要求深刻理解和熟练掌握的内容:苯的结构;单环芳烃的化学性质,苯环上的亲电取代反应机理及定位规律的理论解释。
•要求一般理解和掌握的内容:单环芳烃的来源和制法•难点:•苯环上亲电取代反应定位规律的理论解释第六章单环芳烃•大多数芳烃含有苯的六碳环结构,少数非苯芳烃的结构和性质与苯环相似,也称芳烃.•芳烃的性质特点:(1)不易发生加成反应,(2)不易氧化,(3)而容易起取代反应.(1)单环芳烃•芳烃可分为以下三类:(2)多环芳烃(3)非苯芳烃苯的分子式: (C6H6)一苯环的结构1. 凯库勒结构式性质特点:苯不易发生加成,不易氧化,但容易发生取代反应。
苯的凯库勒式结构+H 2∆H=-120kJ/mol+3H 2∆H=-208kJ/mol (2)苯的氢化(3)1,3-环己二烯脱氢-H 2∆H=-23kJ/mol苯的稳定性证明(1) 环己烯催化加氢:四、单环芳烃的物理性质芳香烃不溶于水,但溶于有机溶剂。
一般芳香烃均比水轻。
沸点随相对分子质量升高而升高。
熔点除与相对分子质量有关外,还与结构有关,通常对位异构体由于分子对称,熔点较高。
苯亲电取代反应的能量示意图反应进程势能+E +EE H+六、苯环上亲电取代反应的定位效应1. 定位规律A.烷基苯的取代反应CH3CH3NO2NO2CH3混酸℃3057%40%甲苯的硝化比苯容易,新引入的取代基主要进入原取代基的邻对位。
实验现象:B.硝基苯的取代反应发烟HNO3+H2SO4NO2NO2NO295℃93.2%硝基苯的硝化比苯困难,新引入的取代基主要进入原取代基的间位。
《有机合成设计》(ppt版)

一、切断介绍
1. 叔丁基氯可以水解为醇:
M e 3 C -C l
M e 3 C + O H - M e 3 C -O H
它的逆过程是怎样的呢?
H C l M e 3 C -O H -H 2 O
M e 3 C + C l-
M e 3 C -C l
比较另一种切断:
Me Me
C Me OH
Me+ Me CMe OH
+ H
M gB r
对称性的仲醇来自甲酸酯与两摩尔 格氏试剂的反应。
Ph
i. Mg,ether
Br ii. HCO2Et
TM26
Ph O H PhA 吡 c啶 2O TM 25
如何制取TM26呢?
这个Br来自醇的溴代。增加两个碳 的伯醇就是环氧乙烷的运用。
a
Ph M gBr+HCHO
Ph
BrFGI b Ph
C O 2E t
C H 2O H
C H O
T M 2121A和TM21B相同或类似TM13的合成。
(二)由醇衍生的化合物
• 醇可以转化为多种化合物,如下表所示:
ROR H+
消除反应 烯烃 见框格36-43
R-X
O
PX3
R'CHO or R1 R2
or HX
氧化
ROH 醇
CHO
Ph3P
CO2Et
OMe
(2)
(3)
OMe
CO2Et (4)
EtO-
O
CO2Et
(5)
O
OMe
O (6)
对苯乙烯的亲核加成
还原、失水 O
OMe Me2CuLi
2010年:第六章 有机合成中的选择性

0.
H O
1
O B 1 0 n O n
B B n
O
选择性的控制-试剂及反应条件的调节 三 选择性的控制 试剂及反应条件的调节 1 羟基的选择性氧化
(1) 烯丙基羟基在其它羟基的存在下可选择性氧化 可 ) 烯丙基羟基在其它羟基的存在下可选择性氧化, 用活性MnO 用活性 O 2、DDQ、Ag2CO3/Celite等。 、 等
C
3 0
C
l C l O DH D Q C N
T O H , H O
O H
3 5
O H
O
C
D D H O , Q T R
O O
(2)
(3)
2 羰基的选择性还原
• 饱和酮和α,β-不饱和酮由于其电子的离域情况不同 饱和酮和α β 不饱和酮由于其电子的离域情况不同 不饱和酮由于其电子的离域情况不同, 亲核试剂可选择性地进攻饱和酮, 而亲电试剂B2H6 亲核试剂可选择性地进攻饱和酮 而亲电试剂B2H6 可选择与不饱和酮反应。 可选择与不饱和酮反应。 O
H O H M n O
2
O H
O O
O H O A O O H 8 0 % e t i l H 0 e g
2
O H O C O 6 C H O
3
, O
O H H
O H O A g 9 0 H O H % O H O H
2
O H H H O
C O
3
O H H
O O H H E N
+
O H C N
C N H ( C 1 l C N O H : : 1 H ) N , O
+
N a C H O H O B C S H
第六章合成氨方案

工业合成氨原料: 1、固体原料:焦炭和煤 2、气体原料:天然气、油田气、焦炉气等 3、液体原料:石脑油、重油、原油等。
五、合成氨发展的三个典型特点:
1.原料构成: 基本完成了从煤、焦炭到油(石脑油、 重油)、天然气的转变。
2.生产规模单系列大型化。 1000~1500T/日
3.能量的合理利用。 用过程余热自产蒸汽推动 蒸汽机供动 力,基本不用电能。
第一节 概述
一、氨的用途
• 85%的氨用来制化学肥料,其余作为生产其 他化工产品的原料。
• 氨除了主要用作化学肥料的原料外,还是生 产染料、炸药、医药、有机合成、塑料、合 成纤维、石油化工等的重要原料。
氨的其他工业用途也十分广泛,例如:在制
冰、空调、冷藏等系统的致冷剂。
二、氨的物理性质
标准状态下是无色气体,具有特殊的刺激性臭味。 20℃下将氨气加压0.8MPa时,液化为无色的液体。
加热措施:开车时采用电加热,正常 生产时氢氮混合气被反应后的高温气体 加热。
氨合成中的反应热进行回收,副产蒸 汽。
(3)氨的分离
a、冷凝法
冷却含氨混合气,气氨冷凝为液氨,经气液分离 设备将液氨从混合气中分离。
理论依据——拉尔逊公式:具体见教材。由拉尔 逊公式可看出,提高压力、降低温度有利于氨 的冷凝分离。
2、合成氨的工艺流程
工艺流程图讲解。 看课本讲解
2.4
蒸汽 精炼气至压缩工段
12 MPa
压 缩 机 来 氢 氨 混 合 气
气氨至冷冻工段 液氨至冷冻工段 再生气去回收
冷却水
12 MPa
Hale Waihona Puke 去废铜液地下槽空气来自空压机
气氨来自液氨计量瓶
铜氨液吸收和再生流程
第六章有机合成反应的工业化放大

依据平时积累的理论基础知识,先自己根据搜集的信息 判断目标化合物该怎么拆解,有哪些拆解方式,找准它,选 用它。 较多的时候是选择快要过期的专利路线,这样既能把规 避专利保护做到最好,又能不费太多心思在路线上,例如目 前国内做化学合成原料药仿制研发的大多数运用此法。 当搜集的有效信息很少的情况下就必须充分利用周围的 资源,集思广益,大家共同制定一条路线,参考类似反应的 文献和根据自己确定的路线,充分考虑可能发生的副反应, 同时要把杂质情况也大致的排一下。
COOH Cl H2N COOH H N
原料只有主含量指标,未提及杂质的种类与上限。 生产中需邻氯苯甲酸中杂质的含量与组成,特别是异 构体的含量。
2、原料中杂质含量常常缺少上限指标。 如氯苯(用于光氯化反应)的原料指标有纯度和二氯 苯的最高含量,而没有提到金属离子的含量。 金属离子的含量对光氯化反应过程非常重要,涉及到 光氯化反应过程中是否有较多副反应的问题,金属离子可 以催化芳环氯化从而生成副产物。
2、非均相反应和均相反应 非均相反应过程中反应往往发生在相界面上,扩散是反 应的控制步骤,剧烈搅拌可加速反应。 工业化过程中的搅拌器一般是推进式、涡轮式或布式搅 拌,同时反应釜内加装挡板以增加混合效果。 均相反应中各因素的影响区别较大。
3、吸热反应和放热反应 吸热反应不会因混合不好造成局部温度过高,温度梯 度容易控制,同时此时浓度效应也不显著,可较慢的搅拌。 放热反应则较复杂。 4、扩散控制与动力学控制 复杂、均相、放热反应的扩散控制过程,要求搅拌越 剧烈越好。 动力学控制过程,反应速度较慢,温度梯度、浓度梯 度对选择性的影响不大,对搅拌速度的要求不高。
二、原料清单 根据自己合成路线所需要的原料列个清单。 合成路线确定了也就基本上确定了所要使用的原料 了,在使用之前一定要先了解原料的理化性质,好好的查 查MSDS了,尤其是其化学反应性质和衍生物性质、本身的 生理毒性、毒害防护和应急处理措施等。 拿到东西就盲目实验,看也不看,想也不想,这样容 易出现意外。几乎所有公司实验室都出过事故的,小到冲 料,大到中毒起火爆炸,重大到人员伤亡。
有机合成设计路线

+
+
-
X=COOEt,CN…
+
二
例 试设计 的合成路线 +
1,6-双官能团化合物
Diels-Alder
+
+
+ 分析 例 试设计 的合成路线
+ 分析 例 试设计 的合成路线
5 碳环切断与合成路线设计
三元环(插入反应) 四元环 五元环 六元环 中环和大环
活性亚甲基两次烷基化 电环化2+2环加成
分子内羟醛缩合 酮酯缩合
Diels-Arden Robinson Frider-Crafts
反合成分析,就是通过切断(dis)、连接(con)、 重排(rearr)等骨架转换及官能团转换实现的
(4)反合成子(retron)
为区别合成子/合成中间体,引入反合成子概念
反合成子: 反合成分析中进行某一转化 所必须的结构单元
转化所必须 的结构单元
转化将要得到的 结构单元
Diels-Alden环加成反应 Robinson成环反应
Diels-Alder反应
01
Robinson成环
02
Fridel-Craftrs反应
03
合成依据:
六元环
例 试设计 的合成路线 分析 合成:略
中环和大环
01
α,ω-二元酸酯
02
酮醇缩合(还原)
(5)合成树
A(TM)
B
C
D
E
C
F
G
H
I
J
K
L
M
N
O
P
Q
前体的前体
TM的前体
合成路线的构成
《有机合成》教案

《有机合成》教案第一章:有机合成的基本概念1.1 有机合成的定义1.2 有机合成的目的和意义1.3 有机合成的方法和分类1.4 有机合成的基本步骤第二章:有机合成的策略与设计2.1 有机合成的策略2.2 有机合成的设计原则2.3 有机合成的路线设计2.4 有机合成的优化与评价第三章:有机合成的反应类型3.1 加成反应3.2 消除反应3.3 取代反应3.4 缩合反应第四章:有机合成的常用试剂与催化剂4.1 有机合成的常用试剂4.2 有机合成的常用催化剂4.3 试剂和催化剂的选择原则4.4 试剂和催化剂的安全使用第五章:有机合成的实验操作技术5.1 有机合成的实验操作步骤5.2 有机合成的实验操作技巧5.3 有机合成的实验操作注意事项5.4 有机合成的实验操作案例分析第六章:有机合成的实例分析6.1 常见有机化合物的合成实例6.2 有机合成实例的解析与评价6.3 有机合成实例的改进与优化6.4 有机合成实例的综合应用第七章:有机合成的绿色化学7.1 绿色化学的基本概念7.2 绿色化学在有机合成中的应用7.3 绿色化学在有机合成设计的原则和方法7.4 绿色化学在有机合成中的挑战与发展第八章:有机合成的现代技术8.1 有机合成的现代技术概述8.2 有机合成的现代技术方法和原理8.3 有机合成的现代技术应用实例8.4 有机合成的现代技术发展趋势第九章:有机合成的安全与环保9.1 有机合成中的安全问题9.2 有机合成中的环保问题9.3 有机合成安全与环保的法规和标准9.4 有机合成安全与环保的实践措施10.1 实验报告的基本要求10.2 实验报告的内容与结构10.4 实验报告的案例分析与评价第十一章:有机合成的案例研究11.1 重要有机化合物的合成案例11.2 有机合成案例的策略分析11.3 有机合成案例的实验操作步骤11.4 有机合成案例的研究意义与影响第十二章:有机合成的工业应用12.1 有机合成在制药工业中的应用12.2 有机合成在材料科学中的应用12.3 有机合成在食品工业中的应用12.4 有机合成在其他领域中的应用第十三章:有机合成的科研前沿13.1 有机合成领域的最新研究动态13.2 有机合成新技术和新方法的发展13.3 有机合成在解决实际问题中的应用13.4 有机合成研究的未来趋势第十四章:有机合成的教学与实践14.1 有机合成教学的内容与方法14.2 有机合成实验的教学设计14.3 有机合成教学的案例分析14.4 有机合成教学的实践与反思第十五章:有机合成的未来发展15.1 有机合成在科学研究中的作用15.2 有机合成在国民经济中的地位15.3 有机合成面临的问题与挑战15.4 有机合成的可持续发展与展望重点和难点解析重点解析:1. 有机合成的基本概念、目的和意义,以及方法和分类。
天然产物全合成完整PPT

赤潮神经毒素 Brevetoxin B
KC.Nicolaou教授等人 历经12年完成了它的合成
有机合成化学与路线设计
第六章 天然产物全合成实例
4
有机合成化学与路线设计
第六章 天然产物全合成实例
有机合成化学与路线设计
第六章 天然产物全合成实例
历经12年完成了它的合物全合成实例
有机合成化学与路线设计
第六章 天然产物全合成实例
主要用于风湿顽痹,麻木瘫痪,跌扑损伤,痈疽肿痛;
小儿麻痹后遗症,类风湿性关节痛 。
历经12年完成了它的合成
人类误食了含有西加毒素的珊瑚鱼即引起中毒。
有机合成化学与路线设计
第六章 天然产物全合成实例
主要用于风湿顽痹,麻木瘫痪,跌扑损伤,痈疽肿痛;
* 实例链接引用了中国科学院上海有机化学研究所姚祝军教授《复杂分子的合成化学》的课件
有机合成化学与路线设计
第六章 天然产物全合成实例
9
西加毒素(Ciguatoxin)是一种神经毒素,由剧毒纲比甲藻产 生 , 通过食物链传递而蓄积于各种珊瑚鱼体内。人类误食了含 有西加毒素的珊瑚鱼即引起中毒。中毒后会出现头晕、恶心、 呕吐、腹痛、腹泻等症状,严重者可导致脱水休克 。
其全合成如下:
有机合成化学与路线设计
第六章 天然产物全合成实例
10
The end
Thank you!
感谢观看
* 实例链接引用了中国科学院上海有机化学研究所姚祝军教授《复杂分子的合成化学》的课件
有机合成化学与路线设计
第六章 天然产物全合成实例
中毒后会出现头晕、恶心、呕吐、腹痛、腹泻等症状,严重者可导致脱水休克 。
马钱子碱(Strychnine )是从马钱子科植物番木鳖的种子中提取的一种生物碱,可引起中枢神经系统的兴奋。
第六章 生物催化有机合成反应

第六章生物催化有机合成反应6.1 生物酶催化反应一、现状与发展:酶于20世纪20年代由Warburg发现,由于发现了酶,Warburg 于1931年获得Nobel生理医学奖。
酶在生物体内起着重要的催化作用,酶的催化作用和能力远远超过传统化学催化剂,这是人们近年得到公认的。
近几年,酶和酶催化作用已经成为人们非常重视和重点研究的领域。
酶的结构、酶的催化活性、酶的催化机理、酶的结构与催化功能的关系研究,已经成为21世纪催化研究的热点和前沿领域,相信,也必将有很大突破。
随着酶研究的深入,模拟酶催化研究以及酶催化技术及其应用方面,也将产生巨大突破。
生产实例:酒曲造酒-----今后,发现新酶、深入研究酶结构,仍将成为重点工作。
天然酶的结构测定,催化活性与机理的研究,亦会是21世纪催化研究的前沿领域。
二、酶催化反应的特点:(1)催化活性极高。
酶催化剂的催化效率比无机催化剂高1~10亿倍。
(酶对化学反应的加速可达100亿倍,---)(2)催化作用高度专一,有严格的选择性。
可达100%的专一性。
对底物的立体异构物具有高度选择性。
(如:对旋光异构、顺反异构等都具有高度选择性)(3)催化反应条件非常温和,操作安全,环境卫生。
(4)涉及的领域广泛。
eg:氨基酸合成,抗生素的合成,有机酸合成,酿酒,食品,环保,医药...等均可采用酶催化技术。
三、酶的构成及其作用原理(1)酶的定义:酶是具有催化作用的高分子蛋白质,为高分子化合物。
20世纪后期,T.R.Cech等发现了RNA的酶活性,研究中发现rRNA 可以自身剪接加工,并分离出一段具有催化活性的内含子(IVS),它具有转磷酸、转核苷酸和催化水解等多种功能,从而打开了酶性核酸研究新领域。
酶的新定义:大多数酶是具有催化作用的高分子蛋白质,为高分子化合物。
(2)酶的构成:酶分子由三部分构成,即:结合中心、催化中心(两者结合又称为活性中心)及分子母体。
(3)酶分子催化作用过程(机理):酶分子通过结合中心与底物发生结合生成活化络合物,然后通过催化中心发生催化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH2-CH=CH2
O Ph Ph FGI DIS OH + PhMgBr
1)
OH
OH CH3
FGI Ph
OH
O
DIS PhCHO +
O
2)
Ph
O Ph COOH
DIS
Ph- +
O
+
CON
COOH O O O
PhMgBr OH O PhMgBr +
Ph
FGA
COOEt
DIS
COOEt
+
2. 碳链的连接 (Connection CON)
碳链的连接是将目标分子中的合成碳原子用新的碳碳 键把它们连接起来,目的是寻找一易得的化合物。
O CON CHO CH3
3. 碳链的重排 (Rearrangement REARR)
把目标分子的碳链进行局部的重新组合,则为碳链 的重排。
在目标分子的一适当位置增加一官能团称为官能团增加。
1. 分子中特定位置不含官能 (对应于官能团转化) 团 官能团添加 两种情况 2. 当反应需要进行选择性控制 (合成时引入活化基或保护基)
例:
NH2 Br
(1)
Br
Br
Br FGI
Br
Br
O
O D-A +
(2)
GA F
O
Robinson 环合 O + O
FGI
NH2
NO2
CH2OH
FGI
CH2Cl
2. 官能团的除去
(Functional Group Removal FGR)
在目标分子中有选择的除去一个或几个官能团,
使分子简化,这是逆向分析常用的方法。
SO3H H3C
O FGI Br
FGI H3C
O
3. 官能团的增加 ( Functional Group Additional FGA)
1828 AD Wohler discovers ammonium cyanate can be converted into urea.
合成设计是有机合成的方法论
• 1)合成设计是对已知合成方法的归纳、
演绎、分析和综合; • 2)合成设计是创造性的工作,是培养学 生创造性的必经途径; • 3)合成设计是综合能力的体现。
SR
a
3
2
1
PPh3
3
2
1
PPh3
四)电子给予体(Electron Doner)
1、烷基或d1合成子
1)
R Br Br + Mg MgBr + Li Li
2)
炔 负 离 子 RMgBr NaNH2 R R
MgBr
R
+
2、 d2合成子
C-H键连到不包合取代基上,C-H被极化。
H 3C CH3 O Pka=35 BuLi Pka=35 BuLi Pka=20 LDA O O Pka=9 K2CO3 CH2 O H 2C O O
Ph
DIS
O CHO
CON
四、合成等效试剂
“合成等效剂”是指那些与自身(常因其太不 稳定)无法使用的合成子有着等同效力 (功能) 的试剂。 例如,试剂C2H5MgX,就是C2H5 合成子的 合成等效剂。现在很多人主张用Synthon代
替“Synthetic equivalent”.
合成等效试剂
Pr C H3C CN OH 合成子 DIS Pr C H3C O+H + CN-
Me Me OH
HBr
Me Me
Br
B. 从官能团处切断,以利用特殊的反应
例1
O + O CHO
例2
O O DIS OH OH OH DIS OH + CH COOH 3 CHO
C. 利用分子内在对称性或潜在的对称性切断
N Me DIS CHO CHO O
H3CO OCH3 H3CO
+ H2NMe +
1、 卤代烷和磺酸酯是最常用的烷基化电子接受体 R+
2、 a1合成子
羰基则作为经典的a1—合成子使用。O-硅烷基化的半硫
缩醛物和甲酸的原酸酯是使用较少的a1—合成子。
3、 a2合成子
羰基化合物的卤代以及烯类的卤代或氧化可以得到 a2试剂。
4、 a3合成子
与吸电子基共轭的c=C双键的亲电性,将使这类化 合物成为有用的a3—合成子。这就是重要的插烯烯
第六章 有机合成的设计
本章主要内容
• • • • • • 前言 逆合成分析的常用符号和术语 切断与合成子 有机合成设计中的策略 合成路线的优选 有机合成设计示例
6.1
前
言
• 有机合成————利用化学反应从简单 化合物制取复杂分子的全过程。
• 有机合成设计————根据目标分子的
结构特点,选择适当的原料,适当的反 应组合成的较为合理的合成路线。
科里(Elias James Corey),美国有机化学家,生于1928年 7月12日,科里从20世纪50年代后期开始从事有机合成 的研究工作,30多年来他和他的同事们共同合成了几百 个重要天然化合物。这些天然化合物的结构都比较复杂, 合成难度很大。他的合成工作主要包括:
①大环结构,如红霉素大环内酯;②杂环结构,如翼萼藤碱;③倍半萜类化合物, 如长叶烯;④多环异戊二烯类化合物,如银杏内酯;⑤前列腺素类化合物,如前 列腺素E1;⑥白三烯类化合物,如白三烯A等。科里不仅在有机合成研究方面显 示出他的天才,而且他还总结出重要理论。1967年他提出了具有严格逻辑性的 “逆合成分析原理”,以及合成过程中的有关原则和方法。按照他的原理,使很 多合成难度较大的有机化合物,得到较高的收率而获得成功。科里还开创了运用 计算机技术进行有机合成设计。按照他的原理,他和他的学生卫普克编制了第一 个计算机辅助有机合成路线设计程序(DCSS)。由此程序为基础,还开发了许多新 的程序。这实际上是使他的“逆合成分析原理”及有关原则、方法数字化。由于 科里提出有机合成的“逆合成分析方法”并成功地合成50多种药剂和百余种天然 化合物,对有机合成有重大贡献,而获得1990年诺贝尔化学奖。
由原料决定有机合成的策略 起始原料→反应→目标分子 在农药、药物等的研究工作中, 需要制备一系列的同系物或合成一系列类 似物,从中选出效果较好的化合物和有效 基本结构。
NH
H2N SO2NH
N
H2N
SO2NH
C
H2N
磺胺胍(SG)
磺胺吡啶
H2N
N N NH2
SO2NH2
H2N
SO2NH2
百浪多息(Prontosil)
4 3 5 2 4 5 3 1 CH3 2
O
4
C2H5O 5
OEt
OC2H5
+ CH3 O H3C 3 2
H3C
1
O
CH3
O
3 4 5 OC2H5
1
OEt CH3 O
H3C
+ O C2H5O
2
O
1
EtO2C
CH3
合成路线1
O OH OH CH3 H3C H3C O I2 CH3 H3C H3C CH3 O
6.2 逆合成分析的常用符号和术语
表示通过化学反应 由后者可以得到前者 通过化学反应, 前者可得后者
一、切断与合成子
一)切断 ( DIS: Disconnection )
成键的逆过程
1. 两个成键电子的均裂(二个电子平均分配给两个碎片)
C1 C2 DIS
C
1
+
C2
2. 二个电子的异裂(即形成一个碳正离子和一个碳负离子)
DIS 1
C1
C2
C
+
C2+
二)合成子
将切断而得到的碎片称为合成子,合成子可以是碳
正离子、碳负离子或自由基。
C-C 键的形成可以有两种方式:
1) C 1
+
C2+
C1
C2
electron donor
electro acceptor
d
synthon radical C + C2
a
2)
1
C1
C2
三)电子接受体a合成子
N H2N SO2NH N
N H2N SO2NH S
磺胺嘧啶(SD)
磺胺噻唑(ST)
反向合成分析
目标分子→反应→起始原料
1990年, EJ.Corey, 创建了 一种独特的有机合成理论— 逆合成分分析理论
The logic of chemical synthesis
1990年诺贝尔化学奖获得者科里(图)
二、有关官能团方面的转换
逆向官能团方面的转换:在不改变目标分子
基本碳链架构的前提下改变官能团的性质或
位置,包括三种变化:
1. 官能团转换
(Functional Group Interconversion FGI)
将目标分子中的一种官能团逆向变化为另一种官能团, 而具此官能团的化合物本身就是原料或制备较容易。
+
Me
CH2OH
HCHO
Me CHO Me
FGI
FGI
Me Me
Cl FGI
Me Me
MgCl
逆合成分析2:
Me Me FGI Me Me OH
Br FGI
Me Me OH
FGI Me O Me
+
H
H
按照逆合成分析2的合成路线:
Me O Me
+
H
H
NaNH2 Me Me OH
