近期获FDA批准的新药盘点(2011年9月15日)
2011年全球新药研发盘点

不知不觉,2012年到了,回首2011年,对于制药行业来说是一个“多事之秋”,行业在推出前景看好的治疗药物上似乎显得略为平淡。
Gilenya:副作用引关注2011年4月,当诺华生产的药物Gilenya在英国上市时,成为该国市场上第一只用于治疗多发性硬化症(MS)的口服药物。
这是MS治疗领域取得的一个重大进步,预计在未来几年中,这一领域将会出现更多的竞争对手。
Gilenya(fingolimod)被用来治疗高度活跃的复发‐缓解型多发性硬化症(在β干扰素注射药物治疗失败之后),但患者的病情还没有严重到足以需要输液治疗。
一名患者使用Gilenya治疗的费用每年平均为19665英镑,这其中包括患者在使用第一剂药物时的一次性观察费用502英镑。
总的来说,其治疗费用要比它最接近的竞争对手——Biogen公司生产的输液治疗药物Tysabri(natalizumab)便宜。
Gilenya在临床试验阶段给人留下了深刻印象,其中一项重要研究显示,与干扰素β‐1AIM相比,Gilenya使MS在1年内的复发率降低了52%。
但是,它确实会引发一些常见的、潜在性严重副作用,其中包括心脏节律不规则以及肠胃炎。
出于这些原因,诺华将被要求添加Gilenya的一项药物警戒。
Benlysta:将开展上市后评价2011年3月,葛兰素史克(GSK)与人类基因组科学(HGS)公司合作研发的狼疮治疗药物Benlysta在美国获批上市,但是从长远来看,如果它想继续留在市场上销售,将必须证明其具有安全记录。
Benlysta是FDA过去50多年来批准的第一只狼疮治疗新药,由于认识到该药可能将是这一疾病治疗领域取得的一大进步,FDA在对它的审批中运用了快速通道。
Benlysta(belimumab)可被用于患自身抗体阳性的系统性红斑狼疮(SLE)成年人的治疗。
狼疮是一种潜在致命性自身免疫性疾病,美国大约有30万~150万名患者,这一疾病更多地影响到女性特别是非洲裔美国妇女。
2011年1-10月美国FDA批准的新药

Institute IncBanzel 卢非酰胺Rufinamide 3 Eisai Inc Lennox-Gastaut综合征03/04硫酸阿巴卡韦硫酸阿巴卡韦片 5 CiplaLimited抗HIV药03/04拉米夫定/富马酸泰诺福韦酯拉米夫定/富马酸泰诺福韦酯片4 CiplaLimited抗HIV药03/04多西紫杉醇多西紫杉醇注射剂 5 Hospira Inc抗癌药03/08Benlysta 贝珠单抗Belimumab 生物药HumanGenomeSciencesInc.红斑狼疮药03/10Gadavist 钆布醇Gadobutrol 1 BayerHealthcarePharms中枢神经系统检查03/14Zyclara 咪喹莫特乳膏,3.75% 5 Graceway生殖器疣03/24Yervoy Ipilimumab全人源单克隆抗体易普利姆玛生物药BristolMyersSquibb晚期黑素瘤03/25Viramune Xr 奈韦拉平缓释片 3 BoehringerIngelheim抗HIV药03/25Horizant 加巴喷丁GabapentinEnacarbil1 Glaxosmithkline腿不宁症04/06Vandetanib 凡德他尼Vandetanib 1 Astrazeneca Pharma甲状腺髓样癌04/06Lotemax 依碳酸氯替泼诺眼膏 3 Bausch AndLomb白内障手术后炎症04/15Phoslyra 醋酸钙口服液 3 Fresenius钙剂04/19Duexis 布洛芬/法莫替丁片 4 HorizonPharma骨关节炎04/23Zytiga 醋酸阿比特龙Abiraterone Acetate1 CentocorOrthoBiotech Inc前列腺癌04/28Androgel 睾酮凝胶Abbott Labs睾酮不足04/29Tradjenta 利拉利汀Linagliptin 1 BoehringerIngelheim2型糖尿病05/02Docefrez 多西他赛 5 SunPharmaGlobal抗癌药05/03阿加曲班阿加曲班Argatroban 5 Sandoz 抗凝血药05/09硫酸阿巴卡韦/拉米夫定\ 5 CiplaLimited抗艾药05/12Victrelis 博普瑞韦Bocepr evir 1 Schering 慢性丙肝05/13Edurant 利匹韦林Rilpivirine 1 Tibotec 抗艾药05/20Incivek 特拉普韦Telaprevir 1 VertexPharms慢性丙肝05/23Dificid 非达霉素Fidaxomicin 1 OptimerPharma艰难梭菌感染腹泻05/27Zutripro 重酒石酸氢可酮、盐酸伪麻黄碱和马来酸氯苯那敏口服液4 CypressPharm 感冒06/08Rezira 重酒石酸氢可酮/盐酸伪麻黄碱口服液4 CypressPharm感冒06/08多西他赛多西他赛注射剂 5 AccordHlthcare Inc抗癌药06/08Potiga 依佐加滨Ezogabine 1 ValeantPharma癫痫部份性发作06/10注射用头孢他啶和葡萄糖注射液头孢他啶 5 B Braun抗感染药06/13Suprenza 盐酸芬特明分散片 3 CitiusPharma减肥药06/13Nulojix Belatacept 生物药BristolMyersSquibb肾移植排异06/15OXECTA 盐酸羟考酮/烟酸 5 KINGPHARMS止痛药06/17Rectiv 硝酸甘油乳膏 3 ProstrakanInc肛裂06/21Morphine Sulfate 硫酸吗啡口服液 3 Lannett止痛药06/23左旋甲状腺素钠左旋甲状腺素钠注射剂7 AppPharms黏液性水肿昏迷06/24阿加曲班阿加曲班 5 EaglePharma抗凝血药06/29多西他赛多西他赛注射剂 5 Sandoz抗癌药06/29Lazanda 芬太尼喷鼻剂 3 ArchimedesDev Ltd爆发性癌痛06/30硫酸可待因硫酸可待因口服液 5 Roxane止咳药06/30Arcapta 马来酸茚达特罗吸入剂 1 Novartis 慢性阻塞性肺病7月Indacaterol Maleate Pharms 1日Xarelto Rivaroxaban (利伐沙班)1 JohnsonAndJohnson预防手术静脉血栓7月1日Brilinta Ticagrelor (替卡格雷) 1 Astrazeneca Lp急性冠脉综合症7月20日Heparin Sodium 肝素钠注射剂 5 Pfizer Inc 抗凝血药7月21日Gemcitabine 吉西他滨注射剂\ Hospira Inc 抗癌药8月4日Rosuvastatin Zinc 瑞舒伐他汀锌片\ WatsonLabs Inc降脂药8月4日Complera 恩曲他滨/利匹韦林rilpivirine /替诺福韦酯片\ Gilead 抗艾药8月10日Zelboraf 维罗非尼Vemurafenib \ Hoffman-LaRoche黑素瘤8月17日Adcetris Brentuximab Vedotin生物药SeattleGenetics霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤8月19日Firazyr 醋酸艾替班特IcatibantAcetateShireOrphanTherapies遗传性血管性水肿8月25日Nucynta Er 他喷他多缓释片 3 JanssenPharms止痛药8月25日Xalkori Crizotinib克里唑蒂尼 1 Pfizer 非小细胞肺癌8月26日Pur-Wash 纯净水 5 NiagaraPharma Inc\ 9月1日拉米夫定; 富马酸替诺福韦酯; 奈韦拉平拉米夫定/富马酸替诺福韦酯/ 奈韦拉平片4 Matrix LabsLtd抗艾药9月8日拉米夫定; 齐多夫定拉米夫定/ 齐多夫定片 5 CiplaLimited抗艾药9月22日Fluoxetine 氟西汀片 3 EdgemontPharms抑郁症10/06Combivent 异丙托溴铵/沙丁胺醇 3 Boehringer 哮喘10/Drug: azilsartan medoxomil; azilsartan medoxomil; azilsartan kamedoxomil Patents International, June 10 2011DRUG INFORMATION:CAS® Registry Number:863031-21-4, azilsartan medoxomil863031-24-7, azilsartan kamedoxomilBrand Name:EDARBILaboratory Code:TAK 491Therapeutic Class:Angiotensin-II AntagonistsClinical Indications:cardiovascular diseasehypertensionPATENT INFORMATION:Patentee: Takeda (Japan)Parent Company: Takeda (Japan)Patent Type: ProductPatent Summary:The patent family listed here claims2-ethoxy-1-[2'-(5-oxo-4,5-dihydro-1,2,4-oxadiazol-3-yl)biphenyl-4-y l]methyl]-1H-benzimidazole carboxylate derivatives. Azilsartan medoxomil is specifically claimed. This family relates to the EDARBI formulations of azilsartan medoxomil.Expiration Comments:Application (2009)20250223Country Comments:Chinese application CN101381366 is a divisional of Chinese patentCN100503605 and claims azilsartan medoxomil specifically and a process by which it can be produced.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 290415Drug: azilsartan medoxomil; azilsartan medoxomil; azilsartan kamedoxomilPatents International, June 10 2011DRUG INFORMATION:CAS® Registry Number:863031-21-4, azilsartan medoxomil863031-24-7, azilsartan kamedoxomilBrand Name:EDARBILaboratory Code:TAK 491Therapeutic Class:Angiotensin-II AntagonistsClinical Indications:cardiovascular diseasehypertensionPATENT INFORMATION:Patentee: Takeda (Japan)Parent Company: Takeda (Japan)Patent Type: Product CN 100503605Patent Summary:The patent family listed here claims2-ethoxy-1-[2'-(5-oxo-4,5-dihydro-1,2,4-oxadiazol-3-yl)biphenyl-4-y l]methyl]-1H-benzimidazole carboxylate derivatives. Azilsartan medoxomil is specifically claimed. This family relates to the EDARBI formulations of azilsartan medoxomil.Expiration Comments:Granted (2009)20250223Country Comments:Chinese patent CN100503605 is based on WO2005080834 and claims azilsartan medoxomil specifically.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved. Dialog® File Number 447 Accession Number 212523Drug: rivaroxaban; rivaroxabanPatents International, July 15 2010DRUG INFORMATION:CAS® Registry Number:366789-02-8, rivaroxabanBrand Name:XARELTOLaboratory Code:BAY 597939BAY 59-7939Therapeutic Class:Other Antithrombotic AgentsClinical Indications:acute coronary syndromecardiovascular diseasecerebrovascular diseasedeep vein thrombosisperipheral vascular diseasepulmonary embolismstrokethrombosisPATENT INFORMATION:Patentee: Bayer (Germany)Parent Company: Bayer (Germany)Patent Type: Equivalent to productPatent Summary:The patent family listed here claims rivaroxaban specifically, processes for preparing the compound and uses for the prophylaxis and/or treatment of thromboembolic disorders and relates to the XARELTO formulations of rivaroxaban.Expiration Comments:Application (2007)20201211Country Comments:Chinese application CN1900074 is a divisional of Chinese patentCN1262551.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 237030Drug: rivaroxaban; rivaroxabanPatents International, July 15 2010DRUG INFORMATION:CAS® Registry Number:366789-02-8, rivaroxabanBrand Name:XARELTOLaboratory Code:BAY 597939BAY 59-7939Therapeutic Class:Other Antithrombotic AgentsClinical Indications:acute coronary syndromecardiovascular diseasecerebrovascular diseasedeep vein thrombosisperipheral vascular diseasepulmonary embolismstrokethrombosisPATENT INFORMATION:Patentee: Bayer (Germany)Parent Company: Bayer (Germany)Patent Type: Equivalent to product CN 100549008Patent Summary:The patent family listed here claims rivaroxaban specifically, processes for preparing the compound and uses for the prophylaxis and/or treatment of thromboembolic disorders and relates to the XARELTO formulations of rivaroxaban.Expiration Comments:Granted (2009)20201211Country Comments:Chinese patent CN100549008 is a divisional of Chinese patent CN1262551.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 237029Drug: rivaroxaban; rivaroxabanPatents International, July 15 2010DRUG INFORMATION:CAS® Registry Number:366789-02-8, rivaroxabanBrand Name:XARELTOLaboratory Code:BAY 597939BAY 59-7939Therapeutic Class:Other Antithrombotic AgentsClinical Indications:acute coronary syndromecardiovascular diseasecerebrovascular diseasedeep vein thrombosisperipheral vascular diseasepulmonary embolismstrokethrombosisPATENT INFORMATION:Patentee: Bayer (Germany)Parent Company: Bayer (Germany)Patent Type: Product CN 1262551Patent Summary:The patent family listed here claims rivaroxaban specifically, processes for preparing the compound and uses for the prophylaxis and/or treatment of thromboembolic disorders and relates to the XARELTO formulations of rivaroxaban.Expiration Comments:Granted (2006)20201211Country Comments:Chinese patent CN1262551 is based on WO0147919. IMS Patent Focus© 2011 IMS Health & Affiliates. All right s reserved. Dialog® File Number 447 Accession Number 180615Drug Name(s) XALKORI (Brand Name Drug) FDA Application No. (NDA) 202570 Active Ingredient(s) CRIZOTINIBCompanyPFIZEROriginal Approval or Tentative Approval DateAugust 26, 2011 Chemical Type1 New molecular entity (NME) Review Classification P Priority review drugProducts on Application (NDA) #202570Click on a column header to re-sort the table:Drug: crizotinib; crizotinibPatents International, October 14 2011DRUG INFORMATION:CAS® Registry Number:877399-52-5, crizotinibBrand Name:XALKORILaboratory Code:PF 2341066PF 02341066Therapeutic Class:Antineoplastic Protein Kinase InhibitorsClinical Indications:cancerlung cancerNSCLCsolid tumorPATENT INFORMATION:Patentee: Pfizer (Algeria)Parent Company: Pfizer (USA)Patent Type: ProductPatent Summary:The patent family listed here claims crizotinib specifically as product.Expiration Comments:Application (2007)20250815Country Comments:Chinese application CN101018780 is based on WO2006021881 and claims crizotinib specifically as product.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 346268Drug: crizotinib; crizotinibPatents International, October 10 2011DRUG INFORMATION:CAS® Registry Number:877399-52-5, crizotinibBrand Name:XALKORILaboratory Code:PF 2341066PF 02341066Therapeutic Class:Antineoplastic Protein Kinase InhibitorsClinical Indications:cancerlung cancerNSCLCsolid tumorPATENT INFORMATION:Patentee: SUGEN (USA)Parent Company: Pfizer (USA)Patent Type: ProductPatent Summary:The patent family listed here claims crizotinib generically as product and relates to the XALKORI formulations of crizotinib.Expiration Comments:Application (2006)20240226Country Comments:Chinese application CN1777427 is based on WO2004076412 and claims crizotinib generically as product.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 345376Drug: crizotinib; crizotinibPatents International, October 03 2011DRUG INFORMATION:CAS® Registry Number:877399-52-5, crizotinibBrand Name:XALKORILaboratory Code:PF 2341066PF 02341066Therapeutic Class:Antineoplastic Protein Kinase InhibitorsClinical Indications:cancerlung cancerNSCLCsolid tumorPATENT INFORMATION:Patentee: Agouron (USA)Parent Company: Pfizer (USA)Patent Type: Product CN 101023064Patent Summary:The patent family listed here claims crizotinib specifically as product and relates to the XALKORI formulations of crizotinib.Expiration Comments:Granted (2011)20250815Country Comments:Chinese patent CN101023064 is based on WO2006021884 and claims crizotinib specifically as product.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 345397Drug Name(s)DIFICID (Brand Name Drug)FDA Application No.(NDA) 201699Active Ingredient(s)FIDAXOMICINCompany OPTIMER PHARMSOriginal Approval or Tentative ApprovalMay 27, 2011DateChemical Type 1 New molecular entity (NME) Review Classification P Priority review drugProducts on Application (NDA) #201699Click on a column header to re-sort the table:Drug: difimicin; tiacumicin B; fidaxomicin; fidaxomicinPatents International, September 01 2011DRUG INFORMATION:CAS® Registry Number:873857-62-6, fidaxomicinBrand Name:DIFICIDLaboratory Code:PAR 101OPT 80Therapeutic Class:Intestinal Anti-infective AntidiarrhoealsClinical Indications:bacterial infectionPATENT INFORMATION:Patentee: Optimer (USA)Parent Company: Par (USA)Patent Type: Product US 7906489Patent Summary:The patent family listed here claims a polymorphic form of fidaxomicin and a method of treating diarrhea caused by Clostridium difficile by orally administering fidaxomicin. This family relates to the DIFICID formulation of fidaxomicin.Expiration Comments:Granted (2011)20270304Country Comments:US patent US7906489 claims a method of treating diarrhea caused by Clostridium difficile gastrointestinal infection in a human patient, comprising orally administering a therapeutically effective amount of fidaxomicin, or a pharmaceutically acceptable salt, combined with one or more pharmaceutically acceptable carriers. The fidaxomicin is greater than 90% by weight stereomerically pure. The term of US patent US7906489 has been extended/adjusted by 762 days under 35 U.S.C.154(b). As a result the estimated expiry date of US patent US7906489 has been reset to 4 March 2027 from 31 January 2025. US patent US7906489 is quoted by the FDA Orange Book as relating to the DIFICID oral tablet formulation of fidaxomicin for the treatment of microbial infections. The applicant is Optimer. US marketing exclusivity for fidaxomicin as a new chemical entity expires on 27 May 2016.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 343067Drug: difimicin; tiacumicin B; fidaxomicin; fidaxomicinPatents International, September 01 2011DRUG INFORMATION:CAS® Registry Number:873857-62-6, fidaxomicinBrand Name:DIFICIDLaboratory Code:PAR 101OPT 80Therapeutic Class:Intestinal Anti-infective AntidiarrhoealsClinical Indications:bacterial infectionPATENT INFORMATION:Patentee: Optimer (USA)Parent Company: Par (USA)Patent Type: Product US 7378508Patent Summary:The patent family listed here claims a polymorphic form of fidaxomicin and a method of treating diarrhea caused by Clostridium difficile byorally administering fidaxomicin. This family relates to the DIFICID formulation of fidaxomicin.Expiration Comments:Granted (2008)20270731Country Comments:US patent US7378508 claims a polymorphic form of fidaxomicin, characterized by a powder x-ray diffraction pattern and by differential scanning calorimetry. US patent US7378508 is quoted by the FDA Orange Book as relating to the DIFICID oral tablet formulation of fidaxomicin. The applicant is Optimer. US marketing exclusivity for fidaxomicin as a new chemical entity expires on 27 May 2016.IMS Patent Focus© 2011 IMS Health & Affiliates. All rights reserved.Dialog® File Number 447 Accession Number 343065Drug Name(s) NEURONTIN (Brand Name Drug) FDA Application No. (NDA) 020235 Active Ingredient(s) GABAPENTINCompanyPFIZER PHARMSOriginal Approval or Tentative Approval DateDecember 30, 1993 Chemical Type1 New molecular entity (NME) Review Classification P Priority review drugProducts on Application (NDA) #020235Click on a column header to re-sort the table:Xenoport 公司是一家以基于前药的转运载体为基础的小型技术公司。
2011年美国FDA批准新药

学报Journal of China Pharmaceutical University第43卷(16):8109-8115.[37]Jones P.Development of poly(ADP-ribose)polymerase(PARP)inhibitors in oncology[J].Annu Rep Med Chem,2010,45:229-243.[38]Salmena L,Carracedo A,Pandolfi PP.Tenets of PTEN tumor sup-pression[J].Cell,2008,133(3):403-414.[39]Mendes-Pereira AM,Martin SA,Brough R,et al.Synthetic lethal targeting of PTEN mutant cells with PARP inhibitors[J].EMBOMol Med,2009,1(6/7):315-322.[40]Shaheen M,Allen C,Nickoloff JA,et al.Synthetic lethality:exploiting the addiction of cancer to DNA repair[J].Blood,2011,117(23):6074-6082.[41]Guha M.PARP inhibitors stumble in breast cancer[J].Nat Biotechnol,2011,29(5):373-374.[42]Gelmon KA,Tischkowitz M,Mackay H,et al.Olaparib in patients with recurrent high-grade serous or poorly differentiated ovariancarcinoma or triple-negative breast cancer:a phase2,multicentre,open-label,non-randomised study[J].Lancet Oncol,2011,12(9):852-861.211第2期胡昆等:刺芒柄花素氮芥衍生物的合成及抗肿瘤活性总之,通过在刺芒柄花素的3'位引入氮芥确实增强了刺芒柄花素的体外抗肿瘤活性。
25个正在研发中的糖尿病药物

25个正在研发中的糖尿病药物2012/12/06 生物探索糖尿病导读过去30年,糖尿病发病率呈逐年上升趋势,而在今后十年,随着人口老龄化、肥胖化,糖尿病患者还将如海啸般涌来。
这对社会来说是一个沉重的负担,但是对药企来说,也是一个巨大的市场。
GEN列出了25个正在研发中的糖尿病药物,多为跨国公司研发,它们有望遏制住糖尿病“汹涌”的势头。
如果把糖尿病比作是一只股票,那它一定是一只大牛股:美国CDC表示,在过去30年里,诊断出患有糖尿病的患者数量从1980年的560万增长到了2010年的2090万,增长率373%。
那么,在这种情况下,有哪些即将出来的新药能够击溃糖尿病目前“繁荣”的局面呢?GEN列出了一份25个糖尿病候选药物清单,这些药物都至少有一个已经提交或被批准的适应症,这些适应症已经到达临床三期试验或者注册审批阶段。
列出的每一个药物里,都包含药物名称、药物研发机构、药物适应症、药物作用机制、药物所处的阶段等信息。
有些药物在获得上市许可后还在为开发新适应症或新剂型做临床试验,这些信息也都列在药物说明的后面。
名词解释NDA:New Drug Application,新药上市申请。
是指向美国食品药品监督管理局(FDA)申报新药上市申请。
MAA:Marketing Authorization Application,上市许可申请。
是指向欧洲药品管理局(EMA)申报新药上市许可申请。
BLA:Biologic License Application,生物制品许可申请。
指向美国食品药品监督管理局(FDA)申报生物制品许可申请。
CHMP:Committee for Medicinal Products for Human Use,欧洲药品管理局人用医药产品委员会。
FDC:Fixed-dose combination,固定剂量复合剂。
是指在同一片剂内混合两种或更多种药物制成的一种复方制剂形式。
正在研发中的25个具有潜力的糖尿病候选药物如下:1、Albiglutide (前身为Syncria)研发机构:人类基因组学公司(现已被葛兰素史克收购)作用机制:胰高血糖素样肽1(GLP-1)受体激动剂适应症(所处阶段):每周一次,治疗2型糖尿病(临床三期试验结束,预计2013年年初提交NDA)2、Alogliptin (Nesina®)研发机构:武田制药、Furiex制药作用机制:DPP-4抑制剂适应症(所处阶段):美国——口服治疗2型糖尿病,单独服用或与噻唑烷二酮吡格列酮一起作为FDC (注册;2012年4月首次提交NDA遭拒,随后于2012年7月重新提交。
和FDA批准新药简介

阿西钠平 asenapine
商品名:
Saphris
公司
上市公司:先灵葆雅Schering-Plough 给药方式:舌下片
适应症:为非典型抗精神病药适用于:1.精神分裂成
年的急性治疗。2.中急性躁狂或混合发作伴有双相I型障 碍成年的急性治疗。
特点:属二苯并氧杂卓并吡咯类,非典型精神病药。
ecallantide (DX-88)
患者。
特点:叶酸类似物代谢性抑制剂。孤儿药物。
贝西沙星 besifloxacin
商品名:
Besivance & Lomb
上市公司:Bausch
给药方式:混悬滴眼液 适应症:治疗细菌性结膜炎,常称为“红眼病”。 特点:
0.6%贝西沙星混悬滴眼液是喹诺酮类抗菌药。
泰拉万星 telavancin
苯甲醇 benzyl alcohol
OH
商品名:
Ulesfia Pharma有限公司
上市公司:Sciele
给药方式:5%苯甲醇洗液 适应症:灭虱剂洗液适用于6月龄以上患者头虱局部治
疗。
特点:首个无毒性、无杀虫剂治头虱剂,本品关闭虱
子气孔(精密呼吸器)预防头虱,使头虱窒息死亡。
复方蒿甲醚 (蒿甲醚和本芴醇)
2009年和2010年FDA批准上市新药
樊后兴 2011年2月6日
2009年批准新药
新分子实体20个
上市新药37个
新生物制品8个
新疫苗9个
普拉格雷 Prasugrel
O
O N S F HCl
商品名:Effient 上市公司:Daiichi Sankyo 和礼来 给药方式:口服
O
适应症:用于急性冠状动脉综合症患者经皮冠状介入治 疗后减少血栓性心血管时间的发生(包括支架血栓形成), 即不稳定性心绞痛或非ST段抬高心肌梗死,ST段抬高心 肌梗死初期或延迟PCI处理患者。
2011-FDA批准的新药

2011∙FDA approved asparaginase Erwinia chrysanthemi [Erwinaze, injection, EUSA Pharma (USA), Inc.] as a component of a multi-agent chemotherapeutic regimen for the treatment of patients with acute lymphoblastic leukemia (ALL) who have developed hypersensitivity to E. coli-derived asparaginase. More Information2 (November 18, 2011)∙FDA approved ruxolitinib (Jakafi oral tablets, Incyte Corporation) for the treatment of intermediate and high risk myelofibrosis,including primary myelofibrosis, post-polycythemia veramyelofibrosis and post-essential thrombocythemia myelofibrosis.Results of two randomized controlled trials in patients withintermediate or high risk myelofibrosis comparing ruxolitinib to placebo (Study 1) or to best available therapy (Study 2) were the basis of approval. More Information3 (November 16, 2011) ∙FDA approved cetuximab (Erbitux, ImClone LLC, a wholly-owned subsidiary of Eli-Lilly and Company) in combination withplatinum-based therapy plus 5-florouracil (5-FU) for thefirst-line treatment of patients with recurrent locoregionaldisease and/or metastatic squamous cell carcinoma of the head and neck (SCCHN). More Information4 (November 7, 2011) ∙FDA granted accelerated approval to deferiprone (Ferriprox Tablets, ApoPharma, Inc.), an oral iron chelator for the treatment ofpatients with transfusional iron overload due to thalassemiasyndromes when current chelation therapy is inadequate. MoreInformation5 (October 14, 2011)∙Changes in bevacizumab (Avastin, Genentech, Inc.) package insert regarding: risk of ovarian failure, osteonecrosis of the jaw, risk of venous thromboembolic event (VTE) and bleeding in patientsreceiving anticoagulation therapy after first VTE event. MoreInformation6 (September 30, 2011)∙FDA granted accelerated approval for the use of eculizumab (Soliris, Alexion, Inc.) for the treatment of pediatric and adult patients with atypical hemolytic uremic syndrome (aHUS). More Information7(September 23, 2011)∙FDA granted approval for denosumab (Prolia, Amgen Inc.) as a treatment to increase bone mass in patients at high risk forfracture receiving androgen deprivation therapy (ADT) fornonmetastatic prostate cancer or adjuvant aromatase inhibitor (AI) therapy for breast cancer. In men with nonmetastatic prostatecancer, denosumab also reduced the incidence of vertebral fracture.More Information8 (September 16, 2011)∙FDA granted accelerated approval to granted accelerated approval to crizotinib (XALKORI Capsules, Pfizer Inc.) for the treatment of patients with locally advanced or metastatic non-small cell lung cancer (NSCLC) that is anaplastic lymphoma kinase (ALK)-positive as detected by an FDA-approved test. The FDA approved the Vysis ALK Break-Apart FISH Probe Kit (Abbott Molecular, Inc.) concurrently with the crizotinib approval. This companion diagnostic test is designed to detect rearrangements of the anaplastic lymphoma kinase (ALK) gene in NSCLC. More Information9 (August 26, 2011)∙FDA granted accelerated approval to brentuximab vedotin (Adcetris for Injection, Seattle Genetics, Inc.) for two indications: (1) treatment of patients with Hodgkin lymphoma after failure ofautologous stem cell transplant (ASCT) or after failure of at least two prior multi-agent chemotherapy regimens in patients who are not ASCT candidates and (2) treatment of patients with systemicanaplastic large cell lymphoma (ALCL) after failure of at least one prior multi-agent chemotherapy regimen. More Information10(August 19, 2011)∙FDA approved vemurafenib tablets (ZELBORAF, Hoffmann-La Roche Inc.) for the treatment of patients with unresectable or metastatic melanoma with the BRAF V600E mutation as detected by an FDA-approved test. More Information11 (August 17, 2011)∙FDA approved sunitinib (Sutent Capsules, Pfizer, Inc.) for the treatment of progressive, well-differentiated pancreaticneuroendocrine tumors (pNET) in patients with unresectable,locally advanced, or metastatic disease. More Information12(May 20, 2011)∙FDA approved everolimus (Afinitor Tablets, Novartis Pharmaceuticals Corporation), for the treatment of progressive neuroendocrine tumors of pancreatic origin (PNET) in patients with unresectable, locally advanced or metastatic disease. The safety and effectiveness of everolimus in the treatment of patients with carcinoid tumors have not been established. More Information13(May 5, 2011)∙FDA approved abiraterone acetate (Zytiga Tablets, Centocor Ortho Biotech, Inc.) for use in combination with prednisone for the treatment of patients with metastatic castration-resistantprostate cancer (mCRPC) who have received prior chemotherapycontaining docetaxel. More Information14 (April 28, 2011)∙FDA approved vandetanib tablets (Vandetanib Tablets, AstraZeneca Pharmaceuticals LP), a kinase inhibitor, for the treatment of symptomatic or progressive medullary thyroid cancer in patients with unresectable, locally advanced, or metastatic disease. The use of vandetanib in patients with indolent, asymptomatic or slowlyprogressing disease should be carefully considered because of the treatment-related risks of vandetanib. More Information15(April 6, 2011)∙FDA approved peginterferon alfa-2b (Sylatron, Schering Corporation, Kenilworth, NJ 07033), for the treatment of patients with melanoma with microscopic or gross nodal involvement within 84 days of definitive surgical resection including complete lymphadenectomy.More Information16 (March 29, 2011)∙FDA approved ipilimumab injection (YERVOY, Bristol-Myers Squibb Company) for the treatment of unresectable or metastatic melanoma.More Information17. (March 25, 2011)∙FDA approved rituximab (Rituxan, Genentech, Inc) for maintenance therapy for patients with previously untreated follicular, CD-20 positive, B-cell non-Hodgkin lymphoma who achieve a response to rituximab in combination with chemotherapy. More Information18(January 28, 2011)。
2011年出现的4个一类新药

2011年出现的4个一类新药2011年是“十二五”的开局之年,“十二五”期间,我国将加大对创新药物的研发投入。
据获悉,中央财政将对“重大新药创制”下拨资金100亿元,配套资金300亿元。
根据《“十二五”计划2012年新增课题申报指南》中的部署,创新药物的研究开发主要针对恶性肿瘤、心脑血管疾病、神经退行性疾病、糖尿病、精神性疾病、自身免疫性疾病、耐药性病原菌感染、肺结核、病毒感染性疾病,以及其他严重危害人民健康的多发病和常见病等10类(种)重大疾病。
其中,由贝达药业自主研发的靶向抗肿瘤药凯美纳的面世,更是被业界堪比医药界的“两弹一星”。
其他一类新药还有先声药业的艾得辛、恒瑞医药的恒扬,生物制品的1类新药是天士力药业的心血管药物注射用重组人尿激酶原。
先声药业的艾得辛是全球第一个上市的艾拉莫德制剂,也是一个全新结构类型的DMARDS(Disease Modifying Anti-rheumatic Drugs)药物,其主要适应症为活动性类风湿性关节炎。
先声药业董事长任晋生先生表示:“国家一类新药艾得辛的上市将会让中国数百万长期受到类风湿性关节炎困扰的患者获得更高质量治疗的机会,为中国临床医生提供了新的更有效的治疗手段。
先声药业一直以来把通过持续创新为患者寻求更有效的药物作为使命,因此一类新药艾得辛的上市也是先声药业药物创新之路的一次重大突破。
”同时,先声药业获得了原料药的审批。
目前艾拉莫德在国内唯一经审批的生产厂家为先声药业风湿类药物的另一个一类新药是恒瑞医药研制的艾瑞昔布片(商品名:恒扬)。
艾瑞昔布是新一代非甾体抗炎类创新药,主要用于缓解骨关节炎的疼痛症状。
恒瑞医药将立即着手安排生产,并集中力量加大市场推广力度,根据艾瑞昔布这一新品种的特点,创新营销模式,加强学术推广,引导新需求,开拓新市场,努力使艾瑞昔布尽早发挥效益。
“艾瑞昔布”的获批上市,标志着公司新药研究由“仿制”向“创新”的重大转变。
恒瑞医药同时获得了原料药的审批,目前艾瑞昔布在国内唯一经审批的生产厂家为恒瑞医药。
2000-2012FDA历年批准产品

慢性髓细胞性白血病 显像剂 复发型多发性硬化症
结肠直肠癌
症状性玻璃体黄斑粘连 癫痫
慢性粒细胞性白血病
类风湿性关节炎(RA) 转移甲状腺髓样癌(MTC) 吸入性炭疽病 慢性粒性白血病 库欣氏病 短肠综合征 高胆固醇血症 非瓣膜性房颤患者缺血性中 风及全身性栓塞的预防 艾滋病并发的痢疾 肺结核
Neohaler 4. Ardovax 5. Benlysta 6. Brilinta 7. Caperlsa 8. Corifact 9. Daliresp 10. Datscan 11. Dificid 12. Edarbi 13. Edurant 14. Firazyr 15. Gadavist 16. Horizant 17. Incivek 18. Laviv 19. Natroba 20. Nulojix 21. Potiga 22. Spherusol 23. Tradjenta 24. Victrelis 25. Viibryd 26. Xalkori 27. Xarelto 28. Yervoy 29. Zelboraf 30. Eylea 31. Erwinaze 32. Erwinaze 33. Ferriprox 34. Jakafi 35. Onfi
1.Voraxaze 2.Picato 3.Inlyta 阿西替尼 4.Erivedge 5.Kalydeco 6.Zioptan 7.Surfaxin
8.Omontys 9.AMYVID 10.Strendra 11.Elelyso 12.Perjeta 13.Belviq 14.Myrbetriq 15.Prepoprik 16.Kyprolis 17.Tudorza Pressair
2011年FDA上半年批准20个新药

2011年FDA上半年批准20个新药2005年FDA批准新药数量严重下滑之后,到2010年一直处于低谷。
据统计,2005年FDA批准的新药数量为20个,比2004年少了14个。
2006年批准数量为18个,2007年为17个,达历史最低,2008年为24个,2009年为25个,2010年21个。
持续6年的低迷之后,在2011年制药行业新药研发终于有了复苏的迹象。
截至2011年7月底,FDA批准了20个新药。
这一令人鼓舞的转变,得益于制药公司改变了新药研发策略,从已知有良好治疗效果的me-too药物聚焦到了未知全新治疗领域药物的开发。
也许正是这样的勇气,让了无生机的制药行业有了久逢甘露的喜悦。
上半年新药超去年同期据美联社报道,FDA药品研究与评价部(CDER)主任Janet Woodcock日前在FDA 的新闻发布会上说:“我们看到的创新数不胜数,根本就记不过来。
”根据FDA的报告,今年前两季度已经批准的“新分子实体”数量已和去年全年水平相当。
与临床上已有的药品相比,这些药物在作用机制或治疗效果上都具有明显优势。
最近FDA 批准了首个可延长晚期黑素瘤(一种致死性皮肤癌)患者生存期的药物,以及50年来批准的首个治疗狼疮的药物。
此外还批准了治疗效果明显优于现有治疗药物的2个丙肝药物。
Janent Woodcock 指出,药物研发当下正处在“转折点”。
她补充解释道:“如果你是一位得了癌症或其它严重疾病的患者,看到这些新药获批备受鼓舞。
”现有新药的研发速度及批准数量已不能满足制药公司的需求。
因为制药巨头们的畅销药物正在逐一失去专利保护,其中包括排名第一的辉瑞的降胆固醇药阿托伐他汀钙(立普妥)。
该药将于今年11月失去专利保护。
据预测,到2015年辉瑞将因仿制药竞争,损失累计达1000亿美元。
这些新药品种并不能扭转“专利悬崖”所带来的冲击,但能起到缓冲作用。
根据Credit Suisse分析师Catherine Arnold预计:未来3年,将有20多个年销售额有望达到甚至超过10亿美元的创新性新药获得FDA批准(见下表)。
2011年FDA批准上市新药及全球新药研究最新进展_陈玲

与聚乙二醇化盐酸多柔比星脂质体 ( PLDH ) 联合应 用, 用于以铂类为主的治疗 6 个月后复发的卵巢癌。 2009 年 10 月, 欧洲药品管理局批准 trabectedin 在欧盟上市, 用于治疗复发性卵巢癌。 此前的 7 月 美国 FDA 就同一适应症驳回了 trabectedin, 并举出 了对不良反应和证据不足的担忧。 由于 trabectedin 生产商未提交任何在复发性卵巢癌患者中直接比较 trabectedin + PLDH 治疗方案与以铂类为主的化疗 方案的证据, 而只是将 trabectedin + PLDH 治疗方案 与不含铂的用药方案进行了比较, 因此英国国家健 康与临床优化研究所 ( NICE ) 评审员对此药亦尚存 有顾虑。2011 年 4 月 NICE 就复发性卵巢癌这一适 应症对本品做出最终裁决, 称不推荐使用本品。 1. 6 转移性软组织或骨肉瘤治疗药 2011 年 6 月默沙东和 Ariad 制药公司最新公布 表1
[2 ] 快速进 展 或 疾 病 负 荷 大 的 患 者 。 而 随 着 vemurafenib 的获准上市, 这些问题或将迎刃而解。 由于
这是第 1 个对间变性淋巴瘤激酶( ALK) 进行靶向治 疗的药品, 用于治疗通过 FDA 批准的检测确认为 ALK 阳 性 的 晚 期 或 转 移 性 的 非 小 细 胞 肺 癌 ( NSCLC ) 。ALK 基因变异被认为是 NSCLC 等癌症 发生的关键驱动因素。 ALK 在非鳞状细胞癌、 无吸 烟史或轻度吸烟史患者中较为常见, 但也在吸烟和 鳞状细胞癌组织患者中也有发现 。 crizotinib 是 FDA 6 年多来批准的第 1 个治疗肺 癌的新药, 表明 NSCLC 治疗模式正在发生转变, 有 望为肺癌个体化治疗开创新局面 。 1. 4 髓样甲状腺癌治疗药 2011 年 4 月 6 日, 阿斯利康公司的 vandetanib ( 凡德他尼, 商品名: Zactima ) 在美国获准用于治疗 不能手术、 局部晚期或转移的有症状或进展的髓样 MTC ) , 甲状腺癌 ( medullary thyroid carcinoma, 成为 第一个批准治疗髓样甲状腺癌药物 。 vandetanib 是口服的小分子多靶点酪氨酸激酶 抑制剂( TKI) , 每日给药 1 次, 其选择性地靶向参与 肿瘤扩散和生长的关键细胞信号传导途径 , 包括血 管内皮生长因子受体( VEGFR) 和表皮生长因子受体 ( EGFR) 。此外, 它还抑制驱动某些肿瘤生长和存活 并据信对 mtc 通路有重要意义的 RET 激酶 1. 5 卵巢癌治疗药
2010及2011年FDA批准新药
collagenase clostridium histolyticum
Auxilium Pharm.
A proteolytic enzyme for treatment of Dupuytren's contracture (a progressive hand disease which affects connective tissue in the palm of the hand).
用于8岁及以上儿童的迟发性庞贝氏症
Menveo
meningococcal vaccine
Novartis
A vaccine to prevent meningococcal disease caused byNeisseria meningitidisserogroups A, C, Y, and W-135 inpersons 11 to 55 years of age.
治疗颈部肌张力障碍和睑痉挛
Xgeva
denosumab
狄诺塞麦
Amgen
More concentrated formulation ofProliato prevent fracture/pain associated with bone metastases.
用于预防实体瘤骨转移患者的骨骼相关事件
提高多发性硬化症患者的步度
Asclera
polidocanol
聚多卡醇注射剂
BioForm Medical
An injectable agent for small varicose veins (spider veins and reticular veins)
治疗小血管静脉曲张
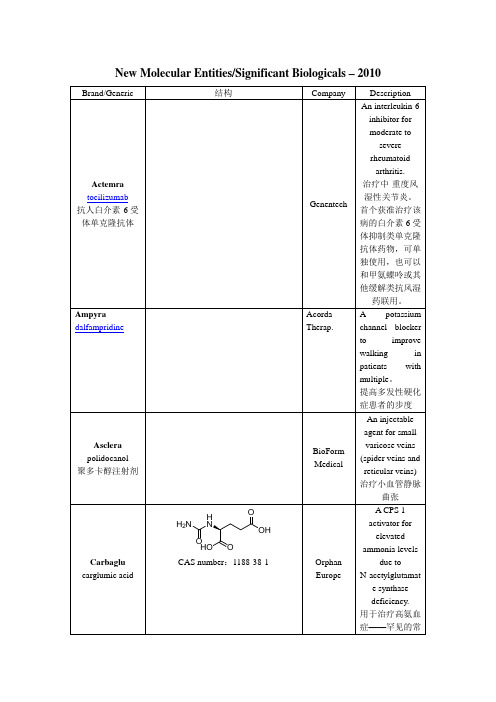
Carbaglu
2011年FDA批准上市的新药

2011年FDA批准上市的新药:阿齐沙坦(Azilsartan)众所周知,新世纪以来,全世界大约有75万美国人(将近三分之一的成年人)和近10亿人有高血压。
到2025年,这一数字预计将增加至15亿美元。
而且风险随着年龄的增长而增加,超过60岁的人50%都会受到影响。
最近,美国心脏协会估计,高血压的直接和间接成本总额每一年超过93.5亿元。
而且心血管疾病和中风患者所花费的费用占个人每年的卫生支出总额的17%。
(1)面对这种状况,全球对高血压药物的研究也是投入了很多的时间与金钱。
目前,高血压药物主要分为以下几类:ACEI、ARB、钙拮抗剂、b受体阻断剂,以及由上述药物组成的固定配比的复方制剂。
此外,直接血管扩张药、肾素抑制剂。
而且,通过阻断ATII效应降低血压,现已广泛用于临床,主要用于临床高血压及其他心肾疾病的治疗。
其中,ARB类降压药的主要代表药物为氯沙坦、缬沙坦、坎地沙坦等。
沙坦类药物在国外已较广泛用于临床高血压病及其他心肾疾病的防治。
沙坦类抗高血压药物的最新代表药物就是:2011年美国FDA批准上市由日本武田制药公司(Takeda)所研发的前体药物阿齐沙坦(又称阿齐沙坦酯,Azilsartan),该药物为一种血管紧张素II受体拮抗剂,可单独使用或与其它降压药一起使用,被视作坎地沙坦酯的下一代产品。
至从1976年我们发现了一个血管紧张素II受体:1-苄基咪唑-5-乙酸衍生物,它的作用虽然弱,但是有较好的选择性。
但是若要与受体发生较好的亲和性,还须按照底物分子的结构构象进行改造。
按照这种想法,我们经过改造得到了一系列联苯四唑类化合物,并从中寻找到了可以口服、选择性高的药物氯沙坦,其钾盐也于1995年首次被美国FDA批准上市。
而且losartan的成功问世,为开发新一代抗压药提供了一条新的很好的路子,已先后有数个沙坦类药物相继上市。
以下就是代表药物losartan的构效关系以及2011年美国FDA批准上市由日本武田制药公司(Takeda)所研发的前体药物阿齐沙坦(azilsartan):也就是根据这种信息,专家开始开发一个通用相当于azilsartan酯合成的,但只有非常有限的信息是可用的。
2011年上半年美国FDA批准新药(续)

2011年上半年美国FDA批准新药(续)5.2波塞瑞韦胶囊由merck公司开发,2011年5月13日获得fda批准,用于联合聚乙二醇化α-干扰素(peginterferon alfa)和利巴韦林(ribavirin)方案治疗≥18岁成人无既往治疗史或已经既往α-干扰素(interferon alfa)和利巴韦林方案治疗失败的呈代偿性肝病、包括已伴肝硬化的基因型为1的慢性丙型肝炎(chc)患者。
波塞瑞韦具有新型作用机制,属丙型肝炎病毒(hcv)非结构蛋白(ns)3/4a丝氨酸蛋白酶抑制剂,系经抑制这一关键的病毒酶而干扰hcv复制、最终呈现抗hcv效力的。
因此,波塞瑞韦亦被称为“直接作用抗病毒药物”。
相比之下,现chc标准治疗药物聚乙二醇化α-干扰素-利巴韦林方案是主要通过增强机体对病毒的天然免疫应答而呈现抗病毒效力的。
不过,该标准治疗方案治疗基因型1的chc时仅能使约40%的患者达到持续病毒学应答,但加用波塞瑞韦后可提高50%以上的持续病毒学应答率。
波塞瑞韦的剂量规格为200 mg/粒,推荐给药方案是每日3次、每次随餐口服800 mg。
fda是主要依据两项合计包括近1 500例成人基因型为1的chc 患者的大型、国际性ⅲ期多中心临床试验数据作出上述波塞瑞韦批准决定的。
这两项试验代号分别为以已经既往治疗失败(包括复发和部分应答者,但排除完全无应答者)患者为对象的hcv respond-2研究和以无既往治疗史患者为对象的hcv sprint-2研究,目的都是评价在聚乙二醇化α-干扰素-利巴韦林标准治疗方案中加用波塞瑞韦能否改善患者的持续病毒学应答率和缩短总治疗期的可能性。
在这两项关键试验中,所有患者均先接受由聚乙二醇化α2b-干扰素(每周1.5 μg/kg)和利巴韦林研究剂量(600~1 400 mg/d)组成的联合方案的4周引导期治疗,然后治疗组患者再开始加用波塞瑞韦(每日3次、每次800 mg)治疗。
2011年FDA批准药物

2011年FDA批准上市的药物名录28个(杭州李晓龙整理)2013.03.15序号英文名中文名CAS 适应症1、抗肿瘤1 乙酸阿比特龙酯154229-18-2 前列腺癌2 Brentuximab vedotin 914088-09-8 淋巴瘤3 克里唑替尼877399-52-5 晚期肺癌4 eribulin me-sylate 甲磺酸艾日布林441045-17-6 晚期乳腺癌116366 黑色素瘤5 维罗非尼918504-65-1 黑色素瘤6 凡德他尼443913-73-3 甲状腺样癌2、抗感染7 ImmunoglobulinG1 356547-88-1 红斑狼疮8 伯克匹韦394730-60-0 丙肝9 229016-73-3 细菌性肺炎10 非达霉素873857-62-6 腹泻11 RILPIVIRINE HCL利匹韦林700361-47-3 艾滋12 特拉匹韦402957-28-2 慢性丙肝3、神经系统及精神药物13 瑞替加滨二盐酸盐150812-13-8 癫痫辅助14 钆布醇138071-82-6 造影剂15 鲁拉西酮367514-87-2 精神分裂16 Ioflupane 碘氟潘155798-07-5 脑成像诊断17 盐酸维拉唑酮163521-08-2 重度抑郁4、心血管18 阿齐沙坦酯863031-21-4 高血压19 达比加群酯211915-06-9 预防中风20 替卡格雷274693-27-5 降低急性动脉综合征5、呼吸系统药物21 茚达特罗312753-06-3 阻塞性肺病22 罗氟司特162401-32-3 严重COPD发作6、其他药物23 belatacept 706808-37-9 肾排异、蝎螯伤24 Gabapentin enacarbil 478296-72-9 不宁腿综合症25 艾替班特130308-48-4 血管水肿26 Linagliptin 利拉利汀668270-12-0 2型糖尿病27 Rivaroxaban 利伐沙班366789-02-8 术后血栓28Tesamorelin 多杀菌素替莫瑞林131929-60-7218949-48-5先前凝血因子缺乏。
2011年美国FDA批准药物简介

2011年美国FDA批准药物简介王春晖; 王达妹【期刊名称】《《上海医药》》【年(卷),期】2012(033)007【总页数】7页(P46-52)【作者】王春晖; 王达妹【作者单位】复旦大学附属中山医院上海 200032【正文语种】中文【中图分类】R972011年,美国FDA批准了24个新分子实体和9个新生物制剂(表1),其中包括心血管系统用药1个、影响血液及造血系统用药5个、抗肿瘤药物8个、抗感染药物5个、神经系统和精神用药4个、呼吸系统用药2个、免疫系统用药3个、内分泌和代谢系统用药1个、造影剂与诊断药物2个、眼科用药1个和外科用药1个。
其中一些新药具有首创性、突破性:利伐沙班是FDA批准的第一个口服静脉血栓预防药物;凡德他尼是FDA批准的第一个甲状腺髓样癌治疗药物;布兰图单抗维多汀是FDA批准的第一个系统型变性大细胞淋巴瘤治疗药物和自1977年以来批准的第一个霍奇金淋巴瘤治疗药物;鲁索利替尼是FDA批准的第一个骨髓纤维化治疗药物;波塞普韦是FDA批准的第一个治疗慢性丙型肝炎的蛋白酶抑制剂;依佐加滨是FDA批准的第一个治疗癫痫的神经元钾通道开放剂;罗氟司特是FDA批准的第一个口服慢性阻塞性肺病抗炎药;贝利木单抗是FDA自1955年以来批准的第一个狼疮治疗药物;阿齐非塞-T是FDA批准的第一个自体细胞美容产品。
本文根据FDA批准的药品说明书简要介绍这33个新药的有关情况。
表1 2011年美国FDA批准新药商品名英文药名中文药名申请公司适应证批准日期新分子实体Datscan ioflupane 123I 碘[123I]氟潘通用电气帕金森综合征诊断 1月14日Natroba spinosad 多杀菌素 Parapro Pharms 头虱感染 1月18日Viibryd vilazodone hydrochloride 盐酸维拉佐酮森林实验室重度抑郁症 1月21日Edarbi azilsartan medoxomil 阿齐沙坦酯武田高血压 2月25日Daliresp roflumilast 罗氟司特 Forest Res Inst 慢性阻塞性肺病 2月28日Gadavist gadobutrol 钆布醇拜耳中枢神经系统核磁共振造影 3月14日Horizant gabapentin enacarbil 加巴喷丁恩那卡比葛兰素集团腿不宁综合征 4月6日vandetanib 凡德他尼 IPR Pharms 甲状腺髓样癌 4月6日Zytiga abiraterone acetate 醋酸阿比特龙简森生物技术转移性前列腺癌 4月28日Tradjenta linagliptin 利拉利汀勃林格英格翰 2型糖尿病患者的血糖控制 5月2日Victrelis boceprevir 波塞普韦先灵慢性丙型肝炎 5月13日Edurant rilpivirine hydrochloride 利匹韦林蒂博泰克艾滋病毒-1感染 5月20日Incivek telaprevir 特拉普韦 Vertex Pharms 慢性丙型肝炎 5月23日Dificid fidaxomicin 非达霉素 Optimer Pharms 艰难梭菌相关性腹泻 5月27日Potiga ezogabine 依佐加滨 Valeant Pharms 癫痫患者的癫痫部分发作 6月10日Arcapta Neohalerindacaterol maleate 马来酸茚达特罗诺华慢性阻塞性肺病 7月1日Xarelto rivaroxaban 利伐沙班强生膝或髋关节置换手术后预防深部静脉血栓症和肺栓塞7月1日Brilinta ticagrelor 替卡格雷阿斯利康降低急性冠脉综合征患者血栓性心血管事件率7月20日(续表1)商品名英文药名中文药名申请公司适应证批准日期Zelborafvemurafenib 维罗非尼霍夫曼-罗氏不可切除的或转移性黑色素瘤 8月17日Firazyr icatibant acetate 醋酸艾替班特 Shire Orphan Therap遗传性血管性水肿 8月25日Xalkori crizotinib 克里唑替尼辉瑞局部晚期或转移性非小细胞肺癌8月26日Ferriprox deferiprone 去铁酮 Apopharma 地中海贫血综合征患者铁过剩 10月14日Onfi clobazam 氯巴占灵北伴伦-加两氏综合征癫痫发作患者的辅助治疗10月21日Jakafi ruxolitinib 鲁索利替尼 Incyte 骨髓纤维化 11月16日新生物制剂Benlysta belimumab 贝利木单抗人类基因科学/葛兰素史克全身性红斑狼疮 3月10日Yervoy ipilimumab 易普利单抗百时施贵宝不可切除的或转移性黑色素瘤 3月25日Nulojix belatacept 贝拉西普百时施贵宝预防成年肾移植患者器官排异 6月15日Laviv azficel-T 阿齐非塞-T Fibrocell Technologies改善鼻唇沟皱纹外观 6月21日Anascorp centruroides (scorpion)immuneF(ab’)2 (equine)木蝎属(蝎)免疫球蛋白罕见疾病治疗蝎毒 8月3日Adcetris brentuximab vedotin 布兰图单抗维多汀西雅图遗传霍奇金淋巴瘤和系统型变性大细胞淋巴瘤8月19日Hemacord hematopoietic progenitor cells-cord脐带血造血祖细胞纽约血液中心异体基因脐带血造血干细胞移植 11月10日Erwinaze asparaginase Erwinia chrysanthemi菊欧杆菌天冬酰胺酶Eusa Pharma USA 已对大肠杆菌来源天冬酰胺酶超敏的急性淋巴细胞白血病11月18日Eylea aflibercept 阿柏西普Regeneron Pharmaceuticals新生血管性(湿性)年龄相关性黄斑变性11月18日1 心血管系统用药阿齐沙坦酯适应证:单用或与其它抗高血压药物联用治疗成人高血压。
2011年原研新药提供

新药”的含义包括化学或生物意义的创新药物;药物适应症或适用范围拓展;新制剂、新剂型药品等。
汇集的主要是由美国FDA批准的“新药”,开发机构则是世界范围(不局限于美国)的制药公司。
新药时间/获准国家/开发机构药品名称1-13,美国,Octapharma 血管性血友病因子/第八凝血因子浓缩物,商品名Human [Wilate] 1-23,美国,Acorda Therape达发吡啶dalfampridine,商品名Ampyra,缓释片utics, Inc.1-25,美国,Novo Nordisk 利拉鲁肽(liraglutide)注射剂,商品名Victoza脑膜炎(A,C,Y和W –135型)寡糖白喉CRM197结合型疫苗(商2-22,美国,Novartis品名Menveo)2-24,美国,Pfizer 13价肺炎球菌结合疫苗(白喉CRM197蛋白;Prevnar 13)3-1,美国,Shire 重组葡萄糖脑苷脂酶velaglucerase alfa注射剂,商品名为VPRIVcarglumic acid [化学名(2S)-2-(氨基甲酰基氨基)戊二酸],为口服片3-13,美国,Orphan Europe剂,商品名Carbaglu3-31,美国,Chemische F abri聚多卡醇(或称聚桂醇400,polidocanol)注射液,商品名Asclera k Kreussler & Co. GmbH4-29,美国,Dendreon sipuleucel - T(Provenge)5-19,美国,Allergan, Inc.加替沙星(gatifloxacin)0.5%滴眼液,商品名Zymaxid5-25,美国,Genzyme Corporα-葡萄糖苷酶(algucosidase alfa),商品名Lumizymeation6-1,美国,Amgen 地诺单抗(denosumab),商品名Prolia8-16,美国,HRA Pharma ulipristal acetate,商品名ella)9-10,俄罗斯,Novatis 芬戈利德(fingolimod),商品名Gilenya9-15,美国,Savient Pegloticase,商品名Krystexxa9-22,美国,Novartis 芬戈利德(fingolimod),商品名Gilenya。
2011年1-4月批准的新药

2011年1-4月美国FDA批准的新药介绍出于安全性考虑,FDA批准上市的新药数在持续下降,展现出FDA愈来愈谨慎的审批态度。
2010年度,只有21只新药被FDA开了绿灯,在这21只药物中,有6只生物制品和15只小分子药物。
这个数量少于2009年的25种和2008年的24种。
2011年1~4月,FDA共批准9只新分子实体(NMEs)和2只生物制品,现将这些新药简单介绍如下。
碘(I-123)氟潘(Ioflupan I-123,DaTscan)DaTscan由通用医疗公司研发,于1月14日获FDA批准,用于帕金森综合征的诊断。
DaTscan是一种在单光子计算机断层扫描时作为显影剂对颅内纹状体区域的多巴胺转运蛋白成像的放射性药物,以辅助医生鉴别和诊断成年患者的帕金森综合征。
DaTscan是一种含有I 123标记的放射线显影剂,其半衰期为13小时,能协助医生对帕金森综合征所致的震颤和特发性震颤(一种手、头、脸的不自主颤动)进行鉴别。
FDA批准DaTscan是基于2项证实可用于颅内纹状体区域DaT分布可视化有效性的Ⅲ期临床试验的结果。
这些研究对284例震颤成人患者进行了评估,研究结果显示,颅内DaT分布可视化检测中的计算机扫描结果与临床诊断一致。
DaTscan常见不良反应是头痛、头晕、食欲增加和蚁走感等。
多杀菌素(Spinosad,Natroba)Natroba 是由Parapro制药公司研发的一种外用混悬剂,其有效成分是由多杀菌素A和多杀菌素D按照5﹕1的比例组成,1月18日获FDA批准用于治疗4岁以上儿童和成人头虱感染。
多杀菌素通过激活头虱的烟碱型受体使其神经细胞去极化,神经元持续兴奋,最终导致头虱神经麻痹并死亡。
0.9%的Natroba外用混悬液的有效性和安全性经2项多中心、随机、活性药物对照研究得以证实。
总共有552例患者接受了该品10分钟的治疗,1周后若还能见到活的头虱,受试者必须进行第2次治疗。
FDA 2011年批准新药汇总

04/28
与泼尼松[泼尼松]联用(一种甾体)治疗晚期(转移)去势难治性前列腺癌既往已接受多烯紫杉醇(化疗)患者
Tradjenta
利拉利汀片
05/02
用于II型糖尿病患者在饮食和运动的配合下控制血糖
Victrelis
波普瑞韦
05/13
慢性丙肝成人患者
Edurant
利匹韦林
05/20
用于治疗从未进行过HIV治疗(初治)的HIV患者
Yervoy
易普利姆玛
3/25
用于晚期黑色素瘤的治疗
Horizant
gabapentin enacarbil
04/06
用于中重度不宁退综合征的治疗,一天一次缓释片
Vandetanib1
凡德他尼
04/06
治疗成人晚期(扩散性)甲状腺髓样癌,主要适用对象是不适合接受外科手术及出现症状的患者。
Zytiga
硫酸阿扎那韦,利托那韦
11/18
治疗HIV-1感染
用于降低哮喘发作频率或者减轻严重的慢性阻塞性肺炎症状(COPD)
Edarbi
阿齐沙坦酯衍生物片
02/25
用于治疗成人高血压
Gadavist
钆布醇
03/14
中枢神经系统核磁共振(MRI)造影剂
Benlysta
belimumab
03/10
用于治疗活动性、自身抗体阳性(系统性红斑狼疮)且正在接受标准治疗(包括类固醇皮质激素、抗疟药、免疫抑制剂和非甾体抗炎药)的狼疮患者。
FDA 2011年批准新药汇总
药品名称
有效成分
批准日期
用途
Datscan
碘[123I]氟潘
01/14
2011年第二季度SFDA批准的一类新药

2011年第二季度,有多个一类新药获得生产批文,其中包括贝达药业的埃克替尼、恒瑞医药的艾瑞昔布、天士力药业的注射用重组人尿激酶原。
新获批进口产品有百时美施贵宝的沙格列汀、施维雅的阿戈美拉汀、葛兰素史克的度他雄胺。
2011年第二季度,有多个一类新药获得生产批文,其中包括贝达药业的埃克替尼、恒瑞医药的艾瑞昔布、天士力药业的注射用重组人尿激酶原。
盐酸埃克替尼片(商品名:凯美纳),由浙江贝达药业有限公司研制,是小分子靶向抗肿瘤药,适应症是晚期非小细胞肺癌。
目前,盐酸埃克替尼已拥有中国、美国和国际专利。
艾瑞昔布片(商品名:恒扬),由江苏恒瑞医药股份有限公司研制。
艾瑞昔布是昔布类药物,属于选择性的COX-2抑制剂,该类药物能提供与传统的非选择性NSAIDs一样的镇痛和抗炎作用,而摒弃了与抑制COX-1相关的胃肠道和肾脏并发症。
注射用重组人尿激酶原(商品名:普佑克),由天津天士力制药的控股子公司上海天士力药业有限公司研制,主要用于急性ST 段抬高性心肌梗死的溶栓治疗。
进口产品方面,糖尿病新药沙格列汀片(商品名:安立泽,英文名:Onglyza)获批进口,进口企业为百时美施贵宝。
该产品属于二肽基肽酶4(DPP-4)抑制剂,由百时美施贵宝和阿斯利康联合研制,并且共同推广,2009年获得FDA批准上市。
2010年该产品全球销售额2.27亿美元。
阿戈美拉汀片(商品名:维度新,英文名:Valdoxan),施维雅公司进口,是首个褪黑素受体激动剂,具有良好的抗抑郁效果。
度他雄胺软胶囊(商品名:安路达,英文名:Avodart),葛兰素史克产品,为5α-还原酶抑制剂,2003年1月首次在美国上市,主要用于抗前列腺增生。
2010年全球销售额6.29亿英镑,同比增长18.68%。
米内网国家药监局紧急通知要求停用药品“力百汀”广东展开全面清查国家食品药品监督管理相关公司股票走势白云山A局昨日在其网站上公布通知,要求立即停止销售和使用葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂(商品名为力百汀),已上市的要求召回。
2011年FDA批准的35个新药

2011年FDA批准的35个新药FierceBiotech最近统计了2011年FDA批准的新药,共35个,其中生物药12个,约占1/3。
另外,新批准的35个药中,有2个药:加乐显(Gadavist)和拜瑞妥(Xarelto)已分别在2009年和2010年在中国获批。
巧的是,去年11月,FDA发布了2011财年批准的新药,数目一样,也是35个,但涵盖的时间段不同。
FDA的财年是从每年的10月至次年的9月。
对于制药公司来说,2011年是新药获批的丰收年。
FDA去年共批准了35个新药,是最近7年来最多的一年。
强生(Johnson & Johnson)和葛兰素史克(GlaxoSmithKline)各有3个新药获批,是获批新药最多的药企。
FDA也立刻夸耀其在2011年批准新药数目的大幅增加,并特别强调其批准了一些创新药物——如西雅图遗传学(Seattle Genetics)治疗淋巴瘤的新药Adcetris。
不过今年会批准几个新药呢?制药公司正在面临着来自仿制药公司日益激烈的竞争,而且,由于研发的乏力,在接下来的几年里,获批的新药数目很有可能下滑。
不过,就像在“15个潜在的重磅炸弹药物”报告里提到的那样,生物制药行业仍然在尽力开发新产品。
药名:Adcetris (brentuximab vedotin)适应症:霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤(ALCL)公司:西雅图遗传学(Seattle Genetics)获批日期:8月19日类型:生物药简介:去年8月,FDA加速审批了西雅图遗传学的孤儿药Adcetris,该药用于治疗霍奇金淋巴瘤和间变性大细胞淋巴瘤。
这是自1977年以来FDA首次批准的霍奇金淋巴瘤治疗药物和FDA有史以来批准的首个间变性大细胞淋巴瘤药物。
美国国家癌症研究所(National Cancer Institute)估计,去年美国大约有9,060新确诊的霍奇金淋巴瘤患者,其中大约1,190人可能因此病死亡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
近期获FDA批准的新药盘点(2011年9月15日)由勃林格殷格翰研发的利拉利汀于5月2日获FDA批准,用于结合饮食和运动改善2型糖尿病人对血糖水平的控制。
利拉利汀通过抑制二肽基肽酶-4(DPP-4)而改善患者的血糖控制。
与其他DPP-4抑制剂相比,利拉利汀的主要优势在于:具有优异的肾脏安全性,并能有效降低糖化血红蛋白。
利拉利汀主要以原型形式经粪便排泄,其经口服之后,经肾排泄的量仅为给药量的5%,即使静脉给药,也只有30.8%经肾排泄,因此接受治疗的患者无需定期检查肝、肾功能以及剂量调整,所有患者可统一固定剂量,便于开处方。
单用利拉利汀或与二甲双胍或匹格列酮联用时均不会增肌降低血糖风险,与二甲双胍联用时还可产生强效作用。
利拉利汀常见不良反应是呼吸道感染、鼻塞、肌肉痛、头痛和喉咙痛。
波普瑞韦(boceprevirVictrelis)波普瑞韦是由默沙东公司研发,于5月13日获FDA批准与聚乙二醇干扰素&alPHa;和利巴韦林联合治疗成人慢性丙型肝炎,是20年来FDA批准的第一种治疗丙肝新药。
波普瑞韦是丙型肝炎病毒非结构蛋白丝氨酸蛋白酶抑制剂。
适用于18岁以上成年代偿性肝脏疾病(包括肝硬化)患者,这些患者之前未曾接受过药物治疗或药物治疗无效的丙肝患者。
波普瑞韦不可单独使用,只能与长效干扰素和利巴韦林联合使用。
波普瑞韦的主要不良反应是贫血或虚弱和乏力。
分析师预计,该药年销售额有望达12亿美元。
利匹韦林(rilpivirineEdurant)利匹韦林由强生公司研发,于5月20日获FDA批准与其他抗逆转录病毒药物联合治疗HIV感染,主要适用于未曾接受过药物治疗的成人HIV感染者。
利匹韦林是一种芳基嘧啶类HIV非核苷类逆转录酶抑制剂(NNRTI),通过非竞争性抑制HIV逆转录酶(RT),抑制HIV-的复制。
该药物不会抑制人细胞DNA聚合酶&alPHa;、β和γ。
利匹韦林的常见不良反应有抑郁、失眠、头痛和皮疹。
特拉瑞韦(TelaprevirIncivek)特拉瑞韦是由Vertex制药公司研发。
于5月23日获FDA批准与聚乙二醇干扰素&alPHa;和利巴韦林联合使用用于治疗慢性丙型肝炎。
特拉瑞韦是一种可逆的HCVNS3/4A蛋白酶抑制剂,能直接攻击HCV、阻断其复制。
特拉瑞韦的有效性和安全性经3项Ⅲ期临床试验验证。
大约有2250例成人患者参与该项研究。
在所有的研究中,患者同时接受了标准治疗药物。
在之前未经治疗的患者中,与单独的标准治疗相比,接受特拉瑞韦治疗的患者中有79%呈现持续性病毒学应答(停药治疗24周后,血液中不再检出病毒感染)。
非达霉素(fidaxomicinDificid)由Optimer公司研发的非达霉素于5月27日获FDA批准。
非达霉素是一种大环内酯类抗生素,其作用机理新颖,主要是通过抑制细菌的RNA聚合酶而产生迅速的抗难治梭状芽孢杆菌感染(CDI)作用。
其治疗CDI优于现有药物。
非达霉素的安全性和有效性经2项大型多中心、随机、双盲、活性药物对照临床试验验证。
非达霉素常见不良反应有恶心、呕吐、头疼、胃痛及痢疾等。
依佐加滨(EzogabinePotiga)由Valeant制药公司研发的依佐加滨于6月10日获FDA批准用于辅助治疗成人难治性癫痫部分发作。
依佐加滨是首个用于治疗癫痫的钾通道激活剂,其作用机理不完全确立。
其主要是通过稳定神经元钾离子通道的“开放”状态降低兴奋性。
依佐加滨的获批将为耐药性癫痫患者提供有效的治疗选择。
Datamonitor预测,2017年依佐加滨在7大主要市场(美国、日本、法国、德国、意大利、西班牙和英国)年度销售高峰将达到3亿美元。
Belatacept(Nulojix)由百时美施贵宝研发的Belatacept于6月15日获FDA批准用于防止成人肾移植者的急性排斥,该药物与其他免疫抑制剂如巴利昔单抗、麦考酚酸酯、类固醇皮质激素联合使用。
Belatacept是一种可溶性重组融合蛋白,可选择性阻断T细胞的激活途径。
Belatacept是首个以保护移植器官功能的药物。
临床结果表明,Belatacept具有与环孢素相似的免疫抑制功效,且在降低心血管和代谢风险,慢性肾移植肾病发生率以及保护肾功能等方面更具优势。
与其他免疫抑制剂一样,Belatacept也有一个黑框警告,该警告信息包括发生严重感染和其他癌症的风险增加。
Belatacept存在2个可能的并发症:移植后淋巴增生性障碍(PTLD)和渐进性多灶性脑白质病(PML)。
利伐沙班(rivaroxabanXarelto)由拜耳公司研发,于7月1日获FDA批准用于髋关节和膝关节置换术的患者预防深静脉血栓。
利伐沙班是一种口服的直接、高度选择性和竞争性的Xa因子抑制剂,其通过抑制凝血Xa因子活性,从而中断凝血过程的内、外源性凝血途径,抑制凝血酶产生和血栓形成。
在6000名膝关节手术患者的临床对比试验中,利伐沙班的效果都要明显优于依诺肝素,而安全性与依诺肝素相当。
利伐沙班较常见的副反应是流血。
分析师预计,该药年销售额有望达43亿美元。
茚达特罗(indacaterolArcaptaNeohaler)茚达特罗是由诺华公司开发,于7月1日获FDA批准用于治疗哮喘和慢性阻塞性肺病(COPD)。
该药是首个迅速改善支气管扩张控制功能及第1秒用力呼气容积(FEV1)的β2-肾上腺素受体激动剂,其通过帮助改善肺部气管周围肌肉状态来防治COPD症状如气喘、呼吸急促的出现。
茚达特罗可持续维持24小时。
茚达特罗在哮喘和COPD患者人群中均有较好的耐受性,且比现有已上市的β2-肾上腺素受体激动剂有更好的心血管安全性。
茚达特罗的说明书中具有长效β2-肾上腺素能受体激动剂可增加哮喘相关死亡风险的黑框警告,其常见副作用包括流鼻涕、咳嗽、咽喉痛、头痛、呕吐。
替卡格雷(TicagrelorBrilinta)由阿斯利康公司研发的替卡格雷于7月20日获FDA批准用于减少急性冠状动脉综合征(ACS)患者血栓事件的发生。
替卡格雷是一种新型的,具有选择性的抗凝血药,也是首个可逆的结合型P2Y12腺苷二磷酸受体(ADP)拮抗剂,能可逆性地作用于血管平滑肌细胞(VSMC)上的嘌呤2受体亚型P2Y12,对ADP引起的血小板聚集有明显的抑制作用,能有效改善急性冠心病患者的症状。
与其他抗凝血药一样,替卡格雷的说明书中有一个黑框警告,该黑框警告提醒医生当替卡格雷与高剂量的阿司匹林联合使用时,其疗效将会降低。
分析师预计,到2015年,替卡格雷的销售额将达10亿美元。
Vemurafenib(Zelboraf)由罗氏公司研发的Vemurafenib于8月17日获FDA批准用于治疗或不能切除(无法通过手术摘除)的黑色素瘤。
Vemurafenib是继FDA 今年3月批准Yervoy后的第二个用于治疗黑色素瘤药物。
FDA在批准Vemurafenib的同时,还批准了首个用于检测cobas4800BRAFV600突变的试验方法,这一诊断方法将有助于确定病人的黑色素瘤细胞是否存在BRAFV600E突变。
分析师预计,到2015年,Vemurafenib的年销售额有望达7.32亿美元。
Brentuximabvedotin(Adcetris)由西雅图遗传公司研发的Brentuximabvedotin于8月19日获FDA 批准用于治疗自体干细胞移植(ASCT)后霍奇金淋巴瘤(HL)和极其罕见的系统性间变性大细胞淋巴瘤(ALCL)。
Brentuximabvedotin是美国1977年以来首个批准用于治疗霍奇金淋巴瘤的药物,也是首个明确表明治疗ALCL的药物。
Brentuximabvedotin是一种抗体共轭药物,可以和抗体结合,直接到达淋巴细胞CD30。
FDA批准Brentuximabvedotin是基于2项开放性单组临床试验,该2项试验的主要终点均为总应答率。
Brentuximabvedotin最常见不良反应为中性粒细胞减少、外周感觉神经病变、疲乏、恶心、贫血、上呼吸道感染。
艾替班特(IcatibantAcetateFirazyr)由Shire公司研发的艾替班特于8月25日获FDA批准用于18岁及以上成年人的遗传性血管水肿(HAE)急性发作治疗,也是FDA批准的第3个用于治疗HAE发作的药物。
艾替班特是一种强力的选择性的缓激肽B2受体及拮抗剂,艾替班特通过抑制与HAE的栓塞局部肿胀、炎症、疼痛症状有关的缓激肽的影响而治疗急性HAE的栓塞局部肿胀。
艾替班特代表了一种新型的,靶向的,皮下给药治疗HAE的方法。
艾替班特装于可在室温(高达77华氏度)下储存的一种预装注射器中,便于携带以及HAE发作时的紧急使用。
艾替班特耐受性良好,常见不良反应包括红肿、温热感、瘙痒、疼痛和灼热。
克里唑蒂尼(CrizotinibXalkori)由辉瑞研发的克里唑蒂尼于8月26日获FDA批准用于治疗存在间变型淋巴瘤激酶(ALK)基因重排的晚期非小细胞肺癌(NSCLC)。
克里唑蒂尼是全球首个口服间变型淋巴瘤激酶(ALK)抑制剂。
克里唑蒂尼通过抑制ALK可以阻断一系列关键的肿瘤细胞生长存活的通路。
对于ALK基因重排的患者,克里唑蒂尼显示出了显着的活性,并可延长生存期。
克里唑蒂尼的有效性和安全性经2项多中心单组临床试验验证,临床研究结果显示,83%的患者的肿瘤某种程度上得到了缩小,其中有54%的患者的肿瘤缩小达1/3或1/3以上。
克里唑蒂尼不良反应轻微,最常见的不良反应为视力障碍、恶心、腹泻、呕吐、水肿和便秘。
