热力学试题二
高二物理热力学第二定律试题

高二物理热力学第二定律试题1.热力学第二定律两种中的一种表述是:不可能使热量由传递到,而不引起其他变化。
该定律使人们认识到:自然界中进行的涉及热现象的宏观过程都具有。
【答案】低温物体,高温物体,方向性【解析】据热力学第二定律可知:不可能使热量由低温物体传递到高温物体,而不引起其他变化;二是:不可能从单一热源吸收热量并把它全部用来做功,而不引起其他变化;自然界中进行的涉及热现象的宏观过程都具有方向性。
【考点】热力学第二定律2.下列说法中正确的是()A.热不可能从低温物体传到高温物体B.容器中气体压强是由于大量气体分子对容器壁的频繁碰撞造成的C.液体表面存在张力是由于表面层分子间距离小于液体内部分子间距离D.蔗糖受潮后会粘在一起,因为没有确定的几何形状,所以它是非晶体【答案】B【解析】通过做功的方式热量可以从低温物体传递到高温物体上,如电冰箱,A错误;气体的压强是由大量的做无规则运动的气体分子对器壁的频繁撞击产生的.B正确,液体表面存在张力是由于表面层分子间距离大于液体内部分子间距离,C错误;蔗糖受潮后会粘在一起,没有确定的几何形状,它是多晶体,D错误【考点】考查了热学基础知识3.关于热现象的描述正确的是A.满足能量守恒定律的宏观过程都可以自发进行B.做功和热传递都通过能量转化的方式改变系统内能C.电冰箱的工作过程表明,热量可以从低温物体向高温物体传递D.温度不同的两块金属接触,达热平衡后,它们具有相同的物理量是热量【答案】C【解析】满足能量守恒定律的宏观过程不一定都可以自发进行,例如热量由低到高的传递,选项A 错误;做功是通过能量转化的方式改变系统内能,而热传递是通过能量的转移来改变物体的内能的,选项B错误;电冰箱的工作过程表明,热量可以从低温物体向高温物体传递,选项C 正确;温度不同的两块金属接触,达热平衡后,它们具有相同的物理量是温度,选项D 错误。
【考点】热传递;热力学第二定律.4.根据热力学定律,下列说法正确的是()A.电冰箱的工作过程表明,热量可以从低温物体向高温物体传递B.空调机在制冷过程中,从室内吸收的热量少于向室外放出的热量C.科技的进步可以使内燃机成为单一的热源热机D.对能源的过度消耗使自然界的能量不断减少,形成“能源危机”【答案】 AB【解析】试题分析: 冰箱制冷的过程实质上是利用氟利昂在冰箱内汽化吸收大量的热量,然后在冰箱外液化放出大量的热量,使冰箱内温度降低,此过程表明,热量可以从低温物体向高温物体传递,故A正确;空调机在制冷过程中,把室内的热量向室外释放,消耗电能,产生热量,故从室内吸收的热量小于向室外放出的热量,故B正确;热力学第二定律:不可能把热从低温物体传到高温物体而不产生其他影响;不可能从单一热源取热使之完全转换为有用的功而不产生其他影响,科技的进步不可能使内燃机成为单一的热源热机,故C错误;自然界的总能量是守恒的,只是有的能源转化成其他形式的能之后,不能再重新被利用,导致可利用能源越来越少,故而形成能源危机,故D错误。
热力学基础测试题

热力学基础测试题(一)的标准摩尔生成焓的反应是………(1) 表示CO2(2)下列情况中属于封闭体系的是………………………(A) 用水壶烧开水(B)氯气在盛有氯气的密闭绝热容器中燃烧(C) 氢氧化钠与盐酸在烧杯里反(D)反应在密闭容器中进行应(3)下列叙述中正确的是………………………(A) 恒压下ΔH=Q p及ΔH=H2-H1。
因为H2和H1均为状态函数,故Qp也为状态函数。
(B) 反应放出的热量不一定是该反应的焓变(C) 某一物质的燃烧焓愈大,其生成焓就愈小(D) 在任何情况下,化学反应的热效应只与化学反应的始态和终态有关,而与反应的途径无关(4) 按通常规定,标准生成焓为零的物质有…………………(A) C(石墨)(B) Br2(g) (C) N2(g)(D) 红磷(p)(5)下列叙述中正确的是………………(A) 由于反应焓变的常用单位是KJ/mol,故下列两个反应的焓变相等:(B) 由于CaCO3的分解是吸热的,故它的生成焓为负值(C) 反应的热效应就是该反应的焓变(D) 石墨的焓不为零(6)CO2(g)的生成焓等于…………………(A) CO2(g)燃烧焓的负值(B) CO(g)的燃烧焓(C) 金刚石的燃烧焓(D) 石墨的燃烧焓(7)由下列数据确定键N-F的键能为…………………………(A) 833.4KJ/mol(B) 277.8 KJ/mol(C) 103.2 KJ/mol(D) 261.9 KJ/mol(8)由下列数据确定水分子中键O-H的键能应为………………………(A) 121KJ/mol(B) 231.3 KJ/mol(C) 464 KJ/mol (D) 589 KJ/mol(9)由下列数据确定 CH4(g)的为…………(A) 211 KJ /mol(B) -74.8KJ/mol(C) 890.3KJ/mol(D) 缺条件,无法算。
(10)已知结晶态硅和无定形硅(Si)的燃烧热各为-850.6KJ/mol 和-867.3KJ/mol 则由无定形硅转化为结晶态硅的热效应为…………(A) 吸热(B) 放热(C) 16.7KJ/mol(D) 不能判断正确答案:1:(D)、2:(D)、3:(B)、4:(A)、5:(D)6:(D)、7:(B)、8:(C)、9:(B)、10:(B)热力学基础测试题(二)(1) 由下列数据确定 NH4Cl(s)溶解成NH4Cl(aq)的热效应应为(A) -6.1KJ/mol (B) +6.1 KJ/mol(C) -108.8 KJ/mol(D) +108.8 KJ/mol(2) 下列叙述中肯定正确的是………………………(A) 由于熵是体系内部微粒混乱程度的量度,所以盐从饱和溶液中结晶析出的过程总是个熵减过程。
化工热力学试题及答案

化工热力学试题及答案一、选择题1. 热力学是研究物质宏观的()性质和()关系的科学。
A. 动态,运动B. 静态,运动C. 静态,平衡D. 动态,平衡答案:C2. 热力学第零定律主要阐述了()。
A. 内能的存在B. 平衡状态的特点C. 熵的增加D. 热量传递答案:B3. 对于孤立系统来说,其熵不断()。
A. 增加B. 减少C. 变化D. 维持不变答案:A4. 以下哪个是热力学第一定律?A. 能量守恒定律B. 熵增定律C. 熵减定律D. 完全合成反应律答案:A5. 热力学第二定律主要阐述了()。
A. 熵的增加B. 熵的减少C. 热能转化效率D. 内能的转化答案:A二、问答题1. 请简要解释热力学第一定律的内容。
答案:热力学第一定律,也称为能量守恒定律,表明能量在系统中的总量是守恒的。
即在一个孤立系统中,能量的增加(或减少)等于对外界做功与系统吸热之和,即ΔU = Q - W。
其中,ΔU代表系统内能的变化,Q代表吸热,W代表对外界做功。
2. 什么是熵?简要解释熵增定律。
答案:熵是系统混乱程度的度量,也可以理解为系统的无序程度。
熵增定律是热力学第二定律的核心表述,它指出孤立系统的熵总是不断增加的。
即系统的无序状态总是向更加无序的方向发展。
这个过程是不可逆的,熵增定律体现了自然界的不可逆性。
三、计算题1. 一个物质在常压下从298K变为328K,该物质对外界吸收了1000J的热量,求该物质的热容。
解答:根据热容的定义,热容C等于物质吸收的热量Q与温度变化ΔT的比值。
即C = Q / ΔT。
根据题目所给的数据,Q = 1000J,ΔT = 328K - 298K = 30K。
将数据代入公式计算得到热容C = 1000J / 30K = 33.33 J/K。
2. 已知某化学反应的焓变为-300 kJ/mol。
如果该反应的摩尔物质数量为2 mol,求该反应的总焓变。
解答:总焓变等于摩尔焓变乘以物质的摩尔物质数量。
热学试题及答案
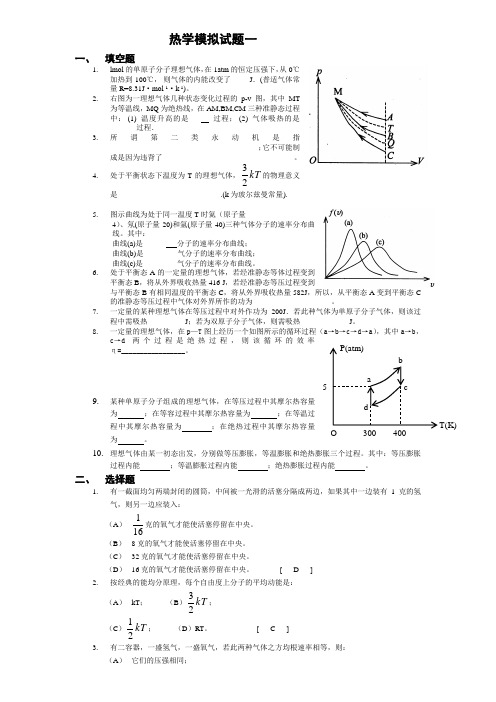
热学模拟试题一一、 填空题1.lmol 的单原子分子理想气体,在1atm 的恒定压强下,从0℃加热到100℃, 则气体的内能改变了_____J .(普适气体常量R=8.31J ·mol -1·k -1)。
2.右图为一理想气体几种状态变化过程的p-v 图,其中MT 为等温线,MQ 为绝热线,在AM,BM,CM 三种准静态过程中: (1) 温度升高的是___ 过程; (2) 气体吸热的是______ 过程. 3.所谓第二类永动机是指 _______________________________________ ;它不可能制成是因为违背了___________________________________。
4.处于平衡状态下温度为T 的理想气体,kT 23的物理意义是 ___________________________.(k 为玻尔兹曼常量).5.图示曲线为处于同一温度T 时氦(原子量 4)、氖(原子量20)和氩(原子量40)三种气体分子的速率分布曲线。
其中:曲线(a)是______ 分子的速率分布曲线; 曲线(b)是_________气分子的速率分布曲线; 曲线(c)是_________气分子的速率分布曲线。
6.处于平衡态A 的一定量的理想气体,若经准静态等体过程变到平衡态B ,将从外界吸收热量416 J ,若经准静态等压过程变到与平衡态B 有相同温度的平衡态C ,将从外界吸收热量582J ,所以,从平衡态A 变到平衡态C 的准静态等压过程中气体对外界所作的功为_____________________。
7. 一定量的某种理想气体在等压过程中对外作功为200J .若此种气体为单原子分子气体,则该过程中需吸热__________J ;若为双原子分子气体,则需吸热_____________J 。
8.一定量的理想气体,在p —T 图上经历一个如图所示的循环过程(a→b→c→d→a),其中a→b,c→d 两个过程是绝热过程,则该循环的效率η=_________________。
化学热力学考试试题

化学热力学考试试题一、选择题1. 下列哪个量在物质由液态变成气态时改变?A. 分子振动B. 分子旋转C. 分子间距D. 分子排列方式2. 当一个化学反应进行至平衡时,下列哪个量不会发生变化?A. 反应速率B. 物质浓度C. 反应物质摩尔比D. 平衡常数3. 完全燃烧1 mol甲烷生成CO2和H2O的焓变是-802.3 kJ/mol,那么生成1 mol CO2需要吸收多少热量?A. -400.2 kJB. -401.15 kJC. -802.3 kJD. 802.3 kJ二、填空题1. 标准状态下,1 mol反应物在298 K时的标准摩尔焓变称为______。
答:标准反应焓变2. 爱因斯坦提出的爱因斯坦关系式将______定量地和______联系在一起。
答:能量、物质三、计算题1. 某化学反应的平衡常数Kc为0.05,如果初始反应物摩尔浓度分别为1 mol/L和2 mol/L,则平衡时反应物和生成物的摩尔浓度分别为多少?答:设平衡时反应物A的摩尔浓度为x mol/L,则反应物B和生成物C 的摩尔浓度也为x mol/L。
由平衡常数的定义可得:Kc = [C]^n/[A]^m[B]^n代入已知的值可得:0.05 = x^1/x^1*x^2化简得 0.05 = 1/x解得x ≈ 20 mol/L所以平衡时反应物和生成物的摩尔浓度均为20 mol/L。
2. 给定以下反应的平衡常数Kp为0.05:2CO(g) + O2(g) ⇌ 2CO2(g)已知在某实验温度下CO的分压为0.3 atm,O2的分压为0.4 atm,求CO2的分压。
答:根据平衡常数的定义可得:Kp = P(CO2)^2/[P(CO)]^2[P(O2)]代入已知的值可得:0.05 = [P(CO2)]^2/[0.3]^2[0.4]化简得 [P(CO2)]^2 = (0.05)(0.3)^2(0.4)解得P(CO2) ≈ 0.13 atm所以CO2的分压约为0.13 atm。
热力学第二定律试题

热力学第二定律试题 TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-热力学第二定律试题(一)填空题(每题2分)1.气体经绝热不可逆膨胀,S 0;气体经绝热不可逆压缩,S 0。
(填>、<、=,下同)2. 1mol单原子理想气体从P1、V1、T1等容冷却到P2、V1、T2,则该过程的?U 0,S 0,W 0。
3.理想气体的等温可逆膨胀过程中,S 0,G 0,U 0,H 0。
(填>、<、=)4.1mol液态水在373K、P0下汽化为水蒸气,则?S 0,G 0,U 0,H 0。
(填>、<、=)5.热力学第二定律告诉我们只有过程的热温商才与体系的熵变相等,而不可逆过程的热温商体系的熵变。
6.在等温等压,不作其它功的条件下,自发过程总是超着吉布斯自由能的方向进行,直到自由能改变量为零就达到了态。
(二)单项选择题(每题1分)7.根据热力学第二定律的表述,下列说法错误的是()(A) 第二类永动机服从能量守恒原理 (B) 热不能全部转化为功而不引起其他变化(C) 热不能全部转化为功 (D) 从第一定律的角度看,第二类永动机允许存在8.关于自发过程方向性的说法错误的是()(A) 功可以自发的全部转变成热,但热却不能全部转化为功而不留下其它变化(B) 一切自发过程都是不可逆过程 (C) 一切不可逆过程都是自发过程(D) 功转变成热和其它过程一样具有方向性9.工作在393K和293K的两个大热源的卡诺热机,其效率为()(A) 83% (B) 25% (C) 100% (D) 20%10.在可逆循环过程中,体系热温商之和是()(A) 大于零 (B) 小于零 (C) 等于零 (D) 不能确定11.理想气体等温可逆膨胀过程,()(A) 内能增加 (B) 熵不变 (C) 熵增加 (D) 内能减少12.某体系在始态A和终态B之间有两条途径:可逆Ⅰ和不可逆Ⅱ,此时有()(A) SA =SB(B) QⅠ/T = QⅡ/T (C) SⅠ=SⅡ(D) SⅠ=⎰T Q IIδ13.下列说法错误的是()(A) 孤立体系发生的任意过程总是向熵增大的方向进行(B) 体系在可逆过程中的热温商等于体系熵变 (C) 不可逆循环过程的热温商小于熵变(D) 体系发生某一变化时的熵变等于该过程的热温商14.热力学第二定律的表达式为dS≥?Q/T环,则()(A) 始、终态相同时,不可逆过程的熵变小于可逆过程的熵变(B) 如果发生某一过程,体系的熵变与热温商相等,则该过程为不可逆过程(C) 对于孤立体系,dS≥0 (D) 在某些情况,可能有dS≤?Q/T环15.300K时,1mol理想气体由A态等温膨胀到B态,吸热,所作的功为A到B等温可逆膨胀功的1/3,则体系的?S为()(A) ·K-1(B) J·K-1(C) ·K-1(D) J·K-116.2mol单原子理想气体,等压由300K升温至600K,其?S为()(A) J·K-1(B) J·K-1(C) J·K-1 (D) J·K-117.在标准压力时,苯的沸点为,1molC6H6(l)完全汽化为同温同压下的苯蒸气。
化热力学考试真题2答案

=8.314×ln(5.0/0.1) +27.86×ln(298/800)+4.27×10-3( 298- 800)= 32.52-29.66 =2.87(kJ· kmol-1.) ( 4 分) -1 Wid=T0△S-△ H= 298× 2.87-(-15162.5)=16017.8(kJ·kmol ) ( 3 分)
13、理想溶液中所有组分的活度系数为零。 () ˆi i 。 14、理想气体有f=P,而理想溶液有 (对) 15、因为GE (或活度系数)模型是温度和组成的函数,故理论上 i 与压力无关。 (错) 16、纯流体的汽液平衡准则为f v=f l。 17、对一个绝热不可逆过程,可以设计一个绝热可逆过程来计算其熵变化?(错)
答案、评分标准: 当汽相为理想气体,液相为非理想溶液时,EOS+γ 的汽液平衡准则为;
pyi pis xi i
N
则 yi pis xi i / p
( 2 分)
而
p
py p x
i s i i i 1 i 1
N
i
( 2 分)
(nG E / RT ) (0.458 n1 n 2 / n) 0.458 n 2 0.458 n1 n 2 ln 1 n1 n1 n n2 T , p , n2 T , p , n2
5、若状态方程能给出纯流体正确的临界压缩因子,那么它就是一个优秀的状态方程。 ( 6、三参数的对应态原理较两参数优秀,因为前者适合于任何流体。 ( ) f P P 0 7、当 时, 。 ( )
授 课 专业班级:
8、吉氏函数与逸度系数的关系是 GT , P G
ig
T , P 1 RT ln 。 (
工程热力学试题2

工程热力学试卷(01)一、问答题(每题5分,共25分)1. 在p-v 图及T-s 图上画出空气的n =1.2的膨胀过程1-2和n =1.6的压缩过程1-3,并确定过程1-2和1-3中功和热量的正负号及初终态热力学能的大小。
2. 若分别以某种服从p (v -b)=R g T 的气体(其中b 为物性常数)和理想气体为工质在两个恒温热源和之间进行卡诺循环,试比较哪个循环的热效率大一些,为什么?3. 下面的说法是否正确,为什么? “若从某一初态经不可逆与可逆两条途径到达同一终态,则不可逆途径的ΔS'必大于可逆途径ΔS ”4. 空气在气缸内经历不可逆过程,内能减少12kJ,对外作功10kJ,试分析空气的熵变有哪几种可能性?为什么?5. 提高活塞式内燃机循环热效率的热力学措施有哪些?其热力学依据是什么?二、计算题(共75分)1. 人体热量的消耗率通常为356kJ/h,在作激烈运动时则达628kJ/h 。
在热天皮肤经由汗的蒸发来散热,若汗的蒸发在定压且与皮肤相同温度(27℃)下进行,问运动时多余热量需每小时蒸发多少汗才能排出?(10分)已知:t =26℃: h'=108.95 kJ/kg 、h "=2548.6 kJ/kg ; t =28℃:h'=117.31 kJ/kg 、h "=2552.3 kJ/kg2. 容积V =0.5m 3的空气初压=0.3MPa,初温=150℃,经膨胀过程到终态=0.08MPa,=20℃,求过程中热力学能,焓及熵的变化量。
空气作为理想气体,其比热容可取定值, 气体常数=287J/(kg·K);=1005 J/(kg·K)。
(10分)3. 刚性容器内有2kg,35℃,2MPa 的氮气,向容器内注入适量的氧气,使容器内压力达3MPa,若过程中温度维持不变,求加入氧气的质量。
氧气比热容取定值, 气体常数=260J/(kg·K)、=917J/(kg·K);氮气比热容取定值, 气体常数=297J/(kg·K) ;=1038J/(kg·K)。
高等工程热力学试卷

一、单选题。
(每题2分,共16分)1.若已知工质的绝对压力P=0.18MPa,环境压力Pa=0.1MPa,则测得的压差为( )A.真空p v=0.08MpaB.表压力p g=0.08MPaC.真空p v=0.28MpaD.表压力p g=0.28MPa2.简单可压缩热力系的准平衡过程中工质压力降低,则( )A.技术功为正B.技术功为负C.体积功为正D.体积功为负3.理想气体可逆定温过程的特点是( )A.q=0B. W t=WC. W t>WD. W t<W4.若从某一初态经可逆与不可逆两条途径到达同一终态,则不可逆途径的△S必( )可逆过程△S。
A.大于B.等于C.小于D.大于等于5.饱和蒸汽经历绝热节流过程后( )A.变为饱和水B.变为湿蒸汽C.作功能力减小D.温度不变6.绝热节流过程中节流前、后稳定截面处的流体( )A.焓值增加B.焓值减少C.熵增加D.熵减少7.空气在渐缩喷管内可逆绝热稳定流动,其滞止压力为0.8MPa,喷管后的压力为0.2MPa,若喷管因出口磨损截去一段,则喷管出口空气的参数变化为( )A.流速不变,流量不变B.流速降低,流量减小C.流速不变,流量增大D.流速降低,流量不变8.把同样数量的气体由同一初态压缩到相同的终压,经( )过程气体终温最高。
A.绝热压缩B.定温压缩C.多变压缩D.多级压缩二、填空题。
(每空2分,共30分)1、温度是衡量_____________的一个物理量,热力学温标的计量单位是_________。
2、物系的温度是用以判别物系间是否处于_________状态的参数。
3、理想气体的逸度等于______,逸度和逸度系数都是物质_______的函数。
4、压缩因子、偏差函数和逸度系数等表示实际流体对理想气体的____________。
5、热力学能和体积不变的简单封闭系统就将等同于________系统。
6、__________称为克劳修斯不等式,对______循环,上式等号成立。
热工学试题参考 02

热工学习题(一)名词解释:过程:指热力系由一个状态变化到另一个状态时所经历的全部状态的集合。
循环:就是封闭的过程,即热力系从某一个状态开始,经过一系列中间状态后,又回复到原来的状态。
稳定状态:所有变量都处于平衡状态的运行状态。
热力学第零定律: 如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
这一结论称做“热力学第零定律”。
灰体:物体的单色黑度不随波长变化的物体。
基本状态参数:从各个不同方面描写热力系宏观状态的物理量是状态参数,常用的有六个即压力、比容、温度、内能、焓、熵。
其中压力、比容、温度可直接测量比较直观,称为基本状态参数。
黑度:同温度下绝对黑体的辐射力之比值。
内能:物质内部分子动能和位能的总和。
开口系统:与外界有质量交换的热力系统称为开口系统。
平衡状态:指热力系在无外界的影响下,宏观性质不随时间而变化的状态。
可逆过程:能够反向进行并完全恢复原来状态而不对外界造成任何影响的热力过程。
热辐射:由于自身温度或热运动的原因而激发的电磁波传播,称为热辐射。
非稳态导热:在导热过程中,如果温度随时间的变化而变化,则认为是非稳态导热热阻:1.导热过程的阻力。
为导热体两侧温差与热流密度之比。
2. 流体在一定流速下由于加热引起的总压损失。
卡诺定律:1:在相同的高温热源和低温热源之间工作的一切可逆热机,热效率都相等,与其工质无关。
2:在相同的高温热源和低温热源之间工作的一切不可逆热机,其热效率不可能大于可逆热机的热效率。
理想气体:是由不占体积的质点组成,分子间没有相互作用力,当实际气体比容趋于无穷大时,它就成了理想气体。
制冷:用人为的方法使其某物体或空间冷却,使其温度低于环境温度并维持这个低温的过程。
传热过程:物系中质点发生相对位移(质点运动)进行热量传递的过程。
稳定温度场:某个换热系统在某一瞬间空间各点的温度分布情况不随时间变化,即为稳定温度场。
黑体:如果物体能全部吸收外来射线即ã=1,则这种物体被定义为黑体。
化学热力学测试题

化学热力学测试题一、选择题(每题1分,共20题)1. 在热力学中,物质的热力学性质主要与下列哪一因素有关?A. 质量B. 温度C. 压力D. 体积2. 下列哪个物理量可以用来描述物质的热力学性质?A. 质量B. 温度C. 频率D. 速度3. 下列哪个过程是放热的?A. 融化冰块B. 沸腾水C. 蒸发乙醚D. 油变为固体4. 下列哪个过程是吸热的?A. 水从液态变为固态B. 水从液态变为气态C. 气态乙醚变为液态D. 固态碘变为气态5. 在常温常压下,下列哪个物质同温同压下反应时放出的热量最大?A. 2mol H2 + O2 → 2mol H2OB. 2mol CO + O2 → 2mol CO2C. 2mol NH3 + 3mol O2 → 2mol NO + 3mol H2OD. 2mol CO2 + H2O → 2mol C2H5OH + O26. 下列反应中,反应热ΔH为负值的是:A. 2mol H2O2 → 2mol H2O + O2B. 2mol H2 + O2 → 2mol H2OC. 2mol H2 + Cl2 → 2mol HClD. 2mol H2 + S → 2mol H2S7. 系统吸收的热量和放出的热量之间的关系是:A. ΔH = ΔE + PΔVB. ΔH = ΔE + VΔPC. ΔH = ΔE + nRTD. ΔH = ΔE - PΔV8. 根据热力学第一定律,下列哪个公式表示了能量守恒定律?A. ΔH = ΔE + PΔVB. ΔH = ΔE + VΔPC. ΔH = ΔE + nRTD. ΔH = ΔE - PΔV9. 在恒压下,焓变化等于:A. 系统的内能变化B. 系统对外界做的功C. 系统与外界交换的热量D. 系统的体积变化10. 根据热力学第一定律,封闭系统内能的变化等于:A. 传热与做功的总和B. 系统的焓变化C. 系统对外界做的功D. 系统释放的热量11. 下列哪个物理量可以用来描述系统对外界做的功?B. 速度C. 电势D. 物态函数12. 根据热力学第一定律,封闭系统内能的变化等于:A. 传热与做功的总和B. 系统的焓变化C. 系统对外界做的功D. 系统释放的热量13. 吸热反应的焓变为:A. 正值B. 负值C. 零值D. 不确定14. 燃烧反应的焓变为:A. 正值B. 负值D. 不确定15. 物质的标准生成焓是指:A. 1mol物质在标准状态下生成时释放的热量B. 1mol物质在标准状态下生成时吸收的热量C. 1g物质在标准状态下生成时释放的热量D. 1g物质在标准状态下生成时吸收的热量16. 标准生成焓通常以下列什么状态为标准?A. 1atmB. 1PaC. 1molD. 1g17. 下列哪个过程的ΔH值可以直接用来表示反应的焓变?A. ΔH = q / nB. ΔH = qpC. ΔH = -qpD. ΔH = -q / n18. 下列哪个条件是热力学计算中的标准条件?A. 25℃、1mol/LB. 0℃、1mol/LC. 27℃、1atmD. 0℃、1atm19. 标准生成焓与反应热相等的反应是:A. 立即满足平衡常数K = 1B. 不能满足平衡常数K = 1C. 不受温度和压力影响D. 可以通过调节温度和压力改变平衡常数K20. 在标准状态下,下列哪个反应焓变可以直接等于其平衡常数K 的值?A. ΔH < 0B. ΔH > 0C. ΔH = 0D. ΔH不等于平衡常数K的值二、简答题(每题5分,共5题)1. 热力学第一定律的表达式是什么?并解释其中各个符号的意义。
高考物理力学知识点之热力学定律基础测试题含答案解析(2)

高考物理力学知识点之热力学定律基础测试题含答案解析(2)一、选择题1.下列说法正确的是()A.物体放出热量,其内能一定减小B.物体对外做功,其内能一定减小C.物体吸收热量,同时对外做功,其内能可能增加D.物体放出热量,同时对外做功,其内能可能不变2.如图所示,一导热性能良好的金属气缸内封闭一定质量的理想气体。
现缓慢地向活塞上倒一定质量的沙土,忽略环境温度的变化,在此过程中()A.气缸内大量分子的平均动能增大B.气体的内能增大C.单位时间内撞击气缸壁单位面积上的分子数增多D.气缸内大量分子撞击气缸壁的平均作用力增大3.下列有关热学的叙述中,正确的是()A.同一温度下,无论是氢气还是氮气,它们分子速率都呈现出“中间多,两头少”的分布规律,且分子平均速率相同B.在绝热条件下压缩理想气体,则其内能不一定增加C.布朗运动是指悬浮在液体中的花粉分子的无规则热运动D.液体表面层分子间距离大于液体内部分子间距离,故液体表面存在张力4.一定质量的理想气体由状态A变化到状态B,气体的压强随热力学温度变化如图所示,则此过程()A.气体的密度减小B.外界对气体做功C.气体从外界吸收了热量D.气体分子的平均动能增大5.下列说法正确的是()A.布朗运动就是液体分子的热运动B.在实验室中可以得到-273.15℃的低温C.一定质量的气体被压缩时,气体压强不一定增大D.热量一定是从内能大的物体传递到内能小的物体6.一定质量理想气体的状态经历了如图所示的ab、bc、cd、da四个过程,其中ab与竖直轴平行,bc的延长线通过原点,cd与水平轴平行,da与bc平行,则 ( )A.ab过程中气体温度不变,气体不吸热也不放热B.bc过程中气体体积保持不变,气体放出热量C.cd过程中气体体积不断增加,气体吸收热量D.da过程中气体体积保持不变,气体放出热量7.一定质量的理想气体的状态变化过程如图所示,MN为一条直线,则气体从状态M到状态N的过程中A.温度保持不变B.温度先升高,后又减小到初始温度C.整个过程中气体对外不做功,气体要吸热D.气体的密度在不断增大8.重庆出租车常以天然气作为燃料,加气站储气罐中天然气的温度随气温升高的过程中,若储气罐内气体体积及质量均不变,则罐内气体(可视为理想气体)( )A.压强增大,内能减小B.吸收热量,内能增大C.压强减小,分子平均动能增大D.对外做功,分子平均动能减小9.如图所示,一定质量的理想气体密封在绝热(即与外界不发生热交换)容器中,容器内装有一可以活动的绝热活塞.今对活塞施以一竖直向下的压力F,使活塞缓慢向下移动一段距离后,气体的体积减小.若忽略活塞与容器壁间的摩擦力,则被密封的气体( )图13-2-4A.温度升高,压强增大,内能减少B.温度降低,压强增大,内能减少C.温度升高,压强增大,内能增加D.温度降低,压强减小,内能增加10.用相同材料制成质量相等的圆环A 和圆盘B,厚度相同,且起始温度也相同,把它们都竖立在水平地面上,如图所示.现给它们相同的热量,假设它们不与任何其他物体进行热交换,则升温后,圆环A的温度t A与圆盘B的温度t B的大小关系是A.t A>t B B.t A=t B C.t A<t B D.无法确定11.下列说法正确的是A.机械能全部变成内能是不可能的B.第二类永动机不可能制造成功的原因是因为能量既不会凭空产生,也不会凭空消失,只能从一个物体转移到另一个物体,或从一种形式转化成另一种形式C.根据热力学第二定律可知,热量不可能从低温物体传到高温物体D.从单一热源吸收的热量全部变成功是可能的12.下列过程中可能发生的是()A.将两瓶不同液体混合,然后它们又自发地各自分开B.利用其他手段,使低温物体温度更低,高温物体的温度更高C.打开一高压密闭容器,其内气体自发溢出后又自发溢进去,恢复原状D.某种物质从高温热源吸收20kJ的热量,全部转化为机械能,而没有产生其他任何影响13.如图所示,在大口的玻璃瓶内装一些水,水的上方有水蒸气。
热学试题1---4及答案

热学模拟试题一一、 填空题1.lmol 的单原子分子理想气体,在1atm 的恒定压强下,从0℃加热到100℃, 则气体的内能改变了_____J .(普适气体常量R=8.31J ·mol -1·k -1)。
2.右图为一理想气体几种状态变化过程的p-v 图,其中MT 为等温线,MQ 为绝热线,在AM,BM,CM 三种准静态过程中: (1) 温度升高的是___ 过程; (2) 气体吸热的是______ 过程. 3.所谓第二类永动机是指 _______________________________________ ;它不可能制成是因为违背了___________________________________。
4.处于平衡状态下温度为T 的理想气体,kT 23的物理意义是 ___________________________.(k 为玻尔兹曼常量).5.图示曲线为处于同一温度T 时氦(原子量 4)、氖(原子量20)和氩(原子量40)三种气体分子的速率分布曲线。
其中:曲线(a)是______ 分子的速率分布曲线; 曲线(b)是_________气分子的速率分布曲线; 曲线(c)是_________气分子的速率分布曲线。
6.处于平衡态A 的一定量的理想气体,若经准静态等体过程变到平衡态B ,将从外界吸收热量416 J ,若经准静态等压过程变到与平衡态B 有相同温度的平衡态C ,将从外界吸收热量582J ,所以,从平衡态A 变到平衡态C 的准静态等压过程中气体对外界所作的功为_____________________。
7. 一定量的某种理想气体在等压过程中对外作功为200J .若此种气体为单原子分子气体,则该过程中需吸热__________J ;若为双原子分子气体,则需吸热_____________J 。
8.一定量的理想气体,在p —T 图上经历一个如图所示的循环过程(a→b→c→d→a),其中a→b,c→d 两个过程是绝热过程,则该循环的效率η=_________________。
高中热力学试题及答案解析

高中热力学试题及答案解析一、选择题1. 热力学第一定律的数学表达式是什么?A. ΔU = Q + WB. ΔH = Q - WC. ΔS = Q/TD. ΔG = ΔH - TΔS答案:A解析:热力学第一定律描述了能量守恒,即系统内能的变化等于系统吸收的热量与对外做功的代数和。
2. 以下哪种情况下,系统的熵会增加?A. 气体在绝热条件下膨胀B. 气体在等温条件下压缩C. 气体在等压条件下膨胀D. 气体在等温等压条件下膨胀答案:C解析:熵是表示系统混乱度的物理量,当系统从有序状态向无序状态转变时,熵会增加。
在等压条件下膨胀,气体分子的混乱度增加,因此熵会增加。
二、填空题1. 热力学第二定律表明,不可能从单一热源_______热能并将其完全转化为_______而不引起其他变化。
答案:吸收;机械能2. 理想气体状态方程为 PV = nRT,其中P表示_______,V表示_______,n表示_______,R是_______,T表示_______。
答案:压强;体积;摩尔数;理想气体常数;温度三、简答题1. 请简述热力学第二定律的开尔文表述和克劳修斯表述,并说明两者之间的联系。
答案:热力学第二定律的开尔文表述指出,不可能从单一热源吸热使之完全转化为功而不产生其他影响。
克劳修斯表述则指出,热量不可能自发地从低温物体传递到高温物体。
两者都表达了能量转化的方向性,即能量转化过程中存在不可逆性。
四、计算题1. 假设一个理想气体在等压过程中从状态A(P1, V1, T1)变化到状态B(P2, V2, T2)。
已知P1 = 1 atm, V1 = 2 L, P2 = 1.5 atm, V2 = 3 L。
求气体在过程中的体积变化量ΔV和温度变化量ΔT。
答案:首先,根据理想气体状态方程 PV = nRT,可以推导出等压过程中体积和温度的关系:V1/T1 = V2/T2。
将已知数据代入,得到2/T1 = 3/T2,解得T2 = 1.5T1。
热学试题

②f(υ )dυ : _____________________________________________。(4 分)
B、当理想气体状态改变时,内能一定改变
C、mol 数相同的各种理想气体,只要温度相同,其内能都一样
D、理想气体内能的改变总是等于 M Cv μ
(T1
T 2
)
E、某给定理想气体,处在一定状态,就具有一定内能
3、如果只用绝热方法使系统初态变到终态,则( )
A、对于联结这两态的不同绝热过程,所作的功不同 B、对于联结这两态的所有绝热过程,所作的功都相同
三、计算题(48%) 1、 证明两绝热线不能相交。(6 分)
2、在半径 r = 0.3mm 的毛细管中注水,一部分在管的下端形成水滴,其形状 可以视作半径 R = 3mm 球的一部分,如图所示,已知水的表面张力系数 α =7.3×10-2N/m,上端液体与毛细管的接触角为 0 度,试求管中水柱的高度 h 。(10 分)
1
4、 一隔板把容器分成相等的两部分,一边盛有质量为 m1,摩尔质量为μ 1 的理想气体,另一边为真空。当抽掉隔板后, 则气体就自由膨胀而充满整个容器,试求系统的熵变。(8 分)
5、燃气涡轮机内工质进行如图所示的循环过程,其中 1—2,3—4 为
绝热过程:2—3,4—1 为等压过程。试证明这循环的效率η 为
值,该过程是( )
A、等容升温过程
B、等温膨胀过程
C、等压膨胀过程
D、绝热膨胀过程
二、填空题(28%) 1、 理想气体温标的定义:①_______________________(V 不变);②_______________________(P 不变)。(4 分) 2、麦克斯韦速率分布函数为________________________________。(2 分)
热学试题1---4及答案

热学模拟试题一一、 填空题1.lmol 的单原子分子理想气体,在1atm 的恒定压强下,从0℃加热到100℃, 则气体的内能改变了_____J .(普适气体常量R=8.31J ·mol -1·k -1)。
2.右图为一理想气体几种状态变化过程的p-v 图,其中MT 为等温线,MQ 为绝热线,在AM,BM,CM 三种准静态过程中: (1) 温度升高的是___ 过程; (2) 气体吸热的是______ 过程. 3.所谓第二类永动机是指 _______________________________________ ;它不可能制成是因为违背了___________________________________。
4.处于平衡状态下温度为T 的理想气体,kT 23的物理意义是 ___________________________.(k为玻尔兹曼常量).5.图示曲线为处于同一温度T 时氦(原子量 4)、氖(原子量20)和氩(原子量40)三种气体分子的速率分布曲线。
其中:曲线(a)是______ 分子的速率分布曲线; 曲线(b)是_________气分子的速率分布曲线; 曲线(c)是_________气分子的速率分布曲线。
6.处于平衡态A 的一定量的理想气体,若经准静态等体过程变到平衡态B ,将从外界吸收热量416 J ,若经准静态等压过程变到与平衡态B 有相同温度的平衡态C ,将从外界吸收热量582J ,所以,从平衡态A 变到平衡态C 的准静态等压过程中气体对外界所作的功为_____________________。
7. 一定量的某种理想气体在等压过程中对外作功为200J .若此种气体为单原子分子气体,则该过程中需吸热__________J ;若为双原子分子气体,则需吸热_____________J 。
8.一定量的理想气体,在p —T 图上经历一个如图所示的循环过程(a→b→c→d→a),其中a→b,c→d 两个过程是绝热过程,则该循环的效率η=_________________。
热学试题(2)

大学物理竞赛训练题 热学(2)一、选择题1. 一定量的理想气体分别由初态a 经①过程ab 和由初态a ′经②过程a′cb 到达相同的终态b ,如p -T 图所示,则两个过程中气体从外界吸收的热量 Q 1,Q 2的关系为:(A) Q 1<0,Q 1> Q 2. (B) Q 1>0,Q 1> Q 2. (C) Q 1<0,Q 1< Q 2. (D) Q 1>0,Q 1< Q 2. [ ]2. 有两个相同的容器,容积固定不变,一个盛有氨气,另一个盛有氢气(看成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氨气也升高同样的温度,则应向氨气传递热量是: [ ](A) 6 J. (B) 5 J. (C) 3 J. (D) 2 J. 3. 某理想气体状态变化时,内能随体积的变化关系如图中AB 直线所示.A →B 表示的过程是 [ ](A) 等压过程. (B) 等体过程.(C) 等温过程. (D) 绝热过程.4.在所给出的四个图象中,哪个图象能够描述一定质量的理想气体,在可逆绝热过程中,密度随压强的变化[ ]5. 气缸中有一定量的氦气(视为理想气体),经过绝热压缩,体积变为原来的一半,则气体分子的平均速率变为原来的 [ ] (A) 24/5倍. (B) 22/3倍. (C) 22/5倍. (D) 21/3倍.6. 对于室温下的双原子分子理想气体,在等压膨胀的情况下,系统对外所作的功与从外界吸收的热量之比W / Q 等于 [ ]pρp(A) ρ p(C)ρp(B)ρp (D)(A) 2/3. (B) 1/2. (C) 2/5. (D) 2/7. 7. 理想气体卡诺循环过程的两条绝热线下的面积大小(图中阴影部分)分别为S 1和S 2,则二者的大小关系是: (A) S 1 > S 2. (B) S 1 = S 2. (C) S 1 < S 2. (D) 无法确定.[ ]8.如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是 (A) p 0. (B)p 0 / 2.(C) 2γp 0. (D) p 0 / 2γ. [ ] (=γC p /C V )9. 一定量的理想气体,开始时处于压强,体积,温度分别为p 1,V 1,T 1的平衡态,后来变到压强,体积,温度分别为p 2,V 2,T 2的终态.若已知V 2 >V 1,且T 2 =T 1,则以下各种说法中正确的是:(A) 不论经历的是什么过程,气体对外净作的功一定为正值. (B) 不论经历的是什么过程,气体从外界净吸的热一定为正值. (C) 若气体从始态变到终态经历的是等温过程,则气体吸收的热量最少.(D) 如果不给定气体所经历的是什么过程,则气体在过程中对外净作功和从外界净吸热的正负皆无法判断. [ ] 10. 如图所示,一定量的理想气体,沿着图中直线从状态a ( 压强p 1 = 4 atm ,体积V 1 =2 L )变到状态b ( 压强p 2 =2 atm ,体积V 2 =4 L ).则在此过程中: (A) 气体对外作正功,向外界放出热量. (B) 气体对外作正功,从外界吸热. (C) 气体对外作负功,向外界放出热量.VS 1S 2p 0V (L)12341234 ab(D) 气体对外作正功,内能减少.[ ] 11. 一定量的理想气体,从a 态出发经过①或②过程到达b 态,acb 为等温线(如图),则①、②两过程中外界对系统传递的热量Q 1、Q 2是(A) Q 1>0,Q 2>0. (B) Q 1<0,Q 2<0.(C) Q 1>0,Q 2<0. (D) Q 1<0,Q 2>0.[ ]12. 一定量的理想气体经历acb 过程时吸热500 J .则经历acbda 过程时,吸热为(A) –1200 J . (B) –700 J .(C) –400 J . (D) 700 J .[ ]13. 如图所示,设某热力学系统经历一个由c →d →e 的过程,其中,ab 是一条绝热曲线,e 、c 在该曲线上.由热力学定律可知,该系统在过程中(A) 不断向外界放出热量.(B) 不断从外界吸收热量. (C) 有的阶段吸热,有的阶段放热,整个过程中吸的热量等于放出的热量.(D) 有的阶段吸热,有的阶段放热,整个过程中吸的热量大于放出的热量.(E) 有的阶段吸热,有的阶段放热,整个过程中吸的热量小于放出的热量.p (×105Pa) 3 m 3)a bc d eVpO[ ]14. 理想气体经历如图中实线所示的循环过程,两条等体线分别和该循环过程曲线相切于a 、c 点,两条等温线分别和该循环过程曲线相切于b 、d 点a 、b 、c 、d 将该循环过程分成了ab 、bc 、cd 、da 四个阶段,则该四个阶段中从图上可肯定为放热的阶段为(A) ab . (B) bc . (C) cd . (D) da . [ ]15. 某理想气体分别进行了如图所示的两个卡诺循环:Ⅰ(abcda )和Ⅱ(a'b'c'd'a'),且两个循环曲线所围面积相等.设循环I的效率为,每次循环在高温热源处吸的热量为Q ,循环Ⅱ的效率为′,每次循环在高温热源处吸的热量为Q ′,则 (A) <′, Q < Q ′. (B) <′ Q > Q ′. (C) >′, Q < Q ′. (D) >′ Q > Q ′.[ ]16. 关于可逆过程和不可逆过程有以下几种说法: (1) 可逆过程一定是平衡过程. (2) 平衡过程一定是可逆过程.(3) 不可逆过程发生后一定找不到另一过程使系统和外界同时复原. (4) 非平衡过程一定是不可逆过程. 以上说法,正确的是: (A) (1)、(2)、(3). (B) (2)、(3)、(4).(C) (1)、(3)、(4). (D) (1)、(2)、(3) 、(4). [ ]a bcd pVOVpOabcda'b'c' d'17. 所列四图分别表示理想气体的四个设想的循环过程.请选出其中一个在物理上可能实现的循环过程的图的标号.[ ]18. 如图所示:一定质量的理想气体,从同一状态A 出发,分别经AB (等压)、AC (等温)、AD (绝热)三种过程膨胀,使体积从V 1增加到V 2.问哪个过程中气体的熵增加最多哪个过程中熵增加为零正确的答案是:(A) 过程AB 熵增加最多,过程AC 熵增加为零.(B) 过程AB 熵增加最多,过程AD 熵增加为零. (C) 过程AC 熵增加最多,过程AD 熵增加为零.(D)过程AD 熵增加最多,过程AB 熵增加为零.[ ]19. 设1 mol 理想气体,从同一初始平衡态出发,进行可逆的等压过程或等体过程.在温熵图(T ~S )中,对于相同的温度(A) 等压过程曲线的斜率大于等体过程曲线的斜率. (B) 等压过程曲线的斜率小于等体过程曲线的斜率. (C) 两种过程曲线的斜率相等. (D) 两种过程曲线的斜率孰大孰小取决于温度的值. [ ]二、填空题1. (5分)一定量理想气体,从同一状态开始把其体积由0V 压缩到021V ,分别经历以下三种过程:(1) 等压过程;(2) 等温过程;(3) 绝热过程.其中:__________过程外界对气体作功最多;__________过程气体内能减小最多;__________过程气体放热最多.绝热等温等体绝热等温等体绝热绝热等压绝热等温绝热pV O (A)pV O(B)pVO(C)pVO(D)V122. (3分) 水的定压比热为 K J/g 2.4⋅.有1 kg 的水放在有电热丝的开口桶内,如图所示.已知在通电使水从30℃升高到80 ℃的过程中,电流作功为 ×105 J ,那么过程中系统从外界吸收的热量Q =______________.3. (3分) 3 mol 的理想气体开始时处在压强p 1 =6 atm 、温度T 1 =500 K 的平衡态.经过一个等温过程,压强变为p 2=3atm .该气体在此等温过程中吸收的热量为Q =_____________J . (普适气体常量11K m ol J 31.8--⋅⋅=R )4. (3分) 右图为一理想气体几种状态变化过程的p -V 图,其中MT 为等温线,MQ 为绝热线,在AM 、BM 、CM 三种准静态过程中:(1) 温度升高的是__________过程;(2) 气体吸热的是__________过程.5. (3分)一定量的理想气体,在p —T 图上经历一个如图所示的循环过程(a →b →c →d →a),其中a →b ,c →d 两个过程是绝热过程,则该循环的效率 =______________.6. (5分) 设在某一过程中,系统由状态A 变为状态B ,如果_________________________________________________,则该过程称为可逆过程; 如果__________________________________________则该过程称为不可逆过程. 7. (4分)所谓第二类永动机是指____________________________________________, 它不可能制成是因为违背了____________________________________________. 8. (3分)由绝热材料包围的容器被隔板隔为两半,左边是理想气体,右边真空.如果 把隔板撤去,气体将进行自由膨胀过程,达到平衡后气体的温度__________(升高、降低或不变),气体的熵__________(增加、减小或不变).ICB A Q V OMTT (K)300 400O 5abcd9. (3分)已知某理想气体的比热容比为,若该气体分别经历等压过程和等体过程,温度由T 1升到T 2,则前者的熵增加量为后者的______________倍.10. (4分) 1 mol 理想气体在气缸中进行无限缓慢的膨胀,其体积由V 1变到V 2. (1) 当气缸处于绝热情况下时,理想气体熵的增量S = _________________. (2) 当气缸处于等温情况下时,理想气体熵的增量S = _________________. 11. (5分)三个附图所示分别是一定量理想气体经历的可逆过程曲线.试判断各图上a ,b 两点中处于哪一点的状态时理想气体的熵大,在熵大的那一点上画上“√”,若在两点时的熵一样大,则在两点上都画上“√”.12. (4分)一个能透热的容器,盛有各为1 mol 的A 、B 两种理想气体,C 为具有分子筛作用的活塞,能让A 种气体自由通过,不让B 种气体通过,如图所示.活塞从容器的右端移到容器的一半处,设过程中温度保持不变,则(1) A 种气体熵的增量S A =_____________________, (2) B 种气体熵的增量S B = ______________________.三、计算题1. (5分)气缸内盛有单原子分子的理想气体,若绝热压缩使其体积减半,问气体分子的方均根速率变为原来的几倍2. (5分)摩尔的某种理想气体,状态按p a V /的规律变化(式中a 为正常量),当气体体积从V 1膨胀到V 2时,试求气体所作的功W 及气体温度的变化T 1-T 2各为多少.VO VOV Oababab等压线等温线绝热线图1ACA +B3. (8分) 温度为25℃、压强为1 atm 的1 mol 刚性双原子分子理想气体,经等温过程体积膨胀至原来的3倍. (普适气体常量R = 1--⋅⋅K mol J 1,ln 3=(1) 计算这个过程中气体对外所作的功.(2) 假若气体经绝热过程体积膨胀为原来的3倍,那么气体对外作的功又是多少 4. (10分) 一个可以自由滑动的绝热活塞(不漏气)把体积为2V 0的绝热容器分成相等的两部分Ⅰ和Ⅱ.I、Ⅱ中各盛有摩尔数为的刚性分子理想气体(分子的自由度为i ),温度均为T 0.今用一外力作用于活塞杆上,缓慢地将Ⅰ中气体的体积压缩为原体积的一半.忽略摩擦以及活塞和杆的体积,求外力作的功.5. (5分) 如图所示,AB 、DC 是绝热过程,CEA 是等温过程,BED 是任意过程,组成一个循环。
热力学测试题-答案

无机化学小考测验(第一、二章)班级: 学号: 姓名:一 选择题(共10题,每题2分)1.下面对功和热的描述正确的是 ( A )A. 都是途径函数,无确定的变化途径就无确定的数值B. 都是途径函数,对应于某一状态有一确定值C. 都是状态函数,变化量与途径无关D. 都是状态函数,始终态确定,其值也确定2.已知在等温等压条件下进行的某反应A(g)+B(g)=C(g)+D(l)的∆H <0、∆S <0,则该反应 ( A )A .低于某温度时正向自发B .高于某温度时正向自发C .任意温度时正向均自发 D. 任意温度时正向均非自发3.某温度时,反应CO(g)+H2O(g)=CO2(g)+H2(g) ∆H θ<0,已达到平衡,则提高CO 的转化率的方法为 ( D )A .增加总压力B .减少总压力C .升高温度 D. 降低温度4.以公式ΔU = Q – p ΔV 表示的热力学第一定律,其适用条件是 ( C )A.封闭系统B.封闭系统,不做非体积功C.封闭系统,不做非体积功的等压过程D.封闭系统,不做非体积功的等温等压过程5.在下列反应中反应的标准摩尔焓变∆r H m Ө与生成物的∆f H m Ө相等的是 ( A )A. H 2(g) +21O 2(g) = H 2O (g) B. H 2(g) + Cl 2(g) = 2HCl(g) C. CaO(s) +CO 2(g) = CaCO 3(s) D. Fe 2O 3 (s) + 6HCl(aq) = FeCl 3(aq) +3H 2O (l)6.已知反应A + 1/2B = D 的标准平衡常数为K 1Ө ,那么反应2A + B = 2D 在同一温度下的标准平衡常数K 2Ө为A. K 2Ө=K 1ӨB. K 2Ө= (K 1 Ө)1/2C. K 2 Ө = 1/2 K 1 ӨD. K 2 Ө = (K 1 Ө) 2 ( D ) 7.298.15 K 时,下列物质的标准生成吉布斯自由能为零的是 ( C )A .Br 2(g)B .Br 2(s)C .Br 2(l)D .Br 2(aq) E. Br -(aq)8.已知298.15K 时,Zn(s)+0.5 O 2(g)=ZnO(s) △r H Өm =-351.5 k J·mol -1;Hg(l)+0.5 O 2(g)=HgO(s) △r H Өm =-90.8 k J·mol -1则反应Zn(s)+HgO(s)=Hg(l)+ZnO(s) 的△r H Өm 为 ( B )A. 442.3 k J·mol -1B. -260.7 k J·mol -1C. –442.3 k J·mol -1D. 260.7 k J·mol -19.对于反应2Cl(g) Cl2(g), △H 和△S 的符号为 ( C )A. △H>0,△S<0B. △H>0,△S>0C. △H<0,△S<0D. △H<0,△S>010.下列单质中,标准生成焓等于零的是 ( C )A.金刚石B.O 3(g)C.Fe(s)D.Hg(g)E.I 2(g)二 填空题(共5题,每题2分)1. 1mol 理想气体,经过恒温膨胀、恒容加热、恒压冷却后完成了一个循环过程,△U= 02. P,T,V,U,H,W,Q,G,S 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
… (3)
ΔrH m (3) = 247.7 kJ·mol-1 根据上述数据可获得 H—O 键的平均键能 εH—O 约为: ( )
(A) 925.5 kJ·mol-1 (B) 462.8 kJ·mol-1 (C) 120.9 kJ·mol-1 (D) 241.8 kJ·mol-1 2 分 (9013) 有一绝热不良的热源(温度为 Tb),缓慢地把热量散失给环境(温度为 Ta),经过相当长时间 后,热源损失了热量Q,而环境得到的热量为Q,计算过程的总熵变。 8. 2 分 (0146) 理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的压力, 则其终态 的温度、体积和体系的焓变必定是: ( ) (A) T 可逆 > T 不可逆,V 可逆 > V 不可逆,ΔH 可逆 > ΔH 不可逆 (B) T 可逆 < T 不可逆,V 可逆 < V 不可逆,ΔH 可逆 < ΔH 不可逆 (C) T 可逆 < T 不可逆,V 可逆 > V 不可逆,ΔH 可逆 < ΔH 不可逆 (D) T 可逆 < T 不可逆,V 可逆 < V 不可逆,ΔH 可逆 > ΔH 不可逆 9. ( 2 分 (0939) 在 300℃时,2 mol 某理想气体的吉布斯自由能 G 与赫姆霍兹自由能 F 的差值为: ) (A) G-F=1.247 kJ (B) G-F=2.494 kJ (C) G-F=4.988 kJ (D) G-F=9.977 kJ 7.
热力学二
试卷
( )
一、选择题 ( 共 15 题 30 分 ) 1. 2 分 (9032) 在标准压力 p和 268.15 K 下,冰变为水,体系的熵变ΔS 体应: (A) 大于零 (B) 小于零 (C) 等于零 (D) 无法确定 2. 2 分 (0486) ( ) Cl2(g)的燃烧热为何值? (A) HCl(g)的生成热 (B) HClO3 的生成热 (C) HClO4 的生成热 (D) Cl2(g)生成盐酸水溶液的热效应
4.
5.
(
)
6.
2 分 (0458) 已知 H2(g,298 K) + (1/2)O2 (g, 298 K) = H2O (g, 298 K)…………… (1) ΔrH m (1) = -241.8 kJ·mol-1 H2(g, 298 K) = 2H (g, 298K)
$ $
… (2)
ΔrH m (2) = 436.0 kJ·mol-1 O2(g, 298 K) = O (g, 298 K)
*. 2 分 (0462) 0462 人在室内休息时,大约每天要吃 0.2 kg 的酐酪(摄取的能量约为 4000 kJ) 。假定这些 能量全部不储存在体内,为了维持体温不变,这些能量全部变为热使汗水蒸发。已知水的汽 ( ) 化热为 44 kJ·mol-1,则每天需喝水: (A) 0.5 kg (B) 1.0 kg (C) 1.6 kg (D) 3.0 kg 11. 2 分 (0105) 按下列路线循环一周,哪种情况的功 W 是大于零的:
;其适用条件 。
18. 2 分 (0838) 选择“>” 、 “<” 、 “=”中的一个填入下列空格: 100℃,1.5p 的水蒸气变成 100℃,p的液体水,ΔS ______ 0, ΔG ______ 0。 19. 2 分 (0382) 对于任何宏观物质, 其焓 H 一定 _______ 内能 U (填上 >、 <、 =) , 因为 _________; 对于等温理想气体反应,分子数增多的 ΔH 一定 _________ΔU,因为 ______ ______ 。 20. 2 分 (1203) 它与压力的关系可表示为 ______。 B 物质的化学位B 与温度的关系可表示为 ______, 21. 2 分 (0577) 从统计热力学观点看,功的微观本质是 _________________________________ 。 热的微观本质是 _________________________________ 。 22. 2 分 (0916) 0916 所谓热力学概率就是 等 除以 于
3.
2 分 (1236) 下列过程均为等温等压过程,根据公式 dG = -SdT + Vdp 计算得ΔG = 0,此结论能用 于下述何过程? -5℃、p、水 (A) -5℃、p、冰 C+D (B) 等温、等压下,Wf = 0 的化学反应 A + B (C) 等温、等压下食盐溶解于水 100℃、p、水气 (D) 100℃、p 、水 2 分 (0485) 氧气的燃烧热应为何值? ( ) (A) 大于零 (B) 小于零 (C) 等于零 (D) 不确定 2 分 (1061) 范德华气体绝热向真空膨胀后,气体的温度: (A) 上升 (B) 下降 (C) 不变 (D) 无法确定
)
15. 2 分 (0507) 并计算反应 CO(g)+2H2(g)=CH3OH(g) 计算 298 K 下, CO(g)和 CH3OH(g)的标准生成焓, 的标准焓变。已知如下燃烧焓数据: ΔcH m (298 K)(CH3OH(g))=-763.9 kJ·mol-1 (1) ΔcH m (298 K)(C(s))=-393.5kJ·mol-1 ΔcH m (298 K)(H2(g))=-285.8 kJ·mol-1
s l
S = -35.46 J·K-1,放热 9860 J。求:-5℃ 时液态苯的饱和蒸气压,设苯蒸气为理想气体。
四、问答题 ( 共 1 题 10 分 ) 30. 10 分 (1112) 对于物态方程为 p(V-b)=nRT 的气体,请证明其等压热容 Cp 不随压力而变化。
的微观状态数.状态的数学概率 。
23. 2 分 (0740) 理想气体向真空膨胀,体积由 V1 变到 V2,其ΔU _____ ,ΔS _____ 。 24. 2 分 (0942) 在只做体积功的封闭体系中,过程的 25. 2 分 (0738) 0738
F的符号
。
选择“>” 、 “<” 、 “=”中的一个填入下列空格: 理想气体经节流膨胀,ΔS _____ 0,ΔG _____ 0。 三、计算题 ( 共 4 题 40 分 ) 26. 10 分 (9169) 在 101.325 kPa 时,甲苯的沸点为 383.2 K,已知此条件下 Sm(l)=264.19 J·K-1·mol-1, ΔvapSm=87.03 J·K-1·mol-1。试计算: (1)在上述条件下,1 mol 液态甲苯蒸发时的 Q, W, ΔvapUm,ΔvapHm,ΔvapFm ,ΔvapGm 及 Sm(g)。 (2)欲使甲苯在 373.2 K 时沸腾,其相应的饱和蒸气压为若干? 27. 10 分 (0985) 在 300 K 时,1 mol 理想气体由 10p等温膨胀至 p,试计算此过程的U, H, S, F, G。 28. 10 分 (0731) 将一玻璃球放入真空容器中,球中已封入 1mol H2O(l) (101.3 kPa,373 K),真空容器内 部恰好容纳 1mol 的 H2O(g) (101.3 kPa,373 K),若保持整个体系的温度为 373 K,小球被击 破后,水全部汽化成水蒸气,计算 Q,W,ΔU,ΔH,ΔS,ΔG,ΔF。根据计算结果, 这一过程是自发的吗?用哪一个热力学性质作为判据?试说明之。 已知水在 101.3 kPa,373 K 时的汽化热为 40 668.5 J·mol-1。 29. 10 分 (0964) 在 -5℃, p下, 1 mol 过冷液态苯凝固时 Δ 已知 -5℃固态苯的饱和蒸气压为 0.0225p,
$ $ $
(2) (3)
Hale Waihona Puke ΔcH m (298 K)(CO(g))=-283.0 kJ·mol-1
$
(4)
二、填空题 ( 共 10 题 20 分 ) 16. 2 分 (1285) 在某些条件下,体系通过和外界环境不断地交换物质和能量,以及通过内部进行的不可逆 过程,体系的无序态有可能变成有序态,普里高津把这样形成的有序状态称为________,因 为它的形成和维持需要__________。 17. 2 分 (0093) 敞开体系的热力学第一定律表达式为 是
(
)
12. 2 分 (0157) 下述哪一种说法错误? ( ) (A) 焓是定义的一种具有能量量纲的热力学量 (B) 只有在某些特定条件下,焓变 ΔH 才与体系吸热相等 (C) 焓是状态函数 (D) 焓是体系能与环境能进行热交换的能量 13. 2 分 (0349) 某定量均相纯流体从 298 K,10p 恒温压缩时 , 总物系的焓增加 , 则该物系从 298 ( ) K,10p节流膨胀到邻近某一状态时,物系的温度必将: (A) 升高 (B) 降低 (C) 不变 (D) 不能确定 14. 2 分 (0483) 标准离子生成焓取 H+的摩尔生成焓为零,即 ΔfHm(H+,∞,aq)=0。在此规定下,H2 的 ( 摩尔生成焓ΔfHm(H2,g)为何值? (A) 为零 (B) 大于零 (C) 小于零 (D) 不定
