3-共振论简介
共振论

而共振论将CO32-的真实结构表示为:
上式的意思是:CO32-的真实结构是上述三个 共振结构式(经典结构式)的共振杂化体 共振论认为:不能用经典结构式圆满表示的分子,其真实 结构是由多种可能的经典极限式叠加(共振杂化)而成的。
共振论的基本思想
当一个分子、离子或自由基的结构可用一个以上不同电子排
CH2
CH2
CH CH (3)
CH2
③ 相邻原子带相同电荷的共振极限结构式不稳定。
O N
+ +
OE H
+ OO N E + H
正电荷相邻, 特别不稳定
共振杂化体能量高,不稳定,不易生成!
④ 负电荷在电负性较大的原子上的结构较稳定。
ÀÀ CH3 CH3 CH3 CH3
C
+
O
-
± È
C
-
È ¨ ¶À O Î
+
⑤ 满足八隅体电子构型的要求者,能量低, 稳定。反之则能量高,不稳定。
ÀÀ CH2=CH ± È CH2-CH
+
CH=CH2
CH-CH2
-
È ¨ Î ¶ À
CH2-CH
+
+ CH-CH2 中C 外层电子只有6个。
总之:
共振式之间,共价键多的结构是稳定
的; 共振结构式越多,其中结构稳定的越 多,其真实分子(共振杂化体)越稳定。
---使原子核的相对位置和电子对的数目保持不 变而改变电子对(一般指P电子)的排列,就能 写出不同的价键结构共振式:
CH2-CH=CH2
+
CH2=CH-CH2
+
2 书写共振式遵循的基本规则
共振论

共振论存在着电子离域的体系包括分子、离子、自由基,用经典的路易斯结构式不能完全、准确地表示出不能描述出其体系内电子云平均化,这个体系的真实结构和性质。
例如,1,3-丁二烯用CH2=CH-CH=CH2C-C有部分双键的性质,C=C比正常C=C键长等。
为了解决用经典的路易斯结构式表达复杂的电子离域体系的矛盾,鲍林在1931-1933年间提出了“共振论”。
共振论是用经典的结构式表达电子离域体系,是价键理论的延伸。
在有机化学中经常被使用,比较方便地解决了电子离域体系的表示,但有它的局限性。
一、共振论的基本概念对于电子离域体系的化学物种,不能用一个经典结构式表示清楚其结构,可用几个可能的经典结构式表示,真实物种是这几个可能的经典结构的叠加——共振杂化体。
表示离域体系的可能的经典结构称做极限结构或共振结构,共振结构的叠加得到共振杂化体,共振杂化体才能较确切地代表真实物种的结构。
1,3-丁二烯可用一系列共振结构表示:每个式子叫共振结构式或共振极限结构式,“<—>”双箭头符号表示共振结构之间的叠加或共振;合起来表示真实的1,3-丁二烯。
表示共振结构的叠加关系,不同于互变异构体间表示互变关系。
共振杂化体是一单一物种,只有一个结构。
极限结构式表示电子离域的极限度。
一个物种的极限结构式越多,电子离域的范围越大,体系能量越低,物种越稳定。
任何一个极限结构的能量都高于共振杂化体的能量,真实物种与最低能量的极限结构(最稳定的极限结构)的能量差称为共振能。
它是由电子离域而获得的稳定化能,与共轭能是一致的。
每个极限结构对其共振杂体的贡献是不相等的。
极限结构越稳定,对共振杂化体的贡献越大。
相同的极限结构贡献相等。
例如,1,3-丁二烯的共轭能为14kJ·mol-1,可用下列极限结构表示:CH2=CH-CH=CH2是最稳定的极限结构,对杂化体贡献最大,它与真实分子的能量差为共振能;后面几个极限结构是不稳定的,能量较高,对共振杂化体的贡献小,有时可以不考虑;和相同,对共振杂化体的贡献相等。
共振论

共振论内容补充共振论最早由美国科学家Linus Pauling (1954年Nobel 化学奖得主)提出,他在1931-1933年间发表了与之相关的7篇研究论文。
针对经典价键理论,共价键都是电子定域在两个成键原子之间的,这种键称为定域键。
若电子可流动,经典价键结构就难以正确表示它的结构状况。
电子可流动的键称为离域键,如苯。
共振论就是设法用多个价键结构来表示有离域键的分子的结构。
共振概念当一个分子、离子或游离基按价键结构规则可以写出一个以上的Lewis 结构式时,真正的结构用一个Lewis 结构表示不确切妥当,要用几个Lewis 结构表示,这些Lewis 结构称为共振结构(常常称为极限结构或参与结构)。
真正的结构是这些共振结构的共振杂化体(hybrid ),如CO 32-可写出3个结构。
O OO O OO O OO I II III共振符号真实的CO 32-结构既不是一会I ,一会II ,一会III ,也不是1/3 I ,1/3 II ,1/3 III 。
真实的CO 32-结构只有一个,用三个Lewis 结构式从三个侧面表示真正的CO 32-结构。
共振结构如何写1.必须符合Lewis结构(8电子)H C OHH H H COHHH C外层10电子2.原子位置不变(只是电子移动)H2C CCH2HCH2CH2CHH2C CH2HC正确键角扭小3.相同电子对数正确CH2CH CH2H2C CH CH2CH2CH CH2能量太高共振使分子稳定1.真正分子的能量低于各个个别共振结构。
2.共振结构对共振杂化体(真正分子)的稳定性有贡献,相同共振结构贡献一样。
3.较稳定共振结构对共振杂化体贡献大。
也就是真正结构更像较稳定结构。
各共振结构贡献的大小1.共价键数多的共振结构贡献大(稳定)CH2CH CH CH2CH2CH CH CH2大2.较稳定的价电子结构(完整八隅体)贡献大CH2O CH3CH2O CH3大3.电荷分离不稳定,电荷不分离稳定CH2CH Cl CH2CH Cl大4.负电荷在电负性大的原子上稳定CH2CH OCH2CH O大共振论在解释有离域键存在的有机反应时是很有用的。
共振论的基本概念

共振论的基本概念★★某些分子、离子或自由基不能用某个单一的结构来解释其某种性质(能量值、键长、化学性能)时,我们就用两个或两个以上的结构式来代替通常的单一结构式,这个过程叫共振。
用共振符号双向箭头表示。
例如:甲酸根离子HCOO就不能用单一的结构式来表示。
因为在上式中有C =O双键和C-O单键两种键,那么C-O单键键长应为143pm,C=O双键键长应为120pm,而实际测得甲酸根离子中的两个碳氧键键长都是126pm,即表明甲酸根离子中没有真正的C -O和C=O。
所以只能用下面两个共振式来表示。
其意义是C-O键介于双键和单键之间的中间状态,负电荷被两个氧承担。
这些组合结构叫共振杂化体(resonance hybrid)或简称杂化体,也就是说Ⅰ和Ⅱ综合称共振杂化体,每个参与杂化的结构叫共振结构式(resonance structures)或极限结构式,也就是说Ⅰ和Ⅱ互称共振结构式。
但并不是说,甲酸根离子一会是极限结构式Ⅰ,一会是极限结构式Ⅱ,也不是说一半是Ⅰ,一半是Ⅱ,而是介于Ⅰ和Ⅱ之间,Ⅰ和Ⅱ都不能表示其真实结构,不能单独存在、独立表示,只能参与共振杂化体。
L.Pauling的学生芝加哥大学的G.W.Wheland教授所作的生物杂化体的比喻是有启发性的。
如把骡子看作是马和驴杂交后生下的动物,是生物杂化体。
这并不是说骡子是几分之几的马和几分之几的驴,也不能说骡子有时候是马,有时候是驴,只能说骡子是与马和驴都有关系的动物。
因而可用两种熟知的动物马和驴来很好地说明骡子。
加利福尼亚工艺学院的J.D.Roberts教授的比喻就更恰当了,在中世纪,欧洲有一个旅行者从印度回来,他把犀牛描绘成龙和独角兽的生物杂化体,用两种熟知的、但完全是想像中的动物来很好地描绘一种真实的动物。
再如:1,3-丁二烯CH=CH—CH=CH,分子中C=C双键的键长不是134pm,而是137pm,C-C单键的键长不是154pm,而是148pm,说明分子中不存在纯粹的单双键,所以不能用一个结构式表示,而应该用共振杂化体表示。
第一节 共振论概述

在价键理论的基础上延伸出,很有用、很 方便的、定性的接近分子和离子的理论—共振 理论。共振论是随着分子轨道理论和价键理论 产生而产生且发展起来的。 (二)产生 羧酸根离子的经典结构式表示为 R C O 。 即两个氧原子和碳相连,分别是碳氧单键和碳 氧双键。按经典结构理论单键和双键距离是不 同的,但实际测得两个碳氧键键长是相同的。
(7)
(8)
(9)
这些结构都是满足分子式为C6H6的要求, 但与苯的化学性质相违背。譬如苯的一取代物 只有一种,苯的邻二取代物也只有一种。上面 式子中(1)—(8)都解释不了苯的一取代物只有一 种这个事实。
(9)式的一元取代物只有一种,应该是苯的真实 结构,但它又解释不了苯的邻二取代物只有一 种结构的事实。
R R R R
R、R之间是双键
二取代基之间是单键
所以,用(9)来表示苯的真实结构也不很确切
基于羧酸根、苯的分子和离子的物理、化 学性质与结构之间的矛盾,经典结构理论是无 法解决的,也就是用经典方法写出的结构式在 上述例子中,不再能表达实际意义了。
德国的Arndt(1924,1930)、英国的Ingold (1926,1933)和美国的Pauling(1931,1933) 先后但又独立的提出企图解决这些矛盾的办法。 他们的出发点不同,但大致都认为:分子的实 际状态不是任何某一个单独的经典价键结构所 能正确描绘的,它介于数个不同的价键结构之 间。这样的现象Arndt称之为中(间)阶(段), Ingold称之为中介,而Pauling称之为共振。依 据共振论的观点,羧酸根 离子可以写成如下形式:
R C O O
-
R
C
OO
(10)
(11)
苯环写成两个Kekule(凯库勒)结构的共振:
理论有机化学 第三章 共振论简介

共 振 论 简 介
OH E OH E H
OH E E H
OH E E H E H E H E H OH OH
OH E H
OH E H
OH E H
OH
OH E H
OH
E H
OH OH
共 振 论 简 介
N02 E N02 E H N02 E H N02 E H
地结构是这些共振结构式的杂化体。这些共
振杂化体仅仅是纸面上的非真实结构。
共 振 论 简 介
解决了苯环结构的四个问题
共 振 论 简 介
O O C O O
O C O O
O C O
碳酸根的共振结构
共 振 论 简 介
2. 在写共振式时只允许电子的移动,原子 核的位置不能变。
CH2 CH2=CHCH2
共振
共 振 论 简 介
练习:写出对硝基苯酚负离子的 合理共振结构式
O
NO2
共 振 论 简 介
§2 共振论的应用
1.定性判断分子稳定性 依据:能写出的共振式越多,真实分子越稳定。
分子 离域能
共振结构
苯 2β 2
奥 3.36β 2
萘 3.683β 3
联苯 4.383β 4
蒽 5.316β 4
菲 5.444β 5
Br2 Br Br
实际:主要发生取代反应
Br2 Br
共 振 论 简 介
理论:二取代产物应该有两个
Br Br
实际:二取代产物只有一个
Br Br
Br Br
共 振 论 简 介
用传统的价键理论不能解释……
共 振 论 简 介
共振论

+ –
–
⑥CH2–CH=CH–CH2
+
–
+
共振论的2个概念: 共振论的2个概念: 极限式——能够用经典价键结构写出来的构造式 极限式 能够用经典价键结构写出来的构造式 共振杂化体——真实物质的结构式,由各种极限式 真实物质的结构式, 共振杂化体 真实物质的结构式 共振杂化而成。 的共振杂化而成。
真实的结构与极限 式之间是什么关系? 式之间是什么关系?
G
+ CH2
-
G为吸电子基团,不稳 为吸电子基团, 为吸电子基团 G为给电子基团,不稳 为给电子基团, 为给电子基团
H
G
CH2 .. O
. C H2 .
G为吸电子基团,稳定 为吸电子基团, 为吸电子基团
H
共轭效应无 论对于C+还 论对于 共轭 p-π共轭 是C-, 都是稳 定因素
H
+
CH
C
H
H H
H C
?
共轭体系极限式的书写 原则,以丁二烯为例: 原则,以丁二烯为例:
CH2—CH—CH—CH2
( (1)各原子位置不变; 2)自由单电子数不能变; )各原子位置不变; )自由单电子数不能变; (3)离域的电子可任意组合。 )离域的电子可任意组合。 – + · · 2 ①CH2=CH–CH=CH2 ②CH2=CH–CH–CH CH2=C=CH–CH3 + – – + ③CH2=CH–CH–CH2 ④CH2–CH–CH=CH2 ⑤CH2–CH–CH=CH2 ⑦CH2–CH=CH–CH2 真实的丁二烯是这7种 真实的丁二烯是这 种 极限式的共振杂化体 极限式的共振杂化体
ΦA
成键轨道 Ψ1= c1ΦA + c2ΦB
共振论_01

判断下列基团Y相对于 是吸电基还是给电基? 判断下列基团 相对于C=C-Y是吸电基还是给电基? 相对于 是吸电基还是给电基
Y -CH3,-CH2-R -CF3,-CHX2 -X -OH,-OR -NH2,-NHR,-NR2 -N+R3 -CN -NO2 -CHO,-COOH,-COOR 诱导效应 + 共轭效应 + + + + 总电效应 + + + -
+ [ H 2 C = O. H ] . 1 .. + H 2 C - O. H ] [ . 2
共振式2中C没满足八隅体结构 3.如都有完整的价电子层结构,但带电荷,则负电荷在负性 较强的原子上,正电荷在负性较弱的原子上稳定。 4.一个分子的极限结构式越多越稳定。
共振论对1,3-丁二烯键长平均化解释如下:
CH2= CH-CH=CH2 (1) + _ CH -CH-CH CH2 2 (4) = + _ CH2=CH CH-CH 2 (7)
_ CH -CH CH-+ 2 CH 2 = (2) _ + CH -CH-CH=CH 2 2 (5 )
_ + CH -CH=CH- 2 CH 2 3) ( _ + CH =CH CH CH 2 6) - 2 (
6共轭效应 共轭效应 在单双键交替出现的共轭分子中,P电子的运动范围不在局限在两个碳 原子之间,而是扩充到四个碳原子之间,这种现象称为离域现象 离域现象。 离域现象 当一个原子受到外界试剂的影响,其他原子马上受到影响,不管共轭体 系多大,作用一致,这种作用为共轭效应 共轭效应。 共轭效应 共轭使电子云分布平均化,体系的能量降低,分子或离子的稳定性增强 。 离域有以下几种情况: π-π共轭: C=C-C=C, p-π共轭: HO-C=C, NH2-C=C, X-C=C, RO-C=C, C=C-C+, C=C-C.; p-p共轭:HO-C+, HO-C.. NH2-C+, NH2-C., X-C+, RO-C+; σ-π共轭: CH3-CH=CH2; σ-p共轭: CH3-C+, CH3-C.; 共轭作用由强到弱:π-π共轭> p-π共轭> p-p共轭>σ-π共轭σ-p共轭 氢化热的概念; 氢化热 烯烃稳定性规律:双键上电子云密度越低(越分散),烯烃越稳定。
有机化学-共振论全解

1.1.形式电荷
基本元素的形式电荷如图表1:
电正性、缺电子性、亲电性的区别
1、电正性或电负性是元素本身的性质,与元素的成键方式没有关系。吸引电子能力的 大小确定的。 2、缺电子性是指原子的价电子没有达到8电子结构时的性质。 3、亲电性: 原子有空轨道并且能量低。(可以与亲核试剂反应) 电正性、缺电子、亲电性、形式电荷等性质都是互相独立的 与化学反应性没有必然的关系! 例如:
O
O R2 R + H2O
Angew. Chem. Int. Ed. 2006, 45, 793 –796
O O R1 O R2 + R3 H-mont n-Heptane, 150 oC H-mont R2 n-Heptane, 100 oC R1 R R' R1 R3 O O R2 + H2O O R2
O O R1 O R2 + CuBr/CoCl2 Solvent R1 O R2
J. Am. Chem. Soc. 2006, 128, 56-57 J. Am. Chem. Soc. 2006, 128, 1798
O R-OH + R1
O R2
InCl3 (5 mol%) Toluene, 80 oC, 15h R1
OH O O + 5a
O
O
2a
4a
Entry
Catayst
Solvent
Yield (%)[b]
1
2
1a
1b[c]
Neat
Neat
71
66
3
4 5[d] 6 7 8 9[e]
1c
1d 1d 1d 1d 1d 1d
Neat
第二讲 共振理论、有机酸碱理论

•加成及π 络合物
(3) 电荷转移络合物(CT complex) 的生成反应
通过电荷配位而形成的络合物叫做电荷转移络合物。它是通过电子从给予体 (碱)的分子转移到电子受体的分子上,然后两者以静电吸引或其它作用力相
结合而形成的。这类络合物的一个特点是常带有显著的颜色。如:
橙色
深红
深紫色
其中各种甲苯是电子给予体(碱),四氰基乙烯是电子接受体(酸)。苯环上的 甲基越多,生成的电荷转移络合物的颜色越深,这表示甲基的数目增加致使电荷 转移程度加大。在紫外光谱中发生红移。
环庚三烯正离子 4n + 2
亲核反应发生在大环,主要产物是4,6,8 位;亲电反应发生在小环,主要产物是1,3 位。
5.判断反应速度 -BrOHCH2=CHCH2Br —→ CH2=CHCH2+ —→ CH2=CHCH2OH
稳定性高反应快
-BrOHCH3CH2CH2Br —→ CH3CH2CH2+ —→ CH3CH2CH2OH
• 三、硬软酸碱(HSAB)理论
• 为了较好地描写Lewis酸碱及其反应行为,1963年皮尔逊 (Pearson)归纳大量实验事实提出了HSAB原理:硬亲硬, 软亲软。 • “硬”、“软”两词实指酸碱约束外层价电子的紧松。 • 硬酸(HA):受体原子体积小,有较高正电荷,外层价电 子可极化性小,不易激发。 • 软酸(SA):受体原子体积大,有较小的或没有正电荷, 可极化性大,外层价电子易激发。 • 硬碱(HB):含有电负性高,可极化性低,难氧化的授电 子原子。 • 软碱(SB):含有电负性低,可极化性高,易氧化的授电 子原子。
1 2
1 2 3
3
P2,3 = 1 + 1/2 = 1.5
宁波大学2023年硕士研究生自命题科目考试大纲 349药学综合

2023年宁波大学硕士研究生招生考试初试科目考试大纲科目代码、名称: 349药学综合一、考试形式与试卷结构(一)试卷满分值及考试时间本试卷满分为300分,考试时间为180分钟。
(二)答题方式答题方式为闭卷、笔试。
试卷由试题和答题纸组成;答案必须写在答题纸(由考点提供)相应的位置上。
(三)试卷内容结构药学综合试卷内容主要包括有机化学、生物化学和药物化学三部分。
有机化学的考试内容主要包括有机化学的基本理论和基础知识,化学物质的性质与结构的关系,光谱学技术分析有机化合物的结构。
有机化学的基本理论和基础知识主要包括有机化合物的同分异构、命名及物性、有机化学反应、有机化学的基本理论及反应机理、有机合成。
化学物质的性质与结构的关系主要包括有机立体化学、碳水化合物、油脂、氨基酸、蛋白质、萜类、甾族等天然产物的结构、性质和用途,杂环化合物及元素有机化学。
光谱学技术分析有机化合物的结构主要包括有机化合物常用的化学、物理鉴定方法。
生物化学的考试内容主要包括生物化学的基本理论和基础知识,物质的结构与性质,物质的分解代谢和合成代谢。
物质的结构和性质的内容主要包括糖类、脂类、氨基酸、蛋白、酶、辅酶、核酸、维生素、激素等物质的结构与性质。
物质的代谢包括分解代谢和合成代谢,主要内容包括糖酵解、柠檬酸循环、生物氧化、戊糖磷酸化途径、糖异生、糖原分解、脂类的分解和合成代谢,蛋白质的分解和合成,核酸的分解与合成代谢等。
药物化学的考试内容主要包括药物化学的基本理论和基础知识,药物的分类与用途,药物的合成方法与构效关系,药物的作用机理与作用方式,以及药物设计的方法与原理。
药物的分类与用途的内容包括不同用途的药物分类。
药物的合成方法与构效关系包括常见药物(比如可卡因、巴比妥等)的合成方法以及结构与构效之间的关系。
药物的作用机理与作用方式,主要内容包括常见药物作用于机体的分子机制。
药物设计的方法与原理,主要内容包括药物设计的基本原理以及计算机辅助药物设计。
共振论简介
CH3CH CH CH CH2
H2
CH3CH CH2 Br2
HBr
平衡控制
Ni
CH3COOH
C2H5 KMnO4 H C C H C2H5 OH
1mol
HCl
KMnO4 O H
? PhCH2CH CH2
Br2, NO3
Br PhCHCH CH2 ?
+? +?
hυ
Cl2 + H2O
?
COOH
CH3CH2CH CHCH3
稳定性: 反 式 顺 式
小结:
1.环己烷有两种极限构象(椅式和船式),椅式为
优势构象。
2.一元取代基主要以e键和环相连。 3.多元取代环己烷最稳定的构象是e键上取代基最
多的构象。
4.环上有不同取代基时,大的取代基在e键上构象
最稳定。
一、命名或写出结构
1、2-甲基二环[4.3.0]壬烷 2、反-1-甲基-4-异丙基环己烷最稳定的构象式 3、5—异丁基壬烷 4、螺[4.5]—6—癸烯 5、(Z)—1—氯—1—溴—1—丁烯
C2H5 Cl
4-甲基-1-异丙基二环[3.1.0]己烷
2-乙基-6-氯二环[3.2.1]辛烷
(2) 螺环烃
两个环共用一个碳原子的环烷烃称为螺环烃。
CH3
编号原则:从较小环中与螺原子相邻的一个
螺碳原子
碳原子开始,徒经小环到螺原子,再沿大环
致所有环碳原子。
Br
5-甲基-1-溴螺[3.4]辛烷
命名:根据成环碳原子的总数称为环某烷, 在方括号中标出各碳环中除螺碳原子以外的 碳原子数目(小的数目排,大的排后),其 它同烷烃的命名。
二、化学性质
大环环烷烃和链状烷烃的化学性质很相像,对一般 试剂表现得不活泼。
3-共振论简介

2β
共振结构
2
奥 3.36β
2
萘
联苯
蒽
菲
3.683β 4.383β 5.316β 5.444β
3
4
4
5
共振论简介
稳定性 PhCH2+ > RCH2+
C2 H
C2 H
C2 H
C2 H
共振论简介
2.对键长的判断
Pi = 1 + ND/SC
1
2
ND - 双键出现次数
SJ - 合理共振式数目
eg.C6H6 P1,2= 1 + 1/2 = 1.5 P2,3 = 1 + 1/2 = 1.5 P1,2 = P2,3 键长相等,为正六边形结构。
C2H=CHC2H=CHCH2 CHCH=C2H
稳定
不稳定
共振论简介
9.共振式中如果所有的原子都有完整的 价电子层则是非常稳定的。
C2H0 C3H C2 = HOC3H
不稳定
稳定
共振论简介
10.电荷分离的共振结构式稳定性降低。
O CH3 C CH3
O CH3 C CH3
稳定
不稳定
共振论简介
11.在共振式中负电荷处在电负性较强的原 子上的式子要比处在电负性较弱原子上的式 子来得稳定。
共振论简介
苯环结构的问题,理论与现实严重不符
理论
实际
有单双键之分,键长不 无单双键之分,
同,应为不规则形状。 为正六角型。
1.54 A 1.34 A
1.39 A 1.39 A
共振论简介
理论 含有三个双键,应该稳定性比较差;
△H = 3×32 = 96 kcal/mol 实际
共振论的基本概念

共振论的基本概念★★某些分子、离子或自由基不能用某个单一的结构来解释其某种性质(能量值、键长、化学性能)时,我们就用两个或两个以上的结构式来代替通常的单一结构式,这个过程叫共振。
用共振符号双向箭头表示。
例如:甲酸根离子HCOO就不能用单一的结构式来表示。
因为在上式中有C =O双键和C-O单键两种键,那么C-O单键键长应为143pm,C=O双键键长应为120pm,而实际测得甲酸根离子中的两个碳氧键键长都是126pm,即表明甲酸根离子中没有真正的C -O和C=O。
所以只能用下面两个共振式来表示。
其意义是C-O键介于双键和单键之间的中间状态,负电荷被两个氧承担。
这些组合结构叫共振杂化体(resonance hybrid)或简称杂化体,也就是说Ⅰ和Ⅱ综合称共振杂化体,每个参与杂化的结构叫共振结构式(resonance structures)或极限结构式,也就是说Ⅰ和Ⅱ互称共振结构式。
但并不是说,甲酸根离子一会是极限结构式Ⅰ,一会是极限结构式Ⅱ,也不是说一半是Ⅰ,一半是Ⅱ,而是介于Ⅰ和Ⅱ之间,Ⅰ和Ⅱ都不能表示其真实结构,不能单独存在、独立表示,只能参与共振杂化体。
L.Pauling的学生芝加哥大学的G.W.Wheland教授所作的生物杂化体的比喻是有启发性的。
如把骡子看作是马和驴杂交后生下的动物,是生物杂化体。
这并不是说骡子是几分之几的马和几分之几的驴,也不能说骡子有时候是马,有时候是驴,只能说骡子是与马和驴都有关系的动物。
因而可用两种熟知的动物马和驴来很好地说明骡子。
加利福尼亚工艺学院的J.D.Roberts教授的比喻就更恰当了,在中世纪,欧洲有一个旅行者从印度回来,他把犀牛描绘成龙和独角兽的生物杂化体,用两种熟知的、但完全是想像中的动物来很好地描绘一种真实的动物。
再如:1,3-丁二烯CH=CH—CH=CH,分子中C=C双键的键长不是134pm,而是137pm,C-C单键的键长不是154pm,而是148pm,说明分子中不存在纯粹的单双键,所以不能用一个结构式表示,而应该用共振杂化体表示。
【理论化学机理】共振论的基本原理及其在有机化学中的应用
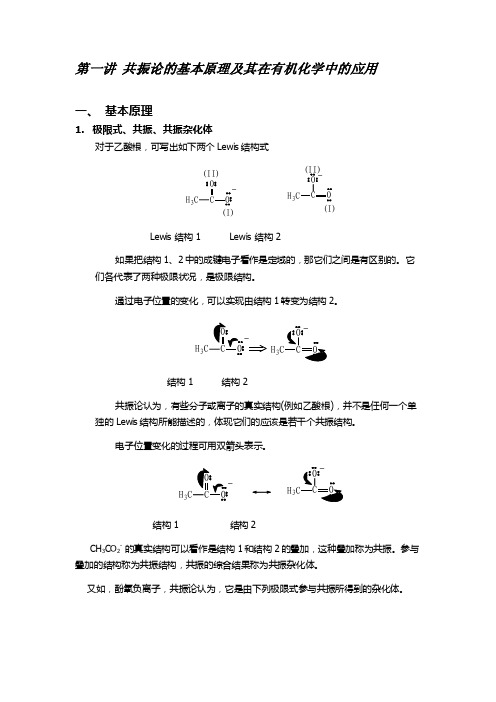
第一讲 共振论的基本原理及其在有机化学中的应用一、 基本原理1. 极限式、共振、共振杂化体对于乙酸根,可写出如下两个Lewis 结构式H 3(I)(II)H 3O (I)(II)Lewis 结构1 Lewis 结构2如果把结构1、2中的成键电子看作是定域的,那它们之间是有区别的。
它们各代表了两种极限状况,是极限结构。
通过电子位置的变化,可以实现由结构1转变为结构2。
H 3结构1 结构2共振论认为,有些分子或离子的真实结构(例如乙酸根),并不是任何一个单独的Lewis 结构所能描述的,体现它们的应该是若干个共振结构。
电子位置变化的过程可用双箭头表示。
H 3H 3结构1 结构2CH 3CO 2- 的真实结构可以看作是结构1和结构2的叠加,这种叠加称为共振。
参与叠加的结构称为共振结构,共振的综合结果称为共振杂化体。
又如,酚氧负离子,共振论认为,它是由下列极限式参与共振所得到的杂化体。
2. 共振结构式的书写规则(1) 只允许合理的Lewis 结构。
(2) 电子位置变,原子的位置不变。
离域所涉及到的电子一般为π电子,或为非键电子对以及容易离域到P 轨道上的电子。
(3) 要求有关的原子必须共平面。
亦即,有关原子为SP 2或SP 杂化(有关原子指的是电子位置变化所涉及到的原子)。
(4) 从一个共振结构变化到另一个共振结构,不配对的电子数保持不变。
例如,重氮甲烷CH 2N 2CHH -C H NN两个极限式的不配对的电子数为0,是允许的。
H-第一个极限式的不配对电子数为0,第二个极限式的不配对电子数为2,是不允许的。
3. 极限式对共振杂化体的贡献共振是稳定因素。
共振杂化体的能量低于任一参与共振的极限式。
但并不是所有的共振结构对描述共振杂化体的贡献是等同的。
(1) 含完整八隅体的结构比在价电子层上少于8个电子的结构更稳定,贡献更大。
(2) 共价键的数目愈多,该共振结构愈稳定。
(3) 结构中电荷分离数目愈大,愈不稳定。
有机化学-共振论全解

B具有电正性,N具有电负性,BH4-,NH4+ 都是富电子原子。 CH3+,CH3I,H2C=O (C 都具有亲电性,但只有CH3+ 中的C 是缺电子原子)
MeO+=CH2 中的O 原子具有形式正电荷,但C原子具有亲电性
配合物1d催化的β- 二酮与烯烃的反应:
机理研究:
2+
+
N N Cl Cl N Ru
Cl OH2 OH2 . (ClO4)2 O + 2a O
N Cl Cl N
N Ru
Cl O O . (ClO4)- + HClO 4
N
Cl
N
Cl
1d
7
配合物7的晶体结构
Cl Cl N N Cl O Ru+ O N N Cl 4 7 3 .ClO4 + O OH ╳ O
2.共振式的书写规则:
(1)共振式间用 连接。
(2)书写共振式时,只允许电子移动,而原子核的位置不动。
+ +
CH2 CH2
CH CH
CH2
+
CH2 X CH2
CH
+
CH2 CH3
CH2
C
(3)所有共振式,都必须符合Lewis结构。
+
H3C O H
X
H3C O H
(4)所有共振式都必须有相等的未成对电子数。
[Ru(dcbp)2(H2O)](OTf)2: N N Ru N N OH2 OH2 . (OTf)2
共振论的基本概念

共振论的基本概念★★某些分子、离子或自由基不能用某个单一的结构来解释其某种性质(能量值、键长、化学性能)时,我们就用两个或两个以上的结构式来代替通常的单一结构式,这个过程叫共振。
用共振符号双向箭头表示。
例如:甲酸根离子HCOO就不能用单一的结构式来表示。
因为在上式中有C =O双键和C-O单键两种键,那么C-O单键键长应为143pm,C=O双键键长应为120pm,而实际测得甲酸根离子中的两个碳氧键键长都是126pm,即表明甲酸根离子中没有真正的C -O和C=O。
所以只能用下面两个共振式来表示。
其意义是C-O键介于双键和单键之间的中间状态,负电荷被两个氧承担。
这些组合结构叫共振杂化体(resonance hybrid)或简称杂化体,也就是说Ⅰ和Ⅱ综合称共振杂化体,每个参与杂化的结构叫共振结构式(resonance structures)或极限结构式,也就是说Ⅰ和Ⅱ互称共振结构式。
但并不是说,甲酸根离子一会是极限结构式Ⅰ,一会是极限结构式Ⅱ,也不是说一半是Ⅰ,一半是Ⅱ,而是介于Ⅰ和Ⅱ之间,Ⅰ和Ⅱ都不能表示其真实结构,不能单独存在、独立表示,只能参与共振杂化体。
L.Pauling的学生芝加哥大学的G.W.Wheland教授所作的生物杂化体的比喻是有启发性的。
如把骡子看作是马和驴杂交后生下的动物,是生物杂化体。
这并不是说骡子是几分之几的马和几分之几的驴,也不能说骡子有时候是马,有时候是驴,只能说骡子是与马和驴都有关系的动物。
因而可用两种熟知的动物马和驴来很好地说明骡子。
加利福尼亚工艺学院的J.D.Roberts教授的比喻就更恰当了,在中世纪,欧洲有一个旅行者从印度回来,他把犀牛描绘成龙和独角兽的生物杂化体,用两种熟知的、但完全是想像中的动物来很好地描绘一种真实的动物。
再如:1,3-丁二烯CH=CH—CH=CH,分子中C=C双键的键长不是134pm,而是137pm,C-C单键的键长不是154pm,而是148pm,说明分子中不存在纯粹的单双键,所以不能用一个结构式表示,而应该用共振杂化体表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
共振论简介
eg. C10H8 P1,2= 1 + 2/3 = 1.67 P3,4= 1 + 2/3 = 1.67
P2,3 = 1 + 1/1 = 1.33
1,2键比2,3键长,奈是拉长的六边形结构。
1 2
3 4
共振论简介
3.判断酸碱性的强弱 Ka
XH ―→ X- + H+
X- 的共振式越多,结构越稳定,Ka值越大, 酸性越强。
实际:主要发生取代反应
Br2
Br
共振论简介
理论:二取代产物应该有两个
Br
Br
Br
Br
实际:二取代产物只有一个
Br Br
共振论简介
用传统的价键理论不能解释……
共振论简介
§1 共振论的主要内容 Solomen的共振规则 1.当一个分子、离子或游离基按价键理论可 以写成一个以上lewis结构式时,则任何一 个结构都不能圆满地表示它地结构。真实地 结构是这些共振结构式的杂化体。这些共振 杂化体仅仅是纸面上的非真实结构。
2β
共振结构
2
奥 3.36β
2
萘
联苯
蒽
菲
3.683β 4.383β 5.316β 5.444β
3
4
4
5
共振论简介
稳定性 PhCH2+ > RCH2+
C2 H
C2 H
C2 H
C2 H
共振论简介
2.对键长的判断
Pi = 1 + ND/SC
1
2
ND - 双键出现次数
SJ - 合理共振式数目
eg.C6H6 P1,2= 1 + 1/2 = 1.5 P2,3 = 1 + 1/2 = 1.5 P1,2 = P2,3 键长相等,为正六边形结构。
2β
共振结构
2
奥 3.36β
2
萘 3.683β
3
联苯 4.383β
4
蒽 5.316β
4
菲 5.444β
5
共振论简介
6.等价的共振式对杂化体的贡献是相等 的。由等价共振式所组成的体系具有巨大的 稳定性。
共振论简介
7.较稳定的结构式对杂化体的贡献较大。
稳定 稳定 不稳定 不稳定 不稳定
共振论简介
8.共价键数目越多的共振式越稳定。
共振论简介
6.判断反应速度
-Br-
OH-
CHC2H=2C=HCCHHC2HB2rOH —→
CH2=CHCH2+
稳定性高反应快
-Br-
OH-
CHC3HC3HC2HC2HC2HB2rOH —→
CH3CH2CH2+
稳定性差反应慢
共振论简介
OH E
OH
E H
OH
E H
OH
E H
OH
E H
OH
OH
OH
E
E
H
OH
E
OH
OH
OH
E H
OH
E H
OH
EH
EH
EH
EH
共振论简介
N20 E
N20
E H
N20 E
N2 0 E
N20
E H
N2 0
EH
N20 E H
N20
E H
N2 0
N20 E H
N20
E H
N2 0
EH
EH
共振论简介
共振论简介
解决了苯环结构的四个问题
共振论简介
O
O
O
C
O
O
C
O
O
C
O
O
碳酸根的共振结构
共振论简介
2.在写共振式时只允许电子的移动,原子核 的位置不能变。
C2HC2H
C2H =C2 HCHC2H CH2 =CH
共振
非共振
CH
OH C3 C HH=C
H
O C3 C H2C H H
结构互变
共振论简介
5.多环芳烃亲电取代反应的定位 只有用共振论来预测。
α位取代的中间体有两个特别稳定的结构, 反应速度快,成为主要产物。β位取代的中 间体只有一个特别稳定的结构,反应速度慢, 是次要产物。
共振论简介
E
E
H
E H
E
E
H
H
E H
环戊二烯负离子 4n + 2
环庚三烯正离子 4n + 2
共振论简介
亲核反应发生在大环,主要产物是 4,6,8位;亲电反应发生在小环,主 要产物是1,3位。
3.所有共振式必须符合lewis结构式,即符
合价键理论。
O
O
O
C3H C
C3H =C
C3H C
N2H
N2H
N2H
NH2 CH3C
O
O CH3C
NH2
OH CH 2=C
NH 2
共振论简介
3.所有共振式必须符合lewis结构式,即符 合价键理论。
O
O
O
C3H C
C3H =C
C3H C
N2H
N2H
N2H
同,应为不规则形状。 为正六角型。
1.54 A 1.34 A
1.39 A 1.39 A
共振论简介
理论 含有三个双键,应该稳定性比较差;
△H = 3×32 = 96 kcal/mol 实际
稳定性很好,反应中一般不开环。 △H = 50 kcal/mol
共振论简介
理论:应该主要发生加成反应
Br2
Br Br
C2H=CHC2H=CHCH2 CHCH=C2H
稳定
不稳定
共振论简介
9.共振式中如果所有的原子都有完整的 价电子层则是非常稳定的。
C2H0 C3H C2 = HOC3H
不稳定
稳定
共振论简介
10.电荷分离的共振结构式稳定性降低。
O CH3 C CH3
O CH3 C CH3
稳定
不稳定
共振论简介
11.在共振式中负电荷处在电负性较强的原 子上的式子要比处在电负性较弱原子上的式 子来得稳定。
3-共振论简介
第三章
共振论简介
共振论简介
共振论也是一种有机结构理论。该理论 简单、直观,能解决共轭体系的结构与性能 问题,结果与分子轨道理论HMO法的计算 结果相似。过去因为政治的原因而被打压。 现在仍然在发展。
共振论简介
苯环结构的问题,理论与现实严重不符
理论
实际
有单双键之分,键长不 无单双键之分,
C2HC=O
C2H=C O
不稳定
稳定
共振论简介
总结:真伪共振结构式的判断—— ① 符合价键理论 ② 原子核位置不变 ③ 能量合理
共振论简介
练习:写出对硝基苯酚负离子的 合理共振结构式
O
NO 2
共振论简介
§2 共振论的应用
1.定性判断分子稳定性 依据:能写出的共振式越多,真实分子越稳定。
分子
苯
离域能
共振论简介
碱性
甲胺 > 苯胺
Ka=2.3×10-11 Ka=2.6×10-5
酸性
O2NC6H4OH > C6H50H > CH3OH pKa = 7.15 pKa = 9.94 pKa = 19
共振论简介
4. 芳环上亲电取代反应的定位
取代反应是一个竞争过程,可以从中间体稳定性 判断反应的方向。
对于第一类定位基,邻对位取代的中间体共振 结构多,稳定性高,邻对位产物占优。
√
×
√
NH2 CH3C
O
×
√
O CH3C
NH2
×
OH CH 2=C
NH 2
共振论简介
4.所有共振式中必须有相等的未成对电子数。
C2= HC2HCHC2C HH2=CHC2C HH2CH
共振论简介
5.真实分子的能量低于所写出的任何一个 共振式的能量。能写出的共振式越多,真实 分子越稳定。
分子
苯
离域能
