高中化学主族元素化学图文
高中化学元素周期表ppt课件

2.10e-与18e-微粒 把握住书写的规律技巧是关键。
原子
分子
阴离子 阳离子
10e- Ne
HF、H2O、 NH3、CH4
F-、
O2-、
N3-、
OH-、
NH
2
Na+、 Mg2+、 Al3+、 H3O+、 NH
4
18e-
Ar
HCl、H2S、 PH3、SiH4、 F2、H2O2、 N2H4、C2H6、 CH3OH、CH3F
5
基础回归 元素的性质与原子结构的关系
1.元素的性质决定于电子层数 和 最外层电子
,
主数要决定于
最外层电。子数
2.同一主族的元素,从上到下,原子核外电子层数依
次 增多,原子半径逐渐 增,大失电子能力逐
渐 增强,得电子能力逐渐
,减金弱属性逐渐
,非金增属强性逐渐 。
减弱
特别提醒 同主族元素性质不一定相似,如第ⅠA族
HF、H2O、NH3、CH4等。 ④任何元素都有零价,但不一定都有负价或正价。如
F无正价,Na、Mg、Al等无负价。
9
2.元素、核素、同位素
10
3.元素的相对原子质量 (1)目前已发现的110多种元素中,大多数都有 同位素。 (2)一种天然存在的元素的各种核素分占的比例 不一定相同,但所占的百分比组成不变。 (3)元素的相对原子质量是按各种天然同位素原 子所占的一定百分比算出来的平均值。元素周期表 和相对原子质量表中的数值就是元素的相对原子质 量,而非核素(或原子)的相对原子质量。
材料;②在周期表中的
F、Cl、附S、近P等探 索 研 制 农 药 的 材 料 ;
③在 过渡元素中寻找催化剂和耐高温、耐腐蚀的合
人教版高中化学必修二课件:1.1《元素周期表》(共37张PPT)

2KI+Br2 = I2+2KBr 静置后,液体分层, 氧化性: Br2 > I2
上层 无色 ,
下层 紫色 。
结论
氧化性:Cl2 > Br2 > I2 还原性:I - > Br - > Cl 小结: 氧化性:F2> Cl2> Br2>I2 还原性:F-> Cl- > Br- > I-
氧化性:F2> Cl2> Br2>I2。 Cl2可从溴、碘的盐 溶液中置换出相应的卤素单质,F2与氯、溴、 碘的盐溶液可以置换出相应的卤素单质吗?
H2+F2 = 2HF H2+Cl2 = 2HCl 暗处剧烈反应并爆炸;HF很稳定 光照或点燃反应;HCl较稳定
H2+Br2 = 2HBr
H2+I2
加热500℃ ,HBr不稳定
2HI 需不断加热,HI同时分解
■都能跟氢气反应,体现相似性 反应通式:H2 + X2 = 2HX (X= F、Cl、Br、I) ■单质氧化性减弱,体现递变性
① 除9、10、18纵行(列序)外,族序数=列序个位数。(记忆方法) ②18个纵行,只16个族;0族和第VIII族不属主族,也不属副族。
一、碱金属元素结构和化学性质的相似性和递变性
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子 2.递变性: 核电荷数↑ 电子层数↑ 原子半径↑ 失电子能力↑ 化学性 质相似
3.请在下面的线框中用色笔画出周期表的轮廓。并标出族序数,写
出七个主族元素(可参考课本)和 0族元素的元素符号。
周期 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB VIIB
IB IIB ⅢA ⅣA ⅤA Ⅵ AⅦA 0 种类
高中化学教学 元素周期表

周
短周期:第1~3周期 长周期:第4~6周期
期 不完全周期:第7周期
主族:IA~VIIA族 7个
族
副族:IB~VIIB族 7个 VIII族:由3个纵行组成 1个
0族:稀有气体元素 1个
二.元素的性质和元素在周期表 中的位置关系
1.元素在周期表中的周期 和元素的性质
注 意
相
邻
2
8周
期
8元
一、元素周期表(长式)
1、元素周期表的编排方法
根据元素周期律,把电子层数目相同的 各种元素,按原子序数递增的顺序从左到右 排成横行,再把不同横行中最外层的电子数 相同的元素,按电子层数递增的顺序由上而 下排成纵行,这样就可以得到一个表,这个 表就叫做元素周期表。
元素周期表是元素周期律的具体表现形式
2、元素周期表的结构
3.斜线是金属和非金属的分界线
• 分界线附近的元素既表现出一定的金属性 也表现出一定的非金属性 周期序数等于主族序数的元素具有两性. 和铝相似,最高氧化物和对应水化物既能和 酸反应又能碱反应
4.价电子: 一般是元素原子的最外层电子
5.最高正价=主族元素的原子的最外层电子数 =8—|负价|
八、1—18号元素的结构性质特点
18 素
原
18 子
32 序
人教版高中化学必修二第一章第一节 《元素周期表 》课件(共15张PPT)

B.原子的核外电子数
C.原子核内的质子数
√D.原子的中子数
1.原子序数为 x 的元素位于第IA族,那么原子序 数为 x+2 的元素肯定不会在( )
√ A.第 IA 族 B.第ⅢB族 C.第ⅢA族 D.0族
【提示】若x为氢元素,则A正确;若x为锂或钠, 则C正确;若x在第4、5、6、7周期,则B项正确。 故答案为D。
3.第ⅠA族和0族元素的原子序数
4.每周期元素的种数
一、元素周期表的结构 “三短”“四长”;“七主”“七副”“0族和Ⅷ族” 二、元素原子结构与其在周期表中位置的关系.
周期序数=电子层数 主族序数=最外层电子数
原子序数
核外电子排布
周期表中位置
1.不能作为元素周期表中元素排列顺序的依据是
A.原子的核电荷数
螺旋式元素周期表
金字塔式元素周期表
1869年,俄国化学家门捷列夫将 元素按照相对原子质量由小到大 依次排列,制出了第一张元素周 期表,这就是现代元素周期表的 雏形。
第一章 物质结构 元素周期律
第一节 元素周期表
【思考与交流】
周期表的结构
阅读教材P4、5页并结合周期表,讨论以下问题
1.元素周期表的编排原则是什么?周期表有多 少横行,多少纵行,多少族?
A.若X是氢,则Y是氦
√C.若X是氟,则W是硫
B.若Y是氦,则Z是钠 D.若Y是氟,则Z是铝
例.已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
【提示】X为第4周期,第ⅠA族;Y为第5周期,第 ⅦA族。
【记一记】
周期表的结构
1.原子序数=核电荷数=质子数=核外电子数
2.周期序数=电子层数 主族序数=最外层电子数
高中化学元素周期表详解

高中化学元素周期表详解化学元素周期表是化学家们研究元素特性和推断元素性质的重要工具之一。
它是由俄罗斯化学家门捷列夫于1869年首次提出的,而如今的周期表已经发展成为包含118个元素的大型表格。
本文将详细解析高中化学元素周期表的内容和特点。
一、周期表的基本结构周期表由周期数和族(或称为组)来组成。
周期数表示元素的电子层,而族表示元素的化学性质和价态。
周期表的布局包括水平周期和垂直周期。
水平周期:它由每一行的元素组成,每行的元素数量逐渐增加。
水平周期从左到右的顺序是1至7,每个周期的最后一个元素都是填满了各个电子层的惰性气体。
垂直周期:它由每一列的元素组成,每列的元素具有相似的化学性质。
所有位于同一族的元素,其最外层电子的数目相同。
二、元素周期表的分类1.主族元素:周期表中的1A到8A族元素,它们的最外层电子数为1至8,具有相似的化学性质。
其中,1A到2A族元素通常被称为典型元素。
2.过渡族元素:周期表中的3B到2B族元素,它们的最外层电子数为1至10。
这些元素具有多种氧化态和复合价的特性,广泛应用于工业和生活中。
3.稀土系列元素:这一系列元素位于周期表的下方两行,它们的最外层电子数为1至14。
稀土系列元素具有特殊的化学性质,在催化剂、磁体、发光材料等领域有重要应用。
4.放射性元素:周期表中的部分元素具有放射性,包括核辐射较强的放射性元素。
这些元素通常位于周期表下方,如镭、钋等。
三、周期表的标识和命名规则周期表中的每一个元素都有一个唯一的符号,通常是由其拉丁文名称的头两个字母组成。
例如,氢元素的符号是H,氧元素的符号是O。
元素的原子序数也是周期表中的重要标识,原子序数是指元素核中质子的数量,也就是元素中电子的数量。
四、周期表的元素属性元素周期表中的每个元素都有自己的一些特点和性质,下面列举一些常见的元素属性:1.原子半径:元素的原子半径是指元素的原子核到最外层电子轨道的距离。
一般来说,随着周期数的增加,原子半径逐渐减小。
人教版化学《元素周期表》精美课件

1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
二、元素周期表
1.原子的电子排布与族的划分 主族元素价电子 ns1~2或ns2np1~5 族序数=价电子数
零族元素价电子 ns2np6(He除外)
过渡元素价电子
第一章 原子结构与性质
第二节 原子结构与元素性质
第一课时
知识回顾:一、元素周期表的结构(由周期与族构成)
短周期
周期 (横行)
长周期
第1周期(H--He):2 种元素 第2周期(Li--Ne):8 种元素 第3周期(Na--Ar):8 种元素
第4周期(K--Kr):18 种元素 第5周期(Rb--Xe):18 种元素 第6周期(Cs--Rn):32 种元素 第7周期(Fr--Og) :32种元素
ⅠB~ⅡB族 (n-1)d10ns1~2 族序数=最外层电子数 ⅢB~ⅦB族 (n-1)d1~5ns1~2 族序数=价电子数
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
练一练
已知某元素的原子序数是25,写出该元素原子的 价电子层结构式,并指出该元素周期表 课件 人教版高中化学选修三
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
随着核电荷数的递增,电子填充遵循构造原理, 每一周期里元素数目随着周期序号的递增渐渐增 多。元素周期系周期发展如同螺壳上的螺旋。
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
(1)同一周期元素结构和性质具有一定的递变性;从左到
人教版高中化学必修 化学2 第一章 第一节 元素周期表(第1课时)

6
55
56
5771
72
73
74
75 76
77 78 79
80 81
82
83
84 85 86
7
87
88
89103
104
105
106
107
108
109
110
111
112
过渡元素
镧系
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
锕系
89
90
91
92
93
94
95
96
97
98
99
100
101
102
VIII
IB
IIB
Sc
Ti
21 钪 22钛
V 23钒
1
2
IA H 1氢 Li 3锂 Na 11钠 K 19钾
IIA Be 4铍 Mg 12镁 Ca 20钙
3
4
2020/4/25
Cr 24铬
Mn 25锰
Fe 26铁
Co 27钴
Ni 28镍
Cu 29铜
A:主族
B:副族
IIIA B 5硼 Al 13铝
IVA C 6碳 Si 14硅
另外,特别族名称:第ⅦA 族—卤族元素
第 0 族—稀有气体元素
2020/4/25
江西省鹰潭市第一中学 桂耀荣
18
一、元素周期表
课堂小结: 1、元素周期表的结构:
七主七副七周期,Ⅷ族零族镧锕系。
2、元素原子结构与其在周期表中位置的关系:
人教版高中化学必修二1.1.3 元素周期表 课件3 (共20张PPT)

反应通式: X2 + H2 = 2HX卤化氢
即氢化物稳定性次序为 :HF>HCl>HBr>HI
②卤素单质间的置换反应
实验
1、NaBr加入少量新制的饱和 氯水,加入少量的四氯化碳, 振荡。 2、KI加入少量新制的饱和氯 水,加入少量的四氯化碳,振 荡。
现象
实验结论
上层液体颜色变浅, 氧化性: 下层液体呈红棕色 Cl2>Br2
决定 结构 反映 性质
存在 决定 用途 保存
卤素的用途
2Cs + 2H2O = 2CsOH + H2↑
通式:2R +2H2O = 2ROH + H2↑
碱金属从上到下,金属性逐渐 增强 , 与水反应越 剧烈 ,置换出氢气越 容易 , 生成的碱的碱性越 强 碱性:LiOH<NaOH <KOH<RbOH<CsOH
碱金属的物理性质的比较
Li 相 似 颜色 硬度 密度 Na K Rb Cs 均为银白色(Cs略带金色) 柔软 较小 较低
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的 难易程度。置换出氢越容易,则金属性越强。 2、根据金属元素最高价氧化物对应水化物碱性 强弱。碱性越强,则原金属元素的金属性越强。 3、可以根据对应阳离子的氧化性强弱判断。金 属阳离子氧化性越强,则元素金属性越弱。
总结:
至此我们可以看到同一主族元素,无论是金 属还是非金属在性质方面都具有一定的相似性和 递变性。 失 金 还 氧化 非 得 电 属 原 性 金 电 子 性 性 逐 属 子 的 逐 逐 渐 性 的 能 渐 渐 减 逐 能 力 增 增 弱 渐 力 逐 强 强 减 逐 渐 弱 渐 增 减 强 弱
减弱 与水反应的能力依次 弱 化物的酸性越来越 。
高一化学知识点-元素周期表

高一化学知识点:元素周期表高一化学知识点:元素周期表一、元素周期表原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、周期序数=电子层数;主族序数=最外层电子数3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数二二质子数+中子数:A==Z+N②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
七大方法助你告别化学“差生”一.尽快去找化学老师,让他告诉你以前学过的关键知识点,在短期内掌握,目的是能够大致跟上现在的教学进度,以听懂老师讲授的新知识。
要想进步,必须弄清楚导致化学成绩差的根本原因是什么?是常用的几个公式、概念没记住,还是很重要的几个基本解题方法不能熟练应用,或者是以前的一些重点知识没有理解透彻等等。
化学之元素周期表的性质
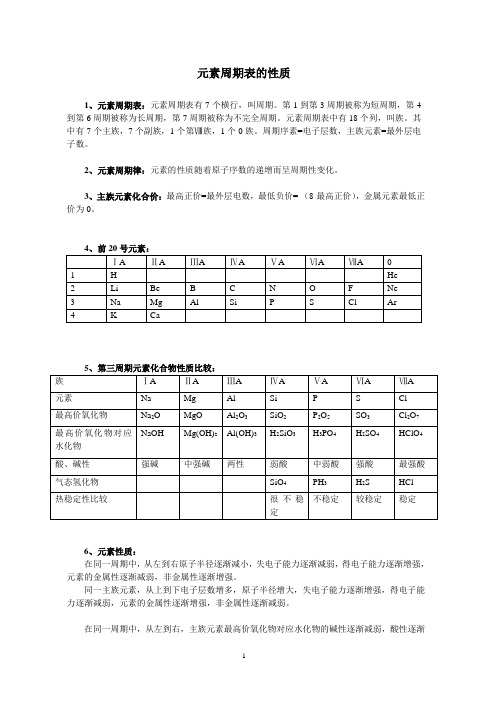
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
高中化学知识结构图
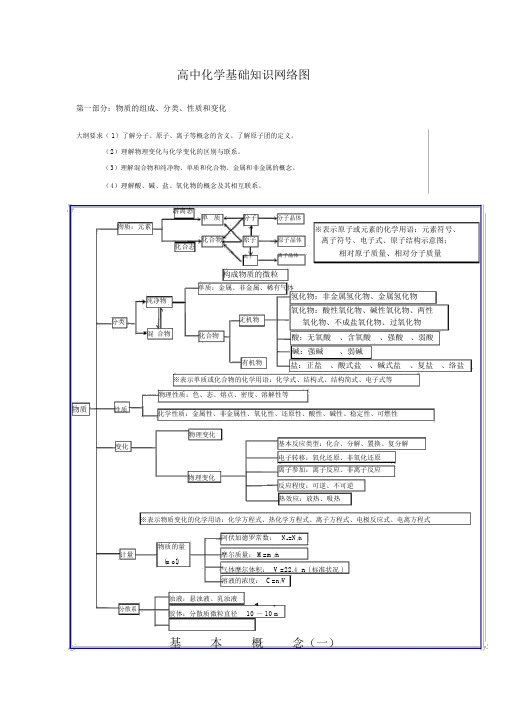
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化大纲要求( 1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
游离态单质分子分子晶体物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物分类无机物混合物化合物有机物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物、过氧化物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:N A=N/n物质的量摩尔质量: M=m/n(mol)气体摩尔体积:V =22.4 n ( 标准状况 )溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~ 10 m基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性游离态物理性质元素单质宏观化合物组化合态大多数有机物稀有气体分子晶体分酸子气态及挥发性物质原子晶体原石墨(混合晶体)子金属晶体微观大多数盐强碱离子晶体离碱性氧化物子部分过氧化物金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属稀有气体纯净物化合物分类无机物有机物性质氢化物金属氢化物酸性物质非金属氢化物碱性成盐氧化物两性氧化物特殊变化不成盐氧化物含氧酸、无氧酸酸强酸、弱酸强碱、弱碱碱可溶碱、难容碱正盐酸式盐盐碱式盐复盐;络盐潮解、分馏混合物升华、萃取有机、无机物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求物质结构和元素周期律(1)了解元素、核素和同位素的含义。
高中化学元素及其化合物建构图
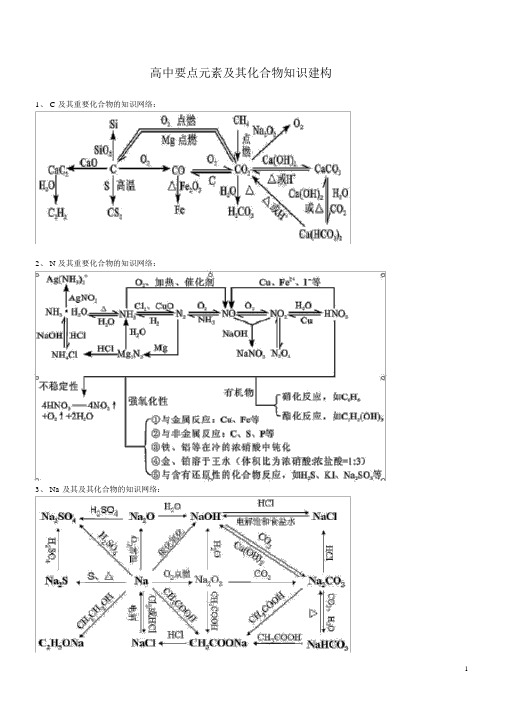
高中要点元素及其化合物知识建构1、 C 及其重要化合物的知识网络:2、 N 及其重要化合物的知识网络:3、 Na 及其及其化合物的知识网络:4、 Mg 及其重要化合物的知识网络:5、 Al 及其化合物知识网络:6、 Si 及其化合物知识网络:7、 S 及其化合物的知识网络:8、 Cl 及其化合物的知识网络:9、 Fe 及其化合物的知识网络:10、 Cu 及其化合物的知识网络:11、有机物的知识网络:高中化学基础知识建构图游离态分子晶体单质分子物质:元素※表示原子或元素的化学用语:元素符号、化合物原子原子晶体离子符号、电子式、原子构造表示图;化合态相对原子质量、相对分子质量离子离子晶体组成物质的微粒单质:金属、非金属、罕有气体纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不行盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、构造式、构造简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、复原性、酸性、碱性、稳固性、可燃性物理变化变化基本反响种类:化合、分解、置换、复分解电子转移:氧化复原、非氧化复原离子参加:离子反响、非离子反响物理变化反响程度:可逆、不行逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反响式、电离方程式阿伏加德罗常数:N A=N/n计量物质的量摩尔质量: M=(mol) m/n气体摩尔体积: V =22.4 n (标准情况)溶液的浓度:=n/VC浊液:悬浊液、乳浊液分别系胶体:分别质微粒直径10-9~10-7 m溶液:溶解均衡、溶解度色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性物理性质游离态单质宏观元素化合物组化合态大部分有机物罕有气体分子晶体分子酸气态及挥发性物质原子晶体原石墨(混淆晶体)子微观金属晶体大多数盐强碱离子晶体离子碱性氧化物部分过氧化物金属性、非金属性氧化性、复原性酸性、碱性稳固性、可燃性金属化学性质单质非金属罕有气体纯净物化合物分类性质无机物有机物氢化物金属氢化物酸性物质非金属氢化物碱性成盐氧化物两性氧化物特别变化不行盐氧化物含氧酸、无氧酸酸强酸、弱酸强碱、弱碱碱可溶碱、难容碱正盐酸式盐盐碱式盐复盐;络盐潮解、分馏混淆物有机、无机升华、萃取物理变化化学变化化合、分解、置换、复分解风化、干馏氧化复原;非氧化复原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不行逆物质构造分子分分分化子子子学的的间键形极作运成性用动力状(态范共离金德价子属极非华键键键力特性极)殊分性性子分共离金子价子属电化化单合合质影子物物及云响合物金理性质晶体类构造简图型电子式金分原离属子子子晶晶晶晶横:周期体体体体n=1n=2n=3n=4n=5n=6n=7纵:族原子中子质量数同位素核外电子原子核核电荷数元素性质子规( 质排原子序数变律分化层布) 规元律素周最次各能期律外外层量层层最最不不多低表现形式超超容原过过纳理元8 18 2n 素个个2 周个实期质律表元元元核示方素编素归素决外制法周周纳性定电表期期质子的表律的排结周布构期周性期性元素种类起止序号2短周期1~28 3~10 元生性质8 11~ 18 周原18 19~36 期子长周期表18 37~54结位构32 55~86 置21 不完整周期87~111主族:Ⅰ A ~Ⅶ A副族:Ⅲ B~Ⅶ B、Ⅰ B ⅡBⅧ族0族比较种类离子晶体 原子晶体 分子晶体组成晶体微粒 阴、阳离子 原子 分子形成晶体作使劲 离子键 共价键 范德华力熔沸点 较高 很高 低硬度硬而脆 大 小不良熔融物导电性.导电绝缘体 (半导体 )不良水溶液理性质传热性不良不良不良延展性 不良 不良 不良溶解性 易溶于极性溶剂 不溶于任何溶剂相像相溶典型实例NaCl , KBr单质:金刚石、 SiC 、Si 、SiO 2单质:H 2、O 2化合物:冰、干冰化 表示方法 :v A =△c A /△t 单位: mol/L · s(min 或 h )学反 是均匀速率,均取正当应 特色 同一反响采用不一样的物质表示速率,数值可能不一样 速率各物质表示的速率比等于该反响方程式的系数比计算内因 (主)和化反响物的构造、性质学 化影响要素浓度化学 反 学 应用压强应 反平速 应衡温度率 条 合外因(辅)件 成催化剂的氨其余条件光、超声选适波、激光、放射线化 择 可逆反响学 于平 化学均衡成立的条定 各成分百分含量保持不变衡件: v 正 =v 逆≠ 0等 v 正=v 逆 ≠ 0化学均衡的特色 动 动向均衡化学均衡、化学(均衡标记的判断 )变条件改变,均衡状态改变反响速率浓度影响化学均衡要素压强 均衡挪动原理(勒沙特列原理 )温度强电解质(完整电离) AB A -+B-(已电离的弱电解质分子数电离均衡 AB A - - 电离度的定义 (电离度α =×100%)电 弱 部弱电解质的分子总数+B 解 电 分 电离度均衡的挪动质解 电化 质 离水的离子积 K W =1× 10-14(25℃ ) 合 )物水的电离均衡 H 2 O H ++OH-溶液的酸碱性: PH=-log[H + ]本质 装置种类发生条件盐类的水解规律(酸碱性性判断)表示方式-离子方程式影响要素离子反响复分解反响非氧化复原水解反响常有种类络合反响置换反响氧化复原溶液中氧化复原反响非 电 解 质比较装置能量变换 (本质)装置特色电极名称电子流向原理蓄电池学 能 应用 电源干电池能 的 原电池 高能电池电 与转变学能电能电 换 电解池解氯碱工业(电解饱和食盐水):原理质化电镀溶 应用电解精练(精练铜) 液电冶炼金属(冶炼铝)原电池电解池化学能→电能电能→化学能(两极分别发生氧化复原反响产生电流)(在电流作用下两极分别发生氧化复原反响)外电路无电源;两极为开朗性不一样外电路一定有直流电源;两极资料均 (或此中之一为能导电的非金属)的金属能导电即可负极(-)——较开朗 阴极——连结电源负极正极(+)较不开朗阳极——连结电源正极eee负极(-)→正极(+)电源负极→阴极电源正极→阳极氧化复原复原电极反响负极: M -ne → M n+开朗金属失掉电子被氧化、被溶解、被腐化。
