最新-2018高考化学二轮复习专题与增分策略 有机合成与推断 限时规范训练 精品
2018版步步高大二轮专题复习与增分策略化学专题复习:专题一 物质的组成、分类及变化 化学用语 含解析

[考纲要求] 1.了解分子、原子、离子等概念的含义;了解原子团的定义。
2.理解物理变化与化学变化的区别与联系。
3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
4.了解胶体是一种常见的分散系。
5.熟记并正确书写常见元素的名称、符号、离子符号。
6.熟悉常见元素的化合价,能根据化合价正确书写化学式(分子式),或根据化学式判断元素的化合价。
7.了解原子结构示意图、分子式、结构式、结构简式的表示方法。
1.利用分类思想宏观把握物质类别2.利用分类思想准确把握氧化物氧化物⎩⎪⎪⎪⎨⎪⎪⎪⎧ 按组成元素⎩⎨⎧ 金属氧化物:如K 2O 、CaO 、Fe 2O 3非金属氧化物:如SO 2、CO 2、SO 3、 P 2O 5按性质⎩⎪⎨⎪⎧ 成盐氧化物⎩⎨⎧ 酸性氧化物:如CO 2、SO 3碱性氧化物:如Na 2O 、 CuO 两性氧化物:如Al 2O 3不成盐氧化物:如CO 、NO 特殊氧化物:如Fe 3O 4、Na 2O 2、H 2O 23.正误判断,辨析“一定”与“不一定”(1)同种元素组成的物质一定是纯净物(×)(2)强碱一定是离子化合物,盐也一定是离子化合物(×)(3)碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物(√)(4)酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物(√)(5)能电离出H +的一定是酸,溶液呈碱性的一定是碱(×)(6)在酸中有几个H 原子就一定是几元酸(×)(7)含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键(√)(8)盐中一定含金属元素(×)(9)能导电的一定是电解质,不导电的一定是非电解质(×)(10)强电解质的导电性一定大于弱电解质的导电性(×)4.识记常见混合物的成分与俗名(1)水煤气:CO 、H 2(2)天然气(沼气):主要成分是CH 4(3)液化石油气:以C 3H 8、C 4H 10为主(4)裂解气:以C 2H 4为主(5)水玻璃:Na 2SiO 3的水溶液(6)王水:浓盐酸与浓硝酸的混合物(体积比3∶1)(7)波尔多液:主要成分是CuSO 4和Ca(OH)2(8)肥皂:主要成分是C 17H 35COONa(9)碱石灰:NaOH 、CaO(10)铝热剂:铝粉和金属氧化物的混合物(11)漂白粉:Ca(ClO)2和CaCl2的混合物题组一理解概念,准确判断1.正误判断,正确的划“√”,错误的划“×”。
2018高考化学二轮难点增分七有机合成与推断题的突破策略(1)42页文档

61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
谢谢!Байду номын сангаас
2018高考化学二轮难点 增分七有机合成与推断
题的突破策略(1)
6、纪律是自由的第一条件。——黑格 尔 7、纪律是集体的面貌,集体的声音, 集体的 动作, 集体的 表情, 集体的 信念。 ——马 卡连柯
8、我们现在必须完全保持党的纪律, 否则一 切都会 陷入污 泥中。 ——马 克思 9、学校没有纪律便如磨坊没有水。— —夸美 纽斯
2018年全国卷高考化学复习专题《有机推断合成》真题集训(解析卷)

2018年全国卷高考化学复习专题《有机推断合成》真题集训1.高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物.E的合成路线如下(部分反应条件和试剂略):请回答下列问题:(1)试剂Ⅰ的名称是________,试剂Ⅱ中官能团的名称是________,第②步的反应类型是________.(2)第①步反应的化学方程式是________________________________.(3)第⑥步反应的化学方程式是________________________________.(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是________.(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH.若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y収生缩聚反应所得缩聚物的结构简式是_______________.[解析](1)试剂Ⅰ的结构简式为CH3OH,名称为甲醇;试剂Ⅱ的结构简式为BrCH2CH2CH2Br,所含官能团的名称为溴原子;根据的结构简式及试剂Ⅱ判断第②步的反应类型为取代反应.[答案](1)甲醇溴原子取代反应2.反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一.根据该合成路线回答下列问题:已知:(1)A的名称是________;B分子中的共面原子数目最多为_______;C分子中与环相连的三个基团中,不同化学环境的氢原子共有________种.(2)D中含氧官能团的名称是________,写出检验该官能团的化学反应方程式:__________________________.(3)E为有机物,能収生的反应有:________.a.聚合反应b.加成反应c.消去反应d.取代反应(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:____________________________.(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整.(6)问题(5)的合成路线中第一步反应的目的是___________________.[解析](1)A为正丁醛或丁醛.B的结构可表示为④,可根据乙烯的平面结构分析:①号和②号C原子及与它们所连的原子,共有6个原子共面;O原子所连的③号C相当于羟基H,也共面;由于单键可以旋转,故④号C和所连的3个H原子中可以有1个共面,故共面的原子最多有9个.由于C的结构不对称,故与环相连的三个基团不对称,则三个基团中不同C原子上的H原子均不相同,即不同化学环境的H原子共有8种.(2)D中的含氧官能团为醛基;检验醛基可用银氨溶液或新制Cu(OH)2悬浊液,反应的化学方程式为(3)产物E为有机物,根据已知中的反应原理可知E为C2H5OH,该有机物为乙醇,可収生消去反应和取代反应,但不能収生聚合反应和加成反应,故答案为cd.[答案](1)正丁醛或丁醛98(2)醛基(6)保护醛基(或其他合理答案)3.芳香族化合物A的分子式为C9H9O3Cl,苯环上有2个取代基且苯环上的一氯代物只有2种,A中滴入浓溴水能产生白色沉淀.G能使溴的四氯化碳溶液褪色.用如图转化关系能合成E、F两种有机高分子化合物.已知两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动収生脱水反应,如:CH3CH(OH)2→CH3CHO+H2O.回答下列问题:(1)B中官能团的名称为____________.(2)I与苯酚可用来制取酚醛树脂,其反应类型为________,G→F的反应类型是________.(3)D→G的反应条件是____________;J的核磁共振氢谱图中有________个吸收峰.(4)A的结构简式为____________________.1 mol A与足量NaOH溶液反应,可消耗________mol NaOH.(5)写出下列反应的方程式:D→E的化学方程式: ___________________________;B与新制氢氧化铜反应的化学方程式:________________________.(6)满足下列条件的C的同分异构体有________种(不考虑立体异构).①能在碱性条件下水解②含有酚羟基[答案] (1)酚羟基、醛基 (2)缩聚反应 加聚反应 (3)浓硫酸、加热 24.以下为有机物H的合成路线(1)A的名称是________.G→H的反应类型是____________,F中官能团名称是________________.(2)E的结构简式为______________________________.(3)写出由对甲基苯甲醇生成D的化学方程式:________________.(4)T是E的同系物,分子式为C10H10O2,具有下列结构与性质的T的同分异构体有________种;①遇到氯化铁溶液収生显色反应②能収生银镜反应③能収生加聚反应④苯环上只有2个取代基其中,在核磁共振氢谱上有6组峰,且峰面积之比为1:2:2:2:2:1的有机物的结构简式为___________.[答案] (1)甲苯 加聚反应 酯基、碳碳双键、溴原子5.某聚酯类高分子材料M 的一种合成路线如图所示:(ii)同一个碳原子上连着两个双键,物质不能稳定存在;碳碳双键上连羟基不稳定请按要求回答下列问题:(1)A的分子式:_____________;B→C的反应类型:______________;C的官能团结构简式:______________.(2)M的结构简式:________________________________.(3)写出下列反应的化学方程式:B与氢氧化钠水溶液加热:_______________;E与银氨溶液水浴加热: _____________________________.(4)写出满足下列条件G的同分异构体的数目________(不考虑顺反异构).①能使酸性高锰酸钾溶液褪色②核磁共振氢谱有3个吸收峰,峰面积之比为1:1:26.化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:[解析](1)由D的结构简式可知,D中的含氧官能团有(酚)羟基、羰基和酰胺键.(2)由F、G的结构简式可知,F中的—OH消失,出现了新的碳碳双键,F→G应是醇羟基収生的消去反应.(3)能収生银镜反应,则同分异构体中含有醛基;能収生水解反应,且产物之一能与FeCl3溶液収生显色反应,则该水解产物含有酚羟基,进一步可推知同分异构体中含有与苯环直接相连的基团“—OOCH”;又因为分子中含有4种氢原子,符合条件的同分异构体有3种:(4)由F的结构简式可知,其分子式为C14H19O3N,而E的分子式为C14H17O3N.由于E经还原得到F,且E中不含Br元素,综合分析D和F的结构变化可推知,E中羰基被还原为醇羟基生成F,逆推可知E的结构简式应为。
2018年高考化学学科二轮复习备考策略

T: O Q: S
A.Q元素所形成的氢化物是同族元素中沸点最低的 B.L、R的单质与盐酸反应速率为:R>L C.M与T形成的化合物是一种新型无机非金属材料 D.L、Q形成的简单离子核外电子数不相等
由元素的原子序数和在周期表中位置可知,R为Be, T为O,L为Mg,M为Al;,Q为S。 A项,H2O因其含有分子间氢键,故是第ⅥA族中 沸点最高的氢化物,故A项错误; B项,同一主族元素,从上到下,元素的金属性逐 渐增强,则L、R的单质与盐酸反应速率R<L,故 B项错误; C项,M与T形成的化合物为Al2O3,虽然是两性氧 化物,但同时也是新型陶瓷,新型陶瓷有Si3N4、B N、Al2O3等,故C项正确; D项,L、Q形成的简单离子分别为Mg2+、S2-,核 外电子数分别为10、18,因此L、Q形成的简单离 子核外电子数不相等,故D项错误。
C15H12O5
特点三:经典题型常考常新 第8题有关NA的讨,第10题实验基 础知识,第11题原电池的工作原理, 第12题物质结构、元素周期律。
16
下图是另一种元素周期表——三角形元素周期表的一部 分,图中标示了L、M、Q、R、T元素的位置,下列判 断不正确的是 B
R: Be L: Mg M: Al
9
2015~2017高考化学试题特点 特点一:试题以传统文化为背景
(2017全国Ⅰ. 8)《本草衍义》中对精制砒霜过程 有如下叙述:―取砒之法,将生砒就置火上,以 器覆之,令砒烟上飞着覆器,遂凝结累然下垂 如乳,尖长者为胜,平短者次之。‖文中涉及的 操作方法是 B A.蒸馏 B.升华 C.干馏 D.萃取
4
一、科学设计命题内容,考查创新思维 能力 在化学学科领域,创新思维能力包括合 成新物质、阐释新的反应历程或结构理论、 设计新的实验方案和合成方法或路线以及 应用新的技术。今年高考化学试题对创新 思维能力的考查主要体现在设计实验方案 和合成路线两个方面。
【新课标】2018最新版本高考化学的三轮复习策略(新人教版)

(4)化学反应与能量 试题考查将集中在:反应热的含义(三种反应热的表示方式 及符号含义),盖斯定律的应用,能量转化方式的判断,燃烧热、 中和热、热化学方程式和电极反应式的书写与正误判断,电化学
装置的工作原理,充放电过程中电解质溶液的变化,有关能源、
燃料等热点问题,相关计算。 注:三种反应热的表示方式: ①生成物总能量-反应物总能量
一轮复习时间:8月—次年1月底
想法:是在整合教材的基础上,将相关知识融为一体,增强知识 的逻辑性和整体性,更大程度的体现学科内的综合,形成大学科知识 体系和网络,提升学生知识应用能力。更大程度上体现知识的难度、 广度、厚度、关联度,不一定就是要求快、难、广、厚,而是要把握 好这个度。同时将两本选修内容也穿插其中,有的时候可以拓宽必修 内容的视野,可提升必做题的答题能力,比如有机化学部分,学了选 修5后,必修部分就不足为道了。 同时关注一轮复习和二轮复习的顺畅衔接。备考过程中切忌冒进,必 须注重细节,踏实备考,备考无捷径,备考的路是一步一步走出来的, 可以超越但不能跨越。
意义和地位: 一轮复习重基础,形成知识网络,兼顾知识的难度、广度、 厚度、关联度,而二轮复习进一步达到“构架知识网络”,是 力争使学生内化知识网络,强化知识体系,是一轮复习的一个 延续和发展,重突破和提升,重知识的综合性和应用性。二轮 复习是整个复习过程中最关键的一个轮次,是提升学生综合能 力的关键一步。 二轮复习承载的责任和功能更大。二轮复习的效果可能直 接决定着一个考生高考的成败。
从“加强基础训练”到“加强综合训练”再到“加强模拟性 综合训练”是一个层层递进的过程,前者是后者的基础,是后者 的延伸和发展,后者是前者的总结和综合,三轮复习是一个统一 体。
一轮复习和二轮复习是有一定区别的, 二者承载的功能不同。
高考化学二轮增分策略 加试32题专练

亲爱的同学:这份试卷将再次记录你的自信、沉着、智慧和收获,我们一直投给你信任的目光……学习资料专题加试32题专练1.(2018·余姚中学高三选考模拟)化合物N是一种用于合成γ分泌调节剂的药物中间体,其合成路线流程图如下:(1)H的结构简式为____________________________________________________________。
(2)下列有关说法错误的是________。
A.G在一定条件下既能与酸反应,又能与碱反应B.C能发生银镜反应C.F→G的反应类型是取代反应D.有机物N的分子式为C13H15NO5(3)写出D→E的化学方程式:__________________________________________________。
(4)写出同时满足下列条件的G的所有同分异构体的结构简式:____________________________________________________________________________。
①含有苯环,核磁共振显示分子中只有四类氢②能发生水解反应,且1 mol该物质与NaOH溶液反应时最多可消耗3 mol NaOH(5)丙烯A经过加成、氧化两步反应可合成C,请写出其合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
答案(1)(2)BC(3)+HNO 3(浓)――→浓H 2SO 4△ +H 2O (4)(5)CH 3CH===CH 2――→HOCl 催化剂――→[O]CH 3COCH 2Cl解析 (1)由N 的结构可知H 与C 发生取代反应生成一个HCl 分子,则H 的结构为。
(2)由H 、N 结构可推知G 的结构为,酯基可以在碱性条件下水解,氨基可以与酸反应,故A 正确;C 中有羰基没有醛基,不能发生银镜反应,故B 错误;F→G 的反应――→H 2Ni ,△,属于加成反应,故C 错误。
2018高考化学二轮复习指导

2019高考化学二轮复习指导二轮复习主要是通过练习强化对知识的理解和应用。
综合训练与专题训练相结合,练题的同时注意归纳总结,比如有机推断专题,钢铁的腐蚀、离子反应等专题。
同时,训练答题的准确性、规范性,提高解题速度,多整理易错点、失分点,并进行强化练习。
信息题则要学会如何去粗取精、去伪存真。
1、专题训练、归纳总结近几年的高考化学试卷,逐年倾向于“能力立意”,更加注重能力和素质的考查。
同时由于试题数目有限,高考卷考察的知识点也比较固定。
所以专题练习可以按照题型和知识点分类专题练习。
以北京高考题为例,7道选择题中,电化学(原电池、电解池或者金属的防护和腐蚀)、化学反应速率和平衡、方程式的正误判断、实验题是常考题目,我们就可以按照这样的专题进行练习。
练习时,注意归纳总结,反思复习,找出同一类题目之间的共通点,同时构建知识点之间的联系,形成完整的知识体系,以题目“反刍”知识,以知识指导题目。
2、限时训练、综合训练(1)限时训练理综化学的选择题并不多,北京卷7道,考试时10-15分钟内完成比较合适,建议学生给自己规定一个时间,对每一个专题模块或者综合训练时进行限时训练,防止大量题海战术时脑疲劳,做题效率下降。
(2)综合训练每周进行一次学科内综合训练。
以北京卷为例,7道Ⅰ卷选择题,4道Ⅱ卷题,限时45分钟完成。
45分钟时间虽然紧张,但不能给得太多时间。
此用意在于:①提高解题速度;②提高阅读、审题能力;③学会合理舍弃,同时调整考试心理,提高考试技巧。
3、跳出题海、突出方法由于复习时间紧任务重,要使学生在有限的时间内复习掌握大量知识并形成知识网络,就必须跳出题海,突出方法,提高复习效率。
突出主干知识相关的题目和题型,新题、难题、偏题适当舍弃。
注意建立知识之间的练习,注重对思维能力的训练,注重对学习方法归纳,并留出时间思考和通读课本。
解题时有意识地进行思维能力训练,找出该题所涉及的知识点(审题)→回忆、联想相关的知识(构思)→应用知识点解决问题(解答)。
2018届高三化学二轮复习计划

2018届高三化学二轮复习计划从三月开始的第二轮复习是高考复习备考非常重要的时期,也是巩固基础、建构网络、总结规律、优化思维、提高能力、熟悉高考的重要阶段,复习效果如何将直接影响高考成绩的好坏。
为了使第二轮复习能扎实有效地顺利进行,确保今年高考取得优异成绩,经过高三备课组认真讨论,深入思考,特制订如下的教学计划:一、具体措施1、组织教师加强对教纲、考纲及考试说明的学习,把考点分解到每节课,复习中重视知识的横向与纵向深入,把握高考复习的正确方向。
组织教师再次精心研究近几年的高考试题,体会高考的命题思想及测试方向。
复习时精选专题,以点带面,使学生知识系统化、网络化。
2、对例题、练习、试题,加强针对性的筛选,特别关注重点知识、热点知识,各类平行班级统一进度、统一训练。
每次训练认真分析测试结果,及时调整复习计划、训练内容和辅导的方式。
采用形式多样的训练方式,包括专题训练、题型训练、化学“7+3+1”训练、纠错训练、选择题训练、理综训练等。
每周至少安排一次理综训练,一次“7+3+1”训练,二至三次选择题专项训练。
3.每周星期一下午为集体备课教研活动时间,讨论下周应讲授知识的重点与难点、本周训练内容、研究学生的学情与教法。
备课组中加强全体教师对关键问题、内容的沟通与研究,引导全体同学探究化学复习方法,狠抓听课效率和训练质量两个关键点。
4.抓好培优补弱工作。
在复习过程中要对小班化学成绩好的学生进行培优,要鼓励他们不要安于现状,要争取更大的成绩;可以在不影响其它科目学习的情况下安排额外的学习训练任务;指导其自主学习和更有效的复习方法,让其充分发挥自己学习的主动性;每次训练的批改要更加严格要求规范,对于出错的地方要帮助他们找出原因,指导其做好改错本和知识归纳的方法,使化学成为其优势学科。
对于其他科目突出但是化学相对薄弱的临界学生做好补差工作,平时对其学习多关注,多鼓励,给其信心,要给他们制定明确的学习目标;试卷的批改要指出其出错的地方,尽可能的面批面改;适当进行单独辅导,对于掌握不好的考点知识进行专题训练。
2018版步步高大二轮专题复习与增分策略化学专题复习:专题八 化学反应速率 化学平衡 含解析

[考纲要求] 1.了解化学反应速率的概念、反应速率的定量表示方法。
2.了解催化剂在生产、生活和科学研究领域中的重要作用。
3.了解化学反应的可逆性。
4.了解化学平衡建立的过程;了解化学平衡常数的含义,能够利用化学平衡常数进行相关计算。
5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。
6.了解化学反应速率和化学平衡的调控在生产、生活和科学研究领域中的重要作用。
1.深度剖析速率的计算方法 (1)公式法:v (B)=Δc (B )Δt =Δn (B )V Δt用上式进行某物质反应速率计算时需注意以下几点:①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
②化学反应速率是某段时间内的平均反应速率,而不是即时速率,且计算时取正值。
③对于可逆反应,通常计算的是正、逆反应抵消后的总反应速率,当达到平衡时,总反应速率为零。
(注:总反应速率也可理解为净速率)(2)比值法:同一化学反应,各物质的反应速率之比等于方程式中的化学计量数之比。
对于反应:m A(g)+n B(g)===p C(g)+q D(g)来说,则有v (A )m =v (B )n =v (C )p =v (D )q 。
2.正确理解速率影响因素(1)“惰性气体”对反应速率的影响①恒容:充入“惰性气体”――→引起总压增大―→物质浓度不变(活化分子浓度不变)―→反应速率不变。
②恒压:充入“惰性气体”――→引起体积增大――→引起物质浓度减小(活化分子浓度减小)――→引起反应速率减小。
(2)纯液体、固体对化学反应速率的影响在化学反应中,纯液体和固态物质的浓度为常数,故不能用固态物质的浓度变化来表示反应速率,但是固态反应物颗粒的大小是影响反应速率的条件之一,如煤粉由于表面积大,燃烧就比煤块快得多。
(3)外界条件对可逆反应的正、逆反应速率的影响方向是一致的,但影响程度不一定相同。
①当增大反应物浓度时,v正增大,v逆瞬间不变,随后也增大;②增大压强,气体分子数减小方向的反应速率变化程度大;③对于反应前后气体分子数不变的反应,改变压强可以同等程度地改变正、逆反应速率;④升高温度,v正和v逆都增大,但吸热反应方向的反应速率增大的程度大;⑤使用催化剂,能同等程度地改变正、逆反应速率。
2018高考二轮专题复习-有机合成与推断

X 的结构简式为
。
首页
(5)苯乙酸乙酯是一种常见的合成香料。请设计合理的方案以 苯甲醛和乙醇为原料合成苯乙酸乙酯(用合成路线流程图表 示,并注明反应条件)。 提示:①R-Br+NaCN—→R-CN+NaBr; ②合成过程中无机试剂任选; ③合成路线流程图示例如下:
2018高考二轮专题复 习-有机合成与推断
专题十三 有机合成与推断
考情调研
真题回眸 (2010·福建理综,31)从樟科植物枝叶提取的精油中含有下列 甲、乙、丙三种成分:
首页
分子式 部分性质
C16H14O2 能使 Br2/CCl4 褪色 能在稀 H2SO4 中水解
(丙)
(1)甲中含氧官能团的名称为____________。 (2)由甲转化为乙需经下列过程(已略去各步反应的无关产物, 下同):
该有机物是含羟基的羧酸,并根据酯的结构,确定—OH 与
—COOH 的相对位置。
首页
4.应用一些特殊的转化关系推断有机物的类型 (1)A—O—2→B—O—2→C,此转化关系说明 A 为醇,B 为醛,C 为
羧酸。
符合此转化关系的有机物 A 为酯,当酸作催化剂时,产物是 醇和羧酸,当碱作催化剂时,产物是醇和羧酸盐。
(4)加入新制 Cu(OH)2 悬浊液并加热,有砖红色沉淀生成, 或加入银氨溶液有银镜出现,说明该物质中含有—CHO。
(5)加入金属钠,有 H2 产生,表示物质可能有—OH 或 —COOH。
首页
(6)加入 NaHCO3 溶液有气体放出或能使紫色石蕊试液变红, 表示物质中含有—COOH。
3.应用特征产物推断碳架结构和官能团的位置
(1)若醇能被氧化成醛或羧酸,则醇分子中含“—CH2OH”;
2018——2019学年北京高三化学二轮复习(有机推断和有机合成)
2018——2019学年北京高三化学二轮复习有机推断和有机合成注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔在答题卡上填写自己的准考证号、姓名、试室号和座位号。
用2B 型铅笔把答题卡上试室号、座位号对应的信息点涂黑。
2.选择题每小题选出答案后,用2B 型铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4.考生必须保持答题卡整洁。
考试结束后,将试卷和答题卡一并交回。
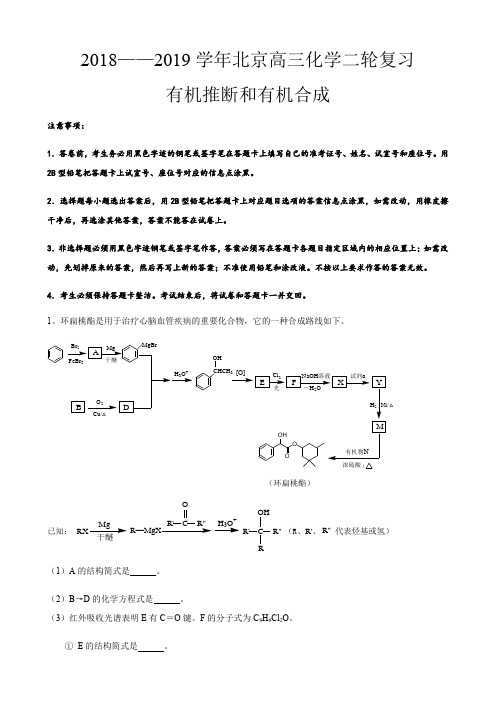
1、环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如下。
CHCH 3OH(环扁桃酯)△Mg R —R'R"OH 3O +CR'R"OH 已知:(R 、R'、R"代表烃基或氢)C(1)A 的结构简式是 。
(2)B →D 的化学方程式是 。
(3)红外吸收光谱表明E 有C =O 键。
F 的分子式为C 8H 6Cl 2O 。
① E 的结构简式是 。
② E →F 的反应类型是 。
(4)X 的结构简式是 。
(5)试剂a 是 。
(6)生成环扁桃酯的化学方程式是 。
(7)以CH 3CH =CH 2、CH 3CHO 为有机原料,结合题目所给信息........,选用必要的无机试剂合成CHCHCH 2CHCH 3,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
答案:(1)Br(2)2 CH 3CH 2OH + O 22 CH 3CHO + 2 H 2O(3)①COCH 3②取代反应(4)COCHO(5)O 2、催化剂(其它合理答案均可)(6)CHOH COOH+CHOHC O+ H 2O(7)路线一:CH 3CH CH 2Br 一定条件CH 2CH CH 2干醚CH 2CH CH 2MgBrCH CHOH O +CH 2CHCH 2CH 3CHOH浓硫酸CH CH CH 2CH 3CH2、(17分)(2019年北京朝阳)药物中间体Q 、医用材料PV A 的合成路线如下。
2018高考化学二轮复习:高考有机化学试题分析与二轮复习策略探讨

高考有机化学试题分析与二轮复习策略探讨2018年考试大纲与2017年考纲比较无明显变化,相对于2016年考试大纲有很大幅度调整,这说明2018年高考化学科的命题仍然保持相对的稳定。
2018年考纲说明在有机部分题型示例中新添加一道题型示例26选自2016年全国Ⅰ卷,这道题以糖类为主,涉及芳香烃、醇、酸、酯及聚合物等高中有机化学的主要知识点,主要考查考生对有机化合物的分子式、结构式、有机反应方程式、同分异构体、官能团相互转化、有机物合成路线设计等内容,这都与新增加的内容对应,对考生的综合应用能力以及运用新知识解决问题的能力要求较高。
一、高考试题对比分析主要考查三种题型,性质题、结构题和(STSE)的情境题,性质题主要是教材涉及到的常见有机物的类型、官能团的名称、官能团的性质;结构题主要是考查同分异构体的数目。
(STSE)的情境题是以与化学学科相关的代表中国古代文明、科技发展的材料为背景,考查与中学化学密切相关的物质的性质、用途等知识点,情景选材大量来自于实际应用情景。
不但注重了对考生的科学素养和科学能力的要求,而且突出了思维的开放性和探究性的考查。
有机选择题具有的特点:第一,紧扣考试大纲,考查的内容均在考纲范围内。
第二,基础性强,考查的内容主要是有机化学的一些主干知识,难度不大,通过对近五年试卷的考情进行分析,发现有机选择题的得分率较高。
第三,考查范围广,考查的内容不仅仅是某一个知识点,一题当中可能涉及有机物的命名、同分异构体的书写、有机物的基本性质等多个考点。
第四,题型多样,题目有时以信息题的形式进行命题,有时会以开门见山的形式进行命题。
表四、近五年全国高考理综Ⅰ有机选做题题型结构对比统计2013年至2017年有机合成与推断题的分值均为15 分,题目均是以合成框图的形式出现,一般流程图较长,6小问,7~10空居多。
同时通过相关反应推断产物,题目的设置从易到难,简单有机物的命名、官能团的名称、反应类型的判断,反应方程式的书写到合成路线的设计,考查的知识点较广且综合性强。
高三化学第二轮复习策略

高三化学第二轮复习策略及复习进度经过半年多的苦教苦学我们终于胜利结束了第一轮复习,即将如火如荼地进行第二轮复习,第一轮复习就是按照课本顺序,逐个逐个地对课本中出现的每一个知识点进行讲解疏理,也就是说完成了对学生的“广积粮”阶段,在这个基础上如何更有效,更有序,更有针对性地进行第二轮复习呢复习的目的为:①帮助学生对已基本掌握的零碎的化学知识进行归类、整理、加工,使之规律化、系统化、条理化、网络化;②对知识点、热点、考点进行思考、总结、处理;让学生掌握的知识更为扎实牢固,相关的知识类比化,同类的知识系统化;③提高学生的知识综合、归纳与概括能力以及分析问题、解决问题的能力,增强知识的运用能力;我们的做法是:“选好例题突破难点、疑点、弱点、盲点及热点知识”:如对“阿伏加德罗常数”的热点考查进行专题复习,将历年高考题归纳发现“陷阱”的设置主要有以下几个方面:①状况条件:考查气体时经常给非标准状况如常温常压下,×105Pa、25℃时等;如MCE97-1525℃,压强为×105Pa时,氮气所含的原子数目为NA;②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等;如:MCE96-20B 标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为8NA/;③物质结构:考查一定物质的量的物质中含有多少微粒分子、原子、电子、质子、中子等时常涉及希有气体He、Ne等为单原子组成,Cl2、N2、O2、H2为双原子分子等;如:MCE96-20D常温常压下,1mol氦气含有的核外电子数为4NA;MCE97-1531g白磷分子中,含有的共价单键数目是4NA个④氧化—还原反应:考查指定物质参加氧化—还原反应时,常设置氧化—还原反应中氧化剂、还原剂、氧化产物、还原产物被氧化、被还原、电子转移得失数目方面的陷阱;如:MCE03-141molNa2O2与水充分反应后转移的电子数为2NA;MCE98-91mol硫原子同足量的铜粉充分反应时,铜失去的电子数为2 NA ;⑤电离、水解:考查电解质溶液中微粒数目或浓度时常涉及弱电解质的电离,盐类水解方面的陷阱;如:SMCE03L的硫化钠溶液中硫离子数目为;从历年高考实验题的考查和学生的实验题解答情况分析,主要暴露了三大问题:一是审题不过关,没读懂题;二是缺乏实验思维;三是答题语言文字表述及化学用语使用不规范;复习中就要求老师进行专门训练与提高,重点在于要求学生思维方法到位;讲解解题技巧方法时,不仅把涉及本章知识的例题讲透,还同时将该方法还能用到其它章节的哪些知识点同时进行归纳与总结,以便学生能真正学会方法,能举一反三;一、认真研读“考纲考题”,提高复习的针对性1、深入研究新课程标准与考试大纲考试大纲是高考命题的依据,考试大纲对高考要考查的知识范围及每个知识点的能力层次都有明确的要求,不能随意的扩大或缩小复习范围,这一点在第二轮复习中显得尤为重要,因为第二轮复习时间短,任务重,不能在“深”、“难”、“偏”上浪费学生的时间和打击学生的自信心;我们很多老师都有这样的感觉:高考题一出来就说我们在复习中做了很多“无用功”;学生也有这样的感觉:考试时感觉良好,估分时捶头顿足,容易的题反而丢分了;究其原因,是难题做多了易题做少了不是题目做多了,教师考纲研究不够,学生解题后的再思考太少了,复习的导向搞偏了,组织教师对考试大纲集中培训;2、潜心研究高考试题研究高考试题非常重要,高考试题不仅是考试大纲对高考要求的具体体现,而且代表了高考考查的方向和深广度;怎么研究我认为可分为三个层面:一是做,新上高三的教师主要做5年来各地高考卷,上过高三的教师重点做3年来年各地高考卷,目的是找感觉,感受高考试题的深广度,这有助于我们在二轮复习把握好“度”,特别是防止在训练题中片面追求偏、难、怪;二是比,对各年全国卷比较,对全国各地卷比较,从中找差别、找共性、找联系,这样,复习的目标更明确,复习的思想更开阔;三是找,通过对近三五年的高考试题的重点研究,找趋势、找方向、找规律,据此可排查出高考的重点、难点、热点,从而提高教师复习的针对性;3、精心研究化学考试能力要求考试大纲中明确规定了化学学科的三种考试能力:接受、吸收、整合化学信息的能力,分析问题和解决解答问题的能力,化学实验与探究能力;教师要充分利用近年高考题,对以上三种能力在高考题中的体现方式和考查形式进行深入细致的分析研究,要将三种能力的提高贯穿于二轮复习教学的始终;同时我们也把考纲中涉及的考点和能力要求以复习材料的形式印发给学生,也让学生知道考什么、怎么考、考到什么程度,从而提高学生复习的针对性;二、切实实行主备制,提高课堂教学的实效性高三二轮复习的主渠道在课堂,课堂教学效率的高低,直接影响教学质量的高低;复习的基本课型有复习课和讲评课;1、复习课经过一轮复习后,我们对所有知识点都复习过一遍,若在二轮复习课堂中再次罗列知识点,教师烦、学生更烦,课堂效率自然低下,怎样提高课堂效率关键在备课;为适应新时代教育教学方式改革的需求,在二轮复习中我们将积极探索教学改革的新思路,新方法,全方位整合各种信息,推行集体备课制,把第二轮复习的各大专题分解成21个小专题,这样既可以加强备课组内教师教学心得的交流,又可以较好地帮助青年教师的成长,还能加强备课组内教师的团结协作,减轻教师工作负担;二轮复习中比较常用的教学设计有:1以题目带知识,考点知识化,知识问题化,即先练后讲;2以结构带知识,从知识结构入手复习,可以让学生自己去构建知识网络,使之形成系统化、网络化;3问题导学式,精心设计高质量的问题,让学生带着问题回归课本,让学生直接填写或在课本上找答案;2、讲评课讲评课是高三二轮复习中最常见、最重要的课型;细化一下,又可分为试卷讲评和习题讲评;学生的能力在复习中能否有效提高,讲评课起着非常关键的作用,要上好讲评课,重点也在备课,也可实行主备制,由主备人提出讲评的要点及讲评方法;应注意好以下三个方面的工作:1讲评的几个环节;无论哪种讲评课,都必须确保“训练—批阅—反馈—讲评—反思”等几个环节的完整与落实,即有发必有收,有收必有改,有改必有评,有评必有思;2讲评的基本方法;主要是归类法,按考点归类,按能力要求归类,按解题思想归类,按错题错因归类等,同是错因分析,又有知识、思维、心理等方面;3讲评力求做到以下几点:首先归类讲解,对出现的问题要进行整理分析归类,重点讲评重点、热点、双基应用的薄弱点,学生的易错、易混、易模糊点;其次注意重过程评析,要创造条件,让学生充分展现思维过程你是怎么想的,你为什么要这样想;再次是注重变式训练如一题多变,一题多解,多题一解等,从多角度归纳总结解决问题的思路、方法、规律,讲评不要就题论题,可借题发挥,讲这个题的规范解答、讲这个题的深化变形、讲这个题与同类型题目的联系等,使讲评取得事半功倍的效果;讲评课也不能“满堂灌”,必须给学生留有思考的时间与反思的余地;每次讲评,要求学生红笔纠错,错题入集,二次批阅,专题补偿,三次过关;三、突出学科特点,提高实验复习的实践性一轮复习中实验复习分散到各个章节中,主要是停留在空对空的做实验题,讲实验题的状态,这样始终落后于高考实验命题的改革;因此在二轮复习中要还化学实验以本来面目,否则实验设计的严密性,实验观察的全面性,实验结果的准确性,实验结论的科学性都只能是水中花,镜中月,可望不可及;通过近几年高考试题发现,实验题的比重有所加大,难度略有上升,且更加注重实验基础与能力的双重考查;为此我们可从以下几方面入手复习实验:1、充分利用学校资源和电化教学优势,在实验专题复习时,利用2个晚上放映实验光盘,让学生看名师是怎么做实验和讲实验的;2、利用学校科技节开放实验室的契机,把常用仪器、常用装置搬到实验室,让学生亲自动手去做去感受;3、查漏补缺,强化基础年级时的薄弱环节及盲点,尽量创造条件,补做高一、高二漏做实验,或重做一些具有代表性的典型试验;4、进行实验设计训练;根据实验习题的要求,设计出实验方案对学生进行强化训练;四、精心选题,规范训练,提高训练的有效性学生能力是练出来的,不是讲出来的,如何对学生进行有效训练,精心选题是关键,经过讨论得出选题要遵循以下原则:1、紧扣大纲,参照考点,在选题时考过的知识点作好记号,方便下次命题教师参考,避免知识点的多次重复和遗漏;2、教师跳进题海,从各种信息来源中精选基础性强、思维性灵活,重能力、有梯度的试题,进行改编、整合,使选编习题符合校情、教情和学情,这才不至于浪费学生时间与精力,把学生从题海中解脱出来;习题要精选,训练更要规范;要规范学生的学习行为,首先要规范教师的教学行为;从语言表达到化学用语的书写,教师要身体力行,做好表率,要重视自己的言行对学生潜移默化的影响;要做好学生训练的规范化,我们可以从以下几方面入手:1、营造训练氛围,将规范教育寓于常规训练之中;如张贴“细节决定成败”,“糊里糊涂做十题,不如明明白白做一题”等口号,时刻告诫学生;2、限时限量,对学生进行解题速度和准确率的规范训练;二轮复习,训练很多,但要多搞定时训练,形式不一,套题训练、专题训练均可;3、结合高考评分标准及阅卷实际,对学生进行规范书写、规范答题训练;如方程式、结构简式、电子式等化学用语的书写,简答题的语言表达和描述,计算题的格式、步骤、精确度等;4、对学生进行审题方法、审题能力的训练与指导;审题不严谨,是学生考试最常见最容易犯的毛病,培养学生审题能力的方法很多,其中“读、划、联、挖”四字审题训练法就是很常用很具实效性的一种方法,值得借鉴;5、大考过后,要深化、细化试卷分析,开展反思活动,如开展“规范试卷”上墙,“典型试卷”上墙活动,开展查失分原因活动,帮助学生改进陋习,培养良好的训练答题习惯,真正提高训练的有效性;高三化学三月中旬-四月中旬第二轮板块复习进度拦隆口中学高三理综化学-王艳慧1)第三周3月18日-3月23日:化学基本概念和基本理论;包括化学用语、阿伏加德罗常数专题、离子共存、离子方程式判断、氧化还原反应;共五课时完成;2)第四周3月25日-3月30日:元素及其化合物;元素周期表与元素周期律、信息和无机推断题、原电池与电解池专题;共五课时完成;3)第五周4月1日-4月6日:有机化合物;有机推断与合成,共五课时完成;4)第六周4月8日-4月13日:化学实验及其化学计算;探究性实验、化学反应速率与化学平衡问题;共五课时完成;第三轮专题复习进度1第七周4月15日-4月20日:理综真题训练,穿插N A的应用、离子共存判断及其离子方程式判断正误;共五课时完成 ;2第八周4月22日-4月27日:有机推断和无机推断做题技巧,真题训练;共五课时完成;3第九周4月29日-5月3日:五一放假4第十周5月6日-5月11日:探究性实验的做题技巧包括;无机和有机实验.仿真题训练;共五课时完成5第十一周5月13日-5月18日:化学反应速率和化学平衡做题技巧及反应热、燃烧热与中和热的应用;共五课时完成;6第十三周5月20日-5月25日:回归课本,整理并分析错题7第十四周5月27日-6月1日:回归课本,分析选择题做题技巧。
2018年高三化学二轮备考策略

防止胶体生成,易沉淀分离
取代
(5)芳香化合物X是F的同分异构体,X能与饱和碳 酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4 种不同化学环境的氢,峰面积比为6∶2∶2∶1,写出 2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物 的合成路线________(其他试剂任选)。
化学核心素养
宏观辨识与微观探析 变化观念与平衡思想
证据推理与模型认识
实验探究与创新意识
科学精神和社会责任
能力要求
1.接受、吸收、整合化学信息的能力 (1)对中学化学基础知识融会贯通,有正确复述、再现、辨认的能 力。 (2)能够通过对实际事物、实验现象、实物、模型、图形、图表的 观察,以及对自然界、社会、生产、生活中的化学现象的观察,获取有 关的感性知识和印象,并进行初步加工、吸收、有序存储的能力。 (3)从试题提供的新信息中,准确地提取实质性内容,并经与已有 知识块整合,重组为新知识块的能力。 2.分析问题和解决(解答)化学问题的能力 (1)将实际问题分解,通过运用相关知识,采用分析、综合的方法, 解决简单化学问题的能力。 (2)将分析解决问题的过程和成果,用正确的化学术语及文字、图 表、模型、图形等表达,并做出解释的能力。 3.化学实验与探究能力 (1)了解并初步实践化学实验研究的一般过程,掌握化学实验的基 本方法和技能。 (2)在解决化学问题的过程中,运用化学原理和科学方法,能设计 合理方案,初步实践科学探究。
2018年化学备考策略
一、精准研究明方向 二、精心谋划定策略
方向比努力更重要 能力比知识更重要!
2018版高考化学二轮教师用书第2部分 专项1 题型4 有机合成与推断(选做题) Word版含答案

题型4有机合成与推断(选做题)(对应学生用书第104页)■题型特点解读·1.题目构成题头(介绍产物用途、产物结构及特点)+题干(以框图呈现物质间的转化关系、陌生的反应信息)+题尾(根据物质结构和图中转化关系设问)。
2.考查方式以新药物、新材料等制备为背景,通过对有机合成路线的分析,综合考查有机物的命名、官能团的性质和名称、有机物分子结构式的书写、等效氢原子种类的判断、反应类型的判断、化学方程式的书写、限定条件下同分异构体的书写及数目判断、有机合成路线的设计等。
■解题策略指导·1.基本思路审题干信息→分析框图关系→正推、逆推、推知中间体→联想官能团的性质→解答相关问题。
2.破题关键以反应类型为突破口,以物质类别判断为核心破题。
(1)看原料:明确合成所需原料。
(2)看目的:观察最终合成产品,分析官能团,寻求合理反应。
(3)找中间产物:根据组成、结构特点、转化关系确定官能团的种类与数量。
(4)看条件:把握特征反应条件与物质类别和反应类型的关系。
(5)研究信息:分析新信息对物质的描述、新反应的条件以及反应前后物质结构(官能团)的变化。
(6)明确题目限定条件。
■典例剖析示范·(2017·全国Ⅱ卷)化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线①如下:已知以下信息③:①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。
回答下列问题:(1)A的结构简式④为____________________。
(2)B的化学名称④为____________________。
(3)C与D反应生成E的化学方程式为________________________________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题十六有机合成与推断
1.肉桂酸( )在化妆行业及香料行业中属于明星物质,而且其需求量愈来愈大,如下图是该物质的合成及其应用。
根据图示回答下列问题:
(1)有机物A分子中的官能团为____________,反应①的催化剂可以是。
(2)有机物B的结构简式为,其分子中所有的碳原子是否可能处于同
一个平面?(填“可能”或“不可能”)。
(3)反应④的条件是,反应类型是____________________________________。
(4)写出反应③的化学方程式:_____________________________________________。
2.化合物H是一种香料,存在于金橘中,可用如下路线合成:
(ⅰ)B2H6
已知:R—CH=CH2——————→
RCH2CH2OH(B2H6为乙硼烷)。
(ⅱ)H2O2/OH-
回答下列问题:
(1)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。
A的分子
式是__________;
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为____________________;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3苯基1丙醇。
F的结构简式是___;
(4)反应①的反应类型是____________;
(5)反应②的化学方程式为______________________________________________;
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:____________。
3.有机化合物A~H的相互转化关系如下图所示(图中副产物均未写出):
其中A的相对分子质量比X大34.5,请回答:
(1)写出有机物的结构简式:
A________________________________________________________________________;
H________________________________________________________________________。
(2)写出反应类型:反应①__________;反应⑧________________________________。
(3)写出下列反应的化学方程式:
反应③___________________________________________________________________;
反应⑥_______________________________________________________________。
(4)B分子内处于同一平面上的原子最多有________个,B在一定条件下可以发生反应生
成高分子化合物N,则N的结构简式为______________________________________。
(5)化合物M是G的一种同分异构体,M具有如下性质:①不与NaHCO3反应,②遇FeCl3
溶液显紫色,③1 mol M恰好与 2 mol NaOH反应,则M的结构简式为___________________________________________________(写一种)。
4.X是一种能与FeCl3溶液作用显紫色的重要有机物。
(1)写出E中官能团的名称__________,反应②的反应类型是____________________。
(2)X的结构简式为___________________________________________________。
(3)写出反应⑤的化学方程式:________________________________________。
(4)写出满足能与FeCl3溶液发生显色反应且含有,不含—CH2—的C(C9H10O3)的同分异构体的结构式简式_______________________________________(写出两种:一种苯环上有四个取代基,一种苯环上有两个取代基)。
5.(2018·上海,29)尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出了两条合成路线)。
已知:
完成下列填空:
(1)写出反应类型:反应②,反应③。
(2)写出化合物D的结构简式:。
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:。
(4)写出反应①的化学方程式:_________________________________________。
(5)下列化合物中能与E发生化学反应的是。
a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):______________________。
6.碳碳双键有如下的断裂方式:
高分子单体A(C5H8O3)可进行如下反应:
实验表明:
①核磁共振氢谱表明A分子中有五种氢,且其峰面积之比为1∶1∶2∶2∶2;
②室温下A不与NaHCO3溶液反应,但可与Na反应放出H2;
③1 mol C与足量的钠反应可释放出22.4 L H2(标准状况下),D能与新制氢氧化铜悬浊
液反应;
④G为六元环状化合物。
根据以上信息回答下列问题:
(1)A中含氧官能团的名称为_________;由A所形成的高聚物的结构______________。
(2)写出C→D的化学反应方程式,反应类型为。
(3)写出E→G的化学反应方程式。
(4)B在浓H2SO4存在下与甲醇反应的产物在一定条件下聚合,写出这个聚合物的结构简
式____________________________________________________________________。
(5)E与C还可以形成高聚物,试写出该高聚物的结构简式_______________________,
合成该高聚物的反应类型为____________。
答案 1.(1)羟基、碳碳双键铜(写“氧化铜”错)
(2)可能
(3)硫酸(或稀硫酸,答“碱”错) 水解反应
2.(1)C4H10(2)2甲基1氯丙烷、2甲基2氯丙烷
3.
(2)消去反应 取代(酯化)反应
4.(1)羧基 取代反应或水解反应
(3)CH 3COOCH==CH 2+H 2O ――→△CH 3COOH +CH 3CHO
CH 3COOH +NaOH ―→H 3CCOONa +H 2O
或CH 3COOCH==CH 2+NaOH ――→△CH 3COONa +CH 3CHO
5.(1)氧化反应 缩聚反应
(2)H 4NOOC(CH 2)4COONH 4
6.(1)酯基、羟基
(2)HOCH 2CH 2OH +O 2――→Cu △
OHC —CHO +2H 2O 氧化反应。
