2018高考化学分类解析-化学反应速率和化学平衡 精品
最新-2018年高考化学 化学反应速率和化学平衡复习课件 精品

B.化学反应速率0.8 mol/(L·s)是指1 s时某物质的浓 度为0.8 mol/L
C.对于任何化学反应来说,反应速率越大,反应现 象就越明显
D.根据化学反应速率的大小可以知道化学反应进行 的快慢
解析:不能用纯液体或固体的物质的量浓度变化来表 示化学反应速率,A错误;化学反应速率是平均速率,而 非瞬时速率,B错误;有些化学反应速率很大,可能无明 显实验现象,C错误;化学反应速率是用来描述化学反应 进行快慢的物理量,D正确.
点拨:解答该题时要注意影响该化学反应速率的因素 有温度、大理石的规格、HNO3的浓度.三个因素中两个 因素不变化,只改变一个因素来分析它对化学反应速率的 影响,要运用好对照实验.
解析:(1)据实验目的(Ⅰ)知①与②两实验的差别为浓 度,故实验②中T=298 K,规格为粗颗粒,而c(HNO3)= 1.00 mol/L;
HI
为例
3.温度 (1)规律:其他条件不变时,升高温度,v增大;反之, 降低温度,v减小 .一般,温度每升高10℃,反应速率就增 大到原来的2~4倍. (2)解释:升高温度―→单位体积内活化分子总数增加
活化分子数增加―→单位时间内有 效碰撞次数增加―→v增大.
(3)图象:(以N2+3H2 2NH3 ΔH<0为例)
4.催化剂
(1)规律:加入催化剂,v增大.
(2)解释:加入催化剂―→降低了反应的活化能―→活
化分子百分数增加
活化分子数增
加―→单位时间内有效碰撞次数增加―→v增大.
(3)图象
[例题2] 某探究小组用HNO3与大理石反应过程中质 量减小的方法,研究影响反应速率的因素.所用HNO3浓 度为1.00 mol/L、2.00 mol/L,大理石有细颗粒与粗颗粒两 种规格,实验温度为298 K、308 K,每次实验HNO3的用 量为25.0 mL,大理石用量为10.00 g.
2018学年度高二化学人教版《化学反应速率和化学平衡》知识点归纳总结及例题导析

《化学反响速率和化学均衡》全章复习与稳固【学习目标】1、认识化学反响速率及其影响要素;2、掌握化学均衡的成立及其影响要素,能用化学均衡常数进行定量剖析;3、初步认识化学反响方向的判断依照。
【知识网络】【重点梳理】重点一、化学反响速率1.化学反响速率的观点及表示方法(1)观点:往常用单位时间里反响物浓度的减少或生成物浓度的增添来表示.(2)表达式:- 1 - 1或 mol·L -1 -1等.(3) 单位: mol·L ·min ·s(4)注意点:①化学反响速率均取正当.②化学反响速率一般不用固体物质表示.③同一反响,采纳不一样物质的浓度变化表示反响速率,数值可能不一样,但意义同样,各物质表示的速率之比等于该反响方程式中的化学计量数之比.④注意差别均匀速率和即时速率.2.影响化学反响速率的要素(1)内因:反响物的构造、性质.(2)外因:①浓度:增大反响物的浓度,反响速率增大.②温度:高升温度,反响速率增大.③压强:关于有气体参加的反响,增大压强,气体物质的浓度增大,反响速率增大.④催化剂:使用催化剂,反响速率增大.重点二、化学均衡(1)可逆反响:在同一条件下,既能向正反响方向进行,同时又能向逆反响方向进行的反响.(2)化学均衡的观点:是指在必定条件下的可逆反响里,正反响和逆反响的速率相等,反响混淆物中各组分的浓度保持不变的状态.(3)化学均衡的特色:①逆:可逆反响②等: v(正 )= v(逆 )③动:动向均衡v(正 )= v(逆 ) ≠0④定:均衡状态时反响混淆物中各组分的浓度保持不变⑤变:当浓度、温度、压强等条件改变时,化学均衡即发生挪动重点三、化学均衡的挪动及影响要素1.化学均衡的挪动(1)定义:可逆反响中旧化学均衡的损坏,新化学均衡的成立过程叫做化学均衡的挪动.(2) 化学均衡挪动的本质原由是v(正 ) ≠v(逆 ).如催化剂能同样程度改变v(正 )和 v(逆 ),所以,加入催化剂,化学均衡不发生挪动.2.影响化学均衡的条件均衡挪动的结果(均与改变条条件的变化均衡挪动的方向件时比较 )向正反响方向挪动①浓度向逆反响方向挪动②压强增大向减吝啬体体积方向挪动负气体压强减小(气体 ) 减小向增大气体体积方向挪动负气体压强增大③温度高升向吸热方向挪动使温度降低降低向放热方向挪动使温度高升3.化学均衡挪动原理 (即勒夏特列原理 )假如改变影响均衡的一个条件(如浓度、压强或温度等 ),均衡就向能够减弱这类改变的方向挪动.重点四、化学均衡常数与转变率1、化学均衡常数:关于一般的可逆反响: mA+nB pC+qD 。
化学第七章 化学反应速率和化学平衡 微专题 24 含答案

微专题化学反应原理在物质制备中的调控作用1.化学反应方向的判定(1)自发反应在一定条件下无需外界帮助就能自发进行的反应称为自发反应.(2)熵和熵变的含义①熵的含义熵是衡量一个体系混乱度的物理量。
用符号S表示.同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一般规律是S(g)>S(l)〉S(s)。
②熵变的含义熵变是反应前后体系熵的变化,用ΔS表示,化学反应的ΔS越大,越有利于反应自发进行。
(3)判断化学反应方向的判据ΔG=ΔH-TΔSΔG<0时,反应能自发进行;ΔG=0时,反应达到平衡状态;ΔG>0时,反应不能自发进行。
2.化工生产适宜条件选择的一般原则(1)从化学反应速率分析,既不能过快,又不能太慢。
(2)从化学平衡移动分析,既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性。
(3)从原料的利用率分析,增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本。
(4)从实际生产能力分析,如设备承受高温、高压能力等.(5)注意催化剂的活性对温度的限制。
3.平衡类问题需综合考虑的几个方面(1)原料的来源、除杂,尤其考虑杂质对平衡的影响。
(2)原料的循环利用。
(3)产物的污染处理。
(4)产物的酸碱性对反应的影响.(5)气体产物的压强对平衡造成的影响。
(6)改变外界条件对多平衡体系的影响。
专题训练1.(2017·四川资阳诊断)无机盐储氢是目前科学家正在研究的储氢新技术,其原理如下:NaHCO3(s)+H2(g),Pd或PdO70 ℃,0.1 MPa HCOONa(s)+H2O(l)在2 L恒容密闭容器中加入足量碳酸氢钠固体并充入一定量的H2(g),在上述条件下发生反应,体系中H2的物质的量与反应时间的关系如表所示:下列推断正确的是()A.当容器内气体的相对分子质量不再变化时,反应达到平衡状态B.0~4 min内H2的平均反应速率v(H2)=0。
2018年高考化学二轮专题复习课件:专题四 化学反应速率与化学平衡(共24张PPT)

• 4.影响化学反应速率的主要因素 反应物本身的性质 ________________________ ,外界因素主要 有: • ⑴浓度 其它条件不变时,增大反应物浓度,反应速率加快 ____________________________________ ; • ⑵温度 其它条件不变时,升高温度,反应速率加快 ____________________________________ ; 其它条件不变时,增大压强,对有气体存 • ⑶压强 在的反应,反应速率加快 ____________________________________ ; • ⑷催化剂 其它条件不变时,使用催化剂,反应速率加快 。 ____________________________________
• 二、化学平衡
• 1.化学平衡 化学平衡状态是指在一定条件下的可逆 _________________________________________ 反应里,正反应和逆反应速率相等,反应混 • _________________________________________ 合物中各组分的浓度保持不变的状态 • ________________________________________. • 2.达到化学平衡状态的特征:
• • • •
等:化学平衡建立时,有v(正)=v(逆)>0 ⑴_________________________________ ; 定:反应混合物中各物质的质量分数保持不变 ⑵__________________________________ ; 动:化学平衡是一个动态平衡 ⑶__________________________________ ; 变:外界条件改变,平衡受到破坏 ⑷__________________________________ 。
2018版高考化学第2轮复习 第三编 化学反应原理 专题十一 化学反应速率和化学平衡

V Δt
用上式进行某物质反应速率计算时需注意以下几点: ①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。 ②化学反应速率是某段时间内的平均反应速率,而不是即时速率,且计 算时取正值。
③对于可逆反应,通常计算的是正、逆反应抵消后的总反应速率,当 达到平衡时,总反应速率为零。 (注:总反应速率也可理解为净速率 ) (2) 比值法:同一化学反应,各物质的反应速率之比等于方程式中的化 学计量数之比。对于反应: mA(g)+nB(g)===pC(g)+qD(g)来说,则有
123456 78
答案
5.对于化学反应: N2(g)+O2(g) 2NO(g) ,在密闭容器中,下列条件的 改变引起该反应的反应速率的变化是什么(填“加快”“不变”或“减慢”)。
A.缩小体积使压强增大: 加__快__。 B.体积不变充入 N2使压强增大:加__快___。 C.体积不变充入氩气使压强增大: 不__变__。 D.压强不变充入氩气使体积增大: 减__慢__。 E.增大体积使压强减小: 减__慢__。
2 题组集训
题组一 化学反应速率的计算类型
1.(2017·浙江省名校协作体高三上学期考试 ) 在一定温度下, 10 mL 0.40 mol·L-1 H2O2发生催化分解。不同时刻测定生成 O2的体积 (已折 算为标准状况 )如下表。
t/min
0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
D.反应至6 min时,H2O2分解了50%
123456 78
解析 答案
2.一定条件下,在体积为 10 L的固定容器中发生反应: N2(g)+3H2(g)
2NH3(g) ΔH<0,反应过程如右图所示,下列说法正确的是
2018年高考考点突破10 化学反应速率与化学平衡 考点三 化学反应速率图像及其应用 含解析

原因解释:AB 致反应速率逐渐增大;小,导致反应速率减小。
1.由图像得出的信息是(1)X 、Y 是反应物,(2)t 3时反应达平衡,Y 的转化率=n 2-n 3n 2×100%。
(2)确定化学方程式中的化学计量数之比,如X 、Y 、Z 三种物质的化学计量数之比为(n 1-n 3)∶(n 2-n 3)∶n 2。
三、速率—外界条件图像及反应 以N 2(g)+3H 2(g)2NH 3(g) ΔH =-92.4 kJ/mol 为例。
1.速率—浓度(c)图像2.速率—温度(T)的图像3.速率—压强(p)图像4.速率—催化剂图像使用催化剂,v正、v逆同等倍数增大,图像为说明:(1)条件增强,曲线在原图像的上方;条件减弱,曲线在原图像的下方。
(2)浓度改变时,图像曲线一条连续,一条不连续;其他条件改变,图像曲线不连续。
(3)对于反应前后气体的体积不变的反应,改变压强时,v正、v逆同等倍数增大或减小。
【特别提醒】分析化学反应速率图像有三看:①看面:弄清纵、横坐标的含义;②看线:弄清线的走向、变化趋势及线的斜率;③看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。
【重难点指数】★★★【重难点考向一】化学反应速率图像题【典型例题1】【2014年高考福建卷第12题】在一定条件下,N2O分解的部分实验数据如下:下图能正确表示该反应有关物理量变化规律的是()(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)。
化学反应速率与化学平衡

化学反应速率与化学平衡化学反应速率与化学平衡是化学领域中的重要概念。
本文将从理论角度探讨化学反应速率与化学平衡之间的关系,并结合实际例子加以说明。
一、化学反应速率化学反应速率指的是反应物消耗或生成的速度,通常用物质浓度的变化率来表示。
反应速率的公式可表示为:速率= ΔC/Δt其中,ΔC表示反应物浓度的变化量,Δt表示时间的变化量。
化学反应速率受到多种因素的影响,如温度、浓度、表面积、催化剂等。
一般来说,温度越高,反应速率越快;浓度越高,反应速率越快;表面积越大,反应速率越快;催化剂的存在能够降低反应活化能,从而加快反应速率。
二、化学平衡化学平衡是指在封闭系统中,反应物和生成物浓度保持一定比例的状态。
在化学平衡中,正反应和逆反应同时发生,且速率相等,达到动态平衡。
根据勒夏特列亲和定律,一个化学平衡的反应可以用如下公式表示:aA + bB ⇌ cC + dD其中,A、B为反应物,C、D为生成物,a、b、c、d为化学计量数。
化学平衡的条件包括温度、压力和浓度。
根据利奥·恩希斯的法则,当某一条件发生变化时,系统会自动调整以维持化学平衡。
温度升高会使平衡位置移动到吸热反应的方向,而当温度降低时,则向放热反应方向移动。
三、化学反应速率与化学平衡的关系化学反应速率和化学平衡是反应动力学和反应热力学两个方面的研究对象。
它们之间存在密切的联系。
在反应初期,反应物浓度较高,反应速率也较快。
但随着时间的推移,反应物浓度逐渐降低,反应速率也减慢,最终趋于稳定。
这种情况下,反应尚未达到化学平衡。
在化学平衡时,正反应和逆反应达到动态平衡,速率相等。
这并不意味着反应速率为零,而是表示反应物和生成物的浓度保持稳定,反应速率呈稳定状态。
实际上,反应速率和平衡浓度之间存在着一种动态的关系。
当反应物浓度偏离平衡浓度时,反应势必要重新调整以恢复平衡,从而使反应速率发生变化。
例如,当反应物浓度增加时,反应速率会相应增加,以达到新的平衡状态。
高考化学复习化学反应速率与化学平衡

高考化学复习化学反应速率与化学平衡高考化学复习:化学反应速率与化学平衡一、化学反应速率及其简单计算1.化学反应速率:通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,其数学表达式可表示为单位一般为mol/(L·min)或mol.·L -1·min -12.结论:对于一般反应 aA + bB =cC + dD 来说有:V A :V B :V C :V D =△C A :△C B :△C C :△C D =△nA :△n B :△n C :△nD = a :b :c :d特别提醒:1.化学反应速率指的是平均速率而不是瞬时速率2.无论浓度的变化是增加还是减少,化学反应速率均取正值。
3.同一化学反应速率用不同物质表示时可能不同,但是比较反应速率快慢时,要根据反应速率与化学方程式的计量系数的关系换算成同一种物质来表示,看其数值的大小。
注意比较时单位要统一。
二、影响化学反应速率的因素1.内因(主要因素):反应物本身的性质(分子结构或原子结构)所决定的。
2.外因(次要因素)(1)浓度:当其他条件不变时,增大反应物的t c V ∆∆=浓度,V正急剧增大,V逆也逐渐增大。
若减小反应物浓度,V逆急剧减小,V正逐渐减小。
(固体或纯液体的浓度可视为常数,故反应速率与其加入量多少无关)。
(2)温度:当其他条件不变时,升温时, V正、V逆都加快;降温时,V正、V逆都减小(3)压强:其他条件不变时,对于有气体参加的反应,通过缩小反应容器,增大压强,V正、V 逆都增大;通过扩大反应容器,压强减小,浓度变小,V正、V逆均减小。
(4)催化剂:使用催化剂,成百上千的同等倍数地增加了正、逆反应速率。
特别提醒:1.改变压强的实质是改变浓度,若反应体系中无气体参加,故对该类的反应速率无影响。
2.恒容时,气体反应体系中充入稀有气体(或无关气体)时,气体总压增大,物质的浓度不变,反应速率不变。
3.恒压时,充入稀有气体,反应体系体积增大,浓度减小,反应速率减慢。
2018年全国卷高考化学总复习《化学反应速率以及化学平衡》专题突破[例题+习题(含解析)]
![2018年全国卷高考化学总复习《化学反应速率以及化学平衡》专题突破[例题+习题(含解析)]](https://img.taocdn.com/s3/m/a7696017ba1aa8114431d9dd.png)
2018年全国卷高考化学总复习《化学反应速率以及化学平衡》专题突破[题型分析]从2017年考试大纲和各地考试说明及近几年各省市高考试题来看,化学反应速率和化学平衡属于必考内容。
任何化学反应都涉及到快慢的问题,特别是化工生产中和实验室制备物质时,都要认真考虑反应进行的快慢及改变的方法如何,所以每年的高考都会出现本部分的题目。
在命题中出现的题型主要是选择题,同一个问题可能从不同角度来考查;另外,除直接考查基本知识外,还增加了考查学生分析问题能力和应用知识能力的题目。
考查的主要知识点有:①利用化学反应速率的数学表达式进行的有关计算;②反应中各物质反应速率之间的关系;③根据浓度、温度、压强、催化剂、颗粒大小、光等外界条件的改变,定性判断化学反应速率的变化。
预测2018年高考,通过化学反应速率测定的方法考查数学处理能力,重点考查考生对化学反应速率的理解,对化学反应速率表示方法的认识,以及运用化学方程式中各物质的化学计量比的关系进行有关的简单计算。
化学反应速率与化学平衡类试题时高考的必考点,大多数省份卷以选择题形式考查,少数也与大题形式。
通常考查化学反应反应速率及计算,影响化学反应速率的因素,化学平衡的建立及移动,化学平衡常数,化学平衡相关计算,化学反应速率与化学平衡图像问题等。
近几年的考查中均出现新的情境,结合等效平衡思想进行分析,相对难度较大。
【例题演练】☆★考点一:化学反应速率及相关计算1、反应速率化学反应速率单位时间内反应物浓度的减少或生成物浓度的增加来表示,ν(B)= Δc(B)Δt,单位为mol/(L·s)或mol/(L·min)(1)化学反应速率并不是均匀进行的,采用这样的方法计算出来的反应速率,是在给定时间范围内的平均反应速率,而不是瞬时反应速率。
(2)反应速率均取正值。
(3)对于同一化学反应,选用不同的物质作标准计算,有不同的速率数值,但却表示的是同一化学反应的速率。
所以必须在速率v的右下角注明参照物的名称。
高考化学化学反应速率与化学平衡
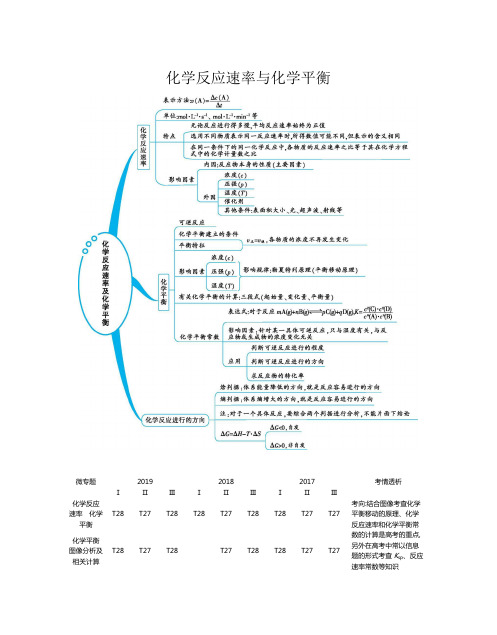
化学反应速率与化学平衡微专题201920182017考情透析ⅠⅡⅢⅠⅡⅢⅠⅡⅢ化学反应速率化学平衡T28T27T28T28T27T28T28T27T27考向:结合图像考查化学平衡移动的原理、化学反应速率和化学平衡常数的计算是高考的重点,另外在高考中常以信息题的形式考查K sp、反应速率常数等知识化学平衡图像分析及相关计算T28T27T28T27T28T28T27T27题型:化学反应原理综合题、选择题、工艺流程题、实验题 分值:10+412化学反应速率 化学平衡一、化学反应速率1.对化学反应速率计算公式的剖析(1)公式:v (B)=Δc(B)Δt =Δn(B)VΔt。
①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
②化学反应速率是某段时间内的平均反应速率,而不是瞬时速率,且计算时取正值。
③同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。
④对于可逆反应,反应进行的净速率是正、逆反应速率之差,当达到平衡时,净速率为零(注:总反应速率也可理解为净速率)。
(2)比值法:同一化学反应,各物质的反应速率之比等于化学方程式中的化学计量数之比。
对于反应m A(g)+n B(g)p C(g)+q D(g),有v(A)m =v(B)n =v(C)p =v(D)q。
2.气体反应体系中充入惰性气体(或无关气体)时,对反应速率的影响 (1)恒容:充入惰性气体总压增大 物质浓度不变(活化分子浓度不变)反应速率不变。
(2)恒压:充入惰性气体体积增大物质浓度减小(活化分子浓度减小)反应速率减慢。
3.外界条件对可逆反应的正、逆反应速率的影响方向是一致的,但影响程度不一定相同(1)当增大反应物浓度时,v 正瞬间增大,随后逐渐减小,v 逆瞬间不变,随后逐渐增大,直至v 正和v 逆相等时达到新平衡。
(2)增大压强,向气体分子数减少的方向的反应速率变化程度更大。
(3)对于反应前后气体分子数不变的反应,改变压强可以同等程度地改变正、逆反应速率。
2018版高考化学二轮复习第七章化学反应速率和化学平衡7.2化学平衡状态化学平衡移动课件

(5)化学平衡状态指的是反应静止了,不再发生反应了
(×)
(6)对于 A(g)+B(g) 2C(g)+D(g)反应,当密度保持不变,
在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状
态的标志
(×)
(7)恒温恒容下进行的可逆反应:2SO2(g)+O2(g) 2SO3(g),
当 SO3 的生成速率与 SO2 的消耗速率相等时,反应达到平衡
(2)建立过程可用下图表示:
2.化学平衡的特点
3.化学平衡的判定 对于密闭容器中的可逆反应:mA(g)+nB(g) pC(g)+qD(g)是 否达到平衡可以归纳如下表(用“平衡”或“不一定平衡”填表)
化学 反应
mA(g)+nB(g)
pC(g)+qD(g)
混合 ①各物质的物质的量或物质的质量分
物体 数一定
量 p+q
_平__衡___ _不__一__定__平__衡___
温度
任何化学反应都伴随着能量变化,当 体系温度一定时
_平__衡___
气体的 密度
密度一定
_不__一__定__平__衡___
颜色 反应体系内有色物质的颜色稳定不变
_平__衡___
基点小练
判断正误(正确的打“√”,错误的打“×”)。
电解
(1)2H2O 点燃 2H2↑+O2↑为可逆反应
( D)
因反应容器保持恒压,所以容器 体积随反应进行而不断变化,结 合 ρ 气=m/V 可知,气体密度不 再变化,说明容器体积不再变 化,即气体的物质的量不再变 化,反应达到平衡状态,①符合 题意;无论是否平衡,反应的 ΔH 都不变,②不符合题意;
A.①②
B.②④
C.③④
D.①④
规律•方法
2018届高考化学一轮复习课件专题十 化学反应速率和化学平衡(含17高考真题及解析) (共140张PPT)

学霸有招
高手洞考
高手锻造
高考考点 35.化学 反应速 率及其 影响因 素
考查内容 1.了解化学反 应速率的概 念和定量表 示方法。能正 确计算化学 反应的转化 率(α) 2.了解反应活 化能的概念, 了解催化剂 的重要作用 3.了解化学反 应的可逆性 及化学平衡 的建立
高考示例 2017 课标 全国Ⅰ 27、 28; 2017 课标 全国Ⅱ27; 2017 课标 全国Ⅲ 13、 28; 2016 课标 全国Ⅱ27; 2016 课标 全国Ⅰ27; 2016 课标 全国Ⅲ27;
高考示例 2015 课标 全国Ⅰ28; 2015 课标 全国Ⅱ27; 2014 课标 全国Ⅰ28; 2014 课标 全国Ⅱ26; 2013 课标 全国Ⅰ28; 2013 课标 全国Ⅱ28
38.化学 反应速 率与化 学平衡 图像
考查频率 命题趋向 (4)平衡常数 (浓度平衡常 数)的含义及 ★★★ 其表达式。定 量方面包 ★★ 括:(1)有关反 5 年 12 考 应速率的计算 和比较;(2)平 衡常数的计算 以及利用化学 平衡常数计算 ★★★ 反应物转化率 ★★ 等。题目多以 5 年 11 考 图像、图表等 形式呈现。
36.化学 平衡状 态及其 影响因 素
考查频率 命题趋向 本部分内容考查 ★★★ 的知识点和题目 形式比较明确,主 ★★ 5 年 8 考 要考查定性和定 量两个方面。 定性 方面包括: (1)化学反应速 率、 化学平衡概念 的分析;(2)确定某 ★★★ 种情况是否达到 化学平衡状态;(3) ★★ 5 年 11 考 外界条件引起的 化学反应速率改 变和化学平衡移 动方向和结果的 判断;
学霸有招
高手洞考
高手锻造
高考考点 考查内容 6.了解化学反 应速率和化学 平衡的调控在 生活、生产和 科学研究领域 中的重要作用
最新-2018年高考化学 第6单元第20讲 化学反应速率课件 精品

大于v(逆)增大倍数
D.体积不变加入氩气,v(正)、v(逆)都增大,且
v(正)增大倍数等于v(逆)增大倍数
【解析】A项正确,因催化剂能同等程度地改变
正逆反应速率;降温,v(正)、v(逆)都减小,由
于平衡正向移动,则v(逆)减小倍数大于v(正)减
小倍数,B项正确。加压,v(正)、v(逆)都增大,
由于平衡正向移动,则v(正)增大倍数大于v(逆)
理解化学反应速率要注意以下几个问题: ①无论是用某一反应物表示还是用某一生成物 表示,由于Δc是取浓度变化的绝对值,因此, 其化学反应速率都取正值。 ②化学反应速率可用反应体系中一种反应物或 生成物浓度的变化来表示,书写时应标明是什 么物质的反应速率。
③一般来说,在反应过程中物质的浓度不断变化, 所以反应都不是等速进行的,因此某一时间内的 反应速率实际上是这一段时间内的平均速率。
【解析】在0~4min,v(M)=(1-0.2)mol/L÷4min= 0.2mol/(L·min),假设这一时间段内速率始终相等, 则在反应进行到2min时,密闭容器中M的物质的量 浓度为:
c(M)=1mol/L-0.2mol/(L·min)×2min=0.6mol/L, 但实际上,反应速率是先快后慢,所以反应进行到 2min时,密闭容器中M的物质的量浓度小于0.6mol/L。
增大倍数,C项正确。D项中反应体系中各物质
的浓度均不改变,v(正)、v(逆)都不会改变,错
误。本题的关键是弄清压强的改变对化学反应速
率的影响实质是引起浓度的变化,如果反应物、
生成物的浓度均无变化,则压强的改变不影响反
应速率。
【参考答案】D
C.5 s
D.10 s
【解析】该时间内SO3的浓度增加了0.4 mol·L -1,根据方程式,相同时间内O2浓度减小了 0.2 mol·L-1。所以,Δt=5 s。 【参考答案】C
《化学反应速率与化学平衡》高考题分析
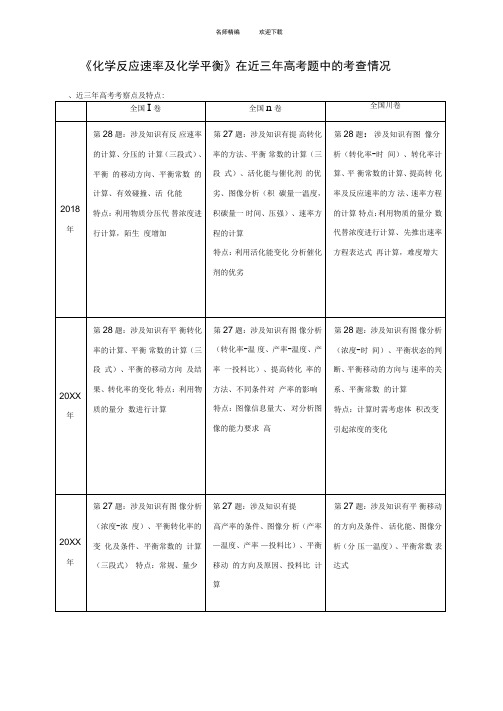
《化学反应速率及化学平衡》在近三年高考题中的考查情况三、题型特点:1、题干信息:多以工业生产过程为考查内容,并结合热化学知识(反应热的计算或热化学方程式的书写)、化学方程式的书写等,重点考察化学平衡及化学反应速率的核心知识。
2、设问内容:考查知识比较广泛,但可看出重点在于:①平衡移动的方向(8次):包括引起平衡移动的条件的判断、平衡的移动等。
②平衡移动的结果(7次):对平衡移动的方向重点体现在结果分析上,即引起了转化率或产率的如何改变,与生产实际相结合。
③平衡常数(7次):重点在于平衡常数的计算,间或考察表达式。
3、知识运用方面:①图像分析(7次):且图像内容不统一,考察角度多变。
②计算中三段式的应用(4次):平衡常数或转化率的计算需应用三段式③计算(12次):考察计算次数多且角度多,如平衡常数的计算、转化率的计算、反应速率的计算、速率方程的计算、投料比的计算、分压的计算等等。
四、三年的题型变化:近三年来,该题型的分值、考察范围、难度、陌生度均有提高。
如图像的内容多变,分压的计算角度多变,对学生知识的理解、运用能力的要求均在提高。
同时要注意对有效碰撞理论、活化能知识的理解及运用的考察。
五、2019年考察方向预测仍然以工业生产过程为考察点,重心仍然为图像分析、平衡移动的方向及结果、平衡常数的计算等方面。
但要注意相关知识的运用,如催化剂、活化能、有效碰撞、以分压(或其它量)代替浓度的计算等。
六、附:近三年相关内容高考题2018年:全国I卷第28题:(15分)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:(2)F. Daniels等曾利用测压法在刚性反应器中研究了25C时^。
他)分解反应:2N;O5(g)^+ 4NO;(g)+ O;(g)112Ng仗)其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=g时,N2O4(g)完全分解):r - 3 -1②研究表明,N2O5(g)分解的反应速率v=2X10 X P N2O5(kPa min ), t=62 min时,测得体系中P Q =2.9 kPa,则此时的P N2Q. = ______________ kPa, v= _______kPa min-1。
2018年高考真题分类之化学平衡及其应用

2018年高考真题——化学平衡及应用全国1卷28.(15分)采用N 2O 5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。
回答下列问题:(1)1840年 Devil 用干燥的氯气通过干燥的硝酸银,得到N 2O 5,该反应的氧化产物是一种气体,其分子式为_______。
(2)F. Daniels 等曾利用测压法在刚性反应器中研究了25℃时N 2O 5(g )分解反应:其中NO 2二聚为N 2O 4的反应迅速达到平衡。
体系总压强p 随时间t 的变化如下表所示(t =∞时,N 2O 5(g )完全分解):t /min0 40 80 160 260 1300 1700 ∞ p /kPa35.840.342.545.949.261.262.363.1①已知:2N 2O 5(g )2N 2O 4(g )+O 2(g )ΔH 1=−4.4 kJ ·mol −12NO 2(g ) N 2O 4(g ) ΔH 2=−55.3 kJ ·mol −1则反应N 2O 5(g )=2NO 2(g )+12O 2(g )的ΔH =_______ kJ ·mol −1。
②研究表明,N 2O 5(g )分解的反应速率v =2×10−3×25N O p (kPa ·min −1)。
t =62 min 时,测得体系中2O p =2.9 kPa ,则此时的25N O p =________ kPa ,v =_______ kPa ·min −1。
③若提高反应温度至35℃,则N 2O 5(g )完全分解后体系压强p ∞(35℃)____63.1 kPa (填“大于”“等于”或“小于”),原因是________。
④25℃时N 2O 4(g )2NO 2(g )反应的平衡常数K p =_______kPa (K p 为以分压表示的平衡常数,结果保留1位小数)。
化学反应速率与化学平衡信息图像题综合分析

做题小经验:
看清题意,明确题目要求。
结合反应速率和产率同时考虑。
知道工业生产中要考虑经济效益,特别是压强的增大,对 设备的要求提高了许多。
3、图像的计算
例6:研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3 与NO的物质的量之比分别为1:3、3:1、4:1时,NO脱除率随温 度变化的曲线如图所示。
则△H1 < △H3(填“>”“<”或“=”), 理由是由图可知,随着温度升高, 。 K2增大,则ΔH2>0,根据盖 斯定律又得ΔH3=ΔH1+ΔH2,所以ΔH1<ΔH3。
2、根据图象选择最佳反应条件
例3:“丁烯裂解法”是重要的丙烯生产法,但生产中会有生成乙烯 的副反应发生. 测得上述两反应的平衡体系中,各组分的质量分数 (w%)随温度(T)和压强(P)变化的趋 势如图 1 和图 2 所示: 主反应:3C4H8 ===4C3H6;副反应:C4H8=== 2C2H4
1、根据图像判断转化率和平衡常数
例2:甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和 H2) 在催化剂的作用下合成甲醇,可能发生的反应如下: I. CO(g) +2H2(g) ===CH3OH(g) △H1 II. CO2(g)+H2(g) ===CO(g)+H2O(g) △H2 III.CO2(g)+3H2(g) ===CH3OH(g)+H2O(g) △H3 上述反应对应的平衡常数分别为K1,K2,K3,它们随温度变化曲线 如下图所示。
探究上述反应中NO的平衡转化率与压强、温度的关系,得到 图所示的曲线.催化装置比较适合的温度和压强是400K,。 1MPa
例5:二甲醚催化重制氢的反应过程中,测得不同温度下各组 分体积分数及二甲醚转化率的关系如下图所示,你认为反应控 C 制的最佳温度应为___________ 。 A.300~350℃ B.350~400℃ C.400~450℃ D.450~500℃
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018高考化学分类解析-化学反应速率和化学平衡1.(2018海南卷)X 、Y 、Z 三种气体,取X 和Y 按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y 的转化率最接近于( ) A .33%B .40%C .50%D .65%解析:由可知: X+2Y 错误!未找到引用源。
2Z 起始: 1 1 0 转化: a 2a 2a 平衡: 1-a 1-2a 2a根据题意有:2-3a 2a = 32,a =13,Y 的转化率最接近65%。
答案:D 。
2.(2018海南卷)反应A(g)+B(g)错误!未找到引用源。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是____________________反应(填“吸热”“放热”);(2)当反应达到平衡时,升高温度,A 的转化率______(填“增大”“减小”“不变”), 原因是____________________________________________;(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________。
(4)在反应体系中加入催化剂,反应速率增大,E 1和E 2的变化是:E 1_________,E 2________(填“增大”“减小、”“不变”)。
解析:由图可以知道,由于该反应的反应物的总能量高于生成物的总能量,所以该反应属于放热反应,所以升高温度,平衡向逆反应进行,所以A 的转化率减小;当在反应体系中加入催化剂,能同倍数改变化学反应速率,因此对化学平衡的移动无影响,即对反应热也无影响。
因为化学反应速率增大,所以E1和E2同时降低。
答案:(1)放热。
(2)减小;该反应正反应为放热反应,升高温度使平衡向逆反应方向移动。
(3)不影响;催化剂不改变平衡的移动。
(4)减小、减小。
3.(2018上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是()A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3解析:化学反应速率与温度、浓度和固体物质的表面积的大小有关,实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3虽然浓度相同,但反应的温度不同,物质的状态也不相同,所以不能比较。
答案:A、C4.(2018上海卷)在2L密闭容器中,800℃时反应2NO(g)+O2(g)错误!未找到引用源。
2NO2(g)体系中,n(NO)随时间的变化如表:(1)写出该反应的平衡常数表达式:K=___________________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO2的变化的曲线是____________。
用O2表示从0~2s内该反应的平均速率v=___________。
(3)能说明该反应已经达到平衡状态的是___________。
a 、v(NO 2)=2v(O 2) b 、容器内压强保持不变c 、v 逆(NO)=2v 正(O 2)d 、容器内的密度保持不变(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a 、及时分离出NO 2气体 b 、适当升高温度 c 、增大O 2的浓度 d 、选择高效的催化剂 答案:(1)K =〔NO 2〕〔NO 〕2〔O 2〕;放热。
(2)b 1.5×10-3mol/(L ·s)。
(3)b c 。
(4)c 。
5.(2018全国Ⅰ卷)已知:4NH 3(g)+5O 2(g)=4NO(g)+6H 2(g). △H=-1025kJ/mol 该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )解析:此题结合化学平衡图像考查外界条件对化学平衡的影响。
根据“先拐先平数值大”的原则,选项A 、B 正确;根据升高温度,平衡向吸热反应方向移动(即逆反应方向移动),可确定A 、B 正确;根据使用催化剂只能改变化学反应速率,缩短达到平衡的时间,但对化学平衡的移动无影响,所以选项D 正确。
答案:C 。
6.(2018广东卷)将H 2(g)和Br 2(g)充入恒容密闭容器,恒温下发生反应H 2(g )+Br 2(g) 错误!未找到引用源。
2HBr (g )0H <,g 平衡时Br 2(g)的转化率为a ;若初始条件相同,绝热下进行上述反应,平衡时Br 2(g)的转化率为b 。
a 与b 的关系是( ) A .a >bB .a=bC .a <bD .无法确定解析:正反应为放热反应,前者恒温,后者相对前者,温度升高。
使平衡向左移动,从而使Br2的转化率降低。
所以b<a. 答案:A7.(2018广东卷)碘钨灯比白炽灯使用寿命长。
灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W (s )+I 2(g )11T T WI 2ΔH <0(温度T 1<T 2)。
下列说法正确的是( )A .灯管工作时,扩散到灯丝附近高温区的WI 2(g )会分解出W 1W 重新沉积到灯丝上B .灯丝附近温度越高,WI 2(g )的转化率越低C .该反应的平衡常数表达式是12()()()c W c I K c WID .利用该反应原理可以提纯钨解析:该反应的正反应为放热反应,温度升高,化学平衡向左移动。
所以灯丝附近温度越高,WI2的转化率越高,B 错。
平衡常数,应为生成物除以反应物:K=c (WI2)/c (W )· c (I2)利用该反应,可往钨矿石中,加如I2单质,使其反应生成WI2富集,再通过高温加热WI2生成钨,从而提纯W ,D 正确。
答案:A 、D8.(2018江苏卷)将一定量的SO 2和含0.7mol 氧气的空气(忽略CO 2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO 2+O 22SO 3(正反应放热)。
反应达到平衡后,将容器中的混合气体通过过量NaOH 溶液,气体体积减少了21.28L ;再将剩余气体通过焦性没食子酸的碱性溶液吸收O 2,气体的体积又减少了5.6L (以上气体体积均为标准状况下的体积)。
(计算结果保留一位小数) 请回答下列问题:(1)判断该反应达到平衡状态的标志是 。
(填字母) a .SO 2和SO 3浓度相等 b .SO 2百分含量保持不变c .容器中气体的压强不变d .SO 3的生成速率与SO 2的消耗速率相等e .容器中混合气体的密度保持不变(2)欲提高SO 2的转化率,下列措施可行的是 。
(填字母) a .向装置中再充入N 2 b .向装置中再充入O 2 c .改变反应的催化剂 d .生高温度 (3)求该反应达到平衡时SO 2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl 2溶液,生成沉淀多少克? 答案:(1)bc (2)b(3)消耗的O 2物质的量:mol molL Lmol 45.0/4.226.57.0=-生成的SO 3物质的量:mol mol 9.0245.0=⨯ SO 2和SO 3的物质的量和:mol molL L95.0/4.2228.21=反应前的SO 2物质的量:mol molL L 95.0/4.2228.21= SO 2的转化率:%7.94%10095.09.0=⨯mol mol(4)在给定的条件下,溶液呈强酸性,BaSO 3不会沉淀。
因此BaSO 4的质量g m o l g m o l 5.10/23305.09.0≈⨯⨯9.(2018宁夏卷)将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应:①NH 4I(s)错误!未找到引用源。
NH 3(g)+HI(g);②2HI(g)错误!未找到引用源。
H 2(g)+I 2(g)。
达到平衡时,c(H 2)=0.5mol ·L -1,c(HI)=4mol ·L -1,则此温度下反应①的平衡常数为( )A .9B .16C .20D .25答案:C 。
10.(2018宁夏卷)已知可逆反应:M(g)+N(g)错误!未找到引用源。
P(g)+Q(g);△H >0, 请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol ·L -1, c(N)=2.4 mol ·L -1,达到平衡后,M 的转化率为60%,此时N 的转化率为 。
(2)若反应温度升高,M 的转化率 (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol ·L -1,c(N)=amol ·L -1;达到平衡后,c(P)=2mol ·L -1,a= 。
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)= bmol ·L -1,达到平衡后,M 的转化率为 。
解析:(1)M 转化的物质的量为0.6mol ·L -1,则N 反应的量也是0.6mol ·L -1,所以N 的转化率为:0.6mol ·L -12.4 mol ·L -1×100%=25%。
(2)由于该反应的正反应为吸热反应,所以升高温度,化学平衡正向移动,M 的转化率增大。
(3) M(g)+N(g)错误!未找到引用源。
P(g)+Q(g)起始:1 2.4 0 0平衡:0.4 1.8 0.6 0.6起始:4 a 0 0平衡:2 a -2 2 22×22×(a -2)=0.6×0.60.4×1.8,a =6mol ·L -1。
(4)x ×x (b -x)×(b -x )=0.6×0.60.4×1.8,x =0.41b ,M 的转化率为41%。
答案:(1)25%。
(2)增大。
(3)6。
(4)41%。
11.(2018山东卷)高温下,某反应达平衡,平衡常数K =()()()()c c c c ∙∙222CO H O CO H .恒容时,温度升高,H 2浓度减小。
下列说法正确的是( ) A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C .升高温度,逆反应速率减小D .该反应化学方程式为CO+H 2O=CO 2+H 2答案:A 。
12.(2018重庆卷)N 2O 2—是一种新型硝化剂,其性质和制备受到人们的关注. (1)N 2O 5与苯发生硝化反应生成的硝基苯的结构简式是 。
