国家三类新兽药 新型兔二联及三联灭活疫苗
家兔主要传染病免疫程序(供参考)

家兔主要传染病免疫程序(供参考)
家兔主要传染病免疫程序(供参考)1 毛兔、獭兔免疫程序仔、幼兔免疫力的建立免疫日龄疫苗名称剂量注射途径35日龄兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗2 ml皮下注射50~55日龄家兔产气荚膜梭菌病(魏氏梭菌病)A型灭活疫苗2 ml皮下注射60~65日龄兔病毒性出血症(兔瘟)灭活疫苗1ml皮下注射或:仔兔40~45日龄断奶用以下程序免疫日龄疫苗名称剂量注射途径30~35日龄多杀性巴氏杆菌病灭活疫苗1 ml皮下注射40~45日龄兔病毒性出血症(兔瘟)灭活疫苗2 ml皮下注射60~65日龄兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗1 ml 皮下注射70 日龄家兔产气荚膜梭菌病(魏氏梭菌病)A型灭活疫苗2 ml皮下注射注:魏氏梭菌病的免疫预防时间可根据兔场发病情况适当调整。
种公兔、非繁殖青、成年兔免疫程序(每年2次定期免疫,间隔6个月) 定期免疫疫苗名称剂量注射途径第1次兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗1 ml皮下注射家兔产气荚膜梭菌病(魏氏梭菌病)A型灭活疫苗2 ml皮下注射第2次兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗1 ml皮下注射家兔产气荚膜梭菌病(魏氏梭菌病)A型灭活疫苗2 ml皮下注射繁殖母兔(每年2次定期免疫,间隔6个月) 定期免疫疫苗名称剂量注射途径第1次兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗2 ml皮下注射家兔产气荚膜梭菌病
(魏氏梭菌病)A型灭活疫苗2 ml皮下注射第2次兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗2 ml皮下注射家兔产气荚膜梭菌病(魏氏梭菌病)A型灭活疫苗2 ml皮下注射。
中国的瑞普,世界的瑞普——专访天津瑞普生物技术股份有限公司副总裁梁武

——专访天津瑞普生物技术股份有限公司副总裁梁武本刊记者/李轶欣在华北这片热土上,有一家专业从事动物保健品研发与生产的企业,致力于为我国规模化畜禽场提供专业解决方案。
拥有瑞普(保定)生物药业有限公司、天津瑞普高科生物药业有限公司、湖南中岸生物药业有限公司、瑞普(天津)生物药业有限公司、湖北龙翔药业有限公司、内蒙古瑞普大地生物药业有限公司6个GMP生产基地;拥有原料药生产线、粉剂/散剂/预混剂、口服液生产线、消毒剂生产线、注射剂生产线、颗粒剂生产线、片剂生产线、灭活疫苗生产线、活疫苗生产线等30条大型生产线;她以巨大的产能成为我国集生物疫苗、药物原料、药物制剂、饲料添加剂四位一体的规模最大、产品种类最全的动物保健品生产基地之一。
在她的身上,有太多的荣耀和光环。
她的名字叫天津瑞普生物技术股份有限公司(以下简称瑞普生物)。
瑞普生物自1998年成立,秉承着“责任创造价值”的核心价值观,经十多年艰苦卓绝的努力,一步步做强、做大。
现在,已成为我国动物保健品行业的领军企业,并于2010年9月登陆中国A股市场,成为上市公司。
作为为数不多的专注于动保领域的上市公司,瑞普生物注重创新,不断投入研发力度,实现创新的可持续性。
瑞普生物是国内第一家蓝耳病自然弱毒活疫苗生产者,是第一家发明猪圆环病毒检测试剂盒的研发者。
始终保持行业的领先优势,生产了280多种动物产品。
瑞普生物已经在全国30个省、市、自治区建立了分销机构,在21个省级政府的招标采购中中标,与743家规模化养殖企业建立了稳定的合作关系。
一级经销客户达2 200多家,覆盖国内500个重点养殖县。
已陆续向埃及、约旦、巴基斯坦、菲律宾等多国进行产品注册和销售。
以完善的市场网络建设,快捷高效的物流服务机制,整合销售,为客户提供“一站式”、全方位服务。
瑞普生物是凭借什么能够发展壮大,并在动保领域里独领风骚?在动物保健品市场如此激烈竞争的今天,瑞普生物是凭借什么,使自己不败?带着这些疑问,本刊记者来到了瑞普生物,专访了副总裁梁武先生,由他解答我们心中的迷惑。
农业部发布新兽药目录(2016年度)
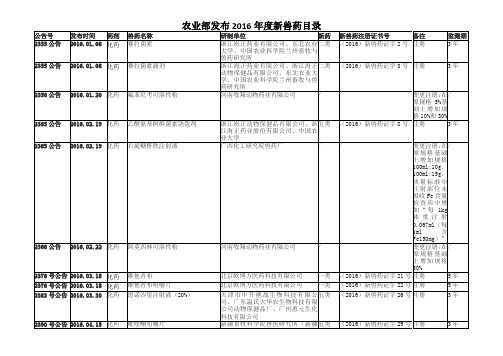
(2016)新兽药证字27号
注册
3年
2397号公告
2016.05.05
生物
猪伪狂犬病耐热保护剂活疫苗(C株)
武汉中博生物股份有限公司、上海创宏生物科技有限公司、扬州优邦生物药品有限公司、浙江美保龙生物技术有限公司、北京华夏兴洋生物科技有限公司
三类
(2016)新兽药证字56号
注册
3年
2440号公告
2016.08.25
化药
维生素C注射液
河北远征药业有限公司、河北远征禾木药业有限公司
/
/
变更注册:增加规格100ml:10g
/
2440号公告
2016.08.25
化药
灭蚕蝇溶液
辽宁凤凰蚕药厂
/
/
变更注册:增加规格100ml:40g,注意事项增加:使用本品后的蚕蛹未进行安全性评价,禁止食用
三类
(2016)新兽药证字63号
注册
3年
2455号公告
2016.10.09
化药
磷酸替米考星可溶性粉
保定冀中药业有限公司、山东鲁抗舍里乐药业有限公司高新区分公司、内蒙古金河动物药业有限公司、河北天象生物药业有限公司、山东鲁抗舍里乐药业有限公司、山东方明邦嘉制药有限公司
三类
(2016)新兽药证字64号
注册
三类
(2016)新兽药证字1号
注册
3年
2356公告
2016.01.20
生物
猪瘟病毒间接ELISA抗体检测试剂盒
中国兽医药品监察所、北京中海生物科技有限公司、中牧实业股份有限公司、广东永顺生物制药股份有限公司、北京世纪元亨动物防疫技术有限公司
三类
(2016)新兽药证字5号
国家三类新兽药——猪支原体肺炎灭活疫苗(DJ-166株)

l O l 0 ቤተ መጻሕፍቲ ባይዱ 1 1 1
四、 免疫原性试验
将D J - 1 6 6 株培养物免疫健康易感 猪后 2 8 d 攻毒 , 攻毒后 2 8 d 剖杀 , 结果见表 2 。
表 2 猪肺 炎支 原体 D J 一 1 6 6 株 免疫原性 试验结果
组别
攻毒 毒株 猪编号
0 O 2 4 5
菌落与支原 体特异性抗体反应 ,与标 记抗体结合 后 ,
荧光显微镜下观察呈现 明亮的黄绿色荧光 。
新 药 动 态
部 申请三类新兽药 , 证 书 为( 2 0 1 5 ) 新兽药证字 5 8 号。
三、 活菌 滴度 测 定
二、 生 物 学特 性
猪肺炎支原体 r ) j 一 1 6 6 株在 制备 的无细胞 培养基 中活
动态 的 括 试 息 作 新 原 纸 用 , 兽 料 ) 着 用 本 , 重 途 药 栏 为 和 介 及 、 目 广 企 成 绍 临 主 大 业 床 品 药 要 读 物 应 内 药 是 者 部 的 用 、 及 提 研 特 效 疫 时 供 制 苗 点 果 报 最 的 及 、 道 新 作 各 国 的 产 种 用 兽 家 品 检 机 批 药 ( 理 测 准 信 包 、
4 . 间接 菌落表面免疫荧光剂试验
段, 经过基 因测序 后 , 初步确定为猪肺炎支原体。然后有经 多重 P C I L ( 猪鼻 支原体 、 猪絮状 支原体和猪 肺炎支原 体 ) 、 培养 特性 、 生化 特性和血 清学 特性鉴 定 , 证 明为猪肺 炎支 原体 , 纯净 。菌株 在人工合成培养基传 8代稳 定后 , 经过 3 次克隆纯化后制备得到该株猪肺炎支原体。并 向中国农业
2
l 2
2023年动物免疫技术指南

2023年动物免疫技术指南
根据2023年国家动物疫病免疫技术指南,针对高致病性禽流感,疫苗选择主要有高致病性禽流感三价灭活疫苗(H5N6、H5-Re13株、
H5N8、H5-Re14株、H7N9、H7Re4株)和高致病性禽流感三价灭活疫苗(H5N2r、HN5801株、rGD59株,H7N9r、HN7903株)。
推荐免疫程序分为规模场和散养户两种情况:
1. 规模场:种鸡、蛋鸡在雏鸡14~21日龄时进行初免,间隔3~4周加强免疫,开产前再强化免疫,之后根据免疫抗体检测结果,每间隔4~6个月免疫一次;商品代肉鸡在7~10日龄时免疫一次,饲养周期超过70日龄的需加强免疫;种鸭、蛋鸭、种鹅、蛋鹅在14~21日龄时进行初免,间隔3~4周加强免疫,之后根据免疫抗体检测结果,每间隔4~6个月免疫一次;商品肉鸭、肉鹅在7~10日龄时免疫一次,饲养周期超过70日龄的需加强免疫;鹌鹑等其他禽类根据饲养用途,参考鸡的免疫程序进行免疫。
2. 散养户:春秋两季分别进行一次集中免疫,每月定期补免。
此外,还需注意其他动物疫病的免疫程序和疫苗选择,按照《国家动物疫病强制免疫指导意见(2022-2025年)》的要求进行免疫。
鸡新城疫禽流感(H9亚型)传染性法氏囊病三联灭活疫苗(LaSota株+YBF003株+S-VP2蛋白)

鸡 新城 疫 ( Ne w c a s t l e Di s e a s e . ND) 、 H9亚 型 禽 流 感 ( H9 s u b t y p e A v i a n I n l f u e n z a . AI ) 、 传染性法 氏囊病 ( I n f e c i t o u s B u r s a l Di s e a s e. I B D) 是影 响养 禽业发展 的三种重 大传染病 , 并且 这三种传染病在很 多地 区的养鸡场同时存 在 , 某 些地 区发病还 相 当严重 , 给养鸡业造成 巨大 的经济损失 。国内 外近年 因抗原浓缩技术和疫 苗佐 剂等工艺技术 的发展 , 上 述三 种病 相应疫苗 的研究及应 用非常普遍 , 但 目前还 没有 鸡新城疫 、 禽 流感 ( H9亚型 ) 、 传染 性法氏囊病三联灭 活疫 苗上 市。 单剂量接种 的安全试验 ” 、 “ 对靶 动物非 使用 日龄 的安全 试 验” 、 “ 对靶动物单剂量接种 、 单剂量重复接种 、 一次超剂 量 接种 的安全试验 ” 、 “ 对产蛋 期蛋鸡安全 试验 ” 、 “ 三 联苗 接 种对鸡的免疫学 功能影响及对鸡的生长 } 生 能影 响” 。试 验 结果表 明: 鸡只精神状态均 良好 , 采食饮水均正 常 , 无异 常 反应 ; 疫 苗接种后对鸡 的免疫学功能 也无 明显影 响。 为验证疫 苗的安全性 , 我们用 中试产 品开展 了临床试 验, 共免疫 试验鸡 近 5万 羽 , 所有 免疫鸡 免疫三联 苗后 采 食、 饮水 、 产蛋 均正常 , 无任 何不 良反应 , 抽取部分 雏鸡解 剖 ,结果 注射部位 1 4日后吸收 良好 , l m l / 只 接种组解 剖 后无结节 , 无红肿等不 良反应 , 证明研制的鸡新城疫 、 禽 流
养兔者该知道的必备药如何有效防治兔瘟

养兔者该知道的必备药如何有效防治兔瘟养兔者该知道的必备药农户和专业户饲养家兔,除了搞好饲养管理外,还必须把疾病防治放在重要的位置。
现将养兔者必知、必备的药物及使用方法介绍如下:1.青霉素针剂,分为20万、40万、80万单位,对葡萄球菌病、巴氏杆菌等有效,与链霉素合用可增强效力。
口服大部分被胃酸破坏,故不宜内服。
用量:成年兔每公斤体重5万至10万单位,肌肉注射,每天2次,连用3天至5天,疗效显着。
2.链霉素针剂。
每只100万单位,用于家兔传染性鼻炎、肠道感染等。
用量:成年兔每公斤体重10万至20万单位,肌肉注射,每天2次,连用3天至5天。
幼兔用量减半。
3.庆大霉素针剂,分为4万、8万、10万、20万单位,为广谱抗菌素。
对大肠杆菌、沙门氏菌、葡萄球菌等有效。
用量:成年兔每只1万至2万单位,肌肉注射,每天1次至2次,连用3天至5天,幼兔用量酌减。
4.土霉素片剂,每片0.25克,广谱抗菌素,但兔不宜长期使用。
用量:每公斤体重40毫克,内服,每天2次,连用3天至5天。
5.复方敌菌净片剂,每片30毫克或100毫克。
可用于预防和治疗兔球虫病、沙门氏菌病及消化道的感染。
用量:成年兔(预防)每公斤体重10毫克,1次内服,每天1次,连用3天至5天。
治疗量每公斤体重25毫克,1次内服,每天1次,连用3天至5天,疗效明显。
6.痢特灵片剂,每片0.1克,有一定毒性,用于肠道感染、兔副伤寒,也具有抗球虫作用。
用量:每公斤体重5毫克至10毫克,内服或拌料,分2次至3次服用。
7.敌百虫粉剂或片剂,对内外寄生虫有强大的杀灭作用,用于治疗兔疥癣病、兔虱等。
用量及用法:1%温水溶液涂擦患部。
8.氯苯胍片剂,每片10毫克,为广谱抗球虫药。
用量:每1000公斤饲料中加100克至150克。
每只每天也可按1片服用。
如何有效防治兔瘟正确选择和使用疫苗选择国家定点生产厂家生产的优质疫苗,到保存条件好信誉度高、经兽医部门批准经营生物制品的专营店购买。
全球首个兔用基因工程灭活疫苗在江苏省农业科学院诞生

8中国饲料2017年第7期修订令规定,对于篡改产品的生产曰期或保质期、或以不正当方法增加重量或容量、或使用不合格用水的行为,一经发现将吊销营业执照或查封经营场所。
另外,委托其他食用蛋收购、销 售业者贴牌的食用蛋收购、销售业者,受委托食用蛋收购、销售业者有违法行为将一起受到行政处罚。
接受新卫生教育不足2年者预进行已受新卫生教育所属业种营业或已受卫生教育者预进行当年所受教育所属业种营业的情况可免除再进行卫生教育。
同时,今年4月1曰起不适宜食用的食用蛋要装入贴有“废弃用”的 废弃容器,不可混入色素一起销售。
并对废弃内容进行记录,该记录自废弃之曰起要保管6个月以上。
金新农出资20亿元建设年出栏百万头生猪项目金新农3月3曰晚间公告,公司 于2017年3月3曰与南平市延平区人民政府签署了《生态养殖及肉联加工框架合作协议》,双方就南平市延平区合作发展年出栏百万头立体生态猪养殖及肉联加工项目达成战略合作意向。
公司出资20亿元,在南平市延平区建设年出栏百万头生猪的立体生态猪养殖及肉联加工项目,用3 ~5年 时间在南平市延平区建设示范种猪繁育基地、标准化的立体生态零排放‘‘无 抗”养殖基地,以及肉联加工厂。
同时,配套建设饲料加工厂、公猪站、病死猪无害化处理厂及配套环保设施等。
◄科技全球首个兔用基因工程灭活疫苗在江苏省农业科学院诞生近曰,江苏省农业科学院兔病学科团队在兔病疫苗研究方面取得重大突破性进展,其研发的兔病毒性出血症(俗称兔瘟)杆状病毒载体灭活疫苗(B A C-V P60株)获得国家新兽药一类注册证书([2017]新兽药证字06号)。
这是我国第一个兔用基因工程疫苗,也是世界上第一个获得政府许可针对兔瘟的亚单位疫苗。
兔瘟是一种由兔出血症病毒引起的急性、烈性传染病,死亡率可达90°%以上。
该疫苗的研制成功,被认为是兔瘟疫苗生产一次质的飞跃。
据悉,与传统疫苗相比,该疫苗生产技术具有多项原创性:一是用细胞生产疫苗抗原,不受敏感动物限制,有利于质量控制和大规模生产,实现了用体外细胞培养兔出血症病毒抗原的重大技术突破;二是不使用强毒生产疫苗,不存在扩散强毒的危险,生物安全性显著提高。
兽用新生物制品管理办法

兽用新生物制品管理办法文章属性•【制定机关】农业部(已撤销)•【公布日期】1989.09.02•【文号】农业部令第五号•【施行日期】1989.09.02•【效力等级】部门规章•【时效性】失效•【主题分类】畜牧业正文*注:本篇法规已被《农业部关于废止农业行政许可规章和规范性文件的决定》(发布日期:2004年7月1日实施日期:2004年11月1日)废止兽用新生物制品管理办法(一九八九年九月二日农业部令第五号发布)第一章总则第一条根据《兽药管理条例》第二十二条的规定,制定本办法。
第二条兽用新生物制品(以下简称新制品)系指我国创制或首次生产的用于畜禽等动物疫病预防、治疗和诊断的生物制品。
对已批准的生物制品所使用的菌(毒、虫)种和生产工艺有根本改进的,亦属新制品管理范畴。
第三条凡从事新制品的研究、生产、检验、使用、监督管理的单位和人员,都必须遵守本办法。
第二章新制品的分类和命名第四条新制品按管理要求分为三类:第一类:我国创制的制品;国外仅有文献报道而未批准生产的制品。
第二类:国外已批准生产,但我国尚未生产的制品。
第三类:对我国已批准的生物制品使用的菌(毒、虫)种和生产工艺有根本改进的制品。
第五条新制品的命名要符合“生物制品命名原则”(见附件一)的规定。
第三章新制品的研制要求第六条新制品应经过实验室试验、田间试验、中间试验、区域试验等研究过程,取得完整的数据,提出制造及检验规程草案(有关试验数据要求见附件五)。
第七条实验室试验应包括菌(毒、虫)种的选育和鉴定,毒力、抗原性、免疫原性、稳定性、特异性试验和生产工艺,制品的安全性、效力(实验动物及使用对象动物)、免疫期和保存期试验等。
第八条田间试验应用3-5批实验室制造的新制品对生产条件下的使用对象动物进行试验,观察其安全性和效力。
第九条中间试制应按实验室生产工艺在生物药品厂或农业部认可的具备一定条件的中试车间试制5-10批(诊断制剂不少于3批)制品,定型生产工艺。
国家三类新兽药重组新城疫病毒、禽流感病毒(H9亚型)二联灭活疫苗(αSG10株+G株)

动态本栏目主要是及时报道国家批准 的新兽药和企业内部研制的新产品(包 括原料药、成品药、疫苗及各种检测 试纸),为广大读者提供最新的兽药信 息,着重介绍药物的特点、作用机理、 作用用途及临床应用效果。
欢迎来稿!E —mail:sysc.**********引领兽药市场/直面兽药销售/沟通兽药产销/探索营销之道国家三类新兽药重组新城疫病毒、禽流感病毒(H9亚型)二联灭活疫苗(aSG10株+G 株)吉林正业生物制品股份有限公司发证日期:(H9亚型)二联灭活疫苗(aSGlO 株+G 株)根据《兽药管理条例》,该兽药符合规定,准予注册|中华人民共和国新兽药注册证书重组新城疫病毒、禽流感病毒(H9亚型)二联灭活疫苗(aSG10 株+G 株)由中国农大动物医学院副院长、博士生导师张国中教授主导研发;中国农业大学、中国兽医药品监察所、吉林正业生物制品股份有限公司等5家单位联合研制,为国家三类新兽药【注册证号:(2019)新兽药证字26号铱。
一、产品特点和优势(一)最新流行毒株,与当前流行毒株更为匹配,保护力更高该产品采用基因VII 型人工致弱鸡新城疫病毒aSG10株和H9N2亚型禽流感病毒G 株双新毒株制备遥新城疫病毒aSG10疫苗株是通过对近5年国内流行的NDV 毒株进行系统分析筛选得到的一株基因V 型代表性毒株,并将该毒株利用反向遗传操作技术进行了人工致弱,对目前流行的新城疫有很高的保护作用遥H9亚型禽流感病毒G 株是通过对近5年国内流行的500株H9-AIV 毒株进行系统分析筛选出与其他毒株交叉保护好的代表性毒株,核酸同源性高达93.2%-99.0%遥分析结果显示,该产品对近五年田间分离的不同地区NDV 和H9-AIV 代表性流行毒株进行攻毒保护试验,免疫 保护效果均在90%以上遥(二)起效快,保护期至少6个月该产品具有免疫产生期早、免疫持续期长、免疫保护效率高的优点遥将3批疫苗分别免疫21日龄SPF 鸡和120 日龄海兰褐商品蛋鸡,0.25mL/只遥疫苗免疫后21天,H9-HI 抗体效价达9log2以上;H9-AIV 流行株攻击后,鸡群不表现任何临床症状,且有效抑制排毒率达90%以上遥本疫苗免疫后14天即可产生较好的免疫保护效果,免疫持续期至少为24周遥新药动态12SPF 鸡NDV-HI 抗体商品蛋鸡NDV-H1抗体108 642 O1(g )车曇垢壬A-*-201301 -•-201302T-201303T-对照组108 6 421(嘗°】$樣拴军三06 8 10 12 14 16 IS 20 22 24 26 28 30 32免疫后不同时间(周〉-*-201301■-201302-*>201303T*-对照组Bl商品蛋鸡H9-HI 抗体SPF 鸡H 9-HI 抗体0 2 4 6 8 10 12 14 16 1S 20 22 24 26 28 30 32A2免疫后不同时间(周〉-♦-201301 -•-201302 -*-201303对照组0 8 6421(2800H E -*-201301-0-201302 —*—201303对照组4 6 & 10 12 14 16 18 20 22 24 26 28 30 32免疫后不同时间(周)O2B 图1疫苗免疫后HI 抗体消长情况A1: SPF 鸡 NDV-HI 抗体;A2 : SPF 鸡 H9-HI 抗体;B1:商品蛋鸡NDV-HI 抗体;B2:商品蛋鸡H9-HI 抗体判定标准:新城疫HI 抗体平均值M5log2;禽流感H9亚型HI 抗体平均值:&7log2该产品对近几年田间分离株的攻毒保护实验该产品以0.25ml/只剂量经颈部皮下注射途径接种3周龄SPF 鸡,免疫后21日NDV HI 抗体平均滴度在7log2以上,AIV HI 抗体平均值在8.5log2以上;用近几年田间分离株攻毒,NDV 对照鸡在攻毒后4日全部死亡,免疫鸡观察期内全部健活且病毒分离阴性率不小于9/10,攻毒保护率达90%以上;AIV 对照鸡病毒分离率均为5/5阳性,免疫鸡观察期内全部健活且病毒分离均为阴性,攻毒保护率为100%遥(见表1、表2)表1免疫鸡对不同NDV 毒株的攻毒保护情况新药动态D 攻毒毒株HI 抗体(Iog2)发病情况死亡慵况病毒分离攻毒保护免疫组7.70/100/101/109/10未免疫组0.05/55/55/50/5cm □ fH-免疫组7.30/100/100/1010/10未免疫组0.05/55/55/50/5l*4R1 A -免疫组7.50/100/101/109/10未免疫组0.05/55/55/50/5免疫组8.10/100/100/1010/10HLJlb 秣"未免疫组0.05/55/55/50/5cvi a 址免疫组8.20/100/100/1010/10未免疫组0.05/55/55/50/5/空白对照0.00/50/50/5/编辑部电话:0311-8 5151289表2免疫鸡对不同H9AIV 的攻毒保护情况攻壽毒株HI 抗体(Iog2 )死亡情况病毒分离情况攻毒將JS12 株免疫组9.20/100/1010/10未免疫组0.01/55/50/5HB13 株免疫组9.30/100/1010/10未免疫组0.01/55/50/5SD14 株-免疫组8.70/100/1010/10未免疫组0.00/55/50/5JS15 株免疫组9.50/100/1010/10未免疫组0.00/55/50/5HN16 株、免疫组9.10/100/1010/10未免疫组0.01/55/50/5/空白对照组0.00/50/5/该产品与国內其他同类疫苗的比较使用新城疫、禽流感疫苗免疫3周龄SPF 鸡,免后21日的测定HI 抗体平均滴度,并使用NDV 强毒株(SG10株)与G 株对不同免疫组进行攻毒,观察其攻毒保护率遥实验结果显示:该产品在安全性方面与其它厂家疫苗无明显差异曰在免疫效力方面,免疫21日后,该产品HI 抗 体平均滴度与其它厂家疫苗无明显差异遥新城疫部分,本疫苗和重组新城疫病毒灭活疫苗(A-VII 株)攻毒保护效果相当曰禽流感部分,攻毒保护效果优于其它两款疫苗遥(见表3、表4)表3 4种疫苗的免疫效力检验结果(新城疫部分)疫苗名称HI 抗体平均滴度(Iog2)(本毒株腿检测)发病数/死亡靭攻毒数病毒分离阳删/攻毒数保护数/攻毒数A (禽正好)6.20/0/102/108/10B 5.8///C5.6///D 6.10/0/102/108/10攻毒对照组0.05/5/55/50/5表43种疫苗的免疫效力检验结果(禽流感部分)尉翔攻毒数病毒分离阳性数 欣毒数HI 抗体平均滴度(Iog2 )G 株驱 本毒株腿疫苗名称A (禽正好)9.19.10/1010/10B 6.89.02/108/10C7.08.91/109A0攻毒对照组0.00.05/50/5备注:A ,重组新城疫病毒、禽流感病毒(H9亚型)二联灭活疫苗(aSG10株+ G 株);B ,新城疫、禽流感(H9亚 型)二联灭活疫苗(La Sota 株+ F 株);C ,鸡新城疫、禽流感(H9亚型)二联灭活疫苗(La Sota 株+ HL 株);D ,重组新城疫病毒灭活疫苗(A-VII 株)遥新药动态基因VII 型NDV 疫苗产生的保护效果明显优于LaSota 疫苗株HI 抗体水平丄‘攻毒方式-*■ ■ ■ ■80604020 (案)#牟举免疫:LaSota免疫:aSGlO 攻毒:SG10攻毒:SG10试验结果显示:当NDV-HI 抗体大于3log2时,本制品与LaSota 灭活疫苗均可保护鸡只不表现临床症状或死亡, 但免疫鸡只的排毒率存在明显差异。
中监所新兽药证书兽用生物制品统计表疫苗类
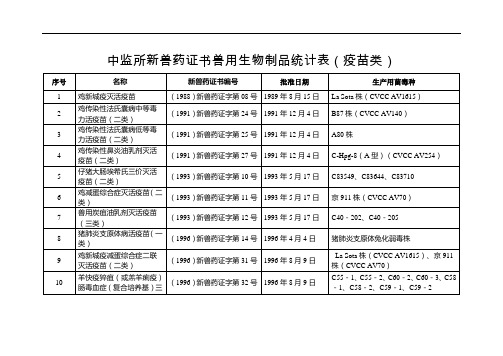
2016年2月4日
YB3株+GD株
38
猪伪狂犬病耐热保护剂活疫苗(HB2000株)三类
(2016)新兽药证字20号
20ቤተ መጻሕፍቲ ባይዱ6年3月18日
HB2000株
39
牛病毒性腹泻/黏膜病、传染性鼻气管炎二联灭活疫苗(NMG株+LY株)(二类)
(2016)新兽药证字51号
2016年7月14日
(2012)新兽药证字20号
2012年6月11日
WF株+BZ株
30
鸡病毒性关节炎活疫苗(ZJS株)(三类)
(2012)新兽药证字40号
2012年11月22日
ZJS株
31
禽流感灭活疫苗(H5N2亚型,D7株)(三类)
(2013)新兽药证字12号
2013年2月8日
H5N2亚型,D7株
32
猪口蹄疫O型灭活疫苗(O/Mya98/XJ/2010株+O/GX/09-7)(三类)
NMG株+LY株
40
山羊传染性胸膜肺炎灭活疫苗(山羊支原体山羊肺炎亚种C87001株)(三类)
(2017)新兽药证字03号
2017年1月20日
C87001株
41
禽流感病毒H5亚型灭活疫苗(D7株+rD8株)
(2017)新兽药证字10号
2017年2月13日
D7株+rD8株
42
鸡马立克氏病I型、III型二价活疫苗(814株+HVT Fc-126克隆株)(三类)
(2017)新兽药证字21号
2017年5月3日
814株+HVT Fc-126克隆株
43
仔猪大肠杆菌病(K88+K99+987P)、产气荚膜梭菌病(C型)二联灭活疫苗
三类新兽药猪瘟活疫苗(传代细胞源)

三类新兽药猪瘟活疫苗(传代细胞源)
无
【期刊名称】《兽药市场指南》
【年(卷),期】2012(000)003
【摘要】猪瘟活疫苗(传代细胞源)系用猪瘟病毒兔化弱毒株(CVCCAV1412)接种易感传代细胞培养,收获培养物,加适宜稳定剂,经冷冻真空干燥制成,主要用于预防猪瘟。
由中国兽医监察所和广东永顺生物制药有限公司联合申报的猪瘟活疫苗(传代细胞源)于2012年1月31日,被农业部批准为国家三类新兽药,证书号为2012新兽药证字01号。
【总页数】2页(P15-16)
【作者】无
【作者单位】不详
【正文语种】中文
【中图分类】S858.285.3
【相关文献】
1.猪瘟活疫苗(传代细胞源)应用 [J], 罗长荣
2.猪瘟活疫苗(传代细胞源)猪瘟病的克星 [J], 范艺凡;霍英
3.猪瘟活疫苗(传代细胞源)免疫产生期和免疫持续期试验 [J], 任向阳;吴文福;岑小清;游启有;刘秋燕;赖月辉;黄秋雪
4.猪瘟活疫苗(传代细胞源)对我国不同猪瘟病毒流行毒株的免疫保护研究 [J], 王琴;范学政;徐璐;赵启祖;张乾义;邹兴启;朱元源;杨劲松;宁宜宝
5.猪瘟活疫苗(传代细胞源)免疫猪的攻毒保护试验 [J], 张毓金;林旭埜;吴文福;任向阳;游启有;岑小清;张木辉;冯忠武;冯忠泽
因版权原因,仅展示原文概要,查看原文内容请购买。
国家一类新兽药兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗

国家一类新兽药兔病毒性出血症、多杀性巴氏杆菌病二联灭活
疫苗
赵永前;李龙蕾;吕光明;薛家宾;徐为中;王芳;张则斌
【期刊名称】《兽药市场指南》
【年(卷),期】2006(000)004
【摘要】兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗,由江苏省农科院兽医研究所和南京天邦生物科技有限公司研制申报,经农业部兽用生物制品规程委员会审查通过,2005年11月16日被批准为国家一类新兽药,并颁发新兽药注册证书【证号:(2005)新兽药证字36号】。
【总页数】1页(P14)
【作者】赵永前;李龙蕾;吕光明;薛家宾;徐为中;王芳;张则斌
【作者单位】南京天邦生物科技有限公司;江苏省农科院兽医研究所
【正文语种】中文
【中图分类】S858.291
【相关文献】
1.兔病毒性出血症与多杀性巴氏杆菌病二联灭活疫苗的试制和效果 [J], 薛家宾;王启明;徐为中;周永银;诸玉梅;陈兴祥
2.兔病毒性出血症、多杀性巴氏杆菌病二联蜂胶灭活疫苗最小免疫剂量测定的试验[J], 王晓丽;程志伟;王永明;李士成
3.兔病毒性出血症,多杀性巴氏杆菌病二联干粉灭活疫苗的研制报告 [J], 刘毅英;同
育英
4.国家三类新兽药重组新城疫病毒、禽流感病毒(H9亚型)二联灭活疫苗(αSG10株+G株) [J], 无
5.猪链球菌病灭活疫苗、兔病毒性出血症-多杀性巴氏杆菌病二联灭活疫苗中试与产业化示范 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
