盐类水解的应用课件
合集下载
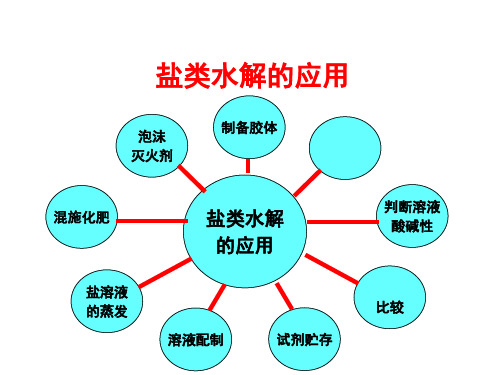
三节三时盐类的水解的应用PPT课件
“焊药”—金属焊接时常用于除去金属表 面的氧化膜,常用ZnCl2、NH4Cl。
灭火器原理
消防灭火中的盐类水解知识
塑料筒里面放入的什么药品? 外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
问题:泡沫灭火器中装的是那两种溶液,其作用原理 是什么?
药品:Al2(SO4)3溶液、NaHCO3溶液
了肥效。
双水解
(三)工业生产中的盐类水解问题
问题10:金属镁与水反应比较困难,若
加一些NH4Cl马上产生大量气体?为什么?
NH4++H2O
NH3•H2O + H+
Mg+ 2H+ = Mg2+ + H2↑ △
NH3•H2O = NH3 ↑ + H2O
总方程式:
Mg+2NH4Cl=MgCl2+2NH3 +H2
(3)强碱弱酸盐水溶液蒸干后一般得到原物质。
如:蒸干 Na2CO3 溶液仍得到 Na2CO3 固体。 (4)对于具有强还原性的盐,如 FeCl2、Na2SO3 等, 在空气中将其溶液蒸干并灼烧时,会发生氧化还原
CO32- + H2O
HCO3- + OH-
SiO2 + 2OH- = SiO32- + H2O
6、加热蒸发可水解的盐溶液析出?固体
问题4:把FeCl3溶液蒸干灼烧,最后得到的固体 产物是什么,为什么?
FeCl3+3H2O ⑴加热促进水解
Fe(OH)3+3HCl ⑵HCl挥发
△
2Fe(OH)3 = Fe2O3 + 3H2O
Al3++3H2O
盐类水解的应用课件

2.双水解的离子组
Al3+——HCO3-、 CO32-、HS-、S2-、AlO2-等 Fe3+——HCO3-、 CO32-、AlO2-、ClO-等 NH4+——SiO32-、AlO2-
5.下列各组离子在溶液中能大量共存的是 ( A ) A.Ca2+、 HCO3- 、C1、K+ B.AI3+、AlO2- 、HCO3-、Na+ C.Fe2+、NH4+、SO42-、S2 D.Fe3+、SCN、Na+(低于400℃) 质的溶液,可以得到该物质的固体的是(C ) A. AlCl3 B. NaHCO3 C. MgSO4 D.
下列物 KMnO4
生活小常识一:炸油条或油饼时必须要放明 矾与纯碱,请解释原理。 2Al3++3CO32- +3H2O = 2Al(OH)3↓+3CO2↑
离子浓度关系
以CH3COONa为例:
1.三个守恒
= c(CH COO - ) + c(CH COOH) C(Na+ ) + c (H ) = c(CH COO ) + c(OH ) (2)电荷守恒: C(OH ) = c(H ) + c(CH COOH) (3)质子守恒:
(1)物料守恒: c(Na+ )
MgCl2· 2O △ 6H Mg(OH)2 △ MgO
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2。
3.分析下列盐溶液蒸干灼烧后得到的固体物质是什么?
FeCl3 溶液 Fe(NO3)3 溶液 Fe2(SO4)3 溶液 Na2CO3 溶液 Fe2O3 Fe2O3 Na2CO3· 2O 10H CuSO4· 2O 5H Fe2(SO4)3 Na2SO3 溶液 Ca(HCO3)2 溶液 Na2CO3 CuSO4 Na2SO4 CaCO3
盐类水解的应用 PPT

总结
泡沫 灭火剂
判断离 子共存
判断离子种 类、数目
混施化肥
盐类水解 的利用
明矾净水 物质提纯
盐溶液 的蒸发
判断溶液 酸碱性
盐的配 制和存放
三、溶液酸碱性的判断
练习和思考:相同温度下同物质的量 浓度的下列溶液PH值由小到大的排序 是:
①NaOH
②NH3·H2O
④NaHSO4 ⑤NH4Cl
⑦NaHCO3 ⑧Ba(OH)2
⑩CH3COOH
③H2SO4 ⑥Na2CO3 ⑨NaCl
答案:③④⑩⑤⑨⑦⑥②①⑧
四、水解的盐的配制和存放
观察思考:
Fe(OH)3〔胶体〕+3H+ Al(OH)3〔胶体〕+3H+
3、农家谚语:“灰混粪,粪混灰,灰粪相混损肥分.” 为什么?
草木灰的成分:K2CO3,水解呈碱性.
CO32-+H2O HCO3-+H2O
HCO3- +OHH2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性.
NH4++H2O
NH3·H2O+ H+
①观察新制和久置的FeCl3溶液,解释不同的原因? ②在溶液配制和存放的过程中如何解决此问题?
答案:
①久置的FeCl3溶液变得浑浊, 是因为Fe3++3H2O Fe(OH)3+3H+ ②配制FeCl3溶液的时候要入少量HCl防止Fe3+水解 【小结】:配制易水解的金属盐溶液应加少
量的___同___种__酸______
4、泡沫灭火器能灭火,为什么?
玻璃筒里面放入的什么药品?外筒(钢质)放入的是 什么药品? 泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
盐类水解的应用 课件

6.化肥的施用 如:草木灰与铵态氮肥不能混合施用,否则会使肥效降 低,这是由于两种盐发生双水解放出氨气的缘故。
7.盐溶液的配制 如:配制FeCl3、SnCl2溶液时应加入少量盐酸,配制 AgNO3溶液时应加入少量硝酸。 问题探究1:实验室配制FeCl2溶液时,通常将FeCl2固体 先溶解在盐酸中,再加水稀释至所需浓度,同时还加入 少量铁屑,为什么?
3.加热蒸干盐溶液析出固体
不水解、不分解的盐溶液加热蒸干时,析出盐的晶体, 如NaCl;能水解,生成的酸不挥发,也能析出该盐的晶 体,如Al2(SO4)3;能水解,但水解后生成的酸有挥发性, 则析出金属氢氧化物,若蒸干后继续加热,则可分解为 金属氧化物,如AlCl3、FeCl3;若盐在较低温度下受热能 分解,则加热蒸干其溶液时,盐已分解,如Ca(HCO3)2。 4.判断盐所对应酸的相对强弱 如:已知物质的量浓度相同的两种盐溶液,NaA和NaB, 其溶液的pH前者大于后者,则酸HA和HB的酸性强弱为 HB>HA。 5.金属与盐溶液反应产生H2 如:金属镁与FeCl3、AlCl3、NH4Cl溶液反应均能产生H2, 因为这些盐水解显酸性。
④不同溶液中同一离子浓度的 子 的 影 响 。 如 在 0.10 mol·L - 1 的 ①NH4HSO4 、 ②NH4C1 、
③CH3COONH4 、 ④(NH4)2SO4
溶
液
中
,
c(NH
+
4
)
的
大
小
顺
序
为
④>①>②>③。
(2)混合溶液中各离子浓度的大小比较,根据电离程度、水解程度的
(2)物料守恒规律
电解质溶液中,由于某些离子能水解或电离,离子种类增多,但原
《盐类的水解》全部ppt课件

专题3 溶液中的离子反应
第三单元 盐类的水解
最新版整理ppt
1
【知识回顾】 根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸 + 碱 == 盐 + 水 (中和反应)
强酸 酸
弱酸
强碱 碱
弱碱
1、强酸强碱盐 NaCl、 K2SO4
生成的盐 2、强酸弱碱盐 FeCl3、NH4Cl 3、强碱弱酸盐 CH3COONa、K2CO3
最新版整理ppt
15
3. 等物质的量浓度、等体积的酸HA与碱NaOH 混合后,溶液的酸碱性是( D )
A、酸性 B、中性 C、碱性 D、不能确定
4. 下列物质分别加入到水中,因促进水的电离而使 溶液呈酸性的是( C )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
酸性
碱性
5. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( A )于2。
CH3COO-+H2O最新版整理pCpt H3COOH+OH- 10
注意:
(1)多元弱酸根水解:如Na2CO3
Na2CO3+H2O NaHCO3+NaOH
CO32-+H2O HCO3-+ OHHCO3-+H2O H2CO3+OH多元弱酸根水解分步进行,但以第一步水解为主
(2)多元弱碱的阳离子水解:如AlCl3
Hale Waihona Puke B.CH3COOHC.NaOH
D.CH3COOK
最新版整理ppt
17
一、盐的类型与盐溶液酸碱性的关系【:课堂小结】
二、盐溶液呈不同酸碱性的原因:
三、盐类水解:
1、定义:
溶液中盐电离出来的弱离子跟水所电离出来 的H+ 或OH –结合生成弱电解质的反应。
第三单元 盐类的水解
最新版整理ppt
1
【知识回顾】 根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸 + 碱 == 盐 + 水 (中和反应)
强酸 酸
弱酸
强碱 碱
弱碱
1、强酸强碱盐 NaCl、 K2SO4
生成的盐 2、强酸弱碱盐 FeCl3、NH4Cl 3、强碱弱酸盐 CH3COONa、K2CO3
最新版整理ppt
15
3. 等物质的量浓度、等体积的酸HA与碱NaOH 混合后,溶液的酸碱性是( D )
A、酸性 B、中性 C、碱性 D、不能确定
4. 下列物质分别加入到水中,因促进水的电离而使 溶液呈酸性的是( C )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
酸性
碱性
5. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( A )于2。
CH3COO-+H2O最新版整理pCpt H3COOH+OH- 10
注意:
(1)多元弱酸根水解:如Na2CO3
Na2CO3+H2O NaHCO3+NaOH
CO32-+H2O HCO3-+ OHHCO3-+H2O H2CO3+OH多元弱酸根水解分步进行,但以第一步水解为主
(2)多元弱碱的阳离子水解:如AlCl3
Hale Waihona Puke B.CH3COOHC.NaOH
D.CH3COOK
最新版整理ppt
17
一、盐的类型与盐溶液酸碱性的关系【:课堂小结】
二、盐溶液呈不同酸碱性的原因:
三、盐类水解:
1、定义:
溶液中盐电离出来的弱离子跟水所电离出来 的H+ 或OH –结合生成弱电解质的反应。
