第六章蛋白质的降解
细胞内蛋白质的降解

直到1970年代末才真正揭示了细胞内蛋白质选择性 降解的分子机制,降解是维护细胞内蛋白质水平不可 或缺的控制步骤。
细胞内特定蛋白质的动态变化像放射性同位素一样,服从 一级反应动力学。常用半寿期表示其降解速率,即一种蛋白质 合成之后被降解一半所用的时间。
丝氨酸蛋白酶 及其活性中心 的结构
枯草溶菌素
胰蛋白酶胰腺胰蛋 白酶抑制 剂复合物
(2)半胱氨酸蛋白酶(EC3.4.22):其活性中心都 有Cys-His,通过共价催化裂解特定的肽键,受低浓度 对-羟基汞苯甲酸(pHMB)和碘乙酸等烷基化试剂抑制。
按进化渊源可划分成三个家族:链球菌溶血素家族 (streptolysin);梭菌蛋白酶家族(clostripain) 和木瓜蛋白酶家族(papain)。
短寿命蛋白质: 长寿命蛋白质:
表5.1 大鼠肝细胞一些蛋白质的半寿期
蛋白质 鸟氨酸脱羧酶 δ-氨基γ--酮戊酸合酶 RNA聚合酶Ⅰ 酪氨酸氨基转移酶 色氨酸加氧酶 脱氧胸苷激酶 β-羟基-β-甲基戊二酰辅酶A还原酶 磷酸烯醇式丙酮酸羧激酶 精氨酸酶 醛缩酶 细胞色素b5 甘油醛3-磷酸脱氢酶 细胞色素b 乳酸脱氢酶(同工酶5) 细胞色素c 透明质酸酶
真核细胞半胱氨酸蛋白酶都属于木瓜蛋白酶家族,主要 存在于细胞溶胶和溶酶体(液泡)内,如组织蛋白酶B、L 、 H、N、S、M、T、依赖金属的半胱氨酸蛋白酶等。
钙依蛋白calpain (calcium-dependent papain-like proteinase)也属于木瓜蛋白酶家族,是一种Ca2+激活的中性 蛋白酶,由80kDa大亚基和30kDa小亚基组成,在细胞溶胶中 降解细胞骨架、受体等长寿命蛋白和一些蛋白激酶。
蛋白质的降解与氨基酸代谢

根据动物实验,人们很早就确定了肝脏是尿素合成的主要 器官,肾脏是尿素排泄的主要器官。1932年Krebs等人利用大 鼠肝切片作体外实验,发现在供能的条件下,可由CO2和氨合 成尿素。若在反应体系中加入少量的精氨酸、鸟尿酸或瓜氨酸 可加速尿素的合成,而这几种氨基酸的含量并不减少。为此, Krebs等人提出了尿素循环学说(urea cycle) ,又称鸟氨酸循 环(orinithine cycle)。
L-谷氨酰胺 谷氨酰胺酶 (肝线粒体)
尿素
L-谷氨酸
2.丙氨酸的转运:
肌肉蛋白
肌肉中有一组氨基转移酶, 可把丙酮酸作为它的-酮酸 的载体。在它们的作用下, 产物为丙氨酸,丙氨酸被释 放到血液,经血液循环进入 肝脏,在肝脏中经转氨作用 又产生丙酮酸,通过葡萄糖 异生途径形成葡萄糖,葡萄 糖通过血液循环回到肌肉中, 通过糖酵解作用降解为丙酮 酸,该循环称为葡萄糖-丙氨 酸循环。 其既可以将肌肉中的氨以 无毒的丙氨酸形式运输到肝, 同时通过肝为肌肉提供葡萄 糖。
蛋白质的降解与氨基酸代谢 Chapter 30 Metabolism of Amino Acids & Proteins.1
一.蛋白质的降解:
细胞不断地把氨基酸合成为蛋白质,又不断地把蛋白 质降解为氨基酸(aa),这个过程有二重意义:
(1). 排除不正常蛋白质,它们若一旦聚集,将对细胞有害。 (2). 通过排除积累过多的酶和“调节蛋白”,使细胞代谢得 以秩序井然地进行。
(1). 转氨基(氨基转移)作用
(2). 氧化脱氨基作用 (3). 联合脱氨基作用
2.1 转氨基作用(transamination):
1) 定义:在转氨酶的作用下,某一氨基酸去掉α-氨基生成 相应的α- 酮酸,而另一种α- 酮酸得到此氨基生成相应的氨 基酸的过程。
细胞内蛋白质的降解

5.1.2.2 叶绿体中的蛋白降解系统
5.1.2.2 Protein Degradation System in Chloplast
5.1.3
蛋白质降解的生物学意义
最近十几年对各类生物细胞内蛋白降解的 研究取得了长足的进展。以植物细胞为例, 每个区隔有一个或多个降解途径(图5.1)。
图5.1 植物细胞中蛋白酶和蛋白水解途径的亚细胞定位
在氨基酸供给不足的条件下,自体吞噬泡的数量增加,细胞 蛋白降解加速,以弥补氨基酸代谢库的亏缺。
许多激素调节着溶酶体的蛋白降解速率,如胰岛素可通过 减少自体吞噬泡的形成抑制肝和骨骼肌溶酶体系统降解蛋白;而 甲状腺素却加速肌肉溶酶体酶的合成和蛋白质降解速率。
在许多病理条件下溶酶体系统主要负责降解糖蛋白、蛋白 聚糖、脂蛋白、膜蛋白、外来蛋白等,但至今还没有足够的证据 表明它的作用是高度选择性的。
(不依赖ATP的胰蛋白酶活性和胰凝乳蛋白酶活性,最大的蛋白酶)
ClpP
ClpAP
E.coli HslVU蛋白酶
FtsH蛋白酶
FtsH蛋白酶
Tricorn Proteinase
5.1.2 细胞内蛋白质降解系统
5.1.2.1 溶酶体系统
1960 年 代 De Duve 证 实 , 溶 酶 体 富 含 在 酸 性 条 件 下 起作用的酶,能把经内吞被摄入细胞的外源蛋白或经受体 介 导 胞饮 进 入的 脂 蛋白 、 铁传 递 蛋白 、 激素 、受体等 长寿命蛋白迅速降解成肽和氨基酸。
这些现象暗示,蛋白质的半寿期取决于它特有的结构和 细胞内环境。 特定蛋白质的降解速率以及细胞或组织中蛋白质降解的 总速率在不同生理条件下是可变的,如应答激素刺激或饥饿。 底物、产物、辅因子甚至药物也能影响蛋白质在细胞内的 降解速率,例如色氨酸加氧酶在其底物色氨酸和辅因子血红素 存在时降解较慢;谷酰胺合成酶在其终产物谷酰胺浓度增大时 加速降解。这种效应的分子机制尚不明了,但在生理上的合理 性显而易见,它保证在底物大量存在时酶保持较高浓度,或者 当产物过多时酶的水平适当降低。
蛋白质降解的三条途径

蛋白质降解的三条途径
1、运输蛋白:参与物质运输的功能,能使物质在细胞和生物体内自由、准确地转移。
主要为各种载体、血红蛋白等。
2、催化蛋白:催化特定的生化反应,降低反应的活化能,使反应快速高效地进行。
主要为各种酶类。
3、免疫系统蛋白:参予免疫系统接收者反应,能够并使生物体有效地抵挡有害生物
或物质的侵略。
主要为各种抗体等。
蛋白质是生命的物质基础,是有机大分子,是构成细胞的基本有机物,是生命活动的
`主要承担者。
没有蛋白质就没有生命。
氨基酸是蛋白质的基本组成单位。
它是与生命及
与各种形式的生命活动紧密联系在一起的物质。
机体中的每一个细胞和所有重要组成部分
都有蛋白质参与。
蛋白质占人体重量的16%~20%,即一个60kg重的成年人其体内约有蛋白质9.6~12kg。
人体内蛋白质的种类很多,性质、功能各异,但都是由20多种氨基酸按不
同比例组合而成的,并在体内不断进行代谢与更新。
蛋白质的降解
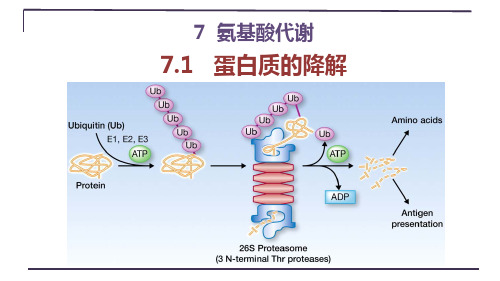
7.1 蛋白质的降解
蛋白质酶促降解不依赖于ATP的降解途径:发生在溶酶体依赖于ATP的降解途径
①N-端规则和特征序列
②需要泛素
③降解发生在蛋白酶体
④高度调控
①N-端规则:一种蛋白质的半衰期与N端氨基酸的性质有关,是 Met, Ser,
Ala, Thr, Val或Gly,则半衰期较长,大于20h;是Phe, Leu, Asp, Lys或Arg ,则半衰期较短,3min或者更短。
特征序列:富含Pro, Glu, Ser 和Thr 序列的蛋白质质被称为PEST 蛋白,比其他蛋白质更易水解。
②泛素:广泛存在于古
菌和所有的真核生物,但不存在于细菌。
本身并不降解蛋白质,给降解的蛋白质打上标记,降解过程由26S蛋白酶体执行,是一种热激蛋白。
泛素需要先活化再反应,活化消耗2个ATP
分子,产生AMP和焦
磷酸PPi。
硫酯键转变
为了酰胺键。
Proteasome(20S) ③蛋白酶体:广泛存在于古菌和所有的真核生物,但不存在于细菌。
本身并不降解蛋白质,给降解的蛋白质打上标记,降解过程由26S蛋白酶体执行,是一种热激蛋白。
蛋白质的降解

蛋白质的降解
蛋白质是生命体内最重要的有机物之一,是构成细胞及组织的基础。
但是,蛋白质在生命体内并不是永久存在的,而是经过一定的代谢作用后被降解掉。
蛋白质的降解过程是一个复杂的过程,涉及到多种酶的参与,包括蛋白酶、肽酶等。
蛋白质降解的主要途径是通过蛋白酶的作用将蛋白质分解成小分子,再通过肝脏和肾脏等器官的代谢作用将其转化为能量或废物排出体外。
此外,蛋白质在细胞内还会经历泛素化和蛋白酶体途径的降解,这是一种通过标记蛋白质并将其送入蛋白酶体内降解的过程。
蛋白质的降解是一个动态平衡的过程,当蛋白质合成速度高于降解速度时,蛋白质的含量就会增加,反之则会减少。
因此,蛋白质的降解对于维持生命体内的蛋白质水平具有至关重要的作用。
总之,蛋白质降解是生命体内的一个重要代谢过程,对于维持生命体内的蛋白质水平具有重要作用。
了解蛋白质的降解过程对于预防和治疗某些疾病具有重要意义。
- 1 -。
蛋白质的降解和氨基酸的代谢

转氨基作用机制
体内重要的转氨酶
丙氨酸氨基转移酶( ① 丙氨酸氨基转移酶(alanine aminotransferase, ALT或glutamic pyruvic 或 transaminase, GPT):肝中活性最高 ):肝 ): 天冬氨酸氨基转移酶( ② 天冬氨酸氨基转移酶(aspartate aminotransferase, AST或glutamic oxalo-acetic 或 transaminase, GOT):心肌中活性最高 ):心肌中活性最高 ):心肌
氮平衡 状态 氮的总 平衡 氮的正 平衡 氮的负 平衡 进、出氮 情况 摄入氮= 摄入氮= 排出氮 摄入氮> 摄入氮> 排出氮 摄入氮< 摄入氮< 排、青春期青少年、孕妇及 恢复期病人 长期饥饿、 长期饥饿、消耗性疾病患者
三、必需氨基酸 人体营养需要,而又不能自身合成, 人体营养需要,而又不能自身合成,必须由 食物供应的氨基酸。 食物供应的氨基酸。共8种:Val、Ile、 Leu、 种 、 、 、 Phe、Met、Trp、Thr、Lys。 、 、 、 、 。 四、蛋白质的互补作用 混合食用营养价值较低的蛋白质, 混合食用营养价值较低的蛋白质,则必需氨 基酸可以互相补充,从而提高营养价值。 基酸可以互相补充,从而提高营养价值。
第一节
蛋白质的酶促降解
一、细胞内蛋白质降解的的两个体系 P286 1. 溶酶体无选择的降解 2. 泛素标记的选择性蛋白质降解 • 泛素:是一种参与蛋白质降解的小分子蛋白质。 泛素:是一种参与蛋白质降解的小分子蛋白质。
1. 溶酶体无选择的降解蛋白质
• 溶酶体组成及特点 含有50种水解酶(组织蛋白酶),最适PH为 含有50种水解酶(组织蛋白酶),最适PH为5.0 50种水解酶 ),最适PH 左右,在细胞溶胶PH下无活性。 左右,在细胞溶胶PH下无活性。 PH下无活性 • 溶酶体对细胞内组分的利用是和膜融合后利用自 身酶来降解。 身酶来降解。 • 溶酶体降解蛋白质是无选择的。 溶酶体降解蛋白质是无选择的。
蛋白质质量控制和蛋白质降解的机制

蛋白质质量控制和蛋白质降解的机制蛋白质是生命体中最重要的生物大分子之一,它们在生命过程中扮演着不可替代的角色。
但是,蛋白质的合成和降解必须保持一个动态平衡,以保证生命体的正常运转。
有关蛋白质的质量控制和降解机制,一直是生物学领域的重要研究方向之一。
一、蛋白质的质量控制细胞内的蛋白质合成需要通过核糖体将氨基酸组装成多肽链,形成成熟的蛋白质。
在这个过程中,往往会出现错误的组装、折叠不完整、不稳定或者失去功能的蛋白质。
这种异常蛋白质会影响正常细胞功能,甚至会导致疾病的发生。
因此,细胞内存在一系列的蛋白质质量控制机制,来对不良蛋白质进行修复或者降解。
其中,最主要的机制包括:分子伴侣介导的折叠控制、泛素降解途径和自噬途径。
1、分子伴侣介导的折叠控制分子伴侣是一类细胞内重要的蛋白质,它们能够结合未折叠或部分折叠的蛋白质,协助其完成正常的折叠过程。
细胞内分子伴侣的种类很多,最常见的是Hsp70和Hsp90家族。
Hsp70家族分子伴侣负责结合未折叠或部分折叠的蛋白质,在ATP的辅助下促进蛋白质的折叠。
而Hsp90家族分子伴侣则负责结合已经部分折叠完成的蛋白质,协助其完成完整的折叠过程。
2、泛素降解途径泛素是一种小分子蛋白质,主要作用是通过连接蛋白质上的氨基酸残基,将需要降解的蛋白质标记出来。
被标记的蛋白质会被多种酶降解,最终释放出单个氨基酸和短肽。
泛素降解途径是细胞内最主要的蛋白质质量控制途径之一,它能够清除一些异常的蛋白质,保障细胞正常的生物学功能。
3、自噬途径自噬途径是细胞内的一种吞噬降解机制,能够积累和降解蛋白质聚合体、细胞器和其他大分子复合物等。
自噬途径的功能是清除过时或部分失去功能的细胞组成部分,维护细胞正常的生物学功能。
二、蛋白质的降解机制蛋白质的降解机制主要通过泛素降解途径和自噬途径来完成。
其中,最常见的是泛素降解途径。
泛素降解途径的主要机制包括泛素连接、泛素酶介导的降解和蛋白质结构分解。
泛素连接是指通过连接泛素分子到蛋白质上,标记需要降解的蛋白质。
蛋白质的酶促降解

• 酶促降解概述 • 蛋白质的酶分类 • 蛋白质的酶促降解过程 • 酶促降解的调节 • 酶促降解的应用 • 研究展望
目录
01
酶促降解概述
酶促降解的定义
酶促降解是指蛋白质在酶的作用下被 分解成小分子的过程。
酶是一种生物催化剂,能够加速蛋白 质的分解反应,使其成为更小的肽段 或氨基酸。
蛋白裂解酶
总结词
蛋白裂解酶是一类能够催化蛋白质分子内部特定化学键转移 的酶,主要作用是将蛋白质分子断裂成两个或多个片段。
详细描述
蛋白裂解酶在生物体内的多种生理过程中发挥作用,如蛋白 质的合成、加工和降解等。与蛋白水解酶不同,蛋白裂解酶 的作用位点通常在蛋白质分子内部的特定化学键,因此具有 更高的特异性。
药物生产
在药物生产过程中,酶促降解技术可以用于实现大规模 的蛋白质切割和修饰,提高生产效率和产品质量。
生物能源
生物燃料
利用酶促降解技术,可以将生物质转化为燃料,如乙 醇和生物柴油等,实现可再生能源的生产。
生物质转化
通过酶促降解技术,可以将生物质转化为高附加值的 化学品,如乳酸和丁醇等,实现生物经济的可持续发 展。
03
蛋白质的酶促降解过程
蛋白质的识别与结合
蛋白质的特异性识别
酶能够识别并选择性地结合特定的蛋白质底 物,这一过程依赖于酶的活性位点和底物之 间的相互作用。
蛋白质与酶的结合方式
蛋白质通过与酶的活性位点结合,形成酶底物复合物,为蛋白质的剪切提供准备。
蛋白质的剪切
蛋白质的断裂
在酶的作用下,蛋白质分子内部或分子间的特定化学键断裂,导致蛋白质被剪切成较小 的肽段或氨基酸。
酶促降解的调节因子
激素
激素可以调节酶的合成和活性,从而影响酶 促降解过程。例如,胰岛素可以促进蛋白质 降解酶的合成和活性。
蛋白质的降解

第六章蛋白质的降解及其生物学意义•第一节蛋白质降解的概述•第二节参与蛋白质降解的酶类•第三节蛋白酶体-泛素系统及其功能•第四节蛋白质降解的生物学意义蛋白质降解是生命的重要过程•维持细胞的稳态。
•清除因突变、热或氧化胁迫造成的错误折叠的蛋白质,防止形成细胞内凝集。
•及时终止不同生命时期调节蛋白的生物活性。
•蛋白质的过度降解也是有害的,蛋白质的降解必须受到空间和时间上蛋白质降解的体系•蛋白质消化分解为被机体吸收的营养物质。
•研究蛋白质结构时,用蛋白酶降解肽链。
•蛋白质新生肽链生物合成以及新生肽链折叠的过程中,质量的控制都与“次品”的降解有关。
•蛋白质在行使功能时,很多调节控制都与肽键的断裂有关,如前肽的切除、无活性的前体蛋白质的激活等。
第一节蛋白质降解的概述蛋白质的寿命•细胞内绝大多数蛋白质的降解是服从一级反应动力学。
半衰期介于几十秒到百余天,大多数是70~80d。
•哺乳动物细胞内各种蛋白质的平均周转率为 1 ~ 2d。
代谢过程中的关键酶以及处于分支点的酶寿命仅几分钟,有利于体内稳态在情况改变后快速建立。
–大鼠肝脏的鸟氨酸脱羧酶半衰期仅11min,是大鼠肝脏中降解最快的蛋白质。
–肌肉肌动蛋白和肌球蛋白的寿命约l~2w。
–血红蛋白的寿命超过一个月。
•蛋白质的半衰期并不恒定,与细胞的生理状态密切相关。
蛋白质寿命的N端规则•N端规则:细胞质中蛋白质的寿命与肽链的N端氨基酸残基的性质有一定的关系。
•N端的氨基酸残基为D、R、L、K和F的蛋白质,其半衰期只有2~3min。
•N端的氨基酸残基为A、G、M和V的蛋白质,它们在原核细胞中的半衰期可超过10h,而在真核细胞中甚至可超过20h。
酿酒酵母蛋白质代谢特点•酿酒酵母中不稳定蛋白的N端氨基酸残基有12个: Asn(B)、Asp(D)、Glu(E)、Phe(F)、His (H)、Ile(I)、Leu(L)、Lys(K)、Arg(R)、Trp(W)、Tyr(Y)和Gln(Z)。
蛋白质的降解和氨基酸的代谢

R1
R2
CHNH2 + C O
COOH COOH
转氨酶
R1 CO + COOH
R2 CHNH2 COOH
要点:
① 反应可逆。
② 体内除Lys、Pro和羟脯氨酸外,大多数氨 基酸都可进行转氨基作用。
2ADP+Pi Pi
氨甲酰磷酸
线粒体
瓜氨酸
胞液
鸟氨酸
瓜氨酸
ATP
鸟氨酸
Urea
AMP+PPi
鸟氨酸循环
精氨酸代 琥珀酸
Arg H2O
延胡索酸
-酮戊 氨基酸 二酸 Asp
-酮酸 Glu 草酰乙酸
苹果酸
鸟氨酸循环要点
① 尿素分子中的氮,一个来自氨甲酰磷酸(或游 离的NH3),另一个来自Asp;
② 每合成1分子尿素需消耗4个~P; ③ 循环中消耗的Asp可通过延胡索酸转变为草酰
• 此阶段消耗2个ATP;
2. 胞液内反应步骤
NH2 CO NH
精氨酸代琥 珀酸合成酶
NH2 COOH
C N CH 精氨酸代琥 NH CH2 珀酸裂解酶
(CH2)3 ATP+Asp
ห้องสมุดไป่ตู้
(CH2)3 COOH
CHNH2
AMP + PPi CHNH2
COOH
COOH
瓜氨酸
精氨酸代
NH2
琥珀酸
COOH CH CH COOH
尿素 NAD+ + H2O
G
G
G
• 是肌肉与肝之间氨的转运形式。
[生物学]真核生物内蛋白质的降解途径
![[生物学]真核生物内蛋白质的降解途径](https://img.taocdn.com/s3/m/c74426d3aef8941ea76e0569.png)
二、真核细胞内蛋白质的降解途径
对于哺乳动物来说,虽然细胞凋亡受多种因子 调控,但细胞凋亡的最终执行者是胱天蛋白 酶(Caspase)家族,Caspase的含义是指该 类蛋白酶的活性部位为极保守的半胱氨酸 (cysteine)及特异性切割底物的天冬氨酸 (aspase),故简称Caspase。目前已发现了 该家族的14种成员,它们以酶原的形式存在 于正常细胞中,一旦细胞凋亡启动,便被激 活,降解蛋白质,执行细胞的凋亡。
二、真核细胞内蛋白质的降解途径
2.4线粒体蛋白酶
• 线粒体基质中含有一个完整的蛋白质周转 系统,并存在一种依赖ATP的细胞器蛋白 降解途径。 • 线粒体蛋白酶系统中不含有泛素,但含有 高分子蛋白酶复合体。该复合体在与细胞 中发现的相似。 • 线粒体蛋白酶分解系统能把多肽或游离的 蛋白质亚基消化成氨基酸。
二、真核细胞内蛋白质的降解途径
溶酶体途径
胱天蛋白酶(Caspase)水解途径
胞液蛋白酶水解途径
Clapains钙蛋白酶系统
泛素-蛋白酶体途径
线粒体蛋白酶
二、真核细胞内蛋白质的降解途径
• 2.1溶酶体途径
溶酶体是真核细胞内重要 的细胞器,属于内膜系统 的组分。它内含60多种酸 性水解酶,能够分解蛋白 质、核酸、多糖及脂类等。
②泛素的转移 活化的泛素转移到泛素结合酶E2的半胱氨酸巯基上,前面我们提到过, E2的作用是将泛素分子绑在蛋白质上,但是,其本身不能特异性的识别蛋白质,所以, 需要E3的帮助。
二、真核细胞内蛋白质的降解途径
• 2.3泛素——蛋白酶体体系
2.3.3依赖泛素的蛋白酶体体系降解蛋白质的过程
(一)蛋白质的泛素化 ③泛素与蛋白质结合 E3具有特异性,可以识别出需破坏的目标蛋白质,即底物蛋白。 底物蛋白先与泛素蛋白连接酶E3结合,E3可使连接了泛素的E2和底物蛋白相互接近, 继而,泛素分子C——末端的甘氨酸残基就与目标蛋白的赖氨酸ε—氨基结合形成异肽键。 一旦有一个泛素分子结合到蛋白质上,不断重复上述过程,下一个泛素又可以连接到前 一个泛素分子48位的赖氨酸残基上。通常多于4个泛素分子,至此即完成了蛋白质的泛 素化。也就是给底物蛋白按上了标签。 (二)蛋白酶体降解蛋白质 被泛素化的蛋白质,就能够被蛋白酶体识别并被多种蛋白水解酶水解成寡肽。
蛋白质降解的生物化学机制

蛋白质降解的生物化学机制蛋白质是生物体内的重要分子,它们在维持生命活动过程中起着重要的作用。
然而,随着时间的推移,蛋白质会逐渐老化或受到外界条件的影响而失去功能,需要被降解和清除。
蛋白质的降解是细胞内的一个关键过程,它由一系列生物化学机制调控。
一、泛素-蛋白酶体系统泛素-蛋白酶体系统是蛋白质降解中最常见的途径之一。
在这个系统中,蛋白质的降解是通过一系列酶的协作完成的。
首先,目标蛋白质上的泛素分子被连接到蛋白质上,这个过程称为泛素化。
泛素化是由泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)协同完成的。
泛素连接到蛋白质上后,蛋白质被识别并被泛素连接酶(E3)转移到蛋白酶体内,随后,在蛋白酶体中,蛋白质被泛素连接酶(E3)的作用下被泛素连接酶(E1)和泛素连接酶(E2)协同降解为小肽片段。
二、蛋白酶介导的降解途径蛋白酶介导的降解途径是通过蛋白酶的活性直接降解蛋白质。
蛋白酶是一类具有特定降解蛋白质功能的酶,它能够识别特定的肽链并将其切割成较短的片段。
在这个过程中,蛋白质的三维结构发生改变,导致其失去功能并容易被蛋白酶降解。
三、自噬途径自噬是一种特殊的蛋白质降解途径,它通过细胞内的溶酶体系统将细胞内的老化或损坏的蛋白质、细胞器和其他的宏分子降解掉。
自噬通过分泌液泡来识别和包裹目标物质,随后包裹体与溶酶体融合,被消化酶降解,释放出氨基酸和其他营养物质,供细胞再利用。
四、选择性蛋白质降解途径除了以上三种主要的降解途径外,还存在一些选择性的蛋白质降解途径。
这些途径通常用于特定类型的蛋白质,如细胞周期蛋白,转录因子等特定功能蛋白质的降解。
在这些途径中,特定的酶或蛋白通过特定机制将目标蛋白质降解为较短的片段,以维持细胞中的正常功能和代谢活动。
综上所述,蛋白质降解是细胞内一系列生物化学机制的共同作用结果。
泛素-蛋白酶体系统、蛋白酶介导的降解途径、自噬和选择性蛋白质降解途径等都在不同程度上参与了蛋白质的降解和清除。
蛋白样品降解的原理是

蛋白样品降解的原理是
蛋白样品降解的原理是将蛋白质分子中的化学键分解为不同的氨基酸组成,因此可以将蛋白质分子分解为小的肽或氨基酸片段。
这种分解是通过切割蛋白质链的肽键来实现的,主要有两种方法,一种是酸性水解,另一种是酶降解。
在酸性水解中,使用酸性溶液将蛋白质分解成小的肽和氨基酸。
在酶降解中,使用适当的酶将蛋白质链切割成小的肽或氨基酸。
这些方法可以用于制备蛋白质样品,并用于质谱、电泳等生化分析方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
载体 SH
SH
或 载体
SH
然后还原
载体
PAPS
载体
还 氧
载体-S - SH
三、C架的来源
来源于糖酵解、三羧酸循环、PPP途径、 光呼吸、乙醛酸循环等途径代谢中间产物。
四、氨的同化
p270
在氮素循环中,生物固氮和硝酸盐还原 形成了无机态氨,进一步氨便被同化转变 成含氮有机化合物。生物体内有两种方式 同化氨。
⑵由于氨基酸侧链不同,每种氨基酸还有其特殊的代谢途径。
第二节 氨基酸的分解与转化
一、脱氨基作用 二、氨基酸分解产物的去向 三、脱羧基作用
一、脱氨基作用
1、氧化脱氨基作用(普遍存在于动、植物)
在有氧作用下,氨基酸进行氧化脱氨作用, 产物是α-酮酸和氨。(每消耗1分子氧,产生2分 子α-酮酸和2分子氨)。
NO2- + 7H+ + 6e- → NH3 + 2H2O 电子供体:Fd(铁氧还蛋白) NAD(P)H
二、S的来源:硫酸的还原
细 还胞原、成H藻2类S,、用高于等含植硫物氨能基吸酸收的SO合4成2-在。体动内物 中不存在。
(一)硫酸离子的活化:活化分两步:
SO42 ATP APS PPi 腺苷酰硫酸
催化转氨基作用的酶叫转氨酶或氨基转移酶,种 类繁多分布广泛。辅基均为磷酸吡哆醛(B6的磷 醛酯)
转氨作用
氨基酸1 酮酸1
酮酸2
转氨酶
氨基酸2
L 谷氨酸
酮戊二酸
草酰乙酸
谷草转氨酶
天冬氨酸
L 谷氨酸
酮戊二酸
丙酮酸 谷丙转氨酶丙氨酸源自3、联合脱氨基作用第七章 蛋白质的酶促 降解与氨基酸代谢
第七章 蛋白质的酶促降解 与氨基酸代谢
第一节 蛋白质的酶促降解 第二节 氨基酸的分解与转化 第三节 氨基酸的生物合成
第一节 蛋白质的酶促降解
一、蛋白水解酶 二、细胞内蛋白质的水解 三、蛋白质降解的意义
一、蛋白水解酶
国际生化协会命名委员会将作用于蛋白质分子 中肽键的酶归属于第三大类(水解酶类)第四 亚类,该亚类又分二个亚亚类,即蛋白酶和肽 酶(按酶的作用特点分类)。
COOH CHNH2 R
COOH -2H C=NH2+ +H2O
R
COOH C=O + NH3 R
谷氨酸 Glu脱氢酶
酮戊二酸 NH 3
H2O NAD+ NADH+H+
谷氨酸脱氢酶在动、植物体内分布广泛,且活性及专一性 很强,只对L-谷氨酸起催化作用。
2、转氨基作用
α-AA和α-酮酸之间氨基的转移作用,是氨基酸脱 去氨基的一种重要形式。
一碳基团p267
在氨基酸代谢过程中,可以分解产生具有 一个碳原子的基团,称为“一碳基团”或 “一碳单位”。
辅酶:FH4(四氢叶酸)——一碳转移过 程中起辅酶作用。
生物学意义:
(1)一碳基团的转移与许多氨基酸代谢有直接关 系。例Gly、Ser、Thr、His等都可作为一碳基团 的供体。
(2)参与嘌呤和胸腺嘧啶的生物合成 (3)参与生物体内许多活性物质的生物合成,
例:肌酸、卵磷脂、S-腺苷蛋(甲硫)氨酸 (SAM)等的生物合成,都和一碳基团的转移有 关。这些化合物中都含有活性甲基。
常见一碳基团:
甲基 -CH3 亚甲基 -CH2- 次甲基 -CH= 甲酰基 –CHO 羟甲基 -CH2OH 亚氨甲基 -CH=NH
1、谷氨酸合成途径
(1)谷氨酰胺合成酶和谷氨酸合酶催化合成,现有试验证 明,谷氨酸的合成,主要通过这条双酶途径催化的。
谷氨酸 NH 3 谷氨酰胺合成酶 谷氨酰胺 ATP ADP
谷氨酰胺 酮戊二酸 谷氨酸合酶 2谷氨酸
(2)非主要途径
NADPH+H + NADP+
酮戊二酸 NH 3 谷氨酸脱氢酶 谷氨酸 H 2O
一、氨的来源
植物:生物固氮 、NO3--N还原、含N有机物 分解
动物:主要来源是AA的脱氨基作用,此外嘌 呤嘧啶的分解也生成氨。
(一)、生物固氮
1、固氮微生物把N2→NH3的过程。
固氮反应
N 16 ATP 8e 10 H 固氮酶 2 NH H 16 ADP Pi
2、泛素化蛋白的降解 泛素化蛋白水解在26S蛋白酶体中完成。蛋白酶体是一 种存在于细胞质中的多亚基蛋白,目标蛋白被水解产生约 7-9个氨基酸残基的肽段,然后再被细胞质中的肽链外切 酶水解为氨基酸。
三、蛋白质降解的意义
1、形成新组织:用于新蛋白质的合成,进 行新陈代谢(自我更新)。
2、参加其它代谢:进一步降解氧化或转化 成他物质。
(二)NO3--N还原
植物体所需要的氮素营养除了生物固氮外, 绝大部分来自土壤中的氮素,主要是植物 吸收土壤中的NO3-在硝酸还原酶和亚硝酸 还原酶的作用形成氨。
2e-
6e-
NO3-
NO2-
NH4+
硝酸还原酶
亚硝酸还原酶
1、硝酸还原酶
诱导酶,环境中须有NO3-,需光照条件。
根据反应中电子供体不同又分为:
肽键。 羧肽酶B:水解由赖氨酸、精氨酸等碱性氨基
酸为羧基末端构成的肽键。 2、氨肽酶: 水解氨基末端的肽键。 3、二肽酶: 水解二肽→氨基酸
氨肽酶
胃蛋白酶
胰凝乳蛋白酶
胰蛋白酶
H2N CH CO HN CH CO NH CH CO NH CH NH CO
R1
R2
CH2
(CH2)3
羧肽酶
NH CH CO NH CH COOH R3
谷氨酰胺酶 谷氨酰胺酶
谷氨酸
H2O
NH3
天冬酰胺 天冬酰胺酶 天冬氨酸
H2O
NH3
二、氨基酸分解产物的去向
(一)NH3的去路 1、重新形成氨基酸 2、形成酰胺(消除NH3毒害,贮存NH3)
生成Gln和Asn,一方面是生物体贮藏和运输氨 的主要形式,也是解除氨毒害的最主要途径。 3、生成铵盐,保持细胞pH 4、生成尿素
①铁氧还蛋白——硝酸还原酶
NO 3
2Fd 还原态 2H
NO 2
2 Fd
氧化态
H
O 2
②NAD(P)H—硝酸还原酶
NO3
NADPH
H
NO2
NADP
H
2O
2、亚硝酸还原酶
正常情况下,NO2-在植物细胞内很少积累,很 快在亚硝酸还原酶催化下,进一步还原成氨。
NADPH+H + NADP+
2、氨甲酰磷酸的形成
有二种酶能催化 NH3、CO2、ATP共同合成氨 甲酰磷酸
4、尿素循环
在哺乳动物体内,氨的主要去路是在肝脏中合成
尿素并随尿排出体外。在部分植物体内尿素的形 成既能解除氨毒,又是氨的一种贮存形式。
NH3 CO2
ATP 氨甲酰磷酸
Pi Cit
ASP 延胡索酸
Orn
Arg
尿素
(二)α-酮酸的代谢去路(C架的去路)
1、转化为丙酮酸 2、转化为草酰乙酸 3、转化为α-酮戊二酸 4、转化为琥珀酰CoA 5、降解为乙酰CoA和乙酰乙酸 6、降解为延胡索酸和乙酰乙酸 7、提供一碳单位 一碳基团、生糖氨基酸、生酮氨基酸 p269
三、脱羧基作用
1、直接脱羧基作用
氨基酸在脱羧酶作用下,进行脱羧反应生成胺类 化合物,脱羧酶辅酶为磷酸吡哆醛。
广泛存在于动、植、微生物中
脱羧酶
R CH COOH
R CH 2 NH2 + CO2
NH2
胺
Lys
尸胺 +CO 2
Arg
腐胺 +CO2
Ser
乙醇胺 +CO2
2、羟化脱羧基作用
Tyr在Tyr酶催化下发生羟化作用生成3,4-二羟 苯丙氨酸(多巴),后者进一步脱羧生成3,4- 二羟苯乙胺(多巴胺)。
多巴进一步氧化后形成聚合物黑素。
马铃薯、苹果、梨、切开长时间暴露空气 变黑,形成黑色素。
人体的表皮基底层及毛囊中有成黑素细胞, 可将酪氨酸转变为黑素,使皮肤毛发呈黑 色(可吸收紫外光)。白化病人:缺酪氨 酸酶。
第三节 氨基酸的生物合成
一、氨的来源 二、S的来源:硫酸的还原 三、C架的来源 四、氨的同化 五、氨基酸的合成
泛素是一类小分子单体蛋白,含有76个氨基酸残基, 保守性很强,因广泛存在于真核细胞而得名。
二、细胞内蛋白质的水解
(二)、泛素途经过程
1、目标蛋白的泛素化标记 泛素对目标蛋白的靶向 标记由3个酶催化完成: 泛肽活化酶(E1) 泛素携带蛋白(E2) 泛素-蛋白连接酶(E3)
二、细胞内蛋白质的水解
(二)、泛素途经
或Tyr
CH2
NH 2或Ayr
胃蛋白酶:芳香族aa-NH2形成的肽键。 胰蛋白酶:Lys或Arg-COOH形成的肽键(碱性,高度专一);Pro
抑制水解。
胰凝乳蛋白酶:芳香族aa-COOH形成的肽键, Leu、Met、His水解 速度次之。Pro抑制水解。
嗜盐菌蛋白酶:疏水性强的残基(Leu、Ile、Phe、Trp、Val、Tyr、 Met);Pro或Gly不水解。
③ 单向性氢酶:催化 H2 [O] H2O 需ATP,KCN抑制。
生物固氮的意义
意义:有益于生物固氮 ① H2氧化生成ATP,用于固氮。 ② 吸氢酶催化的羟化反应消耗大量O2,从而
保护固氮酶系统免受O2的破坏 ③ 吸 抑氢制酶防止H2的积累,避免H2对固氮酶的 ④ H2的利用可间接产生还原力。
