小分子P13K/mTOR双重抑制剂研究进展
如何选择关键靶点PI3K、AKT和mTOR的抑制剂?针对癌症中的PI3K AKT信号通路

如何选择关键靶点PI3K、AKT和mTOR的抑制剂?针对癌症中的PI3K / AKT信号通路-07-23 订阅号APExBIOPI3K / AKT信号通路的异常激活会导致癌症的发展。
PI3K家族分为四类:I类,II类,III类和IV类。
I类可以进一步分为IA和IB类。
本文主要介绍IA类PI3K。
IA类PI3K是由调节性p85亚基和催化性p110亚基组成的异二聚体。
前者由PIK3R1(p85α,p55α和p50α)和PIK3R2(p85β)基因编码,后者由PIK3CA(p110α),PIK3CB(p110β)和PIK3CD (p110δ)编码。
PI3K的信号传导是在细胞表面受体激活时触发的。
p85与活化的受体酪氨酸激酶(RTK)或相关的衔接蛋白的结合激活催化亚基并使其更接近质膜。
在那里,p110磷酸化磷脂酰肌醇4,5-二磷酸(PIP2,质膜的次要组分)以产生磷脂酰肌醇3,4,5-三磷酸(PIP3),其作为激活各种效应蛋白(包括AKT)的第二信使。
AKT的活化是通过3-磷酸肌醇依赖性蛋白激酶-1(PDK1)和mTOR复合物2(TORC2)的磷酸化完成的。
反过来,AKT的激活导致TORC1的激活,AKT和TORC1均调节促进细胞的存活、生长和增殖等途径。
另外,p110α和p110δ可以被Ras(GTP酶转换蛋白)进一步激活,Ras不与p110β结合。
Rac和Cdc42蛋白有助于激活p110β以响应G蛋白偶联受体(GPCR)激活。
TORC1信号传导还充当负反馈调节机制以抑制来自RTK的信号传导。
最后,肿瘤抑制因子PTEN使PIP3去磷酸化并返回PIP2(图1)。
图1 PI3K(IA类) / AKT信号通路的激活(此图列出了多种抑制剂,不知如何选择抑制剂的可作为参考)图2 PI3K(IA 类) / AKT信号通路的药理学抑制。
PI3K通路可以在多个节点上被药理学抑制,包括pan-PI3K和同种型特异性抑制剂,只靶向TORC1或同时靶向TORC1和TORC2的mTOR抑制剂以及AKT抑制剂,这些抑制剂可以直接抑制PI3K活性。
自噬在肝细胞癌治疗中的研究进展

自噬在肝细胞癌治疗中的研究进展1㊀210002㊀东部战区总医院秦淮医疗区全军肝病中心2㊀通讯作者,E⁃mail:leep2002@163.com571100㊀海南海口㊀海南现代妇女儿童医院检验科王华强,李㊀平1,2㊀㊀ʌ摘㊀要ɔ㊀自噬是细胞在自噬相关基因的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程㊂自噬对肝细胞癌的发生㊁发展具有双重作用,既能通过维持肝脏稳态清除癌细胞,又能促进肿瘤微环境中癌细胞增殖㊂目前研究发现针对肝细胞癌治疗的传统化疗药物㊁分子靶向药物㊁RNA干扰和天然药物等均与自噬关系密切㊂大部分情况下抑制自噬可增强药物抗肝癌的活性,也有药物可直接激活自噬依赖性性癌细胞死亡㊂本文结合近年国内外研究现状,就自噬与肝细胞癌发生发展的关系和自噬调控肝细胞癌治疗的作用作一综述,以期为肝细胞癌的治疗提供新思路㊂㊀㊀ʌ关键词ɔ㊀肝细胞癌;㊀自噬;㊀机制;㊀治疗中图分类号:R735 7㊀㊀文献标识码:A㊀㊀文章编号:1009⁃0460(2021)01⁃0089⁃05Researchprogressofautophagyinthetreatmentofhepatocellularcarcinoma㊀㊀WANGHuaqiang,LIPing.DepartmentofClinicalLaboratory,HainanModernWomenandChildrenHospital,Haikou571100,ChinaCorrespondingauthor:LIPing,E⁃mail:leep2002@163.com㊀㊀ʌAbstractɔ㊀Autophagyisaprocessinwhichcellsuselysosomestodegradetheirdamagedorganellesandmacromoleculesunderthecontrolofautophagy⁃relatedgenes.Autophagyhasadualeffectontheoccurrenceanddevelopmentofhepatocellularcarcinoma.Itcannotonlymaintainthesteadystateoftheliverbyeliminatecancercells,butalsopromotetheproliferationofcancercellsinthetumormicroenvironment.Thecurrentresearchfoundthattraditionalchemotherapydrugs,moleculartargeteddrugs,RNAinterferenceandnaturaldrugsforthetreatmentofhepatocellularcarcinomaarecloselyrelatedtoautophagy.Inmostcases,inhibitionofautophagycanenhancetheactivityofdrugsagainstlivercancer,andsomedrugscandirectlyactivatingautophagy⁃dependentcancercelldeath.Inthisarticle,wewillreviewtherelationshipbetweenautophagyandtheoccurrenceanddevelopmentofhepatocellularcarcinoma,andtheroleofautophagyinregulatingthetreatmentofhepatocellularcarcinomainordertoprovidenewideasforthetreatmentofhepatocellularcarcinoma.㊀㊀ʌKeyWordsɔ㊀Hepatocellularcarcinoma;㊀Autophagy;㊀Mechanism;㊀Therapy㊀㊀在全球范围内,肝癌是导致癌症相关死亡的第四大常见原因,在发病率方面排第6位㊂肝癌以肝细胞肝癌(hepatocellularcarcinoma,HCC)为主,尽管近年HCC的内科治疗和外科手术方面取得了很多突破,但5年生存率仅为18%,仅次于胰腺癌的第二大致死性肿瘤[1]㊂近年来大量研究表明,自噬可以对HCC产生促进或抑制的双向调节,调控自噬可影响HCC的治疗㊂本文总结了自噬与HCC发生发展的关系以及近年自噬调控HCC治疗的相关研究,通过全面了解自噬在HCC中的作用,以期为HCC的治疗提供新思路㊂1㊀自噬对HCC发生发展的双向影响1 1㊀自噬与肿瘤发生相关㊀自噬又称Ⅱ型细胞死亡,是细胞在自噬相关基因的调控下将自身受损的细胞器和大分子物质运输到溶酶体进行消化降解的过程[2]㊂自噬在肿瘤发生发展中所扮演的角色具有促进和抑制双面作用㊂在正常情况下,细胞自噬是一种抵抗癌变的途径,自噬可以控制炎症反应㊁清除损伤坏死的细胞器㊁降低细胞内压力㊁稳定细胞基因组㊁阻止癌细胞恶变,并可以通过介导细胞凋亡和免疫反应清除癌变细胞㊂另一方面,细胞一旦发生癌变,自噬反而会扮演促进肿瘤的角色,自噬可维持肿瘤细胞稳定,为肿瘤细胞提供营养物质及能量,增强肿瘤细胞放化疗抗性等[3]㊂这种双重作用说明了自噬在肿瘤发生发展中的复杂性,深入了解自噬的调控作用,对于探索肿瘤发生机制并开拓新的治疗途径具有重要意义㊂1 2㊀细胞自噬抑制HCC㊀细胞自噬有利于维持肝脏的代谢稳态,一旦自噬缺陷可导致肝脏肿瘤发生㊂自噬相关基因(autophagy⁃relatedgene,ATG)参与自噬的调控,其中ATG5和ATG7在肝脏高表达,Atg5-/-和Atg7-/-基因敲除的小鼠会发生肝脏肿瘤,通过对Atg5flox/flox杂合小鼠的肝脏肿瘤分析发现,肿瘤源自于那些Atg5自噬基因缺失的肝细胞[4]㊂Be⁃clin1基因是酵母ATG6的同系物,是哺乳动物参与自噬的特异性基因,在HCC组织中Beclin1的表达显著低于癌旁组织,且Beclin1的表达与HCC病理分级呈负相关[5]㊂自噬抑制HCC还表现为增强自噬可直接诱导肿瘤细胞自噬性死亡㊂Yu等[6]合成了一种化合物,可通过抑制AKT信号而激活自噬,在体外实验中表现为HepG2㊁Hep3B㊁Huh⁃7和SMMC⁃77214种肝癌细胞的增殖均被显著抑制;而在动物实验中,随着自噬的增强,裸鼠肝脏肿瘤的体积和重量均出现明显下降㊂1 3㊀细胞自噬促进HCC㊀自噬是细胞的一种应激反应和生存机制,其可能更有助于HCC细胞能适应外界的一系列应激压力,从而增强HCC细胞的增殖㊁转移能力和对治疗的抵抗㊂自噬和HCC发生相关,研究发现二乙基亚硝胺可诱导小鼠发生HCC,但在自噬受损小鼠中却无法发生HCC,只能诱导出良性肿瘤[7]㊂自噬还在HCC的发展中扮演重要角色㊂在肝癌病程的进展中,自噬体的重要标志分子LC3⁃Ⅱ的表达水平不断增加,而同时高表达LC3⁃Ⅱ和自噬起始分子ULK1的患者具有较差的5年生存率和无进展生存率[8]㊂对于自噬的促癌作用,有研究认为自噬调节是肝癌发生的一个非常早期的事件,并且仅针对最具侵袭性的肝细胞亚群具有特异性㊂他们使用自噬诱导剂胺碘酮可显著促进肝脏癌前病变细胞的增殖能力,而使用自噬抑制剂氯喹可显著抑制肝脏癌前病变细胞的生长[9]㊂关于自噬促进肿瘤转移的分子机制,有研究认为可能和自噬激活Wnt/β⁃catenin信号通路,从而上调HCC细胞中的致癌基因单羧酸转运蛋白1(MCT1)的表达有关[10]㊂2㊀自噬与HCC治疗2 1㊀常规化疗药物㊀化疗是HCC系统治疗方案之一,通过直接杀伤和诱导凋亡等途径抑制肿瘤细胞的增殖和转移,但HCC经过多次化疗后,治疗效果往往会出现下降,而这一现象和化疗药物上调肿瘤细胞的自噬有关㊂Du等[11]发现奥沙利铂在抑制HCC细胞增殖的同时也上调了HCC细胞的自噬,当联合使用ATG7siRNA干扰或氯喹预处理抑制HCC自噬后,奥沙利铂诱导的HCC细胞凋亡活性可分别上升23%和9%,而单独使用ATG7siRNA干扰或氯喹预处理却不能诱导HCC的凋亡㊂Guo等[12]的研究发现,顺铂和5⁃氟尿嘧啶(5⁃FU)在SMMC⁃7721㊁Hep3B和HepG23种不同HCC细胞系中均可增加自噬小体的形成,使用3⁃甲基腺嘌呤(3⁃MA)或siRNA抑制自噬后可明显增强顺铂和5⁃FU的化疗效果;在动物实验中,联合自噬抑制剂组较单用顺铂组的裸鼠肝脏肿瘤平均重量减少了28 57%,体积减小33 4%㊂Tong等[13]研究发现培美曲塞耐药也与自噬有关,抑制自噬相关MEK/ERK信号通路可增强培美曲塞对HCC细胞的化学毒性㊂有研究发现,在自噬诱导HCC对表柔比星产生化学耐药性的过程中,热休克转录因子1(HSF1)通过上调ATG4B活性促进HCC自噬,加入RNAi干扰HSF1后可抑制HCC细胞自噬,增强表柔比星的化疗效果[14]㊂这些研究均表明自噬可诱导HCC细胞对化疗药物产生抗性,干扰自噬是增强HCC化疗敏感性的潜在方法㊂2 2㊀靶向小分子㊀目前大部分研究认为,靶向药物在治疗过程中可诱导HCC自噬从而导致耐药,抑制自噬活性可增强靶向药物抗HCC的作用㊂索拉非尼是首个经美国食品药品管理局(FDA)批准用于治疗HCC的酪氨酸激酶抑制剂(TKI)㊂关于索拉非尼诱导自噬耐药的机制已有一系列研究,通过调控相应通路抑制自噬活性可增强索拉非尼的靶向效果㊂Liu等[15]认为索拉非尼耐药和细胞内质网应激引起的自噬有关,通过siRNA干扰凋亡抑制蛋白cFLIP后可降低内质网应激,减少HCC细胞自噬,逆转索拉非尼的耐药性㊂Lu等[16]研究发现,肝癌组织中细胞表面分子CD24的高表达和索拉非尼耐药密切相关,他们利用shRNA干扰CD24表达后,可激活mTOR/AKT信号通路而抑制HCC自噬,提高索拉非尼的敏感性㊂Turcios等[17]合成了2,5⁃二氯⁃N⁃(2⁃甲基⁃4⁃硝基苯基)苯磺酰胺(别名FH535),利用FH535及其衍生物(FH535⁃N)均可抑制Wnt/β⁃catenin信号通路,降低HCC细胞自噬,进而增强索拉非尼对HCC细胞的靶向抑制作用㊂除了使用RNA干扰和合成化合物阻滞自噬外,国内学者发现[18]中药单体20(S)⁃人参皂苷(Rg3)也可调控自噬增加靶向药物的作用,他们发现索拉非尼联合Rg3后LC3⁃Ⅱ水平明显上调,而不同浓度(0 5μg/ml㊁1μg/ml和2μg/ml)索拉非尼联合Rg3对Hep3B细胞抑制作用均表现为协同增强作用,他们认为Rg3可增加索拉非尼的敏感性,其机制可能是通过抑制HCC细胞自噬活性来实现的㊂也有一些研究与这些报道相反,他们认为增强自噬可诱导HCC细胞发生自噬依赖性细胞死亡,增强靶向药物的效果㊂AZD4547是一种成纤维细胞生长因子受体(FGFR)抑制剂,在索拉非尼耐药HCC细胞中,AZD4547联合索拉非尼可增加LC3㊁Beclin1蛋白水平,降低p62蛋白水平,通过增强自噬水平促进耐药HCC发生自噬依赖性细胞死亡[19]㊂瑞戈非尼是继索拉非尼后另一个多靶点TKI药物,除了直接诱导HCC细胞凋亡外,还可以通过抑制mTOR/AKT信号,促使HCC细胞发生自噬依赖性细胞死亡[20]㊂增强自噬促进HCC细胞死亡这一现象可能是由于这些研究中的自噬活性更强,将肿瘤细胞保护性自噬转变为诱导细胞死亡的途径㊂2 3㊀非编码RNA㊀非编码RNA(ncRNA)与自噬关系密切,其中微小RNA(miRNA)和长链非编码RNA(lncRNA)在HCC中经常失调,近年引起了较多的关注和研究㊂大部分报道认为miRNA通过抑制自噬具有抗肿瘤活性㊂Fu等[21]研究发现,miR⁃30a靶向自噬相关蛋白Beclin1和ATG5mRNA的3 ⁃UTR抑制其翻译,通过下调自噬抑制HCC细胞的生长和转移;他们还通过对52例HCC患者的研究发现,miR⁃30a在肿瘤组织中显著低表达,并且与微血管转移㊁肿瘤复发呈负相关,miR⁃30a低表达患者具有更差的生存期㊂Ou等[22]发现miR⁃490⁃3p在HCC组织中低表达,其过表达可靶向ATG7下调癌细胞自噬,从而抑制HCC细胞增殖㊁延迟细胞周期并促进细胞凋亡㊂Jin等[23]发现阿霉素诱导的HCC细胞自噬降低了miR⁃26水平,而miR⁃26通过靶向自噬蛋白ULK1下调自噬,可抑制HCC细胞增殖并促进凋亡;动物实验表明,miR⁃26或阿霉素均可降低裸鼠移植肝脏肿瘤的体积和重量,当miR⁃26与阿霉素联合使用时,miR⁃26可进一步增强HCC对阿霉素的治疗敏感性㊂Ren等[24]研究发现跨膜蛋白166(EVA1A)通过上调自噬促进HCC对奥沙利铂耐药,而miR⁃125b可与EVA1AmRNA的3 ⁃UTR结合,通过下调EVA1A的翻译抑制自噬活性,提高了HCC对奥沙利铂的敏感性㊂也有一些研究有不同结论,他们认为miRNA抑制自噬后反而起促癌作用㊂Yang等[25]研究发现,miR⁃181a可以通过靶向ATG5抑制HCC的自噬,导致HCC细胞凋亡减少,当使用miR⁃181a⁃sponge干扰后,HCC肿瘤的体积和重量明显下降㊂Zhuang等[26]研究也发现,甘氨酸脱羧酶(GLDC)是miR⁃30d⁃5p的靶标,miR⁃30d⁃5p可下调GLDC活性,减少细胞自噬反而促进HCC的增殖,干扰miR⁃30d⁃5p可抑制HCC进的展㊂LncRNA激活自噬后在HCC中同样具有双向调节作用,但大部分研究认为lLncRNA会增强自噬促进HCC发展㊂LncRNAHULC是第一个在肝癌中鉴定的lncRNA,在肝癌组织中高表达㊂研究表明lncRNAHULC可通过下调miR15a来增加自噬相关基因p62㊁LC3和Becline⁃1的表达,激活自噬促进肝癌细胞增殖[27]㊂LncRNAHOTAIR是第一个被发现具有反式作用的lncRNA,在多种肿瘤中表达上调且与不良预后相关㊂在肝癌中,lncRNAHOTAIR可通过增加ATG3和ATG7表达来激活自噬,进而促进HCC细胞增殖[28]㊂另有一些lncRNA,如PVT1㊁HAGLROS等均可通过靶向miRNA而促进自噬,参与HCC细胞增殖[29⁃30]㊂也有一些研究认为lncRNA虽然增强自噬活性,但可诱导HCC细胞发生自噬依赖性细胞死亡㊂Chen等[31]研究发现lncRNAPTENP1调控抑癌基因PTEN,过表达的PTENP1可与miRNA17㊁miRNA19b和miRNA20A相互作用,抑制PI3K/Akt致癌信号途径,引发HCC细胞发生自噬依赖性细胞死亡㊂Cui等[32]报道lncRNAH19在不同肿瘤中可通过不同的途径发挥致癌或抑癌的生物学功能,在肝癌中可激活HCC细胞中的PI3K⁃Akt⁃mTOR途径,增加自噬,诱导缺氧/复氧损伤,促使肝癌细胞死亡㊂2 4㊀天然药物㊀已发现多种天然药物可调节自噬,大部分天然药物抗HCC的机制是直接诱导HCC细胞发生自噬依赖性死亡㊂黄当归醇(xanthoangelol,XGA)来自中药当归,可通过诱导自噬发挥抗HCC转移的作用,该自噬是由AMPK/mTOR信号通路的激活介导,因此使用3⁃MA抑制自噬后反而拮抗XAG的抗肿瘤作用[33]㊂槐耳颗粒是证据等级较高的可用于肝癌辅助治疗的药物,槐耳的抗肿瘤机制可能与抑制Akt/mTOR通路诱导自噬有关,自噬抑制剂3⁃MA可减少槐耳处理组的自噬,降低槐耳抗肿瘤活性[34]㊂石蒜碱(Ly⁃corine,LCC)是一种多功能的生物活性化合物,其诱导HCC细胞自噬性死亡和舌癌耐药相关基因(TCRP1)表达下调有关,而TCRP1可以降低Akt的磷酸化水平并抑制Akt/mTOR通路,因此LCC可能是通过抑制TCRP1/Akt/mTOR信号通路促进肝癌细胞自噬性死亡[35]㊂另有研究报道小檗碱㊁大蒜素㊁苦参碱㊁甘草次酸㊁蜜环菌素㊁甘草甜素㊁β⁃桧木醇㊁没食子鞣质这些天然植物来源的药物,均可通过诱导肿瘤细胞自噬性死亡而具有抗HCC作用[36⁃37]㊂也有一些研究认为部分天然药物的抗HCC作用是通过抑制自噬活性而产生的㊂一种新型姜黄素衍生物WZ35在胃癌细胞中表现出潜在的抗肿瘤活性,WZ35同样具有抗HCC活性,其作用机制是通过下调YAP介导的自噬活性来抑制肝癌细胞的生长[38]㊂另一方面,在抑制自噬后,部分天然药物的抗HCC作用进一步增强㊂来自蟾蜍毒液的蟾蜍灵可抑制HCC的增殖并促进凋亡,使用自噬抑制剂3⁃MA或氯喹后,可进一步增强蟾蜍灵的抗HCC作用[39]㊂棉酚是一种黄色多酚羟基双萘醛类化合物,主要通过激活细胞凋亡表现出抗HCC的活性㊂由于棉酚诱导的自噬可以保护HCC细胞免受内质网应激相关凋亡的影响,因此棉酚和自噬抑制剂的联用可显著增强抗HCC作用[40]㊂近年报道芹菜素㊁甘草查尔酮A和18β⁃甘草次酸等天然药物都具有抗HCC作用,但同时因诱导自噬而产生耐药,联合使用自噬抑制剂后,可明显提高抗HCC治疗效果[41⁃43]㊂2 5㊀其他治疗㊀其他抗HCC的治疗研究也主要集中于两个方面:抑制自噬增强抗肿瘤活性,或者直接增强自噬诱导HCC细胞死亡㊂Liu等[44]报道,全长肿瘤抑素的活性片段T7肽在抗肿瘤过程中可通过抑制Akt/mTOR信号通路诱导自噬激活,联合自噬抑制剂3⁃MA可显著增强T7肽的抗HCC作用㊂Xu等[45]研究发现,HCC经射频消融治疗后容易出现复发,这与残留癌细胞通过HIF⁃1α/BNIP3途径激活自噬有关,他们针对BNIP3设计靶向抑制剂来下调自噬后,可有效阻止残留HCC细胞的生长和转移㊂也有一些研究发现增强自噬可发生自噬相关细胞死亡,Li等[46]报道IL⁃37除了抗炎细胞因子外,还具有抗HCC作用,其通过抑制PI3K/Akt/mTOR信号通路上调细胞自噬活性,诱导HCC发生自噬依赖性细胞死亡㊂Huang等[47]报道阿司匹林也具有抗肿瘤作用,可通过激活JNK㊁AMPK和GSK⁃3等信号通路上调ULK1㊁Beclin⁃1等自噬相关蛋白活性,诱导HCC细胞发生自噬相关死亡㊂3㊀小结与展望传统观念认为自噬给肿瘤细胞提供营养物质及能量,自噬是促癌因素,抑制自噬可增强药物抗肿瘤的活性㊂然而越来越多研究表明,自噬也可诱导肿瘤细胞发生自噬依赖性细胞死亡㊂自噬在HCC中具有双重作用,既能通过维持细胞稳态清除癌细胞,又能促进肿瘤微环境中癌细胞的存活㊂随着对自噬的认识不断深入,针对HCC治疗的传统化疗药物㊁分子靶向药物㊁RNA干扰和天然药物等均发现与自噬关系密切㊂了解HCC不同阶段自噬作用的具体分子机制仍然是一个挑战,这种深入研究将更有助于抗HCC的治疗㊂参考文献[1]㊀VillanuevaA.HepatocellularCarcinoma[J].NEnglJMed,2019,380(15):1450-1462.[2]㊀LevineB,KroemerG.Biologicalfunctionsofautophagygenes:Adiseaseperspective[J].Cell,2019,176(1⁃2):11-42.[3]㊀陈品珍,杨丁丁,陈兴宇,等.自噬基因Beclin1对乳腺癌作用的研究进展[J].临床肿瘤学杂志,2019,24(1):87-91.[4]㊀YangH,NiHM,DingWX.Emergingplayersinautophagydefi⁃ciency⁃inducedliverinjuryandtumorigenesis[J].GeneExpr,2019,19(3):229-234.[5]㊀SunH,YuJ,WenZ,etal.DecreasedexpressionofBeclin⁃1inpatientswithhepatocellularcarcinoma[J].JBUON,2019,24(2):634-641.[6]㊀YuM,ZengM,PanZ,etal.Discoveryofnovelakt1inhibitorinducesautophagyassociateddeathinhepatocellularcarcinomacells[J].EurJMedChem,2020,189:112076.[7]㊀TianY,KuoCF,SirD,etal.Autophagyinhibitsoxidativestressandtumorsuppressorstoexertitsdualeffectonhepatocarcino⁃genesis[J].CellDeathDiffer,2015,22(6):1025-1034.[8]㊀WuDH,WangTT,RuanDY,etal.CombinationofULK1andLC3Bimproveprognosisassessmentofhepatocellularcarcinoma[J].BiomedPharmacother,2018,97:195-202.[9]㊀KowalikMA,PerraA,Ledda⁃ColumbanoGM,etal.Inductionofautophagypromotesthegrowthofearlypreneoplasticratlivernodules[J].Oncotarget,2016,7(5):5788-5799.[10]㊀FanQ,YangL,ZhangX,etal.AutophagypromotesmetastasisandglycolysisbyupregulatingMCT1expressionandWnt/β⁃cate⁃ninsignalingpathwayactivationinhepatocellularcarcinomacells[J].JExpClinCancerRes,2018,37(1):9.[11]㊀DuH,YangW,ChenL,etal.Roleofautophagyinresistancetooxaliplatininhepatocellularcarcinomacells[J].OncolRep,2012,27(1):143-150.[12]㊀GuoXL,LiD,HuF,etal.Targetingautophagypotentiateschemotherapy⁃inducedapoptosisandproliferationinhibitioninhepatocarcinomacells[J].CancerLett,2012,320(2):171-179.[13]㊀TongY,HuangH,PanH.InhibitionofMEK/ERKactivationattenuatesautophagyandpotentiatespemetrexed⁃inducedactivityagainstHepG2hepatocellularcarcinomacells[J].BiochemBio⁃physResCommun,2015,456(1):86-91.[14]㊀ZhangN,WuY,LyuX,etal.HSF1upregulatesATG4Bex⁃pressionandenhancesepirubicin⁃inducedprotectiveautophagyinhepatocellularcarcinomacells[J].CancerLett,2017,409:81-90.[15]㊀LiuD,FanY,LiJ,etal.InhibitionofcFLIPovercomesac⁃quiredresistancetosorafenibviareducingERstress⁃relatedauto⁃phagyinhepatocellularcarcinoma[J].OncolRep,2018,40(4):2206-2214.[16]㊀LuS,YaoY,XuG,etal.CD24regulatessorafenibresistanceviaactivatingautophagyinhepatocellularcarcinoma[J].CellDeathDis,2018,9(6):646.[17]㊀TurciosL,ChaconE,GarciaC,etal.AutophagicfluxmodulationbyWnt/β⁃cateninpathwayinhibitioninhepatocellularcarcinoma[J/OL].PLoSOne,2019[2020⁃07⁃20].https://pubmed.ncbi.nlm.nih.gov/30794613/.[18]㊀郑㊀侠,华海清,杨爱珍,等.20(S)⁃人参皂苷Rg3对肝癌细胞自噬介导的索拉非尼敏感性的影响[J].临床肿瘤学杂志,2016,21(4):297-303.[19]㊀冯㊀云,亢君君,方宗平,等.AZD4547促进自噬并促进索拉非尼耐药肝癌细胞的死亡[J].细胞与分子免疫学杂志,2019,35(4):339-343.[20]㊀HanR,LiS.Regorafenibdelaystheproliferationofhepatocellularcarcinomabyinducingautophagy[J].Pharmazie,2018,73(4):218-222.[21]㊀FuXT,ShiYH,ZhouJ,etal.MicroRNA⁃30asuppressesauto⁃phagy⁃mediatedanoikisresistanceandmetastasisinhepatocellularcarcinoma[J].CancerLett,2018,412:108-117.[22]㊀OuY,HeJ,LiuY.MiR⁃490⁃3pinhibitsautophagyviatargetingATG7inhepatocellularcarcinoma[J].IUBMBLife,2018,70(6):468-478.[23]㊀JinF,WangY,LiM,etal.MiR⁃26enhanceschemosensitivityandpromotesapoptosisofhepatocellularcarcinomacellsthroughinhibitingautophagy[J/OL].CellDeathDis,2017[2020-07-16] https://pubmed.ncbi.nlm.nih.gov/30794613/.[24]㊀RenWW,LiDD,ChenX,etal.MicroRNA⁃125breversesox⁃aliplatinresistanceinhepatocellularcarcinomabynegativelyreg⁃ulatingEVA1Amediatedautophagy[J].CellDeathDis,2018,9(5):547.[25]㊀YangJ,HeY,ZhaiN,etal.MicroRNA⁃181ainhibitsautophagybytargetingAtg5inhepatocellularcarcinoma[J].FrontBiosci(LandmarkEd),2018,23:388-396.[26]㊀ZhuangH,WuF,WeiW,etal.GlycinedecarboxylaseinducesautophagyandisdownregulatedbymiRNA⁃30d⁃5pinhepatocel⁃lularcarcinoma[J].CellDeathDis,2019,10(3):192.[27]㊀崔大炜,邢育柏,金宏远,等.肝癌高表达长链非编码RNA在肝癌中的表达及其对自噬水平的影响[J].中国医科大学学报,2019,48(11):970-974.[28]㊀YangL,ZhangX,LiH,etal.ThelongnoncodingRNAHO⁃TAIRactivatesautophagybyupregulatingATG3andATG7inhepatocellularcarcinoma[J].MolBiosyst,2016,12(8):2605-2612.[29]㊀YangL,PengX,JinH,etal.Longnon⁃codingRNAPVT1pro⁃motesautophagyasceRNAtotargetATG3byspongingmicroRNA⁃365inhepatocellularcarcinoma[J].Gene,2019,697:94-102.[30]㊀WeiH,HuJ,PuJ,etal.LongnoncodingRNAHAGLROSpro⁃motescellproliferation,inhibitsapoptosisandenhancesautophagyviaregulatingmiR⁃5095/ATG12axisinhepatocellularcarcinomacells[J].IntImmunopharmacol,2019,73:72-80.[31]㊀ChenCL,TsengYW,WuJC,etal.Suppressionofhepatocellularcarcinomabybaculovirus⁃mediatedexpressionoflongnon⁃codingRNAPTENP1andMicroRNAregulation[J].Biomaterials,2015,44:71-81.[32]㊀CuiC,LiZ,WuD.Thelongnon⁃codingRNAH19induceshy⁃poxia/reoxygenationinjurybyup⁃regulatingautophagyinthehep⁃atomacarcinomacells[J].BiolRes,2019,52(1):32.[33]㊀YangX,XieJ,LiuX,etal.Autophagyinductionbyxanthoan⁃gelolexhibitsanti⁃metastaticactivitiesinhepatocellularcarcinoma[J].CellBiochemFunct,2019,37(3):128-138.[34]㊀黎文信,王喜城,向美焕,等.槐耳通过诱导自噬抑制肝癌细胞增殖与迁移[J].中华肝脏外科手术学电子杂志,2019,8(2):169-174.[35]㊀YuH,QiuY,PangX,etal.LycorinePromotesAutophagyandApoptosisviaTCRP1/Akt/mTORAxisInactivationinHumanHepatocellularCarcinoma[J].MolCancerTher,2017,16(12):2711-2723.[36]㊀李㊀霄,张㊀玄,张卓超,等.甘草甜素体外诱导肝癌细胞MHCC97⁃H自噬性死亡的实验[J].中华肝胆外科杂志,2018,24(2):116-121.[37]㊀KwonHY,KimJH,KimB,etal.RegulationofSIRT1/AMPKaxisiscriticallyinvolvedingallotannin⁃inducedsenescenceandimpairedautophagyleadingtocelldeathinhepatocellularcarci⁃nomacells[J].ArchToxicol,2018,92(1):241-257.[38]㊀WangL,ZhuZ,HanL,etal.Acurcuminderivative,WZ35,suppresseshepatocellularcancercellgrowthviadownregulatingYAP⁃mediatedautophagy[J].FoodFunct,2019,10(6):3748-3757.[39]㊀ShengX,ZhuP,QinJ,etal.Thebiologicalroleofautophagyinregulatingandcontrollingtheproliferationoflivercancercellsin⁃ducedbybufalin[J].OncolRep,2018,39(6):2931-2941.[40]㊀ZhangG,WangZ,ChenW,etal.Dualeffectsofgossypolonhumanhepatocellularcarcinomaviaendoplasmicreticulumstressandautophagy[J].IntJBiochemCellBiol,2019,113:48-57.[41]㊀YangJ,PiC,WangG.InhibitionofPI3K/Akt/mTORpathwaybyapigenininducesapoptosisandautophagyinhepatocellularcarcinomacells[J].BiomedPharmacother,2018,103:699-707.[42]㊀NiuQ,ZhaoW,WangJ,etal.LicAinducesautophagythroughULK1/Atg13andROSpathwayinhumanhepatocellularcarcinomacells[J].IntJMolMed,2018,41(5):2601-2608.[43]㊀ChenJ,ZhangZQ,SongJ,etal.18β⁃Glycyrrhetinic⁃acid⁃medi⁃atedunfoldedproteinresponseinducesautophagyandapoptosisinhepatocellularcarcinoma[J].SciRep,2018,8(1):9365.[44]㊀LiuF,WangF,DongX,etal.T7peptidecytotoxicityinhumanhepatocellularcarcinomacellsismediatedbysuppressionofauto⁃phagy[J].IntJMolMed,2019,44(2):523-534.[45]㊀XuWL,WangSH,SunWB,etal.Insufficientradiofrequencyablation⁃inducedautophagycontributestotherapidprogressionofresidualhepatocellularcarcinomathroughtheHIF⁃1α/BNIP3signalingpathway[J].BMBRep,2019,52(4):277-282.[46]㊀LiTT,ZhuD,MouT,etal.IL⁃37inducesautophagyinhepato⁃cellularcarcinomacellsbyinhibitingthePI3K/AKT/mTORpathway[J].MolImmunol,2017,87:132-140.[47]㊀HuangZ,FangW,LiuW,etal.AspirininducesBeclin⁃1⁃de⁃pendentautophagyofhumanhepatocellularcarcinomacell[J].EurJPharmacol,2018,823:58-64.收稿日期:2020-04-01;㊀修回日期:2020-08-24。
抑制自噬增加 PI3K/AKT/mTOR 信号通路抑制剂引起的胃癌细胞死亡

抑制自噬增加 PI3K/AKT/mTOR 信号通路抑制剂引起的胃癌细胞死亡斯庆图娜拉;刘磊【摘要】目的:为了研究3-MA 是否可能增强胃癌细胞对 PI3K/mTOR 抑制剂NVP-BEZ235的敏感性。
方法以胃癌 SNU16细胞系为研究对象,SNU16细胞用不同浓度的 NVP-BEZ235(10 nM、20 nM 和50 nM)处理24 h。
实验分为四组:Control 组,20 nM NVP-BEZ235组,5 mM 3-MA 组,20 nM NVP-BEZ235联合5mM 3-MA 组。
MTT 法用来检测不同组内细胞的生存率,Western blotting 用来检测 Cleaved Caspase-3和 Cytochrome C 的表达水平。
结果MTT 结果表明 NVP-BEZ235能抑制 SNU16细胞的增殖,3-MA 增强了NVP-BEZ235对 SNU16细胞的增殖抑制作用。
Western blotting 结果表明NVP-BEZ235增加了 Cleaved Caspase-3和 Cytochrome C 的表达,而 NVP-BEZ235联合3-MA 会进一步诱导 Cleaved Caspase-3和 Cytochrome C 蛋白的表达。
结论3-MA 通过抑制自噬增加了 SNU16细胞对 NVP-BEZ235的敏感性。
%Objective To study whether 3-MA can enhance the sensitivity of inhibitor NVP-BEZ235 to gastric canc-er cell.Methods SNU16 cells were treated by different coneentrations of NVP-BEZ235(10 nM,20 nM and 50 nM)for 24 h.Next,SNU16 cells were divided into four groups:Control group,20 nM NVP-BEZ235 group,5 mM 3-MA group, 20 nM NVP-BEZ235 combined with 5 mM 3-MA group.MTT assay was used to examine the proliferation inhibition of SNU16 cells.Western blotting was used to detect a change in protein level of Cleaved Caspase-3 and CytochromeC.Re-sults MTT assay showed that growth inhibition rates among thegroups with different levels of NVP-BEZ235 was sta-tistically significant.NVP-BEZ235 combined with 3-MA enhanced the inhibition ratio of cell compared with NVP-BEZ235 group.Western blotting showed that Cleaved Caspase-3 and Cytochrome C were increased in cells following treated with NVP-BEZ235,and then 3-MA enhanced the expression of these proteins induced by NVP-BEZ235.Conclu-sion 3-MA sensitized SNU16 cells to NVP-BEZ235 by inhibition of auto-phagy.【期刊名称】《中国实验诊断学》【年(卷),期】2015(000)009【总页数】4页(P1457-1460)【关键词】胃癌;自噬;NVP-BEZ235;凋亡【作者】斯庆图娜拉;刘磊【作者单位】鄂尔多斯市中心医院,内蒙古鄂尔多斯 017000;鄂尔多斯市中心医院,内蒙古鄂尔多斯 017000【正文语种】中文【中图分类】R735.2尽管最近几年胃癌的发病率有所下降,但胃癌在我国恶性肿瘤中仍高居第一位。
肿瘤干细胞信号通路(PI3KAKT)研究与进展

•综述.肿瘤干细胞信号通路(PI3K/AKT)研究与进展勾蓉(重庆大学附属肿瘤医院健康体检与肿瘤风险筛查中心,重庆400030)摘要肿瘤干细胞是一组存在于肿瘤细胞中可有效躲避放化疗治疗并具有较强增殖与分化能力的小部分细胞亚群,是肿瘤发生发展、产生耐药、治疗后复发的主要原因,根除肿瘤干细胞是彻底治愈肿瘤的一大关键。
PI3K/AKT是与肿瘤细胞的多种生命活动密切相关的一条信号通路,介导肿瘤细胞的增殖、迁移、转移以及自我更新等生命活动,在大多数肿瘤细胞中都存在持续活化现象,是探索肿瘤发生发展分子机制的一条重要靶向位点。
最新研究发现,PI3K/AKT通路介导调控肿瘤干细胞的自我更新能力并可抵抗干细胞造成的细胞耐药,所以探究它与肿瘤干细胞的关系可为人类肿瘤的根治提供新的方法和途径。
关键词PI3K/AKT通路;肿瘤;干细胞冲图分类号]R73-3[文献标识码]A学科分类代码:32067文章编码:1001-8131(2021)01-0139-03Research and Development in the Signal Pathway of Cancer Stem Cells(PI3K/AKT)Gou Rong(Health Examination and Cancer Risk Screening Center,Chongqing Cancer Hospital,Chongqing400030,China) Abstract Cancer stem cells is a small cells group that could avoid radiotherapy and chemotherapy and has a strong selfrenewal ability,it is a crucial reason for tumorigenesis,cancer progression,drug resistance and carcinoma palindromia,would be the principal way to cure cancers.PI3K/AKT is a significant signaling pathway correlated with cell proliferation and differentiation, which reported could modulate cancer stem cells self-renewal and fight off drug resistance caused by cancer stem cells,therefore,it is necessary to find out the relationship between PI3K/AKT pathway and cancer stem cells and explore a new way to cure cancers.Key words PI3K/AKT pathway;Cancer;Stem cells肿瘤干细胞(Cancer stem cells,CSCs)是一组存在于肿瘤细胞中具有自我更新能力和多向分化潜能的小部分细胞亚群[1],通常情况下处于相对静止状态,在受到外界刺激或损伤时才会进入分化状态,加之其具有较强的抵抗凋亡和DNA修复能力,因而可免受一般放化疗方法的杀灭,时会在部分肿瘤细胞灭,是肿瘤治疗和复的主要原因之一3)。
PI3KAkt信号通路在抑郁症及抗抑郁中药作用机制研究中的进展

PI3KAkt信号通路在抑郁症及抗抑郁中药作用机制研究中的进展一、本文概述抑郁症是一种复杂的情绪障碍,影响着全球数亿人的生活质量。
随着对抑郁症病理机制的深入研究,越来越多的证据表明PI3K/Akt 信号通路在抑郁症的发病过程中扮演着重要角色。
中医药在抑郁症的治疗中显示出独特的优势,对于PI3K/Akt信号通路的影响也引起了广泛关注。
本文旨在综述近年来PI3K/Akt信号通路在抑郁症发病机制及抗抑郁中药作用机制中的研究进展,以期为抑郁症的治疗提供新的思路和方法。
我们将简要介绍PI3K/Akt信号通路的基本结构和功能,以及其在抑郁症发病机制中的作用。
然后,我们将重点综述近年来抗抑郁中药对PI3K/Akt信号通路的影响及其作用机制,包括中药单体、中药复方及其有效成分对PI3K/Akt信号通路的调控作用。
我们还将探讨PI3K/Akt信号通路在抗抑郁中药作用机制中的可能作用靶点,以期为抑郁症的中医药治疗提供理论依据。
我们将总结当前研究的不足和未来研究方向,以期为推动PI3K/Akt信号通路在抑郁症及抗抑郁中药作用机制研究中的进一步发展提供参考。
二、PI3KAkt信号通路与抑郁症的关系近年来,越来越多的研究表明,PI3KAkt信号通路与抑郁症的发生和发展密切相关。
PI3KAkt信号通路是一种重要的细胞生存和增殖信号通路,它参与调节多种细胞功能,包括细胞代谢、细胞生长、细胞存活和蛋白质合成等。
在抑郁症的病理生理过程中,PI3KAkt信号通路的异常变化起着重要作用。
在神经系统中,PI3KAkt信号通路通过调节神经元的存活、突触可塑性以及神经递质的合成和释放等过程,影响神经系统的正常功能。
抑郁症患者的大脑中,PI3KAkt信号通路往往出现紊乱,这可能导致神经元损伤、突触可塑性下降以及神经递质失衡,从而引发抑郁症症状。
抗抑郁药物的治疗机制之一就是通过调节PI3KAkt信号通路来改善抑郁症症状。
一些研究表明,抗抑郁药物可以激活PI3KAkt信号通路,促进神经元的存活和突触可塑性的恢复,从而改善抑郁症患者的神经功能。
皮肤鳞状细胞癌的化学药物治疗研究

论文题目:皮肤鳞状细胞癌的化学药物治疗研究摘要:皮肤鳞状细胞癌是一种常见的皮肤恶性肿瘤,化学药物治疗在其治疗中起着重要作用。
本文综合了皮肤鳞状细胞癌的化学药物治疗研究进展,包括化疗药物、靶向药物、免疫治疗等方面的最新研究成果,旨在提供全面的治疗信息和临床指导,为临床实践提供参考。
引言:皮肤鳞状细胞癌是一种源自皮肤鳞状细胞的恶性肿瘤,常见于头颈部和日光暴露部位的皮肤。
化学药物治疗作为皮肤鳞状细胞癌的重要治疗手段之一,已经取得了一定的进展,但仍面临着挑战。
1. 化疗药物1.1 氟尿嘧啶类药物氟尿嘧啶类药物如5-氟尿嘧啶(5-FU)和卡培他滨等,是常用的化疗药物,通过抑制DNA合成和细胞增殖,达到抑制肿瘤生长的目的。
1.2 白蛋白结合类似物白蛋白结合类似物如紫杉醇、紫杉醇类似物和紫杉醇二衍生物等,可以阻断肿瘤细胞有丝分裂,抑制肿瘤生长。
1.3 抗代谢类药物抗代谢类药物如硫唑嘌呤、甲氨蝶呤等,通过干扰肿瘤细胞的核酸合成和代谢途径,达到杀灭肿瘤细胞的目的。
2. 靶向药物2.1 EGFR抑制剂EGFR抑制剂如埃罗替尼、吉非替尼等,可以抑制肿瘤细胞的生长和转移,提高患者的生存率。
2.2 PI3K/AKT/mTOR通路抑制剂PI3K/AKT/mTOR通路抑制剂如西罗莫司、雷帕霉素等,可以抑制肿瘤细胞的增殖和血管生成,延长患者的生存期。
3. 免疫治疗3.1 PD-1/PD-L1抑制剂PD-1/PD-L1抑制剂如尼拉帕利、帕博利珠单抗等,可以激活患者自身免疫系统,增强对肿瘤细胞的杀伤作用。
3.2 CTLA-4抑制剂CTLA-4抑制剂如伊匹希姆、铂美司酞等,可以增强T细胞的抗肿瘤活性,提高患者的生存率。
结论:化学药物治疗在皮肤鳞状细胞癌的治疗中起着重要作用,包括化疗药物、靶向药物和免疫治疗等。
未来的研究应进一步完善治疗方案,探索更有效的治疗策略,提高患者的生存率和生活质量。
PI3K—AKT—mTOR信号通路的研究进展

PI3K—AKT—mTOR信号通路的研究进展PI3K-AKT-mTOR信号转导通路是哺乳动物肿瘤免疫中重要的信号通路,在多种恶性肿瘤的演变过程中发挥了极其重要的作用。
近几年来,随着肿瘤分子生物学的发展,恶性肿瘤的靶向治疗成为研究热点,通过研究探讨PI3K-AKT-mTOR信号通路在肿瘤发生、发展过程中的信号转导机制,联合多种抑制剂或者寻找作用于多种信号通路、多靶点的新药,对于肿瘤的靶向治疗有重要意义。
标签:PI3K-AKT-mTOR;信号转导;肿瘤;抑制剂恶性肿瘤严重危害人类健康,随着社会、经济的发展以及人口老龄化的加剧,我国大多数恶性肿瘤发病率、死亡率呈明显上升趋势。
与此同时,随着人们对恶性肿瘤的研究不断深入,越来越多肿瘤信号通路被发现,其中PI3K-AKT-mTOR 信号转导通路是哺乳动物肿瘤免疫中的重要信号通路,此信号通路对于调节细胞的生长、增殖、自噬以及凋亡有着重要的作用。
1 PI3K-AKT-mTOR 信号通路的组成在各种生物体中,细胞之间相互识别及相互作用,都是通过细胞信号的传导来实现,细胞信号转导指细胞通过细胞膜或者胞内相应受体感受信息分子刺激,通过细胞内信号转导系统进行转换,从而引发一系列生物化学反应及蛋白相互作用,直到细胞生理反应所需基因表达开始、各种生物学效应形成。
1.1 磷脂酰肌醇-3激酶(PI3K)PI3K存在于细胞质中,具有蛋白激酶及磷脂激酶的双重活性。
PI3K包括Ⅰ型、Ⅱ型、Ⅲ型,Ⅰ型的底物主要为磷脂酰肌醇(PI)、3-磷酸磷脂酰肌醇(PIP)及3,4-二磷酸磷脂酰肌醇(PIP2);Ⅱ型的底物主要为PI及PIP,Ⅲ型的底物主要为PI,但是只有Ⅰ型PI3K与肿瘤形成有着密切关联[1-2]。
Ⅰ型PI3K包括IA和IB亚型,它们从酪氨酸激酶连接受体、G蛋白连接受体进行信号传递,IA型PI3K由调节亚基(P58)和催化亚基(P110)组成,其中调节亚基(P58)包含SH2、SH3两个重要结构域,在正常情况下P58与P110结合导致PI3K失活。
小分子抑制剂、激动剂、拮抗剂--PI3KAktmTOR信号通路
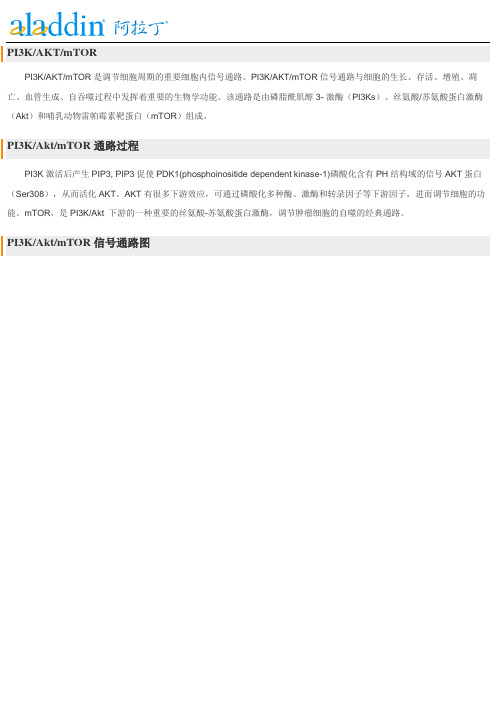
PI3K/AKT/mTORPI3K/AKT/mTOR是调节细胞周期的重要细胞内信号通路。
PI3K/AKT/mTOR信号通路与细胞的生长、存活、增殖、凋亡、血管生成、自吞噬过程中发挥着重要的生物学功能。
该通路是由磷脂酰肌醇3- 激酶(PI3Ks)、丝氨酸/苏氨酸蛋白激酶(Akt)和哺乳动物雷帕霉素靶蛋白(mTOR)组成。
PI3K/Akt/mTOR通路过程PI3K激活后产生PIP3, PIP3促使PDK1(phosphoinositide dependent kinase-1)磷酸化含有PH结构域的信号AKT蛋白(Ser308),从而活化AKT。
AKT有很多下游效应,可通过磷酸化多种酶、激酶和转录因子等下游因子,进而调节细胞的功能。
mTOR,是PI3K/Akt 下游的一种重要的丝氨酸-苏氨酸蛋白激酶,调节肿瘤细胞的自噬的经典通路。
PI3K/Akt/mTOR信号通路图按靶点分类:*PI3KPI3K,是一种胞内磷脂酰肌醇激酶,也具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性。
能够通过PI3K诱发PIP3生成的激活因子,则能够激活Akt 信号途径,包括受体酪氨酸激酶、整合素、B 细胞和T 细胞受体、细胞因子受体、G 蛋白偶联受体等等。
*Akt又称PKB或Rac,是一种丝氨酸/苏氨酸特异性蛋白激酶B,在细胞存活和凋亡中起重要作用,如葡萄糖代谢、凋亡、细胞增殖、转录和细胞迁移。
Akt的Thr308可以被PDK1磷酸化,而被部分激活。
或者473位点上的丝氨酸被mTORC2磷酸化,激发Akt的完全酶活性。
*mTORmTOR是细胞生长和增殖的重要调节因子。
mTOR与其它蛋白质结合,形成两种不同蛋白质复合物,mTORC1和mTORC2,参与调节不同的细胞过程。
*GSK-3。
PI3K信号通路抑制剂研究进展

Hans Journal of Medicinal Chemistry 药物化学, 2020, 8(3), 51-65Published Online August 2020 in Hans. /journal/hjmcehttps:///10.12677/hjmce.2020.83007The Research Progress of PI3K InhibitorsZijian Zhao1, Ming Zhang2, Chi Li1, Xin Wang1,2*1School of Pharmaceutical Sciences, Liaoning University, Shenyang Liaoning2Liaoning Key Laboratory of New Drug Research & Development, Shenyang LiaoningReceived: Jul. 13th, 2020; accepted: Jul. 27th, 2020; published: Aug. 3rd, 2020AbstractPI3K signaling pathway refers to the PI3K/AKT/mTOR signaling pathway. In this review, we briefly summarized the classification of PI3K inhibitors, and the interaction between PI3K inhibi-tors and PI3K active sites. We also introduced the research progress of PI3K inhibitors in detail, and then revealed the structure-activity relationship and design ideas of PI3K inhibitors in order to find drugs with high activity, good selectivity and small side effects, and bring hope for the can-cer therapy. PI3K signaling pathway plays an important role in human development and is closely related to the occurrence and development of a variety of tumors. In different treatment methods for PI3K signaling pathway, small molecule PI3K inhibitors have great potential in molecular tar-geted anti-tumor treatment. Currently, the main known PI3K inhibitors are Copanlisib, Idelalisib Dactolisib, Omipalisib, etc.KeywordsPI3K Signaling Pathway Inhibitors, Structural, Targets, Research ProgressPI3K信号通路抑制剂研究进展赵咨鉴1,张明2,李驰1,王欣1,2*1辽宁大学药学院,辽宁沈阳2辽宁省新药研发重点实验室,辽宁沈阳收稿日期:2020年7月13日;录用日期:2020年7月27日;发布日期:2020年8月3日摘要PI3K信号通路是指PI3K/AKT/mTOR信号通路。
自噬与PI3K—AKT/mTOR信号通路在足细胞损伤中的研究进展

自噬与PI3K—AKT/mTOR信号通路在足细胞损伤中的研究进展自噬是广泛存在于真核细胞中的生命现象,是生物体在其发育、老化过程中都存在的一个净化自身多余或受损细胞器的共同机制,生命体通过自噬清除细胞废物、进行结构重建以维持蛋白代谢平衡及细胞环境稳定。
足细胞是肾脏固有细胞,其损伤是导致肾病蛋白尿和肾小球硬化的重要原因。
PI3K-Akt/mTOR是广泛存在于足细胞内的重要信号通路,对足细胞自噬有一定调控作用。
本文旨在对PI3K-Akt/mTOR信号通路与足细胞自噬的关系进行综述,以期探讨足细胞损伤所致肾病蛋白尿和肾小球硬化的治疗靶点。
[Abstract] Autophagy is a life phenomenon widely exists in eukaryotic cells. It is the common mechanism of biosome that purify its excess or damaged organelle during the process of growth and aging. Organism can remove the cell waste by autophagy and reconstruct the structure in order to maintain the balance of protein metabolism and stable cell environment. Podocyte is the inherent cells of kidney. Podocyte injury is a major cause of nephrotic proteinuria and glomerular sclerosis. PI3K-Akt/mTOR is an important signaling pathway exists in podocytes,which has a certain role in the regulation of autophagy of podocyte. The purpose of this paper is to review the relationship between PI3K-Akt/mTOR signaling pathway and podocyte autophagy,in order to explore the therapeutic targets of proteinuria and glomerular sclerosis induced by podocyte injury.[Key words] Podocyte;Autophagy;Signaling pathway;Kidney disease足细胞是肾小球脏层上皮细胞,是一种高度分化的终末细胞,其作为肾小球滤过屏障的重要部分,通过抵消肾小球高强度的透壁膨胀力、分泌可溶性因子调控其他肾小球细胞来维持正常的肾滤过屏障功能,在免疫因子、肾毒物、缺血缺氧等各种理化因素刺激过程中,均会受到损伤或功能障碍,严重者出现细胞死亡,进而导致肾小球硬化、肾功能损伤[1]。
PI3K-mTOR信号通路的研究进展

P13K—mTOR信号通路的研究进展周虹文富强黄向阳【摘耍】P13K-mTOR(phosphoinositide-3一kinase/themammaliantargetofrapamycin)信号通路在细胞的生长、分化、凋亡等方面都发挥着重要作用,文章对该通路的组成、调节、效应、抑制剂及其应用等方面作了介绍。
并阐述了干扰素a通过该信号通路刺激基因表达的研究现况。
【关键词】P13K—mTOR干扰索aAdvancementofPDK-mTORsignalingpathwayzHoUHong,WENFu-qiang,HUANGXiang-yang.DepartmentofRespiratoryMedicine,WestChinaHospital,SichuanUniversity,Otengdu610041,oli加[Abstract]Previousstudieshavedemonstratedthatphosphoinoaitide-3·kinase/themammaliantargetofrapamycin(P13K—mTOR)signalingpathwaycanbeinvolvedinanumberofcellularprocessesincludingcellproliferation,differentiation,survival,andtumorgrowth.ThisreviewdescfibstherecentadvancesinunderstandingtheP13K—mToRsignalingpathway,theP13K—mToRinhibitors.andalsotheregulationandtheroleofP13K—mTORpathway.Alsoitshedslightoninvestigationsbetweeninterferon-alphaandP13K—mTORpathway.[Keywords]Phosphoinositide-3一kinase/themammaliantargetofrapamycin;Interferon-alphaP13K—mTOR(phosphoinositide-3一kinase/themammaliantargetofrapamycin)信号通路参与细胞的生长、凋亡等重要的细胞信号转导及许多重要的生物学过程,包括转录、翻译、代谢、血管新生以及细胞周期的调控。
PI3K抑制剂在乳腺癌治疗中的应用现状

象 [4] 。 本文将 总 结 PAM 信 号 通 路 作 用 机 制 以 及
PI3K 抑制剂在不同亚型乳腺癌治疗中的应用现状,
以期为不同亚型乳腺癌提供靶向治疗方案。
· 252·
中国肿瘤外科杂志 2021 年 6 月第 13 卷第 3 期 Chin J Surg Oncol, June 2021,Vol.13,No.3
ER + MCF⁃7 细 胞 系) 的 生 长 来 发 挥 协 同 作 用[13] 。
BEZ⁃235 与自噬抑制剂的结合,这些组合导致乳腺癌
细胞增殖抑制和凋亡增加[14] 。
族酶,ⅠA 类 PI3K 是一组由催化亚基 p110( p110α、
3 PI3K 抑制剂与乳腺癌
p85β、p85γ、p50α 和 p55α) 组成的异二聚体,其中催
2 PI3K 抑制剂
鉴于 PI3K 通路的过度激活是乳腺癌最常见的信
雌激素受体(estrogen receptor, ER) 信号传导是乳
乳腺 癌 病 例 为 激 素 受 体 阳 性 ( hormone receptor⁃
positive,HR)[即雌激素受体和 / 或孕酮受体( proges⁃
terone receptor, PR)]。 靶向雌激素作用的内分泌疗
法(endocrine therapies,ETs) 大大降低了乳腺癌的死
亡率。 然而,它们的功效受到天然和获得性内分泌抗
性的限制[15] 。 例如,使用他莫昔芬的患者中有 1 / 3
最终将在 15 年内因内分泌耐药性晚期肿瘤复发;在
common in breast cancer, which makes this pathway a new therapeutic target for breast cancer. A variety of
黑色素瘤小分子靶向药物研究进展_申付文

281[作者简介]申付文,男,硕士,主要从事药品注册工作。
联系电话:(0512)62956991,E-mail :fshen@neupharma.com 。
[通讯作者]钱向平,男,博士,主要从事创新药物研发。
联系电话:(0512)62956991,E-mail :sqian1@neupharma.com 。
·综述·黑色素瘤小分子靶向药物研究进展申付文1,叶立1,刘敬阁1,朱永亮1,陶敏2,钱向平1,3(1苏州润新生物科技有限公司,苏州215123;2苏州大学附属第一医院肿瘤内科,苏州215008;3苏州大学药学院,苏州215123)[摘要]黑色素瘤(melanoma )是一种恶性的黑色素细胞肿瘤。
我国黑色素瘤的发病率逐年攀升,而中晚期黑色素瘤尚无有效的治疗方法,因此研发新的治疗药物显得尤为迫切。
本文对当前黑色素瘤靶向药物进行了总结,重点讨论了MAPK /ERK 信号通路的抑制剂(如BRAF 抑制剂和MEK 抑制剂)。
[关键词]黑色素瘤;MAPK /ERK 信号通路;BRAF 抑制剂;MEK 抑制剂;佯谬抑制剂;小分子靶向治疗[中图分类号]R966[文献标志码]A [文章编号]1003-3734(2015)03-0281-07Progress in small-molecule targeted therapy for the treatment of melanomaSHEN Fu-wen 1,YE Li 1,LIU Jing-ge 1,ZHU Yong-liang 1,TAO Min 2,QIAN Xiang-ping 1,3(1Suzhou NeuPharma Co.,Ltd.,Suzhou 215123,China ;2Department of Internal Medicine-Oncology ,The First Affiliated Hospital of Soochow University ,Suzhou 215008,China ;3College of Pharmaceutical Science ,Soochow University ,Suzhou 215123,China )[Abstract ]Melanoma is a skin tumor caused by excessive proliferation of the abnormal melanocytes with an increasing incidence in recent years.Novel drugs for advanced melanoma are urgently needed because of its low survival rates.In this review ,the small-molecule targeted therapies for the treatment of melanoma ,especially theinhibitors of MAPK /ERKs signal pathways (eg.BRAF inhibitors and MEK inhibitors )were covered.[Key words ]melanoma ;MAPK /ERK signal pathway ;BRAF inhibitor ;MEK inhibitor ;paradox breaker ;small-molecule targeted therapy 1黑色素瘤的发生及治疗现状黑色素瘤(melanoma )是由异常黑色素细胞过度增生引发的皮肤肿瘤,容易复发和转移,是皮肤癌的主要死亡原因之一。
mTOR抑制剂的研究进展

mTOR抑制剂的研究进展1 mTOR概述mTOR(哺乳动物雷帕霉素靶蛋白)是蛋白激酶家族中新的一员,这类蛋白激酶又属于磷酯酰肌醇激酶相关激酶(PIKK)[1-3]。
mTOR是在研究免疫抑制剂雷帕霉素的过程中发现的,科学家在研究中发现结构相似的免疫抑制剂FK506和雷帕霉素能够与相同的靶蛋白FKBP12 (FK506结合蛋白)结合发挥其免疫抑制作用,但是它却与FK506的免疫抑制机制不同,雷帕霉素与FKBP12结合形成的复合物不能与钙调素结合,并且雷帕霉素也不能抑制T细胞的早期激活或直接减少细胞因子的合成,它是通过不同的细胞因子受体阻断信号传导,阻断T淋巴细胞及其它细胞由G1期至S期的进程,而FK506则是抑制T淋巴细胞由G0期至G1期的增殖[4]。
由于mTOR在细胞增殖、分化、转移和存活中的重要地位,mTOR已经成为癌症治疗中的一个新靶点。
mTOR抑制剂的抗癌机制都是通过首先与FKBP-12蛋白生成复合物,此复合物再与mTOR的FRB区域结合由此抑制mTOR的功能,从而抑制了下游的相关因子的功能,将肿瘤细胞阻滞于G1期(前DNA合成期)从而使肿瘤细胞的生长受抑制并最终阻滞细胞的增殖甚至使细胞凋亡。
2 mTOR抑制剂2.1 雷帕霉素及其衍生物雷帕霉素(Rapamycin,Sirolimus,RAPA,1)属大环内酯类抗生素,与FK506结构相似。
早在1975年,从们已从吸水链霉菌(Steoptomyces hyproscopicus)的代谢产物中分离出雷帕霉素,但由于其过低的抗菌活性而遭冷遇,直至1977年由于其结构与免疫抑制剂FK506相似而被发现同样具有免疫抑制活性,但令人惊奇的是雷帕霉素与FK506却有着非常不同的免疫抑制机制,这也加深了人们对T细胞活化的理解。
1989年雷帕霉素作为抗移植的排斥反应的新药进入临床,现已上市。
在上世纪90年代中期,由于雷帕霉素对T淋巴细胞增殖的抑制又引导人们将其用于抗肿瘤细胞治疗,并发现其同样具有较好的抗肿瘤活性,此药作为抗癌药已由美国惠氏公司开发即将进入临床[5]。
nf-κb与pi3k-akt-mtor信号通路在支气管哮喘病理机制中的研究进展

地抑制了支气管哮喘的发生发展ꎬ由此可见 PI3K 信
号通路紧密地参与了支气管哮喘的炎症、变态反应、
气道重塑等病理过程ꎮ 还有动物实验研究发现ꎬ在
小鼠哮喘模型中 PI3K 信号通路的异常活化均明显
增强ꎬ但是在应用 PI3K 抑制剂之后一些支气管哮喘
现代中西医结合杂志 Modern Journal of Integrated Traditional Chinese and Western Medicine 2019 Decꎬ 28(34)
3863
综 述
NF - κB 与 PI3K - Akt - mTOR 信号通路在支气管
哮喘病理机制中的研究进展
常 兴1 ꎬ张 恬2 ꎬ颜培正2 ꎬ张庆祥2
(1. 中国中医科学院广安门医院ꎬ北京 100053ꎻ2. 山东中医药大学中医学院ꎬ山东 济
南 250355)
[ 关键词] 支气管哮喘ꎻ发病机制ꎻNF - κB 信号通路ꎻPI3K - Akt - mTOR 信号通路
doi:10. 3969 / j. issn. 1008 - 8849. 2019. 34. 025
两个方面:一是影响气道平滑肌细胞( ASMCs) 的増
道重塑和气道高反应性为主要特征的ꎬ由多种因素
年ꎬ全球哮喘病患者将有可能达到 4 亿人
[1]
ꎮ 随着
气道炎症的迁延ꎬ气道结构发生了重塑ꎬ导致了气道
不可逆性的气流阻塞ꎬ这便是支气管哮喘发病过程
中最为重要的病理学基础之一 [2] ꎮ 而在支气管哮
喘发病机制的研究过程中ꎬNF - κB 信号通路和磷
殖和嗜酸性粒细胞( eosinophil) 的聚集ꎬ二是可以通
PI3K/Akt信号通路及其抑制剂的研究进展

PI3K/Akt信号通路及其抑制剂的研究进展磷脂酰肌醇3激酶(PI3K)/丝氨酸-苏氨酸激酶(Akt)信号通路在信号转导的调控中扮演着重要角色,能调节细胞增殖、凋亡、代谢、运动、血管生成等生物过程。
与其他信号通路相比,PI3K/Akt信号通路的组成部分更庞大,在肿瘤中更多见。
目前已证实多种肿瘤中存在PI3K/Akt信号通路的超活化,对肿瘤细胞的存活、生长、运动、血管生成和代谢意义重大。
因此,抑制PI3K和与通路相关的成分可能会使肿瘤生长受抑,使患者预后改善。
PI3K/Akt信号通路抑制剂包括针对单一成分的抑制剂和双重抑制剂。
目前大量的PI3K抑制剂已在临床前期研究中取得良好结果,有些已经在血液恶性肿瘤和实体肿瘤中进行了临床试验。
在此综述中,我们简单的总结了PI3K-AKt通路的研究成果,讨论了PI3K 抑制剂从临床前研究到临床研究的发展前景。
Abstract:The phosphatidylinositol 3-kinase(PI3K)/serine-threonine kinase (Akt)signaling pathway plays an important role in the regulation of signal transduction,and can regulate biological processes such as cell proliferation,apoptosis,metabolism,movement,and pared with other signaling pathways,the components of the PI3K/Akt signaling pathway are larger and more common in tumors.It has been confirmed that there are hyperactivations of PI3K/Akt signaling pathways in many types of tumors,which are important for the survival,growth,movement,angiogenesis and metabolism of tumor cells.Therefore,inhibition of PI3K and pathway-related components may inhibit tumor growth and improve patient outcomes.PI3K/Akt signaling pathway inhibitors include single-component inhibitors and dual inhibitors.A large number of PI3K inhibitors have achieved good results in preclinical studies,and some have been clinically tested in hematologic malignancies and solid tumors.In this review,we briefly summarized the research results of the PI3K-AKt pathway and discussed the prospects for the development of PI3K inhibitors from preclinical studies to clinical studies.Key words:PI3K;Akt;mTOR;PI3K/Akt signaling pathway inhibitorsPI3K/Akt信號通路是细胞内信号传导通路,对细胞凋亡、恶变、肿瘤进展、转移和放射治疗都有重要作用[1],可因突变、扩增、缺失、甲基化和翻译后的修饰,导致它在癌症患者中调节异常。
mTOR抑制剂治疗肾细胞癌的研究进展

mTOR抑制剂治疗肾细胞癌的研究进展
刘旭; 张东亮; 刘文虎
【期刊名称】《《中国全科医学》》
【年(卷),期】2011(014)003
【摘要】哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种丝/苏氨酸蛋白激酶,在肾细胞癌(renal cell carcinoma,RCC)的发生、发展过程中起着重要作用。
mTOR抑制剂能够抑制mTOR相关信号通路异常引起的癌基因的转化、肿瘤的生长以及肿瘤血管的生成。
Temsirolimus和依维莫司(everolimus)被批准应用于临床,为进展期RCC的治疗和预后带来新的曙光。
【总页数】2页(P323-324)
【作者】刘旭; 张东亮; 刘文虎
【作者单位】100050 北京市首都医科大学附属北京友谊医院肾内科首都医科大学肾病学系
【正文语种】中文
【中图分类】R737.11
【相关文献】
1.PI3K/Akt/mTOR信号通路抑制剂在尤文肉瘤治疗中的研究进展 [J], 苏泱;周琰;张剑军;胡海燕
2.mTOR抑制剂依维莫司在肾细胞癌治疗中的应用 [J], 张琳袁;张明;达骏
3.mTOR抑制剂治疗结节性硬化症的临床研究进展 [J], 冯莲影
4.mTOR抑制剂依维莫司联合内分泌治疗在老年乳腺癌中的研究进展 [J], 薛晨;杨
建征;石光;于琼;唐艳
5.联合应用mTOR信号通路抑制剂促进肿瘤治疗的研究进展 [J], 刘晨曦;路振;杨华
因版权原因,仅展示原文概要,查看原文内容请购买。
PI3K-Akt-mTOR信号通路

PI3K/Akt/mTOR信号通路关键词:信号通路抑制剂细胞目的:通过特异性阻断PI3K和mTOR,观察HepG2和Hep3B细胞株PI3K/Akt/mTOR信号通路活性及生物学行为的改变,探讨相关的分子机制。
方法:在培养的HepG2、Hep3B人肝癌细胞株和人正常肝细胞株QSG-7701上,以免疫印迹方法(Western blot)检测各细胞株中PI3K(p110α亚单位)、PTEN、pAkt(S473,T308)和p-mTOR(S2448)的表达情况;分别用PI3K抑制剂LY294002(50μmol/ml)和mTOR抑制剂Rapamycin(RAPA,50 nmol/ml)孵育HepG2和Hep3B细胞,以MTT比色法检测细胞的增殖能力,以流式细胞术(Flow cytometry)检测细胞周期和凋亡情况,以Western blot法检测细胞中pAkt(S473,T308)和p-mTOR(S2448)的表达改变。
结果:PTEN在HepG2和Hep3B细胞中基本无表达,在QSG-7701细胞株中高表达,pAkt和p-mTOR在HepG2和Hep3B细胞中的表达较QSG-7701细胞均显著升高;LY294002和RAPA均呈剂量-时间依赖的抑制HepG2和Hep3B细胞生长。
饱和效应浓度的LY294002和RAPA作用24小时后,HepG2和Hep3B 细胞均呈现明显的G0/G1期阻滞,处于S期的细胞比例较对照组显著减少(P<0.01);两给药组中HepG2细胞和Hep3B细胞的凋亡率与对照组比较均显著增加(P<0.01);两给药组HepG2细胞的凋亡率显著高于Hep3B细胞(P<0.01或P<0.05),并且HepG2细胞的凋亡率在RAPA给药组显著高于LY294002给药组(P<0.01),但Hep3B细胞的凋亡率在两组间无显著差异。
饱和效应浓度的LY294002作用48小时后,HepG2和Hep3B细胞中pAkt(T308,S473)和p-mTOR(S2448)的表达水平较对照组均显著降低(P<0.01),饱和效应浓度的RAPA作用48小时后,HepG2和Hep3B细胞中P-mTOR(S2448)的表达水平较对照组均显著降低(P<0.01),而pAkt(T308,S473)的表达水平较对照组均显著升高(分别P<0.01)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制剂主要分为 四类 : P I 3 K抑制剂 、 A k t 抑制剂 、 mT O R抑制剂 和 P I 3 K / m T O R双重抑制剂。其中 . 与单一靶 点小分子
抑制剂相比 , 同时作用于 P I 3 K和 r o T O R双靶点 的双重抑制剂 以其独特 的优势受到 了越来越多的关注 。本文 阐述
C h o n g q i n g , C h i n a ; 2 . S c h o o l o f P h a r ma c y , J i a n g x i S c i e o r ma l Un i v e r s i t y ,
( 1 . T h e A f i l i a t e d Ho s p i t a l o f C h o n g q i n g T h r e e G o r g e s Me d i c a l C o l l e g e , Wa n z h o u 4 0 4 0 0 0 ,
De c . 2 0l 6
小分子 P I 3 K / mT O R双重抑制剂研究进展
孙 成 钰 , 一 , 周 勇 , 周 红 英 , 朱 五 福 ,
( 1 . 重庆三峡 医药高等专科 学校 附属 医院 , 重庆 万州 4 0 4 0 0 ; 2 . 江西科技 师范大学药学院 , 江西 南昌 3 3 0 0 1 3 )
了近 年 来小 分 子 P I 3 K / m T O R 双 重抑 制 剂 的研 究 进 展 。 关键词 : P I 3 K — A k t — m T O R信 号通 路 ; P I 3 K / mT O R 双 重 抑制 剂 : 肿瘤 ; 靶 向 治 疗
中图 分 类号 : R 9 1 4 . 1 文献 标 识 码 : A 文章 编 号 : 1 0 0 7 — 3 5 5 8 ( 2 0 1 6 ) 0 6 — 0 0 6 1 — 0 9
De v e l o p me n t s o f S ma l l Mo l e c u l e PI 3 K/ m TOR Du a l I n h i b i t o r s
S u n C h e n g y u ,Z h o u Yo n g ,Z h o u Ho n g y i n g ,Z h u Wu f u ,
摘 要: P I 3 K — A k t — m T O R信号通路是细胞 内的重要传导通路 , 且研究 发现该通路在肿瘤细胞 中高度表达 , 与肿瘤
形 成 有 着 密切 的联 系 , 抑 制 该 信 号通 路 已经 成 为 肿 瘤 预 防 和肿 瘤 靶 向治 疗 的研 究 热 点 。P I 3 K — A k t — m T O R通 路 抑
第 6期
I s s u e 6
江 西 科 技 师 范大 学 学 报
J o u r n a l o f] i a n g x i S c i e n c e& T e c h n o l o g y No r ma l Un i v e r s i t y
2 0 1 6年 1 2月
oT r OR d u a l i n h i b i t o r s b e c a u s e o f i t s u n i q u e a d v a n t a g e 8 a t t r a c t e d mo r e a n d mo r e a t t e n t i o n . Th i s p a p e r s y s t e ma t ’ i c a l l y
N a n c h a n g 3 3 0 0 1 3 , J i a n g x i , C h i n a )
Ab s t r a c t :P I 3 K- Ak t - mT OR s i g n li a n g p a t h w a y i s a n i mp o r t a n t p a t h wa y i n c e l l s . T h e r e s e a r c h e r s f o u n d t h a t P I 3 K— Ak t - mTO R s i g n a l p a t h wa y i s h i g h l y e x p r e s s e d i n t u mo r c e l l s , wh i c h s h o ws t h a t i t i s c l o s e l y r e l a t e d wi t h t u mo r f o ma r t i o n . An d i n h i b i t i o n o f t h i s s i g n a l i n g p a hw t a y h a s b e e n o n e o f t h e r e s e a r c h h o t s p o t s . P I 3 K- Ak t - mT OR p a t h wa y i n h i b i t o r s i n c l u d e f o u r c a t e g o r i e s : P I 3 K i n h i b i t o r s , Ak t i n h i b i t o r s , mT OR i n h i b i t o s r a n d P I 3 K h n TO R d u a l i n h i b i t o r s . Amo n g t h e m, he t P I 3 K /
