4.1蛋白家族在大鼠大脑皮质神经细胞中的表达和定位
大鼠主动逃避学习后pElk-1在脑内表达分布的时程变化

大鼠主动逃避学习后pElk-1在脑内表达分布的时程变化陈旭红;舒斯云;梁振江;包新民;陈立学;吴永明【期刊名称】《神经解剖学杂志》【年(卷),期】2006(22)2【摘要】为探讨大鼠主动逃避学习后转录因子pElk1在脑内表达分布的时程变化,将55只成年SpragueDawley大鼠,分为正常对照组、Y迷宫训练组和假训练组,其中训练组与假训练组再各分为训练后0、1、3、6、24h组,每组动物各5只。
训练组动物接受Y迷宫光-电结合训练,假训练组动物接受光电不结合假训练。
应用免疫组织化学方法检测各组大鼠脑内各区pElk1分布及表达的变化。
结果发现:pElk1免疫阳性神经元在全脑内分布广泛,在纹状体边缘区皮层大部、下丘脑、杏仁核、海马、尾壳核、边缘区、小脑均有较强表达;Y迷宫训练后0、1、3、6h,在海马、皮层大部、杏仁核、下丘脑、纹状体尾壳核及边缘区、小脑均有pElk1免疫阳性神经元表达的持续增强,训练后24hpElk1免疫阳性反应回归到正常组水平;假训练组在假训练后各时间点也有皮层大部、杏仁核等部位的表达增强,但在海马、尾壳核、纹状体边缘区等部位表达增强不明显,与训练组表达强度相比,差异有显著性。
以上结果表明:pElk1在全脑分布广泛,Y迷宫学习增强海马、尾壳核、纹状体边缘区等区域的pElk1的表达,提示pElk1可能参与了Y迷宫相关的各脑区的学习记忆活动。
【总页数】7页(P207-213)【关键词】pElk-1;学习与记忆;脑;大鼠【作者】陈旭红;舒斯云;梁振江;包新民;陈立学;吴永明【作者单位】南方医科大学第二附属医院神经生物学研究所;深圳市儿童医院耳鼻喉科【正文语种】中文【中图分类】Q427;TU352.11【相关文献】1.大鼠脑内炎症对黑质多巴胺能神经元的长时程毒性作用及星形胶质细胞变化 [J], 赵咏梅;吕风月;许秋岩;闫颖;徐群渊2.一氧化碳中毒大鼠脑内肿瘤坏死因子、白介素-10的时程变化 [J], 张海英;刘郁;赵敏;黄建群3.大鼠局灶性脑缺血再灌注脑组织中活性氧自由基表达的时程变化 [J], 闫峰;赵咏梅;罗玉敏;尹洁;李森;房亚兰;刘克建4.雌激素对慢性脑缺血大鼠海马一氧化氮合酶阳性神经元的影响/大鼠短暂性局灶性脑缺血后神经发生、碱性成纤维细胞生长因子表达及其相互关系的研究/大鼠翼腭神经节、耳神经节和脑底动脉壁神经纤维一氧化氮合酶表达的年龄变化/胰头后面神经分布的应用解剖学研究 [J],5.pERK1/2在大鼠脑内的分布及Y迷宫训练后的时程变化 [J], 陈旭红;舒斯云;梁振江;包新民;吴永明因版权原因,仅展示原文概要,查看原文内容请购买。
S100A4蛋白的生物学功能研究进展

S100A4蛋白的生物学功能研究进展尚禹东;杨艳玲;赵海平;李春义【摘要】S100A4 belongs to S100 protein family ,which is a sort of calcium binding protein with EF double helix domain .S100A4 expresses in kinds of tumor and stem cells of human rather than normal somatocytes .Related investigation suggested that the expression of S 100A4 is relative to paraplasm of cells and development of tumor .S100A4 also involves in the invasion and metastasis of tumor cell .Besides ,it can promote the formation of blood vessel in tumor region .Our research group found that S100A4 presents in cervinus antlerogenic periosteum (AP) and pedicle periosteum(PP) tissues .The processes of proliferation ,growth and differentiation are controlled strictly from velvet stem cell to antler with regu-lar shape ,but without abnormal invasion and metastasis ,which are different from tumor cells doing .Antler is the unique organ regenerating in-termitly among mammals ,which attracts more and more attention to the mechanism of regeneration .As a multiple functional protein highly ex-pressing in rapid proliferative cells ,S100A4 brings us a new research direction for development and regeneration mechanism ofantler .%S100A4是S100蛋白家族成员之一,是一种具有EF双螺旋结构域的Ca2+结合蛋白。
神经元常用标记物

神经元轴突标志物Tau:Neuron Type of MAP; helps maintain structure of the axon----------------------------------------------------------------------------神经元树突标志物Drebrin、MAP、SAP102微管相关蛋白Microtubule-associated protein-2(MAP-2):Neuron Dendrite-specific MAP; protein found specifically in dendritic branching of neuron 是组成神经元细胞骨架的重要组成成分,包括:MAP5、MAP1.2和MAP1(x)三种不同类型。
在神经系统发育、形成和再生过程的不同时期扮演着重要的角色。
其中MAP5为早期微观相关蛋白,在胚胎期和新生动物大脑中有较高表达,并随大脑的逐渐成熟而退化,对神经元突起的生长具有重要的引导作用。
MAP2包括三种亚型:MAP2a、MAP2b和MAP2c。
其中MAP2b和MAP2c出现较早。
随着年龄的增长MAP2被组织蛋白酶D所降解,在不同类型的神经元中表达量存在差异。
----------------------------------------------------------------------------------------------神经元早期标志物Tubulin、b-4tubulin :Neuron Important structural protein for neuron; identifies differentiated neuron Nervous System微管蛋白为球形分子, 分为两种类型:a微管蛋白(a-tubulin)和β微管蛋白(β-tubulin), 这两种微管蛋白具有相似的三维结构, 能够紧密地结合成二聚体, 作为微管组装的亚基,能够聚合并且参与细胞分裂。
Synaptopodin与肾脏疾病的研究进展

Synaptopodin与肾脏疾病的研究进展佚名【期刊名称】《浙江临床医学》【年(卷),期】2019(021)001【总页数】3页(P133-135)【正文语种】中文Synaptopodin(SP)又名突触极蛋白,是足细胞裂隙膜(SD)的重要分子结构。
被认为是足细胞分化成熟的特异性标志物,其损伤缺失会导致裂孔隔膜的疏松、消失,滤过屏障的破坏进而出现蛋白尿。
目前研究证实SP与肌动蛋白紧密相连,可影响足突内的细胞骨架成分,肌动蛋白纤维的聚集和解聚,从而调节足细胞的可塑性,在稳定足细胞应力纤维、维持足突细胞结构及功能、调节和维持肾小球滤过功能等方面均具有重要作用。
1 Synaptopodin的结构与分布SP是一种与肌动蛋白微丝紧密相连的富含脯氨酸的线状蛋白质,存在3中异构体,即神经元Synpo-short、肾Synpo-long和Synpo-T,Synpo-long的C末端与和Synpo-T的C末端相同。
这3种同型特异性的与α-actinin-4相互作用并延长α-actinin-4诱导的肌动蛋白丝[1]。
SP与除myopodin以外的任何已知蛋白均无显著同源性,是myopodin基因家族的第二个成员,也是肾小球足细胞分化成熟的标志[2]。
SP在人类的分子量为73.7KD,等电点是9.38;而在小鼠的分子量为74.0KD,等电点是9.27。
人和大鼠的SP有84%的同源性。
SP多肽链富含脯氨酸,占总量的20%左右,且均匀分布于多肽链中,这使SP不可能组成任何的球状结构域。
SP含有两个PPXY结构域或几个潜在的磷酸激酶的作用位点,可通过其PPXY结构域和其他蛋白的WW结构域相连接。
人类SP的cDNA源于一个2071bp的阅读框和1.5kb的3端非编码区序列,其编码SP多肽链含有690个氨基酸[3]。
SP在海马、大脑皮质、纹状体、嗅觉的远端神经元和分化的足细胞中高度表达[4]。
SP存在于树突棘中,其中棘器是必须装置,棘器由光滑内质网组成。
神经元Marker汇总
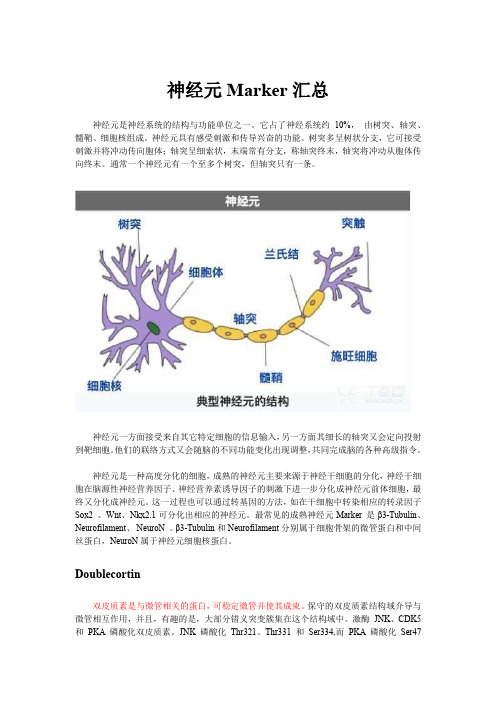
神经元Marker汇总神经元是神经系统的结构与功能单位之一。
它占了神经系统约10%,由树突、轴突、髓鞘、细胞核组成。
神经元具有感受刺激和传导兴奋的功能。
树突多呈树状分支,它可接受刺激并将冲动传向胞体;轴突呈细索状,末端常有分支,称轴突终末,轴突将冲动从胞体传向终末。
通常一个神经元有一个至多个树突,但轴突只有一条。
神经元一方面接受来自其它特定细胞的信息输入,另一方面其细长的轴突又会定向投射到靶细胞。
他们的联络方式又会随脑的不同功能变化出现调整,共同完成脑的各种高级指令。
神经元是一种高度分化的细胞,成熟的神经元主要来源于神经干细胞的分化,神经干细胞在脑源性神经营养因子、神经营养素诱导因子的刺激下进一步分化成神经元前体细胞,最终又分化成神经元。
这一过程也可以通过转基因的方法,如在干细胞中转染相应的转录因子Sox2 、Wnt、Nkx2.1可分化出相应的神经元。
最常见的成熟神经元Marker 是β3-Tubulin、Neurofilament、NeuroN 。
β3-Tubulin和Neurofilament分别属于细胞骨架的微管蛋白和中间丝蛋白,NeuroN属于神经元细胞核蛋白。
Doublecortin双皮质素是与微管相关的蛋白,可稳定微管并使其成束。
保守的双皮质素结构域介导与微管相互作用,并且,有趣的是,大部分错义突变簇集在这个结构域中。
激酶JNK、CDK5 和PKA 磷酸化双皮质素。
JNK 磷酸化Thr321、Thr331 和Ser334,而PKA 磷酸化Ser47并且CDK5 磷酸化Ser297。
Ser297 磷酸化的双皮质素对微管的亲和力降低。
另外,Ser297 的突变会导致迁移缺陷。
双皮质素的突变造成无脑回症(光滑脑),这是一种以癫痫和精神发育迟滞为特征的神经元迁移异常症状。
TBR1T 盒脑蛋白1 (TBR1) 是脊椎动物胚胎发育过程中的一个重要转录因子。
作为T 盒转录因子家族的一员,TBR1 在有丝分裂后期谷氨酸能投射神经元中表达。
神经系统中富含亮氨酸重复结构的蛋白

神经系统中富含亮氨酸重复结构的蛋白【关键词】神经系统;富亮氨酸重复;蛋白彼此作用;功能【摘要】从细菌到哺乳动物,多种物种的神经系统内都存在有一3D结构为马蹄形的富亮氨酸重复结构(LRR)蛋白,其主要在信号转导,细胞黏连,神经系统发育等进程中起作用. 过去的几年内,在无脊椎动物及脊椎动物神经系统内发现了许多具LRRs的蛋白,它们参与了多种神经生理活动. 对这些蛋白的功能作进一步分析,有助于揭露该蛋白家族的分子作用机制,并对进一步熟悉神经系统的发育等重要生理活动有所裨益.【关键词】神经系统;富亮氨酸重复;蛋白彼此作用;功能随着对神经系统发育研究的进展,目前发现了多种参与神经系统发育的基因、蛋白,近几年内,在研究神经系统发育的进程中发此刻果蝇及一些脊椎动物神经系统内的多种蛋白均具有相同的结构域富亮氨酸重复结构域,目前已发现20多种具富亮氨酸重复结构域的蛋白存在于神经系统内.富亮氨酸重复结构(Leucinerich repeats,LRRs)是于1985年第一次发现存在于人血清中一种未知功能的糖蛋白,富亮氨酸α2糖蛋白(leucienrich α2glycoprotein)[1],目前已在多种组织中的60多个功能相异及细胞定位不同的蛋白中发现了富亮氨酸重复结构.富亮氨酸重复结构不同于被普遍熟悉的亮氨酸拉链结构. 亮氨酸拉链存在于寡聚蛋白中,包括许多DNA结合蛋白,如cfos和cjun原癌基因产物. 亮氨酸拉链由重复的7个氨基酸残基组成,亮氨酸位于第7位氨基酸上. 这些亮氨酸位于其组成的α螺旋一侧,其侧链向外伸出,组成状如齿形排列的半拉链,与其异源的互补α螺旋接触后,可借助侧链疏水性交织对插,形成具有稳定卷曲螺旋结构的二聚体,即亮氨酸拉链[2]. 富亮氨酸重复结构与富亮氨酸拉链唯一相似的地方在于,二者的保守亮氨酸残基间都具有特定的距离,而且这些亮氨酸无法被其他疏水性氨基酸所替代. 但是二者间亮氨酸残基间的距离不同,只有在羧基端(C端)的LRRs中的特定亮氨酸之间距离有7个氨基酸. LRRs与亮氨酸拉链中的亮氨酸功能也完全不同,亮氨酸拉链中的亮氨酸残基参与了亮氨酸拉链的寡聚化形成,而LRR中亮氨酸只参与了结构组成,并非直接参与蛋白之间的作用.对含有LRRs蛋白的一级结构分析显示,LRRs 通常呈持续散布,有的蛋白只含有一个LRR,如血小板糖蛋白Ibβ,有的蛋白则含有多个LRR基序(motif),如Chaoptin则含有30个持续LRRs[3]. 不同蛋白中LRRs结构长度可变,通常含有20~29个氨基酸残基,其中最多见的LRR结构含有24个氨基酸残基,它们都含有一个长度为11个氨基酸残基的保守序列,排列为LxxLxLxxN/CxL(“x”可为任意氨基酸),其中第1,4,6,11位氨基酸一般为亮氨酸(Leu)或其他脂肪族氨基酸,第9位氨基酸为天冬氨酸Asp或半光胺酸Cys[3]. 结构研究显示LRRs的排列越规则其3D结构也越规则. 当1,4,6,11位上的Leu被其他疏水性氨基酸如异亮氨酸,缬氨酸或苯丙氨酸所代替时,LRRs重复结构会变得不规则[4].人们对LRRs 3D结构的熟悉来自对猪肝脏核糖核酸酶抑制因子(Ribonuclease Inhibitor, RI)X射线衍射分析[5]. RI为一种胞浆蛋白,其几乎完全由15个持续的LRRs结构组成,它可与包括催化位点在内的核糖核酸酶表面的大部份区域牢固结合,从而起到抑制核糖核酸酶对RNA的剪切作用. 对核糖核酸酶抑制因子晶体结构的研究揭露了LRR持续重复的3D结构组成,每一个独立的亮氨酸重复组成一个独立的βα单位,由一个短的β折叠和一个α螺旋组成,二者近乎平行排列. 另外,每一个持续重复的α螺旋围绕一个一路的轴,彼此也近乎平行地排列,组成一个弯曲的马蹄形结构的外层,β折叠围绕此轴平行排列为β片层结构组成马蹄结构的内层(图1).正是LRR蛋白的这种马蹄状结构的特性,使得其容易和较小的球状蛋白相结合,并可增强它们之间的亲和力和彼此作用. 目前已知的LRR蛋白除具有重复结构的相似处之外,其另一个一路的特点就是富含亮氨酸重复序列蛋白质的LRR结构域为与其他蛋白彼此作用的结合区. LRR蛋白主要在信号转导,细胞黏连,发育,DNA修复、重组、转录,和RNA加工等方面起作用. 它们散布普遍,从细菌到哺乳动物中都有存在,而且在多种组织以至细胞器中也有发现. 过去的几年内,在无脊椎动物及脊椎动物神经系统内发现了多种具LRRs的蛋白(表1). 而咱们最感兴趣的正是这些存在于神经系统内的LRR蛋白.表1神经系统中含有富亮氨酸重复结构的蛋白(略)咱们对上述这些蛋白进行了初步的结构及功能域分析,和细胞定位分析,结果显示这些蛋白中绝大部份位于细胞膜上,只有Slit 蛋白分泌到胞外,LANP蛋白定位到核内(图2),在整个蛋白序列中,LRR 结构域均位于蛋白的N端且占整个蛋白结构的绝大部份. 它们通过LRR结构与相应的配体或受体蛋白结合、彼此作用,从而在胚胎发育,神经发育,细胞极化,基因表达调控,信号转导等方面发挥作用.将上述蛋白与典型的LRR蛋白核酶/血管生成素抑制因子一同进行系统进化分析,结果显示,这些富含LRR结构域的蛋白主要分为三个系统发生群. 不同种属来源的LRR结构域散布于这三个系统发生群中,揭露这些蛋白有可能由一个或几个一路的先人进化而来(图3).上述发现的LRR蛋白有多种位于果蝇(Drosophila)的神经系统内,它们大多参与细胞细胞彼此作用,多作为细胞黏连分子,在神经发育进程中扮演重要角色. 咱们在这里对上述蛋白进行一下简单的介绍.Toll果蝇Toll基因编码一个跨膜蛋白,由803个氨基酸组成的19个富含亮氨酸重复序列的胞外区、跨膜区和269个氨基酸组成的胞内区组成. 其中,17个潜在的糖基化位点和17个半胱氨酸残基均散布于胞外(图2). 自合子期起,Toll蛋白表达贯穿于果蝇胚胎发育的整个进程,其主要散布于胚胎的腹侧,在胚胎发育的后期,主要使肌肉组织形成的进程中,其表达量明显升高. 当RP3或其他运动神经元生长锥伸经肌细胞时,生长锥表面会表达大量Toll蛋白,其作用为支配突触末梢的肌细胞,当神经肌肉接头形成后,Toll表达量随之下降. 在Toll缺失突变体中,RP3生长锥有时会错误支配非目的靶肌细胞. 另外,在非Toll表达期人为表达Toll蛋白,虽然能促使生长锥抵达正确的目的细胞,可是会抑制神经肌肉接头的形成. 因此以为,Toll局部作用并制约特定运动神经元生长锥支配其目的细胞,其时空表达调控对其在胚胎发育进程中的作用十分重要[6].Slit在果蝇、线虫、大鼠和人类等均发现Slit基因的存在,它是由发育期神经管的腹侧中线胶质细胞分泌的一组Mr为170000~190000的分泌型糖蛋白,散布于胶质细胞表面并在所有中枢神经系统轴突表面低水平表达,若是缺乏会致使纵行传导路和交叉(连合)神经元轴突在中线的异样聚集. 其结构从氨基结尾到羧基结尾有一段N端短的信号肽序列,4个富亮氨酸重复(LRRs)序列,7~9个EGF重复序列,一个层粘素(laminin) G序列和一个C结尾富含的胱氨酸的序列,相对于EGF或G序列,LRR结构域几乎组成了Slit蛋白的绝大部份结构. Slit可结合于轴突及生长锥表面的3种Roundabout 受体(Robo,Robo2,Robo3)(图2),研究表明,Slit/ Robo参与多种轴突导向进程,其主要功能在于对轴突的排斥性导向作用,并能增进轴突的分枝和延伸及引导神经细胞的迁移[7].体外研究表明,LRR结构域是Slit作为排斥信号的必需结构. 编码LRR结构域的单个氨基酸发生点突变即可降低Slit的排斥作用,转基因显示主如果该结构域影响轴突的导向. 实验证明,Slit和Robo 的结合及排斥作用需要LRR结构域的存在,LRR缺失后,Slit无法与Robo相结合[8].Connectin果蝇Connectin蛋白,属于具有LRR重复的细胞细胞黏附分子家族,它含有一个信号肽,10个LRR结构域,依托糖基磷脂酰肌醇(GPI)锚定在细胞外膜上(图2),可作为吸引或排斥特定神经细胞的分子,参与运动神经元生长锥导向及突触形成. 在中枢神经系统,Connectin最初表达于果蝇腹侧的8块肌肉组织和支配这些肌肉的运动神经元表面,和沿运动神经元轴突伸展路径上的胶质细胞表面. 在突触形成进程中,Connectin蛋白定位于神经肌肉接头形成时的突触上,突触形成后,则检测不到Connectin的表达. 另外,Connectin还具有促使同型细胞黏连的作用,在肌肉发育的初期表达于成肌细胞,并促使这些成肌细胞成束化. 在运动神经元的轴突生长锥延伸通过外周神经系统时,Connectin蛋白还表达于两种胶质细胞PG1和PG3内. Connectin主要通过同型细胞黏附,协调细胞间彼此作用,从而在靶位点识别中起到重要作用[9].Capricious在果蝇胚胎发育后期,运动神经元轴突生长锥抵达靶目标区域时,会一度搜寻多个可能的靶位点的肌细胞表面,但只会和其中的一个正确靶细胞成立稳定的突触联系,果蝇体内Capricious(caps)基因即调控此进程. caps编码一含有14个LRRs结构域的跨膜蛋白,其胞外区几乎完全由14个LRRs及其N端、C端侧翼结构组成(图2). CAPS蛋白定位于发育期的运动神经元表面,在神经肌肉接头形成进程中,caps表达于很少数量的突触后靶目标肌肉中,和表达于支配这些肌肉的运动神经元中. 体内研究显示,当位于其第一个外显子内蹬LRRs编码区缺失突变后,运动神经元对靶目标选择的特异性就会发生改变,显示caps具有调控特异性突触形成的作用,其可能通过LRRs 结构域调控突触靶位点的识别[10].Tartan果蝇Tartan蛋白为一跨膜蛋白,胞外区由10个LRR结构域及其N端,C端侧翼结构组成,占整个蛋白结构的绝大部份,近接为跨膜区和短的胞内区. Tartan的表达与果蝇胚胎幼虫分节发育,神经发生相关,它参与了神经母细胞,感觉母细胞和外周神经的形成进程,其表达几乎贯穿了胚胎发育的整个进程. tartan等位基因缺失突变体会致使隐性致死,造成周围感觉器官内细胞位置和数量的缺点,影响外周神经的投射,并造成中枢神经系统内神经连合的组织错误. 其缺失突变还可影响到肌肉组织的排列[11].Chaoptin果蝇Chaoptin蛋白是目前发现的具有LRR结构域最多的蛋白,其几乎完全由41个串联的LRR结构域组成(图2). 其作为一种特异性细胞黏附分子,为光感神经元特异性的黏附分子,在成体果蝇复眼中,Chaoptin表达于光感神经元胞体、轴突,起光导作用的微绒毛,和视神经纤维的细胞膜上,它还表达于单眼及果蝇幼虫的光感组织中,通过糖基磷脂酰肌醇(GPI)锚定在细胞膜上. 其功能是作为细胞黏附分子,参与视神经的发育进程,尤其是对视杆微绒毛的排列组成发挥作用[12].Kekkonkekkon基因家族的两个产物Kek1和Kek2均为跨膜蛋白,二者的胞内区不同较大,只有19%同源性,而胞外区相同,均含有6个LRR结构和一个C2型免疫球蛋白结构域(图2),这两种结构域均能介导蛋白蛋白间彼此作用. 二者在胚胎发育进程CNS多种神经元内都有表达. 作为细胞黏合和信号分子,它们可能参与了胚胎CNS 神经元的分化,通过其细胞细胞间彼此作用功能,使得神经元在分化进程中能够识别相邻细胞及分子,从而引导轴突生长及导向[13].近20年来,随着对LRR家族蛋白研究的深切,在高等的脊椎动物,包括哺乳动物体内也发现了多种LRR家族新成员.Trk神经营养素(NTs)高亲和性受体Trk为原癌基因trk编码的跨膜蛋白,其包括有与配体结合的胞外区,跨膜区和胞内酪氨酸蛋白激酶三部份. NTs的信号主如果通过Trk家族酪氨酸蛋白激酶受体抵达神经元的. NTs各个因子特异地识别Trk家族特定的酪氨酸蛋白激酶受体:NGF特异地识别TrkA,BDNF、NT4特异地识别TrkB,NT3识别TrkC. 所有Trk家族受体胞外区包括3个串联的LRR结构域及其N端和C端富含半胱氨酸的侧翼结构,紧接2个Ig样结构. 而第二个LRR motif正是与神经营养因子结合的位点(图2). 实验表明,单独的一个由24个氨基酸残基组成的LRR结构多肽可高效结合NGF,阻碍NGF结合于TrkA胞外的相应区域. TrkB受体上的相应的第二个LRR结构域也具有特异性结合BDNF,NT4的作用[14].LANPLeucinerich acidic nuclear protein (LANP)是酸性富亮氨酸核蛋白,包括247个氨基酸,含两种不同的结构域,其中N端为5个串联的LRR结构域,C端结构域为第105~247位氨基酸残基,为一段富含酸性氨基酸天冬氨酸和谷氨酸的高度重复序列并包括一段核定位信号(图2). LANP普遍散布于大鼠的中枢神经系统内,尤以小脑散布最多,免疫组化研究表明,该蛋白主要位于小脑蒲肯野细胞核内. 其表达量在诞生后发育前期一度升高,在大鼠诞生后第7天,该基因mRNA在小脑外粒层及蒲肯野细胞内适度表达,而在内粒层细胞内弱表达. 在诞生后第2周,该基因在上述细胞内,尤其是蒲肯野细胞内表达量升高,诞生3wk后回落到成体表达水平. 从该蛋白的上述生物学特性推测,LANP有可能在小脑神经元分化进程中起信号转导作用[15].NgRNgR为轴突生长抑制性蛋白Nogo的受体,其含有473个氨基酸,氨基端有一易位信号序列,其后为8个富含亮氨酸的重复区(LRR)和1个LRRC结尾区(LRRCT)(图2). 作为一个糖基醇磷脂结合蛋白,NgR并非跨越细胞膜,其信号的转导必然要激活其他跨膜受体. 实验表明:CNS髓磷脂中另外2种轴突生长抑制性蛋白MAG 与OMgp均通过NgR及与其相连的受体复合物发挥作用. Nogo66与MAG结合于NgR的不同位点上,而Nogo66与OMgp在NgR上的结合位点有重叠,故二者存在竞争. NgR似乎是CNS髓磷脂中各类轴突生长抑制性蛋白发挥作用的集中点[16]. OMgpOMgp(少突胶质细胞/髓鞘糖蛋白)是Mr为110000的糖蛋白,由440个氨基酸组成,通过GPI锚定在髓鞘膜外层. OMgp由四个结构域组成,即氨基端一个较短的富含半胱氨酸的基序,7个富含亮氨酸的串联重复序列,一个丝/苏氨酸富含区和一个疏水的羧基端片段[17](图2). OMgp表达在CNS髓鞘、培育的少突胶质细胞表面和外周神经的节旁区部份神经元上. 它具有诱使生长锥溃变和抑制神经突起再生的作用,这一作用是通过与nogo66等神经再生抑制因子竞争结合同一受体NgR而实现的. 有实验表明,在OMgp与NgR的黏附结合进程中,OMgp的亮氨酸富集重复结构域是必需的,只有含该结构域的OMgp蛋白片段才能黏附表达有NgR的CHO细胞,并抑制神经突起的生长[18]. 还有实验证明,去除LRR的OMgp失去了对COS7细胞的生长抑制功能[19]. 因此推测OMgp LRR结构域有可能在CNS损伤后神经生长抑制进程中起重要作用.LINGO其基因染色体定位为,被命名为“LINGO1”(LRR and Ig domain containing Nogo receptor interacting protein)即“含亮氨酸重复序列和免疫球蛋白结构域的Nogo受体作用蛋白”. LINGO为脑专有蛋白,高表达于脑内,与NgR1共散布;在脊髓中低水平表达,但不存在于机体其他组织. LINGO有四个异构体,LINGO1是主要活性分子,含12个富含亮氨酸的重复序列(12 leucine rich repeats, LRR),一个免疫球蛋白结构域,一个跨膜结构域和一个较短的胞质区(图2). 胞质区上第591位氨基酸残基磷酸化是其发挥活性的结构基础. 在生物体内,LINGO1,NgR1和p75以复合体形式存在于神经元细胞膜,被神经再生抑制因子活化后,一路完成对RhoA的激活,以实现对轴突生长的抑制作用[20].Alivin 1Alivin 1在小鼠和人体神经细胞内都有表达,Alivin 1蛋白结构类似于Kek和Trk家族蛋白,也为一跨膜蛋白,胞外区含有7个LRR结构域,1个IgC2样环状结构域(图2),它在神经元被激活后表达,可增进神经元存活. Alivin 1基因mRNA的表达受电压门控Ca2+通道引发的Ca2+内流所调控,Ca2+浓度升高可引发该基因上调表达,其表达与去极化依赖的细胞存活和NMDA依赖的细胞存活相关,当河豚毒素阻断自发点位后,其在神经元内的表达也受到抑制. 因此该基因的表达是与神经活化状态相关的. 另外,在濒死细胞内该蛋白表达量明显低于正常水平,而高表达该基因可增进凋亡细胞的存活[21].NGL1NGL1为NetrinG1蛋白配体,而NetrinG1是轴突导向分子Netrin家族的一个成员. NGL1为一含640个氨基酸残基的跨膜蛋白,其胞外区占整个蛋白结构的绝大部份,含有9个LRR结构域,外加双侧的LRR N端和C端结构,后接一个Ig结构域,其胞内区仅有92个氨基酸残基(图2). NGL1通过LRR结构域与NetrinG1特异性彼此作用. NetrinG1高度表达于丘脑神经元轴突中,而NGL1在其投射的中间和最终靶目标区纹状体和大脑皮层中表达量最高. 在体实验表明,NGL1可结合在发育期的丘脑轴突表面受体上,增进胚胎丘脑轴突的生长,而游离的NGL1胞外区可显著抑制发育期丘脑轴突在鸡胚前脑内的生长[22].LIG1LIG1为一膜糖蛋白(含1091个氨基酸残基),其胞外区(794个氨基酸残基)包括一个信号肽,15个LRR结构域,3个Ig样结构域,跨膜区由23个氨基酸残基组成,胞内区有274个氨基酸残基(图2). LIG1主要表达于小鼠脑中,尤其是小脑和嗅球内胶质细胞,另外在小鼠胚胎瘤P19细胞分化为神经元样细胞进程中,其表达水平明显升高. 按照LIG1结构和表达特征分析,LIG1极可能作为胶质细胞表面的细胞特异性黏附分子或受体,在神经系统发育,胶质细胞分化,和神经功能的维持等方面发挥功能[23].最近几年来,又有多种含LRR结构的蛋白在神经系统内被发现,如Pal[24],含有5个LRR结构域和1个Ig结构域,表达于视网膜光感细胞中;AMIGO[25],含有6个LRR结构域及1个Ig 结构域,存在于大脑和小脑中,参与轴突束的发育进程;GAC1[26]含12个LRR结构域及1个Ig结构域,主要表达于神经胶质瘤中;NLRR1/2/3[27-28],含有11个LRR结构域,在神经系统发育和再生进程中发挥作用;zfNLRR[29]含有12个LRR结构域及1个Ig 结构域,参与斑马鱼神经系统损伤修复进程.综上所述,自从20世纪80年代在α2糖蛋白内发现LRR结构域以来,所发现的含LRR蛋白已达数十种,它们组成了LRR蛋白家族,参与了多种生物进程,如有的作为细胞黏附分子,有的作为跨膜受体,还有一些是可溶性的结合蛋白或配体. 对于上述这些主要表达于神经系统内的LRR蛋白来讲,它们更多的在神经生理活动中扮演重要角色. 如NgR,OMpg之于轴突生长抑制,Alivin1之于神经元存活,和Slit之于轴突导向,等等. 对于为何神经系统内存在这么多的具LRR结构的蛋白?它们在神经系统内的作用是什么?它们是如何发挥生理作用的?这些问题都有待于咱们在此后去作出解答.相信随着现代分子生物学技术的发展,尤其是蛋白彼此作用技术的发展,咱们此后有可能在更深层次上探讨存在于神经系统内的这些LRR蛋白的功能,这将有助于揭露该蛋白家族的分子作用机制,并对进一步熟悉神经系统的发育等重要生理活动有所裨益.【参考文献】[1]Takahashi N, Takahashi Y, Putnam FW. Periodicity of leucine and tandem repetition of a 24amino acid segment in the primary structure of leucinerich 2glycoprotein of human serum [J]. Proc Natl Acad Sci USA,1985,82(7): 1906-1910.[2]OShea EK, Rutkowski R, Kim PS. Evidence that the leucine zipper is a coiled coil [J]. Science, 1989,243(4890): 538-542.[3]Kobe B,Deisenhofer J. The leucinerich repeat: A versatile binding motif [J]. Trends Biochem Sci, 1994,19 (10):415-421.[4]Kobe B, Kajava A. The leucinerich repeats as a protein recognition motif [J]. Curr Opin Struct Biol, 2001, 11(6):725-732.[5]Kobe B, Deisenhofer J. Crystal structure of porcine ribonuclease inhibitor, a protein with leucinerich repeats [J].Nature,1993, 366(6457): 751-756.[6]Rose D, Zhu X, Kose H, et al. Toll, a muscle cell surface molecule, locally inhibits synaptic initiation of the RP3 motoneuron growth cone in Drosophila [J]. Development, 1997, 124(8): 1561-1571.[7]Wu W, Wong K, Jiang ZH, et al. Guidance of neuronal migration in the olfactory system by the secreted protein Slit[J]. Nature, 1999, 400(6742):331-336.[8]Battye R, Stevens A, Perry RL, et al. Repellent Signaling bySlit Requires the LeucineRich Repeats [J]. J Neurosci, 2001, 21(12): 4290-4298.[9]Nose A, Takeichi M, Goodman CS. Ectopic expression of connectin reveals a repulsive function during growth cone guidance and synapse formation [J]. Neuron, 1994, 13(3): 525-539.[10]Shishido E, Takeichi M,Nose A. Drosophila Synapse Formation: Regulation by Transmembrane Protein with LeuRich Repeats, CAPRICIOUS [J]. Science, 1998, 280(5372):2118-2121.[11]Chang Z, Price BD, Bockheim S, et al. Molecular and genetic characterization of the Drosophila tartan gene[J]. Devel Biol, 1993, 160(2):315-332.[12]Krantz D, Zipursky SL. Drosophila chaoptin, a member of the leucinerich repeat family, is a photoreceptor cellspecific adhesion molecule[J]. EMBO J, 1990, 9(6):1969-1977.[13]Musacchio M, Perrimon N. The drosophila kekkon genes: Novel members of both the leucinerich repeat and immunoglobulin superfamilies expressed in the CNS[J]. Devel Biol, 1996,178(1):63-76.[14]Windisch JM, Auer B, Marksteiner R, et al. Specific neurotrophin binding to leucinerich motif peptides of TrkA and TrkB[J]. FEBS Letters, 1995, 374(1):125-129.[15]Matsuoka K, Taoka M, Satozawa N, et al. A nuclear factor containing the leucinerich repeats expressed in murine cerebellar neurons [J]. Proc Natl Acad Sci USA, 1994, 91(21):9670-9674.[16]Fournier AE, GrandPre T, Strittmatter SM. Identification of a receptor mediating Nogo66 inhibition of axonal regeneration[J]. Nature, 2001, 409(6818): 341-346.[17]Kottis V, Thibault P, Mikol D, et al. Oligodendrocytemyelin glycoprotein (OMgp) is an inhibitor of neurite outgrowth[J]. J Neurochem, 2002, 82(6): 1566-1569.[18]樊拥军,李龙,许健,等. OMgp不同结构域在抑制神经突起生长中的作用[J].细胞生物学杂志,2004,26(3):290-296.[19]Vourch P, Moreau T, Arbion F, et al. Oligodendrocyte myelin glycoprotein growth inhibition function requires its conservedleucinerich repeat domain, not its glycosylphosphatidylinositol anchor [J]. J Neurochem, 2003,85(4): 889-897.[20]Mi S, Lee XH, Shao ZH, et al. LINGO1 is a component of the Nogo66 receptor/p75 signaling complex [J]. Nat Neurosci, 2004, 7(3):221-228.[21]Ono T, SekinoSuzuki N, Kikkawa Y, et al. Alivin 1, a novel neuronal activitydependent gene, inhibits apoptosis and promotes survival of cerebellar granule neurons [J]. J Neurosci, 2003, 23(13): 5887-5896.[22]Lin JC, Ho WH, Gurney A, et al. The netrinG1 ligand NGL1 promotes the outgrowth of thalamocortical axons [J]. Nature Neuroscience, 2003, 6(12):1270-1276.[23]Suzuki Y, Sato N, Tohyama M, et al. cDNA cloning of a novel membrane glycoprotein that is expressed specifically in glial cells in the mouse brain[J]. J Biolo Chem, 1996, 271(37):22522-22527.[24]Gomi F, Imaizumi K, Yoneda T,et al. Molecular cloning of a novel membrane glycoprotein, pal, specifically expressed in photoreceptor cells of the retina and containing leucinerich repeat[J]. JNeurosci, 2000, 20(9):3206-3213.[25]KujaPanula J, Kiiltomki M, Yamashiro T, et al. AMIGO, a transmembrane protein implicated in axon tract development, defines a novel protein family with leucinerich repeats [J]. J Cell Biol, 2003, 160(6):963-973.[26]Almeida A, Zhu XX,Vogt N, et al. GAC1, a new member of the leucinerich repeat superfamily on chromosome band , is amplified and overexpressed in malignant gliomas[J]. Oncogene,1998, 16(23): 2997-3002.[27]Taguchi A, Wanaka A, Mori T, et al. Molecular cloning of novel leucinerich repeat proteins and their expression in the developing mouse nervous system[J]. Brain Res Mol Brain Res, 1996, 35(12):31-40.[28]Taniguchi H, Tohyama M, Takagi T. Cloning and expression of a novel gene for a protein with leucinerich repeats in the developing mouse nervous system[J]. Brain Res Mol Brain Res, 1996, 36(1):45-52.[29]Bormann P, Roth LWA, Andel D, et al. zfNLRR, a novel leucinerich repeat protein is preferentially expressed during regeneration in zebrafish[J]. Mol Cell Neurosci, 1999,13(3):167-179.。
蛋白质表达与神经系统探讨蛋白质表达在神经系统中的重要性

蛋白质表达与神经系统探讨蛋白质表达在神经系统中的重要性蛋白质表达与神经系统探讨蛋白质表达在神经系统中的重要性神经系统是人体中极为重要的生理系统之一,它负责感知、传递和处理信息。
在神经系统中,蛋白质的表达起着至关重要的作用。
本文将探讨蛋白质表达在神经系统中的重要性,并说明其对系统功能和相关疾病的影响。
一、蛋白质表达对神经细胞发育和功能维持的重要性神经元作为神经系统的基本单位,其正常发育和功能维持离不开蛋白质表达的调控。
蛋白质通过转录和翻译的过程,参与调控细胞的形态发生、突触连接的建立和维护,以及神经冲动的传导等重要功能。
1. 蛋白质表达与神经元形态发生神经元的形态发生与其功能紧密相关。
神经元的形态特征,如树突、轴突的延长,以及突触的形成和分化,都依赖于蛋白质表达的准确调控。
例如,神经突触连接的形成需要有锚定细胞膜的蛋白质参与,如神经元黏附蛋白(neuronal cell adhesion molecules,NCAMs)等。
2. 蛋白质表达与突触连接的建立和维护突触是神经元之间传递信息的重要结构,突触连接的建立和维护离不开蛋白质的参与。
例如,突触后密度蛋白(postsynaptic densityproteins,PSDs)在突触后膜的组织和功能调控中起着重要的作用。
蛋白质的表达异常会导致突触连接的紊乱,进而影响神经系统的功能。
3. 蛋白质表达与神经冲动传导神经冲动的传导依赖于神经元膜上特定的离子通道蛋白和细胞间连接的蛋白质。
离子通道蛋白的表达异常会导致神经冲动传导的异常,从而导致神经系统相关疾病的发生。
二、蛋白质表达与神经系统疾病的关联神经系统疾病是指影响神经系统结构、功能或代谢的一类疾病,如帕金森病、阿尔茨海默病和脑卒中等。
这些疾病与蛋白质表达异常密切相关。
1. 蛋白质聚集与神经退行性疾病某些神经系统疾病,如帕金森病和阿尔茨海默病,与蛋白质的异常聚集有关。
例如,阿尔茨海默病患者脑内出现β淀粉样蛋白聚集,导致神经元退化。
水通道蛋白在动物疾病发生过程中的作用研究进展

动物医学进展,021,42(3)=102-105Progress in Veterinary Medicine水通道蛋白在动物疾病发生过程中的作用研究进展张玉婷,张琪,郭抗抗,许信刚*,周宏超*(西北农林科技大学动物医学院,陕西杨凌712100)摘要:水通道蛋白(AQP)是细胞上存在的一种膜孔道蛋白。
动物、植物、微生物细胞上均有水通道蛋白的表达,其主要功能是参与机体的水与电解质代谢。
近年来,针对水通道蛋白在机体所发挥的功能方面研究较多,发现水通道蛋白不仅参与机体生理方面的调控,而且在一些疾病的发生发展过程中也发挥重要的作用。
综述概括了水通道蛋白在脑、肺、肾脏、肠道等组织器官的定位;重点阐述了水通道蛋白在动物脑部疾病、肺部疾病、肾脏疾病、肠道疾病发展过程中所发生的变化。
旨在为患病动物出现水与电解质代谢紊乱症状时,对水通道蛋白发生的变化研究提供参考。
关键词:水通道蛋白;脑水肿;肺动脉高压;肾损伤;腹泻中图分类号:S852.2文献标识码:A 文章编号=^^5038^1)3-0102-0.-1水通道蛋白(aquaporin,AQP)作为一种水转运蛋白在机体各个部位广泛分布,尤其在涉及水液输送的组织细胞内分布量较多,例如在大脑、胃、肠道,肾脏及膀胱等器官均有表达,水通道蛋白在保持机体内环境稳态方面发挥重要作用,增强了机体的代谢能力[]。
研究发现,哺乳动物体内所表达的水通道蛋白已经有13种亚型,分别为AQP0、AQP1、AQP2、AQP3、AQP4、AQP5、AQP6、AQP7、AQP8、AQP9、AQP10、AQP11、AQP12。
水通道蛋白家族根据各个亚型在机体发挥的功能不同,可分为3类:①单纯的水通道蛋白,如AQP1,AQP2,AQP4, AQP5;②水甘油通道蛋白,如AQP3,AQP9、AQP10;③超级水通道蛋白,如AQP6,AQP8, AQP11、AQP12[]。
近年来,某些疾病的发生与水通道蛋白异常表达现象,得到了广泛的关注。
蛋白激酶C的生理功能及其与神经系统老龄相关疾病研究进展

蛋白激酶C的生理功能及其与神经系统老龄相关疾病研究进展汪静;朱雨岚【摘要】蛋白激酶C(PKC)是一种丝氨酸/苏氨酸激酶,参与大脑多种信号通路的调控,提高长期记忆,诱导神经突触再生,提升神经元的修复能力,调控基因水平的表达与凋亡.在脑卒中、阿尔兹海默病、帕金森病等病理生理过程中也发挥作用.本文对PKC的生理功能及其与神经系统老龄相关疾病的关系进行综述.【期刊名称】《神经损伤与功能重建》【年(卷),期】2017(012)001【总页数】4页(P52-54,63)【关键词】蛋白激酶C;生理功能;神经系统疾病;老龄【作者】汪静;朱雨岚【作者单位】哈尔滨医科大学附属第二医院神经内科哈尔滨150086;哈尔滨医科大学附属第二医院神经内科哈尔滨150086【正文语种】中文【中图分类】R741;R742.1我国目前已步入老龄社会。
在神经系统疾病中,脑卒中、阿尔兹海默病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)等疾病都有随年龄增长而高发的特点,但针对其发病机制的治疗手段仍然有限。
目前有2种理论表明蛋白激酶C(protein kinase C,PKC)与年龄相关[1]:①随着年龄增长,组织完成自我修复,但在这过程中PKC功能被抑制,PKC基因表达被抑制直接与神经功能退化相关[2,3];②PKC亚型即使仍旧保持活力,但PKC使与衰老相关酶的基因发生易位,这是其对衰老敏感的重要原因[4]。
以上2种理论都与神经功能衰退相关,且都依赖PKC亚型相互作用,所以PKC有希望成为治疗神经系统疾病分子水平上的新靶点。
本文就PKC与神经系统老龄相关疾病的研究现状做以下综述。
1.1 PKC概念及分布情况PKC是一个丝氨酸/苏氨酸的蛋白激酶,其在脑组织很多成分中表达[4],如神经元、神经胶质细胞、平滑肌细胞、内皮细胞及其他脑组织细胞[5]。
1.2 PKC的亚基及功能PKC的亚基目前为止发现至少10个。
LINGO-1在神经系统疾病中的研究进展2024(全文)

LINGO-1在神经系统疾病中的研究进展2024(全文)摘要LINGO-1是富含亮氨酸重复序列和免疫球蛋白结构域的Nogo 受体作用蛋白-1,在神经系统疾病中特异性表达。
近年来,越来越多证据表明LINGO-1在神经胶质瘢痕形成、细胞死亡及炎症反应中发挥重要作用。
LINGO-1会抑制少突胶质细胞活化,阻止轴突和髓鞘的形成和功能恢复,因此被认为是神经元存活、神经突延伸及轴突髓鞘化的负调节剂。
LINGO-1水平的变化与多种神经系统疾病的发生和发展存在一定联系。
该文对LINGO-1的生理功能进行阐述,并对LINGO-1在多发性硬化症、脊髓损伤、新生儿脑损伤及癫痫等神经系统疾病中的最新研究进展进行综述,旨在探寻神经系统疾病治疗的新策略。
儿童常见的神经系统疾病包括脊髓损伤(spinal cord injury,SCI)、新生儿脑损伤、癫痫、中枢神经系统(central nervous syetem,CNS)感染等,具有高致残率及病死率,严重威胁儿童健康[1 ]。
目前研究发现脑组织中富含亮氨酸重复序列和免疫球蛋白(Ig)结构域的Nogo 受体作用蛋白-1(LINGO-1)是神经再生的抑制因子,在髓鞘的形成和神经突的延伸中发挥重要作用,LINGO-1作为髓鞘再生治疗的新兴分子靶标,其表达水平可能是评估脑损伤严重程度的重要指标[2 ]。
本文主要综述了LINGO-1在多发性硬化症(multiple sclerosis,MS)、新生儿脑损伤、癫痫、SCI等神经系统疾病中的作用及机制,以期能够为神经系统疾病的治疗提供新思路。
1 LINGO-1的生物学功能1.1 LINGO-1的来源、结构和表达特点LINGO-1是一种重要的跨膜蛋白,由12个富含亮氨酸的重复序列和一个Ig结构域组成,共编码614个氨基酸。
LINGO-1基因位于15q24染色体上,具有强大的细胞外结构区域,包括N末端和C末端覆盖结构域、Ig结构域、一个跨膜结构域和一个短的细胞质尾部。
大鼠耳蜗组织中Nedd4及SGK1的表达

大鼠耳蜗组织中Nedd4及SGK1的表达钟时勋;刘兆华【摘要】目的研究大鼠耳蜗组织中神经前体细胞表达-发育性下调基因亚型(neural precursor celI-ex-pressed,developmentally downregulated isoforms,Nedd4)及血清糖皮质激素诱导激酶1(serum glucocorticoid-in-ducible kinase1,SGK1)蛋白分子的表达.方法选取健康Wistar大鼠8只.用特异性多克隆兔抗鼠Nedd4-1/2、Nedd4-2及SGK1抗体,采用免疫组化法研究大鼠耳蜗组织中Nedd4-1/2、Nedd4-2及SGK1蛋白的表达模式.结果 Nedd4-1/2、Nedd4-2及SGK1蛋白广泛表达于大鼠耳蜗组织的各个区域中,包括血管纹、螺旋韧带、Corti器、螺旋缘、螺旋神经节、前庭膜等处.结论在耳蜗组织中,存在一个由SGK1、Nedd4和上皮钠通道(ENaC)组成的Na+转运系统,它们协同作用转运Na+,从而保持内耳内环境的稳定.%Objective To investigate the cellular localization of the neural precursor cell-expressed, developmentally downregulated isoforms(Nedd4), Nedd4- 1/2 and Nedd4- 2, and the serum glucocorticoid- inducible kinasel(SGK1) in various subregions of the rat cochlea. Methods The expression patterns of Nedd4-1/2, Nedd42 and SGK1 in the cochlea of rat were studied by immunohistochemistry with the specific polyclonal rabbit antibodies against the rat Nedd4-1/2, Nedd4-2 and SGK1. Results All three proteins were extensively expressed in various regions of the rat cochlea. They were found in the stria vascularis, spiral ligament, organ of Corti, spiral limbus, spiral ganglion and Reissner's membrane. Conclusion Our findings suggest that there exists a Na+ transport system in the cochlea consisting of SGK1, Nedd4 isoforms andENaC, which may work in concert to transport Na+ and to maintain homeostasis in the inner ear as they do in other tight epithelia.【期刊名称】《听力学及言语疾病杂志》【年(卷),期】2009(017)004【总页数】4页(P369-372)【关键词】内淋巴;耳蜗;血清糖皮质激素诱导激酶1;神经前体细胞表达-发育性下调基因亚型【作者】钟时勋;刘兆华【作者单位】重庆医科大学附属第一医院耳鼻咽喉科,重庆,400016;第三军医大学附属大坪医院耳鼻咽喉科【正文语种】中文【中图分类】R339.16内淋巴为高钾低钠的溶液,由血管纹和前庭暗细胞分泌,在内淋巴囊、耳蜗外沟细胞、前庭移行细胞等处被重吸收。
与神经生长相关的神经系统特异性蛋白质

与神经生长相关的神经系统特异性蛋白质关键词:神经再生神经发育神经生长摘要与神经突起生长相关的神经系统特异性蛋白质是指神经系统特有的在发育或再生中能够促进神经突起生长,或能够决定和诱导神经突起沿正确方向生长的蛋白质因子。
该文对已知的该类蛋白质进行了综述。
关键词:神经系统特异性蛋白质;神经再生;神经发育;神经生长神经细胞是一类分化程度最高的细胞,具有神经系统特殊的功能。
执行这些功能的蛋白质可能是酶、受体以及酶和受体的调控子或其他一些蛋白质因子。
因此把仅在神经系统中出现而其他组织中没有或含量甚微,并且担负神经组织特异性功能的蛋白质称为神经系统特异性蛋白质。
神经系统特异性蛋白质在神经组织中分布广泛,种类较多,功能各异。
这些蛋白质具有一些共同的特点:在特异的神经组织中含量一般较低;分布在胶质细胞及神经元两大部位;担负同一或相近功能的往往是具有很大的保守性的一类家族性蛋白质;通常是在神经系统发育的某一阶段或某一病理状态下才表达出来。
1 发展概况对与神经损伤修复有关的特异性蛋白质的探索一直是神经科学研究的重要课题。
尤其是在20世纪50年代神经生长因子(nerve growth factor,NGF)的发现成为这一探索中的里程碑。
近20年来,随着分子生物学技术的广泛应用,很多相关的蛋白质被相继克隆和表达,并进行了功能研究。
值得注意的是以下两类蛋白质:一类是在神经损伤中促进神经突起生长的蛋白质,如围绕被切断的神经突起远端的雪旺细胞内发现的促神经生长的蛋白质――神经损伤诱导蛋白质(nerve injury-induced protein,Ninjurin)[1];另一类是在神经系统发育中决定神经突起沿正确方向生长的蛋白质,又可以分为诱导性蛋白质或抑制性蛋白质,如哺乳动物发育中诱导联合神经元生长锥突起向脊髓腹侧线的底板生长这一现象中起作用的netrins蛋白[2]等。
这些发现提示,在神经系统内存在这样一些蛋白质,它们在神经再生中能够促进神经突起生长,或在发育中能够决定和诱导神经突起向靶的方向生长。
JAK_STAT信号通路研究进展_宋舟

蛋白酪氨酸磷 酸 酶 (PTP)、细 胞 因 子 信 号 通 路 抑制因子 (SOCS)、活 化 STAT 的 转 录 活 性 抑 制 蛋 白(PIAS)是JAK-STAT 信号通路主要的负调控 因 子 (Clevenger,2004)。PTP 包 括 细 胞 质 PTP- SHP1/2、细 胞 膜 PTP-CD45、核 内 PTP、PTP1B、T 细 胞 PTP(TC-PTP)、PTPRT、PTPBL(Kim 等, 2010)。SHP-1 主 要 表 达 于 造 血 细 胞,通 过 与 细 胞 因子受体、c-Kit、JAKs等底物偶 联 进 行 脱 磷 酸 化 而 起负调控作用,属 于 胞 质 PTP,含 有 两 个 SH2 结 构 域。SHP1 通 过 其 SH2 区 与 酪 氨 酸 磷 酸 化 的 EPOR 结合,SHP1与 EPOR 结合后,通过其酪氨酸 磷酸酶活性使 JAK2 去 磷 酸 化 失 活,从 而 终 止 信 号 通路;CD45 高 表 达 于 造 血 细 胞 中,可 以 抑 制 JAKs 激酶使之去磷酸化,且 能 特 异 性 使 JAK1 的 Tyr去 磷酸化;核 内 PTP 可 能 参 与 STAT 的 去 磷 酸 化 作 用,在 STAT1 的 失 活 和 核 输 出 中 有 重 要 作 用; PTP1B 和 TC-PTP是 两 种 紧 密 联 系 的 蛋 白 酪 氨 酸 磷酸 酶,PTP1B 广 泛 分 布 于 各 种 组 织,TC-PTP 主 要分布 造 血 细 胞,PTP1B 在 瘦 素 (leptin)和 IFN-γ 作 用 后 结 合 到 JAK1 磷 酸 化 位 点,下 调 JAK2、
药物成瘾中的促成瘾和抗成瘾因子

药物成瘾中的促成瘾和抗成瘾因子中国药物依赖性杂志(ChinJDnlgDepend)2010,19(4):241—24[综述]药物成瘾中的促成瘾和抗成瘾因子冰许洁琼朱永平一(浙江大学医学院毒理研究室,杭州,310058)长期摄人成瘾药物可以导致突触内稳态分子功能的适应性变化,这可能是形成药物成瘾的关键因素.成瘾药物根据其不同的化学性质作用于不同的初级靶向分子,但是重复摄人不同成瘾物质最终都引起很多相同的成瘾特征.激活中脑边缘多巴胺系统回路可以强化药物的奖赏效应¨J.但最近的研究发现吗啡存在着非多巴胺依赖的独立奖赏通路-4J.中脑边缘多巴胺奖赏系统包括中脑腹侧被盖区(VTA),伏隔核(NAc),前额叶皮质及其他边缘地区,其中VTA—NAc多巴胺系统在药物的识别刺激作用上发挥作用-o.一旦形成药物依赖,它将会伴随终身,表现为强迫性的用药行为,强烈的药物渴求及复发.这是临床治疗药物依赖患者的一个重大难题.成瘾患者脑功能成像研究发现对药物渴求的产生与前额叶皮质的激活有关J.如反复暴露于苯丙胺(AMPH)会使树突的长度,棘突数目持久地增加,在复杂的环境下增加NAc和前额叶皮质树突状和脊椎密度的抗干扰能力.有研究证明,多次给予甲基苯丙胺(METH)可以导致前额叶皮质中细胞外信号调节激酶1/2(extracellularsignal—regulatedkinase,ERK1/2)激活系统的永久性损伤.这些结构和功能的异常可能在药物滥用包括药物依赖,精神和认知障碍的形成过程中起作用.转录因子的变化可能会导致基因表达的长期改变,从而促进药物依赖相关的神经元适应性变化…J.例如,长期诱导AFosB可以激活AP一1位点的转录,是许多成瘾药物使用后的常见现象.慢性给药诱导大脑中各种神经营养因子,细胞因子和蛋白酶的表达,它们在药物成瘾的发展和复发中起着关键的作用.这些药物成瘾内源性调节物国家重点基础研究发展计划(973计划)(2003CB515400)项目;浙江省科技计划重点项目(2005C23G20t0166)卫生部科学研究基金(省部共建项目计划)(WKJ2(X)7—2~007) 一通讯作者:E—mail:*************Tel:0571—8820813624l?质的功能分为两组,促成瘾和抗成瘾.前者包括碱性成纤维细胞生长因子(basicfibroblastgrowth factor,bFGF)¨,脑源性神经营养因子(brain—derivedneurotrophicfactor,BDNF)¨,组织纤溶酶原激活物(tissueplasminogenactivator,tPA)引,基质金属蛋白酶(matrixmetalloproteinase,MMP)一2和MMP一9_】,白细胞介素(interleukin,IL)和神经营养因子一3(neurotrophicfactor,NT一3),它们可以增加药物的奖赏效应,而后者如肿瘤坏死因子一o【(tumornecrosisfactor—,TNF—d)叫和胶质细胞源性神经营养因子(glialcellline—derivedneurotrophicfactor,GDNF)[21-22]降低药物的奖赏效应(见表1).表1内源性调节物质在药物依赖中的作用苯丙胺/甲基苯丙胺可卡因尼古丁吗啡乙醇1促成瘾因子1.1碱性成纤维细胞生长因子碱性成纤维细胞生长因子(basicfibroblast growthfactor,bFGF)是一个由146个氨基酸组成的多肽,作为一种神经营养因子,其神经活性广泛,可以促进中脑多巴胺细胞的生长,保护受损伤神经元的存活,促进突起生长和神经再生.大鼠长期使用AMPH可引起中脑腹侧被盖区(VTA)和黑质致密部(substantianigraparscompacta,SNc)中星形神经胶质中bFGF的免疫反应持续增加,但是这些现象在伏隔核(NAc)中并没有出现,另外在VTA内注入bFGF的中和抗体可以阻碍AMPH用药引起的行为242?敏化发展.使用抗成瘾药物NMDA拮抗剂可以对bFGF诱导的行为敏化发展起到抑制作用.这些结果显示bFGF是一个促成瘾因子,它是AMPH引起行为敏化的一个必要因素,它可以调节反复用药后因谷氨酸一多巴胺间相互作用而导致的长期后果.1.2脑源性神经营养因子脑源性神经营养因子(brain—derived neurotrophicfactor,BDNF)是一种碱性蛋白质,由119 个氨基酸残基组成,它是脑内分布最为广泛的神经营养因子,对发育中的交感,感觉与运动神经元的存活, 分化和增殖及保护运动神经元的退行性变均有促进作用.它作为神经营养因子家族的一员,与神经生长因子(NGF),神经营养因子一3(NT一3组)和NT一4/ 5一并增强多巴胺能神经元的生存能力和功能.在NAc中注人BDNF可以增强可卡因刺激引起的奖赏效应,且此增强作用在注射后一个月内均持续有效.另一方面,BDNF突变[BDNF一(+/一)]的小鼠相比于普通野生型小鼠不易形成可卡因导致的行为敏化.这些结果提示,在可卡因成瘾中BDNF可能发挥促成瘾的作用.进一步的研究发现,在大鼠毒品渴求模型中,大鼠脑内VTA,NAc和杏仁核中BDNF 水平升高,但NGF水平则未发生变化,然而在大鼠戒断期间BDNF水平不发生变化¨.这种呈时间相关性的BDNF水平增加表明,BDNF可能在可卡因渴求过程中有作用l_2.此外,前脑选择性删除BDNF后疼痛耐受仍正常的小鼠阿片戒断症状也明显得以减弱.再者,有研究显示,提前在NAc内注射抗BDNF或抗TrkB抗体可以显着抑制METH诱导的多巴胺释放以及多巴胺释放导致的相关行为.上述研究结果都支持BDNF是一种促成瘾因子,然而BDNF对酒精成瘾而言可能是一种抗成瘾因子,因为它可以减弱酒精引起的行为反应.与野生型小鼠相比,在BDNF突变小鼠[BDNF一(+/一)]实验中自主摄人酒精引起的奖励效应和行为敏化效果均会减弱.更重要的是,急性系统性的使用酒精或自主摄入酒精都可以导致小鼠背纹状体BDNF水平的增加.1.3组织型纤溶酶原激活物组织型纤溶酶原激活物(tissue—type plasminogenactivator,tPA)/纤溶酶(plasmin)是一种丝氨酸蛋白,由527个氨基酸组成,分子量为68000,它的分子结构多样化,存在单链和双链两种形式.tPA是血管内控制纤溶系统的关键酶,可以催化纤溶酶原转化为纤溶酶,在纤溶过程中发挥重要作用.中国药物依赖性杂志(ChinJDrugDepend)2010,19(4):241—246 tPA在中枢神经系统中表达丰富,它储存于突触小泡中,并通过去极化方式释放到细胞外.越来越多的研究结果显示,tPA可以影响突触可塑性和重建的多个方面,如轴突生长,神经元发展,长时程增强的晚期阶段及学习记忆能力[28-29].最新的研究发现,tPA是通过影响谷氨酸和多巴胺通路来调节神经传递和突触可塑性的豫j.在大鼠和小鼠体内单次注射吗啡可以激活纳洛酮敏感从而引起动物体内MAIr2阳性细胞的tPAmRNA和蛋白表达增加,这与NAc内酶的活性增加有关.除了吗啡,其他药物如甲基苯丙胺,尼古丁和乙醇也可以增加NAc内tPA的表达和活性.此外,药物成瘾可以促进NAc内tPA从突触后神经元释放到胞外空间,激活多巴胺D.和D受体33引,其中多巴胺D受体/蛋白激酶A(PKA)信号通路在调节NAc内tPA的释放中起着重要作用.对tPA缺陷[tPA~(一/一)]和纤维蛋白溶酶原缺陷[plg一(一/一)]小鼠的行为分析显示,tPA/plasmin系统在吗啡"I3,METH[他和尼古丁.]诱导的奖赏效应上发挥着关键作用.tPA缺陷小鼠重复注射吗啡和METH,其行为敏化受到抑制[17引.此外,tPA缺陷小鼠可以抑制酒精戒断后的癫痫发作,这说明tPA可能对酒精诱导的身体依赖发挥作用.tPA可以认为是精神依赖和身体依赖过程中的促成瘾因子.体内微透析的实验发现,在tPA缺陷小鼠中吗啡和尼古丁诱导NAc内多巴胺释放明显减少,而如果事先在NAc中微量注射tPA重组体或纤溶酶可以修复这个缺陷.这些结果表明,tPA/plasmin系统在调节吗啡和尼古丁诱导的NAc内多巴胺的释放中起关键作用Ⅲ.3,且tPA/plasmin系统在去极化诱导的NAc多巴胺释放中有显着作用¨.目前已经识别出蛋白酶激活受体1(PAR1—1)是tPA/plasmin系统调节NAc内多巴胺释放的靶点.METH可以诱导NAc内多巴胺的释放,多次注射METH后NAc内tPA的表达与多巴胺运载体(DA T)介导的纤溶酶诱导多巴胺释放有关.1.4白细胞介素白细胞介素(interleukin,IL)主要是由单个核细胞(包括淋巴细胞和单核一巨噬细胞)产生的一组免疫活性因子,作用于淋巴细胞,巨噬细胞和其他细胞,共同参与机体免疫反应,应激反应和炎症的调节.最新研究显示,细胞活素类物质在神经元发展,成熟,存活及再生方面发挥重要作用.例如,白细胞中国药物依赖性杂志(ChinJDrugDepend)2010,19(4):241—246 介素一1p(IL一1p),一种星形胶质细胞生长因子,它可以增加离体培养脊髓神经元的存活率.IL一6已经表明可以支持培养大鼠胆碱能和儿茶酚胺神经元的存活率,并保护PC12细胞免受神经毒素的损伤.METH可以通过激活B一肾上腺素受体诱导大鼠下丘脑IL一1[3mRNA的表达.IL一1B(原先是作为抗抑郁,抗可卡因和抗苯丙胺的靶点)是羟色胺转运体表达的一个强调节因子,它可能影响METH的作用.IL一2可能增强新颖环境和多巴胺摄取抑制剂GBR12909诱导的探索活动,表明该细胞因子对中脑多巴胺系统具有调节作用.事实上,IL一2可以增强苯丙胺和乙基氯代环唑星识别刺激能力.重复给予IL一6可以增加苯丙胺导致的行为敏化作用.相反,在IL一6基因敲除小鼠中METH诱导多巴胺和羟色胺神经毒性作用得到减弱,不过野生型小鼠和基因敲除小鼠体温或METH水平则没有差异.可卡因作为睫状神经营养因子(CNTF)IL一6 细胞因子家族的一员,慢性给予可以使针对Janus激酶(JAK2,Ⅵ'A里CNTF调节的蛋白酪氨酸激酶) 免疫反应性增加,但急性给药则不能.JAK2水平的增加可能与VTA内急性给予CNTF导致的反应增加有关.1.5神经营养因子一3神经营养因子一3(neurotrophicfactors一3,NT一3)是第三个被确认的神经营养因子,前两者分别为NGF和BDNF.NT一3是由119个氨基酸组成的碱性蛋白,它在周边和中枢神经系统中有助于神经元的生存和分化,同时促进新生神经元和突触的生长和分化.神经营养因子的化学物质,有助于促进和控制神经.急性注射可卡因可以使VTA内NT一3 mRNA水平短暂性增加.连续3d在VTA内注射NT一3使可卡因引起的行为敏化反应增加,而ras/ 丝裂原活化蛋白(MAP)激酶抑制剂PD98059可以阻断NT一3诱导的可卡因行为敏化.另外,VTA或NAe中的NT一3失效分别可以调节可卡因诱导大鼠行为可塑性.在VTA中注入NT一3的中和抗体可以加强可卡因诱导的行为敏化,而在NAC中注入NT一3抗体则增加可卡因诱导的过度活化行为.这些结果表明,NT一3激活ras/MAP激酶信号通路有助于可卡因诱导行为敏化的形成.1.6基质金属蛋白酶基质金属蛋白酶(matrixmetalloproteinases,MMPs)是一大类在结构上具有同源性,活性依赖243?zn或Ca的内肽酶,在血管生成,肿瘤生长及转移中起重要作用.MMPs构成的酶家族至今为止已识别出20多个成员,它们可以通过分解细胞外基质调节蛋白和细胞表面成分改变细胞外周环境.MMP的活性受其与MMP组织抑制剂(TIMPs)间相互作用的调节,而MMP/TIMP系统可以参与下列生物学事件:通过裂解细胞外基质蛋白结构方面的病理生理调节蜂窝结构功能和结构重塑,生长因子和细胞因子生物利用度,和膜受体的脱落J.基质金属蛋白酶一2(MMP一2和MMP一9)是与细胞粘附相关的裂解胶原Ⅳ,V,和层粘连蛋白硫酸软骨素蛋白多糖发挥作用的必要条件.MMP一9 在海马长时程增强和记忆中是必需的.在啮齿类动物中多次注射METH可以导致行为敏化,而此过程伴随着NAC和前额叶皮质内N一乙酰神经氨酸阳性神经元细胞和神经胶质酸性蛋白阳性胶质细胞MMP一2和MMP一9活性的增加.在MMP一2 和MMP一9一缺陷小鼠中,METH诱导的行为敏化, 奖赏效应及NAc内多巴胺释放都衰减.与此相反,在NAc内输注纯化人基质MMP一2可以显着提高METH诱导的多巴胺释放增加.在普通野生型小鼠中重复注射METH,可使吸收到纹状体突触体的[3H]多巴胺减少,但此现象不发生在MMP一2一(一/一)或MMP一9的(一/一)小鼠.因此可以推测,MMP一2和MMP一9通过调节METH引起NAc内多巴胺的释放和摄取,在METH诱导的行为敏化和奖赏效应中发挥促成瘾因子的作用l19].2抗成瘾因子2.1组织金属蛋白酶抑制剂组织金属蛋白酶抑制剂(tissueinhibitorofmetallopr0teinase,TIMPs)是机体内存在的MMPs天然抑制蛋白,它对由MMPs产生的基质降解起着重要的平衡作用.其中1TIMP一2蛋白可与活化的或无活性的MMP一9蛋白结合,抑制MMP一9蛋白的活性.最近研究发现,多次注射METH可伴随TIMP一2 表达的增加.反义TIMP一2的寡核苷酸可以提高METH行为敏化,这与NAc内METH诱导多巴胺释放的增加相关.相反,MMP一2/一9抑制剂可以阻碍METH诱导的行为敏化和奖赏效应,而这与NAc 内METH增加多巴胺释放能力的减弱相关.此外,反复使用METH可以使野生型小鼠前额叶皮质中多巴胺D:受体信号减弱,但在MMP一2(一/一)和MMP一9一(一/~)小鼠中则不出现此类现象.244?MMP/TIMP系统通过调节多巴胺的释放和受体信号参与METH诱导的行为敏化和奖赏效应l4.2.2肿瘤坏死因子一仪肿瘤坏死因子一仅(tumornecrosisfactor,TNF一)是一种单核因子,主要由单核细胞和巨噬细胞产生,它可以通过刺激迷走神经传人直接或间接地影响大脑功能.METH可以诱导C57BL/6小鼠大脑_4和人脑血管内皮细胞中肿瘤坏死因子一基因的表达.重复给予METH可以通过激活多巴胺受体NAc神经元内肿瘤坏死因子一mRNA和蛋白水平表达增加J.给予重组人肿瘤坏死因子一d能抑制METH诱导的奖赏效应,识别的刺激作用和多巴胺能神经毒性.相反,在肿瘤坏死因子一仅缺陷小鼠中METH作用效果增强.再者,肿瘤坏死因子一可以减弱DAT介导的METH引起的NAC内多巴胺释放,可以使在体和离体纹状体内多巴胺释放到突触体.这个神经细胞因子激活自身囊泡内多巴胺摄取,而削弱了METH引起的囊泡内多巴胺摄取.有人提出肿瘤坏死因子一通过激活质膜DAT和囊泡单胺转运体一2(VMAT一2),抑制METH诱导多巴胺释放,在METH诱导药物依赖和神经毒性中发挥神经保护作用...最近的一项研究表明,反复给予吗啡增加肿瘤坏死因子一Of.在NAC和纹状体的表达,TNF一(一/一) 缺陷小鼠吗啡的奖赏效应增强,这显示肿瘤坏死因子一可能减弱吗啡引起的奖赏效应.另外,在体外试验中肿瘤坏死因子诱导神经元神经营养因子GDNF的表达J,提示它与促成瘾因子间存在相互作用.2.3胶质细胞源性神经营养因子胶质细胞源性神经营养因子(glialcellline—derivedneurotrophicfactor,GDNF)是从大鼠的胶质细胞株I349中提纯到的一种新的营养因子,能有效地促进多巴胺能神经元的存活和分化.该因子属于转化生长因子B超家族中的远亲,鼠源GDNF晶体结构分析也表明,它与转化生长因子p:有着十分相似的结构,但是GDNF与转化生长因子B家族中其他成员的同源性均<20%.这种细胞因子通过Ret受体(胶质细胞源性神经营养因子受体Ret)酪氨酸激酶和GDNF家族受体(GFR(x1)发挥生物活性.Ret受体可以与四个GDNF家族成员结合,它通过识别GFRod来特异性结合GDNF.GDNF首先与同源GFRod结合来激活Ret酪氨酸激酶4J.中国药物依赖性杂志(ChinJDrugDepend)2010.19(4):241~246 在VTA中注人GDNF降低机体对慢性可卡因给药的生物化学适应性(诱导的酪氨酸羟化酶,NMDA受体的NR1亚单位,hFosB和PKA催化亚单位),这与减弱可卡因的奖赏效应有关.相反,在大鼠VTA中注射抗GNDF抗体及在GDNF缺陷小鼠(GDNF一(+/一)),可卡因的作用得到增强.慢性可卡因给药不影响中脑多巴胺系统中GFRc~I和Ret蛋白水平,但它可以显着降低Ret的磷酸化水平.以上结果暗示,慢性可卡因给药降低VTA总GDNF信号,从而导致在之后的给药过程中增加动物的行为敏化.最近研究显示,Ⅵ1A中的GDNF可以抑制酒精成瘾.因此,在VTA中注射微量GDNF可以显着抑制酒精的摄入¨引.可能抗成瘾药物伊菠加因(抗抑郁药)可以增加GPNFmRNA和蛋白水平的表达,激活GDNF信号,从而减少酒精的摄人和复发j.此外,GDNF缺陷一(+/一)小鼠与普通野生型小鼠相比吗啡的奖赏效应增强.因此,可以推测GDNF在可卡因,酒精和吗啡成瘾中起抗成瘾的作用¨'1.分别采用静脉自身给药模型和GDNF缺陷(+/一)小鼠的恢复觅药行为模型,来研究GDNF在METH成瘾建立和复吸上的作用引.该研究结果表明,GDNF可以增强METH的自身给药,加强METH的渴求动机,增强药物诱导和长线索诱导的METH觅药行为的恢复.与此相反,同窝出生的GDNF缺陷(+/一)和野生型动物中,在新颖环境反应,METH诱导快速移动行为和敏化,食物强化的操作行为和动机,食物寻求行为的恢复等因素上没有差异.这些结果表明,GDNF是METH成瘾形成和复吸过程中的一种强抗成瘾因子.3结语在给予成瘾药物的过程中,大脑会生成各种细胞因子和蛋白酶,它们或是促成瘾的,或是抗成瘾的.促成瘾因子增强药物的奖赏效应,促进药物成瘾的形成;抗成瘾因子减弱奖赏效应,阻碍药物成瘾的发展.一个强作用的抗成瘾因子GDNF不仅在药物成瘾的发展阶段起抑制作用,还能在抑制药物成瘾复发上起作用.在促成瘾因子和抗成瘾因子间可能存在相互作用,大脑内两者的平衡变化在药物成瘾的形成和复发上发挥关键作用.对这些内源性物质进行调节可能会对成瘾依赖的治疗开辟新的方向.中国药物依赖性杂志(ChinJDrugDeoend)2010.19(4):241—246?245?4参考文献[1]BerkeJD,HymanSE.Addiction,dopamine,andthemolecularmechanismsofmemory[J] .Neuron,2000,25(3):515—532[2]NestlerEJ.Isthereacommonmolecularpathwayforaddiction[J].NatNeurosci,2005,8(1 1):1445—1449[3]MizoguchiH,Y amadaK,MizunoM,eta1.Regulationsofmethamphetaminerewardbyextracellularsignal—regulatedkinase1/2/ets—likegene一1signalingpathwayviatheactivationofdopaminereceptors[J].MolPharmacol,2OO4,65(5 ):1293—1301[4]HnaskoTS,SotakBN,PalmiterRD.Morphinerewardindoparnine—deficientmice[J].Nature,2005,438(7069):854—857[5]OlsonVG,HeusnerCL,BlandRJ,eta1.Roleofnoradrenergicsignalingbythenucleustract ussolitariusinmediatingopiatereward[J].Science,2006,311(5763):1017—1020[6]MunzarP,GoldbergSR.Dopaminergieinvolvementinthediscriminative—stimuluseffectsofmethamphetamineinratse[J].Psychopharmaeology,2000,148(2):209—216[7]K~va$PW,V olkowND.Theneuralbasisofaddiction:flpathologyofmotivationandchoic e[J].AmJPsychiatry,2005,162(8):1403—1413[8]GoldsteinRZ,V olkowND.Drugaddictionanditsunderlyingneumbiologiealbasis:neur oimagingevidencefortheinvolvementofthefrontalcortex[J].AmJPsychiatry,2002,159(10):1642—1652[9]KolbB,GornyG,LiY,eta1.Amphetamineorcocainelimitstheabilityoflaterexperienceto promotestructuralplasticityintheneoco~exandnucleusaccumbens[J].ProcNatlAeadSci,2003,100(18):10523—10528 [10]KameiH,NagaiT,NakanoH,eta1.Repeatedmethamphetaminetreatmentimpaimreco gnitionmemorythroughafailureofnovelty—inducedERKI/2activationintheprefrontalcortexofmice[J].BiolPsychiatry,2006,59(1):75—84[11]NestlerEJ.Molecularbasisoflong—termplasticityunderlyingaddiction[J].NatRevNeurosei,2001,2(2):119—128[123Y amadaK,NabeshimaT.Pro—andanti—addictiveneurotrophiefactorsandcytokinesinpsyehostimalantaddiction:minireview[J].AnnNYAcadSci,2004,1025:198—204[13]Y amadaK,NagaiT,NabeshimaT.Drugdependence,synapticplasticity,andtissueplas minogenactivator[J].JPharmacolSci,2005,97(2):157—161[14]RonD,JanakPH.GDNFandaddiction[J].RevNeurosci,2005,16(4):277—285[15]FloresC,SamahaAN,StewartJ.Requirementofendogenousbasicfibroblastgrowthfac torforsensitizationtoamphetamine[J].JNeurosci,2000,20(2):RC55:1—5[16]GrimmJw,LuL,HayashiT,eta1.Time—dependentincreasesinbrain—derivedneurotrophiefactorproteinlevelswithinthe mesolimbicdopaminesystemafterwithdrawalfromcocaine:implicationsforincubationofc ocainecraving[J].JNeurosci,2003,23(3):742~747[17]NagaiT,YamadaK,Y oshimuraM,eta1.Thetissueplasminogenactivator—plasminsystemparticipatesintherewardingeffect ofmorphinebyregulatingdopaminerelease[J].ProcNatAcadSci,2004,101(10):3650—3655[18]NagaiT,NodaY,IshikawaK,eta1.Theroleoftissueplasminogenactivatorinmethamph etamine—relatedrewardandsensitization[J].JNeurochem,2005,92(3):660—667[19]MizoguchiH,Y amadaK,NiwaM,eta1.Reductionofmethamphetamine—inducedsensitizationandrewardinmatrixmetalloproteinase一2and一9一defcientmice[J].JNeurochem,2007,100(6):1579—1588[203NakajimaA,Y amadaK,NagaiT,eta1.Roleoftumornecrosisfactor—alphainmethamphetamine—induceddrugdependenceandneurotoxicity[J].JNeurosci,2004,24(9):2212—2225[21]MesserCJ,EisehAJ,CarlezonWAJr,eta1.RoleforGDNFinbiochemicalandbehavioral adaptationstodrugsofabuse[J].Neuron,2000,26(1):247—257[22]Y ahY,Y amadaK,NiwaM,eta1.Enduringvulnerabilitytoreinstatementofmethamphet amine—seekingbehavioringlial—cell—line—derivedneurotrophicfactormutantmice[J].FASEBJ,2007,21(9):1994—2004 [23]AkbafianS,RiosM,LiuRJ,eta1.Brain—derivedneurotrophicfactorisessentialforopiate—inducedplasticityof noradrenergieneurons[J].JNeurosci,2002,15(10):4153—4162[24]NaritaM,AokiK,TakagiM,eta1.Implicationofbrain—derivedneurotrophicfactorinthereleaseofdopamineanddopamine—relatedbehaviorsinducedbymethamphetamine[J].Neuroscience,2003,119(3):767—775 [25]McGoughNN,HeDY,LopML,eta1.RACK1an. dbrain—derivedneurotrophicfactor:ahomeostaticpathwaythatregulates alcoholaddiction[J].JNeurosci,2004,24(46):10542—10552[26]ZhangY,KanahoY,FrohmanMA,eta1.PhospholipaseD1一promotedreleaseoftissueplasminogenactivatorfacilitatesneuriteoutgrowth[J].JNeurosci,2005,25(7):1797—1805[27]LochnerJE,HonigmanLS,GrantWF,eta1.Activity—dependentreleaseoftissueplasminogen.activatorfromthedendritic spinesofhippocampalneuronsrevealedbylive—cellimaging[J].JNeurobiol,2006,66(6):564—577246?中国药物依赖性杂志(ChinJDrugDepend)2010,19(4):241—246[28]CalabresiP,NapolitanoM,CentonzeD,eta1.Tissueplasminogenactivatorcontrolsmul tipleformsofsynapticplasticityandmemory[J].EurJNeurosci,2000,12(3):1002—1012[29]MatagaN,MizuguchiY,HenschTK.Experience—dependentpruningofdendriticspinesinvisualcortexbytissueplasminogenactivator[J].Neuron,2004,44(6):1031—1041[30]NicoleO,DocagneF,AliC,eta1.Theproteolyticactivityoftissue—plasminogenactivatorenhancesNMDAreceptor—mediatedsignaling[J].NatMed,2001,7(1):59—64[31]It0M,NagaiT,KameiH,eta1.Involvementoftissueplasminogenactivator—plasminsystemindepolarization—evoked dopaminereleaseinthenucleusaccumbensofmice[J].MolPharmacol,2006,70(5):1720—1725[32]SamsonAL,MedcalfRL.Tissue—typeplasminogenactivator:amultifacetedmodulatorofplasticity[J].Neuron,2006,so(so):673—678ionandsynaptic[33]NagaiT,hoM,NakamiehiN,eta1.Therewardsofnicotine:regulationbytissueplasmino genactivator—plasminsystemthroughproteaseactivatedreceptor一1[J].JNeurosei,2006,26(47):12374—12383 [34]PawlakR,MelchorJP,MatysT,eta1.Ethanol—withdrawalseizuresarecontrolledbytissueplasminogenactivatorvia modulationofNR2B—containingNMDAreceptors[J].ProcNatlAcadSei,2005,102(2):443—448[35]It0M,NagaiT,MizoguchiH,eta1.Activationofpost—synapticdopamineD(1)receptorspromotesthereleaseoftissue plasminogenactivatorinthenucleusaccumbensviaPKAsignaling[J].JNeurochem,2007,1 03(6):2589—2596[36]NagaiT,KameiH,ItoM,eta1.Modificationbythetissueplasminogensctivator—plasminsystemofmorphine—induced dopaminereleaseandhypedocomotion,butnotanti—nociceptiveeffectinmice[J].JNeurochem,2005,93(5):1272—1279[37]Y anY,Y amadaK,MizoguehiH,eta1.Reinforcingeffectsofmorphinearereducedintissu eplasminogenactivator—knockoutmice[J].Neuroscience,2007,146(1):50—59[38]ItoM,NagaiT,MizoguchiH,eta1.Possibleinvolvementofprotease—activatedreceptor一1intheregulationofmorphine—induceddopaminereleaseandhyperlocomotionbythetissueplasminogenactivator—plasminsystem[J].JNeurochem,2007,101(5):1392—1399[39]FukakusaA,NagaiT,MizoguchiH,eta1.Roleoftissueplasminogenactivatorinthesensi tizationofmethamphetamine—induceddopaminere]easeinthenucleusaccumbens[J].JNeurochem,2008,105(2):436-444 [40]Y ongVW,PowerC,ForsythP,eta1.Metalloproteinasesinbiologyandpathologyofthen ervoussystem[J].NatRevNeurosci,2001,2(7):502—511[41]NagyV,BozdagiO,MatyniaA,eta1.Matrixmetalloproteinase一9isrequiredforhippocampallate—phaselong—termpotentiationandmemory[J].JNeurosci,2006,26(7):1923—1934[42]MizoguchiH,Y amadaK,MoufiA,eta1.Roleofmatrixmetalloproteinaseandtissueinhi bitorofMMPinmethamphetamine—inducedbehavioralsensitizationandreward:implicationsfordopaminereceptordown—regulationanddopaminerelease[J].JNeurochem,2007,102(5):1548—1560[43]FloraG,LeeYW,NathA,eta1.Methamphetamine—inducedTNF—alphageneexpressionandactivationofAP一1indiscreteregionsofmousebrain:potentialroleofreactiveoxygenintermediatesandlipidperoxidation [J].NeuromolecularMed,2002,2(1):71—85[4J4]LeeYw,ttennigB,Y aoJ,eta1.MethamphetamineinducesAP一1andNF—kappaBbindingandtransaetivationinhumanbrainendothelialcells[J].JNeurosciRes,2001,66(4):583—591[45]NiwaM,NittaA,Y amadaY,eta1.Tumornecrosisfactor—alphaanditsinducerinhibitmorphine—inducedrewardingeffectsandsensitization[J].BiolPsychiatry,2007,62(6):658—668'[46]NiwaM,NittaA,Y amadaY,eta1.Aninducerforglialcellline—derivedneurotrophicfactorandtumornecrosisfactor—alpha protectsagainstmethamphetamin?。
慢性脑缺血大鼠皮层、海马区BDNF及其受体TrKB的表达与认知功能障碍

论文分类号R741.05 单位代码 10183密级公开研究生学号 2005732122吉林大学硕士学位论文慢性脑缺血大鼠皮层、海马区BDNF及其受体TrKB的表达与认知功能障碍Cognitive impairment and Expression of BDNF、TrKB of cortex and hippocampus in chronic cerebral ischemia rats作者姓名:尹昌浩专业:神经病学导师姓名:冯加纯及职称:教授学位类别:医学硕士论文起止年月:2007年1月至2008年4月吉林大学硕士学位论文原创性声明本人郑重声明:所呈交的硕士学位论文,是本人在指导教师的指导下,独立进行研究工作所取得的成果。
除文中已经注明引用的内容外,本论文不包含任何其他个人或集体已经发表或撰写过的作品成果。
对本文的研究做出重要贡献的个人和集体,均已在文中以明确方式标明。
本人完全意识到本声明的法律结果由本人承担。
学位论文作者签名:日期:年月日中国优秀博硕士学位论文全文数据库》投稿声明研究生院:本人同意《中国优秀博硕士学位论文全文数据库》出版章程的内容,愿意将本人的学位论文委托研究生院向中国学术期刊(光盘版)电子杂志社的《中国优秀博硕士学位论文全文数据库》投稿,希望《中国优秀博硕士学位论文全文数据库》给予出版,并同意在《中国博硕士学位论文评价数据库》和CNKI系列数据库中使用,同意按章程规定享受相关权益。
论文级别:■硕士□博士学科专业:神经病学论文题目:慢性脑缺血大鼠皮层、海马区BDNF及其受体TrKB的表达与认知功能障碍作者签名:指导教师签名:年月日作者联系地址(邮编):吉林大学第一医院神经内科(130021)作者联系电话:作者姓名尹昌浩论文分类号 R741.05 保密级别公开研究生学号 2005732122 学位类别医学硕士授予学位单位吉林大学专业名称神经病学培养单位(院、所、中心)吉林大学第一医院研究方向慢性酒精中毒和脑血管病学习时间2005 年9 月至2008年 6 月论文中文题目慢性脑缺血大鼠皮层、海马区BDNF及其受体TrKB 的表达与认知功能障论文英文题目Cognitive impairment and Expression of BDNF、TrKB of cortex and hippocampus in chronic cerebral ischemia rats关键词(3-8个)关键词:慢性脑缺血;Morris 水迷宫;记忆;内源性神经保护;BDNF;TrKB;姓名冯加纯职称教授导师情况学历学位博士工作单位吉林大学第一医院论文提交日期2008年4月14日答辩日期2008年5月8日是否基金资助项目否基金级别及编号如已经出版,请填写以下内容出版地(城市名、省名)出版者(机构名称出版日期出版者地址(包括邮编)内容提要目的研究慢性脑缺血的损伤机制和慢性脑低灌注中额颞叶皮层、海马区BDNF-TrKB的表达变化规律,明确其内源性的保护机制及其对慢性脑缺血后认知功能的影响。
caspase家族及在细胞凋亡中的作用
caspase家族及在细胞凋亡中的作用admin注:本文仅是基础知识,目前这方面进展十分快,需要更新更多的知识。
如caspase家族目前发现至少14种。
这里仅介绍几种常见的成员。
目的是让大家了解到caspase家族的概况,以及在细胞凋亡中的作用。
一caspase家族蛋白酶的组成未活化的caspase家族蛋白酶是以酶原形式存在的,酶原的氨基端有一段被称为“原结构域”(pro-domain)的序列.酶原活化时不但要将原结构域切除,并且要将剩余部分剪切成一大的形式组成的。
这一小两个亚基,分别称为P20和P10,活性酶就是由这两种亚基以(P20/P10)2种活化反应也是Asp特异的,剪切发生在酶原中保守序列的Asp与其后的氨基酸残基之间,一般是先切下羧基端的小亚基,然后再从大亚基的氨基端切去原结构域.这种剪切可以是酶原及中间活性酶自我催化,也可以是其它ICE家族蛋白酶的作用,还有其它酶类如颗粒酶B参与。
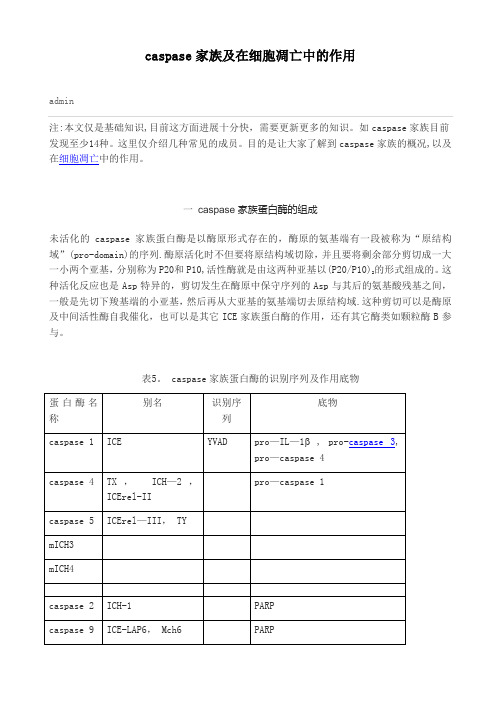
表5。
caspase家族蛋白酶的识别序列及作用底物已命名的caspase家族成员均已克隆成功,它们不但在氨基酸序列上具有同源性,而且在空间结构上也很相似。
目前已经获得了caspase—1(ICE)和caspase—3(CPP32)的X线结晶图像,结果显示它们具有相似的空间结构,在P20的C端和P10的N端有200多个氨基酸残基的序列尤为保守,在空间结构上组成相似的β折叠中心和相邻的α螺旋,保守的、对蛋白酶活性有特殊意义的氨基酸残基均位于这一段,并形成特定的结构。
不同源的序列主要存在于P20的N端和P20与P10交界处,这两个部位的氨基酸残基在蛋白酶活化过程中一般被全部或部分切除。
所有的成员都保守性地包含有与底物P1Asp作用的氨基酸残基,如在ICE中,它们是催化中心的Cys285,与酶/抑制剂复合物的巯基半缩醛以氢键结合的His237,以及可以稳定反应中间物氧阴离子的Gly238。
另外,Arg179、Arg341、Gln383和Ser347形成容纳P1Asp的“口袋”,Ser339靠近Cys285的巯基,以氢键结合P1位的酰胺。
黄芩的有效成分

黄芩的有效成分炎症反应作为一种基本病理过程与许多常见炎症性疾病有着密切的联系,并且随着现代研究的不断深入,越来越多影响人类健康的疾病如高血压、糖尿病、癌症等也逐渐被发现与炎症反应有着密切的联系。
中药黄芩来源于唇性科黄芩属植物黄芩Scutellariabaicalensis的干燥根,是一种十分常见的中药材,在我国有着悠久的使用历史,它始载于《神农本草经》,性味苦寒,有清热燥湿之功效,主要用于湿热证,证见发热胸痞、食欲不振、小便短少、舌苔黄腻等。
黄芩的化学成分有黄酮类、酚酸类、苯乙醇、氨基酸、甾醇、精油、微量元素等。
其活性成分主要为黄酮类化合物,包括黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、新黄芩素等,研究表明它们都具有一定的抗炎作用,能够减少肿瘤坏死因子-α(TNF-α),白细胞介素-1β(IL-1β)等重要炎症介质的释放并且抑制细胞毒性分子一氧化氮(NO)的产生,从而对机体产生保护作用。
近年来通过对黄芩抗炎作用的不断研究,黄芩有效成分的抗炎作用机制也逐渐被人们所掌握,其中就包括对炎症通路的阻断作用,黄芩中多种有效成分能够作用于炎症通路中的关键靶蛋白影响其活性从而抑制炎症反应的发生,但在众多研究中,研究者往往仅从单个蛋白或者单条通路探讨黄芩有效成分对其中的影响,缺乏一定的整体性。
本文从黄芩有效成分在炎症通路中的作用为出发点,就黄芩有效成分在整个炎症通路中作用的靶蛋白做一个较为全面的总结,为黄芩抗炎作用的进一步研究与应用提供参考。
1对TLR通路的影响Toll样受体蛋白(Toll-likereceptors,TLR)最初是在果蝇体内发现的一种信号转导蛋白,在果蝇的发育和免疫反应中有重要的作用。
随着研究的不断深入,人们发现在哺乳动物体内也同样存在着Toll样受体蛋白,并将这种蛋白统一归为TLR 家族。
它们能够结合一些病原体或其产物共有的特定分子结构来进行识别,还可以对不同病原体的相关分子结构进行识别继而引发一系列的信号转导,从而导致炎症介质的释放,并最终激活获得性免疫反应。
水通道蛋白4示踪系统的构建及评价

利用 硅 胶膜 型 m 质粒 D A小 量 提取 试剂 盒 提 N 取和 纯 化前 述 融 合质 粒 , 分别 用 内切 酶 Hidm和 n
道 蛋 白家族 , 要与水 的跨膜 转运 有关[ 主 4 1 中枢 神 。在 经系 统 , P AQ 4是 最主 要 的 A P 主要 分布 于 星形 胶 Q ,
epr e t t c g ytm f F l e d Q 4 a sces l cnt ce. T e a r xe m n, r i ss o G P a l A P w s u csf l o s td h w t i an e be uy u r e pr ebly ea ao yt a s b se o a at cts epes g AQ 4 T e w t e ait vl t n ss m w s et lh d f rt s oye xrsi P . h a r m i ui e ai r r n e
T e ls is E F - adtesq e c Q 4 3w r gtd G Pw i ct tte a io h am d G P 1 n e un eA P- eel ae. F hc l a d a h m n p p C h M2 i ho e
tr ia o A P . 3 dd nta ette lct n o Q 4M2 n cl m mba e C mprd e nl f Q 4M2 i o f c h oa o fA P . 3 o e e rn . o ae m f i l wt h o・ Q 4M2 一xrse T —N 2 at ct ,te w t e ebly icesd u o i te n nA P 一 3epesd C X T A s oy s h a rpr ait nrae p t h r e e m i 5 fls n h Q 4M2 一 pesd C X T A at et od i e A P - 3e rse T —N 2 s oye t x r s < OO ) Co c s n I u .1 . n l is uo n or
蛋白质表达的亚细胞定位及其在细胞生理学中的应用研究

蛋白质表达的亚细胞定位及其在细胞生理学中的应用研究蛋白质是细胞内最基本的分子组成单位,它在细胞生理学中起着至关重要的作用。
了解蛋白质的亚细胞定位是研究其功能和调控机制的关键一步。
随着科技的发展和技术手段的改进,人们对于蛋白质表达的亚细胞定位有了更深入的认识。
本文将探讨蛋白质亚细胞定位的研究方法和其在细胞生理学中的应用。
一、蛋白质亚细胞定位的研究方法1. 免疫共沉淀(immunoprecipitation)免疫共沉淀是通过特异性的抗体与目标蛋白质结合,进而将蛋白质-抗体复合物沉淀下来。
通过这种方法可以精确地确定蛋白质与其他细胞组分之间的相互作用关系,并推测其亚细胞定位。
2. 免疫荧光染色(immunofluorescence)免疫荧光染色是通过将特异性抗体与荧光染料结合,使其能够与特定蛋白质结合。
这种方法可以直接观察蛋白质在细胞中的分布情况,并判断其亚细胞定位。
3. 蛋白质组学(proteomics)蛋白质组学是通过全面分析蛋白质组成和表达水平,探索蛋白质在细胞中的定位和功能。
通过检测细胞内不同组分中蛋白质的表达水平和亚细胞定位,可以更全面地了解蛋白质在细胞内的分布规律。
二、蛋白质亚细胞定位的研究进展1. 细胞器定位细胞器定位是研究蛋白质亚细胞定位的重要方面。
通过免疫染色等方法,已经确定了许多蛋白质的定位,例如线粒体、内质网、高尔基体等。
这些发现为我们进一步了解细胞器功能和调控提供了重要线索。
2. 信号序列研究蛋白质的亚细胞定位通常与其信号序列有关。
研究人员通过对信号序列的分析,可以预测蛋白质的亚细胞定位,并验证其功能。
这一研究领域已经取得了很大进展,并为我们理解蛋白质定位和功能提供了依据。
三、蛋白质亚细胞定位在细胞生理学中的应用1. 疾病诊断与治疗蛋白质亚细胞定位在疾病的诊断和治疗中发挥着重要的作用。
通过研究蛋白质在正常和疾病细胞中的定位差异,可以发现一些疾病的标志物,并为疾病的早期诊断提供依据。
