有机化学 钅羊盐 钅羊字
有机化学的基本概念

29 油脂:高级脂肪酸的甘油酯,一般在室温是液体的称为油,是固体或半固体的 称为脂。
30 官能团:各类烃的衍生物都具有自己特有的化学性质,这些特有的化学性质主 要是由取代氢原子的原子或原子团所决定的,在化学上将这种决定化合物化学特性 的原子或原子团称为官能团。 31 轮烯:一类单双键交替出现的环状烃类化合物。 32 甾族化合物:是指含有环戊并全氢化菲基本骨架(简称甾环)的一大类化合物。 这类化合物通常都含有二个角甲基和一个烃基。用甾族来命名这一整类化合物,是 因为甾字是一个象形字,它暗含了这一类化合物的结构特征,甾下半部的“田”暗 指结构中有四个环,甾上半部的“巛”暗指结构中有两个角甲基和一个烃基。 33 环烷烃:分子中含有环状结构的烷烃叫环烷烃。又称为脂环化合物。 34 烃:由碳和氢两种原子组成的有机化合物称为烃。 35 烃的衍生物:烃分子中的一个或几个氢原子被其它元素的原子或原子团取代后 的生成物称为烃的衍生物。
7 半缩醛或半缩酮:醇具有亲核性,在无水和酸性催化剂如对甲苯磺酸、氯化 氢的作用下,很容易和醛酮发生亲核加成,一分子醛或酮和一分子醇加成的生成 物称为半缩醛或半缩酮。
8 有机化合物:除一氧化碳、二氧化碳、碳酸盐等少数简单含碳化合物以外的 含碳化合物。 9 多肽:一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,形成一个 酰氨键,新生成的化合物称为肽,肽分子中的酰氨键叫做肽键。二分子氨基酸失 水形成的肽叫二肽,多个氨基酸失水形成的肽叫多肽。 10 杂环化合物:在有机化学中,将非碳原子统称为杂原子,最常见的杂原子 是氮原子、硫原子和氧原子。环上含有杂原子的有机物称为杂环化合物。分为两 类,具有脂肪族性质特征的称为脂杂环化合物,具有芳香特性的称为芳杂环化合 物。因为前者常常与脂肪族化合物合在一起学习,所以平时说的杂环化合物实际 指的是芳杂环化合物。杂环化合物是数目最庞大的一类有机物。 11 多环烷烃:含有两个或多个环的环烷烃称为多环烷烃。 12 共轭烯烃:单双键交替出现的体系称为共轭体系,含共轭体系的多烯烃称 为共轭烯烃。
羊经的一半

羊经的一半
羊经的一半:
羟。
笔画:
意思:
〔~基〕化学名词,由氢和氧两种原子组成的一价原子团。
也叫氢氧基。
羊名。
形声。
字从羊从巠,巠亦声。
“巠”义为“绷紧的”、“僵直的”。
“羊”与“巠”联合起来表示“羊的肌肉绷紧”。
《说文·羊部》:“羟,羊名。
”
扩展资料:
1、羟基,也叫氢氧基。
有机化合物分子里的一种官能团。
是醇类(如乙醇)、酚类(如苯酚)等的官能团。
2、羟胺,有机化合物,化学式NH2OH。
白色薄片状、针状晶体或无色油状液体,有腐蚀性。
可用作还原剂或用于有机合成。
也叫胲。
3、羟氨基,含有羟胺的一价基——NHOH。
4、羟锈宁,内吸性光谱三唑类拌种用杀菌剂。
原药具微臭味。
在正常情况下对光、热稳定。
制剂为红色粉末,具微臭味,不溶于水。
主要用于防治小麦和其他禾谷类作物的散黑穗病、腥黑穗病、锈病、白粉病等。
低毒。
原药大鼠口服LD50700—1200mg/kg。
对鱼类、鸟类低毒。
5、羟基化,向有机化合物分子中引入羟基的反应。
通过羟基化反应可制得醇类与酚类化合物。
这两类物质在精细化工中具有广泛的用途,主要用于生产合成树脂、各种助剂、染料、农药、表面活性剂、香料和食品添加剂等。
另外,通过酚羟基的转化反应还可以制得烷基酚醚、二芳醚、芳伯胺和二芳基仲胺等许多含其他官能团的重要中间体和产物。
化学元素读音及其性质

1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí)5 硼(pãng) 6碳(tàn) 7氮(dàn)8 氧(yǎng) 9氟(fú)10 氖(n ǎi)11钠(nà) 12镁(měi) 13铝(lǚ)14 硅(guī)15 磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà)19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài)23 钒(fán) 24铬(gâ) 25锰(měng) 26铁(tiě) 27钴(gǔ)28 镍(niâ)29 铜(tïng)30 锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù)36 氪(kâ)37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní)42 钼(mù) 43锝(dã) 44钌(liǎo) 45铑(lǎo) 46钯(bǎ) 47银(yín) 48镉(gã)49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì)53 碘(diǎn) 54氙(xiān)55铯(sâ) 56钡(bâi) 57镧(lán) 58铈(shì) 59镨(pǔ)60 钕(nǚ)61 钷(pǒ) 62钐(shān) 63铕(yǒu)64 钆(gá) 65铽(tâ) 66镝(dī) 67钬(huǒ)68 铒(ěr) 69铥(di ū)70 镱(yì) 71镥(lǔ) 72铪(hā)73 钽(tǎn) 74钨(wū) 75铼(lái) 76锇(ã) 77铱(yī) 78铂(bï)79 金(jīn) 80汞(gǒng) 81铊(tā) 82铅(qiān)83 铋(bì) 84钋(pō)85砹(ài)86 氡(dōng)87钫(fāng) 88镭(lãi)89 锕(ā) 90钍(tǔ)91 镤(pú) 92铀(yïu) 93镎(n á)94 钚(bù)95 镅(mãi) 96锔(jú)97 锫(pãi)98 锎(kāi) 99锿(āi) 100镄(fâi) 101钔(mãn) 102锘(nuî)103 铹(láo)104 钅卢(lú) 105钅杜(dù)106钅喜(xǐ)107钅波(bō)108 钅黑(hēi)109 钅麦(mài)110 钅达(dá) 111钅仑(lún)五个字五个字背顺序名称字母是必背的初中只需背前20个相对质量不用背考试时卷子上会告诉你的前20号元素1 H 氢1.0079(相对原子质量)化学元素周期表2 He 氦4.00263 Li 锂6.9414 Be 铍9.01225 B 硼10.8116 C 碳12.0117 N 氮14.0078 O 氧15.999 4(3) 9 F 氟18.998 10 Ne 氖20.17 11 Na 钠22.9898 12 Mg 镁24.305 13 Al 铝26.982 14 Si 硅28.085 15 P 磷30.974 16 S 硫32.06 17 Cl 氯35.453 18 Ar 氩39.94 19 K 钾39.098 20 Ca 钙40.08其余需要背的就是金属活动顺序表K -jia Ca -gai Na- na Mg -mei Al -lv Zn - xin Fe- tie Sn -xi Pb- qian H -qing Cu -tong Hg- gong Ag- yin Pt- bo Au -jin价态表一价钾钠氯氢银二价氧钙钡镁锌三铝四硅五价磷二三铁二四碳二四六硫都齐全代数化合价和为零还有就是哪些盐可溶哪些盐不可溶。
大学有机化学性质总结

大学有机化学性质总结大学有机化学性质总结酯类化合物有机化学复习资料化学性质烷烃及环烷烃的化学性质:1.烷烃卤代反应2.环烷烃加成反应(加氢,加卤素,加卤化氢)烯烃的化学性质:1.加成反应(加氢,加水,加卤素,加次卤酸反式加成,自由基加成ROOR)马氏规则的应用(形成稳定的经已碳离子);个别化合物,要考虑甲基、氢的重排。
在过氧化物存在下所,与HBr的自由基加成,反马氏规则。
烯烃的硼氢化-氧化反应条件:BH3或B2H6→H2O2/OH-→H2O反马氏规则,顺型加成,产物是醇。
2.氧化反应1.KMnO4溶液(碱性或中性)产物邻二醇,顺式;KMnO4溶液(酸性)产物双键发生断裂。
(烯烃C=C氧化为C=O;C=C上的氢被氧化成羟基(-OH)。
)2.臭氧化反应:反应条件:O3→Zn/H2O产物是醛、酮炔烃的化学性质:1.酸性(炔化银和炔化亚酮的生成与复原)2.加成反应(加卤素,加卤化氢,加水H2O,HgSO4-H2SO4)炔键在中间,生成反式加成产物。
在过氧化物存在下让,与HBr的自由基加成,反马氏规则。
3.氧化反应(KMnO4溶液(酸性),臭氧化反应)炔烃的硼氢化-氧化反马氏规则,顺型加成,产物是醛酮。
炔烃的加氢1)LindlarPd(顺式烯烃)2)Na,NH3(反式烯烃)共轭二烯烃性质:1.1,2加成-80°C优势和1,4加成40°C优势2.狄尔斯-阿尔德反应共轭二烯烃与含有碳碳双键或三键催生的化合物作用形成六元环产物的反应。
芳香烃的分子结构:1.亲电取代反应(卤化FeCl3/Fe,硝化浓H2SO4,磺化,F-C反应)。
2.溴及其同系物的氧化反应(具有α-H的吡啶同系物苯甲酸)3.苯环侧链的氧化反应(主要产物是α-H被取代的卤代芳香烃)、卤代烃的阴离子:1.各种亲核取代反应(生成醇,醚,硫醇,氰(多一个c羧酸),胺,硝酸酯)。
2..与金属的反应(主要掌握Grignard试剂)(a.烷烃b.(1)CO2(2)H+/H2O多一个c羧酸)。
有机化学中常见的基本概念

58 羧酸:分子中具有羧基(-COOH)的化合物称为羧酸。
59 羧酸衍生物:羧基中的羟基被卤素、羧酸根、烷氧基或胺基置换后产生酰卤 、酸酐、酯或酰胺。这些化合物统称为羧酸衍生物。
60 碳环化合物:碳原子互相连接成环的化合物称为碳环化合物。
61 金羊盐:氧利用孤对电子与质子结合形成钅羊盐。
62 缩硫醛和缩硫酮:乙二硫醇和醛酮反应生成的产物称为缩硫醛、缩硫酮。 63 缩醛或缩酮:一分子醛或酮和两分子醇反应,失去一分子水后生成的产物称 为缩醛和缩酮。 64 醇:脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的化合物 称为醇。羟基是醇的官能团。
(四)有机化学的基本概念
目
录
电子教案
一、化合物类名 二、同分异构体 三、化学键 四、结构和表达
word文档
一、化合物类名 二、同分异构体 三、化学键 四、结构和表达
五、静态立体化学
六、电子效应 七、理论 八、光谱 九、试剂
五、静态立体化学
有机化学yang盐

有机化学yang盐有机化学是研究碳和其它非金属元素之间的化学反应及其产物的科学。
其中,有机盐是一类重要的有机化合物,它们是由一个或多个有机阴离子和一个或多个阳离子组成的化合物。
其中,yang盐是指由阳离子和有机阴离子组成的化合物。
有机化学yang盐的研究历史可以追溯到19世纪初期,当时的化学家们开始研究有机化合物的物理和化学性质,并发现了一些有机盐的性质。
在此基础上,他们开始研究有机盐的合成方法和反应机制,为有机化学的发展奠定了基础。
有机化学yang盐的合成方法主要有以下几种:1. 直接反应法:将有机阴离子和阳离子直接反应生成yang盐,例如:甲基三丁基铵盐的合成反应。
2. 置换反应法:将一个或多个原有的基团被其他基团所置换,生成新的yang盐,例如:苄基三甲基铵盐的合成反应。
3. 加成反应法:将两个或多个分子中的单元通过共价键结合生成新的分子,例如:酰胺型yang盐的合成反应。
有机化学yang盐的应用非常广泛,它们被广泛应用于医药、染料、杀虫剂、表面活性剂等领域。
其中,yang盐在医药领域中的应用尤为重要,例如:1. 阿托品:阿托品是一种yang盐,在医学上被用作解痉剂、消炎剂和镇静剂,对于治疗胃肠道痉挛、胃酸过多等疾病有很好的疗效。
2. 盐酸普萘洛尔:盐酸普萘洛尔是一种yang盐,在医学上被用作β受体阻滞剂,对于降低心率、降低血压等疾病有很好的疗效。
3. 盐酸氨溴索:盐酸氨溴索是一种yang盐,在医学上被用作支气管扩张剂,对于治疗哮喘等疾病有很好的疗效。
总之,有机化学是一门非常重要的学科,而有机化学yang盐作为其中的一种重要化合物,其合成方法和应用也非常广泛。
希望未来有更多的科学家能够对其进行深入的研究,为人类的生活和健康做出更大的贡献。
徐寿昌《有机化学》 课件 第十章 醇、醚

R CH CH R' OH OH
+
Pb(OAc)4
RCHO
+
R'CHO
+ Pb(OAc)2 +
HOAc
这个反应常定量完成,因此可用于乙二醇的定量测定,并可根 据氧化产物推断原醇的结构。 7、邻二醇的重排反应—频哪醇重排
CH3 CH 3 H3C C C CH3
H2SO4 (HCI)
△
CH3 H3C C O C CH3 CH3
M= b.p=
74 117.2
OH OH
频哪醇
频哪酮
CH3 CH3 H3C C C CH3
H2SO4
CH3 CH3 H3C C C CH3
+
OH OH CH3 CH 3 H3C C OH C
OH OH2
CH3 H3C C C CH3
-H
+
CH3 H3C C O C CH3 CH3
+CH3O Nhomakorabea CH3
第二节 醚(ethers)
325℃
5、与酸反应——酯化
醇可与有机酸、无机酸作用生成酯。
O H3C C OH + H
O
O CH2
H+ CH3
△
CH3 C O CH2 CH3
发生酯化反应时,羧酸的C – O键断裂,醇的O – H键断 裂。 CH3 – OH + H2SO4 (CH3)2SO4(硫酸二甲酯)
硫酸二甲酯剧毒,对皮肤的阀限值1ppm,空气中最 高限量5mg/m3。
CH3CH2Cl + H2O
通常用无水氯化锌与浓盐酸按1:1的比例配成溶液与醇反 应, 代替不易操作的氯化氢气体,这样的溶液称为卢卡斯 (Lucas)试剂。结构不同的醇与卢卡斯试剂反应的活性顺序 为:
有机化学中常见涉及碳正离子中问体的重排反应及其特征探讨

有机化学中常见涉及碳正离子中问体的重排反应及其特征探讨【摘要】阐述有机化学中常见涉及碳正离子中间体的重排反应,通过对简单醇重排反应的分析,总结出经过碳正离子中间体的亲核重排反应的特征。
【关键词】碳正离子中间体重排反应有机化学特征在有机化学中,碳正离子的重排反应有重要的作用,但是因为其涉及的反应广泛,在有机化学的学习中人们很难通过单纯的记忆系统地掌握全部的反应。
通过对比总结碳正离子重排反应的规律特征,可以加深人们对此类反应的理解和认识,从而更好地进行有机化学的学习和研究。
一、有机化学中常见涉及碳正离子中间体的重排反应(一)Wanger-Meerwein重排1.一元醇的重排机理本质。
在醇分子中,羟基上的氧原子电负性很强,有两对孤对电子,在酸性条件下,这个氧原子上的孤对电子会从溶液中夺取一个质子H+,形成钅羊盐,此时,氧原子连有两个氢原子,碳氧键极性增加,碳氧键断裂,氧原子得到了碳原子上的一个电子,以水分子的形式被脱去,剩下一个不稳定的碳正离子中间体,这个碳正离子经重排后得到较稳定的碳正离子中间体,最后经SN2反应或E1反应后得到相应的重排产物,如下图所示:2.一元醇重排在反应中的应用。
以3,3-二甲基-2-丁醇为原料制备烯烃为例,反应历程如下:3.对比分析一元醇在稀硫酸条件下的脱水反应特征。
比较丙醇与2-甲基-1-丙醇和2,2-二甲-4-甲基戊醇反应的区别:2-甲基-1-丙醇和2,2-二甲基-4-甲基戊醇在稀硫酸的作用下,反应得到的是重排产物;而丙醇在稀硫酸的作用下,形成的碳正离子,没有经历重排过程即生成了产物。
由此得到的结论是:不是所有的醇,在稀硫酸的作用下,反应都经历碳正离子重排的过程。
那么,究竟是什么样的一元醇反应要经历重排过程呢?物质的存在与其自身的稳定性有很大的关系,重排后得到的碳正离子越稳定,重排性越大。
在碳正离子中,带正电荷的碳离子核外只有7个电子,是一个缺电子的基团,这样的离子不满足八隅体规则,稳定性很低,但是与其相连的烃基通过超共轭效应,对碳正离子具有供电子的能力(如甲基),从而降低其缺电子的性质,提高了碳正离子的稳定性。
有机化学名词解释

一、化合物类名无机酸酯:醇与含氧无机酸反应失去一分子水后的生成物称为无机酸酯。
双烯烃:碳碳双键数目最少的多烯烃是二烯烃或称双烯烃。
可分为三类:两个双键连在同一个碳原子上的二烯烃称为累积二烯烃,两个双键被两个或两个以上单键隔开的二烯烃称为孤立二烯烃,两个双键被一个单键隔开的二烯烃称为共轭二烯烃。
内酯:分子内的羧基和羟基失水形成的产物称为内酯。
内酰胺:分子内的羧基和胺(氨)基失水的产物称为内酰胺。
四级铵碱:四级铵盐在强碱(KOH,NaOH)作用下生成的产物称为四级铵碱。
生物碱:从动植物体内得到的一类有强烈生理效能的含氮有机化合物。
游离生物碱绝大多数是固体,难溶于水,易溶于乙醇等有机溶剂。
天然的生物碱多半是有左旋光的手性化合物。
半缩醛或半缩酮:醇具有亲核性,在酸性催化剂如对甲苯磺酸、氯化氢的作用下,很容易和醛酮发生亲核加成,一分子醛或酮和一分子醇加成的生成物称为半缩醛或半缩酮。
有机化合物:除一氧化碳、二氧化碳、碳酸盐等少数简单含碳化合物以外的含碳化合物。
多肽:一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,形成一个酰氨键,新生成的化合物称为肽,肽分子中的酰氨键叫做肽键。
二分子氨基酸失水形成的肽叫二肽,多个氨基酸失水形成的肽叫多肽。
杂环化合物:在有机化学中,将非碳原子统称为杂原子,最常见的杂原子是氮原子、硫原子和氧原子。
环上含有杂原子的有机物称为杂环化合物。
分为两类,具有脂肪族性质特征的称为脂杂环化合物,具有芳香特性的称为芳杂环化合物。
因为前者常常与脂肪族化合物合在一起学习,所以平时说的杂环化合物实际指的是芳杂环化合物。
杂环化合物是数目最庞大的一类有机物。
多环烷烃:含有两个或多个环的环烷烃称为多环烷烃。
共轭烯烃:单双键交替出现的体系称为共轭体系,含共轭体系的多烯烃称为共轭烯烃。
纤维二糖:是由两分子葡萄糖通过1,4 两位上的羟基失水而来的,纤维二糖是B-糖苷。
纤维素:由多个纤维二糖聚合而成的大分子。
多稀烃:含有多于一个碳碳双键的烯烃称为多稀烃。
有机名词解释

有机化学的基本概念一、化合物类名1无机酸酯:醇与含氧无机酸反应失去一分子水后的生成物称为无机酸酯。
2双烯烃:碳碳双键数目最少的多烯烃是二烯烃或称双烯烃。
可分为三类:两个双键连在同一个碳原子上的二烯烃称为累积二烯烃,两个双键被两个或两个以上单键隔开的二烯烃称为孤立二烯烃,两个双键被一个单键隔开的二烯烃称为共轭二烯烃。
3内酯:分子内的羧基和羟基失水形成的产物称为内酯。
4内酰胺:分子内的羧基和胺(氨)基失水的产物称为内酰胺。
5四级铵碱:四级铵盐在强碱(KOH,NaOH)作用下生成的产物称为四级铵碱。
6生物碱:从动植物体内得到的一类有强烈生理效能的含氮有机化合物。
游离生物碱绝大多数是固体,难溶于水,易溶于乙醇等有机溶剂。
天然的生物碱多半是有左旋光的手性化合物。
7半缩醛或半缩酮:醇具有亲核性,在酸性催化剂如对甲苯磺酸、氯化氢的作用下,很容易和醛酮发生亲核加成,一分子醛或酮和一分子醇加成的生成物称为半缩醛或半缩酮。
8有机化合物:除一氧化碳、二氧化碳、碳酸盐等少数简单含碳化合物以外的含碳化合物。
9多肽:一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,形成一个酰氨键,新生成的化合物称为肽,肽分子中的酰氨键叫做肽键。
二分子氨基酸失水形成的肽叫二肽,多个氨基酸失水形成的肽叫多肽。
10杂环化合物:在有机化学中,将非碳原子统称为杂原子,最常见的杂原子是氮原子、硫原子和氧原子。
环上含有杂原子的有机物称为杂环化合物。
分为两类,具有脂肪族性质特征的称为脂杂环化合物,具有芳香特性的称为芳杂环化合物。
因为前者常常与脂肪族化合物合在一起学习,所以平时说的杂环化合物实际指的是芳杂环化合物。
杂环化合物是数目最庞大的一类有机物。
11多环烷烃:含有两个或多个环的环烷烃称为多环烷烃。
12共轭烯烃:单双键交替出现的体系称为共轭体系,含共轭体系的多烯烃称为共轭烯烃。
13纤维二糖:是由两分子葡萄糖通过1,4两位上的羟基失水而来的,纤维二糖是B-糖苷。
化学
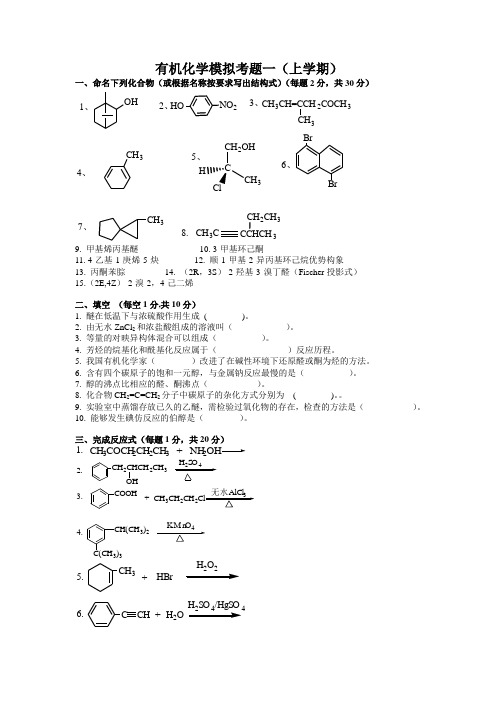
有机化学模拟考题一(上学期)一、命名下列化合物(或根据名称按要求写出结构式)(每题2分,共30分)CH 3CH 3CH=CCH2COCH 3CH 31、2、3、4、5、6、7、BrCH 3HONO 2BrCH 2OH CH 3H8.CH 3CCCHCH3CH 2CH 39. 甲基烯丙基醚 10. 3-甲基环己酮11. 4-乙基-1-庚烯-5-炔 12. 顺-1-甲基-2-异丙基环己烷优势构象13. 丙酮苯腙 14. (2R ,3S )-2-羟基-3-溴丁醛(Fischer 投影式) 15.(2E,4Z )-2-溴-2,4-己二烯二、填空 (每空1分,共10分)1. 醚在低温下与浓硫酸作用生成 ( )。
2. 由无水ZnCl 2和浓盐酸组成的溶液叫( )。
3. 等量的对映异构体混合可以组成( )。
4. 芳烃的烷基化和酰基化反应属于( )反应历程。
5. 我国有机化学家( )改进了在碱性环境下还原醛或酮为烃的方法。
6. 含有四个碳原子的饱和一元醇,与金属钠反应最慢的是( )。
7. 醇的沸点比相应的醛、酮沸点( )。
8. 化合物CH 2=C=CH 2分子中碳原子的杂化方式分别为 ( )。
9. 实验室中蒸馏存放已久的乙醚,需检验过氧化物的存在,检查的方法是( )。
10. 能够发生碘仿反应的伯醇是( )。
三、完成反应式(每题1分,共20分)CH 3COCH2CH 2CH 3 + NH 2OH1.2.CH 2CHCH2CH 3OH24CH 3CH 2CH 2+3.COOHCH(CH3)24.C(CH 3)3CH +CH 3+HBrCH 2O5.6.H SO /HgSOH OHBr+KMnO 4+7.8.CH 3CH 3CH 3CH 2CH 3CH9.BH 3H 2O 2-COOH+10H 3CH 2H丙酮NaI 1112.ClCH 2ClH 2OCH OO 2N浓NaOH13.14.CH 2CHCH 2CH 3BrC 6H 5COCH3C 6H 5MgBr+ 1.无水乙醚2+15.NaBH417.16.OH CH 33CH=CHCHO19.18. CH 3COCH3 + CH 2-OHCH 2OHCH 3CH 2CHO20.CH 3OCH(CH3)2四、选择题(每题1分共10分)1.按次序规则,下列基团中最优先的是( )A. —CNB.—COOHC.—CH 2BrD.—CONH 2 2. 下列化合物中具有芳香性的是:A.B.C.D.3.下列化合物中酸性最弱的是:A 对氯苯酚B 对硝基苯酚C 对甲基苯酚D 苯酚 4. 伯卤代烷,叔卤代烷与NaOH 水溶液发生取代反应,主要历程: A 伯为 S N 2,叔为S N 1 B 伯为S N 1, 叔为S N 2C 伯、叔均为S N 1D 伯、叔均为S N 25. 在下列取代基中,能使苯环亲电取代反应活性增强的是( )。
化学元素拼音注释

化学元素拼音注释1. 氢(qīng):最轻的元素,原子编号为1,存在于水和许多有机化合物中。
2.氦(hè):原子编号为2,是一种稀有气体,在气球和激光等领域有广泛应用。
3.锂(lǐ):原子编号为3,是一种轻金属,常用于制造锂电池和合金。
4.铍(bèi):原子编号为4,是一种贵金属,可用于制造合金和核反应堆材料。
5.硼(bó):原子编号为5,常用于制造玻璃和陶瓷等材料。
6.碳(tàn):原子编号为6,是生命体中的基本组分之一,常见的形式有石墨和钻石。
7.氮(nì):原子编号为7,是空气中的主要成分之一,广泛应用于肥料和制药工业。
8. 氧(yǎng):原子编号为8,是空气中的主要成分之一,是许多化合物的核心元素。
9.氟(fú):原子编号为9,是一种强氧化剂,广泛用于制药和农药等领域。
10.钠(nà):原子编号为11,是一种常见的金属元素,存在于盐和许多其他化合物中。
11.镁(měi):原子编号为12,是一种轻质金属,广泛用于制造合金和火箭燃料等。
12.铝(lǚ):原子编号为13,是一种常见的金属元素,被广泛应用于建筑和包装等领域。
13. 硅(guī):原子编号为14,是一种非金属元素,是许多材料中的重要组分,如玻璃和半导体。
14.磷(lín):原子编号为15,是生命体中的重要组分之一,广泛应用于肥料和制药工业。
15. 硫(liú):原子编号为16,是一种常见的非金属元素,广泛用于制造硫酸和肥料等。
16.氯(lǜ):原子编号为17,是一种强氧化剂,广泛应用于水处理和消毒等领域。
17. 钾(jiǎ):原子编号为19,是一种重要的金属元素,在肥料和医药领域有广泛应用。
18.钙(gài):原子编号为20,是许多生物体中的重要元素,如骨骼和牙齿的构成成分。
19.锶(sī):原子编号为38,可用于制造耐火材料和烟花照明剂等。
元素周期表中各种元素名称的读音

1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí)5 硼(péng) 6碳(tàn) 7氮(dàn)8 氧(yǎng) 9氟(fú)10 氖(n ǎi)11钠(nà) 12镁(měi) 13铝(lǚ)14 硅(guī)15 磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà)19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài)23 钒(fán) 24铬(gè) 25锰(měng) 26铁(tiě) 27钴(gǔ)28 镍(niè)29 铜(tóng)30 锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù)36 氪(kè)37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní)42 钼(mù) 43锝(dé) 44钌(liǎo) 45铑(lǎo) 46钯(bǎ) 47银(yín) 48镉(gé)49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì)53 碘(diǎn) 54氙(xiān)55铯(sè) 56钡(bèi) 57镧(lán) 58铈(shì) 59镨(pǔ)60 钕(nǚ)61 钷(pǒ) 62钐(shān) 63铕(yǒu)64 钆(gá) 65铽(tè) 66镝(dī) 67钬(huǒ)68 铒(ěr) 69铥(di ū)70 镱(yì) 71镥(lǔ) 72铪(hā)73 钽(tǎn) 74钨(wū) 75铼(lái) 76锇(é) 77铱(yī) 78铂(bó)79 金(jīn) 80汞(gǒng) 81铊(tā) 82铅(qiān)83 铋(bì) 84钋(pō)85砹(ài)86 氡(dōng)87钫(fāng) 88镭(léi)89 锕(ā) 90钍(tǔ)91 镤(pú) 92铀(yóu) 93镎(n á)94 钚(bù)95 镅(méi) 96锔(jú)97 锫(péi)98 锎(kāi) 99锿(āi) 100镄(fèi) 101钔(mén) 102锘(nuò)103 铹(láo)104 钅卢(lú) 105钅杜(dù)106钅喜(xǐ)107钅波(bō)108 钅黑(hēi)109 钅麦(mài)110 钅达(dá) 111钅仑(lún)五个字五个字背顺序名称字母是必背的初中只需背前20个相对质量不用背考试时卷子上会告诉你的前20号元素1 H 氢1.0079(相对原子质量)化学元素周期表2 He 氦4.00263 Li 锂6.9414 Be 铍9.01225 B 硼10.8116 C 碳12.0117 N 氮14.0078 O 氧15.999 4(3) 9 F 氟18.998 10 Ne 氖20.17 11 Na 钠22.9898 12 Mg 镁24.305 13 Al 铝26.982 14 Si 硅28.085 15 P 磷30.974 16 S 硫32.06 17 Cl 氯35.453 18 Ar 氩39.94 19 K 钾39.098 20 Ca 钙40.08金属活动顺序表K -jia Ca -gai Na- na Mg -mei Al -lv Zn - xin Fe- tie Sn -xi Pb- qian H -qing Cu -tong Hg- gong Ag- yin Pt- bo Au -jin化合价可以这样记忆:一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心。
初中化学常见元素、离子、物质化学式、名称、俗称及记忆口诀

初中化学常见元素、离子、物质化学式、名称及其俗称一、常见的元素符号及名称氢 H 氦 He 碳 C 氮 N 氧 O 氟 F 氖 Ne ,钠 Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl ,氩 Ar 钾 K 钙 Ca 锰 Mn 铁 Fe 铜 Cu 锌 Zn ,银 Ag 钡 Ba 铂 Pt 金 Au 汞 Hg 碘 I二、常见的金属单质:钾钙钠镁铝锌铁锡铅铜汞银铂金钡锰K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au Ba Mn 二、非金属单质:氢气 H2氧气 O2 氮气 N2 氯气 Cl2臭氧 O3碘 I 碳 C 硅 Si 硫 S 磷 P三、稀有气体:氦气He 氖气Ne氩气Ar四、元素周期表前20号元素氢 H 氦 He 锂 Li 铍Be 硼 B碳 C 氮 N 氧 O 氟 F 氖 Ne钠 Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl氩 Ar 钾 K 钙 Ca五、常见元素和原子团的化合价及离子符号+1 价:K 、Na、Ag 、H、NH 4+2 价:Ca、Mg 、Ba、Zn、Cu+3 价:Al+2、+3 价:Fe-1 价:F、Cl 、OH、NO3-2 价:O、S、CO3、SO4-3 价:PO4记忆口诀元素化合价要记清,金正非负单质零钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧是负二价;一二铜汞二三铁,三价金属铝合金;碳有正二和正四,硫有负二正四和正六负一硝酸氢氧根,负二硫酸碳酸根正一价的是铵根化合物中元素化合价合为零(即化合物中所有元素的化合价加起来和为零)五、常见的离子符号1、常见金属离子锂离子Li+ 钾离子K+ 钠离子Na+钙离子Ca2+镁离子Mg2+ 钡离子Ba2+铝离子Al3+ 锌离子Zn2+铁离子Fe3+ 亚铁离子Fe2+铜离子Cu2+ 银离子Ag+2、常见的非金属离子氟离子F- 氯离子Cl- 溴离子Br - 碘离子I-硫离子S2-氧离子O2- 氢离子H+氢氧根离子OH- 硝酸根离子NO3-氯离子Cl-。
初中化学元素符号顺口溜和记忆口诀

初中化学记忆口诀和元素符号顺口溜你可以念一遍,试试顺口不顺口碳是C、磷是P、铅的符号是PbCu铜、Ca钙、钨的符号WH氢、S硫、硅的符号Si金Au、银Ag、镁的符号Mg钠Na、氖Ne、汞的符号Hg硼是B、钡Ba、铁的符号Fe锌Zn、锰Mn、锡的符号Sn钾是K、碘是I、氟的符号是F氧是O、氮是N、溴的符号是BrAl铝、Cl氯、钅弟的符号Sb第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙那美女鬼流露绿牙第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----彩色贝壳蓝色河钽钨铼锇 ---- 但见乌鸦引来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬天第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊20个必记:氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙5个一记会好记点1、粉末状药品的取用粉末药品药匙取,也可倒在纸槽里;横放试管送底部,直立试管落到低;或:一斜二送三直立;2、块状药品的取用块状药品镊子夹,绝对不能手来拿;横持试管把药放,慢慢竖起向下滑;或:一横二放三慢竖;3、液体药品的取用取下瓶塞倒放桌,标签朝心右手握;口口紧挨要倾斜,倒完液体原处搁;4、液体药品的量取量筒平放实验桌,先倒后滴至刻度;平视凹液最低处,三线一齐为读数;或:一倒二滴三读数;5、用滴管取用药品轻拿滴管胶头处,手捏滴管橡胶头;垂直滴入容器中,切忌管头触器口;或:两管直立,莫触内壁;滴管悬空,滴入正中; 6、托盘天平的使用天平用前调零点,左物右码记心间;砝码要用镊子夹,由大到小顺序拿;一般药品垫纸称,腐蚀药品杯中放;称完天平要复原,游码移回到零点; 或:一放平、二调零,三加砝码四进行;砝码要用镊子取,左物右码须记清;7、酒精灯的使用酒精不能燃着加,对火可能危险发;酒精灯焰分三层,外焰温度为最大;熄灯要用灯帽盖,切记嘴吹酿火灾;万一失火燃起来,抹布立刻来扑盖;8、试管中的固体加热药品斜铺试管底,受热均匀面积大;管口略比管底低,防水倒流试管炸;试管夹持中上部,根据外焰定高度;均匀预热试管后,集中外焰把热加;9、试管中的液体加热加热常用试管夹,夹在试管中上部;试管加液三分一,药液体积不超它;移动试管预热前,应把外壁水擦干;管口不朝你我他,四十五度为最佳;10、仪器的洗涤一般容器用水洗,内壁附物用刷洗;壁内若有不溶物,盐酸溶碱纯碱脂;仪器洗净有标准,水不成股不聚滴;二、前二十种元素氢氦锂铍硼,碳氮氧氟氖;钠镁铝硅磷,硫氯氩钾钙;三、常见元素的化合价一钾钠银氢正一价,钙镁钡锌正二价;一二铜汞二三铁,三铝四硅五氮磷;二四六硫二四碳,金正非负单质零;二一价钾钠银氢氟,二价钙镁和钡锌;铝价正三氧负二,以上价态要记真;铜一二来铁二三,碳硅二四要记全;硫显负二正四六,负三正五氮和磷;氯价通常显负一,还有正价一五七;锰显正价二四六,最高价数也是七; 四、常见原子团的化合价负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根; 五、书写化学方程式步骤左反右生一横线,配平以后加一线;等号上下写条件,箭头标气或沉淀;六、化学方程式计算步骤一解二设最后答,化学方程不能差;准确寻找质量比,纯量代入不掺假;所有单位要一致,列出比例解决它;七、金属活动顺序一金属活动顺序表,钾钙钠镁铝锰锌;铬铁钴镍锡铅氢,氢后铜汞银铂金;二钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金;八、实验室制取氧气二氧化锰氯酸钾,一三混匀口略下;先查气密后装药,固定之后把热加;高锰酸钾加热时,管口还需塞棉花;气泡均匀才收集,先撤后熄莫忘记;向上排气管伸底,余烬火柴检验它;九、酸碱盐的溶解性氢氧钾钠钡钙溶,盐酸除银和亚汞;硫酸不溶有钡铅,钾钠铵硝全都溶;十、空气成分氮气七八氧二一,零点九四为稀气;两个零点零三量,二氧化碳和杂气常见根价口诀一价铵根硝酸根;氢卤酸根氢氧根;高锰酸根氯酸根;高氯酸根醋酸根; 二价硫酸碳酸根;氢硫酸根锰酸根;暂记铵根为正价;负三有个磷酸根; 一价金属银钠钾,还有亚铜亚汞是一价, 二价金属锌钡铜,还有钙镁亚铁汞, 氟氯溴碘常显一, 有时还显三五七, 氢一价,氧二价,铁三铝三记住它, 硫有二四和六价,氮磷三五是常规.一般在口诀中不会编入正价与负价,因此还有以下规律: 金属元素一般是正价,非金属中氢元素是正价,其余的就只有具体情况具体分析了,比如锰有七个化合价,在不同的化合物中都不一样,这些只有死记硬背. 短周期元素化合价与原子序数的关系价奇序奇,价偶序偶; 化学式一排顺序二标价,价数交叉写右下,约简价数作角码,化合价规则去检查; 化学方程式左写反应物,右边写生成;写对化学式,系数来配平;中间连等号,条件要注清;生成沉淀气,箭头来标明; 一找元素见面多,二将奇数变成偶,三按连锁先配平,四用观察配其它;有氢找氢无氢找氧,奇数配偶变单成双,出现分数去掉分母,调整系数使支配平。
一、化合物类名

(四)有机化学的基本慨念一、化合物类名1无机酸酯:醇与含氧无机酸反应失去一分子水后的生成物称为无机酸酯。
2双烯烃:碳碳双键数目最少的多烯烃是二烯烃或称双烯烃。
可分为三类:两个双键连在同一个碳原子上的二烯烃称为累积二烯烃,两个双键被两个或两个以上单键隔开的二烯烃称为孤立二烯烃,两个双键被一个单键隔开的二烯烃称为共轭二烯烃。
3内酯:分子内的羧基和羟基失水形成的产物称为内酯。
4内酰胺:分子内的羧基和胺(氨)基失水的产物称为内酰胺。
5四级铵碱:四级铵盐在强碱(KOH,NaOH)作用下生成的产物称为四级铵碱。
6生物碱:从动植物体内得到的一类有强烈生理效能的含氮有机化合物。
游离生物碱绝大多数是固体,难溶于水,易溶于乙醇等有机溶剂。
天然的生物碱多半是有左旋光的手性化合物。
7半缩醛或半缩酮:醇具有亲核性,在无水和酸性催化剂如对甲苯磺酸、氯化氢的作用下,很容易和醛酮发生亲核加成,一分子醛或酮和一分子醇加成的生成物称为半缩醛或半缩酮。
8有机化合物:除一氧化碳、二氧化碳、碳酸盐等少数简单含碳化合物以外的含碳化合物。
9多肽:一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,形成一个酰氨键,新生成的化合物称为肽,肽分子中的酰氨键叫做肽键。
二分子氨基酸失水形成的肽叫二肽,多个氨基酸失水形成的肽叫多肽。
10杂环化合物:在有机化学中,将非碳原子统称为杂原子,最常见的杂原子是氮原子、硫原子和氧原子。
环上含有杂原子的有机物称为杂环化合物。
分为两类,具有脂肪族性质特征的称为脂杂环化合物,具有芳香特性的称为芳杂环化合物。
因为前者常常与脂肪族化合物合在一起学习,所以平时说的杂环化合物实际指的是芳杂环化合物。
杂环化合物是数目最庞大的一类有机物。
11多环烷烃:含有两个或多个环的环烷烃称为多环烷烃。
12共轭烯烃:单双键交替出现的体系称为共轭体系,含共轭体系的多烯烃称为共轭烯烃。
13纤维二糖是由两分子葡萄糖通过1,4两位上的羟基失水而来的,纤维二糖是 -糖苷。
有机化学的基本概念

有机化学的基本概念目录一、化合物类名一、化合物类名二、同分异构体二、同分异构体三、化学键三、化学键四、结构和表达四、结构和表达五、静态立体化学五、静态立体化学六、电子效应六、电子效应七、理论七、理论八、光谱八、光谱九、试剂九、试剂十、反应和反应机理十、反应和反应机理一、化合物类名1 无机酸酯:醇与含氧无机酸反应失去一分子水后的生成物称为无机酸酯。
2 双烯烃:碳碳双键数目最少的多烯烃是二烯烃或称双烯烃。
可分为三类:两个双键连在同一个碳原子上的二烯烃称为累积二烯烃,两个双键被两个或两个以上单键隔开的二烯烃称为孤立二烯烃,两个双键被一个单键隔开的二烯烃称为共轭二烯烃。
3 内酯:分子内的羧基和羟基失水形成的产物称为内酯。
4 内酰胺:分子内的羧基和胺(氨)基失水的产物称为内酰胺。
5 四级铵碱:四级铵盐在强碱(KOH,NaOH)作用下生成的产物称为四级铵碱。
6 生物碱:从动植物体内得到的一类有强烈生理效能的含氮有机化合物。
游离生物碱绝大多数是固体,难溶于水,易溶于乙醇等有机溶剂。
天然的生物碱多半是有左旋光的手性化合物。
7 半缩醛或半缩酮:醇具有亲核性,在酸性催化剂如对甲苯磺酸、氯化氢的作用下,很容易和醛酮发生亲核加成,一分子醛或酮和一分子醇加成的生成物称为半缩醛或半缩酮。
8 有机化合物:除一氧化碳、二氧化碳、碳酸盐等少数简单含碳化合物以外的含碳化合物。
9 多肽:一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,形成一个酰氨键,新生成的化合物称为肽,肽分子中的酰氨键叫做肽键。
二分子氨基酸失水形成的肽叫二肽,多个氨基酸失水形成的肽叫多肽。
10 杂环化合物:在有机化学中,将非碳原子统称为杂原子,最常见的杂原子是氮原子、硫原子和氧原子。
环上含有杂原子的有机物称为杂环化合物。
分为两类,具有脂肪族性质特征的称为脂杂环化合物,具有芳香特性的称为芳杂环化合物。
因为前者常常与脂肪族化合物合在一起学习,所以平时说的杂环化合物实际指的是芳杂环化合物。
