电离平衡常数
电离平衡常数的比值问题

电离平衡常数的比值问题
电离平衡常数的比值问题涉及到化学反应的平衡状态,具体地,我们将讨论关于酸碱反应和电离反应的比值问题。
在化学中,电离平衡常数通常用来描述化学反应中物质的电离程度。
首先我们来了解一下酸碱反应。
酸碱反应是化学反应中常见的一种类型,涉及到酸和碱之间的中和反应。
在酸碱反应中,我们通常关注的是氢离子(H+)和氢氧根离子(OH-)的浓度。
电离平衡常数(Kw)用来描述在水溶液中水(H2O)分解成氢离子和氢氧根离子的程度。
其数值通常等于1.0 x 10^-14,在常温下保持恒定。
当我们讨论酸碱溶液的酸度或碱度时,常用pH值作为指标。
pH值在0到14之间变化,其中7表示中性,小于7表示酸性,大于7表示碱性。
通过pH值可以推导出溶液中氢离子和氢氧根离子的浓度。
而当我们考虑电离反应时,电离平衡常数(Keq)用来描述反应物和生成物之间的平衡状态。
Keq的计算方法涉及到反应物和生成物的浓度,符号"="表示反应达到平衡。
Keq的数值可以指示反应是偏向生成物(Keq>1)还是原料(Keq<1)或反应物和生成物几乎达到平衡(Keq≈1)。
总结一下,电离平衡常数的比值问题主要涉及到酸碱反应和电离反应的平衡状态。
通过计算相关的平衡常数,我们可以了解反应物和生成物的电离程度以及酸碱溶液的酸碱度。
这对于理解化学反应的平衡过程和性质非常重要。
电离平衡常数

B.盐酸<醋酸
C.一样多
D.无法确定
此时C(醋酸)远大于C(HCl),最终产生H+多 与盐酸
结论:等体积等H+浓度的一元强酸与一元弱酸中和碱的能力: 弱酸>强酸
补充知识:
一.等体积等浓度的一元强酸与一元弱酸对比(以HCl和CH3COOH为例)
1.C(H+)大小: HCl>CH3COOH 2.酸性强弱: HCl>CH3COOH 3.中和碱的能力:(相同)
4.与同一金属反应的起始速率: 相同
5.与足量金属反应产生H2的总量: CH3COOH>HCl
思考: 将等体积,H+浓度均为1mol/L的盐酸和醋酸加水稀释100倍 之后, 它们的H+浓度还相等吗?若不想等,谁的H+浓度更大?
不相等 CH3COOH>HCl CH3COOH是弱电解质,加水会继续电离产生H+
若H+浓度相同,则酸性相同
1L 1mol/LHCl溶液与 1L 1mol/LCH3COOH溶液与足量等浓度的
NaOH溶液发生酸碱中和反应,消耗的NaOH体积 ( C )
A.盐酸>醋酸
B.盐酸<醋酸
C.一样多
D.无法确定
中和反应的本质是H++OH-=H2O
即H+与OH-的物质的量1:1反应试写出化学方程式分析:
醋酸
C C 思考(H:Cl此)时盐<酸的(浓C度H3与CO醋OH酸)的浓度谁大谁小?
原因:醋酸是弱电解质电离很微弱,若醋酸要和盐酸H+浓度相等, 则醋酸浓度必然大于盐酸
等体积 等H+浓度的HCl溶液与CH3COOH溶液与足量等浓度的 NaOH溶液发生酸碱中和反应,消耗的NaOH体积 ( B )
电离平衡常数

大
由Ka、Kb值判断酸碱性相对强弱, 应 用 需在相同温度下。
已知: Ka(HCN)=6.2×10-10mol/L
Ka(CH3COOH)=1.7×10-5mol/L Ka( HF )=6.8×10-4mol/L
,酸性或碱性越
强
。
酸性强弱: HF>CH3COOH>HCN
。
练习: 已知醋酸,碳酸和硼酸298K时的电离常数分别是
0.1mol/L的磷酸溶液中微粒浓度大小关系是: (1).[H3PO4]>[H+]>[H2PO4-]> [HPO42-]> [PO42-] (2).[H+]=[H2PO4-]> 2[HPO42-]>3 [PO43-]+[OH-](电荷守恒) (3).[H3PO4]+[H2PO4-]+[HPO42-]+ [PO42-]=0.1mol/L(物料守恒)
练习:某二元酸(化学式用H2B表示)在水中的电离方程
练习:某二元酸(化学式用H2B表示)在水中的电离方程
式是:H2B = H+ + HB- ,HB-
H+ + B2-
已知0.1mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中 c(H+)________0.11mol/L(填“>”“<”“=”)。 HBH+ + B2-的电离平衡常数是_______。
CH3COO - + H+
α=
100% C(HAc原) C( H+ -) 100% α= C(HAc原)
C(Ac-)
2、影响电离度大小的因素
(1)内因—电解质的本性,电解质越弱,电离度越小
【知识解析】弱电解质的电离平衡
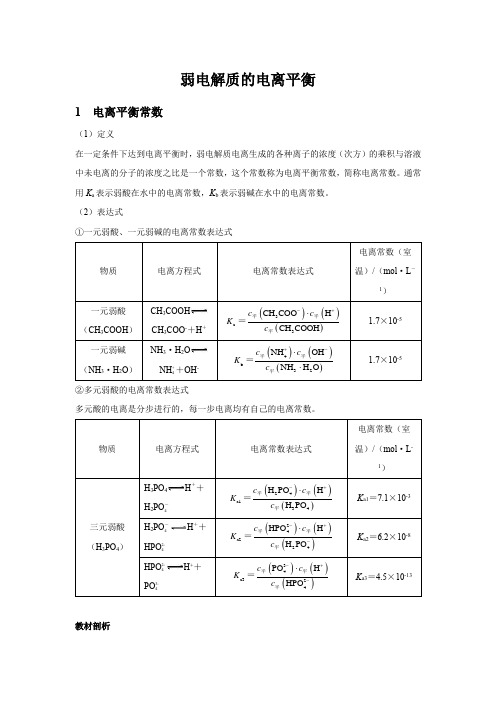
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。
电离平衡常数特点-概述说明以及解释

电离平衡常数特点-概述说明以及解释1.引言1.1 概述概述部分内容:电离平衡常数是化学反应中的一个重要参数,用于描述反应体系中离子的生成和消失的平衡状态。
在化学平衡的研究中,电离平衡常数被广泛应用于酸碱、溶液反应以及其他离子间相互转化的反应体系中。
电离平衡常数的计算是通过离子浓度的比值来确定的。
这里的离子浓度是指溶液中各种离子的浓度,它们的浓度与温度、压强等条件有关。
电离平衡常数的大小反映了反应的偏向性,也即反应往正向或者反向进行的倾向。
当电离平衡常数大于1时,说明正反应占优势,反之小于1时反应则处于反向进行的状态。
在化学实验和工业生产中,了解反应的电离平衡常数可以帮助我们选择合适的条件来控制反应方向和速率。
这对于合成所需产品、提高化学反应效率以及保障生产质量具有重要意义。
此外,电离平衡常数还被广泛应用于环境科学研究中,例如水体中溶解氧和二氧化碳的平衡状态,以及大气中酸性物质与碱性物质之间的相互作用等。
综上所述,电离平衡常数是化学领域中一个重要而有用的概念。
它不仅能够帮助我们理解和预测化学反应的行为,还可以指导我们进行相关实验和工业生产。
对电离平衡常数的研究和应用具有重要的科学意义和实际价值。
1.2文章结构文章结构部分的内容可以参考如下:文章结构:本文分为引言、正文和结论三个部分。
其中,引言部分主要对电离平衡常数的概念进行概述,并说明文章的目的。
正文部分将详细介绍电离平衡常数的定义和意义以及计算方法。
最后,结论部分对电离平衡常数的特点进行总结,并展望了其在未来的应用前景。
引言部分的目的是为读者提供对电离平衡常数的初步了解,同时引发读者的兴趣,使其进一步阅读。
概述部分将简要介绍电离平衡常数的基本概念和作用,提供一定的背景知识。
结构部分将详细阐述文章的组织结构,包括各个部分的内容和顺序,以便读者能够清晰地了解整篇文章的内容和结构。
同时,也可以提前透露一些正文和结论部分的内容予以引导,起到串联和铺垫的作用。
电离平衡常数计算公式

电离平衡常数计算公式全文共四篇示例,供读者参考第一篇示例:电离平衡常数是描述溶液中电解质电离过程的重要参数,它表征了电解质在给定条件下电离和再结合的平衡状态。
电离平衡常数通常用K表示,其值取决于温度、压力和溶液中的其他物质浓度。
计算电离平衡常数需要考虑电解质的电离程度以及溶液中其他离子的影响。
电离平衡常数的计算公式通常根据电解质的电离平衡方程推导得出。
以弱酸为例,其电离平衡方程可表示为:HA ⇌ H+ + A-HA是弱酸分子,H+是氢离子,A-是酸根离子。
根据该电离平衡方程,可以得出酸的电离平衡常数Ka的计算公式:Ka = [H+][A-]/[HA][H+]、[A-]和[HA]分别表示溶液中氢离子、酸根离子和弱酸分子的浓度。
通过测定溶液中酸的浓度和pH值,可以计算出Ka的值。
类似地,弱碱的电离平衡方程可表示为:对于强酸和强碱,其电离平衡常数是非常大的,接近无穷大,因为它们几乎完全电离成离子。
强酸的电离平衡方程可表示为:强碱的电离平衡常数Kb也可以近似为无穷大。
电离平衡常数的计算公式在化学领域中具有广泛的应用,它可以用于预测溶液中各离子的浓度、计算酸碱中和反应的平衡常数等。
在实验室中,人们可以通过测定溶液中离子的浓度和pH值,来计算电离平衡常数,从而了解溶液中电离过程的平衡状态。
电离平衡常数的计算公式还可以帮助人们设计一些化学反应的条件,例如控制溶液中酸碱离子的浓度,调整反应体系的酸碱度等。
通过合理计算电离平衡常数,可以更好地理解化学反应过程并优化实验条件。
电离平衡常数的计算公式在化学研究中具有重要意义,它为人们研究溶液中电解质的电离过程提供了有力的工具。
通过深入理解电离平衡常数的计算公式,我们可以更好地掌握化学反应的规律,促进化学科学的发展和应用。
【2000字】第二篇示例:电离平衡常数是描述在给定条件下溶液中电离反应平衡的一个重要参数。
在化学反应中,当一种物质在溶液中发生电禧反应时,会形成离子。
电离平衡常数与ph的关系

电离平衡常数与ph的关系电离平衡常数(Ka)是描述酸或碱在水溶液中电离程度的指标,它与溶液的pH值之间存在着密切的关系。
在化学平衡中,Ka表示酸的电离程度,而pH值则表示溶液的酸碱性质。
因此,Ka与pH之间的关系对于理解溶液中酸碱平衡的变化至关重要。
首先,让我们来了解一下电离平衡常数(Ka)的含义。
Ka是一个描述溶液中弱酸电离程度的指标,它是酸的离子化反应中产生H+离子的速率常数与酸分子浓度的乘积的比值。
Ka的值越大,说明酸的电离程度越高,溶液中的H+离子浓度也越高。
而pH值则是用来表示溶液酸碱性的指标,它是通过对数函数计算得出的。
当溶液中H+离子的浓度增加时,pH值会降低;反之,H+离子浓度减少时,pH值会升高。
因此,pH值的变化可以直接反映出溶液中酸碱性质的变化。
Ka与pH之间的关系可以通过下面的公式来表示:pH = -log[H+]Ka = [H+][A-]/[HA]其中[H+]表示溶液中的H+离子浓度,[A-]表示酸的共轭碱的浓度,[HA]表示未电离的酸的浓度。
从上述公式可以看出,Ka与溶液中H+离子浓度有直接的关系,而H+离子浓度又决定了溶液的pH值。
因此,Ka与pH之间存在着密切的关联。
在实际应用中,我们可以利用Ka与pH之间的关系来帮助我们理解和控制溶液中酸碱平衡的变化。
比如,在酸碱中和反应中,我们可以根据Ka值来预测反应的方向和程度;在药物和生物化学领域,我们也可以根据Ka值来评估药物的酸碱特性以及其在生物体内的吸收和分布情况。
总之,电离平衡常数(Ka)与pH之间的关系是化学中一个重要的概念,它帮助我们理解溶液中酸碱平衡的变化规律,对于化学、药学、生物化学等领域都具有重要的理论和实际意义。
通过深入理解和应用这一关系,我们可以更好地掌握溶液中酸碱平衡的变化规律,为相关领域的研究和应用提供有力的支持。
课件1:3.1.2电离平衡常数

(2)CaCO3难溶于水,其属于弱电解质。 ( × )
(3)离子化合物一定是强电解质,共价化合物一定是弱电解质。 ( × )
(4)电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是
动态平衡。 ( × )
(5)一定温度下,醋酸的浓度越大,电离常数也越大。 ( × )
电离平衡常数
L-1)
c(mol·
1.7×10-3
c平(mol·L-1)
0.2-1.7×10-3
+
4
1.7×10-3
1.7×10-3
+
OH 0
1.7×10-3
1.7×10-3
c平(NH3·H2O)= (0.2-1.7×10-3 ) mol·L-1≈0.2 mol·L-1
c( NH +4 ) ·c(OH-)
(1.7×10-3) ·(1.7×10-3)
+
0
平衡: c(HX)-c(H+) c(H+)
(+)·(- )
则:Ka=
()-(+)
=
X0
c(X-)
(+)
()-(+ )
由于 c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则
c(H+)= ·(),代入数值求解即可。
电离平衡常数
CH3COOH的Ka和H2CO3的Ka1的大小?
提示:有无色气体产生,反应生成了CO2。说明醋
酸的酸性强于碳酸,即CH3COOH的Ka大于H2CO3
的Ka1。
电离平衡常数
【思考与讨论】
向两个锥形瓶中各加入0.05 g
镁条,盖紧橡胶塞,然后用
电离平衡常数公式

电离平衡常数的计算公式:K=C^x·C。
溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数。
这个常数叫电离平衡常数,简称电离常数。
电解质是溶于水溶液中或在熔融状态下就能够导电的化合物。
根据其电离程度可分为强电解质和弱电解质,几乎全部电离的是强电解质,只有少部分电离的是弱电解质。
电解质都是以离子键或极性共价键结合的物质。
化合物在溶解于水中或受热状态下能够解离成自由移动的离子。
离子化合物在水溶液中或熔化状态下能导电;某些共价化合物也能在水溶液中导电,但也存在固体电解质,其导电性来源于晶格中离子的迁移。
电离平衡常数及相关计算-高考化学专题

考点43 电离平衡常数及相关计算1.表达式(1)对于一元弱酸HA :HAH ++A −,电离常数K =H A HA c c c +-⋅()()()。
(2)对于一元弱碱BOH :BOHB ++OH −,电离常数K =B OH BOH c c c +-⋅()()()。
(3)对于二元弱酸,如H 2CO 3:H 2CO 3H ++3HCO -,K 1=323H HCO H CO c c c +-⋅()()();3HCO-H ++23CO -,K 2=233H CO HCO c c c +--⋅()()();且K 1>K 2。
2.意义:相同条件下,K 越大→越易电离→酸(或碱)性越强3.特点:多元弱酸是分步电离的,各级电离常数的大小关系是K 1≫K 2……,所以其酸性主要决定于第一步电离。
4.影响因素5.电离常数的三大应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
6.电离平衡常数相关计算(以弱酸HX 为例)(1)已知c (HX)和c (H +),求电离常数 HXH + + X −起始(mol·L −1):c (HX) 0 0 平衡(mol·L −1):c (HX)−c (H +) c (H +) c (H +)则:K=H XHXc cc+-⋅()()()=2HHX Hcc c++()()-()。
由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)−c(H+)≈c(HX),则K=2HHXcc+()(),代入数值求解即可。
(2)已知c(HX)和电离常数,求c(H+)HX H++X−起始:c(HX)00平衡:c(HX)−c(H+)c(H+) c(H+)则:K=H XHXc cc+-⋅()()()=2HHX Hcc c++()()-()。
06电离平衡常数

06. 电离平衡常数一、知识梳理1、概念:在一定条件下达到电离平衡时,弱电解质电离形成的各种离子浓度的乘积与溶液中未电离的分子浓度之比为一常数,叫电离平衡常数。
2、符号:K(弱酸Ka,弱碱Kb)3、表示方法:AmBn mA n+ + nB m—K = [A n+]m [B m—]n[AmBn]如:CH 3COOH CH3COO-+H+Ka = [H+][CH3COO—] [CH3COOH]NH 3•H2O NH4+ + OH—Kb = [OH—][NH4+] [NH3•H2O]4、影响因素:电离平衡常数的大小主要由物质的本性和温度决定,T ,K5、K的意义:K值越大,弱电解质较易电离,其对应弱酸、弱碱较强K值越小,弱电解质较难电离,其对应弱酸、弱碱较弱比如说:Ka的意义:Ka ,达电离平衡时电离出的[H+] ,酸性;Kb的意义:Kb ,达电离平衡时电离出的[OH—] ,碱性。
Ka(HCN)= 6.2×10—10mol•L—1Ka(CH3COOH)= 1.7×10—5mol•L—1Ka(HF)= 6.8×10—4mol•L—1酸性:HF >CH3COOH >HCN6、电离度(α):电离平衡常数表示电离的程度有时不够直观,为了更好的比较电解质的电离程度,人们又定义了“电离度”这个概念,相当于化学平衡中反应物的转化率。
表示已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率。
α= 已电离的溶质的分子数/原有溶质分子总数×100%二、典例分析6、已知25℃时,下列酸的电离常数:物质/酸醋酸氢氰酸氢氟酸甲酸电离常数/K a 1.75×10—5 4.93×10—107.2×10—4 1.77×10—4则物质的量浓度均为0.1 mol·L-1的上述溶液酸性最强的是()A.醋酸 B.氢氰酸C.氢氟酸D.甲酸考点:弱电解质在水溶液中的电离平衡.分析:相同浓度的酸,酸的电离常数越大,电解质的酸性越强,据此分析解答.解答:相同浓度的酸,酸的电离常数越大,说明酸的电离程度越大,则酸的酸性越强,根据题意知,氢氟酸的电离平衡常数最大,所以氢氟酸的酸性最强,故选C.点评:本题考查弱电解质的电离,题目难度不大,本题注意电离平衡常数与酸性的强弱判断.三、实战演练1、物质的量浓度相同的下列物质的水溶液,酸性最强的是()A.HCl B.H2SO4C.CH3COOH D.NaCl。
化学物质的电离度与电离平衡常数

化学物质的电离度与电离平衡常数化学物质的电离度与电离平衡常数是化学反应中重要的概念,它们对于理解溶液中物质的行为以及酸碱反应等过程具有重要意义。
本文将从电离度的定义、电离平衡常数的计算以及影响电离度和电离平衡常数的因素等方面进行探讨。
一、电离度的定义电离度是指在溶液中溶解的物质分子或离子的离解程度。
当物质溶解时,其中的分子或离子会与溶剂分子发生相互作用,部分分子或离子会发生离解,形成溶液中的离子。
电离度可以用来描述溶液中溶质的离解程度,它通常用符号α表示,取值范围在0到1之间。
二、电离平衡常数的计算电离平衡常数是指在一定温度下,溶液中物质的电离反应的平衡常数。
对于一般的电离反应,可以用离子浓度的比值来表示电离平衡常数。
以酸碱反应为例,对于弱酸HA的电离反应:HA ⇌ H+ + A-电离平衡常数Ka可以用下式表示:Ka = [H+][A-]/[HA]其中[H+]表示氢离子(质子)的浓度,[A-]表示阴离子的浓度,[HA]表示酸分子的浓度。
电离平衡常数的值越大,说明酸的电离程度越大。
三、影响电离度和电离平衡常数的因素1. 温度:温度对电离度和电离平衡常数有显著影响。
一般情况下,温度升高会使电离度和电离平衡常数增大。
这是因为温度升高会增加反应物分子的动能,使得反应速率增加,促进电离反应的进行。
2. 溶液浓度:溶液中物质的浓度对电离度和电离平衡常数也有影响。
一般来说,溶液浓度越高,电离度和电离平衡常数越大。
这是因为溶液浓度的增加会增加反应物分子之间的碰撞频率,从而促进电离反应的进行。
3. 溶剂性质:溶剂的性质对电离度和电离平衡常数也有一定影响。
不同溶剂对物质的电离程度有不同的影响。
例如,极性溶剂通常会增加物质的电离度和电离平衡常数,而非极性溶剂则相反。
4. 分子结构:物质的分子结构也会影响其电离度和电离平衡常数。
分子中的官能团以及原子间的键的强度等因素都会影响电离度和电离平衡常数的大小。
综上所述,化学物质的电离度与电离平衡常数是描述溶液中物质行为的重要指标。
电离平衡常数计算方法

电离平衡常数计算方法
一。
电离平衡常数那可是化学里头的重要概念,咱得好好唠唠它咋算。
1.1 先得搞清楚啥是电离平衡。
就好比一场拔河比赛,两边势均力敌的时候,那就是平衡状态。
在溶液中,电解质分子电离成离子的过程和离子重新结合成分子的过程达到平衡,这就是电离平衡。
1.2 而电离平衡常数呢,就是用来衡量这个平衡状态的一个重要指标。
它能告诉咱这电离反应进行的程度到底咋样。
二。
那咋算这电离平衡常数呢?
2.1 咱得有个化学方程式。
比如说醋酸的电离,CH₃COOH ⇌ CH₃COO⁻ + H ⁺,这电离平衡常数 K 就等于电离产生的离子浓度的乘积除以未电离的分子浓度。
2.2 举个例子,假设醋酸溶液中,氢离子浓度是 c(H⁺),醋酸根离子浓度是
c(CH₃COO⁻),醋酸分子浓度是 c(CH₃COOH),那电离平衡常数 K = c(H⁺)×c(CH₃COO⁻)÷c(CH₃COOH) 。
2.3 这里头要注意,浓度得是平衡时候的浓度。
而且计算的时候,单位得统一,可别马虎。
三。
再说说这计算过程中的要点。
3.1 得准确测量离子和分子的浓度。
这就像做饭得把材料量准了,不然味道可就不对啦。
3.2 还有啊,要考虑温度的影响。
温度不一样,这电离平衡常数也可能不一样。
就跟人在不同环境下表现不同一个道理。
掌握电离平衡常数的计算方法,对于理解化学反应的本质和规律那可是相当重要。
多做几道题,多琢磨琢磨,您就会发现其中的门道,这化学啊,也就变得有趣起来啦!。
电离平衡常数k和电离度α的关系公式

电离平衡常数k和电离度α的关系公式电离平衡常数k和电离度α的关系公式在化学反应中,电离平衡常数k和电离度α是两个重要的概念。
它们之间存在着一定的关系,本文将深入探讨这个关系,并通过简化的实例来解释这一关系公式。
1. 电离平衡常数k的概念电离平衡常数k是描述化学反应中离子产生的程度的一个指标。
在一个平衡反应中,反应物会生成产物,同时产物也会再转变为反应物。
而电离平衡常数k则表示在平衡态时反应物和产物浓度之间的比例关系。
对于一般的电离平衡反应:aA + bB ↔ cC + dD其电离平衡常数k的表达式可由反应物和产物的物质浓度表示如下:k = [C]^c [D]^d / [A]^a [B]^b其中,[A]、[B]、[C]和[D]分别表示反应物A、B和产物C、D的物质浓度。
2. 电离度α的概念电离度α是电离反应中,反应物转化为离子形式的程度。
它表示的是溶液中的溶质分子中有多少被电离成离子的,是一个以百分比(%)表示的数值。
对于单一物质的电离反应,电离度α的表达式可以表示为:α = (电离物质的浓度) / (电解质的浓度)× 100%电解质的浓度是指溶液中所有电离出来的粒子的总浓度。
电离度α可以用来描述强弱电解质的离子化程度。
3. 电离平衡常数k与电离度α的关系公式电离平衡常数k与电离度α之间存在着一定的关系。
通过进一步的推导,可以得到它们之间的关系公式。
对于一元电离反应(仅涉及一个反应物和一个产物):A ↔ C+其电离平衡常数k的表达式可以简化为:k = [C+] / [A] = α这表明在一元电离反应中,电离平衡常数k等于电离度α。
这是因为一元电离反应中,反应物和产物的浓度之比就等于产生的离子与反应物的浓度之比。
对于多元电离反应(涉及多个反应物和产物),由于存在多个物质浓度之间的关系,电离平衡常数k与电离度α的关系则会更加复杂。
4. 个人观点和理解电离平衡常数k和电离度α是描述电离反应的两个重要指标,它们分别从整体和局部的角度衡量了反应的特征。
高中化学 电离度电离平衡常数

[H+]/(mol.L-1)
5.90×10-4 1.32×10-3 1.86×10-3
结果表明增大c(HAc)的浓度,[H+]浓度增大,但电离 度却是减少的。这是因为HAc的电离度是一个比值, 即α=[H3O+]/c(HAc)。α与[H3O+]及c[HAc]都有关。
7
• 在25℃,0.1mol/L的下列弱电解质的电离度分 别为:
B、CH3COO-
C、OH-
D、C2H5O-
17
例:某二元弱酸溶液按下式发生电离H2A H+ +HA—, HA— H+ + A 2— , 已知K1>K2,设有下列四种溶液:
A .0.01mol/L的H2A B . 0.01mol/L的NaHA溶液 C . 0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
• α= 132/10000×100% = 1.32%。
3
3、电离度的测定方法(见教材76页)
CH3COOH
CH3COO - + H+
纯HAc溶液中,忽略水解离所产生的H+,达到平衡时:
测得已知浓度的HAc 的pH ,由 pH =-lg c(H+), 计算出c(H+),即可算出α。
4
4、影响电离度大小的因素
2. 已知某二元酸H2A,其电离方程式为
H2A→H+ +HA— ;HA— H+ +A2— 。测得25℃时 0.1mol/L的H2A溶液中c(H +)=0.11mol/L,该条件下 HA—的电离度是
A. 1 % B. 9.1 % C. 10 % D. 20 %
24
某氨水的pH=a, 其中水的电离度为1;某硝酸的pH=b , 其中水的电离度为2 ;且a+b= 14,a>11。将氨水和硝酸 等体积混合后,所得溶液中其中水的电离度为3。相同 条件下纯水的电离度为4。则下列关系中正确的是
电离平衡常数

电离平衡常数1.表达式(1)一元弱酸HA 的电离常数:根据HA H ++A -,可表示为K a =c (A -)·c (H +)c (HA )。
(2)一元弱碱BOH 的电离常数:根据BOH B ++OH -,可表示为K b =c (B +)·c (OH -)c (BOH )。
2.特点(1)电离平衡常数与温度有关,与浓度无关,升高温度,K 值增大。
(2)电离平衡常数反映弱电解质的相对强弱,K 越大,表示弱电解质越易电离,酸性或碱性越强。
(3)多元弱酸的各级电离常数的大小关系是K 1≫K 2≫K 3……,故其酸性取决于第一步电离。
3.电离平衡常数的应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
例1 相同温度下,根据三种酸的电离常数,酸 HX HY HZ 电离平衡常数9×10-79×10-61×10-2则三种酸的强弱关系:HZ>HY>HX 。
(2)定量判断电离平衡移动的方向、解释移动的原因。
例2 0.1 mol·L -1的CH 3COOH 溶液加水稀释,平衡移动方向的判断,溶液中c (H +)的变化情况。
答案CH 3COOHH ++CH 3COO -原平衡: c (CH 3COOH) c (H +) c (CH 3COO -) 假设稀释 c (CH 3COOH )n c (H +)n c (CH 3COO -)n至n 倍后:Q =c (H +)n ·c (CH 3COO -)n c (CH 3COOH )n =c (H +)·c (CH 3COO -)n ·c (CH 3COOH )=K an <K a (n >1)所以电离平衡向电离方向移动。
移动的结果使c (CH 3COOH)减小,由于平衡常数不变,故c (H +)和c (CH 3COO -)都必然减小。
电离平衡常数概念

电离平衡常数的概念定义电离平衡常数是指在一定温度下,当气体或溶液中的化学物质发生电离反应时,反应体系达到动态平衡时,离子浓度的乘积与反应物浓度的乘积之比的常数。
通常用K表示。
对于一般的电离反应: A + B ⇌ C + D其电离平衡常数可以表示为: K = [C][D] / [A][B]其中,方括号表示物质的浓度。
重要性电离平衡常数是研究化学反应平衡的重要工具,具有以下重要性:1.揭示反应趋势:电离平衡常数能够反映反应体系中化学物质的相对浓度,从而揭示反应的趋势。
当K > 1时,反应偏向生成物的生成;当K < 1时,反应偏向反应物的生成;当K = 1时,反应物与生成物浓度相等,反应体系处于平衡状态。
2.影响反应速率:电离平衡常数与反应速率密切相关。
当反应体系处于平衡状态时,正反应和逆反应的速率相等,反应速率与电离平衡常数有关。
3.预测反应方向:通过比较反应物和生成物的浓度与电离平衡常数的大小,可以预测反应的方向。
如果反应物浓度大于电离平衡常数,反应向反应物方向进行;如果反应物浓度小于电离平衡常数,反应向生成物方向进行。
4.优化化学工艺:通过调节反应条件,如温度、压力、浓度等,可以改变电离平衡常数,从而优化化学工艺的产率和效率。
应用电离平衡常数的应用广泛,涉及多个领域,包括化学、生物、环境等。
以下是一些常见的应用:1.酸碱平衡:电离平衡常数在酸碱反应中起着重要作用。
对于弱酸和弱碱的电离反应,可以通过电离平衡常数来判断酸碱的强弱,以及酸碱溶液的pH值。
2.配位化学:电离平衡常数在配位化学中也有重要应用。
配位反应中的络合物的形成常数可以通过电离平衡常数来确定,从而了解配位反应的平衡情况。
3.溶解度平衡:电离平衡常数在溶解度平衡中起着关键作用。
通过电离平衡常数,可以确定溶解度积,进而预测溶液中某物质的溶解度。
4.化学反应平衡:电离平衡常数在一般化学反应中也有应用。
通过电离平衡常数,可以预测反应的平衡位置和方向,优化反应条件,提高反应产率和效率。
强酸的电离平衡常数

强酸的电离平衡常数
在化学中,强酸是指能够完全电离产生H+离子的酸。
强酸的电离平衡常数是描述酸的强弱程度的一个重要指标。
它是酸的离子化程度的定量表示,通常用Ka来表示。
电离平衡常数Ka是酸的离子化反应中产生的H+离子和酸的母体分子之间的浓度比值。
它的数值越大,说明酸的离子化程度越高,酸越强。
强酸的电离平衡常数一般都非常大,这意味着强酸的离子化程度非常高。
例如,硫酸的电离平衡常数约为10^3,而盐酸的电离平衡常数约为10^7,这表明盐酸的离子化程度要高于硫酸。
强酸的电离平衡常数的大小受到很多因素的影响,其中包括酸的分子结构、溶液的温度和离子间的相互作用等。
不同酸的电离平衡常数也不尽相同。
酸的电离平衡常数与酸的pKa值之间存在着一定的关系。
pKa是指酸的负对数常数,它与Ka的关系是pKa = -log10(Ka)。
因此,pKa 的数值越小,说明酸的电离平衡常数越大,酸越强。
强酸的电离平衡常数在化学实验和工业生产中有着广泛的应用。
它可以用来评估酸的强弱,指导实验设计和反应控制。
通过调节反应条件,可以控制酸的电离平衡常数,从而实现所需的反应效果。
强酸的电离平衡常数是描述酸的离子化程度的重要参数。
它反映了酸的强弱程度,对于理解酸碱反应和控制化学反应具有重要意义。
通过对强酸的电离平衡常数的研究,我们可以更好地理解酸的性质和化学反应的规律,为化学科学的发展做出贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电离平衡常数
弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量为幂的乘积的比值,即溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数。
这个常数叫电离平衡常数,简称电离常数。
目录
[1]弱电解质AxBy在水溶液中达到电离平衡时:
AxBy==可逆==xA+ + yB-
则,K(电离)=C[A+]^x·C[B-]^y/ C[AxBy] 式中C[A+]、C[B-]、C[AB]分别表示A+、B-和AxBy 在电离平衡时的物质的量浓度。
电离平衡常数的大小反映弱电解质的电离程度,不同温度时有不同的电离常数。
在同一温度下,同一电解质的电离平衡常数相同.但随着弱电解质浓度的降低.转化率会增大.由该温度下的解离度a=(K/起始浓度)的算术平方根.可得知:弱电解质浓度越低电离程度越大. 编辑本段电离常数
弱电解质电离常数
[2]条件是在室温下(25°C)。
Ka表示弱酸的电离常数,Kb表示弱碱的电离常数,pKa(pKb)表示其负对数。
弱酸
名称化学式Ka pKa
硼酸H
3BO
3
5.8×10ˆ-10(Ka1)9.24
碳酸H
2CO
3
4.5X10ˆ﹣7(Ka1)
4.7X10ˆ-11(Ka2)
6.35
10.33
砷酸H
3AsO
3
6.3X10ˆ-3(Ka1)
1.0X10ˆ-7(Ka2)
3.2X10ˆ-12(Ka3)
2.20
7.00
11.50
亚砷酸HAsO
2
6.0X10^-10 9.22
氢氰酸HCN 6.2X10^-10 9.21
铬酸HCrO
4
- 3.2X10^-7(Ka2) 6.50 氢氟酸HF 7.2X10^-4 3.14
亚硝酸HNO
2
5.1X10^-4 3.29
磷酸H
3PO
4
7.6X10^-3(Ka1)
6.3X10^-8(Ka2)
4.4X10^-13(Ka3)
2.12
7.20
12.36
焦磷酸H
4P
2
O
7
3.0X10^-2(Ka1)
4.4X10^-3(Ka2)
2.5X10^-7(Ka3)
5.6X10^-10(Ka4)
1.52
2.36
6.60
9.25
亚磷酸H
3PO
3
5.0X10^-2(Ka1)
2.5X10^-7(Ka2)
1.30
6.60
醋酸CH
3
COOH 1.8X10^-5 4.75 氰酸HCNO 1.2X10^-4 3.92
氢硫酸H
2S
5.7X10^-8(Ka1)
1.2X10^-15(Ka2)
7.24
14.92
硫酸HSO
4
- 1.0X10^-2(Ka2) 1.99
亚硫酸H
2SO
3
1.3X10^-2(Ka1)
6.3X10^-8(Ka2)
1.90
7.20
硫氰酸HSCN 1.4X10^-1 0.85
偏硅酸H
2SiO
3
1.7X10^-10(Ka1)
1.6X10^-12(Ka2)
9.77
11.8
弱碱
名称化学式Ka(b)pKb
氨水NH
3· H
2
O 1.8X10^-5 4.74
联氨(肼)N
2H
4
3.0X10^-6(Kb1)
7.6X10^-15(Kb2)
5.52
14.12
苯胺C
6H
5
NH
2
4.2X10^-10 9.38
羟胺NH
2
OH 9.1X10^-9 8.04
甲胺CH
3NH
2
4.2X10^-4 3.38
乙胺C
2H
5
NH
2
5.6X10^-4 3.25
参考资料
•1.人民教育出版社高中化学选修4《化学反应原理》
•2.王明德(主编)赵清泉刘廉泉.《分析化学》.北京:高等教育出版社,1986:附录1.
相关文献
•大学化学教材使用统一常数的必要性-科技创新导报-2012年第31期 (3)
•有效数字在医用化学实验中的应用-广东化工-2012年第14期 (2)
•有关“溶液中的离子平衡”考点的分析-广东教育:高中版-2012年第10期 (3)以上文献来自于
>> 查看更多相关文献
词条标签:
百度百科中的词条正文与判断内容均由用户提供,不代表百度百科立场。
如果您需要解决具体。
