GSV申请表格
GSP认证申请书及GSP认证相关表格全套

G S P认证申请书及G S P认证相关表格全套集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]附件1受理编号:药品经营质量管理规范认证申请书申请单位: (公章)填报日期年月日受理部门:受理日期:年月日填报说明1、内容填写应准确、完整,不得涂改和复印。
2、报送认证申请书及其他申报情况表时,按有关栏目填写执业药师或专业技术职称和学历的情况,应附有执业药师注册证书或专业技术职称证书和学历证书的复印件。
3、认证申请书以及其他申报资料,应统一使用A4型纸张,标明目录及页码并装订成册。
附件2企业负责人员和质量管理人员情况表填报单位:(盖章)填报日期: 年月日注:1、填报本表时,请将执业药师注册证书或专业技术职称证书(学历证书)的复印件附后。
2、表中的企业质量负责人应在备注栏中注明。
附件3企业药品验收养护人员情况表填报单位:(盖章)填报日期: 年月日注:填报本表是,请将执业药师注册证书或专业技术职称证书(学历证书)的复印件附后。
附件4企业经营设施、设备情况表填报单位:(盖章)填报日期: 年月日填写说明:1、根据企业设施、设备的实际填写。
如无栏目所设项目,应注明“无此项”。
2、表中所有面积均为建筑面积,单位为平方米。
3、“营业场所及辅助、办公用房”栏目中“辅助用房”指库区中服务性或劳保用房。
附件5企业所属药品经营单位情况表填报单位:(盖章)填报日期: 年月日附GSP认证申报资料初审表注:本表由初审部门根据审查结果填写。
“审查结果”栏根据实际情况填写“合格”或“合理缺项”字样。
GSP认证相关表格例表目录例表1 首营企业审批表例表2 首营品种审批表例表3 合格供货方档案表例表4 药品质量档案表例表5 药品购进验收记录例表6 进口药品验收记录例表7 中药饮片质量验收记录例表8 陈列药品质量检查记录例表9 在店药品养护记录例表10 处方药销售登记表例表11 中药饮片装斗复核记录例表12 近效期药品催销表例表13 不合格药品台帐例表14 设施设备一览表例表15 养护设备检修维护记录例表16 陈列/储存环境温湿度记录表例表17 员工培训计划例表18培训实施记录表例表19企业员工健康检查汇总表例表20职工健康档案例表21药品拆零记录首营企业审批表编号:填表日期:首营品种审批表编号:注:本表附药品生产许可证、营业执照、批准文件、质量标准、出厂检验报告书、样品、价格批文、GMP证书以及临床总结报告等资料。
2015年GSP认证申请表(上交)

受理编号:《药品经营质量管理规范》现场检查申请书申请企业名称:(公章)申请日期:年月日受理部门:受理日期:年月日哈尔滨市食品药品监督管理局填报说明1.现场检查申请书应为原件,用中性笔填写或打印,内容应准确、完整,不得涂改和复印。
2.报送GSP现场检查申请书及其它申报情况表时,按有关栏目填写执业药师或专业技术职称和学历情况,应附有执业药师注册证书或专业技术职称证书和学历证书的复印件。
3.报送的资料及表格必须每页加盖企业公章并在规定位置填写日期。
68584.GSP检查申请书以及其它申报资料,应统一使用A4型纸张,标明目录及页码并装订成册,报送市局。
企业基本信息表企业名称注册地址邮政编码经营方式零售企业类型个体许可证编号黑DB经营范围处方药:中成药、化学药制剂、抗生素制剂、生化药品,甲类非处方药****乙类非处方药****。
开办时间2014年7月15日职工人数 3仓库地址无上年销售额(15万元)法定代表人无职务执业药师或技术职称企业负责人企业负责人中药师质量负责人质量负责人中药师质量管理部门负责人质量管理员中药师法定代表人联系电话联系人固定电话传真移动电话邮箱企业基本情况我店是经黑龙江省哈尔滨市药品监督管理局批准于2014年7月成立的药品零售企业。
企业负责人:,企业性质:个体;注册地址:,营业面积42平方米,经营范围:处方药:中成药、化学药制剂、抗生素制剂、生化药品,甲类非处方药****乙类非处方药****。
自开业以来,我店一直以GSP为准则,遵循“管理规范、品质保证、服务周到、信誉优良”的质量方针,建立了包括组织结构、职责制度、过程管理和设施设备等方面的质量管理体系,目前经营约一千品种,年销售额近15万元。
现有员工3人,其中药师2名,所有人员均具有高中以上学历。
药学技术人员配置符合《药品经营质量管理规范》的要求。
3食药监管局理见 市品品督理受意管理经办人: 审 批: 年 月 日(公章)现场检查情况 检查时间检查组成员检查结论自: 年 月 日 至: 年 月 日 组长: 组员:检查派出机构审核情况 检查派出机构负责人:年 月 日(公章) 公示情况公示时间公示形式公示结果自: 年 月 日 至: 年 月 日市级食品药品监督管理部门审批审查意见经办人: 年 月 日审核意见负责人: 年 月 日意见审批意见审批:年月日GSP现场检查申报资料审查目录审查项目审查结果一、《药品经营质量管理规范检查申请书》1份二、《药品经营许可证》正、副本、《营业执照》正、副本、《药品经营质量管理规范认证证书》复印件各1份三、上次认证检查或追踪检查《不合格项目情况表》复印件1份四、企业实施GSP情况报告1份,内容:1.企业的基本情况及上次认证以来《药品经营许可证》许可事项变更情况;药品经营质量管理体系的总体描述以及上一年度企业药品经营质量回顾分析;2.企业的组织机构及岗位人员配备情况;3.各岗位人员培训与健康管理情况;4.质量管理体系文件概况;5.设施与设备配备情况;6.相关设施设备的校准与验证情况;7.计算机系统概况;8.简述药品经营质量风险管控情况;9.企业药品经营活动各环节工作运转及其质量控制情况;10.企业实施电子监管工作情况;11.12个月内无违规经营造成的经销假劣药品的声明。
医疗器械体外诊断试剂临床试验申请表

填表日期:年月日编号:(由机构填写)
试验名称:
□ 医疗器械
□体外诊断试剂
商品名:
是否涉及人类遗传资源采集、收集、研究、开发、买卖、出口、出境等□是□否
医疗器械分类:□第一类□第二类□第三类(CFDA批件:□有□无)
试验分期:□上市前□上市后
是否进口产品:□是□否
是否赠送:□是□否
申办者监查员:
监查员电话:
机构责人签名:
主管院长签名:
注:请准确填写此申请表。试验结束后,以此申请表的内容为依据,由机构上报给CFDA。
目前我院是否有相同通用名试验医疗器械或体外诊断试剂在使用:□是□否
适应症:
临床试验目的:
型号/规格:
申办者:
CRO:
数据处理:□委托专业医学统计人员统计□由经过统计培训的研究者统计
数据统计单位名称:本机构计划完成例数:
计划开始时间:年月日
计划完成时间:年月日
专业组:
主要研究者签名:
QA签名:
科主任签名:
辐射安全许可证申请表

———————————————————————————————— 作者:
———————————————————————————————— 日期:
辐射安全许可证
申 请 表
申请文号:
申请单位(盖章)
申请日期
国家环境保护总局制
ﻬ
填 表 说 明
一、申请表封面右上角框内内容由环境保护主管部门填写。
(三)申请活动种类和范围填写申请许可种类和申请许可范围的组合,如生产Ⅰ类放射源和Ⅱ类放射源,使用Ⅰ类射线装置。
(四)特别的,生产、销售、使用非密封放射性物质的,申请活动种类和范围填写甲级非密封放射性物质工作场所、乙级非密封放射性物质工作场所或丙级非密封放射性物质工作场所。
建造Ⅰ类射线装置的,填写销售(含建造)Ⅰ类射线装置。
法定代表人签字:日期:
辐射安全许可内容申请
(一)放射源
(本表按规划设计规模量填写)
规划装置
名称
规划生产、销售、使用的放射性核素名称
规划生产、销售、
使用的放射性
核素类别
规划设计的
放射性总
活度(贝可)
活动种类
工作场所
名 称
辐射安全许可内容申请
(二)非密封放射性物质
(本表按规划设计规模量填写)
工作场所名称
四、“日等效最大操作量”、“最大等效年用量”、“工作场所等级”按照《电离辐射防护与辐射源安全基本标准》(GB18871-2002)确定。
五、辐射安全许可内容申请应按环境影响评价文件中的放射性同位素与射线装置生产、销售、使用设计规模和内容进行填写。
辐射工作单位基本情况
申请单位名称
申请单位地址
邮编
工作场所
gsp认证申请表

附件1
受理编号:药品经营质量管理规范认证申请书
申请单位: (公章)
填报日期年月日
受理部门:
受理日期:年月日
填报说明
1、内容填写应准确、完整,不得涂改和复印。
2、报送认证申请书及其他申报情况表时,按有关栏目填写
执业药师或专业技术职称和学历的情况,应附有执业药师注册证书或专业技术职称证书和学历证书的复印件。
3、认证申请书以及其他申报资料,应统一使用A4型纸张,
标明目录及页码并装订成册。
企业负责人员和质量管理人员情况表
注:1、填报本表时,请将执业药师注册证书或专业技术职称证书(学历证书)的复印件附后。
2、表中的企业质量负责人应在备注栏中注明。
企业药品验收养护人员情况表
注:填报本表是,请将执业药师注册证书或专业技术职称证书(学历证书)的复印件附后。
附
GSP认证申报资料初审表
注:本表由初审部门根据审查结果填写。
“审查结果”栏根据实际情况填写“合格”或“合理缺项”字样。
附件5:
企业经营设施、设备情况表
此项”。
2、表中所有面积均为建筑面积,单位为平方米。
3、“营业场所及辅助、办公用房”栏目中“辅助用房”指库区中服务
性或劳保用房。
药物临床试验申请表
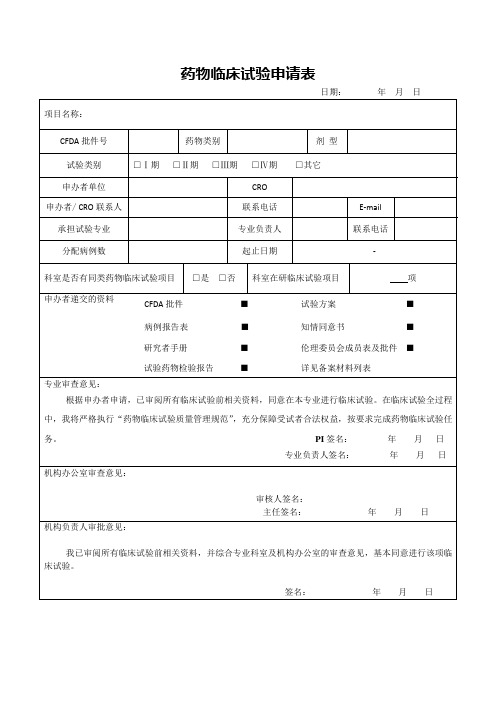
病例报告表■
知情同意书■
研究者手册■
伦理委员会成员表及批件■
试验药物检验报告■
详见备案材料列表
专业审查意见:
根据申办者申请,已审阅所有临床试验前相关资料,同意在本专业进行临床试验。在临床试验全过程中,我将严格执行“药物临床试验质量管理规范”,充分保障受试者合法权益,按要求完成药物临床试验任务。PI签名:年月日
专业负责人签名Biblioteka 年月日机构办公室审查意见:
审核人签名:
主任签名:年月日
机构负责人审批意见:
我已审阅所有临床试验前相关资料,并综合专业科室及机构办公室的审查意见,基本同意进行该项临床试验。
签名:年月日
药物临床试验申请表
日期:年月日
项目名称:
CFDA批件号
药物类别
剂型
试验类别
□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□其它
申办者单位
CRO
申办者/CRO联系人
联系电话
承担试验专业
专业负责人
联系电话
分配病例数
起止日期
-
科室是否有同类药物临床试验项目
□是□否
科室在研临床试验项目
项
申办者递交的资料
CFDA批件■
GSV申请单2014

Audit/Verification Application Form (CM/GSV/MQP/SQP/TGI/WCA)审核申请表Section 1: Service Request 审核需求:Section 5: This Part is for GSV Only GSVSection 8: Declaration of Consent同意声明 (For CM/GSV/MQP/SQP/TGI/WCA)1. The goal of the CM, WCA, GSV, TGI, MQP and SQP Programs are to help the manuf acturing and export community eliminate redundant assessment/audits. Manuf acturers/f acility that voluntarily choose to participate in these Program agree to an on-site independent assessments/audits, to measure and v erify how well their operation/management sy stem m eet the standards outlined in the programs. By signature below, the Applicant agrees and authorizes Intertek to share the audit results (when the f acility has met the requirement of granting Achiev ement Award / ROP) with our GSCC members where the f acility currently or plans to produce merchandise f or sale, as ev idence of accomplishing supply chain obligations.CM, WCA, GSV, TGI, MQP and SQP的目的是帮助制造商和进口商减少重复检验。
GSV申请表格

Form No.: GSV-F16 Issue Date: 18 Aug 2009 Issue No.: 02 Page 1 of 4nitial 初次审核 Re-Audit 跟进审核Annual Renewal 年度审核 (Registration No. 注册号_____________________)Application for GSV On Site VerificationGSV 申请表格Section 1: Invoiced Details 付费方信息Section 2: Details of Physical Facility to Be Visited 工厂联络资料Remark: The factory name and address filled above would be adopted directly for Certificate issuing without further confirmation.备注: 以上所填工厂名称及地址将直接引用于证书,不再另行确认。
Section 3: Basic Information 工厂基本资料Form No.: GSV-F16 Issue Date: 18 Aug 2009 Issue No.: 02 Page 2 of 4Form No.: GSV-F16 Issue Date: 18 Aug 2009 Issue No.: 02 Page 3 of 4Section 4: Confirmation by Intertek Intertek 确认Section 5: Declaration of Consent 同意声明The Applicant agrees that Intertek will list the certification information i.e. company name, registration number, certificate number, date of certification, and expiry date of the certificate, etc. on the certification directory which will be posted on the website for GSV certification.The goal of the Global Security Verification (GSV) Program is to help the foreign manufacturing and export community eliminate redundant inspections. Manufacturers that voluntarily choose to participate in GSV Program agree to an on-site independent security inspection, to measure and verify how well their security practices meet the standards outlined by international import security requirements. By signature below, the Applicant authorizes Intertek to share the security audit results with organizations the Applicant currently or plans to produce merchandise for sale, as evidence of accomplishing supply chain security obligations.If the Applicant is not the Physical Facility where the verification takes place, the Applicant agrees that Intertek to issue the GSV report and certificate to the above Physical Facility.申请人同意Intertek 在GSV 网站认证目录中登载认证信息,包括公司名称、注册号、证书号、认证日期和证书到期日等。
新兽用生物制品临床试验申请表

流水号:
新兽用生物制品临床试验申请表
(示范文本)
申请单位(盖章):XXXX生物技术有限公司
兽药名称:XXX病灭活疫苗
申请日期:XXXX 年XX 月XX 日中华人民共和国农业农村部制
填表说明
1. 本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。
一份表格仅限于一种制品,不同制品需另行填写。
字迹不清、项目填写不全者,不予受理。
2. 本表1~5栏由申请单位填写。
3. 本表签章复印件无效。
常见错误示例
申报临床试验申请时,缺少申请人与开展临床试验单位签订的临床试验协议书原件。
原因:应按照要求提供申请人与开展临床试验单位签订的临床试验协议书原件。
质量信用等级申请表

企业质量信用等级评价申请表企业名称(盖章)____________ 所属部门 ____________________ 企业代码 ____________________填报日期:二OO 年月日申报企业质量信用评价告知书开展工业企业质量信用等级评价工作, 是为了加强质量管理,提高产品质量水平,引导企业信守质量信誉,推进企业质量信用自律机制的形成,引导消费,切实维护消费者(用户)正当权益,维护公平竞争的市场经济秩序,促进国民经济又好又快的发展。
为维护工业企业质量信用等级评价工作的正常秩序,保证评价工作的科学、公正、公平、公开,特向申报工业企业质量信用等级评价的企业告知如下事项:一、工业企业质量信用等级评价工作坚持企业自愿申请,坚持科学、公正、公平、公开原则。
二、工业企业质量信用等级评价工作严格按照《镇江市质量信用等级评价管理办法》规定的程序进行,凡不属于《镇江市质量信用等级评价管理办法》规定的评价程序的任何活动,均与评价工作无关,对评价结果不产生任何影响。
三、镇江市工业企业质量信用评价专家评审组由镇江质量技术监督局、镇江市质量协会组织、委派。
未经许可或委托任何单位和个人都不能代表镇江质量技术监督局、镇江质量协会借企业质量信用等级评价名义开展任何形式的活动。
四、江苏省镇江质量技术监督局、镇江质量协会将对初选名单进行公示,接受社会各方面的监督。
五、工业企业质量信用等级评价由相关评价专家组按照评价细则进行。
评价专家组由行业协会、检测机构、科研院所和其他组织的专家以及消费者(用户)代表组成。
专家从专家库中随机产生。
政府部门的人员不参与评价过程。
六、企业在申请工业企业质量信用等级过程中,须恪守以下原则:1、申报企业要诚实守信,如实填写申报材料,保证申报数据的真实、可查。
2、申报企业要遵守公平、公正的原则,不得采取请客送礼等不正当手段,干扰评价工作。
3、企业的申请材料一律按规定的格式编制,通过当地质监部门统一报送。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Form No.: GSV-F16 Issue Date: 18 Aug 2009 Issue No.: 02 Page 1 of 4
nitial 初次审核 Re-Audit 跟进审核
Annual Renewal 年度审核 (Registration No. 注册号_____________________)
Application for GSV On Site Verification
GSV 申请表格
Section 1: Invoiced Details 付费方信息
Section 2: Details of Physical Facility to Be Visited 工厂联络资料
Remark: The factory name and address filled above would be adopted directly for Certificate issuing without further confirmation.
备注: 以上所填工厂名称及地址将直接引用于证书,不再另行确认。
Section 3: Basic Information 工厂基本资料
Form No.: GSV-F16 Issue Date: 18 Aug 2009 Issue No.: 02 Page 2 of 4
Form No.: GSV-F16 Issue Date: 18 Aug 2009 Issue No.: 02 Page 3 of 4
Section 4: Confirmation by Intertek Intertek 确认
Section 5: Declaration of Consent 同意声明
The Applicant agrees that Intertek will list the certification information i.e. company name, registration number, certificate number, date of certification, and expiry date of the certificate, etc. on the certification directory which will be posted on the website for GSV certification.
The goal of the Global Security Verification (GSV) Program is to help the foreign manufacturing and export community eliminate redundant inspections. Manufacturers that voluntarily choose to participate in GSV Program agree to an on-site independent security inspection, to measure and verify how well their security practices meet the standards outlined by international import security requirements. By signature below, the Applicant authorizes Intertek to share the security audit results with organizations the Applicant currently or plans to produce merchandise for sale, as evidence of accomplishing supply chain security obligations.
If the Applicant is not the Physical Facility where the verification takes place, the Applicant agrees that Intertek to issue the GSV report and certificate to the above Physical Facility.
申请人同意Intertek 在GSV 网站认证目录中登载认证信息,包括公司名称、注册号、证书号、认证日期和证书到期日等。
全球供应链安全验证(GSV)的目的是帮助国外制造商和进口商减少重复检验。
自愿加入GSV 的制造商同意接受独立的现场安全检验,以评估和验证其安全操作是否符合国际进口安全标准的要求。
在文件以下部分签字后,申请人则授权Intertek 与申请人目前或计划为其销售而生产商品的机构分享安全审核结果,作为履行供应链安全责任的证明。
如果申请人不是接受验证的实体工厂,则申请人同意Intertek 向上述实体工厂出具GSV
报告和证书。
Section 6: Confirmation by Customer 客户确认
Date 日期: 2010-5-5
This is to confirm for the above arrangement. 兹确认上述条款和安排
Our service is subject to our Terms & Conditions of Business. Details are separately attached.
有关的商业条款适用於此服务,详情请参考附件。
Please make sure the factory name and address in the application form is applicable to list in the certificate. Otherwise an extra cost of RMB 240 will be charged for any request of amendment on certificate.
请确认申请表上所列的工厂名称及地址适用于证书。
证书如需更改,我们将收取人民币240元的证书修改费。
Cancellations or rescheduling requested more than 2 business days & within 5 business days before the committed audit window will be liable for 50% of the full audit charge in addition to traveling expenses already incurred and non-refundable. If notice of cancellation or rescheduling of a monitoring visit is requested with 48 hours (2 business days) notice or less of the scheduled audit date, the full audit fee is charged in addition to any non-refundable and already incurred traveling expense.
Form No.: GSV-F16 Issue Date: 18 Aug 2009 Issue No.: 02 Page 4 of 4
如果出现下列情况,申请方将承担相应的损失费用:在已确认的验厂日期前两至五个工作日内通知我方取消或更改已确认的验厂日期,申请方承担50%审核费及实际产生的差旅费。
在已确认的验厂日期前48小时内(两个工作日)通知我方取消或更改已确认的验厂日期,申请方承担全部审核费及实际产生的差旅费。
Normally, the GSV certificate would be valid for 12 months. For more details, please contact our GSV Coordinator. 通常情况下,GSV 证书有效期为12个月。
有关认证时间的其它详情,敬请联络Intertek GSV 协调员。
