人教版初三化学知识点总结:组成与结构
人教版九年级化学知识点总结

人教版九年级化学知识点总结一、化学基本概念1. 化学的定义,化学与其他学科的关系2. 物质的分类与性质3. 常见元素、化合物的性质与应用4. 物质的组成、结构和改变二、化学元素、周期表与原子结构1. 元素的基本概念与分类2. 元素的符号、原子序数、相对原子质量和电子结构3. 元素周期表的组成和结构4. 元素周期表的周期性规律、元素周期律三、化学方程式与化学计算1. 化学方程式的基本概念与形式2. 物质的量和化学计算3. 化学方程式与化学计算的应用四、物质的氧化与还原1. 氧化与还原的基本概念2. 元素的氧化性和还原性3. 物质的氧化与还原反应五、物质的结构1. 原子的核和外层电子构造2. 元素键和化合价3. 分子的形状与分子极性4. 浓度概念及浓度计算六、酸碱与盐1. 酸、碱和盐的基本概念2. 酸溶液、碱溶液和盐溶液的鉴别方法3. 酸碱中和反应和酸、碱的性质4. 盐的化学性质和应用七、金属与非金属1. 金属的常见性质与分类2. 金属的常见化合物与应用3. 非金属的常见性质与分类4. 非金属的常见化合物与应用八、高分子化合物1. 高分子化合物的基本概念与分类2. 高分子化合物的合成与分解反应3. 塑料和纤维的应用九、化学能和化学反应速率1. 化学反应过程中的能量变化2. 化学能的利用与化学能的储存3. 化学反应速率的影响因素4. 化学平衡与动态反应过程十、化学与人类生活、环境保护1. 化学与人类生活的关系2. 对环境进行保护和污染预防的化学方法3. 化学对人类健康的影响及其防护以上是人教版九年级化学的主要知识点总结,希望对你有帮助。
人教版初三化学知识点总结归纳(完整版)

初中化學知識點全面總結(完整版)第1單元走進化學世界1、化學是研究物質的組成、結構、性質以及變化規律的基礎科學。
2、我國勞動人民商代會製造青銅器,春秋戰國時會煉鐵、煉鋼。
3、綠色化學-----環境友好化學(化合反應符合綠色化學反應)①四特點P6(原料、條件、零排放、產品)②核心:利用化學原理從源頭消除污染4(1)火焰:焰心、內焰(最明亮)、外焰(溫度最高)(2)比較各火焰層溫度:用一火柴梗平放入火焰中。
現象:兩端先碳化;結論:外焰溫度最高(3)檢驗產物H2O:用乾冷燒杯罩火焰上方,燒杯內有水霧CO2:取下燒杯,倒入澄清石灰水,振盪,變渾濁(4)熄滅後:有白煙(為石蠟蒸氣),點燃白煙,蠟燭複燃。
說明石蠟蒸氣燃燒。
5、吸入空氣與呼出氣體的比較結論:與吸入空氣相比,呼出氣體中O2的量減少,CO2和H2O的量增多(吸入空氣與呼出氣體成分是相同的)6、學習化學的重要途徑——科學探究一般步驟:提出問題→猜想與假設→設計實驗→實驗驗證→記錄與結論→反思與評價化學學習的特點:關注物質的性質、變化、變化過程及其現象;7、化學實驗(化學是一門以實驗為基礎的科學)一、常用儀器及使用方法(一)用於加熱的儀器--試管、燒杯、燒瓶、蒸發皿、錐形瓶可以直接加熱的儀器是--試管、蒸發皿、燃燒匙只能間接加熱的儀器是--燒杯、燒瓶、錐形瓶(墊石棉網—受熱均勻)可用於固體加熱的儀器是--試管、蒸發皿可用於液體加熱的儀器是--試管、燒杯、蒸發皿、燒瓶、錐形瓶不可加熱的儀器——量筒、漏斗、集氣瓶(二)測容器--量筒(1)量取液體體積時,量筒必須放平穩。
視線與刻度線及量筒內液體凹液面的最低點保持水準。
(2)量筒不能用來加熱,不能用作反應容器。
(3)量程為10毫升的量筒,一般只能讀到0.1毫升。
(三)稱量器--託盤天平(用於粗略的稱量,一般能精確到0.1克。
)注意點:(1)先調整零點(2)稱量物和砝碼的位置為“左物右碼”。
(3)稱量物不能直接放在託盤上。
2024年人教版初三化学知识点总结归纳

____年人教版初三化学知识点总结归纳本文总结了____年人教版初三化学的主要知识点。
以下是该学科的各个章节的重点概述。
第一章:物质的组成与分类本章主要介绍了物质的组成和分类方法。
重点掌握原子的结构、元素的定义与分类、化合物的定义与分类,以及混合物和纯净物的概念。
第二章:常见物质的分离与提纯本章重点介绍了常见物质的分离与提纯方法。
其中,重点掌握蒸馏、结晶、过滤、沉淀、脱色、蒸发和萃取等分离与提纯方法的原理与应用。
第三章:溶液与溶解本章主要介绍了溶液的定义、溶解的过程和溶液中溶质的浓度计算。
重点掌握溶解度、饱和溶液、稀溶液和浓溶液的概念。
此外,还要掌握溶解过程中的因素和溶解度与温度、压力的关系。
第四章:酸、碱和盐本章重点介绍了酸、碱和盐的定义、性质和常见的实验方法。
重点掌握酸碱中的氢离子和氢氧根离子的概念,了解酸碱中的常见物质的性质和实验方法。
同时,还要掌握酸碱中的pH值的计算和酸碱中的化学方程式。
第五章:金属与非金属元素本章重点介绍了金属元素和非金属元素的性质和常见的实验方法。
要掌握金属的常见性质,如导电性、延展性、熔点和沸点等,并能了解金属元素的常见用途。
对于非金属元素,要掌握非金属元素的一般性质和常见的实验方法,并了解非金属元素的化合价。
第六章:氧气和氧化还原本章重点介绍了氧气和氧化还原的概念和性质。
要掌握氧气的制备方法、性质和用途,并了解氧化还原反应的基本概念和特点。
此外,还要了解氧化还原反应的常见实验方法和应用。
第七章:化学反应与化学方程式本章主要介绍了化学反应和化学方程式的基本概念和表示方法。
要掌握化学反应的基本特点和分类,以及化学方程式的表示方法和平衡方程的构造。
同时,还要掌握利用化学方程式计算量的关系和平衡方程的简化计算方法。
第八章:化学能和化学反应速率本章重点介绍了化学能和化学反应速率的概念和计算方法。
要了解化学能的定义和计算方式,并掌握化学反应速率的计算公式和影响因素。
此外,还要掌握酶催化作用和催化剂在化学反应中的作用。
人教版初三化学第三章知识点总结
生物细胞中元素含量排列:氧﹥碳﹥氢﹥氮
元素的分类
• 元素
稀有气体元素:“气”字 头
金属元素:“金”字旁
固态非金属:“石”字
非金属元素
旁 液态非金属:“水”字旁
气态非金属:“气”字头
元素符号
1.元素符号的书写: 只用一个符号表示的要大写,用两个符号 表示的应该“一大二小”
而在化学变化中,分子破裂为原子,原子
重新结合形成新的分子。 2、纯净物与混合物的区别
由相同分子构成的物质是纯净物, 由不同种分子构成的物质是混合物。
(四) 原子结构示意图:
第一层 第二层 第三层(最外层)
弧线表示 电子层
+11 2 8 1 弧线上的数字表示各电子层上的电子数
数字1也可以表示 最外层电子数 圆圈表示 原子核 圈内数字表示 质子数 “+”表示 原子核带正电
三态的变化,由于分子之间空隙的变化, 分子本身的体积大小不变。
• (二)化学变化的实质
• 由分子直接构成的物质,在化学变化中:
•
分子分裂
原子
重新组合
新的分子
1.分子是保持物质化学性质的最小粒子,
而原子是化学变化中的最小粒子。
3.在化学变化中,分子可分,原子不可分。
(三)用分子的观点解释:
1、物理变化与化学变化的区别 在物理变化中,分子不会变成其他分子;
2.元素符号的含义 “O” 既表示 氧元素,又表示1个氧原子。 “H” 既表示氢元素,又表示1个氢原子。 “2H” 只能表示2个氢原子。
元素周期表
1.7个横行,即7个周期。
18纵行,16个族(8,9,10纵行共组1个族)。b.该原子的核外电子层数=所在周期数
九年级化学组成与结构知识点

化学是一门研究物质组成与结构、性质与变化规律的科学。
九年级化学主要学习物质的组成与结构知识点,包括元素、化合物、化学键、离子键、共价键、金属键等。
以下是九年级化学组成与结构的知识点。
一、元素与化合物1.元素:由相同类型的原子所组成的物质。
元素可以通过化学符号表示,如氢气表示为H₂,氧气表示为O₂。
2.化合物:由不同类型的元素通过化学键结合而成的物质。
化合物可以通过化学式表示,如水表示为H₂O,二氧化碳表示为CO₂。
二、化学键1.化学键:是原子间相互连接的力,使得原子可以形成分子或离子。
2.离子键:是由金属元素和非金属元素形成的化学键。
在离子键中,金属元素会失去电子形成阳离子,非金属元素会获得电子形成阴离子。
阳离子和阴离子通过电荷吸引力结合在一起。
3.共价键:是由非金属元素间形成的化学键。
在共价键中,原子通过共享电子来实现稳定。
4.金属键:是由金属元素间形成的化学键。
金属元素的原子通过电子海模型在整个金属晶体中相互连接。
三、有机化合物1.有机化合物:是含有碳元素的化合物。
碳元素具有四个价电子,可以与其他原子形成多种化学键。
有机化合物具有多样的性质和结构,是生物体和地球上各种化合物的重要组成部分。
2.烃:由碳和氢组成的有机化合物。
根据碳原子之间的连接方式,烃分为饱和烃(只有单键)和不饱和烃(含有双键或三键)。
3.醇:由羟基(–OH)取代烃链中一个或多个氢原子而形成的有机化合物。
4.醛:由羰基(C=O)取代烃链末端的氧化物而形成的有机化合物。
5.酮:由羰基(C=O)取代烃链中间的氧化物而形成的有机化合物。
6.羧酸:由羧基(–COOH)取代碳链中一个碳原子的有机化合物。
7.酯:由羧酸和醇反应生成的有机化合物。
四、化学反应与平衡1.化学反应:是物质之间发生变化的过程,包括生成新的物质、消耗原有物质或释放出能量等。
2.反应物:参与化学反应的起始物质。
3.生成物:化学反应的产物。
4.化学方程式:用化学式表示化学反应的反应物与生成物之间的摩尔比例关系。
初三化学人教版知识点(汇总6篇)

初三化学人教版知识点(汇总6篇)初三化学人教版知识点(1)1、我国古代三大化学工艺:造纸,制火药,烧瓷器。
2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。
3、构成物质的三种微粒:分子,原子,离子。
4、不带电的三种微粒:分子,原子,中子。
5、物质组成与构成的三种说法:(1)、二氧化碳是由碳元素和氧元素组成的;(2)、二氧化碳是由二氧化碳分子构成的;(3)、一个二氧化碳分子是由一个碳原子和一个氧原子构成的。
6、构成原子的三种微粒:质子,中子,电子。
7、造成水污染的三种原因:(1)工业“三废”任意排放(2)生活污水任意排放(3)农药化肥任意施放8、收集方法的三种方法:排水法(不容于水的气体),向上排空气法(密度比空气大的气体),向下排空气法(密度比)9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变。
10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低)。
11、复分解反应能否发生的三个条件:生成水、气体或者沉淀12、三大化学肥料:N、P、K13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物。
14、燃烧发白光的物质:镁条,木炭,蜡烛(二氧化碳和水)。
15、具有可燃性,还原性的物质:氢气,一氧化碳,单质碳。
16、具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用)。
17、CO的三种化学性质:可燃性,还原性,毒性。
18、三大矿物燃料:煤,石油,天然气。
(全为混合物)19、三种黑色金属:铁,锰,铬。
20、铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁。
21、炼铁的三种氧化物:铁矿石,焦炭,石灰石。
22、常见的三种强酸:盐酸,硫酸,硝酸。
23、浓硫酸的三个特性:吸水性,脱水性,强氧化性。
24、氢氧化钠的三个俗称:火碱,烧碱,苛性钠。
25、碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳。
26、实验室制取CO2不能用的三种物质:硝酸,浓硫酸,碳酸钠。
人教版初三化学第三章知识点总结

a
9
元素周期表
1.7个横行,即7个周期。 18纵行,16个族(8,9,10纵行共组1个族)。
2.由元素周期表可以得到的信息: a.原子序数=质子数 b.该原子的核外电子层数=所在周期数
3.从元素周期表的一个格可以得到的信 息:a. 该原子的名称 b.该原子的元素符号 c.该原子的原子序数 d.该原子的相对原子质量
3.在化学变化中,分子可分,原子不可分。
a
3
离子
• 由原子结构示意图我们知道, • 1.核电荷数=核外电子数 • 2.原子核带正电荷数=核外电子带负电荷数 • 3.核外电子分层排布,做高速运动,不稳定,容易得失电子,形成了带电荷的原子,即离子。
a
4
1.在化学反应中: 原子最外层电子数
<4易失电子
非金属元素
液态非金属:“水”字旁
气态非金属:“气”字头
a
8
元素符号
1.元素符号的含义 “O” 既表示 氧元素,又表示1个氧原子。 “H” 既表示氢元素,又表示1个氢原子。 “2H” 只能表示2个氢原子。
2.H O的含义: a.表示水这种物质 b.表示水是由水分子构成的 c.一个水2分子由2个氢原子和1个氧原子构成 d.表示水是由氢元素和氧元素组成的
• 3. 分子之间存在间隔,如热胀冷缩,物质三态的变化,由于分子之间空隙的变化,分子本身的体积大 小不变。
a
2
• 由分子直接构成的物质,在化学变化中:
• 分子
分裂
原子 重新组合
新的分子(新的 物质)
1.分子是保持物质化学性质的最小粒子,
而原子是化学变化中的最小粒子。
2.在物理变化中,分子不会变成其他分子;而在化学变 化中,分子破裂为原子,原子重新结合形成新的分子。
人教版九年级化学知识点总结

人教版九年级化学知识点总结一、概述九年级化学知识点的重要性九年级化学是初中化学的深化和拓展,对于学生来说具有重要的意义。
九年级化学知识点涵盖了物质、能量、生命活动等方面的基础理论,为学生的高中化学学习打下坚实的基础。
同时,九年级化学也是培养学生科学素养、实验操作能力和创新意识的重要阶段。
二、九年级化学主要知识点梳理1.物质的组成和分类:学习物质的组成元素、化合物和混合物的分类,了解化学符号和化学式的表示方法。
2.化学反应和化学方程式:掌握化学反应的基本类型、特征和规律,学会书写和解读化学方程式。
3.原子和分子:探讨原子的结构、性质和元素周期表的构建,了解分子的组成和性质。
4.元素周期表和周期律:熟悉元素周期表的结构,掌握周期律的规律,预测元素性质的变化。
5.溶液和浓度:学习溶液的组成、分类和浓度表示方法,了解溶液的性质和应用。
6.气体和气体定律:研究气体的性质、气体定律和气体摩尔体积,了解气体在生产和生活中的应用。
7.热力学和热力学定律:探讨热力学基本概念,如热量、内能和热力学第一、第二定律。
8.电化学:了解原电池和电解池的原理,掌握电极反应和电解方程式。
9.化学实验方法和技巧:学习实验基本操作,如称量、溶解、过滤、蒸馏等,提高实验技能。
三、如何高效学习九年级化学1.建立知识体系:梳理九年级化学知识点,形成完整的知识网络。
2.注重课堂笔记:认真听讲,及时记录重点内容,方便课后复习。
3.定期复习和总结:定期对所学知识进行复习和总结,巩固记忆。
4.做题巩固:多做练习题,提高解题能力和应试水平。
5.参加化学课外活动:积极参加化学竞赛、实验活动等,拓宽视野,提高兴趣。
四、九年级化学学习策略和建议1.把握学科特点,培养学习兴趣:了解化学学科的特点,培养对化学的兴趣。
2.合理安排学习时间:制定学习计划,合理分配学习时间,保证学习效果。
3.增强实验操作能力:多参加实验活动,提高实验操作技能。
4.理论联系实际,解决实际问题:将所学知识运用到实际问题中,提高解决问题的能力。
人教版初三化学知识点总结

人教版初三化学知识点总结化学作为一门自然科学,研究了物质的组成、性质和变化过程,是我们生活中不可或缺的一部分。
在初中化学学习中,我们逐渐了解了各种元素、化合物以及化学反应等知识。
本文将对人教版初三化学课程的知识点进行总结。
1. 元素与化合物在化学中,元素是指由相同类型的原子组成的物质,不能通过化学方法分解。
化合物则由两种以上不同类型的原子组成,可以通过化学方法分解。
元素的符号表示法采用元素符号,例如氧元素的符号是O,钠元素的符号是Na。
化合物的化学式表示方法是用元素的符号来表示,例如氧化钠的化学式是Na2O。
2. 原子与分子原子是构成物质无法再分的最小单元,由质子、中子和电子组成。
质子和中子位于原子核内,而电子则以轨道形式分布在原子核周围。
分子是由两个或更多原子结合而成的粒子,分子中的原子可以相同也可以不同。
例如氧气(O2)是由两个氧原子结合而成的分子。
3. 化学键与离子键化学键是原子之间形成的一种连接,分为共价键和离子键。
共价键是通过原子之间共享电子而形成的,常见于非金属元素的化合物中。
例如,水分子由氧原子和两个氢原子共享电子而形成。
离子键是由正离子和负离子之间的电化吸引力形成的。
正离子是失去了一个或多个电子的原子,负离子是获得了一个或多个电子的原子。
例如氯化钠(NaCl)是由钠离子和氯离子之间的电化吸引力形成的。
4. 化学反应化学反应指物质发生变化的过程。
化学反应的表示方法包括化学方程式和离子方程式。
化学方程式以化学式的形式表示化学反应。
例如,氧气和甲烷反应生成二氧化碳和水的方程式为:CH4 + 2O2 → CO2 + 2H2O。
离子方程式是在化学方程式基础上用离子表示化学反应。
例如,氯化钠溶于水后会分解成钠离子和氯离子:NaCl(s) + H2O(l) →Na+(aq) + Cl-(aq)。
5. 酸、碱与盐酸是指可以释放出氢离子(H+)的物质,具有酸味和酸性的性质。
碱是指可以释放出氢氧根离子(OH-)的物质,具有苦味和碱性的性质。
九年级化学物质组成知识点总结

九年级化学物质组成知识点总结化学是一门研究物质组成、性质、结构以及变化的科学。
在九年级的化学课程中,我们学习了许多关于物质组成的知识。
本文将对这些知识点进行总结,希望能够帮助同学们更好地理解和掌握化学的基础概念。
1. 化学元素化学元素是构成物质的基本单位。
元素由相同类型的原子组成,具有一定的化学性质。
目前我们已经发现了118个元素,其中92个是自然界中存在的,剩下的是人工合成的。
元素的化学符号是用来表示元素的缩写,如H表示氢元素,O表示氧元素。
2. 化合物化合物是由两种或两种以上元素以确定的比例化学结合而成的物质。
化合物的形成是通过元素之间的原子重新组合而成的。
例如水(H2O)是由氢和氧元素通过化学反应形成的,具有独特的性质。
3. 氧化还原反应氧化还原反应是化学反应的一种类型,是指物质失去或获得电子的过程。
其中,电子的失去被称为氧化,而电子的获得被称为还原。
氧化还原反应在日常生活中十分常见,比如钢铁生锈、果蔬变色都是氧化还原反应的例子。
4. 离子和离子化合物离子是带正电荷或负电荷的原子或原子团。
正离子是通过失去一个或多个电子形成的,带有正电荷;负离子是通过获得一个或多个电子形成的,带有负电荷。
离子化合物是由正离子和负离子通过静电引力相互结合而成的。
例如,氯化钠(NaCl)是由正离子钠离子和负离子氯离子组成的。
5. 分子和分子化合物分子是由两个或两个以上原子通过化学键相连而形成的。
分子可以是由同一元素的原子构成的,也可以是由不同元素的原子构成的。
分子化合物是由分子组成的化合物。
例如,水(H2O)是由两个氢原子和一个氧原子组成的。
6. 原子核与电子层原子核是位于原子中心的重要部分,由带正电荷的质子和不带电荷的中子组成。
电子层是环绕在原子核外的电子运动轨道,也是带负电荷的粒子。
原子核的质量远远大于电子,占据原子的大部分质量。
7. 元素周期表元素周期表是化学元素的组织和分类方式。
元素周期表按照元素的原子序数(即原子核中质子的数量)排列,原子序数从左上角到右下角递增。
人教版九年级化学知识点

人教版九年级化学知识点人教版九年级化学知识点概述一、化学基础知识1. 物质的组成与分类- 物质由元素组成,分为纯净物和混合物- 纯净物包括单质和化合物,单质由同种元素组成,化合物由不同元素组成2. 原子与分子- 原子是物质的基本单位,由原子核和电子组成- 分子是由两个或多个原子通过化学键结合而成的稳定粒子3. 元素周期表- 元素周期表是按照原子序数排列所有已知元素的表格- 元素周期表分为7个周期,18个族4. 化学式与化学方程式- 化学式表示物质的组成和分子的结构- 化学方程式表示化学反应的过程和物质的转化二、化学反应1. 化学反应的类型- 合成反应、分解反应、置换反应、还原-氧化反应2. 质量守恒定律- 化学反应前后,物质的总质量不变3. 能量变化- 化学反应通常伴随着能量的吸收或释放,如放热反应和吸热反应4. 化学平衡- 在一定条件下,反应物和生成物的浓度保持不变的状态三、常见物质的性质与变化1. 酸碱盐的性质- 酸是能够提供氢离子的物质,碱是能够提供氢氧根离子的物质 - 盐是酸与碱中和反应的产物2. 氧化还原反应- 氧化还原反应是指物质间发生电子转移的反应3. 金属与非金属的性质- 金属具有良好的导电性、导热性和延展性- 非金属具有多种性质,如不导电、易形成共价键等四、实验基本操作与安全1. 实验基本操作- 称量、溶解、过滤、蒸发、蒸馏等2. 实验室安全- 了解化学品的性质,正确使用实验器材,遵守实验室规则五、化学在生活中的应用1. 化学与健康- 食品添加剂、药物合成、营养学等2. 化学与环境- 空气和水污染的化学治理,绿色化学等3. 化学与材料- 金属、塑料、合成材料的化学性质和应用六、化学计算1. 物质的量与摩尔概念- 物质的量是表示物质所含实体数目的物理量,摩尔是物质的量的单位2. 化学反应的计量关系- 通过化学方程式计算反应物和生成物的质量关系3. 溶液的浓度计算- 质量分数、体积分数、摩尔浓度等以上是人教版九年级化学的主要知识点概述,每个知识点都需要通过具体的实例和练习来加深理解和应用。
人教版初三化学知识点总结

人教版初三化学知识点总结一、基本概念与原理1. 物质的组成- 物质由元素组成,元素由原子构成。
- 原子由原子核和核外电子组成。
- 原子核由质子和中子组成。
2. 物质的分类- 纯净物:由单一物质组成,具有固定性质。
- 混合物:由两种或两种以上物质混合而成,各组成部分保持原有性质。
- 单质:由同种元素的原子组成。
- 化合物:由不同元素的原子以固定比例结合而成。
3. 化学反应- 化学反应是指物质之间发生的化学变化,伴随能量变化。
- 反应物和生成物:参与反应的物质称为反应物,反应后生成的物质称为生成物。
- 化学方程式:用化学符号表示化学反应的式子。
4. 物质的性质- 物理性质:不需要发生化学变化就能表现出来的性质,如颜色、状态、密度、熔点、沸点等。
- 化学性质:物质在化学变化中表现出来的性质,如可燃性、氧化性、还原性等。
二、元素与化合物1. 常见元素- 氧、氢、碳、氮、钙、铁、铜等。
2. 常见化合物- 氧化物:由氧元素与其他元素结合形成的化合物,如二氧化碳、氧化铁。
- 酸:在水溶液中电离出的阳离子全部是氢离子的化合物,如硫酸、盐酸。
- 碱:在水溶液中电离出的阴离子全部是氢氧根离子的化合物,如氢氧化钠、氢氧化钙。
- 盐:由金属离子和酸根离子构成的化合物,如氯化钠、硫酸铜。
三、化学实验基础1. 实验器材- 试管、烧杯、酒精灯、滴定管、天平等。
2. 实验操作- 称量、溶解、过滤、蒸发、结晶等。
3. 实验安全- 穿戴实验服、防护眼镜,使用防护手套。
- 了解化学品的性质,正确处理废弃物。
四、化学计算1. 摩尔概念- 摩尔是物质的量的单位,表示含有一定数目粒子的集体。
2. 质量守恒- 化学反应前后,物质的总质量不变。
3. 化学方程式计算- 根据化学方程式和已知条件,计算反应物或生成物的质量。
五、常见化学现象1. 酸碱中和- 酸与碱反应生成盐和水的现象。
2. 氧化还原反应- 物质之间发生电子转移的反应。
3. 沉淀反应- 溶液中离子结合生成不溶于水的物质。
人教九上化学第三单元物质构成的奥秘知识点归纳

人教九上化学第三单元物质构成的奥秘知识点归纳课题1、分子和原子1、构成物质的粒子有:分子、原子、离子。
水〔H2O〕、二氧化碳〔CO2〕、氢气〔H2〕氧气〔O2〕氮气〔N2〕等由分子构成。
金属、固态非金属、稀有气体由原子构成。
氯化钠由离子构成。
NaCl由Na+和Cl-构成。
2、分子的特征:①分子的质量、体积都很小。
②分子总是在不停的运动,且温度越高,分子运动速率越快。
③分子间有距离,气态分子间距离较大。
④同种物质的分子化学性质相反,不同种物质的分子化学性质不同。
3、分子概念:①由分子构成的物质,分子是坚持物质化学性质最小的粒子。
例如:水的化学性质由水分子坚持。
②分子只能坚持物质的化学性质,不能坚持其物理性质。
4、分子由原子构成。
如水分子〔H2O〕是由氢原子、氧原子构成的。
一个过氧化氢分子〔H2O2〕是由两个氢原子和两个氧原子构成的。
5、用分子的观念区分物理变化和化学变化:化学变化有新的分子生成或是说分子的种类改动〔而原子的种类和数目都不变〕。
物理变化分子和原子都不变。
6、用分子的观念区分纯真物和混合物:纯真物由同种分子构成,有化学符号,混合物由不同种分子构成的,普通没有化学符号。
用分子的观念解释化学变化〔或是说化学变化的实质〕:在化学变化中,分子分裂成原子,原子重新构成新分子7、原子概念:原子是化学变化中的最小的粒子。
这里的最小粒子是指原子在化学变化中不能再分。
不是说任何状况下都不可再分。
8、分子与原子的比拟课题2、原子的结构1、原子构成:由居于原子中心带正电的原子核和核外带负电的电子构成。
原子核由质子和中子构成。
每个质子带一个单位的正电荷,每个电子带一个单位的负电荷,中子不带电。
2、原子不显电性的缘由:原子核内质子所带电荷与核外电子的电荷数量相等,电性相反。
3、在原子中:①质子数=电子数=核电荷数〔原子核带的正电荷数〕=原子序数②质子数不一定等于中子数;③不是一切原子都有中子〔氢原子无中子〕④不同类原子,质子数不同。
初中化学总结组成与结构的知识点

初中化学总结组成与结构的知识点组成与结构是化学中的重要知识点之一,它涉及到物质的组成成分以及其微观和宏观结构。
下面将以1200字以上的篇幅,对初中化学中与组成与结构相关的知识进行总结。
组成与结构是物质的基本特征之一,它揭示了物质的内部构造以及成分。
在化学中,物质的组成往往可以通过元素和化合物来描述。
元素是指由同种原子组成的纯粹物质,而化合物是指不同原子组成的化学物质。
首先,元素是一切物质的基础,他们由原子构成。
元素可以通过元素符号来表示,例如氧元素的符号为O,氢元素的符号为H。
元素在周期表中排列有序,根据元素的原子序数(即原子核中质子的数量)从小到大排列。
元素具有一些特定的性质,这些性质与元素的电子排布有关。
例如,氢元素只有一个电子,因此它在化学反应中常常失去或获得一个电子,形成氢阴离子(H-)或氢阳离子(H+)。
氧元素有八个电子,因此它倾向于接受两个电子,形成氧阴离子(O2-)。
化合物是由不同种类的元素组成的物质,其组成成分与比例是固定的。
化合物的组成可以通过化学式来表示,例如水的化学式为H2O,氯化钠的化学式为NaCl。
化合物的化学式中的元素符号代表了化合物中元素的种类,而下标表示了元素的相对比例。
例如,在化学式H2O中,H表示氢元素,2表示氢元素的相对比例是1:2,O表示氧元素。
化合物的不同组成会导致其性质的差异。
例如,水是由氢元素和氧元素组成的化合物,具有独特的物理和化学性质。
氯化钠是由钠元素和氯元素组成的化合物,常用作食盐。
在更深入研究物质的组成与结构时,需要了解元素与化合物的微观和宏观结构。
在原子层面上,元素由原子组成。
原子是不可分割的微小粒子,它由原子核和绕核电子组成。
原子核中包含了质子和中子,质子带正电荷,中子带中性。
绕核电子负责原子的化学性质,它们分布在不同的能级上,各能级上的电子数量与位置是特定的。
化合物的微观结构是由原子间的结合方式和排列方式决定的。
在化合物中,原子通过化学键连接在一起。
人教版九年级化学知识点总结

人教版九年级化学知识点总结化学知识点总结化学作为一门基础科学,研究物质的性质、组成、结构、变化规律以及与能量的关系。
它是学习生物学、地质学、环境科学以及工程学等学科的基础。
下面,我将为大家总结九年级化学的重点知识。
1. 物质的分类(1)纯物质:由同一种物质组成,可以分为元素和化合物两类。
- 元素:由相同种类的原子组成,不能进一步分解,如氧气、金属等。
- 化合物:由不同种类的原子组成,可以进一步分解,如水、二氧化碳等。
(2)混合物:由不同种类的物质组成,可以通过物理手段分离,如空气、海水等。
2. 原子结构(1)原子的组成:原子由核和电子构成。
- 核:由质子和中子组成,质子的数目决定元素的原子序数。
- 电子:位于原子核外围的负电荷粒子,决定了元素的化学性质。
3. 元素周期表(1)元素周期表的组成:元素周期表是根据元素的原子序数和电子排布规律构建的。
(2)元素的周期性规律:随着原子序数的增加,元素的性质呈现规律性变化。
4. 化学式和化学方程式(1)化学式:用化学符号和标记表示化学物质的组成关系和物质的种类,如H2O表示水。
(2)化学方程式:用化学符号和化学式表示化学反应的过程和生成物,如2H2 + O2 → 2H2O表示氢气与氧气生成水的反应。
5. 化学反应(1)反应速率:表示化学反应进行的快慢程度,受到温度、浓度、催化剂等因素的影响。
(2)氧化还原反应:指物质与氧气或其他氧化剂发生反应的过程,其中一个物质发生氧化,另一个物质发生还原。
6. 离子反应和电解(1)离子反应:涉及到离子的反应,离子是带电的原子或原子团。
(2)电解:通过电流将电解质溶液分解成离子的过程,是化学反应中重要的一种。
7. 化学式的计算(1)摩尔质量:表示元素或化合物相对分子式的质量。
(2)摩尔比和化学计量数:用于计算化学反应中物质的摩尔数之比。
8. 酸碱中和和盐(1)酸碱中和反应:酸和碱反应生成盐和水的过程。
(2)盐:由酸和碱中和反应生成的物质,常见的有氯化钠、硫酸铜等。
精选-人教版初三化学知识点总结:组成与结构

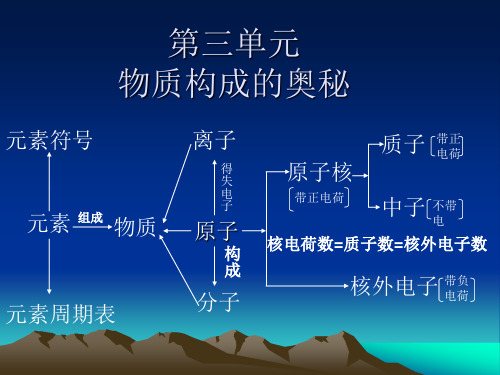
人教版初三化学知识点总结:组成与结构下面这篇人教版初三化学知识点总结:组成与结构是小编为了帮助大家而准备的,希望同学们认真阅读!1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。
原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D(氯分子)(A、Cl B、Cl- C、2Cl D、Cl2)。
保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。
在电解水这一变化中的最小粒子是氢原子和氧原子。
原子中:核电荷数(带正电)=质子数=核外电子数相对原子质量=质子数+中子数原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(正电)、中子(不带电)、电子(带负电)。
一切原子都有质子、中子和电子吗?(错!一般的氢原子无中子)。
某原子的相对原子质量=某原子的质量/C原子质量的1/12。
相对原子质量的单位是1,它是一个比值。
相对分子质量的单位是1。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。
)②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的。
纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。
氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
⑥化学式的意义:表示一种物质,表示这种物质的元素组成,表示这种物质的一个分子,表示这种物质的一个分子的原子构成。
⑦物质是由分子、原子、离子构成的。
由原子直接构成的:金属单质、稀有气体、硅和碳。
人教版初三化学知识梳理整理化学知识点帮助学生建立知识框架

人教版初三化学知识梳理整理化学知识点帮助学生建立知识框架化学是一门研究物质及其变化的科学。
在初中化学学习中,掌握并理解一些基本的化学知识点十分重要,因为它们是我们后续学习更高级化学概念的基础。
本文将对人教版初三化学知识进行梳理整理,帮助学生建立一个清晰的知识框架。
一、物质的分类物质是化学研究的基本对象,我们可以将物质分为纯物质和混合物两大类。
1. 纯物质纯物质是指由相同类型的粒子组成的物质,又可分为单质和化合物两类。
单质是由同种原子组成的物质,如金属元素、非金属元素等。
化合物是由两种或两种以上不同类型的元素以一定的化学比例结合而成的物质,如氧化铜、水等。
2. 混合物混合物是由不同种类的物质按一定比例混合而成的物质,例如饮料、空气等。
二、物质的性质物质的性质是指物质所具有的特点和表现形式,可以分为物理性质和化学性质两类。
1. 物理性质物理性质是指物质在物质本身的作用下所表现出的特点,例如颜色、形状、硬度等。
物质的物理性质可以通过观察和测量来获得。
2. 化学性质化学性质是指物质在与其他物质发生反应时所表现出的特点,例如燃烧、腐蚀等。
物质的化学性质需要通过实验探究来获得。
三、化学变化与能量变化化学变化是指物质发生化学反应时原有物质消失,新的物质生成的过程。
在化学反应中常伴随着能量的变化,主要包括放出热量和吸收热量两种形式。
1. 放热反应放热反应是指在反应过程中释放出热量的反应,可以使周围温度升高。
例如燃烧反应是一种常见的放热反应。
2. 吸热反应吸热反应是指在反应过程中吸收热量的反应,可以使周围温度降低。
例如溶解某些晶体时的溶解过程是一种吸热反应。
四、化学方程式化学方程式是用化学符号和化学式表示化学反应的方法。
它包括反应物、生成物和反应条件等信息。
化学方程式的基本要素包括化学符号、配平和反应条件。
1. 化学符号化学符号是用来表示元素的简化方式,由拉丁字母组成。
例如,氧元素的化学符号是O,氢元素的化学符号是H。
九年级上册化学知识点结构

九年级上册化学知识点结构化学是一门研究物质及其性质、组成、结构、变化规律和能量变化的自然科学。
在九年级上册化学课程中,我们将学习一系列的化学知识点,了解化学的基本原理和重要概念。
本文将按照知识点的体系结构,逐一介绍九年级上册化学知识点。
1. 物质的分类- 纯物质与混合物- 金属与非金属- 溶液与悬浮液2. 元素与化合物- 元素的概念与特征- 元素符号与元素周期表- 化合物的概念与特征- 氧化物、酸化物、碱性氧化物和酸性氧化物3. 化学式与化合价- 电子层次与电子结构- 化学式的表示方法- 阳离子与阴离子的化合价 - 化合价的计算与应用4. 化学方程式- 化学方程式的基本概念 - 反应物与生成物的表示 - 化学方程式的平衡与配平 - 化学方程式的应用5. 酸、碱与盐- 酸的定义与性质- 碱的定义与性质- 酸碱中和反应- 盐的生成与性质6. 常见氧化与还原反应- 氧化与还原的概念与特征- 氧化剂与还原剂的定义- 氧化还原反应的判断与应用7. 金属与非金属的化学性质- 金属与非金属的特征与性质- 金属的活动性与氧化性- 金属与酸、水、盐溶液的反应8. 非金属气体的性质和应用- 氮气、氧气、氢气和氯气的特征与性质 - 非金属气体的应用领域- 气体的制取与收集方法9. 碳化合物的基本概念与分类- 碳的特性与重要性- 有机物与无机物的区别- 碳化合物的分类与特征10. 碳氢化合物的结构与性质- 烷烃、烯烃和炔烃的结构与命名- 碳氢化合物的物理性质与化学性质- 碳氢化合物在生活中的应用这些化学知识点构成了九年级上册化学课程的核心内容。
通过学习这些知识点,我们将能够更好地理解物质世界的运作规律,培养科学思维和实验探究的能力。
希望同学们在化学学习中努力探索,提升自己的化学素养,为进一步学习和应用化学打下坚实的基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人教版初三化学知识点总结:组成与结构
下面这篇人教版初三化学知识点总结:组成与结构是小编为了帮助大家而准备的,希望同学们认真阅读!
1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。
原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D(氯分子)(A、Cl B、Cl- C、2Cl D、Cl2)。
保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。
在电解水这一变化中的最小粒子是氢原子和氧原子。
原子中:核电荷数(带正电)=质子数=核外电子数
相对原子质量=质子数+中子数
原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(正电)、中子(不带电)、电子(带负电)。
一切原子都有质子、中子和电子吗?(错!一般的氢原子无中子)。
某原子的相对原子质量=某原子的质量/C原子质量的1/12。
相对原子质量的单位是1,它是一个比值。
相对分子质量的单位是1。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合
物。
)
②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的。
纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。
氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
⑥化学式的意义:表示一种物质,表示这种物质的元素组成,表示这种物质的一个分子,表示这种物质的一个分子的原子构成。
⑦物质是由分子、原子、离子构成的。
由原子直接构成的:金属单质、稀有气体、硅和碳。
由分子直接构成的:非金属气体单质如H2、O2、N2、Cl2等、共价化合物、一些固态非金属单质如磷、硫等。
分子又是由原子构成的。
共价化合物是由非金属与非金属(或原子团)组成,如CO2、
H2O、SO3、HCl、H2SO4。
由离子直接构成的:离子化合物(金属与非金属或原子团)如NaCl、CaCl2、MgS、NaF、ZnSO4。
构成氯酸钾的微粒是K+、ClO3-。
3、决定元素的种类是核电荷数(或质子数),(即一种元素和另一种元素的本质区别是质子数不同或者核电荷数不同);
决定元素的化学性质的是最外层电子数。
同种元素具有相同的核电荷数,如Fe、Fe2+、Fe3+因核电荷数相同,都称为铁元素,但最外层电子数不同,所以他们的化学性质也不同。
核电荷数相同的粒子不一定是同种元素,如Ne、HF、H2O、NH3、CH4。
已知RO32-有32个电子,则R的质子数为:R+83+2=32
由查字典化学网为大家提供的人教版初三化学知识点总结:组成与结构就到这里了,愿大家学习愉快!。
