最新化学反应工程原理——热量传递与反应器的热稳定性共52页
最新化学反应工程原理——热量传递与反应器的热稳定性

1
热量传递过程对化学反应过程的影响
特点
不能忽略,有时比传质的影响严重
反应过程的热量传递按其尺度分为两类:
颗粒尺度的热量传递 设备尺度的热量传递
催化剂与流体 反应器与冷却介质
2
反应器中传热与换热过程中传热的区别
换热过程传热
单纯的传热,无化学反应
参数灵敏性和热稳定性是两个不同的概念。
9
9.2 催化剂颗粒的热稳定性
10
9.2.1 催化剂颗粒的定态温度
反应放热速率
Qg (H r ) RVp
T低时,过程为反应控制
n b
Qg (H r )kC Vp
T高时,过程为扩散控制
Qg (Hr )kg aCbVp
放热速率是一条S形曲线
11
反应热移走方式:
颗粒与流体传热—对流,唯一途径
颗粒间接触传热—传导,忽略不计
催化剂颗粒与周围流体间的传热速率为:
Qr ha(Ts Tb )Vp
移热速率线是一条直线
Q T Tb
12
定态时:
反应放热速率=向周围流体传热速率
Qr Qg
有三个交点 催化剂颗粒定态温度 TA、TB、TC
3
2 1
Tex—为催化剂颗粒的临界 熄火温度
4
22
临界着火和熄火条件:
着火和熄火时:Qg与Qr线相切—斜率相同
临界着火条件
(Qg )ig (Qr )ig
dQg
dQr ( )ig ( )ig dTs dTs
化学反应中的热量25页PPT

吸热反应
C+CO2(高温) H2+CuO(加热) C+H2O(高温) Ba(OH)2.8H2O+NH4Cl (常温)
CaCO3高温分解
H2(g)+通Cl常2(g把)化=学2H反C应l(过g)程中放出或 反应的能吸量收变的化热示量意称为图反: 应热.常用
符号△H表示点,单燃 位一般用
H2 + Cl2 kJ/m=ol 2HCl
化学反应中的热量
化学反应中的热量
利用化学反应:
一、制取新物质; 例如:实验室制取H2:
Zn + H2SO4 = ZnSO4 + H2↑
二、利用反应中的能量. 例如:碳的燃烧
阅读书上P32-33
探究一:
为什么化学反 应过程中会有放 热或吸热现象?
化学反应前后能量守衡:
反应物的总能量高
化 学 反 应
放 出 能
放 热
量
生成物的总能量低
生成物的总能量高
化 学 反 应
吸 收 能
吸 热
量
反应物的总能量低
一个化学反应吸 收能量还是放出 能量?
决定于反应物的总能 量与生成物的总能量 的相对大小。
探究二:
用化学键的观点来分析化
本质:学反应的本质过程是什么?
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
状态(g、l、s); 3、化学计量数只表示物质的量,
不表示分子数,因此必要时可以
用分数.
思考:氢气在氧气中燃烧生成水的三条
热化学方程式之间有什么区别?
2H2(g)+O2(g)==2H2O(l) △H= - 571.6kJ/mol ① H2(g)+1/2O2(g)==H2O(l) △H= -285.8kJ/mol ② H2(g)+1/2O2(g)==H2O(g) △H= -241.8kJ/mol ③
化学反应工程原理-副本第九章 热量传递与反应器的热稳定性
第九章热量传递与反应器的热稳定性
1.如何区分反应过程中的反应与传热的交联作用所产生的热稳定性问题和参数灵敏性问题?
2.
2.作出催化剂颗粒放热曲线和移热曲线,说明哪些点是稳定点,哪些点是不稳定点?稳定的条件是什么?
3. 作出催化剂颗粒放热曲线和移热曲线,说明哪些点是催化剂颗粒临界着火点,催化剂颗粒临界着火的条件是什么?哪些点是催化剂颗粒临界熄火点?催化剂颗粒临界熄火的条件是什么?
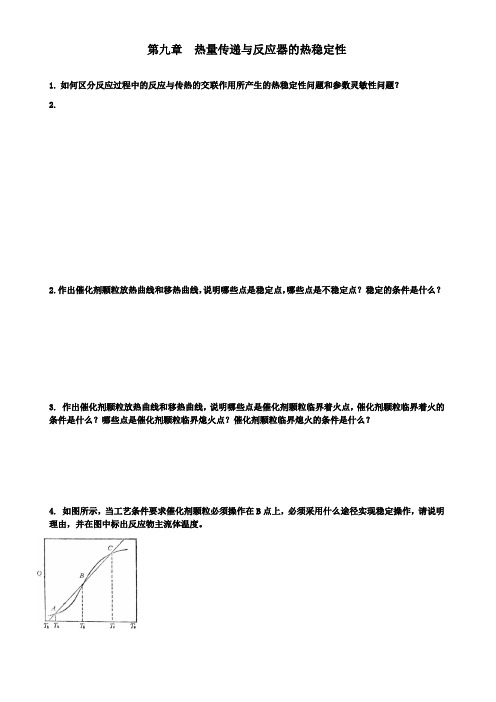
4. 如图所示,当工艺条件要求催化剂颗粒必须操作在B点上,必须采用什么途径实现稳定操作,请说明理由,并在图中标出反应物主流体温度。
环境工程原理热量传递PPT课件

传热速率 W
热阻(传热阻力)
热通量 W/m2
Q (T1 T2 ) T
R
R
q Q T Ar
传热热阻,K/W
温度差
温差 T 为传热的推动力。
单位传热面积的传热热阻 m2·K/W
传导距离越大,传热壁面和导热系数越小,则传热热阻越大
第13页/共55页
对流传热
流体中质点发生相对位移而引起的热量传递过程 对流传热仅发生在流体中 对流与热传导的区别: 流体质点的相对位移
对流换热过程是热传导与对流联合作用的结果。
第15页/共55页
第三节 对流传热
工程中常见的对流换热过程
流体的热交换
——间壁式换热器的换热过程 热交换器(换热器)
套管式换热器
列管式换热器
第16页/共55页
第三节 对流传热
(3)间壁式换热器热量传递过程: (1)热量由热流体传给固体壁面 对流传热 (2)热量由壁面的热侧传到冷侧 导热 (3)热量由壁面的冷侧传到冷流体 对流传热
第3页/共55页
第一节 热量传递的方式
在环境工程中,很多过程涉及加热和冷却: ❖对水或污泥进行加热; ❖对管道及反应器进行保温以减少系统的热量散失; ❖在冷却操作中移出热量。
环境工程中涉及的传热过程主要有两种情况: ❖强化传热过程,如各种热交换设备中的传热; ❖削弱传热过程,如对设备和管道的保温,以减少热量损失。
换热器
*列管式换热器
为防止壳体和管束受热膨胀不同导致的应力变形、管 子扭弯或松脱,常采用热补偿的方法,主要有以下几种:
浮头补偿 补偿圈补偿 U形管补偿
第45页/共55页
换热器
选择的原则:
⑴ 不清洁易结垢的物料应选管; ⑵ 需要通过增大流速以提高给热系数的流体应选管; ⑶ 腐蚀性流体宜走管程,以免管束和壳体同时受腐蚀; ⑷ 压力高的流体宜选管程,以防止壳体受压; ⑸ 蒸汽走壳程,冷凝液易于排出; ⑹ 被冷却的流体一般走壳程,便于散热; ⑺ 粘度大流量小流体选壳程,壳程Re>100即可达到湍流。
反应工程课件第三章2

自热过程:化工生产中的放热过程,通常
利用反应热加热原料,以达到反应所要求
V m3/s
的温度,这种过程称为自热过程。
热稳定性:是指定态的抗干扰能力,当外
界条件有一个小的扰动时,能否仍然达到
自热要求。
干扰
hh
t
对反应器的要求:
能自热平衡,维持反 应在恒温下进行,当外部 环境发生变化时,能保持 热稳定性。
1 km
CA0VR
(H
R
)k10
exp(
E RT
)
1
mk10
exp(
E RT
)
B、移热速率
Q CNT0CP(TT0)K(F TTC) (NT0CPK)F T(NT0CPT0KF C)T
(2)全混流反应器的多态
QRCA0V 1R kk ( mHR)CA0V 1R ( mkH 1R 0e)k1 x0epR x E (p T )R E (T )
f]/V [0CA0
xAfd]x 0 rA
讨论
(1) VRM 大于VRP
(2)
xA f
VRM VR P
(3) 平推流反应器与多级串联全混流反应器体积比较 多级全混流反应器串联操作可以减小返混,提高推
动力,缩小与平推流反应器的体积差别。
A、对一级不可逆反应
等体积的多级全混流反应器串联,设VRP与VRM分别表 示平推流与多级串联全混流反应器的反应体积,两者之
3.4.2 理想流动反应器的体积比较
如果在这些理想反应器中进 行相同的反应,采用相同的 进料流量与进料浓度,反应 温度与最终反应率也相同。 这几种反应器所需的体积是 否相同呢?
(1) 间歇反应器与平推流反应器体积比较 如果间歇反应器与平推流反应器中进行相同的反应,
化学反应工程原理-热量传递与反应器的热稳定性

04 热量传递与反应器热稳定 性关系
热量传递对反应器热稳定性影响
温度梯度
热量传递导致反应器内温度分布不均,形成温度 梯度,影响反应速率和选择性。
热应力
不均匀的温度分布导致反应器材料产生热应力, 可能引发破裂或变形。
热失控
过度的热量积累可能导致反应器热失控,引发安 全事故。
反应器热稳定性对热量传递要求
传热面积等。
选用高性能材料
选择具有优良传热性能和高温 稳定性的材料,如陶瓷、金属 合金等。
强化热量管理
采用先进的热量管理技术,如 热管技术、微通道反应器等, 提高热量传递效率。
引入控制系统
引入先进的温度控制系统,实 现反应温度的精确控制,确保
反应器热稳定性。
05 热量传递与反应器热稳定 性实验方法
热稳定性影响因素
01
反应器结构
反应器的形状、尺寸、材质和保温措施等结构因素都会影响其热稳定性。
例如,反应器壁面厚度和材质热导率会影响热量传递速率,从而影响热
稳定性。
02
操作条件
操作压力、温度、物料浓度和流速等操作条件对反应器的热稳定性也有
显著影响。例如,高温高压条件下,反应速率加快,热量生成增多,对
优化措施
为实现优化目标,采取了多种措施,包括 改进换热器设计、优化操作参数、实施节 能技术改造等。
THANKS FOR WATCHING
感谢您的观看
基于模拟的评价方法
通过建立反应器的数学模型,模拟不同操作条件下的温度响应过程,分析模拟结果中的温 度波动范围和稳定时间等参数,评价反应器的热稳定性。这种方法成本低、效率高,但模 型精度和适用性需要验证。
基于理论分析的评价方法
通过分析反应器内的热量传递和反应动力学过程,推导热稳定性的理论判据和评价方法。 这种方法具有普适性,但需要深入的理论分析和计算。
化学反应工程第三章

反应级数 反应速率
残余浓度式
转化率式
n=0
n=1
n=2 n级 n≠1
rA k
rA kCA
rA
kC
2 A
kt CA0 CA
kt CA0 xA
CA CA0 kt
xA
kt CA0
kt ln CA0 CA
CA CA0ekt
kt ln 1 1 xA
xA 1 ekt
kt 1 1
kt 1 xA
VR
V0CA0 xAf (rA ) f
式中 (rA) f 指按出口浓度计算的反应速率。
N A,CAf X Af
, 若 xA0 0 则物料衡算方程为:
[A流入量]-[A流出量]-[ A反应量]=累积量
NA '
NA
(rA ) f VR
0
N A ' N A0 (1 xA0 ) N A N A0 (1 xAf )
2级反应:CA
CA0 1 CA0kt
CA 随 t 缓慢下降。
对于一级或二级不可逆反应,在反应后期,CA的下降 速率,即xA的上升速率相当缓慢。若追求过低的残余 浓度,即过高的转化率,则在反应后期要花费大量的
反应时间。(见书上例3-1)
例 3-1 在间歇反应器中进行等温二级反应
A→B
反应速率
r
0.01C
应器中达到x=0.99,需要反应时间为10min,问:
(1)在全混流反应器中进行时, 应为多少?
(2)在两个串联全混流反应器中进行时, 又为多少?
第四节 多级全混流反应器的串联及优化
设有一反应,A的初始浓度为CA0,反应结束后最终浓度为 CAf,反应的平衡浓度为CA*,考察平推流反应器和全混流反应器 的浓度推动力。
反应器热稳定性

式(9.1-7)所表示的放热速率关于温度T是一条“S”型的曲线。
移热速率qr 和 放热速率qg
相交于点M、P、N。
在M、P、N点处,由于
qr= qg,所以称为定态操
作点。 在这三点处,温度TN> TP> TM,转化率xN> xP>
xM。
在这三点中, M、N 是稳 定态的操作点,P点是不 稳定的操作点。
9.1.2 全混流反应器的定态
对于一级不可逆放热反应,式(9.1-2)可以分为移热速 率和放热速率两部分:
移热速率: qr V0 c p (T T0 ) KA(T TC ) 放热速率: qg (rA )(H r )VR
(9.1-3) (9.1-4)
物料衡算式为: FA0 x Af VR (rA )
9.1.1 全混流反应器的热量衡算
全混流反应器为一敞开体系,对于定态操作,以进料温度T0 为基准温度,由式(3.1-2)得热量衡算式为:
Qin Qr Qu Qout Qb
已知:Qin V0 c pT0 Qout V0 c pT
Qr (rA )(H r )VR Qu KA(TC T ) Qb 0
T随T0的变化曲线是GAFBDE
T
DE
进料T0 温度变化路径 特殊点 特点
从G点 升温
从E点 降温
GAFDE EDBAG
着火点F F点T陡升 熄火点B B点T陡降
石油化学工程系
化学工程与工艺教研室
B
F
GA
T0
weigang
注意:
当进料温度在TA~ TD范围内时, 产生放热反应多定态现象(吸热反应 只有一个定态)。
化学工程与工艺教研室
weigang
化学反应工程原理

化学反应工程原理1 绪论1.1.3 优化的技术指标(1)反应速率(2)反应选择率(3)能量消耗1.1.4 决策变量(1)结构变量(2)操作方式(3)工艺条件1.4.1化学反应工程理论在反应过程开发中的作用要解决的问题:(1)反应器的合理选型(2)反应器操作的优选条件(3)反应器的工程放大2化学反应动力学2.2.1均相反应的条件(1)反应系统可以成为均相(2)预混合过程的时间远小于反应时间活化能的工程意义是反应速率对反应温度敏感程度的一种度量反应级数的工程意义是表示反应速率对于反应浓度变化的敏感程度2.3.3化学吸附的速率与平衡化学吸附可以分为活化化学吸附和非活化化学吸附。
活化化学吸附随着温度的变化服从阿伦尼乌斯方程;非活化化学吸附的活化能接近于零,吸附速率极快。
常常可以观察到化学吸附最初是非活化的,吸附进行得非常快,而随后速率变慢,且与温度有关,属于活化化学吸附1.理想吸附型理想吸附模型,基于如下假设(1)催化剂表面各处的吸附能力的均匀的,各吸附位具有相同的能量(2)被吸附物仅形成单分子层吸附(3)吸附的分子间不发生相互作用,也不影响分子的吸附作用(4)所有吸附的机理是相同的2.真实吸附模型不满足理想吸附条件的吸附,都称为真实吸附。
以焦姆金和弗隆德里希为代表提出不均匀表面吸附理论,真实吸附模型认为固体表面是不均匀的,各吸附中心的能量不等,有强有弱。
吸附时吸附分子首先占据强的吸附中心,放出的吸附热大。
随后逐渐减弱,放出的吸附热也愈来愈小。
由于催化剂表面的不均匀性,因此吸附活化能E a随着覆盖率的增加而线性增加,解吸活化能E d则随覆盖率的增加而线性降低,即2.4流固相非催化反应动力学两种反应(1)整体反应模型(2)收缩未反应芯模型3理想间歇反应器与典型化学反应的基本特征常见的典型化学反应(1)简单反应(包括自催化反应)(2)可逆反应(3)伴有平行副反应的复杂反应(或平行反应)(4)伴有串联副反应的复杂反应(或串联反应)(5)自催化反应3.1.2反应器设计基本方程(1)物料衡算方程组分i 流入量=组分i 流出量+组分i反应消耗量+组分i积累量(2)热量衡算方程式带入的热焓=流出的热焓+ 反应热+ 热量的积累+ 传向环境的热量(3)动量衡算方程式动量守恒物料衡算和反应速率式是描述反应器性能的两个最基本的方程式3.2.1理想间歇反应器的特征从理想间歇反应器操作可以看到有以下特点(1)由于剧烈的搅拌,反应器内物料浓度达到分子尺度上的均匀,且反应器内浓度处处相等,因而排除了物质传递问题(2)由于反应器内具有足够的传热条件,反应器内各处温度始终相等,因而无需考虑反应器内的热量传递问题(3)反应器内物料同时加入并同时停止反应,所有物料具有相同的反应时间。
第九章、热量传递与反应器的热稳定性课件

以Qg—T作图为一S形曲线,如下图示。 反应过程的移热速率:
假设T0=Tc,且ρ 、Cp不随温度变,则: 以Qr—T作图为一直线。
25
26
二、全混釜的热稳定性 A 、B 、C三点均为满足热平衡条件的定态点。
A点: 当有扰动使T略大于TA 时(dT>0),有Qg<Qr ,移热速
率大于放热速率,体系温度下降,自动恢复到a点。当有扰动使 T略小于TA 时,有Qg>Qr ,移热速率小于放热速率,体系温度 上升,自动恢复到A点。
催化剂与颗粒间的传热速率为:
15
催化剂在临界着火条件下的特征为: 在临界着火点处,反应温度较低,其极限反应速率远远小于
极限扩散速率,固可近似认为: CS=Cb ,则有: 将上式对Ts求导数:
16
将
代入:
对TS求导数得:
得:
又据:
两式相除得:
17
在临界着火点: TS=TSi , Tb=Tig 固有:
率小于放热速率,体系继续温度上降,直至到C点;
当有扰动使T略小于T B 时,有Qr>Qg ,移热速率大于放热 速率,体系温度继续下降,直至到A点。此点为不稳定点。
11
C点: 当有扰动使T略大于Tc 时(dT>0),有Qg<Qr ,移热速
率大于放热速率,体系温度下降,自动恢复到C点; 当有扰动使T略小于TC 时,有Qg>Qr ,移热速率小于放热
致反应温度和反应结果的剧烈变
化,灵敏性很高。 o
37
同样,在D点操作时,若传热系数U增大,其Qr线的斜率会 相应增大,操作点会由原D点移至E点,表现出极大的灵敏性。
若在E点操作, TC升高时, Qr线会右移,操作点会从E点升 至D’ 点;另外, U减小, Qr线的斜率会相应减小,也会造成操作 点的移动,使温度剧升,此现象称为“飞温”。
《化学反应的热效应》 讲义

《化学反应的热效应》讲义一、什么是化学反应的热效应在我们日常生活和化学研究中,经常会遇到各种各样的化学反应。
而当这些化学反应发生时,往往会伴随着能量的变化,这种能量变化以热量的形式表现出来,就被称为化学反应的热效应。
简单来说,化学反应的热效应就是指化学反应过程中吸收或放出的热量。
例如,燃烧煤炭会释放出大量的热,这就是一个典型的放热反应的热效应;而有些化学反应则需要吸收热量才能进行,比如氯化铵和氢氧化钡的反应。
为了更好地理解和研究化学反应的热效应,我们引入了一个重要的概念——焓变(ΔH)。
焓变是指在恒温、恒压条件下,化学反应的反应热。
当ΔH 为负值时,表示反应放热;当ΔH 为正值时,表示反应吸热。
二、热效应的测量要准确测量化学反应的热效应,我们需要借助一些专门的仪器和方法。
其中,最常用的仪器是量热计。
量热计的原理其实并不复杂。
它通过测量反应前后体系的温度变化,再结合体系的热容,就可以计算出反应所放出或吸收的热量。
例如,我们要测量一个燃烧反应的热效应。
首先,将一定量的反应物放入量热计中,然后点燃反应物,使其发生反应。
在反应过程中,量热计中的温度计会记录下温度的变化。
根据温度的升高或降低,以及量热计的热容,就可以计算出反应放出或吸收的热量。
在实际测量中,还需要考虑一些因素的影响,比如热量的散失、测量误差等。
为了减少这些因素的影响,实验中通常会采取一些措施,比如对量热计进行良好的绝热处理、进行多次测量取平均值等。
三、热化学方程式热化学方程式是用来表示化学反应与热效应关系的一种化学方程式。
它与普通化学方程式的不同之处在于,它不仅表明了反应物和生成物,还注明了反应的焓变。
例如,氢气和氧气反应生成水的热化学方程式可以表示为:2H₂(g) + O₂(g) = 2H₂O(l) ΔH =-5716 kJ/mol在这个热化学方程式中,“-5716 kJ/mol”表示每 2 摩尔氢气和 1 摩尔氧气反应生成 2 摩尔液态水时放出的热量为 5716 千焦。
化学反应的热效应

热效应在环境保护中的应用
01 废弃物处理
热效应对废物降解的影响
02 能源利用
利用热效应进行能源转化
03 温室气体排放控制
热效应对温室气体的影响
热力学与热化学的研究方向
新型材料研究
研究新型材料的热化学特 性 应用于材料科学和工程
能源转化技术
开发高效能源转化技术 提高能源利用效率
环境友好型工艺开发
可再生能源的热 效应
可再生能源的热效应 是未来能源发展的重 要方向,利用太阳能、 风能等可再生资源产 生热量,实现清洁能 源的转化。
新型材料的热效应
纳米材料
具有较高的比表 面积
光催化材料
可以利用光能进 行催化反应
91%
超导材料
在低温下表现出 良好的热性能
药物研究中的热效应
传统药物
热效应对药物稳定性有影 响 需要研究剂量与热效应之 间的关系
纳米药物
热效应可以提高药物的生 物利用度 可以加速药物的释放
基因疗法
热效应在基因传递中起重 要作用 热效应对基因治疗的效果 有影响
91%
宇宙中的热力学规律
01 黑洞热辐射
黑洞辐射熵是宇宙中的热力学规律之一
02 星际物质温度分布
星际物质的温度分布符合热力学定律
03 宇宙膨胀热效应
宇宙膨胀导致宇宙背景温度下降
化学反应的热效应
汇报人:XX
2024年X月
目录
第1章 热力学基础 第2章 化学反应的热效应 第3章 热化学方程式 第4章 热力学与热化学的应用 第5章 热力学与热化学的未来 第6章 总结与展望
● 01
第一章 热力学基础
热力学第一定律
热力学第一定律是能 量守恒定律,系统内 能的改变等于系统吸 收的热量减去对外界 做功的量。公式ΔU = Q - W。
理解化工装置中的传热原理

理解化工装置中的传热原理传热是化工装置中一个至关重要的过程,它涉及到能源的转移和利用。
理解传热原理对于优化装置设计、提高能源利用效率以及降低生产成本都具有重要意义。
本文将探讨化工装置中的传热原理,并介绍几种常见的传热方式。
首先,我们来了解传热的基本概念。
传热是指热量从一个物体传递到另一个物体的过程。
在化工装置中,热量的传递可以通过三种方式实现:传导、对流和辐射。
传导是指热量通过物体内部的分子振动和碰撞传递的过程。
在化工装置中,许多设备和管道都是由金属材料构成的,金属具有良好的导热性能,因此传导是常见的传热方式之一。
传导传热的速率取决于物体的导热系数、温度差和物体的厚度。
为了提高传导传热效率,可以选择导热性能良好的材料,或者增加物体的接触面积。
对流是指热量通过流体的运动传递的过程。
在化工装置中,许多工艺过程都涉及到流体的流动,因此对流传热是非常常见的。
对流传热的速率取决于流体的流速、温度差和流体的热传导系数。
为了提高对流传热效率,可以增加流体的流速,或者增加流体与固体物体的接触面积。
辐射是指热量通过电磁波辐射传递的过程。
辐射传热不需要传热介质,可以在真空中传递热量。
在化工装置中,辐射传热主要发生在高温设备和高温炉燃烧室中。
辐射传热的速率取决于物体的温度和表面特性。
为了提高辐射传热效率,可以选择具有较高辐射率的材料。
除了传导、对流和辐射,还有一种特殊的传热方式叫做相变传热。
相变传热是指物质在相变过程中释放或吸收热量的过程。
在化工装置中,许多工艺过程都涉及到物质的相变,比如蒸发、冷凝等。
相变传热的速率取决于物质的相变潜热和相变界面的传热系数。
为了提高相变传热效率,可以增加相变界面的面积,或者选择具有较高传热系数的传热介质。
在实际的化工装置中,通常会综合应用多种传热方式来实现高效的传热。
例如,在换热器中,通过将热源和冷却介质分别流过不同的管道,利用对流传热和传导传热来实现热量的传递。
在蒸馏塔中,通过将液体和气体在塔内交替流动,利用对流传热和相变传热来实现物质的分离。
化工传递工程.第六章 热量传递概论与能量方程

绝对零度以上,都能发射辐射能,但仅当物体间的温
度差较大时,辐射传热才能成为主要的传热方式。
05:09
14
齐齐哈尔大学化工学院
化工传递过程基础
四、同时进行导热、对流传热及辐射传热的过程
如前所述,热量传递有导热、对流传热和辐射传
热三种基本方式,根据具体情况,热量传递可以其中
05:09
6
齐齐哈尔大学化工学院
化工传递过程基础
浓度的自由电子在其晶格结构间运动,当存在温
度差时,自由电子的流动可将热量由高温区快速移向
低温区,这就是良好的导电体往往是良好的导热体的
原因,当金属中含有杂质,例如合金,由于自由电子
浓度降低,则其导热性能会大大下降;在非导电的固
体中,导热是通过晶格结构的振动来实现的,通常通
的热流速率可表示为
q A
k
dt dy
|s
h(ts
tb
)
F
FG
(TS4
T04
)
05:09
19
齐齐哈尔大学化工学院
化工传递过程基础
积分上式,可得导热通量为
热量传递与动量传递有着密切的联系,在研究方法
上,热量传递又与质量传递有许多类似之处,故本篇 内容在整个传递过程理论中具有承上启下的作用。
本篇内容包括第六至第八章。第六章介绍热量传递
概论及能量方程的推导;第七章阐述能量方程在热传 导中的求解和应用;第八章论述对流传热理论及其在 化学工程中的应用。
05:09
kA
dt dy
|s
hA(ts
tb
)
F
FG
A(TS4
T04
第4章 环境工程原理热量传递PPT课件

三、通过平壁的稳定热传导
第二节 热 传 导
(一) 单层平壁的稳态热传导
平壁厚度为b,壁面两侧温度分别 为T1和T2( T1 > T2 )。
➢ 一维稳态热传导
Q A dT
dx
(4.2.6)
x 0 : T T1
x b : T T2
Q b A(T1 T2 )
21
(4.2.7)
令: R b
T2 (1.0 0.001T )dT
b
qdx
T1
0
对于平壁上的稳态一维热传导,热量通量不变。
因此
(T1
T2
)
0.001 2
(T12
T22 )
qb
24
第二节 热 传 导
q
1 b
(T1
T2 )
0.001 2
(T12
T22 )
1 0.4
(950
300)
0.001 (9502 2
3002 )
2641W/m2
② 假定材料均匀,1、 2、 3都不随温
度变化 ,视为常数。
③ 层间接触良好,相互接触的面上温度 相等;
④ 各等温面皆垂直;
⑤ T1、T2、T3、 T3 ,均为恒定。
26
Q
1A
(T1
T2 ) b1
DT1 R1
2 A
(T2 T3) b2
DT2 R2
3 A
(T3 T4 ) b3
DT3 R3
第二节 热 传 导
热阻越大,通过该 层的温度差也越大
DT1 QR1 DT2 QR2 DT3 QR3
1 2 3
T1 T2 T3 Q
T4
传热的推动力
导热热阻
反应热知识点

反应热知识点在化学的世界里,反应热是一个非常重要的概念。
它就像是化学反应中的“温度计”,告诉我们反应过程中能量的变化情况。
首先,咱们来搞清楚什么是反应热。
简单来说,反应热就是化学反应过程中吸收或者放出的热量。
如果一个反应吸收了热量,我们就说它是吸热反应,反应热为正值;要是反应放出了热量,那就是放热反应,反应热为负值。
那反应热是怎么产生的呢?这就得从化学反应的本质说起啦。
化学反应的实质是旧化学键的断裂和新化学键的形成。
断开旧化学键需要吸收能量,形成新化学键则会放出能量。
当吸收的能量大于放出的能量时,反应就是吸热的;反过来,放出的能量大于吸收的能量,反应就是放热的。
比如说,碳和二氧化碳反应生成一氧化碳,这个反应就需要吸收热量,是吸热反应。
而像燃烧煤炭这种反应,会放出大量的热,就是典型的放热反应。
要衡量反应热的大小,我们通常会用到一个物理量,叫焓变(ΔH)。
焓变等于生成物的总焓减去反应物的总焓。
如果焓变大于零,就是吸热反应;焓变小于零,就是放热反应。
那怎么测量反应热呢?常见的方法有两种,一种是通过量热计直接测量,另一种是通过计算得出。
量热计测量就像是给反应做个“体检”,把反应放在特定的装置里,观察热量的变化。
而计算的方法呢,就要用到一些化学知识和公式啦。
比如对于一个在恒压条件下进行的反应,我们可以用ΔH = Qp 来计算,这里的 Qp 是恒压热。
如果是在恒容条件下,就用ΔU = Qv 来算,ΔU 是热力学能的变化,Qv 是恒容热。
了解了反应热的测量,咱们再来说说影响反应热的因素。
首先,反应物和生成物的状态会有影响。
一般来说,同种物质气态时的能量比液态高,液态又比固态高。
所以,当反应物和生成物的状态不同时,反应热也会不同。
反应的条件也很重要。
比如加热或者加压,都可能改变反应的路径和能量变化,从而影响反应热。
还有物质的量也会有作用。
参加反应的物质越多,放出或吸收的热量也就越多。
反应热的知识在实际生活中有很多应用呢。
反应热知识点

反应热知识点在化学的世界里,反应热是一个非常重要的概念。
它就像是化学反应中的“温度计”,能够告诉我们反应过程中能量的变化情况。
那什么是反应热呢?简单来说,反应热就是指化学反应过程中吸收或放出的热量。
要理解反应热,首先得明白化学反应中的能量变化。
化学反应的本质是旧化学键的断裂和新化学键的形成。
当旧化学键断裂时,需要吸收能量;而新化学键形成时,则会放出能量。
如果吸收的能量大于放出的能量,反应就是吸热反应,反应热为正值;反之,如果放出的能量大于吸收的能量,反应就是放热反应,反应热为负值。
比如说,碳在氧气中燃烧生成二氧化碳这个反应,就是一个典型的放热反应。
我们能感受到热量的释放,感觉到周围温度升高。
而碳酸钙在高温下分解生成氧化钙和二氧化碳的反应,则是吸热反应,需要外界提供热量才能进行。
反应热的单位通常是焦耳(J)或千焦(kJ)。
在实际应用中,我们还会用到另一个单位——摩尔焓变(ΔH)。
摩尔焓变表示的是在一定条件下,每摩尔化学反应的焓变。
影响反应热大小的因素有很多。
首先是反应物和生成物的状态。
一般来说,同种物质在气态时的能量高于液态,液态时的能量高于固态。
所以,当反应物和生成物的状态不同时,反应热也会不同。
例如,氢气和氧气反应生成液态水放出的热量,就比生成气态水放出的热量多。
其次,反应的条件也会对反应热产生影响。
比如,在不同的温度和压强下进行同一个反应,反应热可能会有所差异。
接下来,我们再来说说热化学方程式。
热化学方程式是表示化学反应与反应热关系的方程式。
它不仅能表明反应物和生成物,还能明确地给出反应热的值。
在书写热化学方程式时,需要注意以下几点:要注明反应物和生成物的状态;要标明反应热的数值和正负号;化学计量数可以是整数,也可以是分数,但表示的是物质的量。
比如说,氢气和氧气反应生成液态水的热化学方程式可以写成:H₂(g) + 1/2O₂(g) = H₂O(l) ΔH =-2858 kJ/mol 。
这里的-2858kJ/mol 就表示每摩尔这个反应放出的热量是 2858 千焦。
