九年级化学作业课件《第1课时 原子的构成与核外电子排布》PPT
合集下载
鲁教版初中化学九年级全册 第一节原子的构成课件(32张PPT)

Na+ Cl-
Cl-
阳离子 (质子数>电子数)
阴离子 (质子数<电子数)
认识离子
1、离子:带电的原子(或原子团)叫离子。 (1)阳离子:失去电子带正电荷的原子。 (如:Na+)
(2)阴离子:得到电子带负电荷的原子 (如: Cl-)
课堂反馈
1、判断下图是原子,还是离子?
+16 2 8 8 +19 2 8 8 +18 2 8 8
(注:钠原子核内有11个质子,氯原子核内有17
个质子,氩原子核内有18个质子。)
核外电子对原子在化学反应中的影响
1.稀有气体的原子
+2
2
+10
28
+18 2 8 8
He
Ne
Ar
稀有气体的原子最外层有 8 个电子, (氦有 2 个电子),这是一种相对稳定结构,
在化学反应中不容易得失电子,性质稳定。
【小提示】物质都有趋向于稳定状态的特点 (如:水往低处流;树上的苹果往下掉)。
相互 关系
得失电子
分成
离子
原子
得失电子
构成
分子
【分享收获】
原子中的电子
通过学习,你对原子中的 电子有了哪些了解……
1、原子结构示意图 2、电子的分层排布 3、核外电子对原子在
化学反应中的影响 4、认识离子
学以致用
1、指出镁原子原子结构示意图各部分组成的意义。
+12 2 8 2
2、下列原子结构属于稳定结构的是__B___,易得电子 的是__A__,失电子的是___C__。
阴离子
阳离子
原子
质子数<电子数 质子数>电子数 质子数=电子数
第1课时 原子的构成与核外电子排布课件

1 6 8 11 17
课堂教学展示 典例剖析
例 下列关于原子结构的叙述正确的是( B ) A.一切原子的原子核都由质子和中子构成 × B.在原子中,核电荷数一定等于质子数或核外电子数√ C.原子核内质子数一定等于中子数 × D.原子是不能再分的粒子 ×
课堂教学展示 课堂探究
知识点2 原子核外电子的排布特点
答:构成原子的粒子有质子、中子和电子。在氧原子 中由8个质子和8个中子构成原子核,有8个电子在核外 一定空间内高速运动。质子带1个单位正电荷,中子不 显电性,电子带1个单位的负电荷。原子中,核电荷数 =质子数=核外电子数,由于整个原子中正负电荷数相 等,所以整个原子不显电性。
3.在含多个电子的原子里,离核近的电子能量 较低 ,离核远的电子能量较高 ,因此,核 外电子的运动是按 能量高低 在分层运动。
课堂教学展示 新课导入
1964年10月16日我国成功爆炸 第一颗原子弹。原子弹爆炸的威力 非常惊人。
为什么原子弹爆炸会产生如此 巨大的能量呢?我们这节课一 起来学习原子结构的奥秘。
8 16 12
核外 电子数
8
16
12
2.选择题
(1)原子核( B )。
A.由电子和质子构成
B.由质子和中子构成
C.由电子和中子构成
D.由质子、中子和电子构成
(2)在原子里质子数等于( B )。
A.中子数
B.电子数
C.中子数和电子数之和 D.中子数和电子数之差
3.以氧原子为例回答问题:构成原子的粒子有哪几种? 它们是怎样构成原子的?为什么整个原子不显电性?
不是,在氢原子核中只有质子,没有中子。
原子种类
氢 碳 氧 钠 氯
几种原子的构成
质子数
课堂教学展示 典例剖析
例 下列关于原子结构的叙述正确的是( B ) A.一切原子的原子核都由质子和中子构成 × B.在原子中,核电荷数一定等于质子数或核外电子数√ C.原子核内质子数一定等于中子数 × D.原子是不能再分的粒子 ×
课堂教学展示 课堂探究
知识点2 原子核外电子的排布特点
答:构成原子的粒子有质子、中子和电子。在氧原子 中由8个质子和8个中子构成原子核,有8个电子在核外 一定空间内高速运动。质子带1个单位正电荷,中子不 显电性,电子带1个单位的负电荷。原子中,核电荷数 =质子数=核外电子数,由于整个原子中正负电荷数相 等,所以整个原子不显电性。
3.在含多个电子的原子里,离核近的电子能量 较低 ,离核远的电子能量较高 ,因此,核 外电子的运动是按 能量高低 在分层运动。
课堂教学展示 新课导入
1964年10月16日我国成功爆炸 第一颗原子弹。原子弹爆炸的威力 非常惊人。
为什么原子弹爆炸会产生如此 巨大的能量呢?我们这节课一 起来学习原子结构的奥秘。
8 16 12
核外 电子数
8
16
12
2.选择题
(1)原子核( B )。
A.由电子和质子构成
B.由质子和中子构成
C.由电子和中子构成
D.由质子、中子和电子构成
(2)在原子里质子数等于( B )。
A.中子数
B.电子数
C.中子数和电子数之和 D.中子数和电子数之差
3.以氧原子为例回答问题:构成原子的粒子有哪几种? 它们是怎样构成原子的?为什么整个原子不显电性?
不是,在氢原子核中只有质子,没有中子。
原子种类
氢 碳 氧 钠 氯
几种原子的构成
质子数
原子结构与核外电子排布PPT课件
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd Rh
结构、性质、位置之间的关系
原子结构
决定 反映
元素性质
反映 决定
反映 决定
元素在表中位置
自我评价
3、现有下列短周期元素性质的数据:
元素性质╲元素符号
①②③④⑤⑥⑦⑧
原子半径(10-10m) 0.74 1.60 1.52 1.42 0.99 1.86 0.75 0.82
35Cl:34.969 37Cl:36.966
近似相对原子质量: 35Cl:35 37Cl:37
质量数
元素的相对原子质量:按各同位素原子所占的原子百分比
算出来的平均值。
Ar(Cl)= Ar(35Cl) ×a% + Ar(37Cl) ×b%
元素的近似相对原子质量:各种同位素的质量数代替相对 原子质量按百分比算出来的平均值。
相互作 用
静电作用 (吸引和排斥)
共用电子对
存在
离子化合物
共价分子 离子化合物
实例 Na2OK2SO4NH4 Cl
Cl2、CO2、OH-、 NH4+
离子化合物:含有离子键的化合物
共价化合物:只含有共价键的化合物
判断对错: 1、含有共价键的化合物一定是共价化合物。错(NaOH) 2、共价化合物只含共价键。 对 3、含有离子键的化合物一定是离子化合物。对 4、离子化合物可以含共价键。 对(NaOH) 5、只含有共价键的物质一定是共价化合物。错(H2) 6、非金属单质内都含共价键错。,稀有气体
离子键越强,熔沸点越高 2、结构特点:无单个分子,化学式不表示分子式。
每个Na+吸引 6 个Cl-,每个Cl-吸引 6 个Na+ 。 3、性质特点
初三化学上学期核外电子排布-课件

初三化学上学期核外电子 排布-PPT课件
欢迎来到初三化学上学期核外电子排布的PPT课件。在本课程中,我们将学 习原子结构、电子能级和壳层、原子的电子排布和元素周期表以及元素的化 学性质与排布规律。
知识点一:原子结构
原子结构的组成
原子由原子核和核外电子组成,核内质子和中子构成了原子核。
原子核的构成
原子核由质子和中子构成,质子带正电荷,中子不带电。
知识点四:元素的化学性质与排布规律
元素的三种基本性质
元素的化学性质主要包括金 属性、非金属性和半金属性。
元素的同位素和同系物 的概念
元素的同位素是指具有相同 原子序数但质量数不同的同 种元素,同系物是指元素在 化合价和化学性质上相似的 元素。
元素周期表中的元素性 质规律
元素周期表中元素的性质随 着周期数和原子序数的增加 具有一定的规律和趋势。
知识点三:原子的电子排布和元素周期表
1
原子的电子排布规律及其重要性
原子的电子排布遵循泡利的排斥原理,
美学家-泡利的排斥原理
2
它对元素的性质和元素周期表的构建有 重要影响。
泡利的排斥原理规定了每个
3
元素周期表的分类和结构
元素周期表根据元素的原子序数和周期 数进行了分类和排列,具有一定的结构 和规律。
总结
1 本次课程的学习重点和难点
学习重点:原子结构、电子能级和壳层,元素的电子排布规律和元素周期表。 学习难点:了解和应用泡利的排斥原理。
2 总结原子结构和元素周期表的重要性
原子结构和元素周期表是化学研究的基础,对于理解化学性质和反应有重要意义。
3 分享一些实用的学习方法和技巧
通过观看相关视频、做练习题和参加化学实验等方式来加深对原子结构和元素周期表的 理解。
欢迎来到初三化学上学期核外电子排布的PPT课件。在本课程中,我们将学 习原子结构、电子能级和壳层、原子的电子排布和元素周期表以及元素的化 学性质与排布规律。
知识点一:原子结构
原子结构的组成
原子由原子核和核外电子组成,核内质子和中子构成了原子核。
原子核的构成
原子核由质子和中子构成,质子带正电荷,中子不带电。
知识点四:元素的化学性质与排布规律
元素的三种基本性质
元素的化学性质主要包括金 属性、非金属性和半金属性。
元素的同位素和同系物 的概念
元素的同位素是指具有相同 原子序数但质量数不同的同 种元素,同系物是指元素在 化合价和化学性质上相似的 元素。
元素周期表中的元素性 质规律
元素周期表中元素的性质随 着周期数和原子序数的增加 具有一定的规律和趋势。
知识点三:原子的电子排布和元素周期表
1
原子的电子排布规律及其重要性
原子的电子排布遵循泡利的排斥原理,
美学家-泡利的排斥原理
2
它对元素的性质和元素周期表的构建有 重要影响。
泡利的排斥原理规定了每个
3
元素周期表的分类和结构
元素周期表根据元素的原子序数和周期 数进行了分类和排列,具有一定的结构 和规律。
总结
1 本次课程的学习重点和难点
学习重点:原子结构、电子能级和壳层,元素的电子排布规律和元素周期表。 学习难点:了解和应用泡利的排斥原理。
2 总结原子结构和元素周期表的重要性
原子结构和元素周期表是化学研究的基础,对于理解化学性质和反应有重要意义。
3 分享一些实用的学习方法和技巧
通过观看相关视频、做练习题和参加化学实验等方式来加深对原子结构和元素周期表的 理解。
《原子的构成、原子核外电子的排布》课件(公开课)2022年人教版

3、用“猜猜我是谁”的方法复习常见盐的性质和用途, 由此评价学生对基础知识的掌握情况; 如果学生基础较好,则可以使用下列表格:
常见的盐 俗名 化学式
用途
由学生自主完成,并以此评价学生对基础知识的掌握情况。
4、通过常见的盐导出碳酸盐的复习;并通过 评价练习评价学生对碳酸盐性质的理解,得出“用
物质的性质解决问题”的方法;
的提高。
②讨论探究法:其教学模式为情景—思考、讨论—交流、归 纳—总结完善。
③ 学业评价:通过提问、解决问题、评价表等方法评价学生的 学习,通过互评、自评等反馈学生学习效果,促进学生发展。
2、学法: 食盐,生活中常见,人们常用的调味品,学生很熟 悉;常见的盐,前面已有基础,因此在学法上我侧重自
主学习、探究学习和合作学习。 ①自主学习:指导学生以实际生活的经验和对知识 的回顾,归纳出常见盐的用途、调动学生思维的积极性,
__10__ __1102__ __12__
__9__
1101 __1_2_
___9 _ __11_01 _
__1_2 _
(2)分析表中的数据,你发现了哪些规律? ①___质__子__数__=__核__电__荷__数__=__核__外__电__子__数_______; ②___质__子__数__不__一__定__等__于__中__子__数__(_合__理__即__可__)____。
(可用于检验碳酸盐)
分 析:
鸡蛋壳的主要成分是一种含钙元素的化合物,把鸡蛋
壳放入盐酸中会反应生成能使澄清的石灰水变浑浊的气
体。由此可以判断鸡蛋壳的主要成分是 碳酸钙
。
(知识评价)
我会探究:
一包粉末状药品,可能是碳酸钠或者氯化钠,你 能鉴别它究竟是什么吗?简述操作,可能出现的现象
一轮复习原子结构核外电子排布PPT课件

3)先占内层,后占外层
.
化合价变化规律:
①最高正价= 主族序数 = 最外层电子数。
②最高正价+∣最低负价∣=8
③在化合物中,O 一般只显-2价,F只显-1价; 金属元素只有正价而无负价
.
3.原子结构示意图
1)用结构示意图表示原子、单核离子的核电
荷数、电子层结构。
质子数
电子层上的 电子数
Na +11 2 8 1
.
答案 (1)
(2)X(或氧) 2H2S+O2=点==燃==2H2O+2S↓ (3)NH4HSO4 (4)N2H4+2H2O2=点==燃==N2+4H2O
.
【例 1】 已知 A、B、C、D 是中学化学中常见的四种不 同粒子,它们之间存在如图所示的转化关系(反应条件已 经略去):
.
(1)如果 A、B、C、D 均是 10 电子的粒子,请写出 A、D 的 电子式:A____________;D____________。 (2)如果 A 和 C 是 18 电子的粒子,B 和 D 是 10 电子的粒子, 请写出: ①A 与 B 在溶液中反应的离子方程式为_______________。 ②根据上述离子方程式,可以判断 C 与 B 结合质子的能力 大小是(用化学式或离子符号表示)__________________。
第五章物质结构元素周期律
第一节原子结构 核外电子排布
.
原子结构与核外电子排布
1,原子的组成
2,核外电子排布 3,原子结构示意图 4,核素与同位素
.
考纲定位
1、了解元素、核素和同位素的含义 2、了解原子构成。了解原子序数、核电 荷数、质子数、中子数、核外电子数以 及他们之间的相互关系 3、了解原子核外电子排布
.
化合价变化规律:
①最高正价= 主族序数 = 最外层电子数。
②最高正价+∣最低负价∣=8
③在化合物中,O 一般只显-2价,F只显-1价; 金属元素只有正价而无负价
.
3.原子结构示意图
1)用结构示意图表示原子、单核离子的核电
荷数、电子层结构。
质子数
电子层上的 电子数
Na +11 2 8 1
.
答案 (1)
(2)X(或氧) 2H2S+O2=点==燃==2H2O+2S↓ (3)NH4HSO4 (4)N2H4+2H2O2=点==燃==N2+4H2O
.
【例 1】 已知 A、B、C、D 是中学化学中常见的四种不 同粒子,它们之间存在如图所示的转化关系(反应条件已 经略去):
.
(1)如果 A、B、C、D 均是 10 电子的粒子,请写出 A、D 的 电子式:A____________;D____________。 (2)如果 A 和 C 是 18 电子的粒子,B 和 D 是 10 电子的粒子, 请写出: ①A 与 B 在溶液中反应的离子方程式为_______________。 ②根据上述离子方程式,可以判断 C 与 B 结合质子的能力 大小是(用化学式或离子符号表示)__________________。
第五章物质结构元素周期律
第一节原子结构 核外电子排布
.
原子结构与核外电子排布
1,原子的组成
2,核外电子排布 3,原子结构示意图 4,核素与同位素
.
考纲定位
1、了解元素、核素和同位素的含义 2、了解原子构成。了解原子序数、核电 荷数、质子数、中子数、核外电子数以 及他们之间的相互关系 3、了解原子核外电子排布
第1课时原子结构 核外电子的排布(课件)

原子核
原子
中子(相对质量近似为1,不带电)
核外电子(带1个单位负电荷)
核电荷数=核内质子数=核外电子数,1个电子带1个单位负电 荷,1个质子带1个单位 正电荷,中子不带电,所以原子呈电中性。
二、学习质量数的概念
▶思路一
二、学习质量数的概念
[问题思考1]电子、中子、质子的质量见下表,思考原子的质 量为什么主要集中在原子核上。
原子R的核内质子数=b−n,则中子数=a−(b−n)=a−b+n。
二、学习质量数的概念
▶思路二
二、学习质量数的概念
1.观察表格中的数据,思考三种微粒质子、中子、电子的相对 质量之间的关系。
质子和中子的质量基本相等,相对质量约为1,电子的质量可以忽略 不计,原子的质量主要集中在原子核上。
二、学习质量数的概念
课堂练习
2.科学家将铅和氪的原子核对撞,获得了一种质 量数为293,中
子数为175的超重元素。该元素原子核 内中子数与质子数之
差是 ( B )
A.47
B.57
C.61
D.293
课堂练习
3.我国成功研制的铯(133Cs)原子钟,使我国时间 频率基准的精
度从30万年不差1秒提高到600万年 不差1秒。已知该铯原子
电子在原子核外很小的空间内做高速运动,没有确定的轨道
三、学习核外电子的排布规律
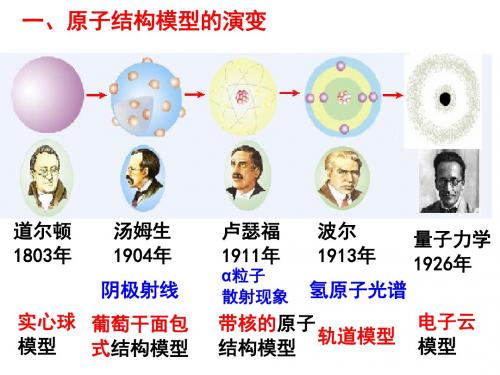
3.从左到右依次是道尔顿模型、汤姆孙原子模型、卢瑟福原子模型、 玻尔原子模型、电子云模型。
三、学习核外电子的排布规律
[问题思考]核外电子的运动有哪些特征?
从微观电子的运动与宏观物质的运动方面考虑。 宏观物体运动的特征: 可以准确地测出它们在某一时刻所处的位置及运动的速度; 可以 描画出它们的运动轨迹。 微观粒子(电子)的运动特征: 电子的质量极微小; 电子绕核运动是在原子这样极其微小的空间中进行; 电子绕核做高速运动。
3.2.1 原子的构成 原子核外电子的排布 课件(共26张PPT)

课时1 原子的构成 原子核外电子的排布
与原子相比,原子核的体积更小
原子 因此,原子核外有很大的空间,电子就在这个空间里不停运动着
课时1 原子的构成 原子核外电子的排布 Ⅱ 原子核外电子的排布 不是真实存在的,只是为了研究方便假设的
核外电子的运动区域由内到外依次为第一至七层
核外电子分层排布示意图
电子层:1 2 3 4 5 6 7
+13 2 8 3
钠Na
镁Mg
铝Al
原子最外层电子一般都少于4个,在化学反应中易失去电子
课时1 原子的构成 原子核外电子的排布 非金属原子的结构示意图
+7 2 5
+8 2 6
+16 2 8 6
+17 2 8 7
氮N
氧O
硫S
氯Cl
原子最外层电子一般都多于4个,在化学反应中易得到电子
课时1 原子的构成 原子核外电子的排布
课时1 原子的构成 原子核外电子的排布 稀有气体原子的结构示意图
+2 2
+10 2 8
+18 2 8 8
氦He
氖Ne
氩Ar
原子最外层一般都有8个电子(氦为2个电子),这样的结构被认为是 一种相对稳定的结构
课时1 原子的构成 原子核外电子的排布 金属原子的结构示意图
+11 2 8 1
+12 2 8 2
19世纪末,英国物理学家汤姆孙发现了电子。在此 基础上,他提出了一种原子模型,认为正电荷均匀 分布在整个原子内,带负电荷的电子镶嵌其中
实心球模型
我国古代哲学家提出了“端”的观点, 古希腊哲学家也提出了意义相近的 “原子”的概念。1808年,道尔顿提 出了原子论。上述“端”和“原子” 可被认为是原子的“实心球模型”
第1课时 原子核外电子的排布课件

原子结构示意图
为了形象地表示原子的结构,人们创造了“原子结构
示意图”这种特殊的图形。
原子核
第3层 第2层
第1层
原子核带正电
+ 15 2 8 5
核电荷数
K层 L层 M层
+17
分层排布
Cl
离核距离
近→远
电子层(n) 1 2 3 4 5 6 7…
电子层符号 K L M N O P Q …
能量高低 低 → 高
层8个,M层8个,该微粒一定是 ( D )
A.氩原子
B.钾离子
C.氯离子
D.无法确定
3.下列有关原子核外电子排布的说法不正确的 是( D) A. 电子总是先排布在能量最低的电子层里 B. 各电子层最多能容纳的电子数为2n2 C. 最外层电子数不超过8个(K层是最外层时, 最多不超过2个) D. S2-的M层电子数是K层电子数的3倍
10 氖 Ne 2
8
18 氩 Ar 2
8
8
36 氪 Kr 2
8 18
8
54 氙 Xe 2
8 18 18 8
86 氡 Rn 2
8 18 32 18 8
最多容纳电子数 2×12 2×22 2×32 2×42
核外电子排布规律
1.电子总是先排布在能量最低的电子层里,然后由内往 外,依次排在能量逐渐升高的电子层里(能量最低原 理),即先排布K层,排满K层后再排L层,排满L层后再 排M层,依此类推。 2.每个电子层最多只能容纳2n2个电子。 3.最外层最多只能容纳 8个电子(K层为最外层时不能 超过2个),次外层最多只能容纳18个电子(K层为次外 层时不能超过2个),倒数第三层最多只能容纳32个电子。
对于给定的元素,还要知道哪些规律,才能表示 出其原子结构示意图呢?
第1课时原子的构成与原子核外电子的排布PPT九年级化学人教版上册精品课件

③分子是由不同的原子构成的 ④分子构成了所有ቤተ መጻሕፍቲ ባይዱ质
⑤分子是构成物质的微粒之一
A.①②⑤
B.③④
C.①②④
D.①⑤
3.太阳系所有行星中,火星是唯一的红色星球。火 星之所以为红色是因为其表面含有丰富的赤铁矿石,赤 铁矿石中含有铁元素,如图是铁原子的结构示意图,下 列判断中,正确的是( D )
A.铁原子的核外电子数为 2 B.铁单质在氧气中燃烧的产物是氧化铁 C.第一层的 2 个电子能量最高 D.铁原子的原子核内有 26 个质子
3镉(73..C()的1F)2吸C[E解收u+析率O]2。根2C据uO题图可知,土壤的pH=7.6左右时,水稻对镉的吸收率几乎不变,达到最小。熟石灰呈碱性,可用于改良酸性土壤,降低水稻对
荷 ___数3__为_____层_1_7排__布__,,它核的内最质外子层数电为子__数__1x_7=_____,__核7__外__电。子分 [完生238((实实黑54解..0A62全成验验色有))析氢 稀燃 二 结 验 固毒][氧盐解(烧氧论证体气2化酸)析产化溶天体2方钠和N]生碳解然法C图a溶生OO的,1,气一所溶甲6H的液石二0燃以:液+中紫燃和灰C氧烧都由转色O烧氯:化生有无2化石化2硫N成H温色1蕊铁aC是比二2室变溶l溶C+水等氧气为OC液液与质a化3体蓝O+:二量硫H产色C紫32氧的,aN(生所O色现Ca化煤。lO以石2象碳完+H该蕊与H+的全2F天溶所Oe反燃C然液[选现应l烧3气变药象,产F反中红e品同生(应含O色相(的H的4硫对1)二3化)元方]应↓氧+学素法,3合化方N;二根理a硫程C:据<即l少式(图溶可很为方示液)多法C可由,OC因三知黄2u此+O:色,CH天+燃u2变2O然OH煤[为C气或H更l无2和FCC容e色u煤2OC易O、3燃l3,2导不、有+烧H致是C红后2酸u酸O褐(都O(雨雨化色H会,形学对)沉产2、成方环淀生A的程境生二l(主式影成O氧要H与响)化)原3所比碳、因选较气C。药大a体C品;O煤,等3对和、质应天N量,a合然的2C理气天O即燃3然等可烧气])都
