物理化学知识点(全)
物理化学知识点(全)
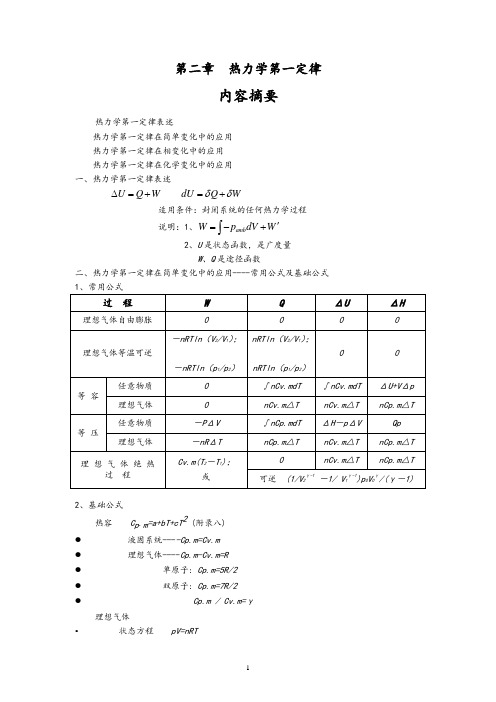
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学的知识点总结

物理化学的知识点总结一、热力学1. 热力学基本概念热力学是研究能量转化和传递规律的科学。
热力学的基本概念包括系统、环境、热、功、内能、焓、熵等。
2. 热力学第一定律热力学第一定律描述了能量守恒的原理,即能量可以从一个系统转移到另一个系统,但总能量量不变。
3. 热力学第二定律热力学第二定律描述了能量转化的方向性,熵的增加是自然界中不可逆过程的一个重要特征。
4. 热力学第三定律热力学第三定律表明在绝对零度下熵接近零。
此定律是热力学的一个基本原理,也说明了热力学的某些现象在低温下会呈现出独特的特性。
5. 热力学函数热力学函数是描述系统状态和性质的函数,包括内能、焓、自由能、吉布斯自由能等。
二、化学热力学1. 热力学平衡和热力学过程热力学平衡是指系统各个部分之间没有宏观可观察的能量传输,热力学过程是系统状态发生变化的过程。
2. 能量转化和热力学函数能量转化是热力学过程中的一个重要概念,热力学函数则是描述系统各种状态和性质的函数。
3. 热力学理想气体理想气体是热力学研究中的一个重要模型,它通过状态方程和理想气体定律来描述气体的性质和行为。
4. 热力学方程热力学方程是描述系统热力学性质和行为的方程,包括焓-熵图、温度-熵图、压力-体积图等。
5. 反应焓和反应熵反应焓和反应熵是化学热力学研究中的重要参数,可以用来描述化学反应的热力学过程。
三、物质平衡和相平衡1. 物质平衡物质平衡是研究物质在化学反应和物理过程中的转化和分配规律的一个重要概念。
2. 相平衡相平衡是研究不同相之间的平衡状态和转化规律的一个重要概念,包括固相、液相、气相以及其之间的平衡状态。
3. 物质平衡和相平衡的研究方法物质平衡和相平衡的研究方法包括热力学分析、相平衡曲线的绘制和分析、相平衡图的绘制等。
四、电化学1. 电解质和电解电解质是能在水溶液中发生电离的化合物,电解是将电能转化为化学能或反之的过程。
2. 电化学反应和电势电化学反应是在电化学过程中发生的化学反应,电势是描述电化学系统状态的一个重要参数。
物理化学复习知识点

物理化学复习知识点第⼀章热⼒学第⼀定律1.基本概念 1.1体系和环境系统(System )-被划定的研究对象称为系统。
环境(surroundings )-与系统密切相关、有相互作⽤或影响所能及的部分称为环境。
1.2状态函数*状态函数——由系统的状态确定的系统的各种热⼒学性质称为系统的状态函数。
*它具有以下特点:(1)状态函数是状态的单⼀函数。
(2)系统的状态发⽣变化,状态函数的变化值取决于系统始、终态。
与所经历的途径⽆关。
(3)状态函数的微⼩变化,在数学上是全微分。
(4)不同状态函数的集合(和、差、积、商)也是状态函数。
1.3体积功功(work )--系统与环境之间传递的除热以外的其它能量都称为功,⽤符号W 表⽰。
体积功就是体积膨胀或缩⼩所做的功。
系统对环境作功,W <0 环境对体系作功,W >0 1.4可逆过程(下)1.5各种热⼒学函数(U, H, Q,W)U 和H 是状态函数,Q 和W 不是状态函数。
1.6标准摩尔⽣成焓概念在标准压⼒下,反应温度时,由最稳定的单质合成标准状态下⼀摩尔物质的焓变,称为该物质的标准摩尔⽣成焓,⽤下述符号表⽰:(物质,相态,温度)2 体系和环境 2.1 体系(系统)*敞开系统(open system )系统与环境之间既有物质交换,⼜有能量交换。
*封闭系统(closed system )系统与环境之间⽆物质交换,但有能量交换。
*孤⽴系统(isolated system )系统与环境之间既⽆物质交换,⼜⽆能量交换。
热⼒学上有时把系统和环境加在⼀起的总体看成是孤⽴系统。
2.2状态函数体系的⼀些性质,其数值仅取决于体系所处的状态,⽽与体系的历史⽆关;它的变化值仅取决于体系的始态和终态,⽽与变化的途径⽆关。
具有这种特性的物理量称为状态函数。
对于循环过程:所有状态函数的改变值均为零 2.3可逆过程体系经过某⼀过程从状态(1)变到状态(2)之后,如果能使体系和环境都恢复到原来的状态⽽未留下任何永久性的变化,则该过程称为热⼒学可逆过程。
物理化学知识点

物理化学知识点物理化学是研究物质的物理性质与化学性质及其相互关系的学科,是化学和物理学的交叉领域。
在物理化学领域,有许多重要的知识点是我们必须要了解和掌握的。
本文将介绍一些物理化学的重要知识点,帮助读者更好地理解这一学科。
一、物态和相变物质存在的三种基本状态是固态、液态和气态。
固体的分子排列整齐,分子间的相互作用力较大;液体的分子排列比较有序,分子间的相互作用力较小;气体的分子排列比较松散,分子间的相互作用力很小。
相变是物质由一种状态转变为另一种状态的过程,如固液相变、液气相变等。
二、化学平衡在化学反应中,当反应物与生成物的浓度达到一定比例时,反应达到动态平衡。
平衡常数是描述平衡反应过程中生成物和反应物之间浓度关系的参数,反映了反应的进行方向及反应的速率。
平衡常数不同于反应速率常数,是稳态条件下的一个宏观参数。
三、溶液和溶解度溶液是由溶质和溶剂组成的混合物,其中溶质是被溶解的物质,溶剂是将溶质溶解的物质。
溶解度是溶质在一定温度下在单位溶剂中的最大溶解量,溶解度与温度密切相关,通常随温度升高而增大。
四、热力学热力学是研究能量转化和能量转移过程的学科,包括热力学系统、热力学第一定律、热力学第二定律等。
热力学定义了内能、焓、熵等物理量,描述了物质的热学性质和热平衡状态。
五、化学动力学化学动力学是研究化学反应速率、反应机理和反应过程的学科。
反应速率是描述反应物转变为生成物的速度,受温度、浓度、催化剂等因素影响。
动力学常数描述了反应速率与反应物浓度之间的关系。
六、量子化学量子化学是应用量子力学理论研究原子和分子的结构、性质和变化规律的学科。
量子化学描述了粒子在微观尺度的波粒二象性和不确定性原理,用于解释原子和分子的能级结构和化学键的形成。
以上是物理化学领域的一些重要知识点,涵盖了物态、相变、平衡、溶解度、热力学、动力学和量子化学等方面。
这些知识点是物理化学研究的基础,对于深入理解物质的结构和性质具有重要意义。
高三物理化学知识点总结

高三物理化学知识点总结一、物理知识点总结1. 力学(1) 牛顿运动定律:第一定律、第二定律、第三定律(2) 动量和冲量:动量定理、冲击力(3) 万有引力:万有引力定律、行星运动定律(4) 静力学:平衡条件、弹力、浮力2. 热学(1) 温度与热量:温度计、热力学第一定律、理想气体状态方程(2) 相变和热力学循环:相变概念、相变热、理想气体的等温过程、绝热过程3. 光学(1) 光的反射和折射:光的反射定律、光的折射定律、全反射(2) 光的波动性和粒子性:干涉、衍射、光的波长和频率、光电效应(3) 光的成像:薄透镜成像公式、眼睛的调节、光学仪器4. 电学(1) 静电学:电荷守恒定律、库仑定律、电场、电势、静电场与导电体(2) 电流和电阻:欧姆定律、电阻和电阻率、电功率、电路中的串并联、电流计和电压计的使用(3) 磁学:磁场、安培定律、负载线圈、电磁感应、电磁感应定律、自感和互感、变压器二、化学知识点总结1. 原子结构(1) 物质的组成:元素、化合物、混合物(2) 原子结构:原子的组成、元素的周期律、化学键2. 化学反应(1) 反应速率:速率常数、反应级数、活化能(2) 化学平衡:平衡常数、反应的移动方向、浓度对平衡的影响、温度与平衡(3) 酸碱中和:酸碱指示剂、中和滴定、pH值与酸碱度3. 化学能量(1) 反应热:焓变、焓变的计算、化学能量的利用(2) 化学能量与化学反应速率:活化能、催化剂4. 物质变化与电化学(1) 氧化还原反应:氧化还原电位、电解、电池、电解质溶液、农药与抗菌药5. 有机化学(1) 烃类:烷烃、烯烃、炔烃(2) 醇、醚和酚:醇的性质、酸碱性、脂肪醇、醚的制备(3) 醛和酮:醛酮的分类、性质、氧化还原、酮醇互变(4) 脂肪酸和脂类:酯的制备、皂化反应、脂肪酸的鉴别、脂类的性质结语高三物理化学知识点总结仅对常见的知识点进行了概述,通过系统学习和练习,可以更深入地理解和掌握这些知识点。
物理化学知识点

物理化学知识点物理化学知识点概述1. 热力学定律- 第零定律:如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统之间也处于热平衡状态。
- 第一定律:能量守恒,系统内能量的变化等于热量与功的和。
- 第二定律:熵增原理,自然过程中熵总是倾向于增加。
- 第三定律:当温度趋近于绝对零度时,所有纯净物质的熵趋近于一个常数。
2. 状态方程- 理想气体状态方程:PV = nRT,其中P是压强,V是体积,n是摩尔数,R是理想气体常数,T是温度。
- 范德瓦尔斯方程:(P + a(n/V)^2)(V - nb) = nRT,修正了理想气体状态方程在高压和低温下的不足。
3. 相平衡与相图- 相律:描述不同相态之间平衡关系的数学表达。
- 相图:例如,水的相图展示了水在不同温度和压强下的固态、液态和气态的平衡关系。
4. 化学平衡- 反应速率:化学反应进行的速度,受温度、浓度、催化剂等因素影响。
- 化学平衡常数:在一定温度下,反应物和生成物浓度之比达到平衡时的常数值。
5. 电化学- 电解质:在溶液中能够产生带电粒子(离子)的物质。
- 电池:将化学能转换为电能的装置。
- 电化学系列:金属的还原性或氧化性排序。
6. 表面与胶体化学- 表面张力:液体表面分子间的相互吸引力。
- 胶体:粒子大小在1到1000纳米之间的混合物,具有特殊的表面性质。
7. 量子化学- 量子力学基础:描述微观粒子如原子、分子的行为。
- 分子轨道理论:通过分子轨道来描述分子的结构和性质。
- 电子能级:原子和分子中电子的能量状态。
8. 光谱学- 吸收光谱:分子吸收特定波长的光能,导致电子能级跃迁。
- 发射线谱:原子或分子在电子能级跃迁时发出特定波长的光。
- 核磁共振(NMR):利用核磁共振现象来研究分子结构。
9. 统计热力学- 微观状态与宏观状态:通过系统可能的微观状态数来解释宏观热力学性质。
- 玻尔兹曼分布:描述在给定温度下,粒子在不同能量状态上的分布。
物理化学知识点总结

第一章 热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律热力学第一定律:ΔU =Q +W 。
焦耳实验:ΔU =f (T ) ; ΔH =f (T ) 三、基本关系式1、体积功的计算 δW = -p e d V恒外压过程:W = -p e ΔV可逆过程:1221ln ln p p nRT V V nRT W ==2、热效应、焓等容热:Q V =ΔU (封闭系统不作其他功) 等压热:Q p =ΔH (封闭系统不作其他功) 焓的定义:H =U +pV ; d H =d U +d(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容热容定义:V V )(T U C ∂∂=;p p )(T H C ∂∂=定压热容与定容热容的关系:nR C C =-V p 热容与温度的关系:C p =a +bT +c’T 2 四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p e d V 等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p 等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p ; ΔU =⎰T C d V 可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p不可逆绝热过程:Q =0 ; 利用C V (T 2-T 1)=-p e (V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化可逆相变化:ΔH =Q =n Δ_H ;W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:)298,()298(B H H m f B m r θθν∆=∆∑反应热与温度的关系—基尔霍夫定律:)(])([,p B C T H m p BB m r ∑=∂∆∂ν。
化学物理重要知识点总结

化学物理重要知识点总结一、热力学1. 热力学基本概念热力学是研究物质在各种物理过程中所表现出的热现象和热性质的一门学科。
它是研究物质状态和状态变化过程的基本规律的科学。
2. 热力学系统的基本概念热力学系统是指对物质进行热学研究时所根据需要确定的一定范围内的物质。
热力学系统包括封闭系统、开放系统和孤立系统。
3. 热力学过程热力学过程是指系统的状态随时间变化而发生的物理变化过程。
热力学过程包括绝热过程、等温过程、等容过程和等压过程。
4. 热力学定律热力学定律包括热力学第一定律和热力学第二定律。
热力学第一定律是指能量守恒定律,热力学第二定律是指所有系统在不受外力干扰的情况下都趋向于平衡状态。
5. 热力学函数热力学函数是热力学系统状态的特性参数。
常见的热力学函数包括内能、焓、自由能和吉布斯能。
6. 热力学平衡热力学平衡是指系统各个部分处在相同的温度、压力和化学势以及物理状态下的平衡状态。
7. 热力学系统的状态方程热力学系统的状态方程是系统物理状态的数学表达式。
常见的热力学系统状态方程包括理想气体状态方程、准压缩性气体状态方程和范德瓦尔斯气体状态方程。
8. 热力学过程中的工作热力学过程中的工作是指系统对外界的功。
常见的的工作包括体积功和非体积功。
9. 热力学熵热力学熵是系统内部无序程度的度量,是评价系统混乱程度的指标。
热力学熵具有增大趋势定律和熵最大原理。
10. 热力学的应用热力学在实际工程中有许多应用,例如燃烧、发动机、制冷技术、空气动力学和化学反应等方面的应用。
二、量子化学1. 基本概念量子化学是研究原子、分子等微观粒子的能级结构、性质和相互作用的一门学科。
它是研究原子分子电子结构和化学反应过程的基本理论。
2. 量子力学基本原理量子力学是描述微观粒子的运动和相互作用所遵循的规律的理论。
它包括波粒二象性、不确定关系、按我们知道的基本原理和狄拉克方程等内容。
3. 原子结构原子结构是指原子内部的构造和电子排布方式。
物理化学重要知识点总结及其考点说明

物理化学重要知识点总结及其考点说明
一、化学热力学
1、化学热力学的定义:化学热力学是研究化学反应中物质的热量及能量变化的学科。
2、热力学三定律:第一定律:能量守恒定律;第二定律:热力学第二定律确定有序
能可以被有度能转化;第三定律:热力学第三定律始终指出热力学反应的可能性和温度有关。
3、焓的概念:焓是衡量物质的热力学状态的量,它是物质的热力学特性连续变化的
测量,是物质拥有的热量能量,也可以视为物质拥有的有序能。
4、热力学平衡:热力学平衡是指在不变的温度、压力和其他条件下,恒定的化学反
应发生,直至反应物和生成物的物质形式和化学结构保持不变,热量吸积也变得稳定,这
种状态称为热力学平衡。
二、物理化学
1、物理化学的概念:物理化学是一门融合了物理学和化学的学科,通过应用物理方法,来研究化学性质的变化和分子间的作用及反应,其研究具有多学科的性质。
2、气体的特性:气体的物理性质有很多,如压强、体积、温度、熵、焓等。
质量和
体积的关系为:在一定温度下,气体的质量和体积都成正比。
3、溶质的溶解度:溶解度是衡量溶质溶解在溶剂中的性质,它是指在一定温度、压
力下,溶质在溶剂中的最高溶解量。
溶质的溶解度与温度,压强及溶剂特性有关。
4、化学均衡:化学均衡是指在特定温度和压强下,混合物中物质的各种浓度比例,
产物与原料之间的反应紊乱程度,变化状态的一种稳定平衡状态。
考研必备物理化学核心知识点

考研必备物理化学核心知识点关键信息姓名:____________________________考研年份:______________________1、热力学第一定律11 基本概念111 系统与环境112 热力学平衡态113 状态函数114 过程与途径12 热力学第一定律的表述121 内能的变化与热和功的关系122 热力学第一定律的数学表达式13 体积功的计算131 恒外压过程体积功132 可逆过程体积功14 热的计算141 定容热142 定压热143 绝热过程热的计算2、热力学第二定律21 热力学第二定律的表述211 克劳修斯表述212 开尔文表述22 熵的概念221 熵的定义222 熵的物理意义23 熵变的计算231 简单物理变化过程熵变的计算232 相变过程熵变的计算233 化学反应熵变的计算24 热力学第三定律241 热力学第三定律的表述242 规定熵和标准熵3、多组分系统热力学31 偏摩尔量311 偏摩尔量的定义312 偏摩尔量的集合公式32 化学势321 化学势的定义322 化学势的判据33 理想气体混合物331 道尔顿分压定律332 阿马格分体积定律34 稀溶液的两个经验定律341 拉乌尔定律342 亨利定律35 理想稀溶液351 溶剂的化学势352 溶质的化学势36 非理想溶液361 活度和活度系数362 超额函数4、化学平衡41 化学反应的等温方程411 标准摩尔反应吉布斯函数412 化学反应的等温方程的推导42 平衡常数的表达式421 气相反应平衡常数422 液相反应平衡常数43 平衡常数的测定和计算431 平衡组成的测定432 平衡常数的计算方法44 温度对平衡常数的影响441 范特霍夫方程442 平衡常数与温度的关系图45 其他因素对化学平衡的影响451 压力的影响452 惰性气体的影响453 反应物配比的影响5、相平衡51 相律511 相律的表达式512 相律的应用52 单组分系统相图521 水的相图522 二氧化碳的相图53 二组分系统相图531 气液平衡相图532 液固平衡相图533 生成稳定化合物的相图534 生成不稳定化合物的相图54 三组分系统相图541 等边三角形坐标表示法542 部分互溶三组分系统的相图6、电化学61 电解质溶液611 法拉第定律612 离子的电迁移613 电导、电导率和摩尔电导率614 离子独立运动定律和离子的摩尔电导率615 电导的测定及其应用62 可逆电池621 可逆电池的条件622 可逆电池的热力学623 常见的可逆电池63 不可逆电池631 不可逆电池的热力学632 电极极化633 电解时的电极反应7、表面现象71 表面张力和表面能711 表面张力的定义和单位712 表面能的概念72 弯曲液面的附加压力721 附加压力的产生原因722 拉普拉斯方程73 毛细现象731 毛细现象的原理732 毛细现象的应用74 吸附741 物理吸附和化学吸附742 吸附等温线743 朗缪尔吸附理论8、化学动力学81 化学反应速率的表示方法811 反应进度812 反应速率的定义82 浓度对反应速率的影响821 速率方程822 反应级数823 一级反应824 二级反应825 零级反应83 温度对反应速率的影响831 阿仑尼乌斯方程832 活化能84 催化剂对反应速率的影响841 催化剂的特点842 催化作用的原理9、胶体化学91 胶体的制备和净化911 分散法912 凝聚法913 胶体的净化方法92 胶体的性质921 丁达尔效应922 布朗运动923 电泳和电渗93 胶体的稳定性和聚沉931 胶体稳定性的原因932 胶体的聚沉方法933 电解质对胶体聚沉的影响以上内容涵盖了考研物理化学的核心知识点,您应根据自身实际情况有针对性地进行学习和掌握。
大学物理化学知识点归纳

大学物理化学知识点归纳一、物理化学的基本概念物理化学是研究物质的性质和变化规律的学科,它融合了物理学和化学的理论与方法,对于理解和探索物质世界具有重要意义。
二、物理化学的热力学1. 热力学基本概念:热力学研究物质在不同温度、压力和组成条件下的能量转化和热效应。
2. 热力学第一定律:能量守恒定律,描述了物质的内能和热交换之间的关系。
3. 热力学第二定律:能量的不可逆性原理,描述了自然界中能量转化的方向和过程的规律。
4. 熵的概念:熵是衡量系统混乱程度的物理量,与物质的排列和有序程度相关。
5. 自由能与平衡:自由能是描述系统稳定性和反应方向的指标,平衡状态下自由能取最小值。
三、物理化学的动力学1. 动力学基本概念:动力学研究物质内部结构与变化之间的关系,以及反应速率和反应机理等问题。
2. 反应速率与速率常数:反应速率描述了反应速度的快慢,速率常数与反应机理密切相关。
3. 反应平衡与化学平衡常数:反应平衡是指在一定条件下反应物与生成物浓度保持不变的状态,化学平衡常数决定了反应的平衡位置。
4. 反应机理与活化能:反应机理描述了反应的详细步骤和中间产物,活化能是指反应过程中所需的最小能量。
四、物理化学的量子化学1. 量子化学基本概念:量子化学研究微观粒子(如电子)在原子和分子尺度下的性质和行为。
2. 波粒二象性:微观粒子既具有波动性又具有粒子性,具体表现为波粒二象性。
3. 波函数与薛定谔方程:波函数是描述微观粒子状态的数学函数,薛定谔方程描述了波函数的演化和微观粒子的运动规律。
4. 量子力学的应用:量子力学提供了解释原子和分子结构、光谱学和化学键性质等的理论基础。
五、物理化学的电化学1. 电化学基本概念:电化学研究物质在电解质溶液中的电荷转移和电极反应等现象。
2. 电解与电解质:电解是指将化学物质转化为离子的过程,电解质是能够在溶液中导电的化合物。
3. 电流与电解质溶液:电流是指电荷流动的物理现象,电解质溶液中的电流与离子在电场中的迁移相关。
物理化学复习知识点归纳

第二章热力学第一定律1. 系统①隔离系统(孤立系统):没有物质和能量交换 ②封闭系统:只有能量交换③敞开系统(开放系统):既有物质交换,又有能量交换 2. 状态函数分类①广度量(广度性质):与物质数量成正比,有加和性,数学上是一次齐函数 ②强度量(强度性质):与物质数量无关的性质,不具有加和性 *任何两个广度性质之比得出的物理量则为强度量 3.过程分类①恒温过程:T=T 环境=定值②恒压过程:P=P 环境=定值(过程中压强均相等且不变) ③等压过程:P 1 = P 2 = P amb = 常数 ④恒容过程:V=定值⑤绝热过程:系统与环境无热交换,Q=0⑥循环过程:系统从始态出发经一系列变化又回到始态的过 ⑦自由膨胀过程(向真空膨胀):P amb (环境压强)=0 ,δW=0⑧可逆过程:将推动力无限小、系统内部及系统与环境之间在无限接近平衡条件下进行的过程。
即P amb =P 系统+dp ,且d p ≈0 4.功和热 (1)功:途径函数①体积功 W=⎰-2V1V amb dV p ,系统得到环境所作功,W >0;系统对环境作功,W <0②可逆功W=⎰-2V 1V pdV(2)热:途径函数,若系统从环境吸热,Q >0;若系统向环境放热,Q <05.热力学能(内能):指系统内部的所有粒子全部能量的总和,包括系统内分子平动、转动、振动能和势能等,即内能,用U 表示,U=f (T,V ),则有:dV )VU(dT )T U (dU T V ∂∂+∂∂= *理想气体时,U=f (T ),恒温过程,0)VU(T =∂∂,即△U=05.热力学第一定律封闭体系:△U=Q+W 或dU=δQ +δW6.焓 H=U+pV , △H=△U+△(pV )=△U+△(nRT ),H=f (p,T ),则有:dp )PH(dT )T H (dH T p ∂∂+∂∂=, ①凝聚态变化过程时,因△(pV )≈0,故△U ≈⎰=∆2T 1T m,p dT Cn H②理想气体时,H=f (T ),恒温过程,0)VH(T =∂∂,即△U=0 7.恒容热、恒压热①恒容热:Q V =△U 或δQ V = dU (dV=0,W ′=0),即系统进行恒容且无非体积功的过程中与环境交换的热,Q V 只取决于系统的始、末态②恒压热:Q p =△H 或δQ p = dH (恒压dp=0或等压,W ′=0),即系统进行恒压且无非体积功的过程中与环境交换的热,Q V 只取决于系统的始、末态 8.摩尔热容①摩尔定容热容(C V ,m ) 定义式:C V ,m =v m v v )TU()T U (n 1dT Q n 1∂∂=∂∂=δ,单位:J ·mol -1·K -1应用:理想气体单纯pVT 变化过程dU=dT nC dT )TU(m ,v V =∂∂或⎰=∆2T 1T m,v dT Cn U当恒容时,Q V =⎰=∆2T 1T m ,v dT C n U②摩尔定压热容(C p ,m ) 定义式:C p ,m =p m p p )TH()T H (n 1dT Q n 1∂∂=∂∂=δ,单位:J ·mol -1·K -1应用:理想气体单纯pVT 变化过程dH=dT nC dT )TH(m ,p p =∂∂或⎰=∆2T 1T m,p dT CnH当恒压时,Q p =⎰=∆2T 1T m ,p dT C n H③C V ,m 与C p ,m 关系C p ,m -C V ,m =p m T mmT V p V U ⎪⎭⎫ ⎝⎛∂∂⎥⎥⎦⎤⎢⎢⎣⎡+⎪⎪⎭⎫⎝⎛∂∂,理想气体:C p ,m -C V ,m =R 常温下,理想气体,单原子C V ,m =R 23,双原子C V ,m =R 25 9.相变焓①摩尔相变焓:(恒压无非体积功)m ,p m Q H =∆βα;纯物质两相平衡,T 、P 一定,)T (f H m =∆βα同一种物质、相同条件下互为相反的两种相变过程,m m H H αββα∆-=∆②摩尔相变焓随温度的变化:⎰∆+∆=∆TT m ,p 0m m dT C )T (H )T (H βαβαβα10.化学反应焓 (1)反应进度:BBn νξ∆=(2)摩尔反应焓B B m r H H ν∑=∆,)p ,T (f H m r =∆ (3)标准摩尔反应焓①标准态:气态,任意T ,kPa 100p =Θ下表现出理想气体性质的纯气体状态 液体或固体,任意T ,kPa 100p =Θ的纯液体或纯固体状态②标准摩尔反应焓)T ,,B (H )T ,,B (H )T (f )T (H )T (H m C B m f B B B m r βνβννΘΘΘΘ∆∑-=∆∑==∑=∆ 【说明】)T ,,B (H m f βΘ∆摩尔生成热,即1B =ν,稳定相态的单质的)T ,,B (H mf βΘ∆=0 )T ,,B (H mc βΘ∆摩尔燃烧热,即1B -=ν,自然燃烧产物为C →CO 2(g)、H →H 2O (l )、N →N 2(g )、S →SO 2(g ),所以产物CO 2(g)、H 2O (l )、N 2(g )、SO 2(g )等的)T ,,B (H mc βΘ∆=0 ③RT Q Q )g (B m ,v m ,p ν∑=-④)T (f )T (H mr =∆Θ——基希霍夫公式:⎰∆+∆=∆ΘΘTK15.298m ,p r m r m r dT C )K 15.298(H )T (H 或m ,p r m r C dT)T (H d ∆=∆Θ⑤非恒温反应过程热(最高温度)计算恒压燃烧所能达到的最高火焰温度计算依据:Q p =△H=0(恒压、绝热) 恒容燃烧(爆炸)反应所能达到的最高温度依据:Q V =△H=0(恒容、绝热) 11.可逆体积功可逆过程有,P amb =P 系统+dp ≈P 系统 (dp ≈0) 所以 ⎰⎰-=-=2V 1V 2V 1V amb r pdV dV P W①理想气体恒温可逆体积功:21122V 1V 2V 1V r ,T P Pln nRT V V ln nRT dV V nRT pdV W -=-=-=-=⎰⎰②理想气体绝热可逆体积功:理气绝热可逆过程方程式1TV -γ=常数、γpV =常数、γγ-1Tp =常数⎪⎪⎭⎫⎝⎛--=-=--⎰1112112V 1V r ,a V 1V 11V p pdV W λγγγ或)T T (nC U W 12m ,V r ,a -=∆= 12.节流膨胀与焦耳-汤姆逊实验①焦耳-汤姆逊实验:绝热条件下,气体的始末态压力分别保持恒定不变情况下的膨胀过程,称节流膨胀②节流膨胀的热力学特征:节流膨胀为恒焓过程,足够低压的气体(可视为理气)经节流膨胀后温度基本不变。
高三物理化学基础知识点

高三物理化学基础知识点高三物理化学基础知识点是学生在高中最后一年需要掌握的重要基础知识。
本文将简要介绍一些物理化学领域的核心概念和知识点,供高三学生复习使用。
一、物理基础知识点1. 运动力学运动力学是物理学的基础,主要研究物体的运动规律。
其中包括位移、速度、加速度、力、质量、牛顿三定律等重要概念。
学生需要熟悉运动方程、力学定律等,以便能够解决各种运动问题。
2. 热学热学是研究热现象及其规律的学科,其中包括温度、热量、热传导、热膨胀、理想气体等概念。
理解热学基本定律,如热传导定律、热平衡定律等,并能应用于实际问题。
3. 光学光学是研究光的传播和光现象的学科。
其中包括光的反射、折射、光的波动性和粒子性、光的干涉和衍射等知识点。
学生需要理解光的传播规律,并能解决与光相关的问题。
4. 电磁学电磁学是研究电和磁现象及其相互关系的学科。
包括电荷、电场、电势、电流、电路等概念。
学生需要掌握静电、电流、电路等基本知识,并能解决与电磁学相关的问题。
二、化学基础知识点1. 原子结构原子结构是化学的基础,涉及原子、元素周期表、元素化合价等概念。
学生需要理解原子的组成,了解电子结构、原子序数、质子数和中子数等知识,并能解决与原子结构相关的问题。
2. 化学键及分子结构化学键是由原子之间的相互作用力形成的,主要包括共价键、离子键和金属键。
了解不同类型的化学键的特点和形成规律,并能理解分子的三维结构。
3. 化学反应与化学方程式化学反应是指物质之间转化为其他物质的过程。
学生需要了解化学反应的基本类型,如氧化还原反应、酸碱中和反应等,并能根据化学方程式解决与化学反应相关的问题。
4. 化学计量和化学计算化学计量是指在化学反应中物质的量的关系。
需要掌握摩尔质量、化学计量关系、反应的计算等内容,并能应用到实际问题中。
总结:高三物理化学基础知识点是学生在高中最后一年需要掌握的重要知识,包括物理学和化学学科的核心概念和知识。
通过理解和掌握这些基础知识,学生可以更好地应对高考物理化学考试,并为进一步深入学习相关领域打下坚实的基础。
化工物理知识点总结

化工物理知识点总结一、物理化学1. 原子结构原子由原子核和绕核运动的电子组成。
原子核由质子和中子组成,质子的电荷为正,中子的电荷为零。
电子围绕原子核运动,靠近原子核的能级比较低,远离原子核的能级比较高。
原子核的质量集中在极小的体积内,占据整个原子体积的极小部分。
由于原子核的半径非常小,通常以费米(Fermi,1fm=10^-15m)作为计量单位。
2. 化学键化学键是相邻原子之间相互作用的结果。
根据原子间结合方式的不同,化学键分为共价键、离子键和金属键。
其中,共价键是通过原子间共享电子而形成的键,离子键是通过正负离子间的静电作用力而形成的化学键,而金属键则是金属中自由电子的集体运动形成的键。
3. 晶体结构固体是由大量原子、离子或分子组成的有序排列的凝聚态物质,其中晶体是一种具有高度有序排列结构的固体。
晶体结构包括离子晶体、共价分子晶体和金属晶体等多种类型,通过X射线衍射、傅里叶变换红外光谱和电子显微镜等手段可以对晶体结构进行研究。
4. 化学反应动力学化学反应动力学研究化学反应速率与反应物浓度、温度和催化剂等因素之间的关系。
常见的反应动力学方程包括零级反应、一级反应和二级反应等,根据反应速率方程可以推导出反应的速率常数和速率表达式。
5. 烃及其衍生物烃是由碳和氢组成的化合物,是石油组分的主要组成部分,包括烷烃、烯烃、芳香烃和环烷烃等。
这些烃类化合物在化学工程中具有重要的应用,例如作为燃料、原料或中间体等。
二、热力学1. 热力学基本概念热力学是研究能量转化与传递规律的一门物理学科,包括能量守恒定律、热力学第一和第二定律等基本概念。
能量守恒定律指出能量不会凭空消失,只会从一种形式转化为另一种形式。
热力学第一定律表明能量守恒的数学表达式,而热力学第二定律则表明热量不会自发地从低温物质传递到高温物质。
2. 热力学系统热力学系统是指研究对象,可以是封闭系统、开放系统或孤立系统。
封闭系统与外界交换能量但不交换物质,开放系统与外界既可以交换能量也可以交换物质,而孤立系统既不与外界交换能量也不与外界交换物质。
物理化学知识点总结[物理化学知识点归纳]
![物理化学知识点总结[物理化学知识点归纳]](https://img.taocdn.com/s3/m/ea35e0ce227916888586d7c1.png)
物理化学知识点总结[物理化学知识点归纳]热力学第一定律...............................................................................(1)第二章热力学第二定律. (3)第三章化学势 (7)第四章化学平衡 (10)第五章多相平衡 (12)第六章统计热力学基础 (14)第七章电化学 (16)第八章表面现象与分散系统 (20)第九章化学动力学基本原理 (24)第十章复合反应动力学 (27)物理化学知识点归纳根据印永嘉物理化学简明教程第四版编写,红色的公式要求重点掌握,蓝色的公式掌握。
第一章热力学第一定律本章讨论能量的转换和守恒,其目的主要解决变化过程的热量,求功的目的也是为了求热。
1. 热力学第一定律热力学第一定律的本质是能量守恒定律,对于封闭系统,其数学表达式为∆U =Q +W 微小过程变化:d U =δQ +δW只作体积功:d U =δQ −p e d V 理想气体的内能只是温度的函数。
2. 体积功的计算:δW V =−p 外d VW V =−∫p 外d VV 1V 2外压为0(向真空膨胀,向真空蒸发):W V =0;恒容过程:W V =0恒外压过程:W V =−p 外(V 2−V 1) 恒压过程:W V =−p (V 2−V 1) 可逆过程:W V =−∫V 2V 1p d V (主要计算理想气体等温可逆、绝热可逆过程的功)3. 焓和热容由于大多数化学反应是在等压下进行的,为了方便,定义一个新的函数焓:H =U +pV焓是状态函数,是广度性质,具有能量,本身没有物理意义,在等压下没有非体积功的热效应等于焓的改变量。
等容热容:C V = δQ V⎛∂U ⎛=⎛⎛ d T ⎛∂T ⎛V等压热容:C p =δQ p⎛∂H ⎛=⎛⎛ d T ⎛∂T ⎛p对于理想气体:C p −C V =nR4. 理想气体各基本过程中W 、Q 、∆U 、∆H 的计算5. 焦耳-汤姆逊系数µ=⎛⎛∂T ⎛1⎛∂H ⎛=−⎛⎛⎛,用于判断气体节流膨胀时的温度变化。
大学课程《物理化学》各章节知识点汇总

1. 自由膨胀过程(即外压等于零):
W pedV
W
V2 V1
pedV
0
5
2. 恒定外பைடு நூலகம்膨胀(压缩)过程
a. 一次膨胀过程
p2
p2
膨胀
p1, V1
p2 , V2
p1
W
V2 V1
pedV
p2
p2 (V2 V1)
V1
V2
a ' .一次压缩过程
p1 p1
p2 , V2
压缩
p1, V1 p1
W
A (p1V1)
p
D
A S1(等 温)C S2 (等容) B
S
S1
S2
nR ln
p1
T
T
T
V1
p2
可逆相变过程的熵变
S Qr Qp H TT T
20
变温过程中熵变的计算
Q CdT
dS Q C dT
T
T
等容过程:
dT dS CV T
或
S
C T2
T1 V
dT T
等压过程:
dS
Cp
dT T
或
S
C T2
T1 p
dT T
压力、体积、温度都发生 变化的过程
U QV
T2 T1
CV
dT
等压热效应(p1 p2 pe ) U Q W
U U2 U1 Qp pe (V2 V1)
(U2 p2V2 ) (U1 p2V2 ) Qp
H2 H1 H Qp
dH Qp
Cp
Qp
dT
H T
p
pH Qp
T2 T1
C
化学物理知识点全总结

化学物理知识点全总结1. 热力学热力学是研究物质在不同温度和压力条件下的能量转化和能量传递规律的学科。
其基本概念包括热力学系统、热力学过程、热力学状态函数和热力学平衡等。
在热力学中,最重要的是热力学定律和热力学函数。
(1)热力学定律:热力学定律是描述物质热力性质的基本规律,包括热力学第一定律(能量守恒定律)、热力学第二定律(熵增加定律)和热力学第三定律(绝对零度定律)。
(2)热力学函数:在热力学中,有许多重要的热力学函数,如内能、焓、自由能、吉布斯自由能等。
这些函数可以描述系统的热力学性质和热力学平衡条件,对于热力学系统的特性和行为具有重要作用。
2. 动力学动力学是研究物质在不同条件下的速率和机理的学科。
其基本概念包括反应速率、反应机理、动力学常数等。
在动力学中,最重要的是反应速率和反应动力学。
(1)反应速率:反应速率是描述化学反应在一定条件下发生速度的物理量。
它可以由反应物和生成物的浓度变化率来表示,通常用微分形式描述。
(2)反应动力学:反应动力学研究反应速率与反应条件、反应物浓度、温度等之间的关系。
它可以用动力学方程来描述,根据反应的不同阶次和机理,可以得到一阶反应、二阶反应、复合反应等不同类型的动力学方程。
3. 量子化学量子化学是研究微观世界中原子、分子和化学键的物理化学学科。
其基本概念包括波函数、薛定谔方程、分子轨道理论等。
在量子化学中,最重要的是波函数和分子轨道理论。
(1)波函数:波函数是量子力学中描述微观粒子状态的数学函数。
它可以用薛定谔方程来描述,包括定态薛定谔方程和时间无关薛定谔方程等不同类型的方程。
(2)分子轨道理论:分子轨道理论是量子化学中描述分子结构和性质的重要理论。
通过线性组合原子轨道(LCAO)的方法,可以得到分子的分子轨道和分子轨道能级,从而理解分子的电子结构和化学键特性。
除了上述几个基本知识点,化学物理学还涉及到电化学、表观化学、结构化学等多个领域。
它们的研究对象不仅包括原子、分子和化学反应,还包括晶体结构、表面界面、纳米材料等多种材料和物质。
物理化学知识点(全)(良心出品必属精品)
吁瑟沂奄佯幌皋宦赃嘎浓虚敌隧记超碟橇授敢匹塞娩伟诚垒桅检瞅置停簧伪靖铲叹箩舷买磺鸵晚浊鲸赎弘绅显伪房拘抄溪法红酱钦傻晃晾泻羌述授臃图墅狈霖棒购叙力辅刚汉万莫造麦林罚播袍呐镶略秤络亿特览姿祈蛮桔淡锣畴掀抛骑握胁嘻莎振讹娥必缅吨北瓶橙赁痔抄敝剖拭毕徊嘶舟母纬造俐县滋绰凝肺韦匈嘿袁肃厚眉咎猿蚤苹踏宵卤横准安镊絮庄魂存跳斥摧辆城瘴借屑垫摇他呀鲜散规瞄饵今予槽惯纲海铅翅耙垣辩畴葬叭沉辕剂龙琅朔危透茶阎赵望咬罩熄衙软求霜谈森痕燕剑帮童咽糜鳃环莉防啪声硫弃必针猾床条迄结谋讥哄贤谚著惨逼钱弘垂勉盒勋难欢醉咸扰瑞吨伪蚜必悼既1第二章热力学第一定律 内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰ 2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T = • 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程 1、 可逆相变化 Q p =n Δ相变H mW = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学重要知识点总结及其考点说明

第一章气体的pvT关系⑴波义尔定律:当n、T一定时,PV=常数⑵盖-吕萨克定律:当n、P一定时,V/T=常数⑶阿伏伽德罗定律:当T、P一定时,V/n=常数●⑷理想气体状态方程:PV=(m/M)RT= nRT或者或PVm=p(V/n)=RTR=8.314mol-1·K-1称为摩尔气体常数;T为华氏温度⑸摩尔分数:X B=n B/n总●⑹道尔顿定律:P B=P总X B;P总=P分⑺实际气体状态方程:PV=znRT(z为压缩因子)●⑻理想气体特征:①分子间无相互作用力②分子本身不占有体积第二章热力学第一定律热力学第一定律(能量守恒定律)●⑴系统:①隔离系统:无能量、无物质交换②★封闭系统:有能量、无物质交换(热力学基础;热力学研究对象)③敞开系统:有能量、有物质交换●⑵状态函数:P、V、T、U、H、G、A、S (P、T、C p, m、C V,m 为强度量,其他均为广度量) 状态函数特征:①有可微分性,能计算②只与始末状态有关●途径函数:Q、W●⑶热:系统从环境中吸热(Q>0);系统对环境做功(W<0)●⑷热力学能:△U=Q+W(封闭系统);U只是温度T的函数;只与首末有关非体积功的计算①气体向真空膨胀时体积功所的计算W=0②恒外压过程体积功W=-p(V2-V1)=-p△V③对于理想气体恒压变温过程W=-p△V=-nR△T④可逆过程体积功W=-p(v2-v1)●⑤理想气体恒温可逆过程体积功 W=-p(v2-v1)或者W=-nRTln(V1/V2)或者W=nRTln(p2/ p1)⑥理想气体绝热可逆过程体积功W=-p(v2-v1)=(-)γ= C p, m /C V,m(双原子气体为1.4)T2/T1=(V1/V2) 的γ-1次方;T2/T1=(P1/P2)的(γ-1)/γ次方;P2/P1=(V1/V2)的γ次方●⑦恒温膨胀可逆功最大,系统对环境作最大功;恒温可逆压缩,环境对系统做最小功⑧可逆相变体积功W=-pdV恒热容、恒压热,焓⑴焓定义:H=U + PV⑵焓变:△H=△U+△(pV)式中△(pV)为p V乘积的增量,只有在恒压下△(pV)=p(V2-V1)在数值上等于体积功。
物理化学知识点总结

1t=1000kg 1kg=1000g 1g=1000m
g
(3)密度公式 m V (4)用天平测量
(1) m m G 有 G
V
g
gV
密度(ρ) (2)压强公式 p gh p gh
1g/cm3=10 00
kg/m3
(3)阿基米德原理 F 浮=ρ液 gV 排 则ρ液= F浮 gV排
合力(F)
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O 42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水 43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
v
P
测量
(3)用钟表
(1) v s (2) P W Fs Fv
t
tt
声速 υ= 340m / s
光速 C = 3× 108 m /s
则v P F
1h=60min 1min=60s
1m/s=3.6k m/h
(1) 重 力 公 式 m G g
质量(m) W Gh mgh m W gh
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 1、常用公式过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1);-nRTln (p 1/p 2)nRTln (V 2/V 1);nRTln (p 1/p 2)等 容任意物质0 ∫ ∫ ΔU+V Δp 理想气体 0△T △T △T等 压任意物质-P ΔV ∫ ΔH -p ΔVQp理想气体-nR ΔT△T△T △T 理 想 气 体 绝 热过 程 (T 2-T 1);或0 △T△T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 =a+bT+cT 2 (附录八) 液固系统=理想气体 单原子: =5R/2 双原子: =7R/2 / =γ 理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V =• 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ=111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程 1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νdT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
四、热力学第一定律在化学变化中的应用 1、基础数据 标准摩尔生成焓 Δf H θm,B (T) (附录九)标准摩尔燃烧焓 Δc H θ(T)(附录十)2、基本公式反应进度 ξ=△ξ= △n B /νB = /νB由标准摩尔生成焓计算标准摩尔反应焓 Δr H θ(T)= ΣνB Δf H θ(T) 由标准摩尔燃烧焓计算标准摩尔反应焓 Δr H θ(T)=-ΣνB Δc H θ(T)(摩尔焓---- ξ=1时的相应焓值)恒容反应热与恒压反应热的关系Q p =Δr H Q v =Δr U Δr H =Δr U + RT ΣνB (g) Kirchhoff 公式 微分式 d Δr H θm (T) / dT=Δr积分式 Δr Hθm (T 2) =Δr H θm (T 1)+∫Σ(νdT本章课后作业:教材(3、4、10、11、16、17、38、20、23、24、28、30、33、34)第三章 热力学第二定律内容摘要1、导出三个新的状态函数——熵、亥姆霍兹函数、吉布斯函数2、过程方向和限度的判断依据——熵判据;亥氏函数判据;吉氏函数判据3、熵变、亥氏函数变、吉氏函数变计算——简单变化、相变化、化学变化4、热力学函数归纳——热力学基本方程一、卡诺循环(热功转换的理论模型)1、 卡诺循环的组成1、恒温可逆膨胀 Q 1 = —W 1= nRT 1 ln (V 2/V 1)2、绝热可逆膨胀 Q ’=0 W ’=(T 2—T 1)3、恒温可逆压缩 Q 2 = —W 2 = nRT 2 ln (V 4/V 3)4、绝热可逆压缩 Q ’’ = 0 W ’’ = (T 1—T 2)∵ △U = 0 (V 2/V 1) = —(V 4/V 3)∴ -W = Q = Q 1 + Q 22、热机效率 通式 1211= -=+W Q Q Q Q η 可逆热机 122111= -==1-Q Q T W Q Q T η+ 讨论:1、可逆热机效率只取决于高、低温热源的温度 2、低温热源和高温热源温度之比越小,热机效率越高 3、温度越高,热的品质越高 结论:1、卡诺热机效率最大2、卡诺循环的热温商之和等于零 ∑(Q/T )=03、卡诺定理“在高低温两个热源间工作的所有热机中,以可逆热机的热机效率为最大。
” 由卡诺定理 ir r η≤η 得出2211Q T Q T ≤- 整理后可得: <0 不可逆循环{Q ()0Tδ≤∑=0 可逆循环上式适用与任何工质和任何变化的循环过程。
4、卡诺定理推论在高温、低温两个热源间工作的所有可逆热机,其热机效率必然相等,与工质及其变化的类型无关。
二、热力学第二定律1、自发过程及其特点一个自发过程发生之后,不可能使体系和环境都恢复到原来状态而不留下任何影响。
2、自发过程的共同特征1、自发过程具有作功能力,是热力学的不可逆过程的。
2、任何体系都是自发地倾向平衡的。
3、反自发过程的进行,必须借助外力。
3、热力学第二定律文字表述1、 克劳修斯说法:不可能把热从低温物体传给高温物体而不产生其它影响。
2、 开尔文说法:不可能从单一热源吸取热量使之完全转变为功而不产生其它影响。
(即:第二类永动机不可能实现)4、克劳修斯不等式(热力学第二定律数学表达式)> 过程不可逆 = 过程可逆5、熵增原理及熵判据熵增原理——隔离系统发生不可逆过程时熵值增大;发生可逆过程时,熵值不变;隔离系统不可能发生熵值减小的过程。
熵判据: > 不可逆,自发= 可逆,平衡(注意与克劳修斯不等式的区别)三、熵变计算{{dS dS dS =≥系统环境隔离+0S S S ∆=∆∆≥系统环境隔离+0dS Q δ≥计算依据——熵(S )的定义式:rQ dS Tδ=r Q δ——可逆过程热T ——系统温度熵是系统的状态函数,是广度量。
单位——1J K -g 。
对应的量有: 规定熵()B S T ——11J mol K --g g 标准摩尔熵()m S T θ——11J mol K --g g 熵是系统混乱程度的度量。
混乱程度越大,熵值越大。
1、单纯PVT 变化熵变的计算① 恒温过程 Qr WS T T-∆==理想气体恒温过程:2112ln ln V P S nR nR V P ∆== ② 恒压过程 2,1ln p m T S nC T ∆= 或 ()2dT S n a bT cT T ∆=++⎰③ 恒容过程 2,1lnv m T S nC T ∆= ④ 理想气体绝热过程: 22,11lnln v m T V S nC nR T V ∆=+ 或:21,12ln ln p m T pS nC nR T p ∆=+ 或:22,,11lnln p m v m V p S nC nC V p ∆=+2、相变过程的熵变计算①可逆相变:mn H S T∆∆=相变 ②不可逆相变:分解过程并分别计算 简单变化过程可逆相变过程3、化学反应熵变计算①热力学第三定律:(),00m S K *=完美晶体 ②热力学标准状态下:()r m B m BS S B θθν∆=∑③任意温度时:设计过程,使其包含 简单变化过程298K 时的化学反应过程{{{{(可逆相变过程)四、 Helmholtz 函数和 Gibbs 函数 1、函数定义式:Helmholtz 函数 —— A=U –TS Gibbs 函数 —— G=H-TS2、 判据: 亥氏函数判据 ,0T V A ∆≤ <——不可逆,自发吉氏函数判据 ,0T p G ∆≤ =——可逆,平衡3、 ΔA 和ΔG 的计算简单变化可逆相变 恒温过程 化学反应五、Clapeyron 方程(表明了纯物质二相平衡时温度与压力之间的关系。
)温度随压力的变化率(Clapeyron 方程) m m H dpdT T V βαβα∆=∆ (推导中用到的热力学基本方程——dG=-SdT+Vdp )Clapeyron 方程的应用——1、固垐垎?噲垐?平衡液、固垐垎?噲垐?平衡固:fus m fus mV dTdP T H ∆=∆;trs m trs m V dT dP T H ∆=∆ 积分后得到 ()2211ln fus m fus mV T p p T H ∆=-∆ (假设Δfus H=常数)()2211ln trs m trs mV Tp p T H ∆=-∆ (假设Δtrs H=常数)2、液垐垎?噲垐?平衡气、固垐垎?噲垐?平衡气: vap m vap m H dP dT T V ∆=∆ ; vap m vap mH dP dT T V ∆=∆ 积分后得到 212111ln vap m H p p R T T ∆⎛⎫=-- ⎪⎝⎭或 212111ln sub m H pp R T T ⎛⎫∆=-- ⎪⎝⎭1ln vap m H p C R T ∆=-+或 1ln sub m H p C R T∆=-+六、热力学基本方程一共8个状态函数,其中3个是辅助函数(){A=U-T S G=H-T S∆∆∆∆∆∆}{vap m sub m H H ∆=∆=气体为理想气体常数常数{}dG SdT Vdp=-+相互之间关系如下: H =U +pVA =U -TSG =H -TS dU TdS pdV =-热力学基本方程是热力学中重要的公式,有着广泛的应用,应掌握公式的应用条件及用法(对函数进行积分计算)。
热力学第二定律学习主线热力学函数的归纳 p TG G S V T p ⎛⎫∂∂⎛⎫=-= ⎪ ⎪∂∂⎝⎭⎝⎭本章课后作业:教材(3、4、9、15、19、21、23、24、31、36、38、47、48)第四章 多组分系统热力学内 容 摘 要一、偏摩尔量1、定义式 ,,CB B T p n X X n ⎛⎫∂= ⎪∂⎝⎭(下角标为具备的条件;X 为状态函数的广度量) 2、常见的偏摩尔量偏摩尔体积 偏摩尔热力学能 偏摩尔焓偏摩尔熵 偏摩尔亥姆霍兹函数 偏摩尔吉布斯函数3、偏摩尔量的集合公式 B B BX n X =∑上式表明:在一定的温度、压力下,某混合物系统的任一广度量等于形成该混合物系统的各组分在该组成下的偏摩尔量与其物质的量的乘积之和。
4、偏摩尔量之间的关系与热力学函数之间的关系及热力学基本方程完全相同。
二、化学势1、化学势——偏摩尔吉布斯函数,定义为2、多组分单相系统热力学公式3、化学势判据多组分单相系统 <——不可逆,自发 =——可逆,平衡 (适用条件:dT=0、dp=0、δW ’=0)三、稀溶液的基本定律1、拉乌尔定律 *A A A p p x = *A p :同温度下液体纯A 的饱和蒸汽压。
